2021年12月14日
セルペルカチニブ、上市
選択的RET阻害薬のセルペルカチニブが2021/12/13に上市された。
出現頻度は肺腺がんのわずか2%に過ぎない。
しかし、義父のようにその2%にあたった患者にとっては、福音だ。
製薬会社から提供されたパンフレットに沿って、RETそのものについて、また薬事承認の裏付けとなったLIBRETTO-001試験の概要と結果に触れる。

正常なRET遺伝子に由来する蛋白質はEGFRなどと同じく受容体型チロシンキナーゼで、リガンドが結合すると二量体を形成し、細胞内シグナル伝達系を介して細胞増殖を促すとされる。
腎臓や腸管神経系の派生や神経組織、神経内分泌組織、造血系などの組織の維持に関わる働きを持つ、とのこと。

一方、RET遺伝子の複製過程で偶然発生したRET融合遺伝子は、リガンドが結合せずとも二量体を形成して細胞質内に局在し、恒常的に細胞増殖を促し、細胞をがん化へ導く。
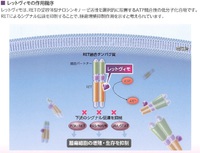
セルペルカチニブ(商品名レットヴィモ)は、RET蛋白質のアデノシン三リン酸(ATP)結合部位に、ATPと競合的に結合することで、細胞内シグナル伝達、細胞増殖刺激を抑制する。

国立がん研究センターで肺腺がん患者319人のドライバー遺伝子変異を調べたところ、その1.9%にRET融合遺伝子を認めた。

過去の論文から6899人の肺がん患者データを抽出して調査したところ、①女性、②60歳未満、③非喫煙者では統計学的有意にRET融合遺伝子陽性肺がんの患者が多かった。

RET融合遺伝子陽性肺がんは、EGFR、ALK、ROS1、BRAF各遺伝子異常と同じく、オンコマインDxTT(デラックスターゲットテスト)マルチCDx(コンパニオン診断)システムで検出できる。

LIBRETTO-001試験は、RET融合遺伝子陽性固形がんの患者を対象とした臨床試験で、推奨用量設定のための安全性確認試験である第I相部分と、主要評価項目を奏効割合とした有効性確認試験である第II相部分に分かれていた。
今回薬事承認の根拠となったのは、第I相部分および第II相部分のコホート1、コホート2における非小細胞肺がん患者のデータだ。

コホート2の未治療群では、総数49人中日本人はわずか4人しか含まれていない。
一方、コホート1の既治療群では、総数210人中日本人は44人と20%を超えるプレゼンスを示している。
既治療群において、95%は化学療法の、60%は抗PD-1 / PD-L1薬の治療歴がある。

第I相部分、第II相部分の統合解析では、主要評価項目の奏効割合は、未治療群では70.5%(95%信頼区間54.8-83.2)、既治療群では56.9%(95%信頼区間49.8-63.8)だった。
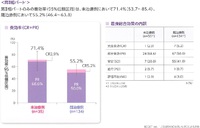
推奨用量に則った治療を受けた第II相部分の患者だけを解析すると、主要評価項目の奏効割合は、未治療群では71.4%(95%信頼区間53.7-85.4)、既治療群では55.2%(95%信頼区間46.4-63.8)だった。

最良変化率のwaterfall plotを見ると、未治療例、既治療例ともに、ほぼすべての患者で腫瘍縮小効果が得られている。
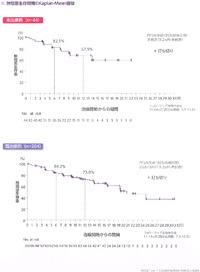
無増悪生存期間中央値は、未治療群では未到達(95%信頼区間9.2-未到達)、既治療群では20.67ヶ月(95%信頼区間19.3-未到達)だった。

全生存期間中央値は、未治療群では未到達(95%信頼区間算定不能)、既治療群でも未到達(95%信頼区間25.7-未到達)だった。

中枢神経系の測定可能病変があった患者で、治療によるその奏効割合は82%で、病勢進行は1人も認めなかった。

本試験全体(非小細胞肺がん以外の固形癌患者も含む)としての有害事象は高頻度に認め、肝障害、QT延長、高血圧が多かった。
特徴的な有害事象として過敏症関連事象が取り上げられた。
発熱、発疹、肝機能障害、血小板減少が現れたら要注意で、まずは休薬とプレドニゾロン0.5-1.0mg/kg程度の内服治療。
間質性肺炎の出現頻度は1.2%とわずかで、Grade 3以上の重篤なものはなかった。
_1-s.jpg)
発現頻度が10%を超える有害事象一覧。

発現頻度が20%を超える有害事象一覧。
-s.jpg)
日本人において、発現頻度が10%を超える有害事象一覧。

日本人において、発現頻度が20%を超える有害事象一覧。
肝機能障害がかなりの高頻度で、定期的な血液検査が欠かせない。

免疫チェックポイント阻害薬の治療歴があると、過敏症発現頻度が10%強まで高まる。
出現頻度は肺腺がんのわずか2%に過ぎない。
しかし、義父のようにその2%にあたった患者にとっては、福音だ。
製薬会社から提供されたパンフレットに沿って、RETそのものについて、また薬事承認の裏付けとなったLIBRETTO-001試験の概要と結果に触れる。

正常なRET遺伝子に由来する蛋白質はEGFRなどと同じく受容体型チロシンキナーゼで、リガンドが結合すると二量体を形成し、細胞内シグナル伝達系を介して細胞増殖を促すとされる。
腎臓や腸管神経系の派生や神経組織、神経内分泌組織、造血系などの組織の維持に関わる働きを持つ、とのこと。

一方、RET遺伝子の複製過程で偶然発生したRET融合遺伝子は、リガンドが結合せずとも二量体を形成して細胞質内に局在し、恒常的に細胞増殖を促し、細胞をがん化へ導く。

セルペルカチニブ(商品名レットヴィモ)は、RET蛋白質のアデノシン三リン酸(ATP)結合部位に、ATPと競合的に結合することで、細胞内シグナル伝達、細胞増殖刺激を抑制する。

国立がん研究センターで肺腺がん患者319人のドライバー遺伝子変異を調べたところ、その1.9%にRET融合遺伝子を認めた。

過去の論文から6899人の肺がん患者データを抽出して調査したところ、①女性、②60歳未満、③非喫煙者では統計学的有意にRET融合遺伝子陽性肺がんの患者が多かった。

RET融合遺伝子陽性肺がんは、EGFR、ALK、ROS1、BRAF各遺伝子異常と同じく、オンコマインDxTT(デラックスターゲットテスト)マルチCDx(コンパニオン診断)システムで検出できる。

LIBRETTO-001試験は、RET融合遺伝子陽性固形がんの患者を対象とした臨床試験で、推奨用量設定のための安全性確認試験である第I相部分と、主要評価項目を奏効割合とした有効性確認試験である第II相部分に分かれていた。
今回薬事承認の根拠となったのは、第I相部分および第II相部分のコホート1、コホート2における非小細胞肺がん患者のデータだ。

コホート2の未治療群では、総数49人中日本人はわずか4人しか含まれていない。
一方、コホート1の既治療群では、総数210人中日本人は44人と20%を超えるプレゼンスを示している。
既治療群において、95%は化学療法の、60%は抗PD-1 / PD-L1薬の治療歴がある。

第I相部分、第II相部分の統合解析では、主要評価項目の奏効割合は、未治療群では70.5%(95%信頼区間54.8-83.2)、既治療群では56.9%(95%信頼区間49.8-63.8)だった。

推奨用量に則った治療を受けた第II相部分の患者だけを解析すると、主要評価項目の奏効割合は、未治療群では71.4%(95%信頼区間53.7-85.4)、既治療群では55.2%(95%信頼区間46.4-63.8)だった。

最良変化率のwaterfall plotを見ると、未治療例、既治療例ともに、ほぼすべての患者で腫瘍縮小効果が得られている。

無増悪生存期間中央値は、未治療群では未到達(95%信頼区間9.2-未到達)、既治療群では20.67ヶ月(95%信頼区間19.3-未到達)だった。

全生存期間中央値は、未治療群では未到達(95%信頼区間算定不能)、既治療群でも未到達(95%信頼区間25.7-未到達)だった。

中枢神経系の測定可能病変があった患者で、治療によるその奏効割合は82%で、病勢進行は1人も認めなかった。

本試験全体(非小細胞肺がん以外の固形癌患者も含む)としての有害事象は高頻度に認め、肝障害、QT延長、高血圧が多かった。
特徴的な有害事象として過敏症関連事象が取り上げられた。
発熱、発疹、肝機能障害、血小板減少が現れたら要注意で、まずは休薬とプレドニゾロン0.5-1.0mg/kg程度の内服治療。
間質性肺炎の出現頻度は1.2%とわずかで、Grade 3以上の重篤なものはなかった。
_1-s.jpg)
発現頻度が10%を超える有害事象一覧。

発現頻度が20%を超える有害事象一覧。
-s.jpg)
日本人において、発現頻度が10%を超える有害事象一覧。

日本人において、発現頻度が20%を超える有害事象一覧。
肝機能障害がかなりの高頻度で、定期的な血液検査が欠かせない。

免疫チェックポイント阻害薬の治療歴があると、過敏症発現頻度が10%強まで高まる。
2021年12月01日
CLIP1-LTK融合遺伝子の発見・・・LC-SCRUM Asiaから
「その他」の中にこそ、新たな発見が眠っている。
誰もが分かってはいるけれど、実際にそれを見出すのは簡単ではない。
今年の肺癌学会総会にシンクロしたもののひとつに、CLIP1-LTK融合遺伝子も挙げられる。
2021/11/25付でNature誌に発表され、国立がん研究センターのプレスリリースでも公表された。
→https://www.nature.com/articles/s41586-021-04135-5
→https://www.ncc.go.jp/jp/information/pr_release/2021/1125/index.html
出現頻度は2/542=0.37%ととてつもなく低い。
NTRKやBRAF遺伝子変異に勝るとも劣らない頻度の低さだ。
とはいえ、ロルラチニブが効くということならば、CLIP1-LTK融合遺伝子を何とか見つけなければ、という気持ちになる。
治療開始前後のPET画像は、きわめてインパクトがある。
そして、夢がある。
これを見て心を揺さぶられない研究者・臨床家は、仕事をする資格がないと私は思う。
CLIP1-LTK融合遺伝子を標的としたロルラチニブの医師主導フェーズ2試験が、登録予定患者数を16人として2022年の早期に開始される予定とのこと。
自ら見出したドライバー融合遺伝子を対象とした世界初の医師主導臨床試験であり、国立がん研究センター東病院のスタッフは勇往邁進していることだろう。
The CLIP1–LTK fusion is an oncogenic driver in non‐small‐cell lung cancer
Hiroki Izumi, Shingo Matsumoto, et al., Nature. 2021 Nov 24.
doi: 10.1038/s41586-021-04135-5. Online ahead of print.
肺がんは最も悪性度の高い腫瘍のひとつである。ドライバー遺伝子異常に基づく分子標的療法は、非小細胞肺がん患者における治療アウトカムを本質的に改善した。しかし一方で、こうしたドライバー遺伝子異常は、非小細胞肺がんの中でも最も多い原発性肺腺がん患者のうち25-40%では見つからない。
今回、多施設共同遺伝子スクリーニング基盤研究であるLC-SCRUM-Asiaにおいて行ったRNAトランスクリプトーム解析から、CLIP1とLTKの新規融合遺伝子を同定したので報告する。CLIP1-LTK融合遺伝子の非小細胞肺がん全体における発生頻度は0.4%で、他のドライバー遺伝子異常と相互排他的な関係にある。CLIP1-LTK融合遺伝子産物のリン酸化活性は恒常的で、がん化を引き起こす能力を持つ。CLIP1-LTK融合遺伝子を導入したBa/F3細胞をALK阻害薬であるロルラチニブで処理したところ、CLIP1-LTK産物のリン酸化活性が阻害され、浸潤増殖が抑制されるとともに細胞死が誘導された。CLIP1-LTk融合遺伝子陽性の非小細胞肺がん患者1人に対してロルラチニブを投与したところ、良好な臨床効果が得られた。我々の知る限り、上皮性悪性腫瘍におけるLTK異常について記載したのは本報告が初である。
誰もが分かってはいるけれど、実際にそれを見出すのは簡単ではない。
今年の肺癌学会総会にシンクロしたもののひとつに、CLIP1-LTK融合遺伝子も挙げられる。
2021/11/25付でNature誌に発表され、国立がん研究センターのプレスリリースでも公表された。
→https://www.nature.com/articles/s41586-021-04135-5
→https://www.ncc.go.jp/jp/information/pr_release/2021/1125/index.html
出現頻度は2/542=0.37%ととてつもなく低い。
NTRKやBRAF遺伝子変異に勝るとも劣らない頻度の低さだ。
とはいえ、ロルラチニブが効くということならば、CLIP1-LTK融合遺伝子を何とか見つけなければ、という気持ちになる。
治療開始前後のPET画像は、きわめてインパクトがある。
そして、夢がある。
これを見て心を揺さぶられない研究者・臨床家は、仕事をする資格がないと私は思う。
CLIP1-LTK融合遺伝子を標的としたロルラチニブの医師主導フェーズ2試験が、登録予定患者数を16人として2022年の早期に開始される予定とのこと。
自ら見出したドライバー融合遺伝子を対象とした世界初の医師主導臨床試験であり、国立がん研究センター東病院のスタッフは勇往邁進していることだろう。
The CLIP1–LTK fusion is an oncogenic driver in non‐small‐cell lung cancer
Hiroki Izumi, Shingo Matsumoto, et al., Nature. 2021 Nov 24.
doi: 10.1038/s41586-021-04135-5. Online ahead of print.
肺がんは最も悪性度の高い腫瘍のひとつである。ドライバー遺伝子異常に基づく分子標的療法は、非小細胞肺がん患者における治療アウトカムを本質的に改善した。しかし一方で、こうしたドライバー遺伝子異常は、非小細胞肺がんの中でも最も多い原発性肺腺がん患者のうち25-40%では見つからない。
今回、多施設共同遺伝子スクリーニング基盤研究であるLC-SCRUM-Asiaにおいて行ったRNAトランスクリプトーム解析から、CLIP1とLTKの新規融合遺伝子を同定したので報告する。CLIP1-LTK融合遺伝子の非小細胞肺がん全体における発生頻度は0.4%で、他のドライバー遺伝子異常と相互排他的な関係にある。CLIP1-LTK融合遺伝子産物のリン酸化活性は恒常的で、がん化を引き起こす能力を持つ。CLIP1-LTK融合遺伝子を導入したBa/F3細胞をALK阻害薬であるロルラチニブで処理したところ、CLIP1-LTK産物のリン酸化活性が阻害され、浸潤増殖が抑制されるとともに細胞死が誘導された。CLIP1-LTk融合遺伝子陽性の非小細胞肺がん患者1人に対してロルラチニブを投与したところ、良好な臨床効果が得られた。我々の知る限り、上皮性悪性腫瘍におけるLTK異常について記載したのは本報告が初である。
2021年11月30日
セルペルカチニブ、2021年12月13日発売予定
2021/11/26-2021/11/28まで、第62回日本肺癌学会学術集会が開催された。
会場はパシフィコ横浜で、現地参加とオンライン参加、どちらも選択可能なハイブリッド形式だった。
地方在住の参加者にとってはとてもありがたい。
当然のごとく、オンラインで参加した。
初日はフルタイムの勤務を終えて、イブニングセミナーだけ聴講した。
週末は私用の合間を縫いながら参加した。
会期後にオンデマンドで聴講できるのは教育講演だけなので、あれもこれもと聴講できないライブ講演なのは現地参加と変わらない。
とはいえ、あちこち移動しなくて済むこと、週末に家や職場を空けないで済むことのメリットは計り知れない。
当然旅費もかからない。
現地参加しなければ得られない果実は当然あるが、その果実もテクノロジーの進歩とともに今後少なくなっていくことだろう。
国内は新型コロナウイルス感染患者数が減少し、警戒が緩んでいる。
一方、欧米を中心として海外では新型コロナウイルス感染者数が増加に転じている。
ここ1週間足らずでオミクロン株が急速に拡散しつつあるが、我が国で次の波が来るのはもはや時間の問題だろう。
年末年始に患者数が増えるだろうことは想像に難くない。
今日は聴講内容には触れずに、タイトルの通りセルペルカチニブについて書き残す。
ありがちな話だが、学会の時期はいろんなことが起こりやすい。
今年は病理所見記載のWHO分類第5版準拠への切り替えと、セルペルカチニブの薬価収載が学会開催にシンクロした。
セルペルカチニブの詳細情報は以下を参照のこと。
→https://www.info.pmda.go.jp/go/pack/42910F2M1020_1_02/
2021/11/25に薬価収載され(=価格が決まり)、メーカー発表によると、2021/12/13に発売されるそうだ。

セルペルカチニブ導入のため、早速義父の入院予約が成されたらしい。
確定診断から約1年、満を持して真打登場だ。
会場はパシフィコ横浜で、現地参加とオンライン参加、どちらも選択可能なハイブリッド形式だった。
地方在住の参加者にとってはとてもありがたい。
当然のごとく、オンラインで参加した。
初日はフルタイムの勤務を終えて、イブニングセミナーだけ聴講した。
週末は私用の合間を縫いながら参加した。
会期後にオンデマンドで聴講できるのは教育講演だけなので、あれもこれもと聴講できないライブ講演なのは現地参加と変わらない。
とはいえ、あちこち移動しなくて済むこと、週末に家や職場を空けないで済むことのメリットは計り知れない。
当然旅費もかからない。
現地参加しなければ得られない果実は当然あるが、その果実もテクノロジーの進歩とともに今後少なくなっていくことだろう。
国内は新型コロナウイルス感染患者数が減少し、警戒が緩んでいる。
一方、欧米を中心として海外では新型コロナウイルス感染者数が増加に転じている。
ここ1週間足らずでオミクロン株が急速に拡散しつつあるが、我が国で次の波が来るのはもはや時間の問題だろう。
年末年始に患者数が増えるだろうことは想像に難くない。
今日は聴講内容には触れずに、タイトルの通りセルペルカチニブについて書き残す。
ありがちな話だが、学会の時期はいろんなことが起こりやすい。
今年は病理所見記載のWHO分類第5版準拠への切り替えと、セルペルカチニブの薬価収載が学会開催にシンクロした。
セルペルカチニブの詳細情報は以下を参照のこと。
→https://www.info.pmda.go.jp/go/pack/42910F2M1020_1_02/
2021/11/25に薬価収載され(=価格が決まり)、メーカー発表によると、2021/12/13に発売されるそうだ。

セルペルカチニブ導入のため、早速義父の入院予約が成されたらしい。
確定診断から約1年、満を持して真打登場だ。
2021年11月14日
進行非小細胞肺がんオリゴ転移巣に対する定位照射のランダム化第II相比較試験
今回の臨床試験は、スローンケタリング記念がんセンター単施設におけるランダム化第II相比較試験だったようだが、単施設で企画された試験としては対象患者数が160人と大規模だ。
非小細胞肺がんと乳がん患者双方を対象としているので、それでも患者が集まるのだろう。
また、転移巣全てを対象とするのではなく、増大傾向にあるか、PETで活動性が高いと判断された病巣のみを定位照射対象としているところに独自性がある。
増大傾向にある、活動性が高いという判断には施設間、担当医間でバラツキが出ることが容易に想像されるので、そうした点では単施設で検証することに意味があるだろう。
それは、裏を返せば、今後第III相多施設共同臨床試験を行うには相当練り上げたプロトコールと品質管理が必要だということでもある。
興味深いことに、非小細胞肺がんと乳がんでサブグループ解析を行うと、非小細胞肺がんではオリゴ転移巣に対する定位照射で無増悪生存期間が延長し、乳がんではそうならなかった。
筆頭演者に対するインタビュー動画を見てみると、乳がん患者では追跡期間中、もともと安定していると考えられた転移巣が進行していたり、あるいは新規転移巣が出現したりで、結局対象患者の90%が短期間で病勢進行に至ったとのこと。
非小細胞肺がんではそうした現象は見られなかったらしい。
非小細胞肺がんと乳がんの比較において、乳がんの方がよりアグレッシブな進行をする、という論調には簡単には賛同しかねるものの、今回の治療コンセプトにより対象となった非小細胞肺がん患者の無増悪生存期間が2ヶ月ちょっとから11か月まで延長したことは素直に喜ばしい。
また、今回のコンセプトで、増悪していない転移巣に対しては現在施行中の薬物療法を継続しながら、増悪している病巣のみを選択して定位照射で制御することにより、時間的・空間的な多様性を示すがん転移巣に対する対処の1つの解を示している。
定位照射に引き続き免疫チェックポイント阻害薬を適用したら効果が増強されるのではないか、など、個人的には魅力的な治療と感じられた。
Consolidative Use of Radiotherapy to Block (CURB) Oligoprogression: Interim Analysis of the First Randomized Study of Stereotactic Body Radiotherapy in Patients With Oligoprogressive Metastatic Cancers of the Lung and Breast
C.J. Tsai et al.
ASTRO’s 63rd Annual Meeting (October 24-27, 2021), Abst.#LBA3
目的:
増悪傾向を示す転移巣のみに局所療法を行うことにより病勢コントロールが得られるという、oligoprogressive stateという現象が進行がんで認められると仮説を立てた。そのため今回の臨床試験では、増悪傾向を示す転移巣が1-5ヶに限られる進行非小細胞肺がんおよび進行乳がんの患者を対象に、これら病巣に対して定位放射線照射を行うことの有用性を評価した。
方法:
1レジメン以上のがん薬物療法を施行され、かつ定位放射線照射の適応があるoligoprogression転移巣を有する進行非小細胞肺がん患者および進行乳がん患者を対象とした。ここで、oligoprogression転移巣(以下OP巣)は、RECISTもしくはPET-RECISTの規定に沿った総計5ヶ以下の個別の転移巣と定義した。層別化因子には、OP巣の個数(1ケ vs 2-5ケ)、前治療の内容(免疫チェックポイント阻害薬 vs その他)、原発巣(非小細胞肺がん vs 乳がん)、原発巣の性質(ドライバー遺伝子変異の有無やホルモンレセプターの発現状態)を規定した。対象患者は、OP巣に対する定位放射線治療+標準治療(SBRT+SOC)群と標準治療(SOC)群に、1:1の割合で無作為に割り付けられた。どのような標準治療を適用するかは、担当医に一任された。主要評価項目は無増悪生存期間(PFS)とした。ランダム化第II相試験デザインを適用し、片側検定としてαエラー=0.05、検出力=0.08に設定、目標患者数は160人とした。PFSは片側層別化ログランク検定を用いて比較した。中間解析を1回設けた。
結果:
2019年1月から2021年5月にかけて、102人の患者を集積した。58人は非小細胞肺がん患者(30人がSBRT+SOC群、28人がSOC群)、44人は乳がん患者(22人がSBRT+SOC群、22人がSOC群)だった。年齢中央値は67歳、ほとんどの患者(75%)は2ケ以上のOP巣を有し、47%の患者はOP巣も含めて6ケ以上の転移巣を有していた。55人(54%)の患者は免疫チェックポイント阻害薬治療歴があった。非小細胞肺がん患者のほとんど(86%)はドライバー遺伝子変異がなく、乳がん患者の32%はいわゆるトリプル・ネガティブ(ER,PgR,HER2発現なし)だった。背景因子は両治療群間でバランスがとれていた。観察期間中央値51週の時点で、71人の患者で病勢進行を認め、30人の患者は死亡していた。PFS中央値はSBRT+SOC群で22週、SOC群で10週だった(p=0.005)で、SBRT+SOC群で有意に延長していた。この結果は、非小細胞肺がん患者における成績に起因していた(SBRT+SOC群で44週、SOC群で9週、p=0.004)。乳がんでは、PFS中央値はSBRT+SOC群で18週、SOC群で17週、p=0.5と両群間に有意差を認めなかった。前述の層別化因子を含め、コックス比例ハザードモデルを用いた多変数解析を行ったところ、非小細胞肺がんサブグループは独立した予後良好因子だった(ハザード比0.38、95%信頼区間0.18-0.77、p=0.007)。Grade2以上の有害事象はSBRT+SOC群のうち8人に認め、うち1人はGrade 3の肺臓炎だった。
結論:
今回の中間解析において、OP巣に対する定位放射線照射が全体集団のPFSを改善することが示された。非小細胞肺がん集団ではPFSが延長する一方で乳がん集団ではそうした現象は見られず、さらなる解析が必要と考えられた。
非小細胞肺がんと乳がん患者双方を対象としているので、それでも患者が集まるのだろう。
また、転移巣全てを対象とするのではなく、増大傾向にあるか、PETで活動性が高いと判断された病巣のみを定位照射対象としているところに独自性がある。
増大傾向にある、活動性が高いという判断には施設間、担当医間でバラツキが出ることが容易に想像されるので、そうした点では単施設で検証することに意味があるだろう。
それは、裏を返せば、今後第III相多施設共同臨床試験を行うには相当練り上げたプロトコールと品質管理が必要だということでもある。
興味深いことに、非小細胞肺がんと乳がんでサブグループ解析を行うと、非小細胞肺がんではオリゴ転移巣に対する定位照射で無増悪生存期間が延長し、乳がんではそうならなかった。
筆頭演者に対するインタビュー動画を見てみると、乳がん患者では追跡期間中、もともと安定していると考えられた転移巣が進行していたり、あるいは新規転移巣が出現したりで、結局対象患者の90%が短期間で病勢進行に至ったとのこと。
非小細胞肺がんではそうした現象は見られなかったらしい。
非小細胞肺がんと乳がんの比較において、乳がんの方がよりアグレッシブな進行をする、という論調には簡単には賛同しかねるものの、今回の治療コンセプトにより対象となった非小細胞肺がん患者の無増悪生存期間が2ヶ月ちょっとから11か月まで延長したことは素直に喜ばしい。
また、今回のコンセプトで、増悪していない転移巣に対しては現在施行中の薬物療法を継続しながら、増悪している病巣のみを選択して定位照射で制御することにより、時間的・空間的な多様性を示すがん転移巣に対する対処の1つの解を示している。
定位照射に引き続き免疫チェックポイント阻害薬を適用したら効果が増強されるのではないか、など、個人的には魅力的な治療と感じられた。
Consolidative Use of Radiotherapy to Block (CURB) Oligoprogression: Interim Analysis of the First Randomized Study of Stereotactic Body Radiotherapy in Patients With Oligoprogressive Metastatic Cancers of the Lung and Breast
C.J. Tsai et al.
ASTRO’s 63rd Annual Meeting (October 24-27, 2021), Abst.#LBA3
目的:
増悪傾向を示す転移巣のみに局所療法を行うことにより病勢コントロールが得られるという、oligoprogressive stateという現象が進行がんで認められると仮説を立てた。そのため今回の臨床試験では、増悪傾向を示す転移巣が1-5ヶに限られる進行非小細胞肺がんおよび進行乳がんの患者を対象に、これら病巣に対して定位放射線照射を行うことの有用性を評価した。
方法:
1レジメン以上のがん薬物療法を施行され、かつ定位放射線照射の適応があるoligoprogression転移巣を有する進行非小細胞肺がん患者および進行乳がん患者を対象とした。ここで、oligoprogression転移巣(以下OP巣)は、RECISTもしくはPET-RECISTの規定に沿った総計5ヶ以下の個別の転移巣と定義した。層別化因子には、OP巣の個数(1ケ vs 2-5ケ)、前治療の内容(免疫チェックポイント阻害薬 vs その他)、原発巣(非小細胞肺がん vs 乳がん)、原発巣の性質(ドライバー遺伝子変異の有無やホルモンレセプターの発現状態)を規定した。対象患者は、OP巣に対する定位放射線治療+標準治療(SBRT+SOC)群と標準治療(SOC)群に、1:1の割合で無作為に割り付けられた。どのような標準治療を適用するかは、担当医に一任された。主要評価項目は無増悪生存期間(PFS)とした。ランダム化第II相試験デザインを適用し、片側検定としてαエラー=0.05、検出力=0.08に設定、目標患者数は160人とした。PFSは片側層別化ログランク検定を用いて比較した。中間解析を1回設けた。
結果:
2019年1月から2021年5月にかけて、102人の患者を集積した。58人は非小細胞肺がん患者(30人がSBRT+SOC群、28人がSOC群)、44人は乳がん患者(22人がSBRT+SOC群、22人がSOC群)だった。年齢中央値は67歳、ほとんどの患者(75%)は2ケ以上のOP巣を有し、47%の患者はOP巣も含めて6ケ以上の転移巣を有していた。55人(54%)の患者は免疫チェックポイント阻害薬治療歴があった。非小細胞肺がん患者のほとんど(86%)はドライバー遺伝子変異がなく、乳がん患者の32%はいわゆるトリプル・ネガティブ(ER,PgR,HER2発現なし)だった。背景因子は両治療群間でバランスがとれていた。観察期間中央値51週の時点で、71人の患者で病勢進行を認め、30人の患者は死亡していた。PFS中央値はSBRT+SOC群で22週、SOC群で10週だった(p=0.005)で、SBRT+SOC群で有意に延長していた。この結果は、非小細胞肺がん患者における成績に起因していた(SBRT+SOC群で44週、SOC群で9週、p=0.004)。乳がんでは、PFS中央値はSBRT+SOC群で18週、SOC群で17週、p=0.5と両群間に有意差を認めなかった。前述の層別化因子を含め、コックス比例ハザードモデルを用いた多変数解析を行ったところ、非小細胞肺がんサブグループは独立した予後良好因子だった(ハザード比0.38、95%信頼区間0.18-0.77、p=0.007)。Grade2以上の有害事象はSBRT+SOC群のうち8人に認め、うち1人はGrade 3の肺臓炎だった。
結論:
今回の中間解析において、OP巣に対する定位放射線照射が全体集団のPFSを改善することが示された。非小細胞肺がん集団ではPFSが延長する一方で乳がん集団ではそうした現象は見られず、さらなる解析が必要と考えられた。
2021年11月09日
セルペルカチニブと過敏症
このところ、間もなく薬価収載され、実臨床に導入されると見込まれるセルペルカチニブのウェブセミナーが繰り返し開催されている。
オンコマインDxTTでの検出が必須で、かつ非扁平上皮非小細胞肺がんにおける出現頻度はわずか2%のがんである。
それだけに、なんとか諦めずに見つけてね、見つけたらきちんと使ってね、というメッセージが込められているように感じる。
セミナーを見ていると、「過敏症(hypersensitive reaction)」というカテゴリーの有害事象が繰り返し取り上げられている。
過敏症というと、一般の感覚からすると「アレルギー」「アナフィラキシー」といった状況を連想する。
われわれ臨床医は、抗体医薬をはじめとした薬物を使用したときの即時反応(結局アナフィラキシーとかインフュージョンリアクションのことだが)を思い浮かべる。
しかし、セルペルカチニブにおける過敏症という概念は、これらとはちょっと違うらしい。
演者の言葉を借りれば、
「なかなかこれまでの分子標的薬で、こうした用語は出てこなかった」
「こういうものが全体の5.2-11.7%くらいにでてくるので、注目すべき」
「過敏症関連事象と表現されている一方で、アナフィラキシーなどの重篤な過敏症を除くと但し書きされており、分かりにくい」
「こうした有害事象が起こりうる、ということを頭に入れておかないと診断自体が難しく、治療調整につなげにくい」
とのこと。
いまのところ、本件についてまとめられたネット上の記事が乏しかったので、まとめておく。
治療上のポイントは休薬とステロイド開始だが、ステロイドの使い方に決まったものはないらしい。
これも演者のコメントを借りれば、患者体重1kg当たり0.5mgくらいの開始量で、経過を見ながら5-10mgずつ減量がいいのではないか、と提案されていた。
<セルペルカチニブによる過敏症の特徴>
・原因は不明
・皮膚症状(斑状丘疹)が主体
・関節痛や筋肉痛を伴う発熱から始まることが多い
・肝機能障害、血小板減少を伴う
・これら個別の有害事象が重なってきたときに過敏症と診断できるが、それと気づくまで診断自体が難しい
・ときに口内炎、下痢、末梢神経障害、筋痙攣
・まれに血圧低下・頻脈・血中クレアチニン値増加を伴う
・治療開始から過敏症出現までの期間中央値は1.9週(範囲は0.9-77)
・過敏症が現れたら、まずは回復するまで休薬
・休薬だけで改善しなければステロイド(プレドニゾロン)内服開始
・その他の対症療法
・ステロイドを開始すると48時間程度で速やかに症状改善
・症状がおさまったら、ステロイドを併用しながらセルペルカチニブ40mg/回、1日2回に減量して再開
(通常の用量は160mg/回、1日2回)
・再開後に7日間以上過敏症症状が再発しないときは、80mg/回、120mg/回、160mg/回と1段階ずつ過敏症発現時の用量まで増やせる
・増量完了後に7日以上過敏症症状が再発しないときは、ステロイドを漸減する
・免疫チェックポイント阻害薬による前治療歴があると過敏症が出現しやすい(11.2-18.8% vs 1.8-2.8%)
オンコマインDxTTでの検出が必須で、かつ非扁平上皮非小細胞肺がんにおける出現頻度はわずか2%のがんである。
それだけに、なんとか諦めずに見つけてね、見つけたらきちんと使ってね、というメッセージが込められているように感じる。
セミナーを見ていると、「過敏症(hypersensitive reaction)」というカテゴリーの有害事象が繰り返し取り上げられている。
過敏症というと、一般の感覚からすると「アレルギー」「アナフィラキシー」といった状況を連想する。
われわれ臨床医は、抗体医薬をはじめとした薬物を使用したときの即時反応(結局アナフィラキシーとかインフュージョンリアクションのことだが)を思い浮かべる。
しかし、セルペルカチニブにおける過敏症という概念は、これらとはちょっと違うらしい。
演者の言葉を借りれば、
「なかなかこれまでの分子標的薬で、こうした用語は出てこなかった」
「こういうものが全体の5.2-11.7%くらいにでてくるので、注目すべき」
「過敏症関連事象と表現されている一方で、アナフィラキシーなどの重篤な過敏症を除くと但し書きされており、分かりにくい」
「こうした有害事象が起こりうる、ということを頭に入れておかないと診断自体が難しく、治療調整につなげにくい」
とのこと。
いまのところ、本件についてまとめられたネット上の記事が乏しかったので、まとめておく。
治療上のポイントは休薬とステロイド開始だが、ステロイドの使い方に決まったものはないらしい。
これも演者のコメントを借りれば、患者体重1kg当たり0.5mgくらいの開始量で、経過を見ながら5-10mgずつ減量がいいのではないか、と提案されていた。
<セルペルカチニブによる過敏症の特徴>
・原因は不明
・皮膚症状(斑状丘疹)が主体
・関節痛や筋肉痛を伴う発熱から始まることが多い
・肝機能障害、血小板減少を伴う
・これら個別の有害事象が重なってきたときに過敏症と診断できるが、それと気づくまで診断自体が難しい
・ときに口内炎、下痢、末梢神経障害、筋痙攣
・まれに血圧低下・頻脈・血中クレアチニン値増加を伴う
・治療開始から過敏症出現までの期間中央値は1.9週(範囲は0.9-77)
・過敏症が現れたら、まずは回復するまで休薬
・休薬だけで改善しなければステロイド(プレドニゾロン)内服開始
・その他の対症療法
・ステロイドを開始すると48時間程度で速やかに症状改善
・症状がおさまったら、ステロイドを併用しながらセルペルカチニブ40mg/回、1日2回に減量して再開
(通常の用量は160mg/回、1日2回)
・再開後に7日間以上過敏症症状が再発しないときは、80mg/回、120mg/回、160mg/回と1段階ずつ過敏症発現時の用量まで増やせる
・増量完了後に7日以上過敏症症状が再発しないときは、ステロイドを漸減する
・免疫チェックポイント阻害薬による前治療歴があると過敏症が出現しやすい(11.2-18.8% vs 1.8-2.8%)
2021年11月03日
根治切除術直後の非小細胞肺がん患者に、バイオマーカー解析をするべきか
患者のことを考えれば、根治切除後できるだけ早い段階でバイオマーカー検索を行っておくのが望ましい。
肺がん領域のみならず、バイオマーカー解析の話題はにぎにぎしい。
対象となるバイオマーカーが増えて、それぞれに異なる検査手法があり、その中にはコンパニオン診断として認められたものとそうでないものがある。
最近では、ひとつの検査で複数のバイオマーカーを調べられるものも出てきている。
加えて、技術的にはどちらの検査でも調べられるバイオマーカーでありながらも、検査Aはコンパニオン診断として認められており、検査Bは認められていない、といったことが発生している。
さらには、各検査手法により必要な検体も異なれば、期待される精度も異なる。
もっと言えば、各検査にかかるお金が高額なうえ、がんゲノムプロファイリング検査ともなれば限られた施設でしかできないため、実施にあたってのハードルが高くなっている。
結果として、一部のマニアックな研究者、臨床家を除いて、バイオマーカー検索は極めて扱いにくい診療となっており、稀なバイオマーカーほどより一層発見されにくい土壌になっている気がする。
たいていの内科臨床医はEGFR遺伝子変異検索とALK免疫染色で満足して、生検組織が大きければOncomine DxTTまで、加えて22C3抗体でPD-L1検索も、といった感じでバイオマーカー検索を行っているのではないだろうか。
これだけでも、相当量の生検検体が必要だろう。
そうした状況であればこそ、せめて外科的切除ができた患者だけでも、切除した病巣が経年劣化しないうちに、早めに網羅的なバイオマーカー解析をしておいた方がいいのではないか、というのが私の考えである。
不幸にして術後再発した際、病巣が生検可能な部位になく、切除病巣は経年劣化のためバイオマーカー検索に不適で、頼みの綱は液性検体での検索のみ、というのはどうにもいただけない。
一歩進んで、バイオマーカー検索目的の外科的肺生検、という考え方もあっていいのではないか。
ADAURA試験やIMpower010試験の結果を受けて、少なくともEGFR遺伝子変異やPD-L1発現状態は切除した病巣を用いてルーチンで調べることになるだろう。
PD-L1発現状態を確認するにあたり使用する免疫染色用モノクローナル抗体のクローンも、内科では使用頻度の多いペンブロリズマブを想定して22C3抗体を、外科では術後補助療法にアテゾリズマブを使用することを想定してSP263抗体を好んで指定する、ということになるかもしれない。
肺がん領域のみならず、バイオマーカー解析の話題はにぎにぎしい。
対象となるバイオマーカーが増えて、それぞれに異なる検査手法があり、その中にはコンパニオン診断として認められたものとそうでないものがある。
最近では、ひとつの検査で複数のバイオマーカーを調べられるものも出てきている。
加えて、技術的にはどちらの検査でも調べられるバイオマーカーでありながらも、検査Aはコンパニオン診断として認められており、検査Bは認められていない、といったことが発生している。
さらには、各検査手法により必要な検体も異なれば、期待される精度も異なる。
もっと言えば、各検査にかかるお金が高額なうえ、がんゲノムプロファイリング検査ともなれば限られた施設でしかできないため、実施にあたってのハードルが高くなっている。
結果として、一部のマニアックな研究者、臨床家を除いて、バイオマーカー検索は極めて扱いにくい診療となっており、稀なバイオマーカーほどより一層発見されにくい土壌になっている気がする。
たいていの内科臨床医はEGFR遺伝子変異検索とALK免疫染色で満足して、生検組織が大きければOncomine DxTTまで、加えて22C3抗体でPD-L1検索も、といった感じでバイオマーカー検索を行っているのではないだろうか。
これだけでも、相当量の生検検体が必要だろう。
そうした状況であればこそ、せめて外科的切除ができた患者だけでも、切除した病巣が経年劣化しないうちに、早めに網羅的なバイオマーカー解析をしておいた方がいいのではないか、というのが私の考えである。
不幸にして術後再発した際、病巣が生検可能な部位になく、切除病巣は経年劣化のためバイオマーカー検索に不適で、頼みの綱は液性検体での検索のみ、というのはどうにもいただけない。
一歩進んで、バイオマーカー検索目的の外科的肺生検、という考え方もあっていいのではないか。
ADAURA試験やIMpower010試験の結果を受けて、少なくともEGFR遺伝子変異やPD-L1発現状態は切除した病巣を用いてルーチンで調べることになるだろう。
PD-L1発現状態を確認するにあたり使用する免疫染色用モノクローナル抗体のクローンも、内科では使用頻度の多いペンブロリズマブを想定して22C3抗体を、外科では術後補助療法にアテゾリズマブを使用することを想定してSP263抗体を好んで指定する、ということになるかもしれない。
2021年10月11日
HER2エクソン20挿入変異陽性非小細胞肺がんに対するpoziotinib
poziotinibについては過去に何度か触れた。
・PoziotinibとEGFR Exon 20変異
→http://oitahaiganpractice.junglekouen.com/e914150.html
・EGFR Exon 20挿入変異とpoziotinib・・・ZENITH20試験コホート1の中間解析
→http://oitahaiganpractice.junglekouen.com/e974052.html
今回の欧州臨床腫瘍学会では、EGFRエクソン20挿入変異ではなく、HER2エクソン20挿入変異を有する非小細胞肺がんに対して、poziotinibはどうか、というZENITH20試験のコホート4についての報告があった。
16mg1日1回、8mg1日2回の2つの方法で試みられているようだが、後者のデータはまだ公表されていないものの、筆頭演者の話によれば後者の方が毒性が軽いとのことだった。
Efficacy and safety of poziotinib in treatment-naïve NSCLC harboring HER2 exon 20 mutations: A multinational phase II study (ZENITH20-4)
R. Cornelissen et al., ESMO 2021 Abst. #LBA46
背景:
EGFRエクソン20変異、あるいはHER2エクソン20変異を有する非小細胞肺がんの治療は確立していない。今回は、HER2エクソン20挿入変異を有する未治療非小細胞肺がん患者を対象に、エクソン20変異によって生じる(他の薬剤では結合困難な)薬剤結合部位にも作用しうるチロシンキナーゼ阻害薬(TKI)であるpoziotinibの有効性と安全性を評価する国際的複数コホート第II相試験を行った。
方法:
ZENITH20試験はエクソン20挿入変異を伴う進行非小細胞肺がん患者を対象とした。腫瘍組織を用いた遺伝子プロファイリングで変異を同定し、コホート1は既治療EGFRエクソン20挿入変異陽性患者、コホート2は既治療HER2エクソン20挿入変異陽性患者、コホート3は未治療EGFRエクソン20挿入変異陽性患者、コホート4は未治療HER2エクソン20挿入変異陽性患者をあてた。poziotinibは1日16mgを経口投与し、1日1回投与、あるいは1日2回分割投与(8mg/回を1日2回)のいずれかの方法で使用し、発現した毒性に応じて治療の中断や減量ができることとした。主要評価項目はRECIST 1.1準拠の独立効果判定委員会判定による奏効割合(ORR)とした。副次評価項目は病勢コントロール割合(DCR) 、奏効持続期間(DOR)、無増悪生存期間(PFS)、安全性とした。今回はコホート4の結果を報告する。
結果:
コホート4では、48人の患者が16mg1日1回投与、23人の患者が8mg1日2回投与で治療を受けた。8mg1日2回投与による治療群は現在も患者集積中であるため、今回は16mg1日1回投与群の結果を報告する。48人の年齢中央値は61歳(34-87)で、4人の患者は学会報告時点でも臨床試験継続中だった。白人が75%、女性が54%、非喫煙者が69%、ECOG PS1が65%だった。88%の患者で治療中断を要し、76%の患者で減量が必要だった。12%の患者で治療中止に至る有害事象が発生した。Grade3以上の治療関連有害事象の主なものは、発疹(35%)、下痢(14%)、胃炎(20%)、爪囲炎(8%)だった。主要評価項目であるORRは44%(95%信頼区間29.5-58.8)だった。さらに2人の患者は、解析時点ではまだ1度の奏効しか確認できていなかったが、確認出来たら奏効割合が48%となる。DCRは75%、DOR中央値は5.4ヶ月(2.8-19.1以上)で、3人の患者が治療を継続していた。PFS中央値は5.6ヶ月(0-20.2以上)だった。
結論:
Poziotinib16mg1日1回投与は、HER2エクソン20変異を有する未治療非小細胞肺がん患者に対して、臨床的に意義のある治療効果を示した。 安全性プロファイルは他の第2世代EGFR阻害薬と同様だった。1日2回投与群の臨床試験は現在も継続中である。
・PoziotinibとEGFR Exon 20変異
→http://oitahaiganpractice.junglekouen.com/e914150.html
・EGFR Exon 20挿入変異とpoziotinib・・・ZENITH20試験コホート1の中間解析
→http://oitahaiganpractice.junglekouen.com/e974052.html
今回の欧州臨床腫瘍学会では、EGFRエクソン20挿入変異ではなく、HER2エクソン20挿入変異を有する非小細胞肺がんに対して、poziotinibはどうか、というZENITH20試験のコホート4についての報告があった。
16mg1日1回、8mg1日2回の2つの方法で試みられているようだが、後者のデータはまだ公表されていないものの、筆頭演者の話によれば後者の方が毒性が軽いとのことだった。
Efficacy and safety of poziotinib in treatment-naïve NSCLC harboring HER2 exon 20 mutations: A multinational phase II study (ZENITH20-4)
R. Cornelissen et al., ESMO 2021 Abst. #LBA46
背景:
EGFRエクソン20変異、あるいはHER2エクソン20変異を有する非小細胞肺がんの治療は確立していない。今回は、HER2エクソン20挿入変異を有する未治療非小細胞肺がん患者を対象に、エクソン20変異によって生じる(他の薬剤では結合困難な)薬剤結合部位にも作用しうるチロシンキナーゼ阻害薬(TKI)であるpoziotinibの有効性と安全性を評価する国際的複数コホート第II相試験を行った。
方法:
ZENITH20試験はエクソン20挿入変異を伴う進行非小細胞肺がん患者を対象とした。腫瘍組織を用いた遺伝子プロファイリングで変異を同定し、コホート1は既治療EGFRエクソン20挿入変異陽性患者、コホート2は既治療HER2エクソン20挿入変異陽性患者、コホート3は未治療EGFRエクソン20挿入変異陽性患者、コホート4は未治療HER2エクソン20挿入変異陽性患者をあてた。poziotinibは1日16mgを経口投与し、1日1回投与、あるいは1日2回分割投与(8mg/回を1日2回)のいずれかの方法で使用し、発現した毒性に応じて治療の中断や減量ができることとした。主要評価項目はRECIST 1.1準拠の独立効果判定委員会判定による奏効割合(ORR)とした。副次評価項目は病勢コントロール割合(DCR) 、奏効持続期間(DOR)、無増悪生存期間(PFS)、安全性とした。今回はコホート4の結果を報告する。
結果:
コホート4では、48人の患者が16mg1日1回投与、23人の患者が8mg1日2回投与で治療を受けた。8mg1日2回投与による治療群は現在も患者集積中であるため、今回は16mg1日1回投与群の結果を報告する。48人の年齢中央値は61歳(34-87)で、4人の患者は学会報告時点でも臨床試験継続中だった。白人が75%、女性が54%、非喫煙者が69%、ECOG PS1が65%だった。88%の患者で治療中断を要し、76%の患者で減量が必要だった。12%の患者で治療中止に至る有害事象が発生した。Grade3以上の治療関連有害事象の主なものは、発疹(35%)、下痢(14%)、胃炎(20%)、爪囲炎(8%)だった。主要評価項目であるORRは44%(95%信頼区間29.5-58.8)だった。さらに2人の患者は、解析時点ではまだ1度の奏効しか確認できていなかったが、確認出来たら奏効割合が48%となる。DCRは75%、DOR中央値は5.4ヶ月(2.8-19.1以上)で、3人の患者が治療を継続していた。PFS中央値は5.6ヶ月(0-20.2以上)だった。
結論:
Poziotinib16mg1日1回投与は、HER2エクソン20変異を有する未治療非小細胞肺がん患者に対して、臨床的に意義のある治療効果を示した。 安全性プロファイルは他の第2世代EGFR阻害薬と同様だった。1日2回投与群の臨床試験は現在も継続中である。
2021年10月08日
セルペルカチニブの添付文書
製造販売承認は得られたものの、まだ薬価収載には至っていないセルペルカチニブだが、添付文書は参照できる状態になっていた。
参考までに。
https://www.lillymedical.jp/ja-jp/answers/144696
参考までに。
https://www.lillymedical.jp/ja-jp/answers/144696
2021年10月07日
第4世代ALK阻害薬・・・TPX-0131とNVL-655
ALK肺がんの領域でなにか新しい話題がないかと思ってい調べたところ、今回紹介する総説に遭遇した。
これまで文献を読んだときは、漫然と要約を書き下していたが、総説だとそうはいかない。
迷った挙句、将来読み返したときに参考になるように、自分なりの要点を3点書き残す。
EGFR肺がんのオシメルチニブ耐性でも問題になっている重複遺伝子変異の概念、その克服を目指す第4世代ALK阻害薬の登場がトピックであり、ALK肺がんの研究開発の奥行を感じさせてくれる総説だった。
Will the clinical development of 4th-generation "double mutant active" ALK TKIs (TPX-0131 and NVL-655) change the future treatment paradigm of ALK+ NSCLC?
Sai-Hong Ignatius Ou et al., Transl Oncol. 2021 Nov;14(11):101191.
doi: 10.1016/j.tranon.2021.101191. Epub 2021 Aug 5.
1)ALK肺がんに対する一次治療としてのALK阻害薬臨床試験のまとめ
ALK肺がんを間野先生の研究グループが発見したのち、当初はマルチキナーゼ阻害薬であるクリゾチニブが使われ始めた。
ALK肺がんの領域におけるクリゾチニブは、もはや「古典」といってもいい治療である。
当初はプラチナ併用化学療法に対し、クリゾチニブが有意に無増悪生存期間延長効果を示し、それもハザード比0.40-0.45程度と圧倒的な差を以てクリゾチニブに軍配が上がっており、ALK肺がんにはALK阻害薬、という今日では当たり前の治療概念が確立された。
以後はクリゾチニブが標準治療、比較対象として広く受け入れられるようになり、いつの間にか他のALK阻害薬の引き立て役になってしまった。
セリチニブはともかく、アレクチニブ、ブリガチニブ、ensartinib、ロルラチニブ、いずれも一次治療として、クリゾチニブと比較して無増悪生存期間を延長し、それもハザード比0.28-0.51と圧倒的な差を以てクリゾチニブ以外のALK阻害薬に軍配が上がっている。
驕れるものは久しからず、とは言わないが、一次治療としてのクリゾチニブの役割は終わった。
そして、ALK肺がんの特徴である高頻度の中枢神経系転移に対する抗腫瘍活性に優れ、かつALK融合遺伝子産物に対する選択的阻害活性がより強いクリゾチニブ以外のALK阻害薬(主にセリチニブ、アレクチニブ)が一次治療として積極的に使用されるようになる。


2)ALK阻害薬の使用法の変遷と、耐性変異様式の移り変わり
ALK異常を含め、複数の遺伝子異常に有効なマルチキナーゼ阻害薬として働くクリゾチニブを使用することにより、クリゾチニブにより誘導される耐性変異は多岐にわたり、solvent front と呼ばれる薬剤結合部位の入り口の耐性変異はその中の一部にしか過ぎなかったが、クリゾチニブ以外のALK選択性の強いALK阻害薬により誘導される耐性変異は、よりsolvent frontへの耐性変異に収斂されていくことになる。
なかでも最も厄介な、それでいて出現頻度の高い耐性変異がG1202R変異であるが、より中枢神経系への移行活性が高く、かつG1202R変異への阻害活性を強めるべく開発されたのがロルラチニブだった。
こうした薬剤特性と治療開発の経緯から、クリゾチニブを第1世代、セリチニブ、アレクチニブ、ブリガチニブ、ensartinibを第2世代、ロルラチニブを第3世代のALK阻害薬と称する分類法が一般的となっていく。
そして近年では、複数の耐性変異が1本のALK肺がん染色体アリルに共存するがために、上記の既存ALK阻害薬が効かない耐性例が見られるようになった。
こうした「重複耐性変異」を有するALK肺がんは、アレクチニブでの治療後(アレクチニブの前治療の如何は問わない)では24%の出現頻度で、第2世代ALK阻害薬を用いた後のロルラチニブでの治療後では48%と倍増していた。
3)重複耐性変異に対する第4世代ALK阻害薬の登場
第2世代、第3世代のALK阻害薬は、二次治療以降で使用すると一般に無増悪生存期間延長効果が薄まってしまう。
例えば、ALTA-1L試験結果から、ブリガチニブを一次治療で使用すると2年程度の無増悪生存期間を見込めるが、アレクチニブ耐性後にブリガチニブを使用すると、無増悪生存期間は4.4-7.3ヶ月程度まで短縮する。
同様に、CROWN試験結果から、ロルラチニブを一次治療で使用すると2年半程度の無増悪生存期間を見込めるが、第2世代ALK阻害薬1種類耐性後にロルラチニブを使用すると6.9ヶ月、2種類以上のALK阻害薬耐性後にロルラチニブを使用すると5.5ヶ月まで短縮する。
こうした状況を打破するために開発されたのが、TPX-0131やNVL-655といった第4世代のALK阻害薬である。
まだ前臨床の段階ではあるが、TPX-0131、NVL-655いずれも、重複耐性変異に対する阻害活性を有することが確認されている。
TPX-0131に至っては、一部の三重重複耐性変異にも阻害活性を有するようである。
一方、G1202R / G1269AやG1202R / G1269A / L1204VのようなTPX-0131でも歯が立たない重複耐性変異も確認されている。
今後は、第4世代ALK阻害薬の効果と安全性を検証する臨床試験が、既存治療耐性化後のALK肺がん患者、あるいは未治療ALK肺がん患者を対象として計画されていくだろう。
また、その結果を受けて、第○○世代といったあいまいな分類ではなく、それぞれの薬理特性に見合ったALK阻害薬分類に切り替わっていくだろう。


なお、ALK阻害薬の耐性化機構については、こちらのリンクがとても参考になるので書き残しておく。
・ALKキナーゼ・ROS1キナーゼ融合遺伝子陽性肺がんの、治療薬への耐性化機構と克服薬を発見することに成功
→https://www.jfcr.or.jp/chemotherapy/pickup/backnumber_003.html
これまで文献を読んだときは、漫然と要約を書き下していたが、総説だとそうはいかない。
迷った挙句、将来読み返したときに参考になるように、自分なりの要点を3点書き残す。
EGFR肺がんのオシメルチニブ耐性でも問題になっている重複遺伝子変異の概念、その克服を目指す第4世代ALK阻害薬の登場がトピックであり、ALK肺がんの研究開発の奥行を感じさせてくれる総説だった。
Will the clinical development of 4th-generation "double mutant active" ALK TKIs (TPX-0131 and NVL-655) change the future treatment paradigm of ALK+ NSCLC?
Sai-Hong Ignatius Ou et al., Transl Oncol. 2021 Nov;14(11):101191.
doi: 10.1016/j.tranon.2021.101191. Epub 2021 Aug 5.
1)ALK肺がんに対する一次治療としてのALK阻害薬臨床試験のまとめ
ALK肺がんを間野先生の研究グループが発見したのち、当初はマルチキナーゼ阻害薬であるクリゾチニブが使われ始めた。
ALK肺がんの領域におけるクリゾチニブは、もはや「古典」といってもいい治療である。
当初はプラチナ併用化学療法に対し、クリゾチニブが有意に無増悪生存期間延長効果を示し、それもハザード比0.40-0.45程度と圧倒的な差を以てクリゾチニブに軍配が上がっており、ALK肺がんにはALK阻害薬、という今日では当たり前の治療概念が確立された。
以後はクリゾチニブが標準治療、比較対象として広く受け入れられるようになり、いつの間にか他のALK阻害薬の引き立て役になってしまった。
セリチニブはともかく、アレクチニブ、ブリガチニブ、ensartinib、ロルラチニブ、いずれも一次治療として、クリゾチニブと比較して無増悪生存期間を延長し、それもハザード比0.28-0.51と圧倒的な差を以てクリゾチニブ以外のALK阻害薬に軍配が上がっている。
驕れるものは久しからず、とは言わないが、一次治療としてのクリゾチニブの役割は終わった。
そして、ALK肺がんの特徴である高頻度の中枢神経系転移に対する抗腫瘍活性に優れ、かつALK融合遺伝子産物に対する選択的阻害活性がより強いクリゾチニブ以外のALK阻害薬(主にセリチニブ、アレクチニブ)が一次治療として積極的に使用されるようになる。


2)ALK阻害薬の使用法の変遷と、耐性変異様式の移り変わり
ALK異常を含め、複数の遺伝子異常に有効なマルチキナーゼ阻害薬として働くクリゾチニブを使用することにより、クリゾチニブにより誘導される耐性変異は多岐にわたり、solvent front と呼ばれる薬剤結合部位の入り口の耐性変異はその中の一部にしか過ぎなかったが、クリゾチニブ以外のALK選択性の強いALK阻害薬により誘導される耐性変異は、よりsolvent frontへの耐性変異に収斂されていくことになる。
なかでも最も厄介な、それでいて出現頻度の高い耐性変異がG1202R変異であるが、より中枢神経系への移行活性が高く、かつG1202R変異への阻害活性を強めるべく開発されたのがロルラチニブだった。
こうした薬剤特性と治療開発の経緯から、クリゾチニブを第1世代、セリチニブ、アレクチニブ、ブリガチニブ、ensartinibを第2世代、ロルラチニブを第3世代のALK阻害薬と称する分類法が一般的となっていく。
そして近年では、複数の耐性変異が1本のALK肺がん染色体アリルに共存するがために、上記の既存ALK阻害薬が効かない耐性例が見られるようになった。
こうした「重複耐性変異」を有するALK肺がんは、アレクチニブでの治療後(アレクチニブの前治療の如何は問わない)では24%の出現頻度で、第2世代ALK阻害薬を用いた後のロルラチニブでの治療後では48%と倍増していた。
3)重複耐性変異に対する第4世代ALK阻害薬の登場
第2世代、第3世代のALK阻害薬は、二次治療以降で使用すると一般に無増悪生存期間延長効果が薄まってしまう。
例えば、ALTA-1L試験結果から、ブリガチニブを一次治療で使用すると2年程度の無増悪生存期間を見込めるが、アレクチニブ耐性後にブリガチニブを使用すると、無増悪生存期間は4.4-7.3ヶ月程度まで短縮する。
同様に、CROWN試験結果から、ロルラチニブを一次治療で使用すると2年半程度の無増悪生存期間を見込めるが、第2世代ALK阻害薬1種類耐性後にロルラチニブを使用すると6.9ヶ月、2種類以上のALK阻害薬耐性後にロルラチニブを使用すると5.5ヶ月まで短縮する。
こうした状況を打破するために開発されたのが、TPX-0131やNVL-655といった第4世代のALK阻害薬である。
まだ前臨床の段階ではあるが、TPX-0131、NVL-655いずれも、重複耐性変異に対する阻害活性を有することが確認されている。
TPX-0131に至っては、一部の三重重複耐性変異にも阻害活性を有するようである。
一方、G1202R / G1269AやG1202R / G1269A / L1204VのようなTPX-0131でも歯が立たない重複耐性変異も確認されている。
今後は、第4世代ALK阻害薬の効果と安全性を検証する臨床試験が、既存治療耐性化後のALK肺がん患者、あるいは未治療ALK肺がん患者を対象として計画されていくだろう。
また、その結果を受けて、第○○世代といったあいまいな分類ではなく、それぞれの薬理特性に見合ったALK阻害薬分類に切り替わっていくだろう。


なお、ALK阻害薬の耐性化機構については、こちらのリンクがとても参考になるので書き残しておく。
・ALKキナーゼ・ROS1キナーゼ融合遺伝子陽性肺がんの、治療薬への耐性化機構と克服薬を発見することに成功
→https://www.jfcr.or.jp/chemotherapy/pickup/backnumber_003.html
2021年09月28日
セルペルカチニブ、製造販売承認
RET阻害薬、セルペルカチニブの製造販売承認が2021/09/27付で下りたとのこと。
→https://news.lilly.co.jp/down2.php?attach_id=817&category=19&page=1&access_id=2151
・RET阻害薬、セルペルカチニブがやってくる
→http://oitahaiganpractice.junglekouen.com/e993028.html
また、現在進行中のLIBRETTO-431試験に加え、治験参加施設で
「トランスフェクション再編成(RET)活性化を有する局所進行性又は転移性固形腫瘍患者の治療のための多施設拡大アクセスプログラム(EAP)」
と称する倫理供給も併せて行われているようだ。
・国立研究開発法人国立がん研究センター東病院
・国立研究開発法人国立がん研究センター中央病院
・北海道大学病院
・金沢大学附属病院
・鳥取大学医学部附属病院
・大阪市立総合医療センター
病状の進行が早く、数か月後の市販まで待てない、というRET陽性進行肺がんの方は、各施設へアクセス可能ならば検討してみてはどうだろうか。
→https://news.lilly.co.jp/down2.php?attach_id=817&category=19&page=1&access_id=2151
・RET阻害薬、セルペルカチニブがやってくる
→http://oitahaiganpractice.junglekouen.com/e993028.html
また、現在進行中のLIBRETTO-431試験に加え、治験参加施設で
「トランスフェクション再編成(RET)活性化を有する局所進行性又は転移性固形腫瘍患者の治療のための多施設拡大アクセスプログラム(EAP)」
と称する倫理供給も併せて行われているようだ。
・国立研究開発法人国立がん研究センター東病院
・国立研究開発法人国立がん研究センター中央病院
・北海道大学病院
・金沢大学附属病院
・鳥取大学医学部附属病院
・大阪市立総合医療センター
病状の進行が早く、数か月後の市販まで待てない、というRET陽性進行肺がんの方は、各施設へアクセス可能ならば検討してみてはどうだろうか。
2021年09月22日
HER2遺伝子変異陽性肺がんに対するtrastuzumab deruxtecan
HER2遺伝子変異陽性非小細胞肺がん。
いい思い出がない。
もう6年以上前だが、1人だけ担当したことがある。
もともと他院で診療されていた患者だが、プラチナ併用化学療法と丸山ワクチンを併用したいということで私のもとに来られた。
とにかく、できることは何でもしたい、と本人・ご家族ともに考えておられた。
化学療法も丸山ワクチンも顕著な効果なく、LC-SCRUMに参加したところ、HER2遺伝子変異陽性を指摘された。
当時、確か北大でトラスツズマブの、岡山大でT-DM1の臨床試験が行われていたと記憶しているが、既に参加できるようなPSではなかった。
最終的には、苦し紛れにpan HER inhibitorであるアファチニブを使ったが、全く歯が立たなかった。
今回取り上げる論文冒頭の記載によると、HER2遺伝子変異陽性肺がんは非扁平上皮非小細胞肺がん患者の3%弱に認められ、女性・非喫煙者に多く、予後不良とのこと。
私が担当した患者に見事に特徴が合致する。
・HER2遺伝子変異陽性肺癌
→http://oitahaiganpractice.junglekouen.com/e808769.html
実際のところ、HER2を治療標的とした初期の臨床試験は、まさに死屍累々たる有様だった。
・Studies Explore Targeted Therapies in Lung Cancer
→http://oitahaiganpractice.junglekouen.com/e900760.html
・T-DM1 for HER2 positive NSCLC
→http://oitahaiganpractice.junglekouen.com/e906042.html
そんな中、以下の記事でごくわずかに触れたが、
「抗体-薬物複合体を用いた治療により、HER2遺伝子変異陽性非小細胞肺がん患者では60%以上の奏効割合が、現在進行中の臨床試験で示されている」
という話があり、その結果公表が待っていた。
・あれから20年も、この先10年も
→http://oitahaiganpractice.junglekouen.com/e982143.html
そして、ようやくその時が来た。
trasutuzumab deruxtecanは乳がんや胃がんで既に有効性が証明されていたが、今回のDESTINY-01試験で非小細胞肺がんにおいても一定の有効性が確認された。
参加した患者の95%がプラチナ併用化学療法施行済み、66%がPD-1 / PD-L1抗体使用済み、20%がドセタキセル使用済み、14%が抗HER2チロシンキナーゼ阻害薬使用済みということ。
経過観察期間中央値はまだわずか13ヶ月だが、奏効割合55%、無増悪生存期間中央値8.2ヶ月、全生存期間中央値17.8ヶ月というのは有望な数字である。
Trastuzumab Deruxtecan in HER2-Mutant Non–Small-Cell Lung Cancer
DESTINY-Lung01 Trial
Bob T. Li,Yasushi Goto, M.D., Ph.D., Kazuhiko Nakagawa, M.D., Hibiki Udagawa, M.D. Misako Nagasaka, M.D., Ryota Shiga, B.Sc. et al.
N Engl J Med September 18, 2021, published online
DOI: 10.1056/NEJMoa2112431
背景:
ヒト上皮成長因子受容体2(HER2)を標的とした治療は、これまでのところ非小細胞肺がん領域では承認されていない。HER2遺伝子変異陽性非小細胞肺がんに対し、HER2抗体-薬物複合体であるtrastuzumab deruxtecan(以前はDS-8201のコードネームで呼称されていた)を使用した際の有効性、安全性について、これまでのところ国際的に検証されたことはない。
方法:
標準治療に対し耐性となったHER2遺伝子変異陽性進行非小細胞肺がん患者に対し、trastuzumab deruxtecan(患者体重1kgあたり6.4mg)を投与する国際多施設共同第2相臨床試験を行った。主要評価項目は独立委員会判定による奏効割合とした。副次評価項目には、奏効持続期間、無増悪生存期間、全生存期間、安全性を含めた。バイオマーカーとして、HER2遺伝子変異の多様性についても検討した。
結果:
計91人の患者が登録された。経過観察期間中央値は13.1ヶ月(0.7-29.1)だった。奏効割合は55%(95%信頼区間44-65%)だった。奏効持続期間中央値は9.3ヶ月(95%信頼区間5.7-14.7)だった。無増悪生存期間中央値は8.2ヶ月(95%信頼区間6.0-11.9)、全生存期間中央値は17.8ヶ月(95%信頼区間13.8-22.)だった。安全性プロファイルは、trastuzumab deruxtecanに関連した過去の研究結果で認められたのと同様だった。Grade 3以上の薬剤関連有害事象は患者の46%に認められた。その中でも最も頻度が高かったのは好中球減少症(19%)だった。薬剤性と判定された間質性肺障害は26%の患者に認められ、2人はこれにより死亡した。腫瘍縮小効果はHER2遺伝子変異のどのサブタイプでも同様に認められ、免疫染色によるHER2発現の有無、あるいはHER2増幅の有無と縮小効果の間には関連性は見られなかった。
結論
trasutuzumab deruxtecanは、既治療HER2陽性非小細胞肺がん患者に対して、持続的な抗腫瘍活性を示した。安全性プロファイルの点では、薬剤性肺障害による死亡例が2件発生したが、概ね過去の研究で確認されたのと同様の所見だった。
いい思い出がない。
もう6年以上前だが、1人だけ担当したことがある。
もともと他院で診療されていた患者だが、プラチナ併用化学療法と丸山ワクチンを併用したいということで私のもとに来られた。
とにかく、できることは何でもしたい、と本人・ご家族ともに考えておられた。
化学療法も丸山ワクチンも顕著な効果なく、LC-SCRUMに参加したところ、HER2遺伝子変異陽性を指摘された。
当時、確か北大でトラスツズマブの、岡山大でT-DM1の臨床試験が行われていたと記憶しているが、既に参加できるようなPSではなかった。
最終的には、苦し紛れにpan HER inhibitorであるアファチニブを使ったが、全く歯が立たなかった。
今回取り上げる論文冒頭の記載によると、HER2遺伝子変異陽性肺がんは非扁平上皮非小細胞肺がん患者の3%弱に認められ、女性・非喫煙者に多く、予後不良とのこと。
私が担当した患者に見事に特徴が合致する。
・HER2遺伝子変異陽性肺癌
→http://oitahaiganpractice.junglekouen.com/e808769.html
実際のところ、HER2を治療標的とした初期の臨床試験は、まさに死屍累々たる有様だった。
・Studies Explore Targeted Therapies in Lung Cancer
→http://oitahaiganpractice.junglekouen.com/e900760.html
・T-DM1 for HER2 positive NSCLC
→http://oitahaiganpractice.junglekouen.com/e906042.html
そんな中、以下の記事でごくわずかに触れたが、
「抗体-薬物複合体を用いた治療により、HER2遺伝子変異陽性非小細胞肺がん患者では60%以上の奏効割合が、現在進行中の臨床試験で示されている」
という話があり、その結果公表が待っていた。
・あれから20年も、この先10年も
→http://oitahaiganpractice.junglekouen.com/e982143.html
そして、ようやくその時が来た。
trasutuzumab deruxtecanは乳がんや胃がんで既に有効性が証明されていたが、今回のDESTINY-01試験で非小細胞肺がんにおいても一定の有効性が確認された。
参加した患者の95%がプラチナ併用化学療法施行済み、66%がPD-1 / PD-L1抗体使用済み、20%がドセタキセル使用済み、14%が抗HER2チロシンキナーゼ阻害薬使用済みということ。
経過観察期間中央値はまだわずか13ヶ月だが、奏効割合55%、無増悪生存期間中央値8.2ヶ月、全生存期間中央値17.8ヶ月というのは有望な数字である。
Trastuzumab Deruxtecan in HER2-Mutant Non–Small-Cell Lung Cancer
DESTINY-Lung01 Trial
Bob T. Li,Yasushi Goto, M.D., Ph.D., Kazuhiko Nakagawa, M.D., Hibiki Udagawa, M.D. Misako Nagasaka, M.D., Ryota Shiga, B.Sc. et al.
N Engl J Med September 18, 2021, published online
DOI: 10.1056/NEJMoa2112431
背景:
ヒト上皮成長因子受容体2(HER2)を標的とした治療は、これまでのところ非小細胞肺がん領域では承認されていない。HER2遺伝子変異陽性非小細胞肺がんに対し、HER2抗体-薬物複合体であるtrastuzumab deruxtecan(以前はDS-8201のコードネームで呼称されていた)を使用した際の有効性、安全性について、これまでのところ国際的に検証されたことはない。
方法:
標準治療に対し耐性となったHER2遺伝子変異陽性進行非小細胞肺がん患者に対し、trastuzumab deruxtecan(患者体重1kgあたり6.4mg)を投与する国際多施設共同第2相臨床試験を行った。主要評価項目は独立委員会判定による奏効割合とした。副次評価項目には、奏効持続期間、無増悪生存期間、全生存期間、安全性を含めた。バイオマーカーとして、HER2遺伝子変異の多様性についても検討した。
結果:
計91人の患者が登録された。経過観察期間中央値は13.1ヶ月(0.7-29.1)だった。奏効割合は55%(95%信頼区間44-65%)だった。奏効持続期間中央値は9.3ヶ月(95%信頼区間5.7-14.7)だった。無増悪生存期間中央値は8.2ヶ月(95%信頼区間6.0-11.9)、全生存期間中央値は17.8ヶ月(95%信頼区間13.8-22.)だった。安全性プロファイルは、trastuzumab deruxtecanに関連した過去の研究結果で認められたのと同様だった。Grade 3以上の薬剤関連有害事象は患者の46%に認められた。その中でも最も頻度が高かったのは好中球減少症(19%)だった。薬剤性と判定された間質性肺障害は26%の患者に認められ、2人はこれにより死亡した。腫瘍縮小効果はHER2遺伝子変異のどのサブタイプでも同様に認められ、免疫染色によるHER2発現の有無、あるいはHER2増幅の有無と縮小効果の間には関連性は見られなかった。
結論
trasutuzumab deruxtecanは、既治療HER2陽性非小細胞肺がん患者に対して、持続的な抗腫瘍活性を示した。安全性プロファイルの点では、薬剤性肺障害による死亡例が2件発生したが、概ね過去の研究で確認されたのと同様の所見だった。
2021年09月21日
オシメルチニブ耐性化後は、耐性機序同定や分子標的治療は意味がないのか
今回の報告では、二次治療でオシメルチニブが導入され、その後に病勢進行した患者が対象ということで、現在の実臨床とは乖離があるかも知れない。
また、耐性機序に即して分子標的薬の治療を選択したとはいえ、既存の治療薬を使いまわしただけなので、今回の報告を以て耐性機序同定やそれに基づく分子標的薬選択は意味がない、とまでは言わない。
しかし、オシメルチニブ耐性化後に既存の分子標的薬を、それも耐性機序を同定せずに使いまわす、という治療は多かれ少なかれ行われていることだろう。
今回の報告は、そうした治療態度はあまり報われない、ということを裏付けている。
要約中では耐性化機序に基づく分子標的治療と化学療法の間には無増悪生存期間の違いはないと書かれているが、数字だけみると化学療法の方が有望に感じる。
現時点では、耐性化機序にこだわらず、オシメルチニブ耐性化後はKEYNOTE-189レジメンでの治療に切り替えた方がまだ希望が持てるのではないか。
Paired Liquid and Tissues Biopsies to Guide Treatment for Patients That Progress on 2nd Line Osimertinib Treatment
Tijmen van der Wel et al., WCLC2021 Abst.#MA07.03
背景:
高い奏効割合と忍容性を示すにも関わらず、大多数の患者においてオシメルチニブに対する耐性化が起こることは避けられない。個々の患者における耐性機序の同定は、引き続く分子標的治療の指針となり得る。今回の取り組みでは、以下の2点を目的とした。
1)オシメルチニブによる二次治療後に病勢進行に至った患者に対して、リキッドバイオプシーと組織生検を同時に行うことにより耐性機序を同定する、
2)オシメルチニブ中止後、次に行う治療による無増悪生存期間を算出する
方法:
2019年09月から2021年02月までに、二次治療としてのオシメルチニブ投与後に病勢進行に至った50人の患者を集積し、今回の単施設前向き研究に組み入れた。対象患者は、リキッドバイオプシーと組織生検の両方を受けた。リキッドバイオプシーの解析には、AVENIO ctDNA拡張パネルを用いた。組織生検の解析には、検索対象遺伝子を定めた次世代シーケンサーパネル解析と、Archer FusionPlex Lung Version 1を用いた。こうして得られた解析結果は、毎週開催される分子腫瘍会議(Molecular Tumor Board, MTB)において個々の患者ごとに議論された。この会議では、個別化医療に向けて助言することを目的とした。MTB開催後の治療効果については、6-8週間ごとにCTで評価した。
結果:
EGFR遺伝子変異は、リキッドバイオプシーでは50人中37人(74%)で、組織生検では50人中48人(96%)で確認された。リキッドバイオプシーと組織生検で結果が一致したのは、50人中35人(70%)だった。50人中39人(78%)では、1種以上の耐性化機序がリキッドバイオプシーないしは組織生検で同定され、そのうち15人では2種以上の耐性化機序が関わっていた。頻度が高かった耐性化機序は、MET増幅が38%、EGFR C797S変異が16%だった。
MTBでの議論に基づき、23人の患者が分子標的薬の治療を受け、16人の患者が化学療法を受けた。4人の患者は緩和医療のみを受けた。6人の患者はオシメルチニブ使用を継続し、そのうち3人は追加の局所制御治療も併せて行った。1人の患者では、まだ化学療法を開始していなかった。分子標的薬使用の内訳は、BRAF V600E変異陽性患者に対するダブラフェニブ+トラメチニブ併用療法が1人、BRAF融合遺伝子陽性患者に対するダブラフェニブ単剤療法もしくはダブラフェニブ+トラメチニブ併用療法が計3人、EGFR G724S/L718Q変異に対する第2世代EGFRチロシンキナーゼ阻害薬単剤療法が計2人、トランス型のT790M/C797S変異に対する第1世代EGFRチロシンキナーゼ阻害薬単剤療法が計2人、MET増幅陽性患者に対するクリゾチニブ単剤療法が計8人、ALK融合遺伝子陽性患者に対するクリゾチニブ単剤療法が1人、MET増幅+ALK融合遺伝子併存患者に対するクリゾチニブ単剤療法が1人、HER2増幅/過剰発現患者に対するT-DM1単剤療法が5人だった。無増悪生存期間中央値は化学療法適用患者では5.2ヶ月(95%信頼区間3.9-6.5)、分子標的薬適用患者では3.3ヶ月(95%信頼区間は1.4-5.2ヶ月)だった。追跡期間中央値は化学療法適用患者では9.1ヶ月、分子標的薬適用患者では7.2ヶ月だった。分子標的薬を適用した患者では、同定された耐性機序の数は無増悪生存期間の長短とは無関係だった。1種の耐性機序が同定された患者における無増悪生存期間中央値は5.8ヶ月(95%信頼区間4.2-7.5)で、2種以上の耐性機序が同定された患者における無増悪生存期間中央値は3.2ヶ月(95%信頼区間0.2-6.2)だった。
分子標的薬使用後に病勢進行した患者のうち、10人ではさらに組織生検が行われた。10人中5人(50%)では新たな耐性機序が明らかとなったものの、そのうち治療標的となり得たのは3人(30%)に留まった。
結論:
今回対象とした患者集団では、二次治療でオシメルチニブを使用したのちに病勢進行に至った患者でリキッドバイオプシーと組織生検を合わせて行っても、その結果を踏まえた分子標的治療と化学療法の間では無増悪生存期間に違いはなかった。オシメルチニブ耐性化後の分子標的治療の効果が比較的短期間に留まるのは、同時発生、異時発生を問わず、高頻度に複数の耐性化機序が関わっているためかもしれない。
また、耐性機序に即して分子標的薬の治療を選択したとはいえ、既存の治療薬を使いまわしただけなので、今回の報告を以て耐性機序同定やそれに基づく分子標的薬選択は意味がない、とまでは言わない。
しかし、オシメルチニブ耐性化後に既存の分子標的薬を、それも耐性機序を同定せずに使いまわす、という治療は多かれ少なかれ行われていることだろう。
今回の報告は、そうした治療態度はあまり報われない、ということを裏付けている。
要約中では耐性化機序に基づく分子標的治療と化学療法の間には無増悪生存期間の違いはないと書かれているが、数字だけみると化学療法の方が有望に感じる。
現時点では、耐性化機序にこだわらず、オシメルチニブ耐性化後はKEYNOTE-189レジメンでの治療に切り替えた方がまだ希望が持てるのではないか。
Paired Liquid and Tissues Biopsies to Guide Treatment for Patients That Progress on 2nd Line Osimertinib Treatment
Tijmen van der Wel et al., WCLC2021 Abst.#MA07.03
背景:
高い奏効割合と忍容性を示すにも関わらず、大多数の患者においてオシメルチニブに対する耐性化が起こることは避けられない。個々の患者における耐性機序の同定は、引き続く分子標的治療の指針となり得る。今回の取り組みでは、以下の2点を目的とした。
1)オシメルチニブによる二次治療後に病勢進行に至った患者に対して、リキッドバイオプシーと組織生検を同時に行うことにより耐性機序を同定する、
2)オシメルチニブ中止後、次に行う治療による無増悪生存期間を算出する
方法:
2019年09月から2021年02月までに、二次治療としてのオシメルチニブ投与後に病勢進行に至った50人の患者を集積し、今回の単施設前向き研究に組み入れた。対象患者は、リキッドバイオプシーと組織生検の両方を受けた。リキッドバイオプシーの解析には、AVENIO ctDNA拡張パネルを用いた。組織生検の解析には、検索対象遺伝子を定めた次世代シーケンサーパネル解析と、Archer FusionPlex Lung Version 1を用いた。こうして得られた解析結果は、毎週開催される分子腫瘍会議(Molecular Tumor Board, MTB)において個々の患者ごとに議論された。この会議では、個別化医療に向けて助言することを目的とした。MTB開催後の治療効果については、6-8週間ごとにCTで評価した。
結果:
EGFR遺伝子変異は、リキッドバイオプシーでは50人中37人(74%)で、組織生検では50人中48人(96%)で確認された。リキッドバイオプシーと組織生検で結果が一致したのは、50人中35人(70%)だった。50人中39人(78%)では、1種以上の耐性化機序がリキッドバイオプシーないしは組織生検で同定され、そのうち15人では2種以上の耐性化機序が関わっていた。頻度が高かった耐性化機序は、MET増幅が38%、EGFR C797S変異が16%だった。
MTBでの議論に基づき、23人の患者が分子標的薬の治療を受け、16人の患者が化学療法を受けた。4人の患者は緩和医療のみを受けた。6人の患者はオシメルチニブ使用を継続し、そのうち3人は追加の局所制御治療も併せて行った。1人の患者では、まだ化学療法を開始していなかった。分子標的薬使用の内訳は、BRAF V600E変異陽性患者に対するダブラフェニブ+トラメチニブ併用療法が1人、BRAF融合遺伝子陽性患者に対するダブラフェニブ単剤療法もしくはダブラフェニブ+トラメチニブ併用療法が計3人、EGFR G724S/L718Q変異に対する第2世代EGFRチロシンキナーゼ阻害薬単剤療法が計2人、トランス型のT790M/C797S変異に対する第1世代EGFRチロシンキナーゼ阻害薬単剤療法が計2人、MET増幅陽性患者に対するクリゾチニブ単剤療法が計8人、ALK融合遺伝子陽性患者に対するクリゾチニブ単剤療法が1人、MET増幅+ALK融合遺伝子併存患者に対するクリゾチニブ単剤療法が1人、HER2増幅/過剰発現患者に対するT-DM1単剤療法が5人だった。無増悪生存期間中央値は化学療法適用患者では5.2ヶ月(95%信頼区間3.9-6.5)、分子標的薬適用患者では3.3ヶ月(95%信頼区間は1.4-5.2ヶ月)だった。追跡期間中央値は化学療法適用患者では9.1ヶ月、分子標的薬適用患者では7.2ヶ月だった。分子標的薬を適用した患者では、同定された耐性機序の数は無増悪生存期間の長短とは無関係だった。1種の耐性機序が同定された患者における無増悪生存期間中央値は5.8ヶ月(95%信頼区間4.2-7.5)で、2種以上の耐性機序が同定された患者における無増悪生存期間中央値は3.2ヶ月(95%信頼区間0.2-6.2)だった。
分子標的薬使用後に病勢進行した患者のうち、10人ではさらに組織生検が行われた。10人中5人(50%)では新たな耐性機序が明らかとなったものの、そのうち治療標的となり得たのは3人(30%)に留まった。
結論:
今回対象とした患者集団では、二次治療でオシメルチニブを使用したのちに病勢進行に至った患者でリキッドバイオプシーと組織生検を合わせて行っても、その結果を踏まえた分子標的治療と化学療法の間では無増悪生存期間に違いはなかった。オシメルチニブ耐性化後の分子標的治療の効果が比較的短期間に留まるのは、同時発生、異時発生を問わず、高頻度に複数の耐性化機序が関わっているためかもしれない。
2021年09月20日
EGFR/ALK陽性非小細胞肺がんに対するカルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法
いわゆるKEYNOTE-189レジメンをチロシンキナーゼ阻害薬無効となったEGFR/ALK異常陽性非小細胞肺がん患者さんに適用したらどうなるか、という臨床試験。
患者集積不良で早期終了になったとはいえ、EGFR遺伝子変異陽性患者は目標の28人中26人まで集積できている。
加えて、26人中22人はオシメルチニブ治療歴のある患者ということで、現在の治療実態に近い患者が集められている。
その上で、KEYNOTE-189レジメンを適用したら生存期間中央値22.2ヶ月(95%信頼区間20.6-未到達)、無増悪生存期間中央値8.3ヶ月(95%信頼区間7.2-16.5)というのは、チロシンキナーゼによる前治療歴がある前提で考えると、とても希望の持てる数字ではないだろうか。
本家KEYNOTE-189試験における生存期間中央値22.0ヶ月(95%信頼区間19.5-25.2)、無増悪生存期間中央値9.0ヶ月(95%信頼区間8.1-9.9)なので、ほぼ遜色ない結果である。
なお、ALK融合遺伝子陽性患者は本当に患者数が少なくて、評価困難である。
Pembrolizumab in Combination With Platinum-Based Chemotherapy in Recurrent EGFR/ALK-Positive Non-Small Cell Lung Cancer (NSCLC)
Shirish M. Gadgeel et al., WCLC 2021 Abst.#OA09.03
背景:
EGFR / ALK遺伝子異常を伴う非小細胞肺がん患者において、免疫チェックポイント阻害薬単剤での治療効果は限られている。今回はこうした患者に対して、カルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法の効果を検証するための第II相試験を企画した。
方法:
EGFR遺伝子変異あるいはALK融合遺伝子を有する非小細胞肺がん患者で、これら遺伝子異常に対応した分子標的薬を使用したものの病勢が再燃したものを対象とした。カルボプラチン5AUC、ペメトレキセド500mg/㎡、ペンブロリズマブ200mgを3週間ごとに反復投与した。4サイクル目以降はペメトレキセド+ペンブロリズマブ併用療法を2年間を上限に反復した。効果判定は当初の6サイクルまでは2サイクルごとに、その後は担当医の決定に従って適宜行うこととした。主要評価項目はRECIST ver.1.1準拠の奏効割合とし、副次評価項目には無増悪生存期間(PFS)や生存期間(OS)を含めた。腫瘍組織のPD-L1発現状態は治療施設内で調べた。循環血中腫瘍細胞を1サイクル目と3サイクル目に先立って評価した。EGFR遺伝子変異陽性患者群とALK融合遺伝子陽性患者群それぞれで28人の評価可能患者を集積することを目標としたが、患者集積が遅々として進まなかったため早期終了となった。
結果:
33人の患者が登録され、26人はEGFR遺伝子変異陽性非小細胞肺がん(Exon19欠失変異が13人、Exon21 L858R点変異が9人)だった。64%は女性で、年齢中央値は67歳だった。前治療レジメン数の中央値は1(範囲は1-3)だった。26人のEGFR遺伝子変異陽性非小細胞肺がんのうち、22人にはオシメルチニブの治療歴があった。今回のプロトコール治療を施行したサイクル数の中央値は6(範囲は2-24)で、4人の患者(すべてEGFR遺伝子変異陽性患者)は解析時点でもプロトコール治療を継続していた。奏効割合(95%信頼区間)はEGFR遺伝子変異陽性非小細胞肺がんでは42%(23-63)、ALK融合遺伝子陽性非小細胞肺がんでは29%(4-71)だった。奏効持続期間は6.1ヶ月だった。腫瘍組織のPD-L1発現状態は30人の患者で確認でき、PD-L1の発現状態によらず生存期間は同等だった。治療開始前の循環血中腫瘍細胞を評価できたEGFR遺伝子変異陽性患者における中央値は4ヶ/ml(0-23)だった。生存期間中央値は、循環血中腫瘍細胞が減少した患者集団では未到達、増加した患者集団では18.5ヶ月(p=0.52)だった。頻度の高かった有害事象は、倦怠感、嘔気、骨髄抑制、咳、呼吸困難だった。頻度が高かったGrade3以上の有害事象は好中球減少、血小板減少、血栓塞栓症、AST/ALT上昇だった。薬剤性肺障害を来した患者が1人いた。
結論:
TKI治療不耐となったEGFR遺伝子変異陽性非小細胞肺がん患者において、カルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法は奏効割合42%、生存期間中央値22ヶ月の成績を残した。

患者集積不良で早期終了になったとはいえ、EGFR遺伝子変異陽性患者は目標の28人中26人まで集積できている。
加えて、26人中22人はオシメルチニブ治療歴のある患者ということで、現在の治療実態に近い患者が集められている。
その上で、KEYNOTE-189レジメンを適用したら生存期間中央値22.2ヶ月(95%信頼区間20.6-未到達)、無増悪生存期間中央値8.3ヶ月(95%信頼区間7.2-16.5)というのは、チロシンキナーゼによる前治療歴がある前提で考えると、とても希望の持てる数字ではないだろうか。
本家KEYNOTE-189試験における生存期間中央値22.0ヶ月(95%信頼区間19.5-25.2)、無増悪生存期間中央値9.0ヶ月(95%信頼区間8.1-9.9)なので、ほぼ遜色ない結果である。
なお、ALK融合遺伝子陽性患者は本当に患者数が少なくて、評価困難である。
Pembrolizumab in Combination With Platinum-Based Chemotherapy in Recurrent EGFR/ALK-Positive Non-Small Cell Lung Cancer (NSCLC)
Shirish M. Gadgeel et al., WCLC 2021 Abst.#OA09.03
背景:
EGFR / ALK遺伝子異常を伴う非小細胞肺がん患者において、免疫チェックポイント阻害薬単剤での治療効果は限られている。今回はこうした患者に対して、カルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法の効果を検証するための第II相試験を企画した。
方法:
EGFR遺伝子変異あるいはALK融合遺伝子を有する非小細胞肺がん患者で、これら遺伝子異常に対応した分子標的薬を使用したものの病勢が再燃したものを対象とした。カルボプラチン5AUC、ペメトレキセド500mg/㎡、ペンブロリズマブ200mgを3週間ごとに反復投与した。4サイクル目以降はペメトレキセド+ペンブロリズマブ併用療法を2年間を上限に反復した。効果判定は当初の6サイクルまでは2サイクルごとに、その後は担当医の決定に従って適宜行うこととした。主要評価項目はRECIST ver.1.1準拠の奏効割合とし、副次評価項目には無増悪生存期間(PFS)や生存期間(OS)を含めた。腫瘍組織のPD-L1発現状態は治療施設内で調べた。循環血中腫瘍細胞を1サイクル目と3サイクル目に先立って評価した。EGFR遺伝子変異陽性患者群とALK融合遺伝子陽性患者群それぞれで28人の評価可能患者を集積することを目標としたが、患者集積が遅々として進まなかったため早期終了となった。
結果:
33人の患者が登録され、26人はEGFR遺伝子変異陽性非小細胞肺がん(Exon19欠失変異が13人、Exon21 L858R点変異が9人)だった。64%は女性で、年齢中央値は67歳だった。前治療レジメン数の中央値は1(範囲は1-3)だった。26人のEGFR遺伝子変異陽性非小細胞肺がんのうち、22人にはオシメルチニブの治療歴があった。今回のプロトコール治療を施行したサイクル数の中央値は6(範囲は2-24)で、4人の患者(すべてEGFR遺伝子変異陽性患者)は解析時点でもプロトコール治療を継続していた。奏効割合(95%信頼区間)はEGFR遺伝子変異陽性非小細胞肺がんでは42%(23-63)、ALK融合遺伝子陽性非小細胞肺がんでは29%(4-71)だった。奏効持続期間は6.1ヶ月だった。腫瘍組織のPD-L1発現状態は30人の患者で確認でき、PD-L1の発現状態によらず生存期間は同等だった。治療開始前の循環血中腫瘍細胞を評価できたEGFR遺伝子変異陽性患者における中央値は4ヶ/ml(0-23)だった。生存期間中央値は、循環血中腫瘍細胞が減少した患者集団では未到達、増加した患者集団では18.5ヶ月(p=0.52)だった。頻度の高かった有害事象は、倦怠感、嘔気、骨髄抑制、咳、呼吸困難だった。頻度が高かったGrade3以上の有害事象は好中球減少、血小板減少、血栓塞栓症、AST/ALT上昇だった。薬剤性肺障害を来した患者が1人いた。
結論:
TKI治療不耐となったEGFR遺伝子変異陽性非小細胞肺がん患者において、カルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法は奏効割合42%、生存期間中央値22ヶ月の成績を残した。

2021年09月18日
ドライバー遺伝子異常検出におけるジレンマとmultiplex PCR
非小細胞肺がんの診療において、ドライバー遺伝子異常、PD-L1陽性割合といったバイオマーカー評価の重要性は論を俟たない。
どちらも様々な手法で調べられてきて、1薬剤につき1コンパニオン検査での診断しか認めないという不毛極まりない時期があったが、少しずつ実態に即してきている感がある。
とは言え、まだまだ最適化されたとはいいがたい。
ドライバー遺伝子変異検索においては、個別のドライバー遺伝子異常をPCR検査を用いて検出する方法と、次世代シーケンサー(NGS)を用いてまとめて調べる方法がある。
前者は高感度だが、基本的には1遺伝子異常につき1検査という対応関係があるので、EGFR、ALK、ROS1、BRAF、RET、MET14skipと調べようとしたら6回分の生検組織量と手間とお金がかかる。
出現頻度1%のドライバー遺伝子変異に組織と手間とお金をかけるのかと思うと、すぐには気が進まない。
効率的に、頻度の高いものから調べたくなるのが人情だが、そうしていると稀な遺伝子異常を検出したくなったときには生検組織がなくなっていた、ということは起こりうる。
NGSを使えば全部まとめて調べられるからいいんじゃないか、と言われそうだが、そもそもNGSでの検索には相応の量の生検組織が要求される。
そして、PCRに比べると検査感度は劣る。
NGSで陰性、PCRでEGFR遺伝子変異陽性だったという話はちらほら耳にする。
そんななか、中国のAmoy DiagnosticsのAmoyDx Multi-Gene Mutations Detection Kitについて、理研ジェネシス社が製造販売承認を取得したようだ。
2021/06/25付で(EGFR, ALK, ROS1, BRAF)、さらに2021/08/12付でMETエクソン14スキッピング変異が追加され、5種の遺伝子変異を1つの検査で、それも高感度のPCRベースで検出できるようになる見通しだ。
→https://www.rikengenesis.jp/information/press.html
この検査が一般的に使われるようになると、稀な遺伝子異常も検出されやすくなるだろう。
本検査キットは、9種(EGFR, KRAS, BRAF, NRAS, HER2, PIK3CA, ALK, ROS1, RET)の変異を同時に検索できるので、いずれはRETに対するセルペルカチニブ、KRAS G12Cに対するSotorasib、HER2に対するT-DM1といった組み合わせに対し、本検査もコンパニオン診断として追加承認申請されるかもしれない。
→http://www.amoydiagnostics.com/productDetail_35.html
どちらも様々な手法で調べられてきて、1薬剤につき1コンパニオン検査での診断しか認めないという不毛極まりない時期があったが、少しずつ実態に即してきている感がある。
とは言え、まだまだ最適化されたとはいいがたい。
ドライバー遺伝子変異検索においては、個別のドライバー遺伝子異常をPCR検査を用いて検出する方法と、次世代シーケンサー(NGS)を用いてまとめて調べる方法がある。
前者は高感度だが、基本的には1遺伝子異常につき1検査という対応関係があるので、EGFR、ALK、ROS1、BRAF、RET、MET14skipと調べようとしたら6回分の生検組織量と手間とお金がかかる。
出現頻度1%のドライバー遺伝子変異に組織と手間とお金をかけるのかと思うと、すぐには気が進まない。
効率的に、頻度の高いものから調べたくなるのが人情だが、そうしていると稀な遺伝子異常を検出したくなったときには生検組織がなくなっていた、ということは起こりうる。
NGSを使えば全部まとめて調べられるからいいんじゃないか、と言われそうだが、そもそもNGSでの検索には相応の量の生検組織が要求される。
そして、PCRに比べると検査感度は劣る。
NGSで陰性、PCRでEGFR遺伝子変異陽性だったという話はちらほら耳にする。
そんななか、中国のAmoy DiagnosticsのAmoyDx Multi-Gene Mutations Detection Kitについて、理研ジェネシス社が製造販売承認を取得したようだ。
2021/06/25付で(EGFR, ALK, ROS1, BRAF)、さらに2021/08/12付でMETエクソン14スキッピング変異が追加され、5種の遺伝子変異を1つの検査で、それも高感度のPCRベースで検出できるようになる見通しだ。
→https://www.rikengenesis.jp/information/press.html
この検査が一般的に使われるようになると、稀な遺伝子異常も検出されやすくなるだろう。
本検査キットは、9種(EGFR, KRAS, BRAF, NRAS, HER2, PIK3CA, ALK, ROS1, RET)の変異を同時に検索できるので、いずれはRETに対するセルペルカチニブ、KRAS G12Cに対するSotorasib、HER2に対するT-DM1といった組み合わせに対し、本検査もコンパニオン診断として追加承認申請されるかもしれない。
→http://www.amoydiagnostics.com/productDetail_35.html
2021年09月15日
中国人患者におけるRET阻害薬(Selpercatinib, Pralsetinib)の有効性
中国人を対象としたRET阻害薬のデータが公表されていた。
SelpercatinibもPralsetinibも、奏効割合という点では変わりはなさそう。
Pralsetinibでは骨髄抑制の有害事象が目立つ。
Efficacy and Safety of Selpercatinib in Chinese Patients With RET Fusion-Positive Non-Small Cell Lung Cancer: A Phase 2 Trial
Shun Lu et al., WCLC 2021 Abst.#MA02.01
背景:
Serpercatinibは、rearranged during transfection(RET)キナーゼに対する高い選択性と阻害活性を有する、この分野では初めての薬であり、中枢神経系への活性も有する。RET融合遺伝子陽性非小細胞肺がんやRET変異のある甲状腺がんに対して多数の国々で承認されている。今回は、RET融合遺伝子陽性非小細胞肺がんの中国人患者を対象に、Serpercatinibの効果と安全性を検証した初めての臨床試験であるLIBRETTO-321試験について報告する。
方法:
LIBRETTO-321試験は、オープンラベル、多施設共同の第II相試験であり、RET融合遺伝子陽性非小細胞肺がんを含むRET遺伝子異常陽性進行固形がんの中国人患者を対象とした。Selpercatinib 160mgを1日2回経口投与し、28日間の治療を1サイクルとして、病勢進行、忍容不能の毒性、臨床試験参加への患者同意撤回、患者死亡のいずれかが発生するまで治療を継続した。主要評価項目はRECIST ver.1.1準拠の独立効果判定委員会(IRC)評価による奏効割合とした。副次評価項目の主なものは、奏効持続期間(DoR)、中枢神経病変における奏効割合(CNS-ORR)、中枢神経病変における奏効持続期間(CNS-DoR)、安全性とした。有効性評価はprimary analysis setとresponse evaluable patientsに分けて行った。primary analysis set(PAS)は中央臨床検査部においてRET融合遺伝子陽性非小細胞肺がんと確認された患者集団であり、response evaluable population(REP)は本試験に登録され、測定可能病変を有し、少なくとも1回は効果判定を受けた全ての非小細胞肺がん患者集団である。安全性はプロトコール治療を受けた全ての患者に対して評価した。
結果:
20201年3月25日までに、77人の患者が登録され、この中には47人のRET融合遺伝子陽性非小細胞肺がん患者が含まれており、26人はPASの基準を満たした。PASの患者集団の観察期間中央値は9.7ヶ月で、IRC評価による奏効割合は69.2%(95%信頼区間48.2-85.7)で、治療歴のない患者では87.5%、治療歴のある患者では61.1%だった。奏効持続期間中央値は未到達で、9ヶ月奏効持続割合は93.8%だった。REP集団は総数45人で、観察期間中央値は10.4ヶ月、IRC評価による奏効割合は66.7%(95%信頼区間51.0-80.0)だった。治療開始前に測定可能な中枢神経病変を有していた5人の患者のうち、4人(80%)はIRC評価による中枢神経病変の奏効基準を満たしており、9ヶ月後も効果が持続していた。安全性評価対象となった77人において、Grade 3以上の有害事象で頻度が高かったのは高血圧(19.5%)、AST上昇(15.6%)、ALT上昇(15.6%)だった。ほとんどの有害事象はGrade 1もしくは2だった。有害事象のためSelpercatinibの治療中止に至った割合は5.2%で、用量減量を必要としたのは32.5%だった。Selpercatinibとは無関係と思われる有害事象で1人の患者が死亡した。
結論:
Selpercatinibは中国人のRET融合遺伝子陽性進行非小細胞肺がん患者に対して、強力で持続的な抗腫瘍活性を示し、LIBRETTO-001試験で示された知見と同様だった。

Efficacy and Safety of Pralsetinib in Chinese Patients with Advanced RET Fusion+ Non-Small Cell Lung Cancer
Qing Zhou et al., WCLC 2021 Abst.#MA02.02
背景:
RET融合遺伝子は非小細胞肺がん患者のおよそ1-2%で認められるドライバー遺伝子異常として同定された。PralsetinibはRET遺伝子異常に対する高い選択性および阻害活性を持つRET阻害薬である。ARROW試験は第I / II相、オープンラベルの臨床試験で、非小細胞肺がんをはじめとした種々のRET遺伝子異常陽性進行固形がんに対するPralsetinibの安全性と抗腫瘍活性を評価する初の臨床試験である。前回のWCLC2020において、プラチナ併用化学療法後にPralsetinibを使用したRET融合遺伝子陽性進行非小細胞がんの中国人患者集団における効果と安全性について報告した。今回はその後の最新情報に加え、未治療RET融合遺伝子陽性進行非小細胞肺がんの中国人患者集団におけるPralsetinibの効果と安全性についても報告する。
方法:
未治療、もしくはプラチナ併用化学療法治療歴のあるRET融合遺伝子陽性非小細胞肺がン中国人患者を対象に、Pralsetinib 400mg/日を投与した。主要評価項目は独立効果判定委員会によるRECIST ver.1.1準拠の奏効割合、安全性プロファイルとした。副次評価項目には奏効持続期間(DoR)、病勢コントロール割合(DCR)、無増悪生存期間(PFS)、全生存期間(OS)を含めた。
結果:
2021年4月12日までに、68人のRET融合遺伝子陽性非小細胞肺がん中国人患者(プラチナ併用化学療法治療歴あり:37人、治療歴なし:31人)がPralsetininbの治療を受けた。治療前の段階で、ほとんど(95.6%)の患者がECOG-PS1の状態だった。RET融合遺伝子の融合パートナー(KIF5Bが66.2%、CCDC6が17.6%、その他が16.2%)、脳転移合併割合(33.8%)はこれまで知られているデータとほぼ同様だった。治療効果は図表に示したとおりであり、Pralsetinibは治療歴の有無に関わらず高い奏効割合を示した。少なくとも1回のPralsetinib投与を受けた患者は安全性評価対象とした(n=68)。治療関連有害事象として頻度が高かったのは、AST上昇(80.9%)、好中球減少(79.4%)、貧血(67.6%)、白血球減少(60.3%)、ALT上昇(57.4%)だった。10.3%の患者が有害事象を理由にPralsetinibの使用を中止した。
結論:
PralsetinibはRET融合遺伝子陽性の非小細胞肺がん中国人患者において、治療歴の有無に関わらず、早くかつ深い臨床的活性を有する有望な分子標的薬である。中国人患者におけるPralsetinibの有効性は、国際共同試験におけるデータと同様で、治療歴のない中国人患者でも同様の有効性を示した。安全性プロファイルは管理可能であり、未知の有害事象には見舞われなかった。Pralsetinibは良好な有効性・安全性プロファイルを有し、RET融合遺伝子陽性進行非小細胞肺がんの中国人患者に対して新しい医療を提案している。

SelpercatinibもPralsetinibも、奏効割合という点では変わりはなさそう。
Pralsetinibでは骨髄抑制の有害事象が目立つ。
Efficacy and Safety of Selpercatinib in Chinese Patients With RET Fusion-Positive Non-Small Cell Lung Cancer: A Phase 2 Trial
Shun Lu et al., WCLC 2021 Abst.#MA02.01
背景:
Serpercatinibは、rearranged during transfection(RET)キナーゼに対する高い選択性と阻害活性を有する、この分野では初めての薬であり、中枢神経系への活性も有する。RET融合遺伝子陽性非小細胞肺がんやRET変異のある甲状腺がんに対して多数の国々で承認されている。今回は、RET融合遺伝子陽性非小細胞肺がんの中国人患者を対象に、Serpercatinibの効果と安全性を検証した初めての臨床試験であるLIBRETTO-321試験について報告する。
方法:
LIBRETTO-321試験は、オープンラベル、多施設共同の第II相試験であり、RET融合遺伝子陽性非小細胞肺がんを含むRET遺伝子異常陽性進行固形がんの中国人患者を対象とした。Selpercatinib 160mgを1日2回経口投与し、28日間の治療を1サイクルとして、病勢進行、忍容不能の毒性、臨床試験参加への患者同意撤回、患者死亡のいずれかが発生するまで治療を継続した。主要評価項目はRECIST ver.1.1準拠の独立効果判定委員会(IRC)評価による奏効割合とした。副次評価項目の主なものは、奏効持続期間(DoR)、中枢神経病変における奏効割合(CNS-ORR)、中枢神経病変における奏効持続期間(CNS-DoR)、安全性とした。有効性評価はprimary analysis setとresponse evaluable patientsに分けて行った。primary analysis set(PAS)は中央臨床検査部においてRET融合遺伝子陽性非小細胞肺がんと確認された患者集団であり、response evaluable population(REP)は本試験に登録され、測定可能病変を有し、少なくとも1回は効果判定を受けた全ての非小細胞肺がん患者集団である。安全性はプロトコール治療を受けた全ての患者に対して評価した。
結果:
20201年3月25日までに、77人の患者が登録され、この中には47人のRET融合遺伝子陽性非小細胞肺がん患者が含まれており、26人はPASの基準を満たした。PASの患者集団の観察期間中央値は9.7ヶ月で、IRC評価による奏効割合は69.2%(95%信頼区間48.2-85.7)で、治療歴のない患者では87.5%、治療歴のある患者では61.1%だった。奏効持続期間中央値は未到達で、9ヶ月奏効持続割合は93.8%だった。REP集団は総数45人で、観察期間中央値は10.4ヶ月、IRC評価による奏効割合は66.7%(95%信頼区間51.0-80.0)だった。治療開始前に測定可能な中枢神経病変を有していた5人の患者のうち、4人(80%)はIRC評価による中枢神経病変の奏効基準を満たしており、9ヶ月後も効果が持続していた。安全性評価対象となった77人において、Grade 3以上の有害事象で頻度が高かったのは高血圧(19.5%)、AST上昇(15.6%)、ALT上昇(15.6%)だった。ほとんどの有害事象はGrade 1もしくは2だった。有害事象のためSelpercatinibの治療中止に至った割合は5.2%で、用量減量を必要としたのは32.5%だった。Selpercatinibとは無関係と思われる有害事象で1人の患者が死亡した。
結論:
Selpercatinibは中国人のRET融合遺伝子陽性進行非小細胞肺がん患者に対して、強力で持続的な抗腫瘍活性を示し、LIBRETTO-001試験で示された知見と同様だった。

Efficacy and Safety of Pralsetinib in Chinese Patients with Advanced RET Fusion+ Non-Small Cell Lung Cancer
Qing Zhou et al., WCLC 2021 Abst.#MA02.02
背景:
RET融合遺伝子は非小細胞肺がん患者のおよそ1-2%で認められるドライバー遺伝子異常として同定された。PralsetinibはRET遺伝子異常に対する高い選択性および阻害活性を持つRET阻害薬である。ARROW試験は第I / II相、オープンラベルの臨床試験で、非小細胞肺がんをはじめとした種々のRET遺伝子異常陽性進行固形がんに対するPralsetinibの安全性と抗腫瘍活性を評価する初の臨床試験である。前回のWCLC2020において、プラチナ併用化学療法後にPralsetinibを使用したRET融合遺伝子陽性進行非小細胞がんの中国人患者集団における効果と安全性について報告した。今回はその後の最新情報に加え、未治療RET融合遺伝子陽性進行非小細胞肺がんの中国人患者集団におけるPralsetinibの効果と安全性についても報告する。
方法:
未治療、もしくはプラチナ併用化学療法治療歴のあるRET融合遺伝子陽性非小細胞肺がン中国人患者を対象に、Pralsetinib 400mg/日を投与した。主要評価項目は独立効果判定委員会によるRECIST ver.1.1準拠の奏効割合、安全性プロファイルとした。副次評価項目には奏効持続期間(DoR)、病勢コントロール割合(DCR)、無増悪生存期間(PFS)、全生存期間(OS)を含めた。
結果:
2021年4月12日までに、68人のRET融合遺伝子陽性非小細胞肺がん中国人患者(プラチナ併用化学療法治療歴あり:37人、治療歴なし:31人)がPralsetininbの治療を受けた。治療前の段階で、ほとんど(95.6%)の患者がECOG-PS1の状態だった。RET融合遺伝子の融合パートナー(KIF5Bが66.2%、CCDC6が17.6%、その他が16.2%)、脳転移合併割合(33.8%)はこれまで知られているデータとほぼ同様だった。治療効果は図表に示したとおりであり、Pralsetinibは治療歴の有無に関わらず高い奏効割合を示した。少なくとも1回のPralsetinib投与を受けた患者は安全性評価対象とした(n=68)。治療関連有害事象として頻度が高かったのは、AST上昇(80.9%)、好中球減少(79.4%)、貧血(67.6%)、白血球減少(60.3%)、ALT上昇(57.4%)だった。10.3%の患者が有害事象を理由にPralsetinibの使用を中止した。
結論:
PralsetinibはRET融合遺伝子陽性の非小細胞肺がん中国人患者において、治療歴の有無に関わらず、早くかつ深い臨床的活性を有する有望な分子標的薬である。中国人患者におけるPralsetinibの有効性は、国際共同試験におけるデータと同様で、治療歴のない中国人患者でも同様の有効性を示した。安全性プロファイルは管理可能であり、未知の有害事象には見舞われなかった。Pralsetinibは良好な有効性・安全性プロファイルを有し、RET融合遺伝子陽性進行非小細胞肺がんの中国人患者に対して新しい医療を提案している。

2021年09月14日
オシメルチニブによる術前療法・・・NeoADAURAの前哨戦
昨年来、オシメルチニブによる術後補助療法のADAURA試験が大きな話題となっており、既に我が国でも適応拡大申請が成されている。
→https://prtimes.jp/main/html/rd/p/000000336.000024308.html
臨床研究の焦点は、既に術前治療のステップに移っている。
今年の世界肺癌会議では、オシメルチニブによる術前療法の報告が2報あった。
1報は中国から、オシメルチニブによる術前療法の効果と安全性に関する後方視的な検討について。
1報は米国から、オシメルチニブによる術前療法の効果と安全性に関する第II相試験の中間解析結果について。
なんとなく、診療や研究に対する哲学やアプローチの違いが表れているような感じがして興味深い。
そして、出てくる結論が似たり寄ったりであることも、また興味深いところである。
他の類似薬がそうであるように、オシメルチニブも単剤では病理学的効果はさほど高くないようだ。
オシメルチニブが効きにくい背景となりそうなRBM10という遺伝子変異が見つかったのは、今後に役立つのかもしれない。
P03.02 - Osimertinib as Neoadjuvant Therapy for Resectable EGFR Mutant Non-small Cell Lung Cancer: A Real-World Multicenter Retrospective Study
Xue-Feng Leng et al., WCLC2021 Abst.#P03.02
背景:
第3世代のEGFRチロシンキナーゼ阻害薬であるオシメルチニブは、優れた安全性プロファイルを有し、IB-IIIA期のEGFR遺伝子変異陽性完全切除後非小細胞肺がん患者の無病生存期間(Disease Free Survival, DFS)を延長する。しかし、術前治療としてのオシメルチニブのデータは限られている。今回の多施設共同後方視的研究は、IA-IIIB期のEGFR遺伝子変異陽性切除可能非小細胞肺がん患者におけるオシメルチニブの術前治療に関し、効果と安全性を検証するために企画した。
方法:
オシメルチニブの術前治療(80mg/日を経口投与)を1-3ヶ月行った後に手術を行ったIA-IIIB期の切除可能EGFR遺伝子変異陽性非小細胞肺がん患者13人の臨床データを後方視的に収集した。
結果:
術前オシメルチニブ投与の平均期間は59.8日間だった。オシメルチニブによる術前治療後、2人の患者は完全奏効、9人は部分奏効、2人は病勢安定の状態にあり、奏効割合は84.6%、病勢コントロール割合は100%だった。切除後の病理所見において、残存腫瘍細胞が病巣の10%未満と定義されるmajor Pathologic Response(mPR)の状態にある患者が4人認められた。mPR割合は75%だった。残存腫瘍細胞が皆無と定義される病理学的完全奏効(pathological Complete Response, pCR)は認められなかった。術前の臨床病期診断が術後病理病期診断で改善する(downstaging)現象は5人で認められた。オシメルチニブ投与に伴う深刻な有害事象や手術合併症は認めなかった。
結論:
今回の後方視的検討において、EGFR遺伝子変異陽性切除可能IA-IIIB期非小細胞肺がん患者におけるオシメルチニブ術前療法は忍容性良好で良好な病理学的治療効果につながっていた。
P26.02 - A Phase II Trial of Neoadjuvant Osimertinib for Surgically Resectable EGFR-Mutant Non-Small Cell Lung Cancer: Updated Results
Collin M. Blakely et al., WCLC2021 Abst.#P26.02
背景:
第3世代のEGFRチロシンキナーゼ阻害薬であるオシメルチニブは、EGFR遺伝子変異陽性進行非小細胞肺がんに対する一次治療として良好な安全性プロファイルと効果を併せ持っている。IB-IIIA期の外科切除後EGFR遺伝子変異陽性非小細胞肺がん患者に対し、オシメルチニブによる術後補助療法は有意に再発リスクを低下させる。一方、外科切除可能なEGFR遺伝子変異陽性非小細胞肺がんに対するオシメルチニブ術前療法の利点はまだわかっていない。ドライバー遺伝子変異陽性非小細胞肺がんに対する術前分子標的治療は、術前化学療法に比べて病理学的奏効割合や安全性の面でより有利かもしれない。こうした取り組みは、最適ながん遺伝子標的治療に対する腫瘍細胞の耐性メカニズムを同定することにも役立つ。
方法:
本試験はオシメルチニブ術前療法に関する進行中の多施設共同第II相試験であり、EGFR遺伝子変異陽性(Exon 19欠失変異あるいはExon 21 L858R点突然変異)の外科的切除可能な病期(AJCC第7版準拠でのI-IIIA期)にある非小細胞肺がん患者27人の集積を目指している。適格患者は、オシメルチニブ80mg/日内服を28日間サイクルで1サイクルあるいは2サイクルにわたって継続し、その後に外科的切除を受ける。主要評価項目は切除標本における残存腫瘍細胞が10%未満だった患者の割合を示すmajor Pathological Response(mPR)とした。副次評価項目は安全性、想定外の手術日程遅延、術後合併症割合、病理学的奏効割合(残存腫瘍細胞が0-49%の場合を奏効と定義)、病理学的完全奏効(pathological Complete Response, pCR)割合、奏効割合、リンパ節転移病巣のdownstagingの状態、無病生存期間(Disease Free Survival, DFS)、全生存期間(Overall Survival, OS)とした。
結果:
2021年4月までに、13人の早期(IA/B期6人、IIA/B期2人、IIIA期5人)EGFR遺伝子変異陽性(Exon 19欠失変異7人、Exon 21 L858R点突然変異6人)非小細胞肺がん患者が登録され、平均59日間のオシメルチニブによる術前治療の後に手術を受けた。mPR割合は15%(2 / 13)だった。病理学的奏効割合は69%(9 / 13)だった。病理学的完全奏効は認められなかった。画像診断上の奏効割合は46%(6 / 13)で、病勢安定の患者は7人、病勢コントロール割合は100%だった。治療開始前にリンパ節転移があった5人の患者のうち、リンパ節転移病巣のdownstagingは4人の患者で認められた(80%)。DFSやOSのデータはまだ評価できる段階にない。治療の安全性は良好で重篤な有害事象は確認されておらず、全ての患者が手術日程遅延や想定外の術後合併症に見舞われずに手術を受けられた。1人だけ、Grade 2相当の肺臓炎を合併したが、ステロイド治療を行うことなく改善した。7人の患者について、プロトコール治療開始前の腫瘍生検検体を用いて最大500か所に及ぶがん関連遺伝子解析を行った。オシメルチニブによる病理学的有効性が認められなかった4人のうち3人(75%)で、RBM10の機能失活を来す遺伝子変異が認められた。
結論:
今回の第II相試験の中間解析で、オシメルチニブによる術前治療は忍容性良好で、想定外の手術日程遅延を来すことなく、かつ病理学的奏効やリンパ節転移巣のdownstagingが得られることが分かった。一方、mPRに至る患者はまれであり、pCRを達成する患者は皆無だった。オシメルチニブによる病理学的奏効が得られなかった患者の大多数でRBM10変異が観察された。EGFR遺伝子変異陽性肺がんにおいて、臨床的に意義のあるmPR割合を達成するためには、NeoADAURA試験で検証されているようなオシメルチニブ+化学療法による術前療法のようなアプローチが必要なのかもしれない。
NeoADAURA試験(ClinicalTrials.gov ID: NCT04351555)
EGFR遺伝子変異陽性完全切除可能非小細胞肺がん患者を対象に、プラチナ製剤+ペメトレキセド併用術前療法と比較して、プラチナ製剤+ペメトレキセド+オシメルチニブ併用術前療法、オシメルチニブ単剤術前療法の効果と安全性を検証する無作為化第III相試験。
→https://prtimes.jp/main/html/rd/p/000000336.000024308.html
臨床研究の焦点は、既に術前治療のステップに移っている。
今年の世界肺癌会議では、オシメルチニブによる術前療法の報告が2報あった。
1報は中国から、オシメルチニブによる術前療法の効果と安全性に関する後方視的な検討について。
1報は米国から、オシメルチニブによる術前療法の効果と安全性に関する第II相試験の中間解析結果について。
なんとなく、診療や研究に対する哲学やアプローチの違いが表れているような感じがして興味深い。
そして、出てくる結論が似たり寄ったりであることも、また興味深いところである。
他の類似薬がそうであるように、オシメルチニブも単剤では病理学的効果はさほど高くないようだ。
オシメルチニブが効きにくい背景となりそうなRBM10という遺伝子変異が見つかったのは、今後に役立つのかもしれない。
P03.02 - Osimertinib as Neoadjuvant Therapy for Resectable EGFR Mutant Non-small Cell Lung Cancer: A Real-World Multicenter Retrospective Study
Xue-Feng Leng et al., WCLC2021 Abst.#P03.02
背景:
第3世代のEGFRチロシンキナーゼ阻害薬であるオシメルチニブは、優れた安全性プロファイルを有し、IB-IIIA期のEGFR遺伝子変異陽性完全切除後非小細胞肺がん患者の無病生存期間(Disease Free Survival, DFS)を延長する。しかし、術前治療としてのオシメルチニブのデータは限られている。今回の多施設共同後方視的研究は、IA-IIIB期のEGFR遺伝子変異陽性切除可能非小細胞肺がん患者におけるオシメルチニブの術前治療に関し、効果と安全性を検証するために企画した。
方法:
オシメルチニブの術前治療(80mg/日を経口投与)を1-3ヶ月行った後に手術を行ったIA-IIIB期の切除可能EGFR遺伝子変異陽性非小細胞肺がん患者13人の臨床データを後方視的に収集した。
結果:
術前オシメルチニブ投与の平均期間は59.8日間だった。オシメルチニブによる術前治療後、2人の患者は完全奏効、9人は部分奏効、2人は病勢安定の状態にあり、奏効割合は84.6%、病勢コントロール割合は100%だった。切除後の病理所見において、残存腫瘍細胞が病巣の10%未満と定義されるmajor Pathologic Response(mPR)の状態にある患者が4人認められた。mPR割合は75%だった。残存腫瘍細胞が皆無と定義される病理学的完全奏効(pathological Complete Response, pCR)は認められなかった。術前の臨床病期診断が術後病理病期診断で改善する(downstaging)現象は5人で認められた。オシメルチニブ投与に伴う深刻な有害事象や手術合併症は認めなかった。
結論:
今回の後方視的検討において、EGFR遺伝子変異陽性切除可能IA-IIIB期非小細胞肺がん患者におけるオシメルチニブ術前療法は忍容性良好で良好な病理学的治療効果につながっていた。
P26.02 - A Phase II Trial of Neoadjuvant Osimertinib for Surgically Resectable EGFR-Mutant Non-Small Cell Lung Cancer: Updated Results
Collin M. Blakely et al., WCLC2021 Abst.#P26.02
背景:
第3世代のEGFRチロシンキナーゼ阻害薬であるオシメルチニブは、EGFR遺伝子変異陽性進行非小細胞肺がんに対する一次治療として良好な安全性プロファイルと効果を併せ持っている。IB-IIIA期の外科切除後EGFR遺伝子変異陽性非小細胞肺がん患者に対し、オシメルチニブによる術後補助療法は有意に再発リスクを低下させる。一方、外科切除可能なEGFR遺伝子変異陽性非小細胞肺がんに対するオシメルチニブ術前療法の利点はまだわかっていない。ドライバー遺伝子変異陽性非小細胞肺がんに対する術前分子標的治療は、術前化学療法に比べて病理学的奏効割合や安全性の面でより有利かもしれない。こうした取り組みは、最適ながん遺伝子標的治療に対する腫瘍細胞の耐性メカニズムを同定することにも役立つ。
方法:
本試験はオシメルチニブ術前療法に関する進行中の多施設共同第II相試験であり、EGFR遺伝子変異陽性(Exon 19欠失変異あるいはExon 21 L858R点突然変異)の外科的切除可能な病期(AJCC第7版準拠でのI-IIIA期)にある非小細胞肺がん患者27人の集積を目指している。適格患者は、オシメルチニブ80mg/日内服を28日間サイクルで1サイクルあるいは2サイクルにわたって継続し、その後に外科的切除を受ける。主要評価項目は切除標本における残存腫瘍細胞が10%未満だった患者の割合を示すmajor Pathological Response(mPR)とした。副次評価項目は安全性、想定外の手術日程遅延、術後合併症割合、病理学的奏効割合(残存腫瘍細胞が0-49%の場合を奏効と定義)、病理学的完全奏効(pathological Complete Response, pCR)割合、奏効割合、リンパ節転移病巣のdownstagingの状態、無病生存期間(Disease Free Survival, DFS)、全生存期間(Overall Survival, OS)とした。
結果:
2021年4月までに、13人の早期(IA/B期6人、IIA/B期2人、IIIA期5人)EGFR遺伝子変異陽性(Exon 19欠失変異7人、Exon 21 L858R点突然変異6人)非小細胞肺がん患者が登録され、平均59日間のオシメルチニブによる術前治療の後に手術を受けた。mPR割合は15%(2 / 13)だった。病理学的奏効割合は69%(9 / 13)だった。病理学的完全奏効は認められなかった。画像診断上の奏効割合は46%(6 / 13)で、病勢安定の患者は7人、病勢コントロール割合は100%だった。治療開始前にリンパ節転移があった5人の患者のうち、リンパ節転移病巣のdownstagingは4人の患者で認められた(80%)。DFSやOSのデータはまだ評価できる段階にない。治療の安全性は良好で重篤な有害事象は確認されておらず、全ての患者が手術日程遅延や想定外の術後合併症に見舞われずに手術を受けられた。1人だけ、Grade 2相当の肺臓炎を合併したが、ステロイド治療を行うことなく改善した。7人の患者について、プロトコール治療開始前の腫瘍生検検体を用いて最大500か所に及ぶがん関連遺伝子解析を行った。オシメルチニブによる病理学的有効性が認められなかった4人のうち3人(75%)で、RBM10の機能失活を来す遺伝子変異が認められた。
結論:
今回の第II相試験の中間解析で、オシメルチニブによる術前治療は忍容性良好で、想定外の手術日程遅延を来すことなく、かつ病理学的奏効やリンパ節転移巣のdownstagingが得られることが分かった。一方、mPRに至る患者はまれであり、pCRを達成する患者は皆無だった。オシメルチニブによる病理学的奏効が得られなかった患者の大多数でRBM10変異が観察された。EGFR遺伝子変異陽性肺がんにおいて、臨床的に意義のあるmPR割合を達成するためには、NeoADAURA試験で検証されているようなオシメルチニブ+化学療法による術前療法のようなアプローチが必要なのかもしれない。
NeoADAURA試験(ClinicalTrials.gov ID: NCT04351555)
EGFR遺伝子変異陽性完全切除可能非小細胞肺がん患者を対象に、プラチナ製剤+ペメトレキセド併用術前療法と比較して、プラチナ製剤+ペメトレキセド+オシメルチニブ併用術前療法、オシメルチニブ単剤術前療法の効果と安全性を検証する無作為化第III相試験。
2021年09月13日
病勢進行後の治療をどう考えるか
肺がんの治療が多様化し、治療の考え方はとても複雑になった。
病勢進行後の治療をどう考えるかについて、散文的にはなるが書き記しておきたい。
1)「病勢進行」をどうとらえるか
病勢進行の定義をRECIST効果判定の考え方に沿って端的に書き下すなら、「一定以上の病巣増大、あるいは新規病巣の出現」である。
薬の腫瘍縮小効果を評価する臨床試験においては、この基準が厳密に適用される。
とはいえ、それさえも絶対的なものではない。
〇主観の問題
病勢進行後の治療をどう考えるかについて、散文的にはなるが書き記しておきたい。
1)「病勢進行」をどうとらえるか
病勢進行の定義をRECIST効果判定の考え方に沿って端的に書き下すなら、「一定以上の病巣増大、あるいは新規病巣の出現」である。
薬の腫瘍縮小効果を評価する臨床試験においては、この基準が厳密に適用される。
とはいえ、それさえも絶対的なものではない。
〇主観の問題
画像診断に基づいて腫瘍縮小効果を判定するといっても、評価者の主観に左右される。
患者・家族と喜びも悲しみも分かち合う担当医と、まったく診療に関わらない効果判定委員会では、どうしても測定結果に相違がある。
効果判定委員会の評価を仮に真の測定結果とするならば、患者・家族の心情を慮って測定結果をいい方にとってしまう担当医もいるだろう。
逆に、臨床試験の厳格さを重視するあまりに、却って測定結果を悪い方にとってしまう担当医もいるだろう。
そうした評価のブレがつきものだが、最近はあえて効果判定委員会の評価ではなく、担当医の評価を主要な評価項目に据える臨床試験も散見する。
これは私の推測だが、プロトコール治療が効果・安全性両面で優れていれば、担当医は長くプロトコール治療を続けたいと思うだろうし、逆に効果・安全性いずれかに問題があれば(診療をしていてそのように感じるならば)担当医は早くプロトコール治療をやめて、次の治療を提供したいと考えるだろう。
そうした担当医の主観が、敢えて効果判定に持ちこまれるようにしているのかもしれない。
〇タイミングの問題
治療の効果発現時期が効果判定のタイミングとうまく合致するとは限らない。
双極にあるのが、ドライバー遺伝子変異に対する分子標的薬と、免疫チェックポイント阻害薬である。
分子標的薬は一般に効果発現が早く、適切に使えば治療初期は劇的に病巣が縮小することが多い。
一方で、免疫チェックポイント阻害薬では、有効な場合にも一過性に病巣が増大することがある(Pseudo-Progression)。
そのため、免疫チェックポイント阻害薬で効果判定を急ぎすぎると、せっかく有効なのに早期に中止してしまう可能性がある。
〇過大評価の問題
RECIST効果判定では、「ベースライン(治療開始前)径和に比して、標的病変の径和が30%以上減少したら奏効と判定する」、「(治療)経過中の最小の径和(ベースライン径和が経過中の最小値である場合、これを最小の径和とする)に比して、標的病変の径和が20%以上増加、かつ径和が絶対値でも5mm以上増加したら病勢進行と判定する」という規定が存在する。
よく言われることだが、100mmあった病巣が、治療により10mmまで縮小し奏効と判定され、その後20mmまで増大したら、RECIST規定上はその時点で病勢進行である。
治療開始前からすれば1/5まで病巣が縮小した状態を保っているのだが、最も病巣が縮小した時点を基準とすれば病巣は2倍に増大している。
10mmまで縮小するのに1ヶ月、その後20mmまで増大するのに3年かかったとしても、RECIST効果判定上は病勢進行である。
この時点で治療をやめるのは誰が考えてもナンセンスだと思うのだが、ここまで極端でないにしても、似たようなことは実臨床で行われている可能性がある。
100mmあった病巣が、治療により70mmまで縮小し奏効と判定され、そこから84mmまで増大してもやはり病勢進行である。
この場合も、治療開始前より腫瘍が縮小しているにもかかわらず、治療は変更されることになる。
RECIST効果判定に従う限り、一旦奏効と判定された後の病勢進行は過大評価されがちであることがわかると思う。
〇評価確定の問題
RECIST効果判定においては、完全奏効や奏効の判定は、一定程度の腫瘍縮小が2回の効果判定にわたって連続的に確認されることで初めて確定する。
一方、病勢進行は1回の効果判定で基準を満たせば直ちに確定である。
〇病理学的な確認の問題
とくに新規病巣が出現した場合には要注意である。
その病巣が転移巣とは限らない。
実際に生検してみたら単なる良性病変だった、ということはしばしばある。
他にもまだ様々な問題はあると思うが、これらを踏まえると実地臨床においてはRECIST基準を厳密に守る必要はない。
とはいえ、各担当医の主観に完全に委ねてしまうと、担当医間、診療施設間でのバラつきがあまりに大きくなってしまい、都合が悪い。
RECISTはもともと化学療法の効果判定のために定められた性質が強いが、分子標的薬や免疫チェックポイント阻害薬のような新しいメカニズムの治療が一般化している以上、もはやRECIST自体が現状に合わなくなっている感が強い。
実地臨床でも応用可能な効果判定基準の策定に向けて、見直しをすべき時期に来ているように思う。
願わくば、患者の状態の代替指標として有効に機能する測定値の経過の追い方や、時間(縮小速度、増悪速度)の概念を新しい基準では盛り込んでほしい。
2)「病勢進行」後の治療をどのように考えるか
病勢進行、と判定しても、その後の治療の考え方は千差万別である。
ここでは、検討すべき項目を述べ、コメントを付すにとどめる。
〇考え得る治療
往々にして、初期に行われる治療の方が効果が高く、二次、三次、四次治療と進むにつれて期待できる効果は薄れていく。
病巣が大きくなっているにしても、治療前に比べると増大スピードが緩やかになっているようであれば、敢えてその治療をできる限り続けるという戦略もあるだろう。
〇年齢
90代の患者に対し、分子標的薬が効かなくなったからと言って、安易に化学療法に切り替えるのが良いとは限らない。
化学療法に切り替えるくらいなら、有害事象の軽い分子標的薬を使い続けて、それで効かなくなったら運命と思ってあきらめる、という人は多い。
〇体力(PS)
言いたいことは年齢の項と同様である。
〇治療薬の種類
点滴なのか、内服なのか。
化学療法なのか、分子標的薬なのか、血管増殖因子阻害薬なのか、免疫チェックポイント阻害薬なのか。
病勢進行後、次に使うとしたらどのような薬を想定しているのか。
それぞれの要素によって、おのずと考え方は変わってくるだろう。
例えば、免疫チェックポイント阻害薬使用後に分子標的薬に切り替えるのは、間質性肺炎のリスクを考えると勇気がいる。
敢えて間に化学療法を挟んで免疫チェックポイント阻害薬の影響が薄れるのを待つというのも戦略としてあり得るだろう。
〇脳転移による病勢進行
遠隔転移の中でも、脳転移については特別視することが多い。
脳転移以外は病勢進行を認めない、というときは、脳転移巣のみ放射線治療で対処し、薬物療法は変更しないということは多い。
薬物療法の進歩とともに、病勢進行の判定、その後の治療計画策定は一筋縄ではいかなくなった。
とは言え、これは決して悪いことではないように思う。
肌感覚としてかなりの確度を以て言えるのだが、担当医が「これはもういよいよ治療を変えなければまずい」とはっきり感じる場合を除いて、病勢進行時に急いで治療を変える必要はない。
そのくらい、肺がん領域における薬物療法は効果とその持続時間、安全性の両面から質が高くなっているように感じられる。
2021年09月10日
BRAF遺伝子変異と縁がない
BRAF遺伝子変異と縁がない。
どうも大分県内ではほとんどBRAF変異陽性肺がんは見つかっていないらしい。
現時点で大分県内で3人報告があり、うち2人は1施設に集中していて、ダブラフェニブ+トラメチニブ併用療法を施行中なのだとか。
あと1人は手術後の検索でたまたま見つかったものの、現時点で術後再発を来していないため、経過観察中なのだとか。
これまで、BRAF遺伝子変異陽性肺がんについては断片的にしか取り上げたことがない。
・BRAF変異を有する非小細胞肺癌とdabrafenib
→http://oitahaiganpractice.junglekouen.com/e848365.html
わざわざ2種類の分子標的薬を併用するのには、理由があるらしい。
いわゆる増殖シグナル伝達系の垂直阻害である。
・ダブラフェニブ+トラメチニブの作用機序(ノバルティス・ファーマ株式会社のHPへ)
→https://novartis-jp.secure.force.com/tflmkn/tflmkn_m_behavior_index
今回は、BRAF遺伝子変異陽性非小細胞肺がんにおけるダブラフェニブ+トラメチニブ併用療法の有効性を検証した臨床試験2報をまとめておく。
前者は初回治療、後者は二次治療以降の患者における臨床試験結果である。
早い話が、どの時点であれBRAF遺伝子変異があれば本治療を適用しよう、ということである。
まずは一次治療についての論文。
Dabrafenib plus trametinib in patients with previously untreated BRAF V600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial
David Planchard et al., Lancet Oncol. 2017 Oct;18(10):1307-1316.
doi: 10.1016/S1470-2045(17)30679-4. Epub 2017 Sep 11.
背景:
BRAF V600E遺伝子変異は肺腺癌の1-2%に認められるドライバー遺伝子変異である。ダブラフェニブ単剤あるいはダブラフェニブ+トラメチニブ併用療法は、BRAF V600E遺伝子変異陽性の既治療進行非小細胞肺がんに対して潜在的な抗腫瘍活性を示した。今回はBRAF V600E遺伝子変異陽性未治療進行非小細胞肺がんに対する、ダブラフェニブ+トラメチニブ併用療法の効果と安全性を検証した。
方法:
今回の第II相・段階的登録・複数コホート・多施設共同・非ランダム化オープンラベル試験では、18歳以上のBRAF V600E遺伝子変異陽性既治療進行非小細胞肺がん患者を、北米、欧州、アジアの8か国19施設から、コホートCとして登録した。対象患者はダブラフェニブ150mg/回を1日2回、トラメチニブ2mgを1日1回、病勢進行に至るか、忍容不能の毒性に至るか、患者の治療同意が撤回されるか、患者が死亡するかするまで内服した。主要評価項目はRECIST ver.1.1に基づいた担当医評価による奏効割合とした。主要評価項目と安全性に関する解析は、intent-to-treat解析で行った。本試験は論文発表時点で継続中だが、患者集積は終了した。
結論:
続いて、二次治療以降についての論文。
Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial
David Planchard et al., Lancet Oncol. 2016 Jul;17(7):984-993.
どうも大分県内ではほとんどBRAF変異陽性肺がんは見つかっていないらしい。
現時点で大分県内で3人報告があり、うち2人は1施設に集中していて、ダブラフェニブ+トラメチニブ併用療法を施行中なのだとか。
あと1人は手術後の検索でたまたま見つかったものの、現時点で術後再発を来していないため、経過観察中なのだとか。
これまで、BRAF遺伝子変異陽性肺がんについては断片的にしか取り上げたことがない。
・BRAF変異を有する非小細胞肺癌とdabrafenib
→http://oitahaiganpractice.junglekouen.com/e848365.html
わざわざ2種類の分子標的薬を併用するのには、理由があるらしい。
いわゆる増殖シグナル伝達系の垂直阻害である。
・ダブラフェニブ+トラメチニブの作用機序(ノバルティス・ファーマ株式会社のHPへ)
→https://novartis-jp.secure.force.com/tflmkn/tflmkn_m_behavior_index
今回は、BRAF遺伝子変異陽性非小細胞肺がんにおけるダブラフェニブ+トラメチニブ併用療法の有効性を検証した臨床試験2報をまとめておく。
前者は初回治療、後者は二次治療以降の患者における臨床試験結果である。
早い話が、どの時点であれBRAF遺伝子変異があれば本治療を適用しよう、ということである。
まずは一次治療についての論文。
公表されたのは、こちらの方が後である。
Dabrafenib plus trametinib in patients with previously untreated BRAF V600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial
David Planchard et al., Lancet Oncol. 2017 Oct;18(10):1307-1316.
doi: 10.1016/S1470-2045(17)30679-4. Epub 2017 Sep 11.
背景:
BRAF V600E遺伝子変異は肺腺癌の1-2%に認められるドライバー遺伝子変異である。ダブラフェニブ単剤あるいはダブラフェニブ+トラメチニブ併用療法は、BRAF V600E遺伝子変異陽性の既治療進行非小細胞肺がんに対して潜在的な抗腫瘍活性を示した。今回はBRAF V600E遺伝子変異陽性未治療進行非小細胞肺がんに対する、ダブラフェニブ+トラメチニブ併用療法の効果と安全性を検証した。
方法:
今回の第II相・段階的登録・複数コホート・多施設共同・非ランダム化オープンラベル試験では、18歳以上のBRAF V600E遺伝子変異陽性既治療進行非小細胞肺がん患者を、北米、欧州、アジアの8か国19施設から、コホートCとして登録した。対象患者はダブラフェニブ150mg/回を1日2回、トラメチニブ2mgを1日1回、病勢進行に至るか、忍容不能の毒性に至るか、患者の治療同意が撤回されるか、患者が死亡するかするまで内服した。主要評価項目はRECIST ver.1.1に基づいた担当医評価による奏効割合とした。主要評価項目と安全性に関する解析は、intent-to-treat解析で行った。本試験は論文発表時点で継続中だが、患者集積は終了した。
結果:
2014年4月16日から2015年12月28日までの期間内に、36人の患者を登録し、ダブラフェニブ+トラメチニブ併用療法による初回治療を行った。2017年4月28日のカットオフ時点での追跡期間中央値は15.9ヶ月(四分位間は7.8-22.0)だった。主要評価項目である、担当医評価による奏効割合は64%(95%信頼区間46-79)で、2人(6%)は完全奏効、21人(58%)は部分奏効だった。全ての患者になんらかの有害事象が確認され、69%の患者でgrade 3ないし4の有害事象を認めた。2人以上の患者で認められたgrade 3もしくは4の有害事象は、発熱(11%)、ALT上昇(11%)、高血圧(11%)、嘔吐(8%)だった。2人以上の患者で認められた重篤な有害事象は、ALT上昇(14%)、発熱(11%)、AST上昇(8%)、左室駆出率低下(8%)だった。プロトコール治療と関連性はないと判断されたものの、致死的な有害事象が1件発生した(心肺停止)。
結論:
ダブラフェニブ+トラメチニブ併用療法は未治療のBRAF V600E遺伝子変異陽性進行非小細胞肺がんに対し、臨床的に有用な抗腫瘍活性を示すとともに、対処可能な安全性プロファイルを有する治療である。
続いて、二次治療以降についての論文。
毒性プロファイルは若干異なるものの、有効性はほとんど変わらない。
Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial
David Planchard et al., Lancet Oncol. 2016 Jul;17(7):984-993.
doi: 10.1016/S1470-2045(16)30146-2. Epub 2016 Jun 6.
背景:
背景:
BRAF遺伝子変異は非小細胞肺がん細胞におけるmitogen-activated protein kinase(MAPK)経路を介したドライバー遺伝子変異である。BRAF阻害により、BRAF V600E遺伝子変異を有する非小細胞肺がんにおいて抗腫瘍活性が確認されている。BRAF V600E遺伝子変異陽性非小細胞肺がんにおいて、BRAF阻害薬とMEK阻害薬を併用してMAPK経路を阻害することにより、BRAF V600E遺伝子変異陽性悪性黒色腫で確認されたように、BRAF阻害薬単剤療法よりも有効である可能性がある。今回はBRAF-V600E遺伝子変異陽性非小細胞肺がん患者を対象に、ダブラフェニブ+トラメチニブ併用療法の有効性と安全性を確認することにした。
方法:
本試験は第2相多施設共同非ランダム化オープンラベル試験として計画した。対象者は成人(18歳以上)のBRAF V600E遺伝子変異陽性既治療進行非小細胞肺がん患者で、少なくともプラチナ併用化学療法1レジメンは経験済みで、かつ既治療レジメン数は3レジメン以下とされた。BRAF阻害薬もしくはMEK阻害薬の治療歴があるものは除外された。脳転移を有する患者も参加可能とされたが、無症候性で、未治療あるいは局所療法後3週間以上は安定した状態を保っていて、病巣のサイズが1cm以下であることを条件とした。対象患者はダブラフェニブ150mg/回を1日2回、トラメチニブ2mgを1日1回、21日間を1コースとし、病勢進行に至るか、忍容不能の毒性に至るか、患者の治療同意が撤回されるか、患者が死亡するかするまで内服した。主要評価項目はRECIST ver.1.1に基づいた担当医評価による奏効割合とし、intent-to-treat解析で行った。安全性について少なくとも3週間に1回、CTCAE ver. 4.0基準に基づいて評価を行い、主要評価項目と同様の手法で解析を行った。本試験は論文発表時点で継続中だが、患者集積は終了した。
結果:
2013年12月20日から2015年1月14日にかけて、北米、欧州、アジアの9か国30施設から59人の患者を集積した。2人の患者は治療歴がなかったため不適格とし、残る57人の患者を登録した。主要評価項目である、担当医評価による奏効割合は63.2%(95%信頼区間49.3-75.6)だった。重篤な有害事象は56%の患者で発生し、発熱(16%)、貧血(5%)、混迷(4%)、食欲不振(4%)、喀血(4%)、高カルシウム血症(4%)、嘔気(4%)、皮膚扁平上皮がん合併(4%)が含まれていた。grade 3-4の有害事象の主なものとして、好中球減少(9%)、低ナトリウム血症(7%)、貧血(5%)を認めた。プロトコール治療に直接の関連がない有害事象で4人の患者が死亡し、その内訳は後腹膜空出血、くも膜下出血、急性呼吸不全、急速な病勢進行による死亡だった。
結論:
ダブラフェニブ+トラメチニブ併用療法は、BRAF V600E変異陽性の既治療非小細胞肺癌に対して、臨床的に有用かつ強固な抗腫瘍活性を示すとともに、対処可能な安全性プロファイルを有する治療である。
2021年09月09日
RET阻害薬、セルペルカチニブがやってくる
取り上げるのが少し遅くなってしまったが、RET融合遺伝子陽性肺がんに対する分子標的薬、セルペルカチニブがそろそろやってきそうだ。
2021/07/30に開催された薬事・食品衛生審議会医薬品第二部会で、RET融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌を対象に、RETキナーゼ阻害薬セルペルカチニブ(商品名レットヴィモ)の承認が了承された。
→https://www.mhlw.go.jp/content/11121000/000806707.pdf
まだ薬事承認、薬価収載の手続きが残っているが、早ければ2021年内には実臨床で使用できるようになるのではないだろうか。
また2021/09/02付で、既に実臨床で頻用されているオンコマインDx Target Test マルチ CDxシステムで、RET融合遺伝子に対してもコンパニオン診断としての使用が追加承認された。
→https://www.thermofisher.com/jp/ja/home/about-us/news-gallery/release/2021/pr090221.html
セルペルカチニブについては、過去に何度か取り上げた。
第III相試験、LIBRETTO-431試験の結果を待って承認されるのかと思っていたが、想定より早かった。
化学療法の副作用に耐えながら承認を待っていたRET陽性肺がん患者の親族として、セルペルカチニブの承認に尽力してくださった全ての方に心から感謝を申し上げたい。
・RET肺がんとSelpercatinib
→http://oitahaiganpractice.junglekouen.com/e982216.html
・RET肺がんに対するSelpercatinibの第III相試験 LIBRETTO-431
→http://oitahaiganpractice.junglekouen.com/e984811.html
・RET融合遺伝子陽性肺がんに対するselpercatinibの第III相試験:LIBRETTO-431試験の概要
→http://oitahaiganpractice.junglekouen.com/e985209.html
・RET陽性肺がんのLIBRETTO-001試験、東アジア人患者でのサブグループ解析
→http://oitahaiganpractice.junglekouen.com/e985296.html
・RET陽性肺がんの臨床的特徴と治療反応性 シンガポール国立がんセンターの報告から
→http://oitahaiganpractice.junglekouen.com/e985297.html
・EGFR耐性機構としてのRET融合遺伝子出現と、オシメルチニブ+selpercatinib併用療法
→http://oitahaiganpractice.junglekouen.com/e985376.html
・LIBRETTO-001試験 前治療の効果は?
→http://oitahaiganpractice.junglekouen.com/e987053.html
2021/07/30に開催された薬事・食品衛生審議会医薬品第二部会で、RET融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌を対象に、RETキナーゼ阻害薬セルペルカチニブ(商品名レットヴィモ)の承認が了承された。
→https://www.mhlw.go.jp/content/11121000/000806707.pdf
まだ薬事承認、薬価収載の手続きが残っているが、早ければ2021年内には実臨床で使用できるようになるのではないだろうか。
また2021/09/02付で、既に実臨床で頻用されているオンコマインDx Target Test マルチ CDxシステムで、RET融合遺伝子に対してもコンパニオン診断としての使用が追加承認された。
→https://www.thermofisher.com/jp/ja/home/about-us/news-gallery/release/2021/pr090221.html
セルペルカチニブについては、過去に何度か取り上げた。
第III相試験、LIBRETTO-431試験の結果を待って承認されるのかと思っていたが、想定より早かった。
化学療法の副作用に耐えながら承認を待っていたRET陽性肺がん患者の親族として、セルペルカチニブの承認に尽力してくださった全ての方に心から感謝を申し上げたい。
・RET肺がんとSelpercatinib
→http://oitahaiganpractice.junglekouen.com/e982216.html
・RET肺がんに対するSelpercatinibの第III相試験 LIBRETTO-431
→http://oitahaiganpractice.junglekouen.com/e984811.html
・RET融合遺伝子陽性肺がんに対するselpercatinibの第III相試験:LIBRETTO-431試験の概要
→http://oitahaiganpractice.junglekouen.com/e985209.html
・RET陽性肺がんのLIBRETTO-001試験、東アジア人患者でのサブグループ解析
→http://oitahaiganpractice.junglekouen.com/e985296.html
・RET陽性肺がんの臨床的特徴と治療反応性 シンガポール国立がんセンターの報告から
→http://oitahaiganpractice.junglekouen.com/e985297.html
・EGFR耐性機構としてのRET融合遺伝子出現と、オシメルチニブ+selpercatinib併用療法
→http://oitahaiganpractice.junglekouen.com/e985376.html
・LIBRETTO-001試験 前治療の効果は?
→http://oitahaiganpractice.junglekouen.com/e987053.html
2021年09月06日
進行が速い進行肺腺がんに遭遇したらどう振る舞うか
先日に引き続き、webinerで米国識者の症例検討を聴講した。
細かい議論の内容は分からないが、なんとなく同じことでみんな迷うんだなというのはわかった。
変な親近感を感じてしまった。
・31歳、女性
・(多分痩せる目的で)胃のバイパス手術の既往あり
・喫煙歴はほとんどなし:1日20本を1年間(1-pack-year)
・どんどん悪化する咳、息切れ、食欲不振、体重減少を主訴に救急外来を受診した
・胸部レントゲン写真で、右大量胸水を認めた
・CTで、右大量胸水、右肺門部腫瘍、両側肺門・縦隔のリンパ節腫大、肝・骨に無数の転移性腫瘍を認めた
・頭部MRIでは、脳転移の所見はなかった
・胸水穿刺し細胞診へ提出したところ、低分化腺がんと診断された
・免疫染色でCK7+, TTF1+, napsinA+が確認され、原発性肺腺がんと診断された
・PD-L1発現状態を調べたところ、90%陽性だった
・次世代シーケンサーを用いた網羅的ドライバー遺伝子変異解析を行うことにしたが、結果が返ってくるまでに2-3週間を要す
さて、どうするか、とのこと。
PD-L1発現が90%以上なんだから、迷わずペンブロリズマブで、と言ってしまいたいところだが、そうは問屋が卸さない。
パネリストによると、
・なんといっても若くて、ほぼ喫煙歴がなく、しかも臨床経過が激しい
・これだけで、何らかのドライバー遺伝子変異の関与を強く疑う
・何らかの遺伝子変異があり、分子標的薬を使う可能性があるからには、不用意に免疫チェックポイント阻害薬を入れるべきではない
・免疫チェックポイント阻害薬を使用したのちに、何らかのドライバー遺伝子変異が見つかった場合には、却って不利な状況に陥りかねない
・免疫チェックポイント阻害薬使用後に分子標的薬を使うと、薬剤性肺障害のリスクが高い
・待機する余裕があれば、ドライバー遺伝子変異の結果が返ってくるまで薬物療法は控えた方がいい
・待機する余裕がなければ、カルボプラチン+ペメトレキセド併用療法で凌ぎつつ、時を待つのが良い
実際のところ、右胸腔ドレナージを行い、待機していたそう。
果たして予感は的中し、ALK融合遺伝子陽性だった様子。
ここから論点は、ALK阻害薬をどのように使うかに移った。
第一世代:クリゾチニブ
第二世代:セリチニブ、アレクチニブ、ブリガチニブ
第三世代:ロルラチニブ
もはやクリゾチニブを初回治療で選ぶことはなく、第二世代を選ぶか、第三世代を選ぶかが焦点である。
第二世代(セリチニブ以外)、第三世代、それぞれにクリゾチニブを比較対象として、第III相臨床試験で優越性が示されている。
ことにアレクチニブを指示する話題は豊富である。
<アレクチニブ>
・J-ALEX and ALEX
→http://oitahaiganpractice.junglekouen.com/e902483.html
・ALEXと脳転移
→http://oitahaiganpractice.junglekouen.com/e916528.html
・ALEX試験のアジア人サブグループ解析
→http://oitahaiganpractice.junglekouen.com/e916937.html
・ALEX試験、最新の生存解析結果
→http://oitahaiganpractice.junglekouen.com/e976408.html
・J-ALEX試験最終解析・・・ありがちな結論だけどやっぱりすごい。
→http://oitahaiganpractice.junglekouen.com/e989928.html
<ブリガチニブ>
・Brigatinib、進行ALK肺がんの一次治療でクリゾチニブを凌駕 ALTA-1L study
→http://oitahaiganpractice.junglekouen.com/e942885.html
<ロルラチニブ>
・ロルラチニブ、一次治療へ・・・第III相CROWN試験
→http://oitahaiganpractice.junglekouen.com/e979184.html
・改めてCROWN試験
→http://oitahaiganpractice.junglekouen.com/e980198.html
第二世代から入って、耐性化を確認してから第三世代を使うのか。
いきなり最初から第三世代を使うのか。
いろいろ議論された結果、明確な結論は導き出されなかった。
第二世代、第三世代、どれもいい薬じゃん、とのこと。
効果よりも、副作用を判断基準にして、患者の希望を聞きながら選びましょうということになった。
ことに第三世代に関しては、中枢神経系への効果が高いゆえの中枢神経系副作用や脂質異常症が問題となる。
記憶障害やらなんやらは、患者のアイデンティティにも関わる問題なだけに、治療開始前後の治療説明が必須である。
細かい議論の内容は分からないが、なんとなく同じことでみんな迷うんだなというのはわかった。
変な親近感を感じてしまった。
・31歳、女性
・(多分痩せる目的で)胃のバイパス手術の既往あり
・喫煙歴はほとんどなし:1日20本を1年間(1-pack-year)
・どんどん悪化する咳、息切れ、食欲不振、体重減少を主訴に救急外来を受診した
・胸部レントゲン写真で、右大量胸水を認めた
・CTで、右大量胸水、右肺門部腫瘍、両側肺門・縦隔のリンパ節腫大、肝・骨に無数の転移性腫瘍を認めた
・頭部MRIでは、脳転移の所見はなかった
・胸水穿刺し細胞診へ提出したところ、低分化腺がんと診断された
・免疫染色でCK7+, TTF1+, napsinA+が確認され、原発性肺腺がんと診断された
・PD-L1発現状態を調べたところ、90%陽性だった
・次世代シーケンサーを用いた網羅的ドライバー遺伝子変異解析を行うことにしたが、結果が返ってくるまでに2-3週間を要す
さて、どうするか、とのこと。
PD-L1発現が90%以上なんだから、迷わずペンブロリズマブで、と言ってしまいたいところだが、そうは問屋が卸さない。
パネリストによると、
・なんといっても若くて、ほぼ喫煙歴がなく、しかも臨床経過が激しい
・これだけで、何らかのドライバー遺伝子変異の関与を強く疑う
・何らかの遺伝子変異があり、分子標的薬を使う可能性があるからには、不用意に免疫チェックポイント阻害薬を入れるべきではない
・免疫チェックポイント阻害薬を使用したのちに、何らかのドライバー遺伝子変異が見つかった場合には、却って不利な状況に陥りかねない
・免疫チェックポイント阻害薬使用後に分子標的薬を使うと、薬剤性肺障害のリスクが高い
・待機する余裕があれば、ドライバー遺伝子変異の結果が返ってくるまで薬物療法は控えた方がいい
・待機する余裕がなければ、カルボプラチン+ペメトレキセド併用療法で凌ぎつつ、時を待つのが良い
実際のところ、右胸腔ドレナージを行い、待機していたそう。
果たして予感は的中し、ALK融合遺伝子陽性だった様子。
ここから論点は、ALK阻害薬をどのように使うかに移った。
第一世代:クリゾチニブ
第二世代:セリチニブ、アレクチニブ、ブリガチニブ
第三世代:ロルラチニブ
もはやクリゾチニブを初回治療で選ぶことはなく、第二世代を選ぶか、第三世代を選ぶかが焦点である。
第二世代(セリチニブ以外)、第三世代、それぞれにクリゾチニブを比較対象として、第III相臨床試験で優越性が示されている。
ことにアレクチニブを指示する話題は豊富である。
<アレクチニブ>
・J-ALEX and ALEX
→http://oitahaiganpractice.junglekouen.com/e902483.html
・ALEXと脳転移
→http://oitahaiganpractice.junglekouen.com/e916528.html
・ALEX試験のアジア人サブグループ解析
→http://oitahaiganpractice.junglekouen.com/e916937.html
・ALEX試験、最新の生存解析結果
→http://oitahaiganpractice.junglekouen.com/e976408.html
・J-ALEX試験最終解析・・・ありがちな結論だけどやっぱりすごい。
→http://oitahaiganpractice.junglekouen.com/e989928.html
<ブリガチニブ>
・Brigatinib、進行ALK肺がんの一次治療でクリゾチニブを凌駕 ALTA-1L study
→http://oitahaiganpractice.junglekouen.com/e942885.html
<ロルラチニブ>
・ロルラチニブ、一次治療へ・・・第III相CROWN試験
→http://oitahaiganpractice.junglekouen.com/e979184.html
・改めてCROWN試験
→http://oitahaiganpractice.junglekouen.com/e980198.html
第二世代から入って、耐性化を確認してから第三世代を使うのか。
いきなり最初から第三世代を使うのか。
いろいろ議論された結果、明確な結論は導き出されなかった。
第二世代、第三世代、どれもいい薬じゃん、とのこと。
効果よりも、副作用を判断基準にして、患者の希望を聞きながら選びましょうということになった。
ことに第三世代に関しては、中枢神経系への効果が高いゆえの中枢神経系副作用や脂質異常症が問題となる。
記憶障害やらなんやらは、患者のアイデンティティにも関わる問題なだけに、治療開始前後の治療説明が必須である。




