2020年06月30日
ALEX試験、最新の生存解析結果
もはや、ALK陽性肺がん初回治療の不動の第一選択と言っていいアレクチニブ。
このことを決定づけた第III相臨床試験、標準投与量が我が国と他国で異なることから、我が国ではJ-ALEX試験として、他国ではALEX試験として施行された。
今回は、ALEX試験における生存解析の最新報告。
アレクチニブ群で、追跡期間中央値が4年を超えてもまだ生存期間中央値未到達で、5年生存割合が62.5%というのは、とても立派なことだ。
本当に、ドライバー遺伝子変異があるかないかで、患者の運命が大きく変わってしまう。
EGFR遺伝子変異の有無がゲフィチニブの有効性を左右することが明らかとなったのが2004年の話だが、それから16年経過して、治療対象となるドライバー遺伝子変異の種類が増えるとともに、個々の遺伝子変異に対する治療の進歩も目覚ましい。
それだけに、診断プロセスに見落としや怠慢があってはならないし、分子標的薬の対象である患者に対して適切な説明もなくそれ以外の治療を行うことは、厳に慎まなければならない。
そして、もはや5年生存ではなく、その先を見据えた治療開発が必要になったと言ってよいだろう。
Updated overall survival (OS) and safety data from the randomized, phase III ALEX study of alectinib (ALC) versus crizotinib (CRZ) in untreated advanced ALK+ NSCLC.
Peters et al., ASCO2020 abst.#9518
背景:
ALK融合遺伝子陽性の未治療進行非小細胞肺がんを対象に、アレクチニブとクリゾチニブの有効性を比較した第III相ALEX試験について、無増悪生存期間の最終結果は既に報告されている。すなわち、アレクチニブ群で34.8ヶ月(95%信頼区間は17.7ヶ月から未到達)、クリゾチニブ群で10.9ヶ月(95%信頼区間は9.1-12.9ヶ月)、ハザード比0.43(95%信頼区間は0.32-0.58)だった。今回は、前回の同様の報告から12ヶ月の追跡調査を行い、2019年11月29日カットオフ時点での5年生存割合最新データについて報告する。
方法:
免疫染色による中央判定でALK融合遺伝子陽性を確認した臨床病期IIIB / IV期の非小細胞肺がん患者で、ECOG-PSは0-2、過去に全身薬物療法の治療歴のない患者を対象に、アレクチニブ群(アレクチニブ600mg/日、152人)とクリゾチニブ群(クリゾチニブ250mg/日、151人)に1:1の割合で割り付けた。治療開始前の段階で、無症候性の脳転移を有する患者は参加可能とした。全生存期間は副次評価項目で、本試験の有効性判定にはもともと寄与しない臨床試験デザインとなっていた。
結果:
追跡期間中央値は、アレクチニブ群で48.2ヶ月、クリゾチニブ群で23.2ヶ月だった。全生存期間に関するデータは今だ不十分で(死亡イベントの発生割合は37%、ハザード比は0.67(95%信頼区間は0.46-0.98)、アレクチニブ群の生存期間中央値は未到達、クリゾチニブ群の生存期間中央値は57.4ヶ月(95%信頼区間は34.6-未到達)だった。アレクチニブ群の5年生存割合は62.5%(95%信頼区間は54.3%-70.8%)、クリゾチニブ群の5年生存割合は45.5%(95%信頼区間は33.6-57.4%)だった。治療開始前に脳転移があった患者に限ればハザード比は0.58(95%信頼区間は0.34-1.00)、脳転移がなかった患者に限ればハザード比は0.76(95%信頼区間は0.45-1.26)だった。サブグループ解析を行っても、生存期間に関するアレクチニブ群の優位性は一貫していた。今回の追跡調査において、毒性に関する新たな知見は得られなかった。アレクチニブ群の35%、クリゾチニブ群の9%は未だにプロトコール治療を継続していた。プロトコール治療終了後、1レジメン以上の後治療を行った患者において(アレクチニブ群の32.2%、クリゾチニブ群の45.7%)、アレクチニブ群で最も多く用いられたALK阻害薬はロルラチニブであり(7.2%)、クリゾチニブ群で最も多く用いられたLAK阻害薬はセリチニブだった(15.2%)
・ALEX試験 概略

・ALEX試験 生存曲線

・J-ALEX and ALEX
http://oitahaiganpractice.junglekouen.com/e902483.html
・ALEX試験のアジア人サブグループ解析
http://oitahaiganpractice.junglekouen.com/e916937.html
このことを決定づけた第III相臨床試験、標準投与量が我が国と他国で異なることから、我が国ではJ-ALEX試験として、他国ではALEX試験として施行された。
今回は、ALEX試験における生存解析の最新報告。
アレクチニブ群で、追跡期間中央値が4年を超えてもまだ生存期間中央値未到達で、5年生存割合が62.5%というのは、とても立派なことだ。
本当に、ドライバー遺伝子変異があるかないかで、患者の運命が大きく変わってしまう。
EGFR遺伝子変異の有無がゲフィチニブの有効性を左右することが明らかとなったのが2004年の話だが、それから16年経過して、治療対象となるドライバー遺伝子変異の種類が増えるとともに、個々の遺伝子変異に対する治療の進歩も目覚ましい。
それだけに、診断プロセスに見落としや怠慢があってはならないし、分子標的薬の対象である患者に対して適切な説明もなくそれ以外の治療を行うことは、厳に慎まなければならない。
そして、もはや5年生存ではなく、その先を見据えた治療開発が必要になったと言ってよいだろう。
Updated overall survival (OS) and safety data from the randomized, phase III ALEX study of alectinib (ALC) versus crizotinib (CRZ) in untreated advanced ALK+ NSCLC.
Peters et al., ASCO2020 abst.#9518
背景:
ALK融合遺伝子陽性の未治療進行非小細胞肺がんを対象に、アレクチニブとクリゾチニブの有効性を比較した第III相ALEX試験について、無増悪生存期間の最終結果は既に報告されている。すなわち、アレクチニブ群で34.8ヶ月(95%信頼区間は17.7ヶ月から未到達)、クリゾチニブ群で10.9ヶ月(95%信頼区間は9.1-12.9ヶ月)、ハザード比0.43(95%信頼区間は0.32-0.58)だった。今回は、前回の同様の報告から12ヶ月の追跡調査を行い、2019年11月29日カットオフ時点での5年生存割合最新データについて報告する。
方法:
免疫染色による中央判定でALK融合遺伝子陽性を確認した臨床病期IIIB / IV期の非小細胞肺がん患者で、ECOG-PSは0-2、過去に全身薬物療法の治療歴のない患者を対象に、アレクチニブ群(アレクチニブ600mg/日、152人)とクリゾチニブ群(クリゾチニブ250mg/日、151人)に1:1の割合で割り付けた。治療開始前の段階で、無症候性の脳転移を有する患者は参加可能とした。全生存期間は副次評価項目で、本試験の有効性判定にはもともと寄与しない臨床試験デザインとなっていた。
結果:
追跡期間中央値は、アレクチニブ群で48.2ヶ月、クリゾチニブ群で23.2ヶ月だった。全生存期間に関するデータは今だ不十分で(死亡イベントの発生割合は37%、ハザード比は0.67(95%信頼区間は0.46-0.98)、アレクチニブ群の生存期間中央値は未到達、クリゾチニブ群の生存期間中央値は57.4ヶ月(95%信頼区間は34.6-未到達)だった。アレクチニブ群の5年生存割合は62.5%(95%信頼区間は54.3%-70.8%)、クリゾチニブ群の5年生存割合は45.5%(95%信頼区間は33.6-57.4%)だった。治療開始前に脳転移があった患者に限ればハザード比は0.58(95%信頼区間は0.34-1.00)、脳転移がなかった患者に限ればハザード比は0.76(95%信頼区間は0.45-1.26)だった。サブグループ解析を行っても、生存期間に関するアレクチニブ群の優位性は一貫していた。今回の追跡調査において、毒性に関する新たな知見は得られなかった。アレクチニブ群の35%、クリゾチニブ群の9%は未だにプロトコール治療を継続していた。プロトコール治療終了後、1レジメン以上の後治療を行った患者において(アレクチニブ群の32.2%、クリゾチニブ群の45.7%)、アレクチニブ群で最も多く用いられたALK阻害薬はロルラチニブであり(7.2%)、クリゾチニブ群で最も多く用いられたLAK阻害薬はセリチニブだった(15.2%)
・ALEX試験 概略

・ALEX試験 生存曲線

・J-ALEX and ALEX
http://oitahaiganpractice.junglekouen.com/e902483.html
・ALEX試験のアジア人サブグループ解析
http://oitahaiganpractice.junglekouen.com/e916937.html
2020年06月29日
オシメルチニブ+ABBV-399
EGFR遺伝子変異陽性の進行非小細胞肺がんの患者さんで、オシメルチニブに耐性化した後、どうするか。
普通に考えれば化学療法への移行というところだろう。
臨床試験では、オシメルチニブ+αの治療がいろいろと試されている。
オシメルチニブと、c-MET抗体-抗腫瘍薬複合体のTeliso-V(ABBV-399)の併用に関する臨床試験が国内でも進行中とのこと。
Teliso-V単剤療法に関する第I相臨床試験の報告があったので、要約に目を通してみた。
果たして、オシメルチニブとの併用で相乗効果が得られるのかどうか。
First-in-Human Phase I, Dose-Escalation and -Expansion Study of Telisotuzumab Vedotin, an Antibody-Drug Conjugate Targeting c-Met, in Patients With Advanced Solid Tumors
John H Strickler, et al, J Clin Oncol 2018
目的:
今回の第I相臨床試験(first-in human study, 試験薬を世界で初めてヒトに投与する試験)では、抗c-Metモノクローナル抗体ABT-700と抗腫瘍薬monomethyl auristatin Eの複合体であるtelisotuzumab vedotin(Teliso-V、以前はABBV-399と呼ばれていた)について評価した。
方法:
用量漸増相では、3-6人の進行固形癌の患者を8つのコホートに振り分けた(Teliso-Vを0.15mg/kg投与するコホートから、3.3mg/kg投与するコホートまで)。続いて、用量拡大相では、c-Metを過剰発現している(免疫染色で細胞膜が染色されるH-scoreが150以上であるもの)非小細胞肺がん患者を組み入れた。対象患者は、Teliso-V単剤療法を3週間ごとに受けた。安全性、忍容性、薬物動態、最大耐用量を決定した。
結果:
48人の患者が登録された(年齢中央値は65歳、全体の35.4%が非小細胞肺がん患者、前治療レジメン数の中央値は4レジメン)。3.0mg/kgコホート(9人)、3.3mg/kgコホート(3人)において、それぞれ1人ずつが用量制限毒性を来した。最大耐用量の同定には至らなかったが、全体の安全性と忍容性のデータから、第II相試験での推奨用量は2.7mg/kgとした。治療関連毒性で頻度が高かったものは、疲労(42%)、嘔気(27%)、便秘(27%)、食欲不振(23%)、嘔吐(21%)、呼吸困難(21%)、下痢(19%)、末梢浮腫(19%)、末梢神経障害(17%)だった。Grade 3以上の毒性で頻度が高かったものは、疲労、貧血、好中球減少症、低アルブミン血症で、いずれも4%ずつの発現率だった。Teliso-Vと抗体量の血中濃度は、概ね投与量に比例しており、平均半減期は2-4日間だった。前向きスクリーニングを行ったところ、58人の非小細胞肺がん患者中で35人(60%)がc-Met陽性だった。c-Met陽性の非小細胞肺がん患者で、Teliso-Vの投与量が2.4-3.0mg/kgだった患者を対象に調べたところ、3人(18.8%、95%信頼区間は3.1-45.7%)で部分奏効を認め(奏効持続期間中央値は4.8ヶ月)、無増悪生存期間中央値は5.7ヶ月(95%信頼区間は1.2-15.4ヶ月)だった。その他の患者では、腫瘍縮小効果は得られなかった。
結論:
Teliso-V単剤療法は良好な安全性・忍容性プロファイルを示し、c-MET陽性の非小細胞肺がん患者において有望な抗腫瘍活性を示した。
普通に考えれば化学療法への移行というところだろう。
臨床試験では、オシメルチニブ+αの治療がいろいろと試されている。
オシメルチニブと、c-MET抗体-抗腫瘍薬複合体のTeliso-V(ABBV-399)の併用に関する臨床試験が国内でも進行中とのこと。
Teliso-V単剤療法に関する第I相臨床試験の報告があったので、要約に目を通してみた。
果たして、オシメルチニブとの併用で相乗効果が得られるのかどうか。
First-in-Human Phase I, Dose-Escalation and -Expansion Study of Telisotuzumab Vedotin, an Antibody-Drug Conjugate Targeting c-Met, in Patients With Advanced Solid Tumors
John H Strickler, et al, J Clin Oncol 2018
目的:
今回の第I相臨床試験(first-in human study, 試験薬を世界で初めてヒトに投与する試験)では、抗c-Metモノクローナル抗体ABT-700と抗腫瘍薬monomethyl auristatin Eの複合体であるtelisotuzumab vedotin(Teliso-V、以前はABBV-399と呼ばれていた)について評価した。
方法:
用量漸増相では、3-6人の進行固形癌の患者を8つのコホートに振り分けた(Teliso-Vを0.15mg/kg投与するコホートから、3.3mg/kg投与するコホートまで)。続いて、用量拡大相では、c-Metを過剰発現している(免疫染色で細胞膜が染色されるH-scoreが150以上であるもの)非小細胞肺がん患者を組み入れた。対象患者は、Teliso-V単剤療法を3週間ごとに受けた。安全性、忍容性、薬物動態、最大耐用量を決定した。
結果:
48人の患者が登録された(年齢中央値は65歳、全体の35.4%が非小細胞肺がん患者、前治療レジメン数の中央値は4レジメン)。3.0mg/kgコホート(9人)、3.3mg/kgコホート(3人)において、それぞれ1人ずつが用量制限毒性を来した。最大耐用量の同定には至らなかったが、全体の安全性と忍容性のデータから、第II相試験での推奨用量は2.7mg/kgとした。治療関連毒性で頻度が高かったものは、疲労(42%)、嘔気(27%)、便秘(27%)、食欲不振(23%)、嘔吐(21%)、呼吸困難(21%)、下痢(19%)、末梢浮腫(19%)、末梢神経障害(17%)だった。Grade 3以上の毒性で頻度が高かったものは、疲労、貧血、好中球減少症、低アルブミン血症で、いずれも4%ずつの発現率だった。Teliso-Vと抗体量の血中濃度は、概ね投与量に比例しており、平均半減期は2-4日間だった。前向きスクリーニングを行ったところ、58人の非小細胞肺がん患者中で35人(60%)がc-Met陽性だった。c-Met陽性の非小細胞肺がん患者で、Teliso-Vの投与量が2.4-3.0mg/kgだった患者を対象に調べたところ、3人(18.8%、95%信頼区間は3.1-45.7%)で部分奏効を認め(奏効持続期間中央値は4.8ヶ月)、無増悪生存期間中央値は5.7ヶ月(95%信頼区間は1.2-15.4ヶ月)だった。その他の患者では、腫瘍縮小効果は得られなかった。
結論:
Teliso-V単剤療法は良好な安全性・忍容性プロファイルを示し、c-MET陽性の非小細胞肺がん患者において有望な抗腫瘍活性を示した。
2020年06月25日
ドライバー遺伝子変異検査に関する要望書
MET、NTRK遺伝子変異を検出するにあたって、保険診療上の歪みを指摘した要望書が、日本肺癌学会と日本肺がん患者連絡会から厚生労働省に宛てて提出されたとのこと。
もっともな話。
エキスパートパネルにかける必要すらないように感じる。
EGFR、ALK、ROS1が検出されたときに、初回治療前にエキスパートパネルにかけようなんて、誰も考えない。
MET、NTRKについても、同じように考えるのが人情だ。
オンコマインをコンパニオン診断として認めればもっとスッキリするんだろうけど。
https://www.haigan.gr.jp/uploads/files/要望書%E3%80%80MET.NTRK.pdf
もっともな話。
エキスパートパネルにかける必要すらないように感じる。
EGFR、ALK、ROS1が検出されたときに、初回治療前にエキスパートパネルにかけようなんて、誰も考えない。
MET、NTRKについても、同じように考えるのが人情だ。
オンコマインをコンパニオン診断として認めればもっとスッキリするんだろうけど。
https://www.haigan.gr.jp/uploads/files/要望書%E3%80%80MET.NTRK.pdf
2020年06月23日
わかりやすい字を書きましょう。
中学3年生の時の恩師、大野先生の教えで、今でも肝に銘じていることがある。
「美しい字を書く必要はないが、誰にでもわかる字を書きなさい」
私は幼稚園から高校まで書道を習ったが、書道で習ったことよりも、たったの一文で表された大野先生の教えの方をむしろ大切にしている。
文字の第一義は、自分の考えを相手に伝えることである。
芸術性をどんなに高めようとも、文字は文字であり、絵画ではない。
意思を伝えることが出来なければ、文字に文字としての意義はないと思う。
なんでこんなことを言うのかというと、電子カルテ全盛、リモート診療ことはじめの現代にあっても、わかりやすい字を肉筆で書くことは変わらぬ意義を持つと考えるからだ。
内容が読み取れない、作成者の名前すら読めない病状説明文書や診療情報提供書など、何の意味も持たない。
電子カルテ以前に、ワードプロセッサー(もはや死語か)で文書を作成する、という行為は、医療界に大きな変革とリスク低減効果をもたらしたはずである。
それでも、ときにはあえて肉筆で文書を作成しなければならないことはある。
そして、要点をおさえたスケッチは、ときに千万の文字よりも雄弁に患者・家族に訴えかける。
医療を志す人には、疑いなく絵心が必要だが、この件はまた別の機会に。
「美しい字を書く必要はないが、誰にでもわかる字を書きなさい」
私は幼稚園から高校まで書道を習ったが、書道で習ったことよりも、たったの一文で表された大野先生の教えの方をむしろ大切にしている。
文字の第一義は、自分の考えを相手に伝えることである。
芸術性をどんなに高めようとも、文字は文字であり、絵画ではない。
意思を伝えることが出来なければ、文字に文字としての意義はないと思う。
なんでこんなことを言うのかというと、電子カルテ全盛、リモート診療ことはじめの現代にあっても、わかりやすい字を肉筆で書くことは変わらぬ意義を持つと考えるからだ。
内容が読み取れない、作成者の名前すら読めない病状説明文書や診療情報提供書など、何の意味も持たない。
電子カルテ以前に、ワードプロセッサー(もはや死語か)で文書を作成する、という行為は、医療界に大きな変革とリスク低減効果をもたらしたはずである。
それでも、ときにはあえて肉筆で文書を作成しなければならないことはある。
そして、要点をおさえたスケッチは、ときに千万の文字よりも雄弁に患者・家族に訴えかける。
医療を志す人には、疑いなく絵心が必要だが、この件はまた別の機会に。
2020年06月19日
ドライバー変異林立時代の診断の在り方を真剣に考える
肺がん領域におけるドライバー遺伝子変異検索の対象が本格的に広がってきた。
薬物療法効果予測因子として広義に捉えれば、現時点で以下のバイオマーカーが(近い将来のものも含めて)対象となる。
・EGFR遺伝子変異(エクソン19欠失、エクソン21-L858R、エクソン20-T790M、エクソン20挿入、その他のuncommon mutation)
・ALK融合遺伝子
・ROS1融合遺伝子
・BRAF遺伝子変異
・NTRK融合遺伝子
・METエクソン14スキップ変異 / 増幅
・RET融合遺伝子
・KRAS遺伝子変異
・HER2遺伝子変異 / 増幅
・PD-L1発現
・マイクロサテライト不安定性(MSI)
加えて、標準治療終了後は次世代シーケンサーによるがんゲノムプロファイリングが控えている。
・Foundation One
・Oncoguide-NCC Oncopanel
こんな風に雑多に並べると、
「どれが役に立つかわからないんだから、出せるだけ検査に出せばいいじゃん」
という声が聞こえてきそうだ。
話はそう単純ではない。
気管支鏡や針生検で採取されるわずかな検体を、これら全ての検査に供するというのは、言ってみれば一粒の麦チョコを20人で分け合うようなものだ。
満足できるわけがない。
検査検体採取から治療選択までのプロセスを考えてみても、複雑極まりない。
・採取法6通り(血液検体、液性検体、気管支鏡鉗子生検、気管支鏡リンパ節針生検、CTガイド下針生検、外科的肺生検)
・臨床検査法4通り(PCR、免疫染色、FISH、遺伝子シーケンシング)
・治療選択肢多数(EGFR阻害薬5種、ALK阻害薬4種、ROS1阻害薬2種、BRAF阻害薬1種、NTRK阻害薬1種、PD-1 / PD-L1阻害薬4種、MSI-High対象薬1種)
順列組み合わせをすると、途方もない数になる。
しかも、この薬はこの検査法で陽性となったときにしか使えない(コンパニオン診断)といった条件まで付いているため、更に複雑になる。
コンパニオン診断については、いったん現場に落とし込まれたら、何となくうやむやになる気がする。
EGFR遺伝子変異、ALK融合遺伝子、PD-L1陽性率について、検査会社ごとの個別の手法にうるさく言及する手合いは、もはや少数派だろう。
一番の問題は、検査に耐える検査検体採取を、いかにして行うかだ。
前提条件として、
・まとまった量の検体がとれるのは、外科的肺生検>局麻下での転移巣生検>針生検>気管支鏡下鉗子生検>液性検体>血液検体
・血液検体へのct-DNAの含有量が多いのは、転移巣多数の進行期>転移巣少数の進行期>局所進行期>早期
・ct-DNAによるドライバー遺伝子変異の検出は、見つかったらめっけもん、くらいの捉え方がちょうどいい
・若くて、タバコを吸わなくて、肺への物理化学的刺激を受けた経験が少ない人のがんは、ドライバー遺伝子変異依存の可能性大
・年を取っていて、タバコを吸った経験があり、肺への物理化学的刺激が多かった人のがんは、多段階発がんで多様な遺伝子異常とが蓄積しており、がん特異抗原が蓄積している
・複数の遺伝子異常を効率よく調べるには、十分な生検組織量を求められる(普通の気管支鏡鉗子生検では不足)
・ドライバー遺伝子変異陽性の進行期肺がんなら、分子標的薬、化学療法を過不足なく行うことで、長い無増悪生存期間、全生存期間が得られるが、治癒は望みがたい
・PD-L1発現陽性の進行期肺がんなら、免疫チェックポイント阻害薬を使用すると、一部の患者は極めて長期に生存し、治癒に近い状態になる
これらから導き出されるのは、
・外科的肺生検、局麻下転移巣生検では、必要十分な組織を採取し、治療に結び付くバイオマーカーはできるだけたくさん検索する
・進行期であることが明らかなら、針生検、気管支鏡生検時には、できるだけ通常鉗子を用いて大きな組織を採取するように心がける
・ctDNA検索でドライバー遺伝子異常が確認されたら、生検標本を用いての追加検索はしない
・進行期であっても、バイオマーカー検索のために必要ならば、できる限り外科的肺生検やリンパ節生検を行う
・ドライバー遺伝子変異検索に適した検体がとれているかどうか、病理医から報告書へ簡単なコメントを付してもらう
といった対策である。
気管支鏡生検時にガイドシースや超音波プローブを使うにしても、せめて1-2検体くらいは通常鉗子で大きめの組織を採取するように心がけたい。
治療効果予測因子が多数知られているだけに、見落としを減らして進行期肺がん患者の長期生存につなげようと思ったら、たとえ進行期の患者と言えども、これまでより積極的に外科的生検を勧めるべきかもしれない。
薬物療法効果予測因子として広義に捉えれば、現時点で以下のバイオマーカーが(近い将来のものも含めて)対象となる。
・EGFR遺伝子変異(エクソン19欠失、エクソン21-L858R、エクソン20-T790M、エクソン20挿入、その他のuncommon mutation)
・ALK融合遺伝子
・ROS1融合遺伝子
・BRAF遺伝子変異
・NTRK融合遺伝子
・METエクソン14スキップ変異 / 増幅
・RET融合遺伝子
・KRAS遺伝子変異
・HER2遺伝子変異 / 増幅
・PD-L1発現
・マイクロサテライト不安定性(MSI)
加えて、標準治療終了後は次世代シーケンサーによるがんゲノムプロファイリングが控えている。
・Foundation One
・Oncoguide-NCC Oncopanel
こんな風に雑多に並べると、
「どれが役に立つかわからないんだから、出せるだけ検査に出せばいいじゃん」
という声が聞こえてきそうだ。
話はそう単純ではない。
気管支鏡や針生検で採取されるわずかな検体を、これら全ての検査に供するというのは、言ってみれば一粒の麦チョコを20人で分け合うようなものだ。
満足できるわけがない。
検査検体採取から治療選択までのプロセスを考えてみても、複雑極まりない。
・採取法6通り(血液検体、液性検体、気管支鏡鉗子生検、気管支鏡リンパ節針生検、CTガイド下針生検、外科的肺生検)
・臨床検査法4通り(PCR、免疫染色、FISH、遺伝子シーケンシング)
・治療選択肢多数(EGFR阻害薬5種、ALK阻害薬4種、ROS1阻害薬2種、BRAF阻害薬1種、NTRK阻害薬1種、PD-1 / PD-L1阻害薬4種、MSI-High対象薬1種)
順列組み合わせをすると、途方もない数になる。
しかも、この薬はこの検査法で陽性となったときにしか使えない(コンパニオン診断)といった条件まで付いているため、更に複雑になる。
コンパニオン診断については、いったん現場に落とし込まれたら、何となくうやむやになる気がする。
EGFR遺伝子変異、ALK融合遺伝子、PD-L1陽性率について、検査会社ごとの個別の手法にうるさく言及する手合いは、もはや少数派だろう。
一番の問題は、検査に耐える検査検体採取を、いかにして行うかだ。
前提条件として、
・まとまった量の検体がとれるのは、外科的肺生検>局麻下での転移巣生検>針生検>気管支鏡下鉗子生検>液性検体>血液検体
・血液検体へのct-DNAの含有量が多いのは、転移巣多数の進行期>転移巣少数の進行期>局所進行期>早期
・ct-DNAによるドライバー遺伝子変異の検出は、見つかったらめっけもん、くらいの捉え方がちょうどいい
・若くて、タバコを吸わなくて、肺への物理化学的刺激を受けた経験が少ない人のがんは、ドライバー遺伝子変異依存の可能性大
・年を取っていて、タバコを吸った経験があり、肺への物理化学的刺激が多かった人のがんは、多段階発がんで多様な遺伝子異常とが蓄積しており、がん特異抗原が蓄積している
・複数の遺伝子異常を効率よく調べるには、十分な生検組織量を求められる(普通の気管支鏡鉗子生検では不足)
・ドライバー遺伝子変異陽性の進行期肺がんなら、分子標的薬、化学療法を過不足なく行うことで、長い無増悪生存期間、全生存期間が得られるが、治癒は望みがたい
・PD-L1発現陽性の進行期肺がんなら、免疫チェックポイント阻害薬を使用すると、一部の患者は極めて長期に生存し、治癒に近い状態になる
これらから導き出されるのは、
・外科的肺生検、局麻下転移巣生検では、必要十分な組織を採取し、治療に結び付くバイオマーカーはできるだけたくさん検索する
・進行期であることが明らかなら、針生検、気管支鏡生検時には、できるだけ通常鉗子を用いて大きな組織を採取するように心がける
・ctDNA検索でドライバー遺伝子異常が確認されたら、生検標本を用いての追加検索はしない
・進行期であっても、バイオマーカー検索のために必要ならば、できる限り外科的肺生検やリンパ節生検を行う
・ドライバー遺伝子変異検索に適した検体がとれているかどうか、病理医から報告書へ簡単なコメントを付してもらう
といった対策である。
気管支鏡生検時にガイドシースや超音波プローブを使うにしても、せめて1-2検体くらいは通常鉗子で大きめの組織を採取するように心がけたい。
治療効果予測因子が多数知られているだけに、見落としを減らして進行期肺がん患者の長期生存につなげようと思ったら、たとえ進行期の患者と言えども、これまでより積極的に外科的生検を勧めるべきかもしれない。
2020年06月18日
テクノロジーの進歩とともに失われていくもの
テクノロジーの進歩とともに、失われていくものがある。
新型コロナウイルスとともにリモートコミュニケーションが普及し、face to face交流の一部は確実に失われるだろう。
そのほかに、最近失われたなあと感じるものを挙げる。
・LEDの普及とともに、白熱電球の温かみが失われた
・エアコンの普及とともに、石油ストーブの上で焼くバターロールのおいしさが失われた
・携帯電話の普及とともに、ポケットベルの心地よい不自由さが失われた
・オートマチックトランスミッションの普及とともに、マニュアルトランスミッションの楽しさが失われた
・電子カルテの普及とともに、難読達筆文字で解読不能な医者の診療記録が失われた
・画像診断システムの普及とともに、シャーカステンとレントゲンフィルムが失われた
・電子スコープの普及とともに、気管支ファイバースコープが失われた
・CTの普及とともに、レントゲン断層撮影の技術が失われた
・プラスチック製の聴診器ダイアフラムの普及とともに、アルミニウムダイキャスト製の聴診器ダイアフラムが失われた
・輸液プラネクタシステムの普及とともに、J-ループやインターリンクシステム、三方活栓が失われた
・気管支鏡ガイドシース法の普及とともに、通常気管支鏡生検技術が失われた
・電子メールの普及とともに、味のある手書きの手紙のやり取りが失われた
・治療技術全般と商業化の進歩とともに、医療経済的なモラルが失われた
・経鼻経管栄養や胃瘻栄養の普及により、尊厳ある人の死が失われた
・温泉エネルギー発電の普及とともに、自噴する別府温泉の一部が失われた
新型コロナウイルスとともにリモートコミュニケーションが普及し、face to face交流の一部は確実に失われるだろう。
そのほかに、最近失われたなあと感じるものを挙げる。
・LEDの普及とともに、白熱電球の温かみが失われた
・エアコンの普及とともに、石油ストーブの上で焼くバターロールのおいしさが失われた
・携帯電話の普及とともに、ポケットベルの心地よい不自由さが失われた
・オートマチックトランスミッションの普及とともに、マニュアルトランスミッションの楽しさが失われた
・電子カルテの普及とともに、難読達筆文字で解読不能な医者の診療記録が失われた
・画像診断システムの普及とともに、シャーカステンとレントゲンフィルムが失われた
・電子スコープの普及とともに、気管支ファイバースコープが失われた
・CTの普及とともに、レントゲン断層撮影の技術が失われた
・プラスチック製の聴診器ダイアフラムの普及とともに、アルミニウムダイキャスト製の聴診器ダイアフラムが失われた
・輸液プラネクタシステムの普及とともに、J-ループやインターリンクシステム、三方活栓が失われた
・気管支鏡ガイドシース法の普及とともに、通常気管支鏡生検技術が失われた
・電子メールの普及とともに、味のある手書きの手紙のやり取りが失われた
・治療技術全般と商業化の進歩とともに、医療経済的なモラルが失われた
・経鼻経管栄養や胃瘻栄養の普及により、尊厳ある人の死が失われた
・温泉エネルギー発電の普及とともに、自噴する別府温泉の一部が失われた
2020年06月17日
ADAURA試験
ADAURA試験については、以前取り上げた。
http://oitahaiganpractice.junglekouen.com/e973395.html
無病生存期間の生存曲線を見ると、目を瞠る。
ハザード比0.17・・・。
そうそうお目にかかれない数字である。
本試験は、術後補助化学療法の標準治療であるプラチナ併用化学療法とオシメルチニブを比較したものではない。
EGFR遺伝子変異陽性の完全切除後非扁平上皮非小細胞肺がん患者を対象とし、適応のある患者には標準治療である術後補助化学療法を行い(詳しい治療レジメンの記載はないが)、その後にオシメルチニブを上乗せする意義があるかどうかを、プラセボ対照で検証した試験である。
実地臨床において、術後補助化学療法の適応はあるものの、年齢、背景疾患、患者の希望等々の理由で術後補助化学療法がおこなわれない患者は相当数いるため、こうした試験デザインでも一定の意義がある。
治療的にも医療経済的にも"toxic new"な治療だったわけだが、少なくともプラチナ併用術後補助化学療法の対象となるII期、IIIA期の患者に対しては、圧倒的な無病生存期間の延長効果を示している。
それも、「予定していなかった中間解析の結果を受けて、独立データモニタリング委員会が早期の非盲検化を勧告した」というほどの出来事であり、余程のことである。
多分、EGFRチロシンキナーゼ阻害薬関連試験の常で、全生存期間の延長は達成できないだろう。
それも、おそらくはオシメルチニブを術後補助療法として加えることにより再発を先延ばしにする効果が得られているだけで、オシメルチニブ群のプラセボ群の累積再発患者数は、おそらく有意差は出ないだろう。
そして、治癒を目指すべき患者を対象とした臨床試験で、全生存期間の延長が得られないときに、その治療に臨床的な意義があるのか、という議論が沸き起こるだろう。
しかし、再発なく過ごせる期間が圧倒的に長くなる、というのは、当然大きなアドバンテージだ。
また、本試験は、IB期とII / III期への対応を、明確に区別すべき世界的なきっかけになるかも知れない。
所属リンパ節転移を伴わないIB期と、伴う(ということは、既にリンパ路にのった腫瘍細胞が広い範囲に広がっている)II / III期では、おのずと異なる対応が必要となるだろう。
IB期に対する我が国の標準術後補助化学療法はUFT内服2年間だが、果たしてオシメルチニブは、この成績を凌駕できるだろうか。
http://oitahaiganpractice.junglekouen.com/e968113.html
また、II-IIIA期の患者で、術後補助化学療法が行われた患者と行われなかった患者で、無病生存期間や全生存期間に差が出るかどうかも見てみたいところである。
Osimertinib as adjuvant therapy in patients with stage IB-IIIA EGFR mutation positive NSCLC after complete tumor resection
Roy Herbst et al.
ASCO 2020 abst. #LBA5
背景:
オシメルチニブは第3世代の、中枢神経病変への活性を有するEGFRチロシンキナーゼ阻害薬で、EGFR遺伝子変異陽性の未治療進行非小細胞肺がんに対する治療において、ゲフィチニブやエルロチニブよりも効果が高いことが示されている。非小細胞肺がん患者の約30%はI-IIIA期の早期段階で診断され、この場合は外科手術が第一選択の治療である。II-III期、およびIB期の一部の患者では、切除後に術後補助化学療法を行うことが標準治療とされているが、いまだ術後再発率は高く、他の治療の必要性が叫ばれてきた。ADAURA試験は、完全切除後で、必要に応じて術後補助化学療法がおこなわれたIB-IIIA期のEGFR遺伝子変異陽性非小細胞肺がん患者を対象として、プラセボに対するオシメルチニブの有効性と安全性を評価することを目的とした第III相二重盲検ランダム化比較試験である。独立したデータモニタリング委員会の勧告に従い、本試験は有効性データをもとに早期の非盲検化を行うこととなった。そのため、今回は予定していなかった中間解析結果について報告する。
方法:
適格患者の条件は以下の通り。
・18歳以上(日本と台湾では20歳以上)
・WHO PS 0もしくは1
・IB, II, IIIA期の原発性非扁平上皮非小細胞肺がん
・EGFR遺伝子変異(エクソン19欠失変異 / エクソン21L858R点突然変異)が確認されている
・原発性非小細胞肺がん完全切除後で、術後状態から回復している
術後(補助)化学療法は許容された。対象患者はオシメルチニブ群(オシメルチニブ80mg/回を1日1回服用)とプラセボ群に1:1の割合で無作為に割り付けられ、3年間を上限としてプロトコール治療を受けた。病期(IB期 / II期 / IIIA期)、EGFR遺伝子変異のタイプ(エクソン19 / エクソン21)、人種(アジア人 / 非アジア人)を割り付け調整因子とした。主要評価項目はII-IIIA期の患者の無病生存期間とし、副次評価項目は全生存期間と安全性とした。データカットオフは2020年1月17日に設定された。
結果:
全体で、682人の患者が無作為割り付けされた。オシメルチニブ群は339人、プラセボ群は343人だった。背景因子は両群でバランスが取れていた。IB期患者はそれぞれ31%、II / IIIA期患者はそれぞれ69%、女性は68% / 72%、エクソン19変異は55% / 56%、エクソン21変異は45% / 44%だった。II-IIIA期の患者の無病生存期間に関するハザード比は0.17(95%信頼区間は0.12-0.23)で、p<0.0001(156 / 470イベント)と、オシメルチニブ群で有意に延長した。2年無病生存割合はオシメルチニブ群で90%、プラセボ群で44%だった。対象となった患者全体では、無病生存期間に関するハザード比は0.21(95%信頼区間は0.16-0.28)で、p<0.0001(196 / 682イベント)と、こちらもオシメルチニブ群で有意に延長した。2年無病生存割合はオシメルチニブ群で89%、プラセボ群で53%だった。データカットオフ時点での全生存期間データは未だ不十分で(データ確定は4%程度)、682人中29人が死亡していた(オシメルチニブ群で9人、プラセボ群で20人)。安全性については、オシメルチニブについて既に知られている内容と変わりはなかった。
結論:
オシメルチニブによる術後補助療法は、今回の対象集団に対して統計学的有意に、かつ臨床的にも意義のある無病生存期間の延長効果を示した。
・本試験のシェーマ

・患者背景

・試験結果概要

・無病生存期間生存曲線
II-IIIA期のみ(主要評価項目)

IB-IIIA期の全て
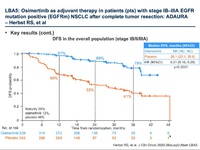
・各病期ごとの無病生存期間生存曲線

・サブグループ解析のフォレスト・プロット

・II期、IIIA期患者の全生存期間生存曲線

http://oitahaiganpractice.junglekouen.com/e973395.html
無病生存期間の生存曲線を見ると、目を瞠る。
ハザード比0.17・・・。
そうそうお目にかかれない数字である。
本試験は、術後補助化学療法の標準治療であるプラチナ併用化学療法とオシメルチニブを比較したものではない。
EGFR遺伝子変異陽性の完全切除後非扁平上皮非小細胞肺がん患者を対象とし、適応のある患者には標準治療である術後補助化学療法を行い(詳しい治療レジメンの記載はないが)、その後にオシメルチニブを上乗せする意義があるかどうかを、プラセボ対照で検証した試験である。
実地臨床において、術後補助化学療法の適応はあるものの、年齢、背景疾患、患者の希望等々の理由で術後補助化学療法がおこなわれない患者は相当数いるため、こうした試験デザインでも一定の意義がある。
治療的にも医療経済的にも"toxic new"な治療だったわけだが、少なくともプラチナ併用術後補助化学療法の対象となるII期、IIIA期の患者に対しては、圧倒的な無病生存期間の延長効果を示している。
それも、「予定していなかった中間解析の結果を受けて、独立データモニタリング委員会が早期の非盲検化を勧告した」というほどの出来事であり、余程のことである。
多分、EGFRチロシンキナーゼ阻害薬関連試験の常で、全生存期間の延長は達成できないだろう。
それも、おそらくはオシメルチニブを術後補助療法として加えることにより再発を先延ばしにする効果が得られているだけで、オシメルチニブ群のプラセボ群の累積再発患者数は、おそらく有意差は出ないだろう。
そして、治癒を目指すべき患者を対象とした臨床試験で、全生存期間の延長が得られないときに、その治療に臨床的な意義があるのか、という議論が沸き起こるだろう。
しかし、再発なく過ごせる期間が圧倒的に長くなる、というのは、当然大きなアドバンテージだ。
また、本試験は、IB期とII / III期への対応を、明確に区別すべき世界的なきっかけになるかも知れない。
所属リンパ節転移を伴わないIB期と、伴う(ということは、既にリンパ路にのった腫瘍細胞が広い範囲に広がっている)II / III期では、おのずと異なる対応が必要となるだろう。
IB期に対する我が国の標準術後補助化学療法はUFT内服2年間だが、果たしてオシメルチニブは、この成績を凌駕できるだろうか。
http://oitahaiganpractice.junglekouen.com/e968113.html
また、II-IIIA期の患者で、術後補助化学療法が行われた患者と行われなかった患者で、無病生存期間や全生存期間に差が出るかどうかも見てみたいところである。
Osimertinib as adjuvant therapy in patients with stage IB-IIIA EGFR mutation positive NSCLC after complete tumor resection
Roy Herbst et al.
ASCO 2020 abst. #LBA5
背景:
オシメルチニブは第3世代の、中枢神経病変への活性を有するEGFRチロシンキナーゼ阻害薬で、EGFR遺伝子変異陽性の未治療進行非小細胞肺がんに対する治療において、ゲフィチニブやエルロチニブよりも効果が高いことが示されている。非小細胞肺がん患者の約30%はI-IIIA期の早期段階で診断され、この場合は外科手術が第一選択の治療である。II-III期、およびIB期の一部の患者では、切除後に術後補助化学療法を行うことが標準治療とされているが、いまだ術後再発率は高く、他の治療の必要性が叫ばれてきた。ADAURA試験は、完全切除後で、必要に応じて術後補助化学療法がおこなわれたIB-IIIA期のEGFR遺伝子変異陽性非小細胞肺がん患者を対象として、プラセボに対するオシメルチニブの有効性と安全性を評価することを目的とした第III相二重盲検ランダム化比較試験である。独立したデータモニタリング委員会の勧告に従い、本試験は有効性データをもとに早期の非盲検化を行うこととなった。そのため、今回は予定していなかった中間解析結果について報告する。
方法:
適格患者の条件は以下の通り。
・18歳以上(日本と台湾では20歳以上)
・WHO PS 0もしくは1
・IB, II, IIIA期の原発性非扁平上皮非小細胞肺がん
・EGFR遺伝子変異(エクソン19欠失変異 / エクソン21L858R点突然変異)が確認されている
・原発性非小細胞肺がん完全切除後で、術後状態から回復している
術後(補助)化学療法は許容された。対象患者はオシメルチニブ群(オシメルチニブ80mg/回を1日1回服用)とプラセボ群に1:1の割合で無作為に割り付けられ、3年間を上限としてプロトコール治療を受けた。病期(IB期 / II期 / IIIA期)、EGFR遺伝子変異のタイプ(エクソン19 / エクソン21)、人種(アジア人 / 非アジア人)を割り付け調整因子とした。主要評価項目はII-IIIA期の患者の無病生存期間とし、副次評価項目は全生存期間と安全性とした。データカットオフは2020年1月17日に設定された。
結果:
全体で、682人の患者が無作為割り付けされた。オシメルチニブ群は339人、プラセボ群は343人だった。背景因子は両群でバランスが取れていた。IB期患者はそれぞれ31%、II / IIIA期患者はそれぞれ69%、女性は68% / 72%、エクソン19変異は55% / 56%、エクソン21変異は45% / 44%だった。II-IIIA期の患者の無病生存期間に関するハザード比は0.17(95%信頼区間は0.12-0.23)で、p<0.0001(156 / 470イベント)と、オシメルチニブ群で有意に延長した。2年無病生存割合はオシメルチニブ群で90%、プラセボ群で44%だった。対象となった患者全体では、無病生存期間に関するハザード比は0.21(95%信頼区間は0.16-0.28)で、p<0.0001(196 / 682イベント)と、こちらもオシメルチニブ群で有意に延長した。2年無病生存割合はオシメルチニブ群で89%、プラセボ群で53%だった。データカットオフ時点での全生存期間データは未だ不十分で(データ確定は4%程度)、682人中29人が死亡していた(オシメルチニブ群で9人、プラセボ群で20人)。安全性については、オシメルチニブについて既に知られている内容と変わりはなかった。
結論:
オシメルチニブによる術後補助療法は、今回の対象集団に対して統計学的有意に、かつ臨床的にも意義のある無病生存期間の延長効果を示した。
・本試験のシェーマ

・患者背景
・試験結果概要

・無病生存期間生存曲線
II-IIIA期のみ(主要評価項目)
IB-IIIA期の全て
・各病期ごとの無病生存期間生存曲線
・サブグループ解析のフォレスト・プロット
・II期、IIIA期患者の全生存期間生存曲線
2020年06月13日
Foundation One CDxのレポートに見るROS1融合遺伝子陽性肺がんの概略
Foundation One CDxを発注し、ROS1融合遺伝子が検出されたが、そこに記された概略がとてもよくまとめられている。
勉強になったので、書き残す。
<ROS1融合遺伝子>
ROS1がん遺伝子は、いくつかのシグナル伝達系(ERK1/2, PI3K, AKT, STAT3, VAV3)を活性化することにより細胞の成長や分化を制御する役割を持つインシュリン受容体ファミリーに属するチロシンキナーゼをコードする。ROS1融合遺伝子はROS1がん遺伝子のキナーゼドメインであるexon 36-42を含んでおり、そのためにシグナル伝達系を活性化し、がん化を惹起する。ROS1融合遺伝子を有する非小細胞肺がん患者に対しては、クリゾチニブが有効である。
<ROS1融合遺伝子陽性肺がんの頻度、予後>
ROS1遺伝子再構成 / 融合遺伝子は、非小細胞肺がん患者の1-2%に認められる。肺腺がんに限れば、1-3.4%の頻度とされる。CD74-ROS1融合遺伝子が全体の23-27%を占める。1,137人の肺腺がん患者を対象とした研究において、ROS1遺伝子再構成を有するIV期の患者14人は、その他の遺伝子変異を有するIV期の患者と比較して、全生存期間が有意に良好だった(生存期間中央値 36.7ヶ月)ことが示されている。本研究において、化学療法とクリゾチニブの両方の治療を受けたROS1遺伝子再構成陽性IV期患者の平均生存期間は5.3年だった。喫煙歴のない原発性肺腺がん根治切除後の患者において、ALKやROS1の融合遺伝子が陽性であることは無病生存期間を有意に短縮する予後不良因子(ハザード比2.11)であるが、肺腺がんの患者がALK、ROS1、RETの融合キナーゼを有することは生命予後の改善と相関関係があり、他の予後因子と独立した予後良好因子だった。208人の喫煙経験のない原発性肺腺がん患者を調査した研究で、7人(3.4%)のROS1融合遺伝子陽性の患者が含まれており、他の患者と比較してペメトレキセドで治療をすることにより高い奏効割合が期待でき(60% vs 8.5%, p=0.01)、無増悪生存期間も有意に長かった(未到達 vs 3.3ヶ月、p=0.008)。一方、ROS1融合遺伝子陽性の患者にEGFRチロシンキナーゼ阻害薬を使用した患者では、使用しないALK / ROS1融合遺伝子陽性患者に比べて有意に無増悪生存期間が短縮していた(2.5ヶ月 vs 7.8ヶ月, p=0.01)。
<ROS1融合遺伝子陽性肺がんに対する治療戦略>
クリゾチニブ、エヌトレクチニブ、セリチニブ、ロルラチニブは、ROS1遺伝子再構成陽性非小細胞肺がんに対して統計学的に有意な臨床的有用性を示している。また、クリゾチニブやセリチニブによる治療後に耐性化した患者でも、brigatinibやcabozantinibによる治療で、臨床的有用性が示されている。repotrectinibを用いた2件の第I相試験において、チロシンキナーゼ阻害薬治療歴のないROS1遺伝子再構成陽性非小細胞肺がん患者における奏効割合は、80%、81.8%だった。一方で、チロシンキナーゼ阻害薬治療歴のある患者では、奏効割合は17.6%、38.9%と低かった。また、他の試験において、repotrectinibをチロシンキナーゼ阻害薬治療歴のある患者で使うと、治療歴のない患者に使った時と比べて、奏効持続期間が短縮する(10.2ヶ月 vs 未到達)ことも示されている。
日本のROS1遺伝子再構成陽性非小細胞肺がん患者を対象に、新規化合物であるDS-6051bを用いて行われた第I相試験では、全コホートでの奏効割合は58.3%、病勢コントロール割合は100%と報告された。クリゾチニブ未治療の患者コホートでは、奏効割合は66.7%だった。クリゾチニブによる治療歴のある患者を対象にDS-6051bを用いた別の第I相試験では、奏効割合は33.3%、病勢コントロール割合は66.7%だった。
<クリゾチニブ>
クリゾチニブはMET、ALK、ROS1、RONといったキナーゼを阻害する。ALK遺伝子再構成、ROS1遺伝子再構成を有する進行非小細胞肺がんに対し、米国食品医薬品局が承認済みである。
クリゾチニブは、ALK遺伝子再構成陽性、ROS1遺伝子再構成陽性、NTRK1融合遺伝子陽性、あるいはMET活性化陽性の非小細胞肺がん患者に対する有用性が示されている。治療歴のあるROS1遺伝子再構成陽性非小細胞肺がんに対し、クリゾチニブでの治療を試みた第II相METROS試験では、奏効割合65%(患者数26人、完全奏効1人、部分奏効16人、病勢安定6人)、21か月間の経過観察期間の中にあって、無増悪生存期間中央値は22.8ヶ月、全生存期間中央値は未到達だった。同様に、第I相PROFILE1001試験においてROS1遺伝子再構成を有する非小細胞肺がん患者に対しクリゾチニブを使用したところ、奏効割合は72%(患者数53人、完全奏効6人、部分奏効32人、病勢安定10人)だった。c-MET増幅、c-MET遺伝子変異、あるいはROS1遺伝子再構成を有する患者を対象としたAcSe試験において、ROS1陽性患者にクリゾチニブを使用した際の奏効割合は67.6%(完全奏効1人、部分奏効24人)、病勢コントロール割合は86%だった。無悪生存期間中央値は5.5ヶ月、全生存期間中央値は17.2ヶ月だった。後方視的検討を行った研究では、ROS1遺伝子再構成陽性の肺癌がんに対してクリゾチニブを使用したところ奏効割合は80%、無増悪生存期間中央値は9.1ヶ月だった。
<セリチニブ>
セリチニブは、ALK、ROS1、IR(インシュリンレセプター?)、IGF-1R(インシュリン様成長因子-1レセプター)といったキナーゼを阻害する。認可されたコンパニオン診断薬で診断されたALK遺伝子再構成陽性の進行非小細胞肺がんに対して、米国食品医薬品局が承認済みである。
ROS1遺伝子再構成を有する非小細胞肺がんに対して有効性が示された第II相臨床試験に基づき、ROS1遺伝子再構成はセリチニブの効果予測因子となりうる。
セリチニブは、ALK / ROS1遺伝子再構成陽性の非小細胞肺がん患者に対して恩恵をもたらすことが示されている。ROS1遺伝子再構成陽性の進行非小細胞肺がん患者を対象とした第II相試験において、クリゾチニブ治療歴のない患者に対しては、セリチニブは67%の奏効割合と、19.3ヶ月の無増悪生存期間中央値をもたらした。また、参加した患者全体の生存期間中央値は24ヶ月で、脳転移を有する患者ではその63%で脳転移巣の病勢コントロールが得られた。ALKもしくはROS1遺伝子再構成陽性の進行非小細胞肺がん患者を対象としたもう1件の第II相臨床試験では、奏効割合73%、病勢コントロール割合92%、無増悪生存期間中央値14.4ヶ月だった。クリゾチニブでの治療後に耐性となったROS1遺伝子再構成陽性非小細胞肺がん患者におけるセリチニブの効果については、データは限られており、かつ混沌としている。クリゾチニブの治療歴がある2人の患者を含むセリチニブの第II相試験において、どちらの患者でも効果は見られなかった。しかし、別の症例報告では、クリゾチニブによる治療後に病勢進行に至ったROS1遺伝子再構成陽性非小細胞肺がん患者に対してセリチニブを使用したところ、毒性により中止を余儀なくされるまでの8ヶ月間は部分奏効の状態が続き、その後セリチニブが再開されてからさらに17ヶ月は有効だったと報告されている。
<Brigatinib>
BrigatinibはALK、ROS1、変異EGFRといったキナーゼを阻害する。ALK遺伝子再構成陽性の進行非小細胞肺がんで、クリゾチニブによる治療後耐性化した、もしくはクリゾチニブが毒性のために使用できない患者に対して、米国食品医薬品局が承認済みである。
ROS1融合遺伝子陽性の非小細胞肺がん患者に対する臨床効果と、前臨床試験における有望な結果から、ROS1遺伝子再構成はBrigatinibの効果予測因子となりうる。
Brigatinibはもともと、ALK遺伝子再構成陽性の非小細胞肺がんに対する治療として研究が進められてきた。Brigatinibはまた、ALK / ROS1 / EGFRに変異を有する肺がん以外の固形がんにおいて、17%の奏効割合を示した。ROS1遺伝子再構成陽性非小細胞肺がん患者で、クリゾチニブ、セリチニブの治療歴がある患者に対してBrigatinibを使用したところ、部分奏効が得られたという1例報告がある。また、ROS1遺伝子再構成陽性の非小細胞肺がん患者3人を対象にBrigatinibを使用したところ、クリゾチニブによる治療歴がある患者2人では効果が病勢安定もしくは病勢進行だったが、クリゾチニブの治療歴がない患者1人では21ヶ月以上にわたって部分奏効の状態が続いたという。
<ロルラチニブ>
ロルラチニブはALKとROS1を治療標的としたチロシンキナーゼ阻害薬である。クリゾチニブ、アレクチニブ、セリチニブ使用後に病勢進行に至ったALK陽性進行非小細胞肺がん患者に対して、米国食品医薬品局が承認済みである。
前臨床試験、臨床試験の結果から、ROS1遺伝子再構成はロルラチニブの効果予測因子となりうる。
ロルラチニブはもともと、ALKもしくはROS陽性の非小細胞肺がんに対して、既存のチロシンキナーゼ阻害薬への耐性化を克服するために開発が進められた薬である。非小細胞肺がんに対するロルラチニブの治療効果を検証した第I相臨床試験において、ROS1遺伝子再構成陽性患者に対する奏効割合は50%、奏効持続期間中央値は12ヶ月だった。続く第II相臨床試験では、クリゾチニブ治療歴のない患者での奏効割合は62%(完全奏効2人、部分奏効11人)、無増悪生存期間中央値は21ヶ月で、クリゾチニブ治療歴のある患者での奏効割合は35%(完全奏効2人、部分奏効12人)、無増悪生存期間中央値は8.5ヶ月だった。頭蓋内病変に対する効果は前治療に関わらず認められ、頭蓋内病変奏効割合はクリゾチニブ治療歴のない患者では64%(完全奏効5人、部分奏効2人)、クリゾチニブ治療歴のある患者では50%(完全奏効9人、部分奏効3人)だった。症例報告において、EZR-ROS1融合遺伝子陽性で、S1986Y/F変異を伴っていた進行非小細胞肺がん患者でもロルラチニブは有効だった。また、EZR-ROS1融合遺伝子陽性の原発性肺腺がん患者で、クリゾチニブによる二次治療後に部分奏効となり、ロルラチニブによる三次治療後に血清CEA値が低下し続けている症例報告もある。
<エヌトレクチニブ>
エヌトレクチニブはTRKA / TRKB / TRKC(NTRK1 / NTRK2 / NTRK3)、ROS1、ALKを治療標的とするチロシンキナーゼ阻害薬である。成人においては、ROS1陽性進行非小細胞肺がんとNTRK陽性の固形がんに対して米国食品医薬品局が承認済みである。
非小細胞肺がんや各種固形がんを対象とした臨床試験の結果に基づき、ROS1遺伝子再構成はエヌトレクチニブの効果予測因子となりうる。
ROS1阻害薬未治療のROS1融合遺伝子陽性非小細胞肺がんの患者を対象にエヌトレクチニブの効果を検証した第I相、第II相臨床試験の統合解析の結果から、奏効割合は77.4%(完全奏効3人を含む)、奏効持続期間中央値は24.6ヶ月、無増悪生存期間中央値は19.0ヶ月と報告された。脳転移のない患者での奏効割合は80%、脳転移のある患者での奏効割合は73.9%と同様であった。また、脳転移のある患者における頭蓋内病変奏効割合は50%だった。実地臨床における調査報告では、ROS1遺伝子再構成陽性非小細胞肺がん患者における無増悪生存期間中央値は、エヌトレクチニブで19.0ヶ月、クリゾチニブで8.5ヶ月だった。
勉強になったので、書き残す。
<ROS1融合遺伝子>
ROS1がん遺伝子は、いくつかのシグナル伝達系(ERK1/2, PI3K, AKT, STAT3, VAV3)を活性化することにより細胞の成長や分化を制御する役割を持つインシュリン受容体ファミリーに属するチロシンキナーゼをコードする。ROS1融合遺伝子はROS1がん遺伝子のキナーゼドメインであるexon 36-42を含んでおり、そのためにシグナル伝達系を活性化し、がん化を惹起する。ROS1融合遺伝子を有する非小細胞肺がん患者に対しては、クリゾチニブが有効である。
<ROS1融合遺伝子陽性肺がんの頻度、予後>
ROS1遺伝子再構成 / 融合遺伝子は、非小細胞肺がん患者の1-2%に認められる。肺腺がんに限れば、1-3.4%の頻度とされる。CD74-ROS1融合遺伝子が全体の23-27%を占める。1,137人の肺腺がん患者を対象とした研究において、ROS1遺伝子再構成を有するIV期の患者14人は、その他の遺伝子変異を有するIV期の患者と比較して、全生存期間が有意に良好だった(生存期間中央値 36.7ヶ月)ことが示されている。本研究において、化学療法とクリゾチニブの両方の治療を受けたROS1遺伝子再構成陽性IV期患者の平均生存期間は5.3年だった。喫煙歴のない原発性肺腺がん根治切除後の患者において、ALKやROS1の融合遺伝子が陽性であることは無病生存期間を有意に短縮する予後不良因子(ハザード比2.11)であるが、肺腺がんの患者がALK、ROS1、RETの融合キナーゼを有することは生命予後の改善と相関関係があり、他の予後因子と独立した予後良好因子だった。208人の喫煙経験のない原発性肺腺がん患者を調査した研究で、7人(3.4%)のROS1融合遺伝子陽性の患者が含まれており、他の患者と比較してペメトレキセドで治療をすることにより高い奏効割合が期待でき(60% vs 8.5%, p=0.01)、無増悪生存期間も有意に長かった(未到達 vs 3.3ヶ月、p=0.008)。一方、ROS1融合遺伝子陽性の患者にEGFRチロシンキナーゼ阻害薬を使用した患者では、使用しないALK / ROS1融合遺伝子陽性患者に比べて有意に無増悪生存期間が短縮していた(2.5ヶ月 vs 7.8ヶ月, p=0.01)。
<ROS1融合遺伝子陽性肺がんに対する治療戦略>
クリゾチニブ、エヌトレクチニブ、セリチニブ、ロルラチニブは、ROS1遺伝子再構成陽性非小細胞肺がんに対して統計学的に有意な臨床的有用性を示している。また、クリゾチニブやセリチニブによる治療後に耐性化した患者でも、brigatinibやcabozantinibによる治療で、臨床的有用性が示されている。repotrectinibを用いた2件の第I相試験において、チロシンキナーゼ阻害薬治療歴のないROS1遺伝子再構成陽性非小細胞肺がん患者における奏効割合は、80%、81.8%だった。一方で、チロシンキナーゼ阻害薬治療歴のある患者では、奏効割合は17.6%、38.9%と低かった。また、他の試験において、repotrectinibをチロシンキナーゼ阻害薬治療歴のある患者で使うと、治療歴のない患者に使った時と比べて、奏効持続期間が短縮する(10.2ヶ月 vs 未到達)ことも示されている。
日本のROS1遺伝子再構成陽性非小細胞肺がん患者を対象に、新規化合物であるDS-6051bを用いて行われた第I相試験では、全コホートでの奏効割合は58.3%、病勢コントロール割合は100%と報告された。クリゾチニブ未治療の患者コホートでは、奏効割合は66.7%だった。クリゾチニブによる治療歴のある患者を対象にDS-6051bを用いた別の第I相試験では、奏効割合は33.3%、病勢コントロール割合は66.7%だった。
<クリゾチニブ>
クリゾチニブはMET、ALK、ROS1、RONといったキナーゼを阻害する。ALK遺伝子再構成、ROS1遺伝子再構成を有する進行非小細胞肺がんに対し、米国食品医薬品局が承認済みである。
クリゾチニブは、ALK遺伝子再構成陽性、ROS1遺伝子再構成陽性、NTRK1融合遺伝子陽性、あるいはMET活性化陽性の非小細胞肺がん患者に対する有用性が示されている。治療歴のあるROS1遺伝子再構成陽性非小細胞肺がんに対し、クリゾチニブでの治療を試みた第II相METROS試験では、奏効割合65%(患者数26人、完全奏効1人、部分奏効16人、病勢安定6人)、21か月間の経過観察期間の中にあって、無増悪生存期間中央値は22.8ヶ月、全生存期間中央値は未到達だった。同様に、第I相PROFILE1001試験においてROS1遺伝子再構成を有する非小細胞肺がん患者に対しクリゾチニブを使用したところ、奏効割合は72%(患者数53人、完全奏効6人、部分奏効32人、病勢安定10人)だった。c-MET増幅、c-MET遺伝子変異、あるいはROS1遺伝子再構成を有する患者を対象としたAcSe試験において、ROS1陽性患者にクリゾチニブを使用した際の奏効割合は67.6%(完全奏効1人、部分奏効24人)、病勢コントロール割合は86%だった。無悪生存期間中央値は5.5ヶ月、全生存期間中央値は17.2ヶ月だった。後方視的検討を行った研究では、ROS1遺伝子再構成陽性の肺癌がんに対してクリゾチニブを使用したところ奏効割合は80%、無増悪生存期間中央値は9.1ヶ月だった。
<セリチニブ>
セリチニブは、ALK、ROS1、IR(インシュリンレセプター?)、IGF-1R(インシュリン様成長因子-1レセプター)といったキナーゼを阻害する。認可されたコンパニオン診断薬で診断されたALK遺伝子再構成陽性の進行非小細胞肺がんに対して、米国食品医薬品局が承認済みである。
ROS1遺伝子再構成を有する非小細胞肺がんに対して有効性が示された第II相臨床試験に基づき、ROS1遺伝子再構成はセリチニブの効果予測因子となりうる。
セリチニブは、ALK / ROS1遺伝子再構成陽性の非小細胞肺がん患者に対して恩恵をもたらすことが示されている。ROS1遺伝子再構成陽性の進行非小細胞肺がん患者を対象とした第II相試験において、クリゾチニブ治療歴のない患者に対しては、セリチニブは67%の奏効割合と、19.3ヶ月の無増悪生存期間中央値をもたらした。また、参加した患者全体の生存期間中央値は24ヶ月で、脳転移を有する患者ではその63%で脳転移巣の病勢コントロールが得られた。ALKもしくはROS1遺伝子再構成陽性の進行非小細胞肺がん患者を対象としたもう1件の第II相臨床試験では、奏効割合73%、病勢コントロール割合92%、無増悪生存期間中央値14.4ヶ月だった。クリゾチニブでの治療後に耐性となったROS1遺伝子再構成陽性非小細胞肺がん患者におけるセリチニブの効果については、データは限られており、かつ混沌としている。クリゾチニブの治療歴がある2人の患者を含むセリチニブの第II相試験において、どちらの患者でも効果は見られなかった。しかし、別の症例報告では、クリゾチニブによる治療後に病勢進行に至ったROS1遺伝子再構成陽性非小細胞肺がん患者に対してセリチニブを使用したところ、毒性により中止を余儀なくされるまでの8ヶ月間は部分奏効の状態が続き、その後セリチニブが再開されてからさらに17ヶ月は有効だったと報告されている。
<Brigatinib>
BrigatinibはALK、ROS1、変異EGFRといったキナーゼを阻害する。ALK遺伝子再構成陽性の進行非小細胞肺がんで、クリゾチニブによる治療後耐性化した、もしくはクリゾチニブが毒性のために使用できない患者に対して、米国食品医薬品局が承認済みである。
ROS1融合遺伝子陽性の非小細胞肺がん患者に対する臨床効果と、前臨床試験における有望な結果から、ROS1遺伝子再構成はBrigatinibの効果予測因子となりうる。
Brigatinibはもともと、ALK遺伝子再構成陽性の非小細胞肺がんに対する治療として研究が進められてきた。Brigatinibはまた、ALK / ROS1 / EGFRに変異を有する肺がん以外の固形がんにおいて、17%の奏効割合を示した。ROS1遺伝子再構成陽性非小細胞肺がん患者で、クリゾチニブ、セリチニブの治療歴がある患者に対してBrigatinibを使用したところ、部分奏効が得られたという1例報告がある。また、ROS1遺伝子再構成陽性の非小細胞肺がん患者3人を対象にBrigatinibを使用したところ、クリゾチニブによる治療歴がある患者2人では効果が病勢安定もしくは病勢進行だったが、クリゾチニブの治療歴がない患者1人では21ヶ月以上にわたって部分奏効の状態が続いたという。
<ロルラチニブ>
ロルラチニブはALKとROS1を治療標的としたチロシンキナーゼ阻害薬である。クリゾチニブ、アレクチニブ、セリチニブ使用後に病勢進行に至ったALK陽性進行非小細胞肺がん患者に対して、米国食品医薬品局が承認済みである。
前臨床試験、臨床試験の結果から、ROS1遺伝子再構成はロルラチニブの効果予測因子となりうる。
ロルラチニブはもともと、ALKもしくはROS陽性の非小細胞肺がんに対して、既存のチロシンキナーゼ阻害薬への耐性化を克服するために開発が進められた薬である。非小細胞肺がんに対するロルラチニブの治療効果を検証した第I相臨床試験において、ROS1遺伝子再構成陽性患者に対する奏効割合は50%、奏効持続期間中央値は12ヶ月だった。続く第II相臨床試験では、クリゾチニブ治療歴のない患者での奏効割合は62%(完全奏効2人、部分奏効11人)、無増悪生存期間中央値は21ヶ月で、クリゾチニブ治療歴のある患者での奏効割合は35%(完全奏効2人、部分奏効12人)、無増悪生存期間中央値は8.5ヶ月だった。頭蓋内病変に対する効果は前治療に関わらず認められ、頭蓋内病変奏効割合はクリゾチニブ治療歴のない患者では64%(完全奏効5人、部分奏効2人)、クリゾチニブ治療歴のある患者では50%(完全奏効9人、部分奏効3人)だった。症例報告において、EZR-ROS1融合遺伝子陽性で、S1986Y/F変異を伴っていた進行非小細胞肺がん患者でもロルラチニブは有効だった。また、EZR-ROS1融合遺伝子陽性の原発性肺腺がん患者で、クリゾチニブによる二次治療後に部分奏効となり、ロルラチニブによる三次治療後に血清CEA値が低下し続けている症例報告もある。
<エヌトレクチニブ>
エヌトレクチニブはTRKA / TRKB / TRKC(NTRK1 / NTRK2 / NTRK3)、ROS1、ALKを治療標的とするチロシンキナーゼ阻害薬である。成人においては、ROS1陽性進行非小細胞肺がんとNTRK陽性の固形がんに対して米国食品医薬品局が承認済みである。
非小細胞肺がんや各種固形がんを対象とした臨床試験の結果に基づき、ROS1遺伝子再構成はエヌトレクチニブの効果予測因子となりうる。
ROS1阻害薬未治療のROS1融合遺伝子陽性非小細胞肺がんの患者を対象にエヌトレクチニブの効果を検証した第I相、第II相臨床試験の統合解析の結果から、奏効割合は77.4%(完全奏効3人を含む)、奏効持続期間中央値は24.6ヶ月、無増悪生存期間中央値は19.0ヶ月と報告された。脳転移のない患者での奏効割合は80%、脳転移のある患者での奏効割合は73.9%と同様であった。また、脳転移のある患者における頭蓋内病変奏効割合は50%だった。実地臨床における調査報告では、ROS1遺伝子再構成陽性非小細胞肺がん患者における無増悪生存期間中央値は、エヌトレクチニブで19.0ヶ月、クリゾチニブで8.5ヶ月だった。
2020年06月12日
血液検査と骨髄抑制管理の外部委託
本日の就業前30分ごろ、病院の事務局長から呼び出しを受けた。
何の相談だろうと思ったら、近くの総合病院からアンケート回答依頼が来ているので、相談に乗ってほしいとのことだった。
最近、この総合病院に血液内科が新設された。
血液内科の医師が2人、常勤医として赴任している様子。
その血液内科から、血液腫瘍患者の治療経過中、骨髄抑制に関する外来血液検査と、顆粒球コロニー刺激因子投与を請け負ってもらうことはできないだろうか、という内容だった。
最近、この手の話が少しずつ増えてきているような気がする。
例えば、
・化学療法開始後、②コース目以降を地元の病院にお願いする
・術後補助化学療法(UFT内服)を、地元の病院にお願いする
・終末期緩和医療を、地元の病院にお願いする
・術後リハビリを、地元の病院にお願いする
などなど。
地域連携パスの運用実績ががん診療連携拠点病院の認定条件になっていたりとか、こうした連携を推進しなければならない事情もあるのだろう。
今回の件もこうした点に関わりがあるのかもしれないし、実際に業務が多忙なため少しでも外注したいということかもしれない。
請け負う条件として、
・血液検査が自施設でできる
・白血球については、細胞分画まで結果を出せる
・検査結果が出るまでにそれほど時間がかからない
・顆粒球コロニー刺激因子投与ができる
などが記載されていた。
当たり前だけど、当院ではすべて可能である。
少しでもお役に立てるならと、私が外来診療をしている曜日なら対応可能と事務局長に伝えた。
何の相談だろうと思ったら、近くの総合病院からアンケート回答依頼が来ているので、相談に乗ってほしいとのことだった。
最近、この総合病院に血液内科が新設された。
血液内科の医師が2人、常勤医として赴任している様子。
その血液内科から、血液腫瘍患者の治療経過中、骨髄抑制に関する外来血液検査と、顆粒球コロニー刺激因子投与を請け負ってもらうことはできないだろうか、という内容だった。
最近、この手の話が少しずつ増えてきているような気がする。
例えば、
・化学療法開始後、②コース目以降を地元の病院にお願いする
・術後補助化学療法(UFT内服)を、地元の病院にお願いする
・終末期緩和医療を、地元の病院にお願いする
・術後リハビリを、地元の病院にお願いする
などなど。
地域連携パスの運用実績ががん診療連携拠点病院の認定条件になっていたりとか、こうした連携を推進しなければならない事情もあるのだろう。
今回の件もこうした点に関わりがあるのかもしれないし、実際に業務が多忙なため少しでも外注したいということかもしれない。
請け負う条件として、
・血液検査が自施設でできる
・白血球については、細胞分画まで結果を出せる
・検査結果が出るまでにそれほど時間がかからない
・顆粒球コロニー刺激因子投与ができる
などが記載されていた。
当たり前だけど、当院ではすべて可能である。
少しでもお役に立てるならと、私が外来診療をしている曜日なら対応可能と事務局長に伝えた。
2020年06月09日
国産PCA(patient controlled analgesia)ポンプ...i-Fusor plus
最近入院していたがん患者さんの疼痛管理がなかなか大変で、一晩中、ほぼ20分に1回の頻度で注射用麻薬のレスキュー投与を必要としていた。
当然、患者さん本人だけでなく、夜勤の看護スタッフはずっと気が休まらない。
私の疼痛コントロールの拙さからくるもので、申し訳ないったらない。
以前、当院に緩和ケア病棟があったころには、PCAポンプを利用していたようだが、今ではその文化すらなくなってしまった。
私もスタッフも随分と苦労して、次回同じような機会があったらPCAポンプを使おうということになった。
PCAポンプは、精密持続点滴ポンプに、患者さん本人が痛いときに追加投与するためのボタンが附属したもの、と考えるといい。
どんどん追加投与をすると、薬の中毒症状が懸念されるため、限度回数などを設定することができる。
これは、私が最初に接したPCAポンプ、「CADD-Legacy PCA」。
今でもこれを使っている施設は多いのではないだろうか。

これは、現在も当院においてある(近々廃棄予定の)「テルフュージョン小型シリンジポンプ」。
小型ではあるが、それだけに用量の制限があり、あまり好きではなかった。

今回採用候補となっているのが、JMS社製の「i-Fusor plus」。
各種附属機能がついていて、国産らしい。




そんなに大きくもないし、既存の輸液システムが使えるみたいだし、これはいいね、という話になった。
問題は価格。
本体の価格もさることながら、消耗品が高い。
もう少し検討することにした。

当然、患者さん本人だけでなく、夜勤の看護スタッフはずっと気が休まらない。
私の疼痛コントロールの拙さからくるもので、申し訳ないったらない。
以前、当院に緩和ケア病棟があったころには、PCAポンプを利用していたようだが、今ではその文化すらなくなってしまった。
私もスタッフも随分と苦労して、次回同じような機会があったらPCAポンプを使おうということになった。
PCAポンプは、精密持続点滴ポンプに、患者さん本人が痛いときに追加投与するためのボタンが附属したもの、と考えるといい。
どんどん追加投与をすると、薬の中毒症状が懸念されるため、限度回数などを設定することができる。
これは、私が最初に接したPCAポンプ、「CADD-Legacy PCA」。
今でもこれを使っている施設は多いのではないだろうか。

これは、現在も当院においてある(近々廃棄予定の)「テルフュージョン小型シリンジポンプ」。
小型ではあるが、それだけに用量の制限があり、あまり好きではなかった。

今回採用候補となっているのが、JMS社製の「i-Fusor plus」。
各種附属機能がついていて、国産らしい。




そんなに大きくもないし、既存の輸液システムが使えるみたいだし、これはいいね、という話になった。
問題は価格。
本体の価格もさることながら、消耗品が高い。
もう少し検討することにした。

Posted by tak at
16:02
│Comments(0)
2020年06月09日
「進行性線維化を伴う間質性肺疾患」へ、ニンテダニブが使用可能に
肺がんと直接の関係はないが、「進行性線維化」を伴う幅広い間質性肺疾患に対して、ニンテダニブが保険適用されることになった。
ニンテダニブもピルフェニドンも、対象疾患がほぼ特発性肺線維症に限定されていたため、これは大きなbreak throughといってよい。
「進行性線維化」の定義は緩く(オンライン講演会では、そもそも「現時点で明確な定義はない」と説明されていた)、HRCTにおいて線維化の進行が認められ、呼吸状態が悪化したと担当医が判断すれば、それすなわち「進行性線維化」である。
今後、「進行性線維化を伴う間質性肺疾患」を有する患者が肺がんを合併した場合、ニンテダニブを使用する機会が増えるだろう。
この患者群において、ニンテダニブは間質性肺疾患による無増悪生存期間を延長している。
その上、肺がんに対する抑制作用も有しているとなると、有害事象の懸念以外にあえて使わない理由が思い浮かばない。
・・・もちろん、経済的有害事象は計り知れない。
ニンテダニブ150mgは6574.4円なので、ニンテダニブだけで1日13148.8円、月間約40万円、年間約480万円の負担が社会にのしかかる。
INBUILD試験に参加した患者のほぼ100%が喫煙者だったことを考えると、やるせない。
免疫チェックポイント阻害薬と全く同じ構図がここにも横たわっている。
適用条件に、「喫煙経験を有する患者は除外する」と付加してはどうだろう。
馬鹿正直に喫煙歴を申告する人はいないだろうが、少なくとも使用開始後の喫煙習慣を抑制するくらいの効果はあるだろう。
ニンテダニブに関する過去の記事は、以下を参照。
なお、本邦では、原発性肺癌そのものに対するニンテダニブの適応はない。
http://oitahaiganpractice.junglekouen.com/e843642.html
http://oitahaiganpractice.junglekouen.com/e896262.html
<日本ベーリンガー・インゲルハイム社のプレスリリース>
日本ベーリンガーインゲルハイム、国内におけるオフェブカプセルの進行性線維化を伴う間質性肺疾患に対する適応追加の承認取得
―日本初の進行性線維化を伴うILDの治療薬―
https://www.boehringer-ingelheim.jp/press-release/20200529_01
Nintedanib in Progressive Fibrosing Interstitial Lung Diseases (INBUILD study)
Kevin R Flaherty et al., N Engl J Med . 2019 Oct 31;381(18):1718-1727.
doi: 10.1056/NEJMoa1908681.
PDF: https://www.nejm.org/doi/pdf/10.1056/NEJMoa1908681
背景:
前臨床データにおいて、細胞内チロシンキナーゼ活性を阻害する働きを持つニンテダニブは、肺の線維化過程を阻害することが示唆されている。特発性肺線維症(IPF)および全身性強皮症を伴う間質性肺疾患患者では、ニンテダニブ150mgの1日2回投与により、努力性肺活量の低下が抑制されたと報告されている。しかし、肺の線維化を招く他の幅広い疾患においても同様の効果が得られるのかはわかっていなかった。
方法:
今回の二重盲検プラセボ対照第III相臨床試験は、日本を含む15ヶ国、153施設の共同臨床試験として行われた。高分解能CTにおいて、肺容積全体の10%以上が線維化を起こしている患者を対象として、ニンテダニブ150mg/回を1日2回服用する患者群(N群)と、プラセボを服用する患者群(P群)に割り付けた。全ての患者は、過去24ヶ月間、「治療」を受けたにも関わらず「進行する間質性肺疾患」を有し、努力性肺活量は予測値の45%以上保たれており、肺の一酸化炭素拡散能(diffusing capacity of the lung for carbon monoxide, DLCO)が予測値の30%以上80%未満であることとした。ここでの治療には、ニンテダニブ、ピルフェニドン、アザチオプリン、シクロスポリン、ミコフェノール酸モフェチル、タクロリムス、リツキシマブ、シクロフォスファミド、プレドニゾロン換算で20mg/日以上の糖質コルチコイドは含まないものとした。また、進行する間質性肺疾患の条件として、以下のいずれかを満たすものとした。
①24ヶ月間で、努力性肺活量が予測値の10%以上低下したもの
②24か月間で、努力性肺活量が予測値の5%以上10%未満低下し、呼吸症状が悪化したか、高分解能CTで線維化の範囲が増加したもの
③呼吸状態が悪化し、かつ高分解能CTで線維化の範囲が増加したもの。
高分解能CTにおける線維化パターン(蜂巣肺の所見や時間的・空間的多相性所見を伴う通常型間質性肺炎パターンか、それ以外の線維化パターンか)を割り付け調整因子とした。
主要評価項目は、努力性肺活量の年次低下量とし、プロトコール治療開始時点から52週経過時点で測定・評価した。これは、全体の患者群と、通常型間質性肺炎様患者群限定でそれぞれ解析した。
結果:
2017年2月~2018年4月の期間に対象患者が登録され、計663人(N群332人、P群331人)の患者がプロトコール治療を受けた。412人(62.1%、両群206例ずつ)が通常型間質性肺炎様線維化パターンを示していた。間質性肺疾患の診断名として、慢性過敏性肺臓炎(26.1%)と自己免疫性間質性肺疾患(25.6%)が多かった。N群のうち252人(75.9%)、P群のうち282人(85.2%)が52週の治療を完遂した。
全体の患者群では、N群の努力性肺活量年次低下量が-80.8mlであったのに対し、P群では-187.8mlで、その差は107.0ml(95%信頼区間は65.4-148.5ml)で、p<0.001と有意にN群の低下量が低かった。通常型間質性肺炎様患者群では、N群で-82.9mlであったのに対し、P群では-211.1mlで、その差は128.2ml(95%信頼区間は70.8-185.6ml)で、p<0.001と有意にN群の低下量が低かった。
52週経過時点での間質性肺疾患の増悪または死亡は、全体の患者群ではN群が7.8%(26/332)、P群が9.7%(32/331)で、ハザード比は0.80(95%信頼区間:0.48-1.34)だった。通常型間質性肺炎様患者群ではN群が8.3%(17/206)、P群が12.1%(25/206)で、ハザード比は0.67(95%信頼区間:0.36-1.24)だった。また、52週経過時点での死亡は、全体ではN群が4.8%(16/332)、P群が5.1%(17/331)で、ハザード比は0.94(95%信頼区間:0.47-1.86)、通常型間質性肺炎様患者群では、N群が5.3%(11/206)、P群が7.8%(16/206)で、ハザード比0.68(95%信頼区間:0.32‐1.47)だった。
主要な有害事象は下痢で、N群の66.9%、P群の23.9%で認めた。肝機能障害も、P群に比べてN群でより高頻度に認めた。
結論:
進行性の線維化を伴う間質性肺疾患患者において、努力性肺活量の年次低下量はP群に比べてN群で有意に減少した。下痢が主な有害事象だった。
<参考資料>日本ベーリンガーインゲルハイム社提供のパンフレット,オンライン講演より
「進行性線維化を伴う間質性肺疾患」は、その原因疾患を問わない
過敏性肺臓炎、職業性肺疾患(塵肺)、薬剤性肺障害、サルコイドーシスなど、この概念図ではすべて含まれることになる


自己免疫性疾患の中で、強皮症や多発性筋炎 / 皮膚筋炎では、間質性肺疾患が死因の35-50%程度を占める
その上、自己免疫疾患は、悪性腫瘍の合併割合が高いとされる

INBUILD試験の概要
対象となった患者を、ニンテダニブ服用群とプラセボ群に無作為割り付け
年間の努力性肺活量低下量を主要評価項目としている

「進行性線維化」は以下のように定義された
ivの項目については、担当医の主観でほぼ決まってしまう。

患者背景
平均年齢は65‐70歳
やや男性が多く、通常型間質性肺炎パターンの患者ではさらに男性が増える
ほぼ100%の参加者が喫煙経験あり
通常型間質性肺炎様パターンを示す患者が約60%

努力性肺活量の年間減少量は、有意にニンテダニブ群で少なかった→努力性肺活量がより維持された

努力性肺活量低下の経時的変化は、ニンテダニブ群でより軽度だった

ニンテダニブは、今回の対象患者の無増悪生存期間を有意に延長した

ニンテダニブは、下痢、悪心・嘔吐といった消化器系の有害事象を高率に合併した
呼吸不全、肺炎といった有害事象で死亡に至った患者が、ニンテダニブ群の6.3%に認められた


ニンテダニブもピルフェニドンも、対象疾患がほぼ特発性肺線維症に限定されていたため、これは大きなbreak throughといってよい。
「進行性線維化」の定義は緩く(オンライン講演会では、そもそも「現時点で明確な定義はない」と説明されていた)、HRCTにおいて線維化の進行が認められ、呼吸状態が悪化したと担当医が判断すれば、それすなわち「進行性線維化」である。
今後、「進行性線維化を伴う間質性肺疾患」を有する患者が肺がんを合併した場合、ニンテダニブを使用する機会が増えるだろう。
この患者群において、ニンテダニブは間質性肺疾患による無増悪生存期間を延長している。
その上、肺がんに対する抑制作用も有しているとなると、有害事象の懸念以外にあえて使わない理由が思い浮かばない。
・・・もちろん、経済的有害事象は計り知れない。
ニンテダニブ150mgは6574.4円なので、ニンテダニブだけで1日13148.8円、月間約40万円、年間約480万円の負担が社会にのしかかる。
INBUILD試験に参加した患者のほぼ100%が喫煙者だったことを考えると、やるせない。
免疫チェックポイント阻害薬と全く同じ構図がここにも横たわっている。
適用条件に、「喫煙経験を有する患者は除外する」と付加してはどうだろう。
馬鹿正直に喫煙歴を申告する人はいないだろうが、少なくとも使用開始後の喫煙習慣を抑制するくらいの効果はあるだろう。
ニンテダニブに関する過去の記事は、以下を参照。
なお、本邦では、原発性肺癌そのものに対するニンテダニブの適応はない。
http://oitahaiganpractice.junglekouen.com/e843642.html
http://oitahaiganpractice.junglekouen.com/e896262.html
<日本ベーリンガー・インゲルハイム社のプレスリリース>
日本ベーリンガーインゲルハイム、国内におけるオフェブカプセルの進行性線維化を伴う間質性肺疾患に対する適応追加の承認取得
―日本初の進行性線維化を伴うILDの治療薬―
https://www.boehringer-ingelheim.jp/press-release/20200529_01
Nintedanib in Progressive Fibrosing Interstitial Lung Diseases (INBUILD study)
Kevin R Flaherty et al., N Engl J Med . 2019 Oct 31;381(18):1718-1727.
doi: 10.1056/NEJMoa1908681.
PDF: https://www.nejm.org/doi/pdf/10.1056/NEJMoa1908681
背景:
前臨床データにおいて、細胞内チロシンキナーゼ活性を阻害する働きを持つニンテダニブは、肺の線維化過程を阻害することが示唆されている。特発性肺線維症(IPF)および全身性強皮症を伴う間質性肺疾患患者では、ニンテダニブ150mgの1日2回投与により、努力性肺活量の低下が抑制されたと報告されている。しかし、肺の線維化を招く他の幅広い疾患においても同様の効果が得られるのかはわかっていなかった。
方法:
今回の二重盲検プラセボ対照第III相臨床試験は、日本を含む15ヶ国、153施設の共同臨床試験として行われた。高分解能CTにおいて、肺容積全体の10%以上が線維化を起こしている患者を対象として、ニンテダニブ150mg/回を1日2回服用する患者群(N群)と、プラセボを服用する患者群(P群)に割り付けた。全ての患者は、過去24ヶ月間、「治療」を受けたにも関わらず「進行する間質性肺疾患」を有し、努力性肺活量は予測値の45%以上保たれており、肺の一酸化炭素拡散能(diffusing capacity of the lung for carbon monoxide, DLCO)が予測値の30%以上80%未満であることとした。ここでの治療には、ニンテダニブ、ピルフェニドン、アザチオプリン、シクロスポリン、ミコフェノール酸モフェチル、タクロリムス、リツキシマブ、シクロフォスファミド、プレドニゾロン換算で20mg/日以上の糖質コルチコイドは含まないものとした。また、進行する間質性肺疾患の条件として、以下のいずれかを満たすものとした。
①24ヶ月間で、努力性肺活量が予測値の10%以上低下したもの
②24か月間で、努力性肺活量が予測値の5%以上10%未満低下し、呼吸症状が悪化したか、高分解能CTで線維化の範囲が増加したもの
③呼吸状態が悪化し、かつ高分解能CTで線維化の範囲が増加したもの。
高分解能CTにおける線維化パターン(蜂巣肺の所見や時間的・空間的多相性所見を伴う通常型間質性肺炎パターンか、それ以外の線維化パターンか)を割り付け調整因子とした。
主要評価項目は、努力性肺活量の年次低下量とし、プロトコール治療開始時点から52週経過時点で測定・評価した。これは、全体の患者群と、通常型間質性肺炎様患者群限定でそれぞれ解析した。
結果:
2017年2月~2018年4月の期間に対象患者が登録され、計663人(N群332人、P群331人)の患者がプロトコール治療を受けた。412人(62.1%、両群206例ずつ)が通常型間質性肺炎様線維化パターンを示していた。間質性肺疾患の診断名として、慢性過敏性肺臓炎(26.1%)と自己免疫性間質性肺疾患(25.6%)が多かった。N群のうち252人(75.9%)、P群のうち282人(85.2%)が52週の治療を完遂した。
全体の患者群では、N群の努力性肺活量年次低下量が-80.8mlであったのに対し、P群では-187.8mlで、その差は107.0ml(95%信頼区間は65.4-148.5ml)で、p<0.001と有意にN群の低下量が低かった。通常型間質性肺炎様患者群では、N群で-82.9mlであったのに対し、P群では-211.1mlで、その差は128.2ml(95%信頼区間は70.8-185.6ml)で、p<0.001と有意にN群の低下量が低かった。
52週経過時点での間質性肺疾患の増悪または死亡は、全体の患者群ではN群が7.8%(26/332)、P群が9.7%(32/331)で、ハザード比は0.80(95%信頼区間:0.48-1.34)だった。通常型間質性肺炎様患者群ではN群が8.3%(17/206)、P群が12.1%(25/206)で、ハザード比は0.67(95%信頼区間:0.36-1.24)だった。また、52週経過時点での死亡は、全体ではN群が4.8%(16/332)、P群が5.1%(17/331)で、ハザード比は0.94(95%信頼区間:0.47-1.86)、通常型間質性肺炎様患者群では、N群が5.3%(11/206)、P群が7.8%(16/206)で、ハザード比0.68(95%信頼区間:0.32‐1.47)だった。
主要な有害事象は下痢で、N群の66.9%、P群の23.9%で認めた。肝機能障害も、P群に比べてN群でより高頻度に認めた。
結論:
進行性の線維化を伴う間質性肺疾患患者において、努力性肺活量の年次低下量はP群に比べてN群で有意に減少した。下痢が主な有害事象だった。
<参考資料>日本ベーリンガーインゲルハイム社提供のパンフレット,オンライン講演より
「進行性線維化を伴う間質性肺疾患」は、その原因疾患を問わない
過敏性肺臓炎、職業性肺疾患(塵肺)、薬剤性肺障害、サルコイドーシスなど、この概念図ではすべて含まれることになる


自己免疫性疾患の中で、強皮症や多発性筋炎 / 皮膚筋炎では、間質性肺疾患が死因の35-50%程度を占める
その上、自己免疫疾患は、悪性腫瘍の合併割合が高いとされる

INBUILD試験の概要
対象となった患者を、ニンテダニブ服用群とプラセボ群に無作為割り付け
年間の努力性肺活量低下量を主要評価項目としている

「進行性線維化」は以下のように定義された
ivの項目については、担当医の主観でほぼ決まってしまう。

患者背景
平均年齢は65‐70歳
やや男性が多く、通常型間質性肺炎パターンの患者ではさらに男性が増える
ほぼ100%の参加者が喫煙経験あり
通常型間質性肺炎様パターンを示す患者が約60%

努力性肺活量の年間減少量は、有意にニンテダニブ群で少なかった→努力性肺活量がより維持された

努力性肺活量低下の経時的変化は、ニンテダニブ群でより軽度だった

ニンテダニブは、今回の対象患者の無増悪生存期間を有意に延長した

ニンテダニブは、下痢、悪心・嘔吐といった消化器系の有害事象を高率に合併した
呼吸不全、肺炎といった有害事象で死亡に至った患者が、ニンテダニブ群の6.3%に認められた


2020年06月03日
先祖を想い、家族をつなぐ
何度でも繰り返すが、新型コロナウイルスは家族の絆を分断した。
進行がんで患者が苦しんでいて、遠く離れた家族と今こそ互いに会うべきときなのに、自粛という壁が立ちはだかる。
健康なときに家族を大切にしないと、いざというときに後悔することになる。
今年に入ってから、世界中でどれだけの遺族が、死にゆく家族と一目会うことすらできずに、辛い別れを味わったことだろうか。
遺骸に会えず、やっと再会を果たしたとき、亡き人は小さな骨壺に収まっている。
そんな羽目に陥ったのは、決して新型コロナウイルス感染症の犠牲者だけではないはずだ。
この仕事をしていると、いろんな切なくやるせない場面に遭遇する。
そんなとき、ふと思うことがある。
ごく一般の日本人にとって、宗教やスピリチュアルは、どのような位置づけなのだろうか。
私は兄弟の中では末っ子で、文字通り目の中に入れても痛くないほど、祖父は私をかわいがってくれたらしい。
しかし、私が祖父とともに写っている写真は、私が知る限り、たった一枚しか残されていない。
まだ私が1歳くらい、よだれかけをしてちょこんと胡坐をかいて座っていて、その隣で浴衣姿の祖父が目を細めて微笑しながら同じように座っている。
祖父が長く生きていれば私の記憶にもいくばくかは残ったのだろうが、祖父は私が2歳のころ他界した。
私の中に、祖父との触れ合いの記憶は残っていない。
しかし、祖父が亡くなった後も、私が大学に進学して実家を去るまで、ある理由で祖父の魂は常に私と共にあった。
その理由のために、一時期はかなり両親に対して複雑な気持ちを持っていたが、徐々に受け入れられるようになった。
これまでの人生で何度か不思議な体験や重要な岐路を経験した。
そのたびに祖父の見えない手に導かれてここまで来れたような気がする。
ハリー・ポッターにとっての両親、ジェームス・ポッターとリリー・ポッターのようなものだ。
きっとこういうのを、スピリチュアルというんだろうな。
じいちゃん、ありがとう。
これからもよろしく。
同居していた叔母を7年前に、父を6年前に亡くし、自ずと仏壇や墓前で手を合わせることが増え、宗教に対する考え方が少しずつ変わってきた。
若いころは、
「宗教なんて、結局患者が死んだ後にしか役に立たない、宗教家なんて、患者の生き死にに何の責任もないところでお金を稼ぐわけだし、客は増える(積み重なる)一方で減らないから、こんなおいしい商売はないよな」
なんて不信心極まりない考えを持っていた。
あくまで仕事最優先で、お盆に帰省することなんてまずなかった。
今でも、医者は現世利益のためにのみ存在する、という基本的な考え方は変わらない。
しかし、治癒不能の肺がん患者さんに接したとき、宗教が心のよりどころになる、いくばくかは救われる、ということはあるような気がする。
宗教的な理由で輸血ができない患者さんは、そもそもがん治療なんて受けない方がいいのでは、といつも思う。
だけど、その同じ宗教が、きっと治療の道行きの中で、心の支えになってくれるのだろう。
一般に宗教心が希薄な我が国。
治癒不能の肺がんと診断されたとき、その心のありようは、宗教心篤い国の患者さんたちとは随分と異なるのではないか。
大多数の国民が同じ宗教を信じている国や、宗教法人が経営母体となっている病院などでは、病院内に宗教施設があると聞く。
進行がんの患者は、往々にして心のバランスを崩しがちだが、心のよりどころに宗教があり、治療の場から近いところに相談できる宗教家がいると、こうした患者は救われるのかもしれない。
進行がんの患者ではないが、私が担当していた90歳を超える独居患者さんが、最近自宅に退院した。
自宅の中を伝い歩きできる程度の身体能力で、果たして自宅退院して生活が成り立つのか、と心配で仕方がなかった。
しかし、試験外出に立ち会ったリハビリスタッフや医療ソーシャルワーカーの話を聞いて、これはいける、と確信した。
家の中で動作確認をして、さあ病院に帰りましょう、というとき、どうしても自宅から坂道を登ったところにあるお寺にお参りして帰りたいと、患者が切望したそうだ。
聞けば、入院前までは毎日欠かさずお参りをしていたという。
退院後もお参りしに行くのであれば、そちらも確認をした方がいいですね、でも誰か付き添いの方がいないとお参りには行けませんよ、と話しながら外に出ると、近所の方々がわらわらと現れたそうだ。
「〇〇さん、やっと帰ってこれたねえ」
「みんな待ってたのよ」
「またお寺にお参りに行くのね」
「一緒に行きましょうか?」
「また毎日お話ししましょうね」
と口々に言っては、患者さんの手を引いてお寺へ導いていく。
近所のおばちゃんたちの介護余力、おそるべし。
ああ、この方は、お寺という触媒を介して、地域のみなさんと強いきずなで結ばれているのだなあ、なんて豊かな生活なんだろうと、スタッフみんなが感じて帰ってきたということだ。
宗教は、他人同士をつなぐ助け合いの窓という一面もあるのだ。
とはいえ、それぞれの宗教のイデオロギーの違いから論争に発展しがちなので、過度に宗教を礼賛するつもりはない。
一方、先祖・家族を大切にする、ということであれば、世界中の誰もが共感できるのではないか。
先祖がいて、頑張ってくれたからこそ、今の自分がある、そして家族があると考えて、先祖を思い、敬い、感謝する、そのくらいの価値観は共有していいのでは。
私は毎週実家の仏壇で祖父母や叔母、父に手を合わせている。
若いころとは違って、盆正月には必ず私と妻の実家に顔を出す。
節目節目で墓参をする。
私は曲がりなりにも仏教徒なのでそうするわけだが、日本古来の土着の神様にもときどき祈りを捧げ、コメとサケとモチをお供えする。
それぞれの宗教的な立場で、それぞれのやり方に沿って、先祖と家族を敬えばそれで足りる。
そうした姿を子供たちにも見せて、先祖を想い、家族をつなぐ、とはどういうことか、言葉ではなく行動で伝えたい。
緊急事態宣言が解除され、制限がいくばくかでも緩められた今だからこそ、それが許される患者・家族には、互いに見つめあい、言葉を交わし、触れ合える幸せを分かち合い、生きて出会えた喜びの気持ちと絆を大切にしてほしい。
進行がんで患者が苦しんでいて、遠く離れた家族と今こそ互いに会うべきときなのに、自粛という壁が立ちはだかる。
健康なときに家族を大切にしないと、いざというときに後悔することになる。
今年に入ってから、世界中でどれだけの遺族が、死にゆく家族と一目会うことすらできずに、辛い別れを味わったことだろうか。
遺骸に会えず、やっと再会を果たしたとき、亡き人は小さな骨壺に収まっている。
そんな羽目に陥ったのは、決して新型コロナウイルス感染症の犠牲者だけではないはずだ。
この仕事をしていると、いろんな切なくやるせない場面に遭遇する。
そんなとき、ふと思うことがある。
ごく一般の日本人にとって、宗教やスピリチュアルは、どのような位置づけなのだろうか。
私は兄弟の中では末っ子で、文字通り目の中に入れても痛くないほど、祖父は私をかわいがってくれたらしい。
しかし、私が祖父とともに写っている写真は、私が知る限り、たった一枚しか残されていない。
まだ私が1歳くらい、よだれかけをしてちょこんと胡坐をかいて座っていて、その隣で浴衣姿の祖父が目を細めて微笑しながら同じように座っている。
祖父が長く生きていれば私の記憶にもいくばくかは残ったのだろうが、祖父は私が2歳のころ他界した。
私の中に、祖父との触れ合いの記憶は残っていない。
しかし、祖父が亡くなった後も、私が大学に進学して実家を去るまで、ある理由で祖父の魂は常に私と共にあった。
その理由のために、一時期はかなり両親に対して複雑な気持ちを持っていたが、徐々に受け入れられるようになった。
これまでの人生で何度か不思議な体験や重要な岐路を経験した。
そのたびに祖父の見えない手に導かれてここまで来れたような気がする。
ハリー・ポッターにとっての両親、ジェームス・ポッターとリリー・ポッターのようなものだ。
きっとこういうのを、スピリチュアルというんだろうな。
じいちゃん、ありがとう。
これからもよろしく。
同居していた叔母を7年前に、父を6年前に亡くし、自ずと仏壇や墓前で手を合わせることが増え、宗教に対する考え方が少しずつ変わってきた。
若いころは、
「宗教なんて、結局患者が死んだ後にしか役に立たない、宗教家なんて、患者の生き死にに何の責任もないところでお金を稼ぐわけだし、客は増える(積み重なる)一方で減らないから、こんなおいしい商売はないよな」
なんて不信心極まりない考えを持っていた。
あくまで仕事最優先で、お盆に帰省することなんてまずなかった。
今でも、医者は現世利益のためにのみ存在する、という基本的な考え方は変わらない。
しかし、治癒不能の肺がん患者さんに接したとき、宗教が心のよりどころになる、いくばくかは救われる、ということはあるような気がする。
宗教的な理由で輸血ができない患者さんは、そもそもがん治療なんて受けない方がいいのでは、といつも思う。
だけど、その同じ宗教が、きっと治療の道行きの中で、心の支えになってくれるのだろう。
一般に宗教心が希薄な我が国。
治癒不能の肺がんと診断されたとき、その心のありようは、宗教心篤い国の患者さんたちとは随分と異なるのではないか。
大多数の国民が同じ宗教を信じている国や、宗教法人が経営母体となっている病院などでは、病院内に宗教施設があると聞く。
進行がんの患者は、往々にして心のバランスを崩しがちだが、心のよりどころに宗教があり、治療の場から近いところに相談できる宗教家がいると、こうした患者は救われるのかもしれない。
進行がんの患者ではないが、私が担当していた90歳を超える独居患者さんが、最近自宅に退院した。
自宅の中を伝い歩きできる程度の身体能力で、果たして自宅退院して生活が成り立つのか、と心配で仕方がなかった。
しかし、試験外出に立ち会ったリハビリスタッフや医療ソーシャルワーカーの話を聞いて、これはいける、と確信した。
家の中で動作確認をして、さあ病院に帰りましょう、というとき、どうしても自宅から坂道を登ったところにあるお寺にお参りして帰りたいと、患者が切望したそうだ。
聞けば、入院前までは毎日欠かさずお参りをしていたという。
退院後もお参りしに行くのであれば、そちらも確認をした方がいいですね、でも誰か付き添いの方がいないとお参りには行けませんよ、と話しながら外に出ると、近所の方々がわらわらと現れたそうだ。
「〇〇さん、やっと帰ってこれたねえ」
「みんな待ってたのよ」
「またお寺にお参りに行くのね」
「一緒に行きましょうか?」
「また毎日お話ししましょうね」
と口々に言っては、患者さんの手を引いてお寺へ導いていく。
近所のおばちゃんたちの介護余力、おそるべし。
ああ、この方は、お寺という触媒を介して、地域のみなさんと強いきずなで結ばれているのだなあ、なんて豊かな生活なんだろうと、スタッフみんなが感じて帰ってきたということだ。
宗教は、他人同士をつなぐ助け合いの窓という一面もあるのだ。
とはいえ、それぞれの宗教のイデオロギーの違いから論争に発展しがちなので、過度に宗教を礼賛するつもりはない。
一方、先祖・家族を大切にする、ということであれば、世界中の誰もが共感できるのではないか。
先祖がいて、頑張ってくれたからこそ、今の自分がある、そして家族があると考えて、先祖を思い、敬い、感謝する、そのくらいの価値観は共有していいのでは。
私は毎週実家の仏壇で祖父母や叔母、父に手を合わせている。
若いころとは違って、盆正月には必ず私と妻の実家に顔を出す。
節目節目で墓参をする。
私は曲がりなりにも仏教徒なのでそうするわけだが、日本古来の土着の神様にもときどき祈りを捧げ、コメとサケとモチをお供えする。
それぞれの宗教的な立場で、それぞれのやり方に沿って、先祖と家族を敬えばそれで足りる。
そうした姿を子供たちにも見せて、先祖を想い、家族をつなぐ、とはどういうことか、言葉ではなく行動で伝えたい。
緊急事態宣言が解除され、制限がいくばくかでも緩められた今だからこそ、それが許される患者・家族には、互いに見つめあい、言葉を交わし、触れ合える幸せを分かち合い、生きて出会えた喜びの気持ちと絆を大切にしてほしい。
2020年06月02日
MET exon 14 skipping mutationとtepotinib
tepotinibのことがNew England Journal of Medicineに掲載されていたので、要約だけ。
過去の記事と若干データが異なるが、updateされたということだろうか。
http://oitahaiganpractice.junglekouen.com/e973397.html
Tepotinib in Non–Small-Cell Lung Cancer with MET Exon 14 Skipping Mutations
Paul K. Paik, M.D. et al., N Engl J Med 2020
May 29, 2020, DOI: 10.1056/NEJMoa2004407
背景:
転写RNAのスプライシング部位の異常に起因し、正常な翻訳(蛋白質合成)ができなくなるMET exon 14スキッピング変異は、非小細胞肺がん患者の3-4%に認められる。本患者群に対して、METに高い選択性を有する分子標的薬であるtepotinibの効果と安全性を評価した。
方法:
今回のオープンラベル、第II相試験において、MET exon 14スキッピング変異を有する進行非小細胞肺がん患者を対象に、tepotinib 500mg/日を1日1回、参加者に内服してもらった。主要評価項目は、独立評価委員会により評価された奏効割合で、少なくとも9ヶ月以上追跡調査されている患者のみを対象とした。奏効割合は、MET exon 14スキッピング変異がリキッド・バイオプシーで検出されたか、あるいは組織生検標本で検出されたかによって層別解析した。
結果:
2020年1月1日までに、総計152人の患者がtepotinibを使用して。99人が少なくとも9ヶ月以上の追跡調査を受けた。全体の奏効割合は46%(95%信頼区間は36-57%)で、奏効持続期間中央値は11.1ヶ月(95%信頼区間は7.2ヶ月以上)だった。リキッド・バイオプシーでMET exon 14スキッピング変異が確認された患者群66人では、奏効割合は48%(95%信頼区間は36-61%)で、組織診断で確認された患者群60人では、奏効割合は50%(95%信頼区間は37-63%)だった。27人の患者は、両方の検査でMET exon 14スキッピング変異が確認されていた。担当医評価による奏効割合は56%(95%信頼区間は45-66%)で、前治療の内容にかかわらず同様の結果だった。
Tepotinibに関連すると思われるGrade 3以上の有害事象は全体の28%で認められ、末梢性浮腫も7%で認められた。Tepotinibの投与中止を余儀なくされる有害事象は、全体の11%で認めた。治療開始前と治療中にリキッド・バイオプシーサンプルを採取した患者では、循環腫瘍DNAに改善が見られた患者は全体の67%だった。
結論:
MET exon 14スキッピング変異を有する進行非小細胞肺がん患者では、tepotinibによる治療は約半数の患者に対して部分奏効をもたらした。Grade 3以上の有害事象としては、末梢性浮腫が主たるものだった。
過去の記事と若干データが異なるが、updateされたということだろうか。
http://oitahaiganpractice.junglekouen.com/e973397.html
Tepotinib in Non–Small-Cell Lung Cancer with MET Exon 14 Skipping Mutations
Paul K. Paik, M.D. et al., N Engl J Med 2020
May 29, 2020, DOI: 10.1056/NEJMoa2004407
背景:
転写RNAのスプライシング部位の異常に起因し、正常な翻訳(蛋白質合成)ができなくなるMET exon 14スキッピング変異は、非小細胞肺がん患者の3-4%に認められる。本患者群に対して、METに高い選択性を有する分子標的薬であるtepotinibの効果と安全性を評価した。
方法:
今回のオープンラベル、第II相試験において、MET exon 14スキッピング変異を有する進行非小細胞肺がん患者を対象に、tepotinib 500mg/日を1日1回、参加者に内服してもらった。主要評価項目は、独立評価委員会により評価された奏効割合で、少なくとも9ヶ月以上追跡調査されている患者のみを対象とした。奏効割合は、MET exon 14スキッピング変異がリキッド・バイオプシーで検出されたか、あるいは組織生検標本で検出されたかによって層別解析した。
結果:
2020年1月1日までに、総計152人の患者がtepotinibを使用して。99人が少なくとも9ヶ月以上の追跡調査を受けた。全体の奏効割合は46%(95%信頼区間は36-57%)で、奏効持続期間中央値は11.1ヶ月(95%信頼区間は7.2ヶ月以上)だった。リキッド・バイオプシーでMET exon 14スキッピング変異が確認された患者群66人では、奏効割合は48%(95%信頼区間は36-61%)で、組織診断で確認された患者群60人では、奏効割合は50%(95%信頼区間は37-63%)だった。27人の患者は、両方の検査でMET exon 14スキッピング変異が確認されていた。担当医評価による奏効割合は56%(95%信頼区間は45-66%)で、前治療の内容にかかわらず同様の結果だった。
Tepotinibに関連すると思われるGrade 3以上の有害事象は全体の28%で認められ、末梢性浮腫も7%で認められた。Tepotinibの投与中止を余儀なくされる有害事象は、全体の11%で認めた。治療開始前と治療中にリキッド・バイオプシーサンプルを採取した患者では、循環腫瘍DNAに改善が見られた患者は全体の67%だった。
結論:
MET exon 14スキッピング変異を有する進行非小細胞肺がん患者では、tepotinibによる治療は約半数の患者に対して部分奏効をもたらした。Grade 3以上の有害事象としては、末梢性浮腫が主たるものだった。



