2018年10月24日
Entrectinib - ROS1 / NTRK inhibitor, underconstruction
以前、ROS1融合遺伝子陽性肺がんで、クリゾチニブ耐性になっちゃったらどうしよう、という相談を頂き、苦し紛れに以下の記事を書いた。
http://oitahaiganpractice.junglekouen.com/e930157.html
苦し紛れで書いた記事をご覧になった別の方から、
「実は、家族が子宮原発の小細胞癌で、主治医に調べてもらったらROS1融合遺伝子陽性で・・・」
という、更に難しいご質問を頂いて、しどろもどろになりながらもできる限りのお答えをした。
その方が検討しておられたEntrectinibの臨床試験、結局適応基準を満たせず参加しなかったとのことだった。
2018年10月22日付で、Roche / 中外製薬からこんなプレスリリースが発出されていたようだ。
https://www.chugai-pharm.co.jp/news/detail/20181022160001_776.html
ROS1 / NTRK、いずれも肺がんで認められる頻度は低い異常だが、効率よく検出される検査技術が望まれる。
次世代シーケンサーでの網羅的解析、実地臨床への適用が待ち遠しい。
http://oitahaiganpractice.junglekouen.com/e942705.html
一方、改訂版LC-SCRUMの当院倫理審査委員会が1週間前に行われ、承認された。
事務局に報告し、現在は患者登録用の資材が届くのを待っているところだ。
http://oitahaiganpractice.junglekouen.com/e930157.html
苦し紛れで書いた記事をご覧になった別の方から、
「実は、家族が子宮原発の小細胞癌で、主治医に調べてもらったらROS1融合遺伝子陽性で・・・」
という、更に難しいご質問を頂いて、しどろもどろになりながらもできる限りのお答えをした。
その方が検討しておられたEntrectinibの臨床試験、結局適応基準を満たせず参加しなかったとのことだった。
2018年10月22日付で、Roche / 中外製薬からこんなプレスリリースが発出されていたようだ。
https://www.chugai-pharm.co.jp/news/detail/20181022160001_776.html
ROS1 / NTRK、いずれも肺がんで認められる頻度は低い異常だが、効率よく検出される検査技術が望まれる。
次世代シーケンサーでの網羅的解析、実地臨床への適用が待ち遠しい。
http://oitahaiganpractice.junglekouen.com/e942705.html
一方、改訂版LC-SCRUMの当院倫理審査委員会が1週間前に行われ、承認された。
事務局に報告し、現在は患者登録用の資材が届くのを待っているところだ。
2018年10月23日
JO25567試験とNEJ026試験・・・エルロチニブ+ベバシズマブの位置づけは・・・?
ずっと棚上げにしてきた話題だが、今日は思い切って取り上げる。
以前もちょっとだけ触れた。
http://oitahaiganpractice.junglekouen.com/e935118.html
EGFR遺伝子変異陽性の進行非小細胞肺がん患者さんに対して、エルロチニブ単剤療法とエルロチニブ+ベバシズマブ併用療法の効果を検証する臨床試験。
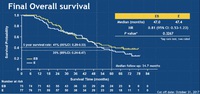
ランダム化第II相試験のJO25567試験は、4年前には論文化されていて、エルロチニブ+ベバシズマブ療法が有意に無増悪生存期間を延長し、ベバシズマブの新たな可能性を示すepoch makingな結果を残した。
http://oitahaiganpractice.junglekouen.com/e751839.html
一方、この当時から全生存期間に大きな差がついていないことが意識されていた。
今年2018年の米国臨床腫瘍学会では、追跡調査の結果、無増悪生存期間には差がつくものの、全生存期間には差がつかないことが改めて報告された。
無増悪生存期間は延長するものの、全生存期間には寄与しないというベバシズマブの特性が、分子標的薬との併用でも追認されるという結果に終わった。
もちろん、無増悪生存期間の延長には意味がある。
医療従事者は全生存期間が金科玉条であり、無増悪生存期間はあくまでも副次的な目標、ととらえがちだが、患者さんやご家族の話を伺っていると、仮に全生存期間が延長しなかったとしても、無増悪生存期間が延長するなら治療の意義は十分にあるようだ。
問題は、無増悪生存期間の延長と引き換えに、ベバシズマブ特有の有害事象リスクを受け入れられるかどうかということだろう。
なお、サブグループ解析を見ると、術後再発患者では(対象患者数が少なく信頼性は落ちるものの)エルロチニブ+ベバシズマブ併用療法の方が優位に生存期間を延長したようだ。
病勢進行後の後治療については、オシメルチニブを含めて、両群に差異はなかった。



さて、一方のNEJ026試験。
JO25567試験の結果が公表されたときは、このデータなら第II相試験の段階で実地臨床に応用しても差し支えないだろうという議論が大勢だった。
実際に、欧州ではJO25567試験とBELIEF試験のデータを背景として、エルロチニブ+ベバシズマブ併用療法を規制当局が承認した。
http://oitahaiganpractice.junglekouen.com/e851167.html
http://oitahaiganpractice.junglekouen.com/e906132.html
http://oitahaiganpractice.junglekouen.com/e914142.html
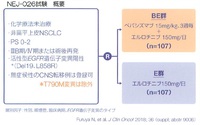
しかし、(私を含め)第III相臨床試験原理主義者が多い我が国では、第III相試験できちんと検証すべきだろうということになり、NEJグループがNEJ026試験を立ち上げた。
基本的には第II相試験であるJO25567試験の内容を第III相ランダム化比較試験へ拡大したという位置づけだが、病勢増悪後の後治療も規定されている。
エルロチニブ単剤療法(E)群では、後治療はプラチナ製剤+ペメトレキセド併用療法からペメトレキセド維持療法、エルロチニブ+ベバシズマブ併用療法(BE)群では、後治療はプラチナ製剤+ペメトレキセド+ベバシズマブ併用療法からペメトレキセド+ベバシズマブ併用維持療法、というように、併用群ではbeyond PDでのベバシズマブ継続使用が規定されていた。
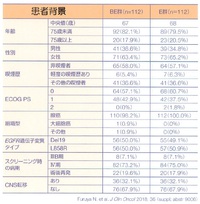
結果として、E群およびBE群の無増悪生存期間中央値はそれぞれ13.3ヶ月、16.9ヶ月でハザード比は0.65(95%信頼区間は0.417-0.877)、p値は0.01573と有意にBE群で優れていた。

さらに、EGFR遺伝子変異型別のサブグループ解析では、Exon 19欠失変異では両群に有意差は認められず、Exon21点突然変異ではBE群が有意に優れる結果だった。

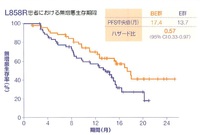
有害事象は、予想通り高血圧・タンパク尿・出血がBE群で高頻度となっており、無増悪生存期間延長のためにこれを許容できるかが焦点である。
なんにせよ、JO25567試験で認められた無増悪生存期間延長効果がNEJ026試験でも認められたわけで、Exon 21変異でより効果が高かったことを考えると、若い患者でExon 19変異の人はアファチニブ、Exon 21変異の人はエルロチニブ+ベバシズマブといった使い分けもできるのではないだろうか。
まだ先の話だが、おそらく全生存期間はJO25567試験の結果を追認することになるだろう。
しかし、JO25567試験で確認された、両群とも生存期間中央値が47ヶ月以上という事実、従来のエルロチニブの臨床効果と比較すると、やや長すぎるような違和感を覚えるのは私だけだろうか。
要は生存期間中央値が4年ということであり、これはLUX-Lung 3試験から得られた日本人に対するアファチニブの生存期間延長効果に匹敵する。
http://oitahaiganpractice.junglekouen.com/e821581.html
以前もちょっとだけ触れた。
http://oitahaiganpractice.junglekouen.com/e935118.html
EGFR遺伝子変異陽性の進行非小細胞肺がん患者さんに対して、エルロチニブ単剤療法とエルロチニブ+ベバシズマブ併用療法の効果を検証する臨床試験。
ランダム化第II相試験のJO25567試験は、4年前には論文化されていて、エルロチニブ+ベバシズマブ療法が有意に無増悪生存期間を延長し、ベバシズマブの新たな可能性を示すepoch makingな結果を残した。
http://oitahaiganpractice.junglekouen.com/e751839.html
一方、この当時から全生存期間に大きな差がついていないことが意識されていた。
今年2018年の米国臨床腫瘍学会では、追跡調査の結果、無増悪生存期間には差がつくものの、全生存期間には差がつかないことが改めて報告された。
無増悪生存期間は延長するものの、全生存期間には寄与しないというベバシズマブの特性が、分子標的薬との併用でも追認されるという結果に終わった。
もちろん、無増悪生存期間の延長には意味がある。
医療従事者は全生存期間が金科玉条であり、無増悪生存期間はあくまでも副次的な目標、ととらえがちだが、患者さんやご家族の話を伺っていると、仮に全生存期間が延長しなかったとしても、無増悪生存期間が延長するなら治療の意義は十分にあるようだ。
問題は、無増悪生存期間の延長と引き換えに、ベバシズマブ特有の有害事象リスクを受け入れられるかどうかということだろう。
なお、サブグループ解析を見ると、術後再発患者では(対象患者数が少なく信頼性は落ちるものの)エルロチニブ+ベバシズマブ併用療法の方が優位に生存期間を延長したようだ。
病勢進行後の後治療については、オシメルチニブを含めて、両群に差異はなかった。




さて、一方のNEJ026試験。
JO25567試験の結果が公表されたときは、このデータなら第II相試験の段階で実地臨床に応用しても差し支えないだろうという議論が大勢だった。
実際に、欧州ではJO25567試験とBELIEF試験のデータを背景として、エルロチニブ+ベバシズマブ併用療法を規制当局が承認した。
http://oitahaiganpractice.junglekouen.com/e851167.html
http://oitahaiganpractice.junglekouen.com/e906132.html
http://oitahaiganpractice.junglekouen.com/e914142.html
しかし、(私を含め)第III相臨床試験原理主義者が多い我が国では、第III相試験できちんと検証すべきだろうということになり、NEJグループがNEJ026試験を立ち上げた。
基本的には第II相試験であるJO25567試験の内容を第III相ランダム化比較試験へ拡大したという位置づけだが、病勢増悪後の後治療も規定されている。
エルロチニブ単剤療法(E)群では、後治療はプラチナ製剤+ペメトレキセド併用療法からペメトレキセド維持療法、エルロチニブ+ベバシズマブ併用療法(BE)群では、後治療はプラチナ製剤+ペメトレキセド+ベバシズマブ併用療法からペメトレキセド+ベバシズマブ併用維持療法、というように、併用群ではbeyond PDでのベバシズマブ継続使用が規定されていた。


結果として、E群およびBE群の無増悪生存期間中央値はそれぞれ13.3ヶ月、16.9ヶ月でハザード比は0.65(95%信頼区間は0.417-0.877)、p値は0.01573と有意にBE群で優れていた。

さらに、EGFR遺伝子変異型別のサブグループ解析では、Exon 19欠失変異では両群に有意差は認められず、Exon21点突然変異ではBE群が有意に優れる結果だった。


有害事象は、予想通り高血圧・タンパク尿・出血がBE群で高頻度となっており、無増悪生存期間延長のためにこれを許容できるかが焦点である。
なんにせよ、JO25567試験で認められた無増悪生存期間延長効果がNEJ026試験でも認められたわけで、Exon 21変異でより効果が高かったことを考えると、若い患者でExon 19変異の人はアファチニブ、Exon 21変異の人はエルロチニブ+ベバシズマブといった使い分けもできるのではないだろうか。
まだ先の話だが、おそらく全生存期間はJO25567試験の結果を追認することになるだろう。
しかし、JO25567試験で確認された、両群とも生存期間中央値が47ヶ月以上という事実、従来のエルロチニブの臨床効果と比較すると、やや長すぎるような違和感を覚えるのは私だけだろうか。
要は生存期間中央値が4年ということであり、これはLUX-Lung 3試験から得られた日本人に対するアファチニブの生存期間延長効果に匹敵する。
http://oitahaiganpractice.junglekouen.com/e821581.html
2018年10月17日
デュルバルマブは局所進行非小細胞肺がんの生存期間を有意に延長した(PACIFIC試験)
我が国の実地臨床に導入済みだが、局所進行非小細胞肺がんに対する放射線化学療法後のデュルバルマブ療法の効果を検証した第III相PACIFIC試験の生存期間解析結果が論文報告された。
既にNew England Journal of Medicine誌に無増悪生存期間の解析結果が報告済みだったが、全生存期間解析結果が改めて本誌に採択されたと言うこと自体が、いかに本治療がEpoch Makingであるかを物語っている。
デュルバルマブ群の生存期間中央値は、25.2ヶ月の経過観察期間経過時点でも全く見通せない。
生存期間中央値の95%信頼区間は34.7ヶ月以上とされており、早い話が95%程度の確率でほぼ3年生存できるということだ。
個人的に本治療が意義深いと感じるのは、以下のような点だ。
・治癒を目指した治療においてきっちりと結果が出て、かつ生存曲線における両治療群間の差が末広がりになりつつあること
・バイオマーカーによる患者選別をしておらず、放射線化学療法終了時点で病勢進行がなければ誰にでも適用可能であること
そうは言いながら、我が国で本治療を行う場合には、放射線肺臓炎を含めた間質性肺炎の取り扱いには注意したい。
最近、放射線化学療法後、病勢進行を待たずににペンブロリズマブを使用し、不幸な転帰をたどった患者がいた。
Overall Survival with Durvalumab after Chemoradiotherapy in Stage III NSCLC
Antonia et al., N Engl J Med 2018
DOI: 10.1056/NEJMoa1809597
背景:
本第III相試験(PACIFIC試験)の前回の解析において、臨床病期III期、切除不能の非小細胞肺癌と診断され、抗がん薬・根治的胸部放射線同時併用療法後に病勢進行を認めなかった患者では、デュルバルマブがプラセボ(偽薬)に対して有意に無増悪生存期間を延長することが明らかとなった。今回は、もうひとつの主要評価項目である全生存期間解析結果に関して報告する。
方法:
本試験に参加した患者をデュルバルマブ群(デュルバルマブを体重1kgあたり10mgの投与量で2週ごとに投与、最長12ヶ月まで)とプラセボ群(偽薬を2週ごとに投与、最長12ヶ月まで)に2:1の比率で無作為割付した。(また、プロトコール治療を12ヶ月まで継続し、その時点で病勢進行が認められなかった場合には継続投与可とし、また一旦プロトコール治療を完遂して無治療経過観察の後に病勢進行した場合にも、プロトコール治療再開可とされた。)年齢、性別、喫煙歴を割付調整因子とし、最後の胸部放射線照射日から起算して1-42日の間で無作為割付を行った。主要評価項目は無増悪生存期間と全生存期間とした。最終解析は、無作為割付された計713人の患者において、概ね491の死亡イベントが観察された際(イベント発生率69%)に行うように設定された。中間解析は、同様に285件、393件の死亡イベントが観察された際に行うことになっていた。この計画に基づき、初回の中間解析は299件の死亡イベントが確認された2018年3月22日時点をデータカットオフとして行った。中間解析における有効中止の基準をp=0.00274としていたが、今回の中間解析時点でこの基準を達成したため、データを公表することになった。
結果:
2014年5月から2016年4月までの間に、計713人の患者が無作為割付され、709人(99.4%)がプロトコール治療を受けた(デュルバルマブ群473人、プラセボ群236人)。2018年3月22日のデータカットオフまでに299件の死亡イベント(デュルバルマブ群183件、プラセボ群116件)が観察された。経過観察期間中央値は25.2ヶ月だった。デュルバルマブ群とプラセボ群の比較において、1年生存割合はそれぞれ83.1%(95%信頼区間は79.4-86.2%)および75.3%(95%信頼区間は69.2-80.4%)だった。2年生存割合はそれぞれ66.3%(95%信頼区間は61.7-70.4%)および55.6%(95%信頼区間は48.9-61.8%)であり、両側検定におけるp値は0.0025で、デュルバルマブが有意に生存期間を延長した。生存期間中央値はそれぞれ未到達(95%信頼区間は34.7ヶ月-未到達)および28.7ヶ月(95%信頼区間は22.9ヶ月-未到達)だった。ハザード比は0.68、99.73%信頼区間は0.47-0.997で、p=0.0025の有意水準だった。無増悪生存期間中央値はそれぞれ17.2ヶ月(95%信頼区間は13.1-23.9ヶ月)および5.6ヶ月(95%信頼区間は4.6-7.7ヶ月)だった(ハザード比は0.51、95%信頼区間は0.41-0.63)。副次評価項目である、患者に遠隔転移イベントもしくは死亡イベントが発生するまでの期間の中央値は、それぞれ28.3ヶ月および16.2ヶ月だった(ハザード比0.53、95%信頼区間0.41-0.68)。Grade 3-4の有害事象発生割合はそれぞれ30.5%、26.1%であり、プロトコール治療の毒性中止にいたる割合はそれぞれ15.4%、9.8%だった。
結論:
本試験において、デュルバルマブはプラセボに比して、有意に生存期間を延長した。
既にNew England Journal of Medicine誌に無増悪生存期間の解析結果が報告済みだったが、全生存期間解析結果が改めて本誌に採択されたと言うこと自体が、いかに本治療がEpoch Makingであるかを物語っている。
デュルバルマブ群の生存期間中央値は、25.2ヶ月の経過観察期間経過時点でも全く見通せない。
生存期間中央値の95%信頼区間は34.7ヶ月以上とされており、早い話が95%程度の確率でほぼ3年生存できるということだ。
個人的に本治療が意義深いと感じるのは、以下のような点だ。
・治癒を目指した治療においてきっちりと結果が出て、かつ生存曲線における両治療群間の差が末広がりになりつつあること
・バイオマーカーによる患者選別をしておらず、放射線化学療法終了時点で病勢進行がなければ誰にでも適用可能であること
そうは言いながら、我が国で本治療を行う場合には、放射線肺臓炎を含めた間質性肺炎の取り扱いには注意したい。
最近、放射線化学療法後、病勢進行を待たずににペンブロリズマブを使用し、不幸な転帰をたどった患者がいた。
Overall Survival with Durvalumab after Chemoradiotherapy in Stage III NSCLC
Antonia et al., N Engl J Med 2018
DOI: 10.1056/NEJMoa1809597
背景:
本第III相試験(PACIFIC試験)の前回の解析において、臨床病期III期、切除不能の非小細胞肺癌と診断され、抗がん薬・根治的胸部放射線同時併用療法後に病勢進行を認めなかった患者では、デュルバルマブがプラセボ(偽薬)に対して有意に無増悪生存期間を延長することが明らかとなった。今回は、もうひとつの主要評価項目である全生存期間解析結果に関して報告する。
方法:
本試験に参加した患者をデュルバルマブ群(デュルバルマブを体重1kgあたり10mgの投与量で2週ごとに投与、最長12ヶ月まで)とプラセボ群(偽薬を2週ごとに投与、最長12ヶ月まで)に2:1の比率で無作為割付した。(また、プロトコール治療を12ヶ月まで継続し、その時点で病勢進行が認められなかった場合には継続投与可とし、また一旦プロトコール治療を完遂して無治療経過観察の後に病勢進行した場合にも、プロトコール治療再開可とされた。)年齢、性別、喫煙歴を割付調整因子とし、最後の胸部放射線照射日から起算して1-42日の間で無作為割付を行った。主要評価項目は無増悪生存期間と全生存期間とした。最終解析は、無作為割付された計713人の患者において、概ね491の死亡イベントが観察された際(イベント発生率69%)に行うように設定された。中間解析は、同様に285件、393件の死亡イベントが観察された際に行うことになっていた。この計画に基づき、初回の中間解析は299件の死亡イベントが確認された2018年3月22日時点をデータカットオフとして行った。中間解析における有効中止の基準をp=0.00274としていたが、今回の中間解析時点でこの基準を達成したため、データを公表することになった。
結果:
2014年5月から2016年4月までの間に、計713人の患者が無作為割付され、709人(99.4%)がプロトコール治療を受けた(デュルバルマブ群473人、プラセボ群236人)。2018年3月22日のデータカットオフまでに299件の死亡イベント(デュルバルマブ群183件、プラセボ群116件)が観察された。経過観察期間中央値は25.2ヶ月だった。デュルバルマブ群とプラセボ群の比較において、1年生存割合はそれぞれ83.1%(95%信頼区間は79.4-86.2%)および75.3%(95%信頼区間は69.2-80.4%)だった。2年生存割合はそれぞれ66.3%(95%信頼区間は61.7-70.4%)および55.6%(95%信頼区間は48.9-61.8%)であり、両側検定におけるp値は0.0025で、デュルバルマブが有意に生存期間を延長した。生存期間中央値はそれぞれ未到達(95%信頼区間は34.7ヶ月-未到達)および28.7ヶ月(95%信頼区間は22.9ヶ月-未到達)だった。ハザード比は0.68、99.73%信頼区間は0.47-0.997で、p=0.0025の有意水準だった。無増悪生存期間中央値はそれぞれ17.2ヶ月(95%信頼区間は13.1-23.9ヶ月)および5.6ヶ月(95%信頼区間は4.6-7.7ヶ月)だった(ハザード比は0.51、95%信頼区間は0.41-0.63)。副次評価項目である、患者に遠隔転移イベントもしくは死亡イベントが発生するまでの期間の中央値は、それぞれ28.3ヶ月および16.2ヶ月だった(ハザード比0.53、95%信頼区間0.41-0.68)。Grade 3-4の有害事象発生割合はそれぞれ30.5%、26.1%であり、プロトコール治療の毒性中止にいたる割合はそれぞれ15.4%、9.8%だった。
結論:
本試験において、デュルバルマブはプラセボに比して、有意に生存期間を延長した。
2018年10月16日
Avelumabの二次治療はこけてしまった・・・JAVELIN Lung 200試験
多少の条件の違いはあれ、現在我が国では非小細胞肺癌に対する二次治療として、ニボルマブ、ペンブロリズマブ、アテゾリズマブといった複数の免疫チェックポイント阻害薬を使うことができる。
今回登場するAvelumabは、アテゾリズマブと同様にPD-L1阻害薬に分類され、開発中の免疫チェックポイント阻害薬の話題になると必ず話題に上ってくる薬だった。
しかし、残念ながら今回の臨床試験では、有効性を証明することはできなかった。
・・・まあ正直言って、同様の治療選択肢が3種あれば十分か、という気もする。
それにしても、今回の要約を読んでいて眉をひそめてしまったのは、ドセタキセル群の治療関連死の割合が4%にも上るということ。
実地臨床での感覚からすると、ちょっと高すぎるような気がする。
臨床試験である以上は、実地臨床よりも体力のある患者が参加しているはずで、それでいてこの数字はちょっと高すぎる。
治療関連死の原因内訳をみても、なんだか診断自体があいまいすぎて、よく分からない。
診療の質自体がどうなのか、ちょっと疑問視してしまう。
論文本編ではなく、要約しか読んでいないので、詳細は分からないが、とりあえず以下のリンクが参考になるだろう。
http://oitahaiganpractice.junglekouen.com/e926191.html
Avelumab versus docetaxel in patients with platinum-treated advanced non-small-cell lung cancer (JAVELIN Lung 200): an open-label, randomised, phase 3 study
Fabrice Barlesi et al., Lancet Oncol September 24, 2018
DOI:https://doi.org/10.1016/S1470-2045(18)30673-9
背景:
進行非小細胞肺がん患者の治療において、免疫チェックポイント関連分子であるPD-1 / PD-L1を治療標的とした抗体は臨床的効果を示した。今回は、プラチナ併用化学療法治療歴のある非小細胞肺がん患者に対する抗PD-L1抗体Avelumabの効果と安全性について検証した。
方法:
JAVELIN Lung 200試験は、多施設共同、オープンラベル、無作為化、第III相臨床試験として計画され、31か国から173施設が参加した。以下を適格条件とした:18歳以上、臨床病期IIIB期 / IV期 / 術後再発、プラチナ併用化学療法後に病勢進行が認められた、ECOG-PS 0 / 1、期待される生存期間12週間以上、骨髄機能・腎機能・肝機能が適切に保たれている。
参加者はAvelumab群(10mg/kg, 2週間ごと投与)とドセタキセル群(75mg/㎡、3週間ごと投与)のいずれかに1:1の比率で無作為に割り付けられた。割り付け調整因子は腫瘍のPD-L1(73-10抗体で評価)発現状態(腫瘍細胞の1%以上か、1%未満か)、組織型(扁平上皮癌か、非扁平上皮癌か)とした。主要評価項目は全生存期間で、PD-L1陽性の患者集団において概ね337イベントが発生した時点で解析を行う予定とした。治療効果はまずPD-L1陽性患者集団(腫瘍細胞の1%以上がPD-L1陽性)において解析され、引き続いて全ての患者集団で解析するといった階層的な手法をとった。安全性は少なくとも1コースのプロトコール治療が行われた全ての患者集団で解析した。
結果:
2015年3月24日から2017年1月23日にかけて、792人の患者が本試験に登録され、Avelumab群に396人、ドセタキセル群に396人が無作為に割り付けられた。Avelumab群のうち264人、ドセタキセル群のうち265人はPD-L1陽性と判定された。PD-L1陽性患者集団において、生存期間中央値に有意な差はなかった(Avelumab群11.4ヶ月(95%信頼区間は9.4-13.9ヶ月)vs ドセタキセル群10.3ヶ月(95%信頼区間8.5-13.0ヶ月)、ハザード比0.90(95%信頼区間0.72-1.12)、片側検定でのp=0.16)。治療関連有害事象はAvelumab群393人のうち251人(64%)、ドセタキセル群365人のうち313人(86%)で認めた。頻度の高かったGrade 3-5の有害事象は、Avelumab群では点滴時の過敏反応(infusion related reaction)が6人(2%)、リパーゼ上昇が4人(1%)で、ドセタキセル群では好中球減少が51人(14%)、発熱性好中球減少が37人(10%)だった。重篤な治療関連有害事象はAvelumab群で34人(9%)、ドセタキセル群で75人(21%)だった。治療関連死はAvelumab群で4人(1%)で、間質性肺炎2人、急性腎障害1人、自己免疫性心筋炎+心不全+呼吸不全1人だった。同様にドセタキセル群では14人(4%)で、肺炎3人、発熱性好中球減少1人、敗血症性ショック1人、敗血症性ショックを伴う発熱性好中球減少1人、急性呼吸不全1人、心不全1人、腎障害1人、粘膜炎を伴う白血球減少1人、感染症1人、好中球減少を伴う感染症1人、脱水1人で、あと1人は原因不明だった。
結論:
プラチナ併用化学療法後に病勢進行を来し、PD-L1陽性の非小細胞肺癌に対し、Avelumabはドセタキセルに対する優越性を示せなかった(が、安全性は高かった)。
今回登場するAvelumabは、アテゾリズマブと同様にPD-L1阻害薬に分類され、開発中の免疫チェックポイント阻害薬の話題になると必ず話題に上ってくる薬だった。
しかし、残念ながら今回の臨床試験では、有効性を証明することはできなかった。
・・・まあ正直言って、同様の治療選択肢が3種あれば十分か、という気もする。
それにしても、今回の要約を読んでいて眉をひそめてしまったのは、ドセタキセル群の治療関連死の割合が4%にも上るということ。
実地臨床での感覚からすると、ちょっと高すぎるような気がする。
臨床試験である以上は、実地臨床よりも体力のある患者が参加しているはずで、それでいてこの数字はちょっと高すぎる。
治療関連死の原因内訳をみても、なんだか診断自体があいまいすぎて、よく分からない。
診療の質自体がどうなのか、ちょっと疑問視してしまう。
論文本編ではなく、要約しか読んでいないので、詳細は分からないが、とりあえず以下のリンクが参考になるだろう。
http://oitahaiganpractice.junglekouen.com/e926191.html
Avelumab versus docetaxel in patients with platinum-treated advanced non-small-cell lung cancer (JAVELIN Lung 200): an open-label, randomised, phase 3 study
Fabrice Barlesi et al., Lancet Oncol September 24, 2018
DOI:https://doi.org/10.1016/S1470-2045(18)30673-9
背景:
進行非小細胞肺がん患者の治療において、免疫チェックポイント関連分子であるPD-1 / PD-L1を治療標的とした抗体は臨床的効果を示した。今回は、プラチナ併用化学療法治療歴のある非小細胞肺がん患者に対する抗PD-L1抗体Avelumabの効果と安全性について検証した。
方法:
JAVELIN Lung 200試験は、多施設共同、オープンラベル、無作為化、第III相臨床試験として計画され、31か国から173施設が参加した。以下を適格条件とした:18歳以上、臨床病期IIIB期 / IV期 / 術後再発、プラチナ併用化学療法後に病勢進行が認められた、ECOG-PS 0 / 1、期待される生存期間12週間以上、骨髄機能・腎機能・肝機能が適切に保たれている。
参加者はAvelumab群(10mg/kg, 2週間ごと投与)とドセタキセル群(75mg/㎡、3週間ごと投与)のいずれかに1:1の比率で無作為に割り付けられた。割り付け調整因子は腫瘍のPD-L1(73-10抗体で評価)発現状態(腫瘍細胞の1%以上か、1%未満か)、組織型(扁平上皮癌か、非扁平上皮癌か)とした。主要評価項目は全生存期間で、PD-L1陽性の患者集団において概ね337イベントが発生した時点で解析を行う予定とした。治療効果はまずPD-L1陽性患者集団(腫瘍細胞の1%以上がPD-L1陽性)において解析され、引き続いて全ての患者集団で解析するといった階層的な手法をとった。安全性は少なくとも1コースのプロトコール治療が行われた全ての患者集団で解析した。
結果:
2015年3月24日から2017年1月23日にかけて、792人の患者が本試験に登録され、Avelumab群に396人、ドセタキセル群に396人が無作為に割り付けられた。Avelumab群のうち264人、ドセタキセル群のうち265人はPD-L1陽性と判定された。PD-L1陽性患者集団において、生存期間中央値に有意な差はなかった(Avelumab群11.4ヶ月(95%信頼区間は9.4-13.9ヶ月)vs ドセタキセル群10.3ヶ月(95%信頼区間8.5-13.0ヶ月)、ハザード比0.90(95%信頼区間0.72-1.12)、片側検定でのp=0.16)。治療関連有害事象はAvelumab群393人のうち251人(64%)、ドセタキセル群365人のうち313人(86%)で認めた。頻度の高かったGrade 3-5の有害事象は、Avelumab群では点滴時の過敏反応(infusion related reaction)が6人(2%)、リパーゼ上昇が4人(1%)で、ドセタキセル群では好中球減少が51人(14%)、発熱性好中球減少が37人(10%)だった。重篤な治療関連有害事象はAvelumab群で34人(9%)、ドセタキセル群で75人(21%)だった。治療関連死はAvelumab群で4人(1%)で、間質性肺炎2人、急性腎障害1人、自己免疫性心筋炎+心不全+呼吸不全1人だった。同様にドセタキセル群では14人(4%)で、肺炎3人、発熱性好中球減少1人、敗血症性ショック1人、敗血症性ショックを伴う発熱性好中球減少1人、急性呼吸不全1人、心不全1人、腎障害1人、粘膜炎を伴う白血球減少1人、感染症1人、好中球減少を伴う感染症1人、脱水1人で、あと1人は原因不明だった。
結論:
プラチナ併用化学療法後に病勢進行を来し、PD-L1陽性の非小細胞肺癌に対し、Avelumabはドセタキセルに対する優越性を示せなかった(が、安全性は高かった)。
2018年10月10日
免疫チェックポイント阻害薬(アテゾリズマブ)、いよいよ肺小細胞癌の領域へ
IMpower133の結果が2018年の世界肺癌会議で公表されたようで、早くも内容が論文化されたようだ。
無理もないことで、多分20年ぶりくらいで、進展型肺小細胞がんの薬物療法に関わる第III相試験において生命予後を改善する新治療が出てきたことになる。
ペンブロリズマブ(第II相試験)もIpilimumab(第III相試験)もこの分野ではこけている。
そうした中、免疫チェックポイント阻害薬の一角であるアテゾリズマブが進展型肺小細胞がんの生存期間中央値を2ヶ月延長した、ということで、小さな改善効果とは言いながら、非常に有意義だと感じる。
アテゾリズマブは既にわが国で製造承認、薬価収載ともに終わっている。
どの程度の日本人患者が本試験に参加したのかは定かでない(きっと近い将来学術集会で明らかにされるだろう)ので、本試験結果を以ってそのまま規制当局が国内使用を許可するかどうかは見通せない。
しかし、仮に適応拡大承認が得られれば、比較的速やかに普及するのではないだろうか。
国民医療費はさらに高騰するが。
論文本体を読み込むと以下のように書いてあり、要約の内容に一部誇張された内容が入っていそうで、注意したい。
・全生存期間と無増悪生存期間をいずれも主要評価項目とした
・全生存期間の解析を先に行って、これにより有意差が確認されたら無増悪生存期間の解析を段階的に行うことにした
・全生存期間の有意水準は両側検定でp=0.045、無増悪生存期間の有意水準は両側検定でp=0.005とした(従って、今回の試験では、無増悪生存期間に有意な改善は認められなかった(p=0.02)ことになる)
・今回は、もともと予定していた中間解析時点で有意な全生存期間の延長が認められたため、結果を公表することになった
・データカットオフは2018年4月(ということは、世界肺癌会議や今回の論文発表に間に合わせるために、かなりの突貫工事でデータのとりまとめを行ったものと想像される)
また、以下のような興味深いことも目に付いた。
・全生存期間についてサブグループ解析を行うと、65歳未満の年齢層では両治療群間に有意差を認めなかったが、65歳以上では有意差が認められ、アテゾリズマブ群の方が優れていた(それぞれの年齢層はほぼ半々であることから、この結果の信頼性は高いと考えられる。数ある臨床試験でも、若年者よりも高齢者の方が予後が優れる、というものはあまり記憶にない)
・脳転移を有する患者群での治療効果は、こうした患者の絶対数が少なかったために解析困難だった
・奏効持続期間は、アテゾリズマブ群の方がかなり長そうだった
・生存曲線を見ると、両群ともに治療開始から半年くらいまでは曲線の下がり方はなだらか(ということは、治療開始から半年間くらいは亡くなる方が少なめだったということ)で、それ以降に両群間の差がついてきた
・censored caseが多いためまだ結論を出すには早いが、非小細胞肺癌におけるこの種の臨床試験に比べると、long survivorはすくなさそう
・そこそこの割合の人が、プロトコール治療中に(進展型小細胞がんであるにもかかわらず)予防的全脳照射を受けた
話題は尽きないが、epoch-makingな治療が登場したことは間違いないし、本論文はonlineで無料で入手できるので(こういう太っ腹なところは流石のトップジャーナルである)、この分野で働く職業人としては是非一読したい。
こうなると、神経内分泌腫瘍の領域にも免疫チェックポイント阻害薬の波がやってくるかもしれない。
First-Line Atezolizumab plus Chemotherapy in Extensive-Stage Small-Cell Lung Cancer.
Horn L. et al., N Engl J Med. 2018 Sep 25.
DOI: 10.1056/NEJMoa1809064. [Epub ahead of print]
PDF: https://www.nejm.org/doi/pdf/10.1056/NEJMoa1809064
背景:
PD-L1とPD-1のシグナル伝達系を阻害することにより腫瘍特異的なT細胞免疫機能を賦活することが、進展型肺小細胞がんの治療に有望であることがすでに示されていた。免疫チェックポイント阻害薬と殺細胞性抗腫瘍薬を併用することにより、相乗効果が得られるかもしれない。
方法:
今回、未治療の進展型肺小細胞がん患者に対してカルボプラチン+エトポシド併用療法に対するアテゾリズマブの上乗せ効果を検証するプラセボ対照二重盲見第III相比較試験を計画した。参加登録した患者は、カルボプラチン+エトポシド併用療法に加えて、アテゾリズマブを使用する群(アテゾリズマブ群)とプラセボを使用する群(プラセボ群)に1:1の割合で無作為に割り付けられた。治療導入期にはそれぞれの治療を3週間ごとに最大4コースまで行い、維持治療期にはアテゾリズマブもしくはプラセボを、忍容不能な毒性にさいなまれるか、RECIST ver.1.1における病勢進行基準を満たすか、ないしは臨床的有益性がもはや認められないと担当医が判断するかまで投与継続された。主要評価項目は無増悪生存期間、全生存期間とした。
結果:
計201人の患者がアテゾリズマブ群へ、202人の患者がプラセボ群に割り付けられた。経過観察期間13.9ヶ月の段階で、生存期間中央値はアテゾリズマブ群で12.3ヶ月、プラセボ群で10.3ヶ月、ハザード比0.70、95%信頼区間は0.54-0.91、p=0.007と、アテゾリズマブ群で有意に優れていた。無増悪生存期間中央値はアテゾリズマブ群で5.2ヶ月、プラセボ群で4.3ヶ月、ハザード比0.77、95%信頼区間は0.62-0.96、p=0.02だった。安全性プロファイルは、それぞれの治療について過去に報告された有害事象とほぼ同様で、新規なものは認めなかった。
結論:
進展が多少細胞肺癌の初回治療において、化学療法にアテゾリズマブを加えることにより、全生存期間(と無増悪生存期間)が有意に延長した。
無理もないことで、多分20年ぶりくらいで、進展型肺小細胞がんの薬物療法に関わる第III相試験において生命予後を改善する新治療が出てきたことになる。
ペンブロリズマブ(第II相試験)もIpilimumab(第III相試験)もこの分野ではこけている。
そうした中、免疫チェックポイント阻害薬の一角であるアテゾリズマブが進展型肺小細胞がんの生存期間中央値を2ヶ月延長した、ということで、小さな改善効果とは言いながら、非常に有意義だと感じる。
アテゾリズマブは既にわが国で製造承認、薬価収載ともに終わっている。
どの程度の日本人患者が本試験に参加したのかは定かでない(きっと近い将来学術集会で明らかにされるだろう)ので、本試験結果を以ってそのまま規制当局が国内使用を許可するかどうかは見通せない。
しかし、仮に適応拡大承認が得られれば、比較的速やかに普及するのではないだろうか。
国民医療費はさらに高騰するが。
論文本体を読み込むと以下のように書いてあり、要約の内容に一部誇張された内容が入っていそうで、注意したい。
・全生存期間と無増悪生存期間をいずれも主要評価項目とした
・全生存期間の解析を先に行って、これにより有意差が確認されたら無増悪生存期間の解析を段階的に行うことにした
・全生存期間の有意水準は両側検定でp=0.045、無増悪生存期間の有意水準は両側検定でp=0.005とした(従って、今回の試験では、無増悪生存期間に有意な改善は認められなかった(p=0.02)ことになる)
・今回は、もともと予定していた中間解析時点で有意な全生存期間の延長が認められたため、結果を公表することになった
・データカットオフは2018年4月(ということは、世界肺癌会議や今回の論文発表に間に合わせるために、かなりの突貫工事でデータのとりまとめを行ったものと想像される)
また、以下のような興味深いことも目に付いた。
・全生存期間についてサブグループ解析を行うと、65歳未満の年齢層では両治療群間に有意差を認めなかったが、65歳以上では有意差が認められ、アテゾリズマブ群の方が優れていた(それぞれの年齢層はほぼ半々であることから、この結果の信頼性は高いと考えられる。数ある臨床試験でも、若年者よりも高齢者の方が予後が優れる、というものはあまり記憶にない)
・脳転移を有する患者群での治療効果は、こうした患者の絶対数が少なかったために解析困難だった
・奏効持続期間は、アテゾリズマブ群の方がかなり長そうだった
・生存曲線を見ると、両群ともに治療開始から半年くらいまでは曲線の下がり方はなだらか(ということは、治療開始から半年間くらいは亡くなる方が少なめだったということ)で、それ以降に両群間の差がついてきた
・censored caseが多いためまだ結論を出すには早いが、非小細胞肺癌におけるこの種の臨床試験に比べると、long survivorはすくなさそう
・そこそこの割合の人が、プロトコール治療中に(進展型小細胞がんであるにもかかわらず)予防的全脳照射を受けた
話題は尽きないが、epoch-makingな治療が登場したことは間違いないし、本論文はonlineで無料で入手できるので(こういう太っ腹なところは流石のトップジャーナルである)、この分野で働く職業人としては是非一読したい。
こうなると、神経内分泌腫瘍の領域にも免疫チェックポイント阻害薬の波がやってくるかもしれない。
First-Line Atezolizumab plus Chemotherapy in Extensive-Stage Small-Cell Lung Cancer.
Horn L. et al., N Engl J Med. 2018 Sep 25.
DOI: 10.1056/NEJMoa1809064. [Epub ahead of print]
PDF: https://www.nejm.org/doi/pdf/10.1056/NEJMoa1809064
背景:
PD-L1とPD-1のシグナル伝達系を阻害することにより腫瘍特異的なT細胞免疫機能を賦活することが、進展型肺小細胞がんの治療に有望であることがすでに示されていた。免疫チェックポイント阻害薬と殺細胞性抗腫瘍薬を併用することにより、相乗効果が得られるかもしれない。
方法:
今回、未治療の進展型肺小細胞がん患者に対してカルボプラチン+エトポシド併用療法に対するアテゾリズマブの上乗せ効果を検証するプラセボ対照二重盲見第III相比較試験を計画した。参加登録した患者は、カルボプラチン+エトポシド併用療法に加えて、アテゾリズマブを使用する群(アテゾリズマブ群)とプラセボを使用する群(プラセボ群)に1:1の割合で無作為に割り付けられた。治療導入期にはそれぞれの治療を3週間ごとに最大4コースまで行い、維持治療期にはアテゾリズマブもしくはプラセボを、忍容不能な毒性にさいなまれるか、RECIST ver.1.1における病勢進行基準を満たすか、ないしは臨床的有益性がもはや認められないと担当医が判断するかまで投与継続された。主要評価項目は無増悪生存期間、全生存期間とした。
結果:
計201人の患者がアテゾリズマブ群へ、202人の患者がプラセボ群に割り付けられた。経過観察期間13.9ヶ月の段階で、生存期間中央値はアテゾリズマブ群で12.3ヶ月、プラセボ群で10.3ヶ月、ハザード比0.70、95%信頼区間は0.54-0.91、p=0.007と、アテゾリズマブ群で有意に優れていた。無増悪生存期間中央値はアテゾリズマブ群で5.2ヶ月、プラセボ群で4.3ヶ月、ハザード比0.77、95%信頼区間は0.62-0.96、p=0.02だった。安全性プロファイルは、それぞれの治療について過去に報告された有害事象とほぼ同様で、新規なものは認めなかった。
結論:
進展が多少細胞肺癌の初回治療において、化学療法にアテゾリズマブを加えることにより、全生存期間(と無増悪生存期間)が有意に延長した。
2018年10月05日
我が国の肺がん死亡数は伸び悩んでいる
「伸び悩んでいる」という表現は、不適切かも知れない。
「肺がんの年間死亡数、80,000人突破は目前」と毎年学生講義で話してきたが、どうもそうはならなさそうだ。
2014年以降、74,000人そこそこで頭打ちとなっており、もうそれほど増えそうにない。
先進諸国では、既に肺がんの年齢調整死亡率は下降局面に入っていることが知られている。
死亡数も増えなくなったということは、そろそろ高齢化の影響が薄れ始めている、ということかも知れない。

出典:厚生労働省 平成29年人口動態統計
「肺がんの年間死亡数、80,000人突破は目前」と毎年学生講義で話してきたが、どうもそうはならなさそうだ。
2014年以降、74,000人そこそこで頭打ちとなっており、もうそれほど増えそうにない。
先進諸国では、既に肺がんの年齢調整死亡率は下降局面に入っていることが知られている。
死亡数も増えなくなったということは、そろそろ高齢化の影響が薄れ始めている、ということかも知れない。

出典:厚生労働省 平成29年人口動態統計
2018年10月05日
Brigatinib、進行ALK肺がんの一次治療でクリゾチニブを凌駕 ALTA-1L study
希少疾患で、肺がん診療全体に対するインパクトは大きくないものの、ALK肺がんの話題が続いている。
Brigatinibがクリゾチニブに対して、無増悪生存期間で上回ったとのこと。
第III相試験の結果であるため、素直に捉えれば、進行ALK肺がんの初回治療ではクリゾチニブよりもBrigatinibを選ぶべき、ということになる。
じゃあアレクチニブとどっちがより推奨されるのか、とか、二次治療では何がいいのか、となると、これはまた別の話。
今の流れからすると、当面我が国ではアレクチニブで初回治療、ロルラチニブで二次治療、というのが標準になるんだろうな。
NEJ009試験を踏まえると、ペメトレキセド併用化学療法とALK阻害薬を一緒に使うと、さらに良さそうだけど。
誰かそんな臨床試験しないかな。
Brigatinib versus Crizotinib in ALK-Positive Non–Small-Cell Lung Cancer
Camidge et al., N Engl J Med. 2018 Sep 25. [Epub ahead of print]
DOI: 10.1056/NEJMoa1810171
背景:
次世代ALK阻害薬であるBrigatinibは、クリゾチニブ治療後に耐性となったALK陽性肺がん患者に対して有効である。しかし、未治療ALK肺がん患者に対し、クリゾチニブと比較してどの程度の効果を示すのかははっきりしていない。
方法:
オープンラベル、第III相無作為化比較試験(ALTA-1L study)において、ALK陽性未治療進行非小細胞肺癌患者をBrigatinib群とクリゾチニブ群に1:1の比率で無作為に割り付けた。Brigatinib群では、Brigatinib180mgを1日1回(治療初期7日間は90mgを1日1回)で連日服用し、クリゾチニブ群ではクリゾチニブ250mgを1日2回連日服用した。主要評価項目は独立した効果判定委員会により評価された無増悪生存期間とした。副次評価項目は奏効割合、頭蓋内病変奏効割合とした。解析に必要な病勢増悪もしくは患者死亡のイベントを198件と見積もり、その約50%が発生した時点で中間解析を行うこととした。
結果:
計275人の患者が各治療群に無作為割り付けされた。137人がBrigatinib群に、138人がクリゾチニブ群に割り付けられた。99件のイベントが発生した時点で初回の中間解析を行った。Brigatinib群の経過観察期間中央値は11.0ヶ月、クリゾチニブ群の経過観察期間中央値は9.3ヶ月だった。
ログランク検定で解析したところ、12ヶ月無増悪生存割合はBrigatinib群で67%(95%信頼区間は56-75%)、クリゾチニブ群で43%(95%信頼区間は32-53%)で、ハザード比は0.49(95%信頼区間は0.33-0.74)、p<0.001とBrigatinib群で有意に優れていた。
奏功割合はBrigatinib群で71%(95%信頼区間は62%-78%)、クリゾチニブ群で60%(95%信頼区間は51-68%)だった。頭蓋内病変の奏功割合はBrigatinib群で78%(95%信頼区間は52-94%)、クリゾチニブ群で29%(95%信頼区間は11-52%)だった。
結論:
ALK陽性未治療進行非小細胞肺癌患者において、Brigatinibはクリゾチニブに対して優位に無増悪生存期間を延長した。
Brigatinibがクリゾチニブに対して、無増悪生存期間で上回ったとのこと。
第III相試験の結果であるため、素直に捉えれば、進行ALK肺がんの初回治療ではクリゾチニブよりもBrigatinibを選ぶべき、ということになる。
じゃあアレクチニブとどっちがより推奨されるのか、とか、二次治療では何がいいのか、となると、これはまた別の話。
今の流れからすると、当面我が国ではアレクチニブで初回治療、ロルラチニブで二次治療、というのが標準になるんだろうな。
NEJ009試験を踏まえると、ペメトレキセド併用化学療法とALK阻害薬を一緒に使うと、さらに良さそうだけど。
誰かそんな臨床試験しないかな。
Brigatinib versus Crizotinib in ALK-Positive Non–Small-Cell Lung Cancer
Camidge et al., N Engl J Med. 2018 Sep 25. [Epub ahead of print]
DOI: 10.1056/NEJMoa1810171
背景:
次世代ALK阻害薬であるBrigatinibは、クリゾチニブ治療後に耐性となったALK陽性肺がん患者に対して有効である。しかし、未治療ALK肺がん患者に対し、クリゾチニブと比較してどの程度の効果を示すのかははっきりしていない。
方法:
オープンラベル、第III相無作為化比較試験(ALTA-1L study)において、ALK陽性未治療進行非小細胞肺癌患者をBrigatinib群とクリゾチニブ群に1:1の比率で無作為に割り付けた。Brigatinib群では、Brigatinib180mgを1日1回(治療初期7日間は90mgを1日1回)で連日服用し、クリゾチニブ群ではクリゾチニブ250mgを1日2回連日服用した。主要評価項目は独立した効果判定委員会により評価された無増悪生存期間とした。副次評価項目は奏効割合、頭蓋内病変奏効割合とした。解析に必要な病勢増悪もしくは患者死亡のイベントを198件と見積もり、その約50%が発生した時点で中間解析を行うこととした。
結果:
計275人の患者が各治療群に無作為割り付けされた。137人がBrigatinib群に、138人がクリゾチニブ群に割り付けられた。99件のイベントが発生した時点で初回の中間解析を行った。Brigatinib群の経過観察期間中央値は11.0ヶ月、クリゾチニブ群の経過観察期間中央値は9.3ヶ月だった。
ログランク検定で解析したところ、12ヶ月無増悪生存割合はBrigatinib群で67%(95%信頼区間は56-75%)、クリゾチニブ群で43%(95%信頼区間は32-53%)で、ハザード比は0.49(95%信頼区間は0.33-0.74)、p<0.001とBrigatinib群で有意に優れていた。
奏功割合はBrigatinib群で71%(95%信頼区間は62%-78%)、クリゾチニブ群で60%(95%信頼区間は51-68%)だった。頭蓋内病変の奏功割合はBrigatinib群で78%(95%信頼区間は52-94%)、クリゾチニブ群で29%(95%信頼区間は11-52%)だった。
結論:
ALK陽性未治療進行非小細胞肺癌患者において、Brigatinibはクリゾチニブに対して優位に無増悪生存期間を延長した。
2018年10月03日
免疫チェックポイント阻害薬が病状悪化を助長することもある?
本庶先生のノーベル医学生理学賞受賞が決まり、さらに注目度が高まりそうなPD-1 / PD-L1阻害薬。
ただ、効果判定は一筋縄ではいかない。
以前から言われていたPseudo-progression(本当は治療が効いているのに、病巣への炎症細胞浸潤の影響で一時的に病巣が大きくなり、その後小さくなる現象)以外にも、本当に本治療薬が病状の悪化を助長していそうだ、という報告がちらほらあった。
Hyperprogressive Disease(HPD)という概念だが、これまでの治療で原発巣のサイズが1年半くらいずっと変わらなかった自分の患者で、アテゾリズマブを使い始めた途端に増大したことを考えると、そんなこともあるのかも知れないな、と感じる。
化学療法でも、ペンブロリズマブ(PD-1阻害薬)でも大きくならなかったのに、アテゾリズマブ(PD-L1阻害薬)を使い始めた途端に大きくなるって、いったいどういう機序なんだろう。
今回の報告はレトロスペクティブ研究だが、興味深いので取り上げてみた。
HPDが約14%で認められたとのこと。
Pseudoprogressionが約5%で認められたとのことなので、真のHPDは差し引き9%程度ということか。
単剤化学療法におけるHPDは約5%とのことだから、PD-1 / PD-L1阻害薬で2倍程度はHPDが発生したということだ。
しかし、「進行の度合いが強い患者ほどHPDが多く認められるし、早期にHPDとなった患者は予後不良」というのは、当たり前といえば当たり前だ。
Hyperprogressive Disease in Patients With Advanced Non–Small Cell Lung Cancer Treated With PD-1/PD-L1 Inhibitors or With Single-Agent Chemotherapy
Roberto Ferrara, et al. JAMA Oncol. Published online September 6, 2018.
DOI:10.1001/jamaoncol.2018.3676
背景:
超病勢進行(Hyperprogressive disease, HPD)はPD-1 / PD-L1阻害薬治療中のがん患者において、最近報告された病勢進行のパターンである。進行非小細胞肺がん患者においてHPDが起こる頻度やHPD発生後の予後については知られていない。
研究の目的:
単剤化学療法による治療を受けた患者と比較して、PD-1 / PD-L1阻害薬治療を受けた進行非小細胞肺がん患者において、HPDが認められるかどうか、治療内容とHPDについて関連性が認められるかどうか調査することを目的とした。
研究の方法:
多施設共同レトロスペクティブ研究とした。フランス国内で、2011年8月4日から2017年4月5日までに治療を受けた、前治療歴のある進行非小細胞肺がん患者を対象とした。PD-1 / PD-L1阻害薬による治療を受けた患者(8施設から集積)と単剤化学療法を受けた患者(4施設から集積)を集積した。RECIST ver.1.1基準における測定可能病変に対して、少なくともこれら治療前に2回、治療後に1回のCT撮影を行っていることを必須とした。今回の治療開始前、および治療中の腫瘍増殖速度(tumora growth rate, TGR)を計測した。HPDは初回効果判定時点で、月間のTGR変化量(ΔTGR)が50%を超える病勢進行と定義した。主要評価項目は各治療施行中のHPD発生割合とした。
結果:
PD-1 / PD-L1阻害薬による治療を受けた対象患者は406人で、その63.8%は男性、46.3%(188人)は65歳以上、72.4%(294人)は非扁平上皮癌患者で、92.9%(377人)はPD-1阻害薬単剤療法を二次治療以降で受けていた。経過観察期間中央値は12.1ヶ月(95%信頼区間は10.1-13.8ヶ月)で、生存期間中央値は13.4ヶ月(95%信頼区間は10.2-17.0ヶ月)だった。13.8%(56人)の患者はHPDと判定された。偽進行(pseudoprogression)は4.7%(19人)で認めた。HPDはPD-1 / PD-L1療法導入前に2ヶ所以上の遠隔転移巣を有していた患者で有意に高頻度に認められた(HPD患者65人中、複数の遠隔転移を有していた患者は35人(62.5%)で、非HPD患者350人中、複数の遠隔転移を有していた患者は149人(42.6%)、p=0.006)。PD-1 / PD-L1阻害薬治療開始後6週間以内にHPDと判定された患者では、通常の病勢進行の患者と比較して有意に生命予後不良だった(生存期間中央値は前者で3.4ヶ月(95%信頼区間2.8-7.5ヶ月)、後者で6.2ヶ月(95%信頼区間5.3-7.9ヶ月)、ハザード比2.18(95%信頼区間1.29-3.69)、p=0.003)。単剤化学療法による治療を受けた対象患者59人のうち、HPDと判定されたのは5.1%(3人)だった。
結論:
今回の調査では、前治療歴を有する進行非小細胞肺がん患者において、PD-1 / PD-L1阻害薬での治療を受けた患者の方が単剤化学療法を受けた患者よりHPDを起こすことが多かった。また、PD-1 / PD-L1阻害薬治療を受けた場合、転移巣が多い(≒進行の度合いの強い)ことと生命予後不良であることの相関が認められた。
ただ、効果判定は一筋縄ではいかない。
以前から言われていたPseudo-progression(本当は治療が効いているのに、病巣への炎症細胞浸潤の影響で一時的に病巣が大きくなり、その後小さくなる現象)以外にも、本当に本治療薬が病状の悪化を助長していそうだ、という報告がちらほらあった。
Hyperprogressive Disease(HPD)という概念だが、これまでの治療で原発巣のサイズが1年半くらいずっと変わらなかった自分の患者で、アテゾリズマブを使い始めた途端に増大したことを考えると、そんなこともあるのかも知れないな、と感じる。
化学療法でも、ペンブロリズマブ(PD-1阻害薬)でも大きくならなかったのに、アテゾリズマブ(PD-L1阻害薬)を使い始めた途端に大きくなるって、いったいどういう機序なんだろう。
今回の報告はレトロスペクティブ研究だが、興味深いので取り上げてみた。
HPDが約14%で認められたとのこと。
Pseudoprogressionが約5%で認められたとのことなので、真のHPDは差し引き9%程度ということか。
単剤化学療法におけるHPDは約5%とのことだから、PD-1 / PD-L1阻害薬で2倍程度はHPDが発生したということだ。
しかし、「進行の度合いが強い患者ほどHPDが多く認められるし、早期にHPDとなった患者は予後不良」というのは、当たり前といえば当たり前だ。
Hyperprogressive Disease in Patients With Advanced Non–Small Cell Lung Cancer Treated With PD-1/PD-L1 Inhibitors or With Single-Agent Chemotherapy
Roberto Ferrara, et al. JAMA Oncol. Published online September 6, 2018.
DOI:10.1001/jamaoncol.2018.3676
背景:
超病勢進行(Hyperprogressive disease, HPD)はPD-1 / PD-L1阻害薬治療中のがん患者において、最近報告された病勢進行のパターンである。進行非小細胞肺がん患者においてHPDが起こる頻度やHPD発生後の予後については知られていない。
研究の目的:
単剤化学療法による治療を受けた患者と比較して、PD-1 / PD-L1阻害薬治療を受けた進行非小細胞肺がん患者において、HPDが認められるかどうか、治療内容とHPDについて関連性が認められるかどうか調査することを目的とした。
研究の方法:
多施設共同レトロスペクティブ研究とした。フランス国内で、2011年8月4日から2017年4月5日までに治療を受けた、前治療歴のある進行非小細胞肺がん患者を対象とした。PD-1 / PD-L1阻害薬による治療を受けた患者(8施設から集積)と単剤化学療法を受けた患者(4施設から集積)を集積した。RECIST ver.1.1基準における測定可能病変に対して、少なくともこれら治療前に2回、治療後に1回のCT撮影を行っていることを必須とした。今回の治療開始前、および治療中の腫瘍増殖速度(tumora growth rate, TGR)を計測した。HPDは初回効果判定時点で、月間のTGR変化量(ΔTGR)が50%を超える病勢進行と定義した。主要評価項目は各治療施行中のHPD発生割合とした。
結果:
PD-1 / PD-L1阻害薬による治療を受けた対象患者は406人で、その63.8%は男性、46.3%(188人)は65歳以上、72.4%(294人)は非扁平上皮癌患者で、92.9%(377人)はPD-1阻害薬単剤療法を二次治療以降で受けていた。経過観察期間中央値は12.1ヶ月(95%信頼区間は10.1-13.8ヶ月)で、生存期間中央値は13.4ヶ月(95%信頼区間は10.2-17.0ヶ月)だった。13.8%(56人)の患者はHPDと判定された。偽進行(pseudoprogression)は4.7%(19人)で認めた。HPDはPD-1 / PD-L1療法導入前に2ヶ所以上の遠隔転移巣を有していた患者で有意に高頻度に認められた(HPD患者65人中、複数の遠隔転移を有していた患者は35人(62.5%)で、非HPD患者350人中、複数の遠隔転移を有していた患者は149人(42.6%)、p=0.006)。PD-1 / PD-L1阻害薬治療開始後6週間以内にHPDと判定された患者では、通常の病勢進行の患者と比較して有意に生命予後不良だった(生存期間中央値は前者で3.4ヶ月(95%信頼区間2.8-7.5ヶ月)、後者で6.2ヶ月(95%信頼区間5.3-7.9ヶ月)、ハザード比2.18(95%信頼区間1.29-3.69)、p=0.003)。単剤化学療法による治療を受けた対象患者59人のうち、HPDと判定されたのは5.1%(3人)だった。
結論:
今回の調査では、前治療歴を有する進行非小細胞肺がん患者において、PD-1 / PD-L1阻害薬での治療を受けた患者の方が単剤化学療法を受けた患者よりHPDを起こすことが多かった。また、PD-1 / PD-L1阻害薬治療を受けた場合、転移巣が多い(≒進行の度合いの強い)ことと生命予後不良であることの相関が認められた。
2018年10月01日
次世代シーケンサーによる網羅的遺伝子変異検索、いよいよ保険適用へ秒読み
新聞からの抜粋ばかりだが、2018年09月29日は、こんな記事もあった。

こちらは、どちらかというと医療費のコストダウンにつながる記事であり、喜ばしい。
少なくとも肺がん領域では、複数の遺伝子異常を一括して調べられるようになるだろう。

こちらは、どちらかというと医療費のコストダウンにつながる記事であり、喜ばしい。
少なくとも肺がん領域では、複数の遺伝子異常を一括して調べられるようになるだろう。
2018年10月01日
治療1回5000万円・・・、ホンマかいな・・・。
唐代の名医、孫思邈はその著書の中で、
「上等の医者は国を治す能力があり、中等の医者は人を治すことができ、下等の医者は病気しか治せない(上医医国、中医医人、下医医病)」
と書き残したらしい。
さて、果たして現代医療はどこに向かっているのか。
以下の記事を読んで、びっくりたまげてしまった。

免疫チェックポイント阻害薬や慢性C型肝炎治療薬でも十分高額だが、今回の記事で取り扱われている薬は一桁違う。
キムリア(ノバルティス社)は急性リンパ性白血病に対するCAR-T細胞療法。
イエスカルタ(ギリアド・サイエンシズ社)は非ホジキンリンパ腫に対するCAR-T細胞療法。
いずれも画期的新薬であることは疑いないのだろうが、1回4000万円から5000万円・・・。
ホンマかいな。
もはやここまで来たら、「常軌を逸している」と言わせてもらっていいだろう。
家を売っても、たった1回の治療費すら払えない。
こうした治療を賄っていたら、国民健康保険も民間医療保険も、あっという間に破綻してしまうのではないか。
「人の命はお金に代えられない」
ごもっとも。
しかし、これらの治療が国民健康保険で制限なくできるようになれば、病気は治るかも知れないけれど、人も国も、経済的に破滅するだろう。
医師であることの罪悪感にさいなまれて仕方がない。
「上等の医者は国を治す能力があり、中等の医者は人を治すことができ、下等の医者は病気しか治せない(上医医国、中医医人、下医医病)」
と書き残したらしい。
さて、果たして現代医療はどこに向かっているのか。
以下の記事を読んで、びっくりたまげてしまった。

免疫チェックポイント阻害薬や慢性C型肝炎治療薬でも十分高額だが、今回の記事で取り扱われている薬は一桁違う。
キムリア(ノバルティス社)は急性リンパ性白血病に対するCAR-T細胞療法。
イエスカルタ(ギリアド・サイエンシズ社)は非ホジキンリンパ腫に対するCAR-T細胞療法。
いずれも画期的新薬であることは疑いないのだろうが、1回4000万円から5000万円・・・。
ホンマかいな。
もはやここまで来たら、「常軌を逸している」と言わせてもらっていいだろう。
家を売っても、たった1回の治療費すら払えない。
こうした治療を賄っていたら、国民健康保険も民間医療保険も、あっという間に破綻してしまうのではないか。
「人の命はお金に代えられない」
ごもっとも。
しかし、これらの治療が国民健康保険で制限なくできるようになれば、病気は治るかも知れないけれど、人も国も、経済的に破滅するだろう。
医師であることの罪悪感にさいなまれて仕方がない。
2018年10月01日
PD-1発見者の本庶佑先生、2018年ノーベル医学生理学賞受賞
免疫チェックポイント阻害薬のコンセプトであるPD-1 / PD-L1系を発見された京都大学名誉教授の本庶佑(ほんじょたすく)先生。
2018年のノーベル医学生理学賞を受賞することが決定したと速報が入った。
おめでとうございます。
https://news.yahoo.co.jp/pickup/6298645
2018年のノーベル医学生理学賞を受賞することが決定したと速報が入った。
おめでとうございます。
https://news.yahoo.co.jp/pickup/6298645




