2024年12月09日
2022年01月05日の記事より・・・がん治療とその後の療養生活
私の母の胸部放射線治療、開始前は私自身薄氷を踏む思いで見ていました。
母はもともと乳がんの術後再発を抑える目的で左乳房(前胸部)全体に極量の放射線治療をしていました。
治療終了からすでに10年経過しているとはいえ、放射線治療の後遺障害は永続的です。
新たに見つかった左下葉肺がん+縦郭リンパ節転移の治癒を目指すには、左胸部の広範囲に放射線をさらに極量を上乗せして照射するしかありませんでした。
放射線治療医に相談して、なんとか照射野が重ならないように工夫しても、どうしても調整の利かない部分が出てきます。
その部分の皮膚が壊死する、潰瘍化して穴が開く、くらいの覚悟をして治療に臨みました。
母は文句なしに後期高齢者なので、局所進行期の原発性肺腺がんに対してカルボプラチン分割投与+同時併用根治的胸部放射線照射を行いました。
治療の全行程を入院管理下で行いました。
嘔気、嘔吐、食欲不振、食道炎症状はありましたが、幸い皮膚障害は軽微に抑えられました。
早期からの軟膏処方、照射前後の冷却処置など、担当医や看護スタッフのきめ細かなケアの賜物と感謝しています。
これまでのところまだ持ちこたえていますが、放射線治療の後遺障害というのは一定の期間をおいて出てくることもあり、まだまだ油断はできません。
また、皮膚への照射線量を分散させるための調整の影響か、肺への放射線照射範囲は私が想像していたよりも広くに及び、比例して放射線肺臓炎を来した肺野も広くなり、プレドニゾロン内服期間がかなり長くなりました。
治療開始前が1Lちょっとでしたので、おそらく今の母の肺活量は、確実に1Lを下回っているだろうと思います。
そんなわけで、母の自宅療養については不安を感じていました。
諸般の事情で母と同居できず、私自身いつも申し訳なく感じていますが、独居であることを除いては母の療養環境は恵まれているようです。
片道5分程度の場所にあるスーパーまでを最大半径とした行動範囲で概ね生活が回ります。
家業の関係で、しょっちゅう人が出入りして、あれこれ話をしていきます。
家業を回転させるために常に頭を使います。
私のほか、本人のきょうだいや親族、地元の友人が頻繁に訪ねてきます。
温泉卵を茹でてはあちこちの親族やお客さまに送り付け、お返しに全国の山海珍味が返ってきて、またお返しを送ります。
どこまでが仕事で、どこからが付き合いや趣味なのか、もうよくわかりません。
母とお客さまが一緒に食事をしているところに、私も途中から混じるなどしばしばです。
肺がん、乳がん、関節リウマチ、うつ病、糖尿病などなど、病める方々がたくさんやってきて、お風呂に入って地獄蒸しで食事をして、母と話をして、なぜかみなさん活気を取り戻して帰っていきます。
とある会社の社長さんは、糖尿病による動脈硬化で足先が壊死しかけていたところ、実家の温泉で湯治を始めてからみるみる血行が良くなったそうで、それからというもの実家の一室に住みついてしまいました。
何が言いたいのかというと、母にとって生活に必要なほどほどの運動が身体機能のリハビリとなり、家業の運転や多様なみなさんとの付き合いが高次脳機能の維持に役立っているようだということです。
幸い母はまだ五感が健在なので、人とのコミュニケーションには支障がありません。
同じ話を繰り返すことが以前よりも増えましたが、確認を兼ねてあえてそうしているのだろうと前向きにとらえています。
以前の私ならば、肺がんの診療において肺がんにしか目が向かず、こうした生活に必要な身体機能、認知機能の維持には配慮ができませんでした。
むしろ、治療に必要な身体機能、認知機能がなければ、治療を受ける適応(資格)がないと判断してしまうようなところがありました。
治療に必要な体力、認知機能、療養環境を整えるところにも目配りしなければならない、というのは、地元に帰ってきて自然と老年期医療に携わるようになって、はじめて見えてきた視点です。
生活の質を心地よく保ちながら長く治療を続けるには、身体・認知機能の維持と療養環境の整備はとても大切だと考えるようになりました。
2021年11月14日
進行非小細胞肺がんオリゴ転移巣に対する定位照射のランダム化第II相比較試験
今回の臨床試験は、スローンケタリング記念がんセンター単施設におけるランダム化第II相比較試験だったようだが、単施設で企画された試験としては対象患者数が160人と大規模だ。
非小細胞肺がんと乳がん患者双方を対象としているので、それでも患者が集まるのだろう。
また、転移巣全てを対象とするのではなく、増大傾向にあるか、PETで活動性が高いと判断された病巣のみを定位照射対象としているところに独自性がある。
増大傾向にある、活動性が高いという判断には施設間、担当医間でバラツキが出ることが容易に想像されるので、そうした点では単施設で検証することに意味があるだろう。
それは、裏を返せば、今後第III相多施設共同臨床試験を行うには相当練り上げたプロトコールと品質管理が必要だということでもある。
興味深いことに、非小細胞肺がんと乳がんでサブグループ解析を行うと、非小細胞肺がんではオリゴ転移巣に対する定位照射で無増悪生存期間が延長し、乳がんではそうならなかった。
筆頭演者に対するインタビュー動画を見てみると、乳がん患者では追跡期間中、もともと安定していると考えられた転移巣が進行していたり、あるいは新規転移巣が出現したりで、結局対象患者の90%が短期間で病勢進行に至ったとのこと。
非小細胞肺がんではそうした現象は見られなかったらしい。
非小細胞肺がんと乳がんの比較において、乳がんの方がよりアグレッシブな進行をする、という論調には簡単には賛同しかねるものの、今回の治療コンセプトにより対象となった非小細胞肺がん患者の無増悪生存期間が2ヶ月ちょっとから11か月まで延長したことは素直に喜ばしい。
また、今回のコンセプトで、増悪していない転移巣に対しては現在施行中の薬物療法を継続しながら、増悪している病巣のみを選択して定位照射で制御することにより、時間的・空間的な多様性を示すがん転移巣に対する対処の1つの解を示している。
定位照射に引き続き免疫チェックポイント阻害薬を適用したら効果が増強されるのではないか、など、個人的には魅力的な治療と感じられた。
Consolidative Use of Radiotherapy to Block (CURB) Oligoprogression: Interim Analysis of the First Randomized Study of Stereotactic Body Radiotherapy in Patients With Oligoprogressive Metastatic Cancers of the Lung and Breast
C.J. Tsai et al.
ASTRO’s 63rd Annual Meeting (October 24-27, 2021), Abst.#LBA3
目的:
増悪傾向を示す転移巣のみに局所療法を行うことにより病勢コントロールが得られるという、oligoprogressive stateという現象が進行がんで認められると仮説を立てた。そのため今回の臨床試験では、増悪傾向を示す転移巣が1-5ヶに限られる進行非小細胞肺がんおよび進行乳がんの患者を対象に、これら病巣に対して定位放射線照射を行うことの有用性を評価した。
方法:
1レジメン以上のがん薬物療法を施行され、かつ定位放射線照射の適応があるoligoprogression転移巣を有する進行非小細胞肺がん患者および進行乳がん患者を対象とした。ここで、oligoprogression転移巣(以下OP巣)は、RECISTもしくはPET-RECISTの規定に沿った総計5ヶ以下の個別の転移巣と定義した。層別化因子には、OP巣の個数(1ケ vs 2-5ケ)、前治療の内容(免疫チェックポイント阻害薬 vs その他)、原発巣(非小細胞肺がん vs 乳がん)、原発巣の性質(ドライバー遺伝子変異の有無やホルモンレセプターの発現状態)を規定した。対象患者は、OP巣に対する定位放射線治療+標準治療(SBRT+SOC)群と標準治療(SOC)群に、1:1の割合で無作為に割り付けられた。どのような標準治療を適用するかは、担当医に一任された。主要評価項目は無増悪生存期間(PFS)とした。ランダム化第II相試験デザインを適用し、片側検定としてαエラー=0.05、検出力=0.08に設定、目標患者数は160人とした。PFSは片側層別化ログランク検定を用いて比較した。中間解析を1回設けた。
結果:
2019年1月から2021年5月にかけて、102人の患者を集積した。58人は非小細胞肺がん患者(30人がSBRT+SOC群、28人がSOC群)、44人は乳がん患者(22人がSBRT+SOC群、22人がSOC群)だった。年齢中央値は67歳、ほとんどの患者(75%)は2ケ以上のOP巣を有し、47%の患者はOP巣も含めて6ケ以上の転移巣を有していた。55人(54%)の患者は免疫チェックポイント阻害薬治療歴があった。非小細胞肺がん患者のほとんど(86%)はドライバー遺伝子変異がなく、乳がん患者の32%はいわゆるトリプル・ネガティブ(ER,PgR,HER2発現なし)だった。背景因子は両治療群間でバランスがとれていた。観察期間中央値51週の時点で、71人の患者で病勢進行を認め、30人の患者は死亡していた。PFS中央値はSBRT+SOC群で22週、SOC群で10週だった(p=0.005)で、SBRT+SOC群で有意に延長していた。この結果は、非小細胞肺がん患者における成績に起因していた(SBRT+SOC群で44週、SOC群で9週、p=0.004)。乳がんでは、PFS中央値はSBRT+SOC群で18週、SOC群で17週、p=0.5と両群間に有意差を認めなかった。前述の層別化因子を含め、コックス比例ハザードモデルを用いた多変数解析を行ったところ、非小細胞肺がんサブグループは独立した予後良好因子だった(ハザード比0.38、95%信頼区間0.18-0.77、p=0.007)。Grade2以上の有害事象はSBRT+SOC群のうち8人に認め、うち1人はGrade 3の肺臓炎だった。
結論:
今回の中間解析において、OP巣に対する定位放射線照射が全体集団のPFSを改善することが示された。非小細胞肺がん集団ではPFSが延長する一方で乳がん集団ではそうした現象は見られず、さらなる解析が必要と考えられた。
非小細胞肺がんと乳がん患者双方を対象としているので、それでも患者が集まるのだろう。
また、転移巣全てを対象とするのではなく、増大傾向にあるか、PETで活動性が高いと判断された病巣のみを定位照射対象としているところに独自性がある。
増大傾向にある、活動性が高いという判断には施設間、担当医間でバラツキが出ることが容易に想像されるので、そうした点では単施設で検証することに意味があるだろう。
それは、裏を返せば、今後第III相多施設共同臨床試験を行うには相当練り上げたプロトコールと品質管理が必要だということでもある。
興味深いことに、非小細胞肺がんと乳がんでサブグループ解析を行うと、非小細胞肺がんではオリゴ転移巣に対する定位照射で無増悪生存期間が延長し、乳がんではそうならなかった。
筆頭演者に対するインタビュー動画を見てみると、乳がん患者では追跡期間中、もともと安定していると考えられた転移巣が進行していたり、あるいは新規転移巣が出現したりで、結局対象患者の90%が短期間で病勢進行に至ったとのこと。
非小細胞肺がんではそうした現象は見られなかったらしい。
非小細胞肺がんと乳がんの比較において、乳がんの方がよりアグレッシブな進行をする、という論調には簡単には賛同しかねるものの、今回の治療コンセプトにより対象となった非小細胞肺がん患者の無増悪生存期間が2ヶ月ちょっとから11か月まで延長したことは素直に喜ばしい。
また、今回のコンセプトで、増悪していない転移巣に対しては現在施行中の薬物療法を継続しながら、増悪している病巣のみを選択して定位照射で制御することにより、時間的・空間的な多様性を示すがん転移巣に対する対処の1つの解を示している。
定位照射に引き続き免疫チェックポイント阻害薬を適用したら効果が増強されるのではないか、など、個人的には魅力的な治療と感じられた。
Consolidative Use of Radiotherapy to Block (CURB) Oligoprogression: Interim Analysis of the First Randomized Study of Stereotactic Body Radiotherapy in Patients With Oligoprogressive Metastatic Cancers of the Lung and Breast
C.J. Tsai et al.
ASTRO’s 63rd Annual Meeting (October 24-27, 2021), Abst.#LBA3
目的:
増悪傾向を示す転移巣のみに局所療法を行うことにより病勢コントロールが得られるという、oligoprogressive stateという現象が進行がんで認められると仮説を立てた。そのため今回の臨床試験では、増悪傾向を示す転移巣が1-5ヶに限られる進行非小細胞肺がんおよび進行乳がんの患者を対象に、これら病巣に対して定位放射線照射を行うことの有用性を評価した。
方法:
1レジメン以上のがん薬物療法を施行され、かつ定位放射線照射の適応があるoligoprogression転移巣を有する進行非小細胞肺がん患者および進行乳がん患者を対象とした。ここで、oligoprogression転移巣(以下OP巣)は、RECISTもしくはPET-RECISTの規定に沿った総計5ヶ以下の個別の転移巣と定義した。層別化因子には、OP巣の個数(1ケ vs 2-5ケ)、前治療の内容(免疫チェックポイント阻害薬 vs その他)、原発巣(非小細胞肺がん vs 乳がん)、原発巣の性質(ドライバー遺伝子変異の有無やホルモンレセプターの発現状態)を規定した。対象患者は、OP巣に対する定位放射線治療+標準治療(SBRT+SOC)群と標準治療(SOC)群に、1:1の割合で無作為に割り付けられた。どのような標準治療を適用するかは、担当医に一任された。主要評価項目は無増悪生存期間(PFS)とした。ランダム化第II相試験デザインを適用し、片側検定としてαエラー=0.05、検出力=0.08に設定、目標患者数は160人とした。PFSは片側層別化ログランク検定を用いて比較した。中間解析を1回設けた。
結果:
2019年1月から2021年5月にかけて、102人の患者を集積した。58人は非小細胞肺がん患者(30人がSBRT+SOC群、28人がSOC群)、44人は乳がん患者(22人がSBRT+SOC群、22人がSOC群)だった。年齢中央値は67歳、ほとんどの患者(75%)は2ケ以上のOP巣を有し、47%の患者はOP巣も含めて6ケ以上の転移巣を有していた。55人(54%)の患者は免疫チェックポイント阻害薬治療歴があった。非小細胞肺がん患者のほとんど(86%)はドライバー遺伝子変異がなく、乳がん患者の32%はいわゆるトリプル・ネガティブ(ER,PgR,HER2発現なし)だった。背景因子は両治療群間でバランスがとれていた。観察期間中央値51週の時点で、71人の患者で病勢進行を認め、30人の患者は死亡していた。PFS中央値はSBRT+SOC群で22週、SOC群で10週だった(p=0.005)で、SBRT+SOC群で有意に延長していた。この結果は、非小細胞肺がん患者における成績に起因していた(SBRT+SOC群で44週、SOC群で9週、p=0.004)。乳がんでは、PFS中央値はSBRT+SOC群で18週、SOC群で17週、p=0.5と両群間に有意差を認めなかった。前述の層別化因子を含め、コックス比例ハザードモデルを用いた多変数解析を行ったところ、非小細胞肺がんサブグループは独立した予後良好因子だった(ハザード比0.38、95%信頼区間0.18-0.77、p=0.007)。Grade2以上の有害事象はSBRT+SOC群のうち8人に認め、うち1人はGrade 3の肺臓炎だった。
結論:
今回の中間解析において、OP巣に対する定位放射線照射が全体集団のPFSを改善することが示された。非小細胞肺がん集団ではPFSが延長する一方で乳がん集団ではそうした現象は見られず、さらなる解析が必要と考えられた。
2021年10月10日
放射線治療を前処置とした免疫チェックポイント阻害薬
表題のテーマについて、しばし物思いにふけっていた。
忘れないうちに書き残しておく。
・姑息的放射線照射による遠隔腫瘍縮小(アブスコパル)効果と免疫チェックポイント阻害薬 その1
→http://oitahaiganpractice.junglekouen.com/e992230.html
・姑息的放射線照射による遠隔腫瘍縮小(アブスコパル)効果と免疫チェックポイント阻害薬 その2
→http://oitahaiganpractice.junglekouen.com/e992257.html
<がん特異抗原の流出と各種がん治療に関する仮説>
手術:マクロレベルでの治療なので、がん特異抗原の流出にはほとんど影響しない
放射線治療:がん細胞を物理的に破壊する→様々ながん特異抗原蛋白、ペプチドが作成されやすい
化学療法:がん細胞を化学反応として破壊、あるいは静止化する→放射線治療に比べるとがん特異抗原、ペプチドの多様性は乏しい
<放射線治療を前処置とした免疫チェックポイント阻害薬施行時のがん免疫サイクルの仮説>
1)放射線治療による前処置
中枢神経系への放射線治療→がん特異抗原が体循環にまで行きわたるかどうか不明
中枢神経系以外への放射線治療→がん特異抗原ががん組織から流出する
2)抗CTLA-4抗体で、抗原提示細胞のがん特異抗原認識を増強
放射線治療後によりがん特異抗原の流出が活性化、かつ多様化され、抗原提示細胞の提示能力のレパートリーが広がる
2.5)抗原提示細胞が細胞障害性T細胞を教育する過程を増強
この系が見つかれば、新たな治療薬創生に繋がるかもしれない
3)抗PD-1 / PD-L1抗体で細胞障害性T細胞によるがん細胞攻撃を増強
認識可能ながん特異抗原が多様化することで、細胞障害性T細胞ががん細胞を攻撃する効率が高くなる
<考え得る臨床試験コンセプト>
・局所進行肺がんに対する化学放射線療法に引き続く抗CTLA-4抗体+抗PD-1 / PD-L1抗体±手術
・骨転移を伴う進行期肺がんに対する姑息的放射線治療に引き続く抗CTLA-4抗体+抗PD-1 / PD-L1抗体
・中枢神経系転移を伴う進行期肺がんに対する全脳照射に引き続く抗CTLA-4抗体+抗PD-1 / PD-L1抗体
・進行期肺がんに対し、がん特異抗原流出を目的とした定位照射と、それに引き続く抗CTLA-4抗体+抗PD-1 / PD-L1抗体
忘れないうちに書き残しておく。
・姑息的放射線照射による遠隔腫瘍縮小(アブスコパル)効果と免疫チェックポイント阻害薬 その1
→http://oitahaiganpractice.junglekouen.com/e992230.html
・姑息的放射線照射による遠隔腫瘍縮小(アブスコパル)効果と免疫チェックポイント阻害薬 その2
→http://oitahaiganpractice.junglekouen.com/e992257.html
<がん特異抗原の流出と各種がん治療に関する仮説>
手術:マクロレベルでの治療なので、がん特異抗原の流出にはほとんど影響しない
放射線治療:がん細胞を物理的に破壊する→様々ながん特異抗原蛋白、ペプチドが作成されやすい
化学療法:がん細胞を化学反応として破壊、あるいは静止化する→放射線治療に比べるとがん特異抗原、ペプチドの多様性は乏しい
<放射線治療を前処置とした免疫チェックポイント阻害薬施行時のがん免疫サイクルの仮説>
1)放射線治療による前処置
中枢神経系への放射線治療→がん特異抗原が体循環にまで行きわたるかどうか不明
中枢神経系以外への放射線治療→がん特異抗原ががん組織から流出する
2)抗CTLA-4抗体で、抗原提示細胞のがん特異抗原認識を増強
放射線治療後によりがん特異抗原の流出が活性化、かつ多様化され、抗原提示細胞の提示能力のレパートリーが広がる
2.5)抗原提示細胞が細胞障害性T細胞を教育する過程を増強
この系が見つかれば、新たな治療薬創生に繋がるかもしれない
3)抗PD-1 / PD-L1抗体で細胞障害性T細胞によるがん細胞攻撃を増強
認識可能ながん特異抗原が多様化することで、細胞障害性T細胞ががん細胞を攻撃する効率が高くなる
<考え得る臨床試験コンセプト>
・局所進行肺がんに対する化学放射線療法に引き続く抗CTLA-4抗体+抗PD-1 / PD-L1抗体±手術
・骨転移を伴う進行期肺がんに対する姑息的放射線治療に引き続く抗CTLA-4抗体+抗PD-1 / PD-L1抗体
・中枢神経系転移を伴う進行期肺がんに対する全脳照射に引き続く抗CTLA-4抗体+抗PD-1 / PD-L1抗体
・進行期肺がんに対し、がん特異抗原流出を目的とした定位照射と、それに引き続く抗CTLA-4抗体+抗PD-1 / PD-L1抗体
2021年09月24日
ドライバー遺伝子変異陽性患者におけるPACIFICレジメンの有効性
免疫チェックポイント阻害薬とドライバー遺伝子変異陽性肺がんとの関連性。
・免疫チェックポイント阻害薬使用後にチロシンキナーゼ阻害薬を使うと、薬剤性肺障害のリスクが高い
・免疫チェックポイント阻害薬単独では有効性が低い
・チロシンキナーゼ阻害薬を使い切った後にプラチナ併用化学療法+免疫チェックポイント阻害薬併用を行うと有効かもしれない
・KRAS遺伝子変異陽性なら、免疫チェックポイント阻害薬の効果が期待できる
といったところだろうか。
ドライバー遺伝子変異陽性肺がんにおいても、III期であれば化学放射線療法後にデュルバルマブを地固め投与するPACIFICレジメンが標準と考えられるが、今回の報告はその有効性を後方視的に検討したものである。
対象患者数が極めて少ない(KRAS変異以外はすべて一桁)とはいえ、上記の原則を裏付けるような結果であり、個人的に興味深かったので記事にした。
今後の臨床試験や実地臨床にどのように活かすべきか。
さらに、免疫チェックポイント阻害薬の恩恵は喫煙者の方が受けやすいという、非喫煙者としては全く受け入れがたい事実も再確認された。
それも、無増悪生存期間中央値にして1年以上の有意差を以て、である。
免疫チェックポイント阻害薬を取り扱う製薬会社にたばこ会社が資本参加したら、と考えると、本当に暗澹たる気分になる。
Durvalumab consolidation in patients with stage III non-resecable NSCLC with driver genomic alterations
M. Riudavets Melia et al., ESMO Congress 2021 Abst.#1172MO
Annals of Oncology (2021) 32 (suppl_5): S939-S948.
背景:
デュルバルマブはIII期切除不能非小細胞肺がんに対する化学放射線療法後の地固め標準治療である。ドライバー遺伝子異常を伴う非小細胞肺がん患者における本治療の有効性はあまりよく分かっていない。今回はこの件について調査することを目的とした。
方法:
化学放射線療法後にデュルバルマブ投与を受けたIII期切除不能非小細胞肺がん患者について、欧州および米国の25施設で、2020年04月15日から2020年10月20日までに臨床データおよび生物学的データを集積し、後方視的検討を行った。ドライバー遺伝子異常は、EGFR、BRAF、KRAS遺伝子変異とALK、ROS1融合遺伝子を対象とした。画像診断上の奏効割合はRECIST v1.1基準、あるいは担当医の評価基準に基づいて評価した。ドライバー遺伝子異常ごとに、無増悪生存期間(PFS)と全生存期間(OS)を評価した。
結果:
323人の調査対象患者のうち、43人が1種類のドライバー遺伝子異常を伴っていた。KRAS遺伝子変異26人(うち8人がG12C変異)、EGFR遺伝子変異8人(うち6人がエクソン19欠失もしくはエクソン21点突然変異)、BRAF遺伝子変異5人(うち4人がV600E変異)、ALK融合遺伝子4人という内訳だった。年齢中央値は66歳(39-84)、性別比は1:1で、98%の患者がPS≦1で、19%は非喫煙者だった。88%は腺がんだった。PD-L1発現は85%の患者で陽性だった(4人はデータ確認不能だった)。調査対象患者全体における無増悪生存期間中央値は17.5ヶ月(95%信頼区間13.2-24.9)、全生存期間中央値は47ヶ月(95%信頼区間47-未到達)だった。ドライバー遺伝子変異を伴う患者(dGA群)と伴わない患者(non-dGA群)で比較したところ、無増悪生存期間中央値はdGA群で14.9ヶ月(95%信頼区間8.1-未到達)、non-dGA群で18ヶ月(95%信頼区間13.4-28.3)と統計学的有意差を認めなかった(p=1.0)。全生存期間に関するデータは解析時点では不足しており算出できなかった。ドライバー遺伝子変異ごとの解析結果は図表の通りで、KRAS遺伝子変異を有する患者以外では無増悪生存期間中央値は9ヶ月以下に留まった。

dGA群において、PD-L1発現状態と全生存期間、無増悪生存期間の間に相関関係はなかった。一方、無増悪生存期間と喫煙歴には正の相関があり、中央値は喫煙者で19.2ヶ月(95%信頼区間11.3-未到達)、非喫煙者で5.8ヶ月(95%信頼区間3.9-未到達)だった。
結論:
ドライバー遺伝子異常を伴うIII期切除不能非小細胞肺がん患者に対する化学放射線療法後のデュルバルマブによる地固め療法は、KRAS遺伝子変異陽性患者を除いては限定的な有効性に留まった。より規模の大きな研究で検証する必要がある。
・免疫チェックポイント阻害薬使用後にチロシンキナーゼ阻害薬を使うと、薬剤性肺障害のリスクが高い
・免疫チェックポイント阻害薬単独では有効性が低い
・チロシンキナーゼ阻害薬を使い切った後にプラチナ併用化学療法+免疫チェックポイント阻害薬併用を行うと有効かもしれない
・KRAS遺伝子変異陽性なら、免疫チェックポイント阻害薬の効果が期待できる
といったところだろうか。
ドライバー遺伝子変異陽性肺がんにおいても、III期であれば化学放射線療法後にデュルバルマブを地固め投与するPACIFICレジメンが標準と考えられるが、今回の報告はその有効性を後方視的に検討したものである。
対象患者数が極めて少ない(KRAS変異以外はすべて一桁)とはいえ、上記の原則を裏付けるような結果であり、個人的に興味深かったので記事にした。
今後の臨床試験や実地臨床にどのように活かすべきか。
さらに、免疫チェックポイント阻害薬の恩恵は喫煙者の方が受けやすいという、非喫煙者としては全く受け入れがたい事実も再確認された。
それも、無増悪生存期間中央値にして1年以上の有意差を以て、である。
免疫チェックポイント阻害薬を取り扱う製薬会社にたばこ会社が資本参加したら、と考えると、本当に暗澹たる気分になる。
Durvalumab consolidation in patients with stage III non-resecable NSCLC with driver genomic alterations
M. Riudavets Melia et al., ESMO Congress 2021 Abst.#1172MO
Annals of Oncology (2021) 32 (suppl_5): S939-S948.
背景:
デュルバルマブはIII期切除不能非小細胞肺がんに対する化学放射線療法後の地固め標準治療である。ドライバー遺伝子異常を伴う非小細胞肺がん患者における本治療の有効性はあまりよく分かっていない。今回はこの件について調査することを目的とした。
方法:
化学放射線療法後にデュルバルマブ投与を受けたIII期切除不能非小細胞肺がん患者について、欧州および米国の25施設で、2020年04月15日から2020年10月20日までに臨床データおよび生物学的データを集積し、後方視的検討を行った。ドライバー遺伝子異常は、EGFR、BRAF、KRAS遺伝子変異とALK、ROS1融合遺伝子を対象とした。画像診断上の奏効割合はRECIST v1.1基準、あるいは担当医の評価基準に基づいて評価した。ドライバー遺伝子異常ごとに、無増悪生存期間(PFS)と全生存期間(OS)を評価した。
結果:
323人の調査対象患者のうち、43人が1種類のドライバー遺伝子異常を伴っていた。KRAS遺伝子変異26人(うち8人がG12C変異)、EGFR遺伝子変異8人(うち6人がエクソン19欠失もしくはエクソン21点突然変異)、BRAF遺伝子変異5人(うち4人がV600E変異)、ALK融合遺伝子4人という内訳だった。年齢中央値は66歳(39-84)、性別比は1:1で、98%の患者がPS≦1で、19%は非喫煙者だった。88%は腺がんだった。PD-L1発現は85%の患者で陽性だった(4人はデータ確認不能だった)。調査対象患者全体における無増悪生存期間中央値は17.5ヶ月(95%信頼区間13.2-24.9)、全生存期間中央値は47ヶ月(95%信頼区間47-未到達)だった。ドライバー遺伝子変異を伴う患者(dGA群)と伴わない患者(non-dGA群)で比較したところ、無増悪生存期間中央値はdGA群で14.9ヶ月(95%信頼区間8.1-未到達)、non-dGA群で18ヶ月(95%信頼区間13.4-28.3)と統計学的有意差を認めなかった(p=1.0)。全生存期間に関するデータは解析時点では不足しており算出できなかった。ドライバー遺伝子変異ごとの解析結果は図表の通りで、KRAS遺伝子変異を有する患者以外では無増悪生存期間中央値は9ヶ月以下に留まった。

dGA群において、PD-L1発現状態と全生存期間、無増悪生存期間の間に相関関係はなかった。一方、無増悪生存期間と喫煙歴には正の相関があり、中央値は喫煙者で19.2ヶ月(95%信頼区間11.3-未到達)、非喫煙者で5.8ヶ月(95%信頼区間3.9-未到達)だった。
結論:
ドライバー遺伝子異常を伴うIII期切除不能非小細胞肺がん患者に対する化学放射線療法後のデュルバルマブによる地固め療法は、KRAS遺伝子変異陽性患者を除いては限定的な有効性に留まった。より規模の大きな研究で検証する必要がある。
2021年09月13日
病勢進行後の治療をどう考えるか
肺がんの治療が多様化し、治療の考え方はとても複雑になった。
病勢進行後の治療をどう考えるかについて、散文的にはなるが書き記しておきたい。
1)「病勢進行」をどうとらえるか
病勢進行の定義をRECIST効果判定の考え方に沿って端的に書き下すなら、「一定以上の病巣増大、あるいは新規病巣の出現」である。
薬の腫瘍縮小効果を評価する臨床試験においては、この基準が厳密に適用される。
とはいえ、それさえも絶対的なものではない。
〇主観の問題
病勢進行後の治療をどう考えるかについて、散文的にはなるが書き記しておきたい。
1)「病勢進行」をどうとらえるか
病勢進行の定義をRECIST効果判定の考え方に沿って端的に書き下すなら、「一定以上の病巣増大、あるいは新規病巣の出現」である。
薬の腫瘍縮小効果を評価する臨床試験においては、この基準が厳密に適用される。
とはいえ、それさえも絶対的なものではない。
〇主観の問題
画像診断に基づいて腫瘍縮小効果を判定するといっても、評価者の主観に左右される。
患者・家族と喜びも悲しみも分かち合う担当医と、まったく診療に関わらない効果判定委員会では、どうしても測定結果に相違がある。
効果判定委員会の評価を仮に真の測定結果とするならば、患者・家族の心情を慮って測定結果をいい方にとってしまう担当医もいるだろう。
逆に、臨床試験の厳格さを重視するあまりに、却って測定結果を悪い方にとってしまう担当医もいるだろう。
そうした評価のブレがつきものだが、最近はあえて効果判定委員会の評価ではなく、担当医の評価を主要な評価項目に据える臨床試験も散見する。
これは私の推測だが、プロトコール治療が効果・安全性両面で優れていれば、担当医は長くプロトコール治療を続けたいと思うだろうし、逆に効果・安全性いずれかに問題があれば(診療をしていてそのように感じるならば)担当医は早くプロトコール治療をやめて、次の治療を提供したいと考えるだろう。
そうした担当医の主観が、敢えて効果判定に持ちこまれるようにしているのかもしれない。
〇タイミングの問題
治療の効果発現時期が効果判定のタイミングとうまく合致するとは限らない。
双極にあるのが、ドライバー遺伝子変異に対する分子標的薬と、免疫チェックポイント阻害薬である。
分子標的薬は一般に効果発現が早く、適切に使えば治療初期は劇的に病巣が縮小することが多い。
一方で、免疫チェックポイント阻害薬では、有効な場合にも一過性に病巣が増大することがある(Pseudo-Progression)。
そのため、免疫チェックポイント阻害薬で効果判定を急ぎすぎると、せっかく有効なのに早期に中止してしまう可能性がある。
〇過大評価の問題
RECIST効果判定では、「ベースライン(治療開始前)径和に比して、標的病変の径和が30%以上減少したら奏効と判定する」、「(治療)経過中の最小の径和(ベースライン径和が経過中の最小値である場合、これを最小の径和とする)に比して、標的病変の径和が20%以上増加、かつ径和が絶対値でも5mm以上増加したら病勢進行と判定する」という規定が存在する。
よく言われることだが、100mmあった病巣が、治療により10mmまで縮小し奏効と判定され、その後20mmまで増大したら、RECIST規定上はその時点で病勢進行である。
治療開始前からすれば1/5まで病巣が縮小した状態を保っているのだが、最も病巣が縮小した時点を基準とすれば病巣は2倍に増大している。
10mmまで縮小するのに1ヶ月、その後20mmまで増大するのに3年かかったとしても、RECIST効果判定上は病勢進行である。
この時点で治療をやめるのは誰が考えてもナンセンスだと思うのだが、ここまで極端でないにしても、似たようなことは実臨床で行われている可能性がある。
100mmあった病巣が、治療により70mmまで縮小し奏効と判定され、そこから84mmまで増大してもやはり病勢進行である。
この場合も、治療開始前より腫瘍が縮小しているにもかかわらず、治療は変更されることになる。
RECIST効果判定に従う限り、一旦奏効と判定された後の病勢進行は過大評価されがちであることがわかると思う。
〇評価確定の問題
RECIST効果判定においては、完全奏効や奏効の判定は、一定程度の腫瘍縮小が2回の効果判定にわたって連続的に確認されることで初めて確定する。
一方、病勢進行は1回の効果判定で基準を満たせば直ちに確定である。
〇病理学的な確認の問題
とくに新規病巣が出現した場合には要注意である。
その病巣が転移巣とは限らない。
実際に生検してみたら単なる良性病変だった、ということはしばしばある。
他にもまだ様々な問題はあると思うが、これらを踏まえると実地臨床においてはRECIST基準を厳密に守る必要はない。
とはいえ、各担当医の主観に完全に委ねてしまうと、担当医間、診療施設間でのバラつきがあまりに大きくなってしまい、都合が悪い。
RECISTはもともと化学療法の効果判定のために定められた性質が強いが、分子標的薬や免疫チェックポイント阻害薬のような新しいメカニズムの治療が一般化している以上、もはやRECIST自体が現状に合わなくなっている感が強い。
実地臨床でも応用可能な効果判定基準の策定に向けて、見直しをすべき時期に来ているように思う。
願わくば、患者の状態の代替指標として有効に機能する測定値の経過の追い方や、時間(縮小速度、増悪速度)の概念を新しい基準では盛り込んでほしい。
2)「病勢進行」後の治療をどのように考えるか
病勢進行、と判定しても、その後の治療の考え方は千差万別である。
ここでは、検討すべき項目を述べ、コメントを付すにとどめる。
〇考え得る治療
往々にして、初期に行われる治療の方が効果が高く、二次、三次、四次治療と進むにつれて期待できる効果は薄れていく。
病巣が大きくなっているにしても、治療前に比べると増大スピードが緩やかになっているようであれば、敢えてその治療をできる限り続けるという戦略もあるだろう。
〇年齢
90代の患者に対し、分子標的薬が効かなくなったからと言って、安易に化学療法に切り替えるのが良いとは限らない。
化学療法に切り替えるくらいなら、有害事象の軽い分子標的薬を使い続けて、それで効かなくなったら運命と思ってあきらめる、という人は多い。
〇体力(PS)
言いたいことは年齢の項と同様である。
〇治療薬の種類
点滴なのか、内服なのか。
化学療法なのか、分子標的薬なのか、血管増殖因子阻害薬なのか、免疫チェックポイント阻害薬なのか。
病勢進行後、次に使うとしたらどのような薬を想定しているのか。
それぞれの要素によって、おのずと考え方は変わってくるだろう。
例えば、免疫チェックポイント阻害薬使用後に分子標的薬に切り替えるのは、間質性肺炎のリスクを考えると勇気がいる。
敢えて間に化学療法を挟んで免疫チェックポイント阻害薬の影響が薄れるのを待つというのも戦略としてあり得るだろう。
〇脳転移による病勢進行
遠隔転移の中でも、脳転移については特別視することが多い。
脳転移以外は病勢進行を認めない、というときは、脳転移巣のみ放射線治療で対処し、薬物療法は変更しないということは多い。
薬物療法の進歩とともに、病勢進行の判定、その後の治療計画策定は一筋縄ではいかなくなった。
とは言え、これは決して悪いことではないように思う。
肌感覚としてかなりの確度を以て言えるのだが、担当医が「これはもういよいよ治療を変えなければまずい」とはっきり感じる場合を除いて、病勢進行時に急いで治療を変える必要はない。
そのくらい、肺がん領域における薬物療法は効果とその持続時間、安全性の両面から質が高くなっているように感じられる。
2021年09月08日
限局型肺小細胞がんにおける海馬回避予防的全脳照射
海馬回避全脳照射については、以前触れたことがある。
・全脳照射の時、海馬を避けることに意味はあるのか
→http://oitahaiganpractice.junglekouen.com/e971509.html
一般向けの教養書でも海馬と記憶の関係はしばしば触れられている。
アルツハイマー病においては、海馬の萎縮が画像診断上の一つの目安とされており、最近脳神経内科医に相談した私の入院患者は、実際に海馬の萎縮を以てアルツハイマー病の疑いが強いと指摘されていた。
上記の記事は、転移性脳腫瘍を発症した患者全体が適格患者とされていた。
今回はもっと対象者を絞り込み、予防的全脳照射の適応がある肺小細胞がん患者とされている。
欧州では進展型肺小細胞がん患者も予防的全脳照射の対象とされており、本試験でも約30%が進展型の患者であったようで、我が国における実臨床とは一部隔たりがある。
とはいえ、5年生存割合が35-40%にも及んだ患者集団において、認知機能をより良好に維持したというのは、無視できないデータのように考えられる。
FCSRTという耳慣れない評価尺度が用いられているため、簡単にではあるが参考資料を末尾に付した。
我が国でも、一般に用いられている長谷川式認知機能評価スケールやMMSEを評価項目に加えて検討すると、より実感がわく結果が得られるのではないだろうか。
Randomized Phase III Trial of Prophylactic Cranial Irradiation With or Without Hippocampal Avoidance for Small-Cell Lung Cancer (PREMER): A GICOR-GOECP-SEOR Study
Núria Rodríguez de Dios et al., Published online August 11, 2021.
DOI: 10.1200/JCO.21.00639 Journal of Clinical Oncology
方法:
放射線全脳照射治療中に海馬の神経幹細胞が暴露される放射線量は、認知機能低下と関連があると言われてきた。小細胞肺がん患者に対して海馬回避予防的全脳照射(Hippocampal Acoidance-Prophylactic Cranial Irradiation, HA-PCI)を適用する際の関心事は、放射線暴露を回避した海馬領域における脳転移の発生頻度である。
方法:
今回の第III相臨床試験では、2019年10月までスペイン国内13施設から150人の肺小細胞がん患者(71.3%は限局型)が組み入れられ、標準的な予防的全脳照射(Prophylactic Cranial Irradiation, PCI, 総線量25Gyを10回分割照射)群とHA-PCI群に割り付けた。主要評価項目はFree and Cued Selective Reminding Test(FCSRT)における治療後3ヶ月時点での遅延自由再生(Delayed Free Recall, DFR)とし、治療開始前のベースラインの点数より3点以上低下したら認知機能低下と判定した。副次評価項目は、FCSRTにおける他項目の点数、Quality of Life(QoL)、脳転移の発生割合および発生部位、全生存期間とした。データは治療開始前、治療開始後3ヶ月、6ヶ月、12ヶ月、24ヶ月の時点で評価した。
結果:
PCI群、HA-PCI群にそれぞれ75人ずつが割り付けられた。両群合わせて13人が不適格と判断され、結局PCI群に68人、HA-PCI群に69人が割り付けられた。両治療群間で、患者背景に有意な差は見られなかった。生存患者の経過観察期間中央値は40.4ヶ月だった。治療開始前から治療後3ヶ月時点までのDFRの低下は、PCI群(23.5%)に比してHA-PCI群(5.8%)で有意に軽微だった(オッズ比5, 95%信頼区間1.57-15.86, p=0.003)。FCSRTにおける他項目の検討では、治療開始前から治療後3ヶ月時点までの全再生(Total Recall, TR)の低下はPCI群で20.6%, HA-PCI群で20.6%、治療開始前から治療後6ヶ月時点までのDFRの低下はPCI群で33.3%、HA-PCI群で11.1%、TRの低下はPCI群で38.9%、HA-PCI群で20.3%、全自由再生(Total Free Recall, TFR)の低下はPCI群で14.8%、HA-PCI群で31.5%、治療開始前から治療後24ヶ月時点までのTRの低下はPCI群で47.6%、HA-PCI群で14.2%だった。2年経過時点における、脳転移の累積発生割合はHA-PCI群で22.8%、PCI群で17.7%で統計学的有意差を認めなかった(p=0.430)。脳転移再発した患者のうち、多発脳転移再発はPCI群で70.5%、HA-PCI群で84.6%に認めた。HA-PCI群のうち、1人で海馬歯状回への転移を認めた。海馬回避領域への単発の脳転移再発は認めなかったが、多発脳転移を来した患者において、PCI群で2人、HA-PCI群で12人に海馬回避領域の転移を認めた。60ヶ月経過時点で、HA-PCI群のうち60.0%、PCI群のうち65.3%は死亡していた→5年生存割合はHA-PCI群で40%、PCI群で34.7%だった。生存期間中央値はHA-PCI群で23.4ヶ月、PCI群で24.9ヶ月だった(p=0.556)。QoLには両群間で有意差を認めなかった。
結論:
小細胞肺がん患者に対するPCI中に海馬を照射野から外すことにより、認知機能はよりよく維持された。脳転移再発割合、全生存期間、QoLは標準的なPCIと遜色なかった。
Free and Cued Selective Reminding Test 日本語版作成とその有効性について
田村 至、老年精神医学雑誌,22(8):949-954,2011
(以下、序文より一部抜粋)
軽度認知障害のスクリーニング検査として欧米で使用されているFree and Cued Selective Reminding Test(FCSRT)は、16単語の即時ヒント再生,3回にわたる自由再生およびヒント再生,遅延自由・ヒント再生を行うことで,記憶の3側面である記銘・想起・貯蔵を個別に検査することができる。欧米では,FCSRTがアルツハイマー病とパーキンソン病,脳血管性認知症などとの鑑別診断に有用であると報告されている。
・全脳照射の時、海馬を避けることに意味はあるのか
→http://oitahaiganpractice.junglekouen.com/e971509.html
一般向けの教養書でも海馬と記憶の関係はしばしば触れられている。
アルツハイマー病においては、海馬の萎縮が画像診断上の一つの目安とされており、最近脳神経内科医に相談した私の入院患者は、実際に海馬の萎縮を以てアルツハイマー病の疑いが強いと指摘されていた。
上記の記事は、転移性脳腫瘍を発症した患者全体が適格患者とされていた。
今回はもっと対象者を絞り込み、予防的全脳照射の適応がある肺小細胞がん患者とされている。
欧州では進展型肺小細胞がん患者も予防的全脳照射の対象とされており、本試験でも約30%が進展型の患者であったようで、我が国における実臨床とは一部隔たりがある。
とはいえ、5年生存割合が35-40%にも及んだ患者集団において、認知機能をより良好に維持したというのは、無視できないデータのように考えられる。
FCSRTという耳慣れない評価尺度が用いられているため、簡単にではあるが参考資料を末尾に付した。
我が国でも、一般に用いられている長谷川式認知機能評価スケールやMMSEを評価項目に加えて検討すると、より実感がわく結果が得られるのではないだろうか。
Randomized Phase III Trial of Prophylactic Cranial Irradiation With or Without Hippocampal Avoidance for Small-Cell Lung Cancer (PREMER): A GICOR-GOECP-SEOR Study
Núria Rodríguez de Dios et al., Published online August 11, 2021.
DOI: 10.1200/JCO.21.00639 Journal of Clinical Oncology
方法:
放射線全脳照射治療中に海馬の神経幹細胞が暴露される放射線量は、認知機能低下と関連があると言われてきた。小細胞肺がん患者に対して海馬回避予防的全脳照射(Hippocampal Acoidance-Prophylactic Cranial Irradiation, HA-PCI)を適用する際の関心事は、放射線暴露を回避した海馬領域における脳転移の発生頻度である。
方法:
今回の第III相臨床試験では、2019年10月までスペイン国内13施設から150人の肺小細胞がん患者(71.3%は限局型)が組み入れられ、標準的な予防的全脳照射(Prophylactic Cranial Irradiation, PCI, 総線量25Gyを10回分割照射)群とHA-PCI群に割り付けた。主要評価項目はFree and Cued Selective Reminding Test(FCSRT)における治療後3ヶ月時点での遅延自由再生(Delayed Free Recall, DFR)とし、治療開始前のベースラインの点数より3点以上低下したら認知機能低下と判定した。副次評価項目は、FCSRTにおける他項目の点数、Quality of Life(QoL)、脳転移の発生割合および発生部位、全生存期間とした。データは治療開始前、治療開始後3ヶ月、6ヶ月、12ヶ月、24ヶ月の時点で評価した。
結果:
PCI群、HA-PCI群にそれぞれ75人ずつが割り付けられた。両群合わせて13人が不適格と判断され、結局PCI群に68人、HA-PCI群に69人が割り付けられた。両治療群間で、患者背景に有意な差は見られなかった。生存患者の経過観察期間中央値は40.4ヶ月だった。治療開始前から治療後3ヶ月時点までのDFRの低下は、PCI群(23.5%)に比してHA-PCI群(5.8%)で有意に軽微だった(オッズ比5, 95%信頼区間1.57-15.86, p=0.003)。FCSRTにおける他項目の検討では、治療開始前から治療後3ヶ月時点までの全再生(Total Recall, TR)の低下はPCI群で20.6%, HA-PCI群で20.6%、治療開始前から治療後6ヶ月時点までのDFRの低下はPCI群で33.3%、HA-PCI群で11.1%、TRの低下はPCI群で38.9%、HA-PCI群で20.3%、全自由再生(Total Free Recall, TFR)の低下はPCI群で14.8%、HA-PCI群で31.5%、治療開始前から治療後24ヶ月時点までのTRの低下はPCI群で47.6%、HA-PCI群で14.2%だった。2年経過時点における、脳転移の累積発生割合はHA-PCI群で22.8%、PCI群で17.7%で統計学的有意差を認めなかった(p=0.430)。脳転移再発した患者のうち、多発脳転移再発はPCI群で70.5%、HA-PCI群で84.6%に認めた。HA-PCI群のうち、1人で海馬歯状回への転移を認めた。海馬回避領域への単発の脳転移再発は認めなかったが、多発脳転移を来した患者において、PCI群で2人、HA-PCI群で12人に海馬回避領域の転移を認めた。60ヶ月経過時点で、HA-PCI群のうち60.0%、PCI群のうち65.3%は死亡していた→5年生存割合はHA-PCI群で40%、PCI群で34.7%だった。生存期間中央値はHA-PCI群で23.4ヶ月、PCI群で24.9ヶ月だった(p=0.556)。QoLには両群間で有意差を認めなかった。
結論:
小細胞肺がん患者に対するPCI中に海馬を照射野から外すことにより、認知機能はよりよく維持された。脳転移再発割合、全生存期間、QoLは標準的なPCIと遜色なかった。
Free and Cued Selective Reminding Test 日本語版作成とその有効性について
田村 至、老年精神医学雑誌,22(8):949-954,2011
(以下、序文より一部抜粋)
軽度認知障害のスクリーニング検査として欧米で使用されているFree and Cued Selective Reminding Test(FCSRT)は、16単語の即時ヒント再生,3回にわたる自由再生およびヒント再生,遅延自由・ヒント再生を行うことで,記憶の3側面である記銘・想起・貯蔵を個別に検査することができる。欧米では,FCSRTがアルツハイマー病とパーキンソン病,脳血管性認知症などとの鑑別診断に有用であると報告されている。
2021年09月02日
髄膜癌腫症と姑息的全脳全脊髄放射線照射
ときどき、髄膜癌腫症に対して全脳全脊髄放射線照射という治療が行われることがある。
転移性脳腫瘍に対する全脳照射は一般的な治療だが、肺がん領域で全脳全脊髄照射をする例はあまり見たことがない。
1年くらい前だったか、がんセンターに勤める医師に髄膜癌腫症の治療について意見を求めたところ、全脳全脊髄照射をしてみては、という答えが返ってきた。
どの程度の治療効果が期待できるのか、ちょっと文献の要約をかじってみた。
全脳全脊髄照射にそれほど劇的な効果が期待できるわけではない。
例外的に、61.5ヶ月以上の長期生存が得られている非小細胞肺がん患者がいたが、詳細に書かれていないものの、おそらくはドライバー遺伝子変異を有する患者だろう。
髄膜癌腫症を発症してからの平均的な生命予後は1.5-5ヶ月、予後のよい患者でも7-8ヶ月程度の生命予後である。
今回取り上げた2件の文献は、いずれも全脳全脊髄照射の有効性を統計学的に証明したものではないので、これを以て本治療を積極的に進める根拠にはならない。
正直言って、労多くして益少なし、という印象を受けた。
とはいえ、もし本治療を検討するときには、治療に期待できる効果を患者に指し示すにあたっては参考になるデータだろう。
Craniospinal irradiation(CSI) in patients with leptomeningeal metastases: risk-benefit-profile and development of a prognostic score for decision making in the palliative setting
Michal Devecka et al., BMC Cancer. 2020 Jun 1;20(1):501.
doi: 10.1186/s12885-020-06984-1.
背景:
本研究の目的は、髄膜癌腫症(leptomeningitis, LM)を合併した患者に対して全脊髄照射あるいは全脳全脊髄照射(CranioSpinal irradiation,CSI)を行った際の忍容性、治療効果を調べることと、どんな背景を持つ患者が本治療の恩恵を受けるのか予測可能なスコアリングシステムを提案することである。
方法:
我々の施設でCSIを施行した19人の患者を評価対象とした。患者背景、がん原発巣の状態、CSIによる治療効果と毒性を後方視的に検討した。中枢神経系以外の病状は、CSI施行前に行った病期判定時のCTで評価した。患者のPSや臨床病期に基づいた層別化によりスコアリングシステムを作成し、治療効果予測を行った。
結果:
全生存期間に関する経過観察期間中央値は3.4ヶ月(0.5-61.5)だった。生存期間中央値は、LM合併乳がん患者で4.7ヶ月、LM合併非小細胞肺がん患者で3.3ヶ月だった。非小細胞肺がん患者は5人含まれていて、それぞれの生存期間中央値は1.5ヶ月、1.5ヶ月、3.3ヶ月、4.2ヶ月、61.5ヶ月だった。①KPS<70 or KPS≧70、あるいは②中枢神経系外病変あり or なし、によって層別化したところ、①・②いずれも予後不良因子がない患者の生存期間中央値は7.3ヶ月、①・②どちらか一方の予後不良因子を有する患者の生存期間中央値は3.3ヶ月、①・②いずれの予後不良因子を有するものの生存期間中央値は1.5ヶ月だった。CSIによる非血液毒性は軽微だった。
結論:
CSIにより臨床的に意義のある生存期間が得られ、抗がん薬髄腔内投与による治療効果と遜色なかった。簡単な予後予測スコアリングシステムにより、全脳全脊髄照射の恩恵が得られる患者の選別ができそうだった。
A systematic review of craniospinal irradiation for leptomeningeal disease: past, present, and future
L Maillie et al., Clin Transl Oncol. 2021 Oct;23(10):2109-2119.
doi: 10.1007/s12094-021-02615-8. Epub 2021 Apr 21.
背景:
髄膜癌腫症(leptomeningeal dissemination,LMD)は、中枢神経系の髄膜と脳脊髄液に腫瘍細胞がばらまかれる、稀ではあるが致死的な合併症である。全脳全脊髄照射(CranioSpinal irradiation, CSI)は中枢神経系全てのくも膜下腔を照射野におさめる治療であり、LMDにおける最後の治療手段として時に用いられる。
方法:
今回は、成人の固形癌あるいは血液腫瘍に起因するLMDに対するCSIの役割について記述した文献についてまとめた。2020年9月1日までに論文化された報告をPubMedデータベースで検索した。
結果:
262件の文献がヒットした。LMDに対してCSIが施行された計275人の患者を含む13件の研究を解析対象とした。CSI照射時点での年齢中央値は43歳、ほとんどの患者のKPSは70以上だった。LMDを合併した悪性腫瘍で頻度が高かったのは、急性リンパ性白血病、乳がん、急性骨髄性白血病だった。CSI線量の中央値は30Gyで、全体の18%の患者が陽子線治療を受けていた。52%の患者で、神経学的症候の安定化もしくは改善が認められた。全患者集団における生存期間中央値は5.3ヶ月だった。骨髄回避陽子線治療を受けた患者における生存期間中央値は8ヶ月だった。頻度の高かった有害事象は血液毒性と胃腸毒性だった。
結論:
薬物療法や放射線治療が進歩したにもかかわらず、LMDは依然として様々な悪性腫瘍における破滅的な終末期合併症だった。治療関連有害事象はCSI遂行における障壁となり得る。一部のLMD患者において、骨髄回避陽子線治療はより安全な緩和医療となり得るし、生命予後延長効果もあるかも知れない
転移性脳腫瘍に対する全脳照射は一般的な治療だが、肺がん領域で全脳全脊髄照射をする例はあまり見たことがない。
1年くらい前だったか、がんセンターに勤める医師に髄膜癌腫症の治療について意見を求めたところ、全脳全脊髄照射をしてみては、という答えが返ってきた。
どの程度の治療効果が期待できるのか、ちょっと文献の要約をかじってみた。
全脳全脊髄照射にそれほど劇的な効果が期待できるわけではない。
例外的に、61.5ヶ月以上の長期生存が得られている非小細胞肺がん患者がいたが、詳細に書かれていないものの、おそらくはドライバー遺伝子変異を有する患者だろう。
髄膜癌腫症を発症してからの平均的な生命予後は1.5-5ヶ月、予後のよい患者でも7-8ヶ月程度の生命予後である。
今回取り上げた2件の文献は、いずれも全脳全脊髄照射の有効性を統計学的に証明したものではないので、これを以て本治療を積極的に進める根拠にはならない。
正直言って、労多くして益少なし、という印象を受けた。
とはいえ、もし本治療を検討するときには、治療に期待できる効果を患者に指し示すにあたっては参考になるデータだろう。
Craniospinal irradiation(CSI) in patients with leptomeningeal metastases: risk-benefit-profile and development of a prognostic score for decision making in the palliative setting
Michal Devecka et al., BMC Cancer. 2020 Jun 1;20(1):501.
doi: 10.1186/s12885-020-06984-1.
背景:
本研究の目的は、髄膜癌腫症(leptomeningitis, LM)を合併した患者に対して全脊髄照射あるいは全脳全脊髄照射(CranioSpinal irradiation,CSI)を行った際の忍容性、治療効果を調べることと、どんな背景を持つ患者が本治療の恩恵を受けるのか予測可能なスコアリングシステムを提案することである。
方法:
我々の施設でCSIを施行した19人の患者を評価対象とした。患者背景、がん原発巣の状態、CSIによる治療効果と毒性を後方視的に検討した。中枢神経系以外の病状は、CSI施行前に行った病期判定時のCTで評価した。患者のPSや臨床病期に基づいた層別化によりスコアリングシステムを作成し、治療効果予測を行った。
結果:
全生存期間に関する経過観察期間中央値は3.4ヶ月(0.5-61.5)だった。生存期間中央値は、LM合併乳がん患者で4.7ヶ月、LM合併非小細胞肺がん患者で3.3ヶ月だった。非小細胞肺がん患者は5人含まれていて、それぞれの生存期間中央値は1.5ヶ月、1.5ヶ月、3.3ヶ月、4.2ヶ月、61.5ヶ月だった。①KPS<70 or KPS≧70、あるいは②中枢神経系外病変あり or なし、によって層別化したところ、①・②いずれも予後不良因子がない患者の生存期間中央値は7.3ヶ月、①・②どちらか一方の予後不良因子を有する患者の生存期間中央値は3.3ヶ月、①・②いずれの予後不良因子を有するものの生存期間中央値は1.5ヶ月だった。CSIによる非血液毒性は軽微だった。
結論:
CSIにより臨床的に意義のある生存期間が得られ、抗がん薬髄腔内投与による治療効果と遜色なかった。簡単な予後予測スコアリングシステムにより、全脳全脊髄照射の恩恵が得られる患者の選別ができそうだった。
A systematic review of craniospinal irradiation for leptomeningeal disease: past, present, and future
L Maillie et al., Clin Transl Oncol. 2021 Oct;23(10):2109-2119.
doi: 10.1007/s12094-021-02615-8. Epub 2021 Apr 21.
背景:
髄膜癌腫症(leptomeningeal dissemination,LMD)は、中枢神経系の髄膜と脳脊髄液に腫瘍細胞がばらまかれる、稀ではあるが致死的な合併症である。全脳全脊髄照射(CranioSpinal irradiation, CSI)は中枢神経系全てのくも膜下腔を照射野におさめる治療であり、LMDにおける最後の治療手段として時に用いられる。
方法:
今回は、成人の固形癌あるいは血液腫瘍に起因するLMDに対するCSIの役割について記述した文献についてまとめた。2020年9月1日までに論文化された報告をPubMedデータベースで検索した。
結果:
262件の文献がヒットした。LMDに対してCSIが施行された計275人の患者を含む13件の研究を解析対象とした。CSI照射時点での年齢中央値は43歳、ほとんどの患者のKPSは70以上だった。LMDを合併した悪性腫瘍で頻度が高かったのは、急性リンパ性白血病、乳がん、急性骨髄性白血病だった。CSI線量の中央値は30Gyで、全体の18%の患者が陽子線治療を受けていた。52%の患者で、神経学的症候の安定化もしくは改善が認められた。全患者集団における生存期間中央値は5.3ヶ月だった。骨髄回避陽子線治療を受けた患者における生存期間中央値は8ヶ月だった。頻度の高かった有害事象は血液毒性と胃腸毒性だった。
結論:
薬物療法や放射線治療が進歩したにもかかわらず、LMDは依然として様々な悪性腫瘍における破滅的な終末期合併症だった。治療関連有害事象はCSI遂行における障壁となり得る。一部のLMD患者において、骨髄回避陽子線治療はより安全な緩和医療となり得るし、生命予後延長効果もあるかも知れない
2021年08月20日
姑息的放射線照射による遠隔腫瘍縮小(アブスコパル)効果と免疫チェックポイント阻害薬 その2
こちらは、イピリムマブと放射線治療の相互作用によりアブスコパル効果が認められたとする報告である。
古典的なサイモンの2-atage designで小規模な臨床試験を行いつつ、そのメカニズムを実験データで裏付けるという報告で、基礎研究に疎い私のような臨床家でもある程度理解できる内容だった。
とはいえ、本論文の構成は臨床系の論文と比べるとirregularでまとめるのに苦労したうえ、実験データに関する記述の理解はいまひとつなので、ここでは実臨床に即した内容のみ書き残す。
放射線治療によるアブスコパル効果をイピリムマブが増強する、と表現するべきなのか、イピリムマブによる薬理作用を放射線治療による病巣からのがん特異抗原抽出が増強する、と表現するべきなのか。
いずれにせよ、放射線治療による新規がん特異抗原の提示と、それによる免疫反応を増強するというコンセプトを考えると、PD-1 / PD-L1系よりもCTLA-4系の方が放射線治療との親和性は高いのかもしれない。
さらに一歩進んで、抗PD-1 / PD-L1抗体と抗CTLA-4抗体の併用療法を放射線治療と組み合わせるというコンセプト、これから開発されることに期待したい。
Radiotherapy induces responses of lung cancer to CTLA-4 blockade
Silvia C Formenti et al., Nat Med. 2018 Dec;24(12):1845-1851.
doi: 10.1038/s41591-018-0232-2. Epub 2018 Nov 5.
要約:
局所的な放射線治療は、前臨床試験および悪性黒色腫患者に関する複数の症例報告において、抗CTLA-4抗体による全身性の反応を増強することが示されているが、既往の抗CTLA-4抗体治療に反応しない腫瘍に対しても全身性反応(アブスコパル効果)を誘導するかどうかはわかっていない。放射線治療は抗腫瘍T細胞の活性化、照射を受けた腫瘍内部でのI型インターフェロン誘導に依存した抗腫瘍効果を促す。マウスのがんモデルにおいて、腫瘍内I型インターフェロン誘導はアブスコパル効果招来には欠かせない。
放射線治療と抗CTLA-4抗体併用療法で治療を受けた患者に見られるアブスコパル効果のメカニズムはよく分かっていない。今回我々は、一般に抗CTLA-4抗体単剤療法、もしくは抗CTLA-4抗体と化学療法併用では有意な腫瘍縮小効果が得られないとされる進行非小細胞肺がんを研究対象とした。既治療進行非小細胞肺がん患者に対して、放射線治療と抗CTLA-4抗体の併用療法が抗腫瘍T細胞を誘導することを報告する。奏効割合は参加患者のうち18%で、病勢コントロールが得られたのは31%だった。放射線治療後に血清中インターフェロンβが増加することと、放射線治療後早期に劇的に血中T細胞クローンが変化することが最も強い効果予測因子であり、前臨床試験で得られたデータを裏付けることとなった。腫瘍縮小効果が認められたある患者の免疫機能解析を行ったところ、放射線治療により増幅された遺伝子由来の新規がん特異抗原を認識するCD8陽性T細胞が体内で急速に増えていることが分かった。免疫原性を持つ遺伝子変異産物が放射線治療により免疫システムにさらされることがアブスコパル効果の発生に必要であるとする仮説を支持する結果だった。
背景:
姑息的放射線照射とイピリムマブ(抗CTLA-4抗体)の併用療法によるアブスコパル効果で完全寛解が長期持続している進行非小細胞肺がん患者の症例経験から、今回の臨床試験を企画した。病巣局所への姑息的放射線照射が、病巣それ自体をいわば「体内ワクチン」として免疫系に認識させ、さらにCTLA-4受容体をブロックすることによる抗腫瘍免疫反応との相乗効果を引き起こす、という仮説を検証することにした。
方法:
今回の第II相試験は単施設単アーム試験であり、試験デザインとしてサイモンのoptimal two-stage designを採用した。第1段階では10人の患者を組み入れ、全くアブスコパル効果が確認されなかった場合にはこの時点で無効中止とした。1人以上の患者でアブスコパル効果が確認出来たら、第2段階としてさらに29人の患者を組み入れることにした。全体として少なくとも4人(10.25%)でアブスコパル効果が確認できなければ無効とした。姑息的放射線治療は画像誘導放射線治療(image guided radiothrapy, IGRT)あるいは強度変調放射線治療(intensity modulated radiotherapy, IMRT)の手法を用いたリニアック外照射を用い、任意の1ヶ所の病巣に照射することとした。第I相部分(13人)では6GyX5回、第II相部分(26人)では9.5GyX3回の照射スケジュールとした。イピリムマブは3mg/kg/回の投与量で、1回目を放射線治療1日目に合わせて投与し、病勢進行、患者死亡、忍容不能の毒性発生、患者の臨床試験参加同意撤回のいずれかのイベントが発生するまで、3週間ごとに4コース反復した。主要評価項目は放射線照射範囲外における腫瘍縮小効果(Abscopal Response Rate, ARR)とした。プロトコール治療開始日を1日目とし、88日目に施行したPET/CTで効果判定を行った。効果判定の基準としては、irRCとRECIST1.1を併用した。
結果:
2014年06月から2015年04月までに39人の患者を集積した。年齢中央値は68歳(48-97)、男性16人(41%)、腺がん34人(87%)、扁平上皮がん3人(8%)、3レジメン以上の化学療法歴がある患者が17人(45%)、20-pack-year超の喫煙歴を有する患者が23人(61%)、転移のある臓器数の中央値は3(1-6)で、内訳は骨16人(41%)、脳16人(41%)、肝9人(23%)、肺34人(90%)、軟部組織他23人(61%)だった。ドライバー遺伝子変異(陽性者数/検索総数)はEGFRが6/29(21%)、ALKが0/19(0%)、ROS1が0/6(0%)、RETが1/11(9%)、KRASが7/20(35%)だった。39人中21人(54%)がプロトコール治療を完遂し、88日目のPET/CTによる効果判定を受けた。1人はプロトコール治療を完遂したものの、効果判定を受けなかった。17人はプロトコール治療を完遂できず、うち8人は治療中に死亡し、9人は治療中に病勢進行を来した。ARRは18%(7/39)だった。プロトコール治療を完遂した集団に限定すればARRは33%(7/21)で、7人中2人は完全奏効、5人は部分奏効だった。加えて5人は病勢安定の状態にあったため、放射線照射範囲外における病勢コントロール割合(Abscopal Control Rate, ACR)は31%(12/39)だった。生存者の経過観察期間中央値は43ヶ月(38-47)で、全患者集団における生存期間中央値は7.4ヶ月(95%信頼区間4.4-12.6)だった。プロトコール治療を完遂した患者集団では、生存期間中央値は13.0ヶ月(95%信頼区間10.6-25.2)であり、完遂できなかった患者集団の3.0ヶ月(95%信頼区間2.5-3.5)に比べて有意に延長していた(p<0.001)。放射線照射範囲外における病勢コントロールが得られた患者集団では、生存期間中央値は20.4ヶ月(95%信頼区間12.9-未到達)で、そうでない患者集団の3.5ヶ月(95%信頼区間3.1-7.4)に比べて有意に延長していた(p<0.001)。プロトコール治療を完遂した21人のうち4人はデータカットオフ時点で生存しており(うち3人では病勢コントロールが得られていた)、それぞれの生存期間は38ヶ月、42ヶ月、44ヶ月、47ヶ月だった。治療開始前に採取された腫瘍組織でのPD-L1発現状態、腫瘍組織へのCD8陽性T細胞の浸潤状態、放射線照射部位や照射スケジュールは、治療効果予測因子とはならなかった。プロトコール治療を完遂した患者集団21人において、放射線照射範囲外における病勢コントロールが得られた患者は12人で、そのうちEGFR遺伝子変異が検索されていたのは9人、陽性だったのは0人だったが、病勢進行と判定された残り9人のうち、EGFR遺伝子変異が検索されていたのは8人、陽性だったのは4人で、EGFR遺伝子変異陽性者には有意に病勢進行の患者が多かった(p=0.029)。
古典的なサイモンの2-atage designで小規模な臨床試験を行いつつ、そのメカニズムを実験データで裏付けるという報告で、基礎研究に疎い私のような臨床家でもある程度理解できる内容だった。
とはいえ、本論文の構成は臨床系の論文と比べるとirregularでまとめるのに苦労したうえ、実験データに関する記述の理解はいまひとつなので、ここでは実臨床に即した内容のみ書き残す。
放射線治療によるアブスコパル効果をイピリムマブが増強する、と表現するべきなのか、イピリムマブによる薬理作用を放射線治療による病巣からのがん特異抗原抽出が増強する、と表現するべきなのか。
いずれにせよ、放射線治療による新規がん特異抗原の提示と、それによる免疫反応を増強するというコンセプトを考えると、PD-1 / PD-L1系よりもCTLA-4系の方が放射線治療との親和性は高いのかもしれない。
さらに一歩進んで、抗PD-1 / PD-L1抗体と抗CTLA-4抗体の併用療法を放射線治療と組み合わせるというコンセプト、これから開発されることに期待したい。
Radiotherapy induces responses of lung cancer to CTLA-4 blockade
Silvia C Formenti et al., Nat Med. 2018 Dec;24(12):1845-1851.
doi: 10.1038/s41591-018-0232-2. Epub 2018 Nov 5.
要約:
局所的な放射線治療は、前臨床試験および悪性黒色腫患者に関する複数の症例報告において、抗CTLA-4抗体による全身性の反応を増強することが示されているが、既往の抗CTLA-4抗体治療に反応しない腫瘍に対しても全身性反応(アブスコパル効果)を誘導するかどうかはわかっていない。放射線治療は抗腫瘍T細胞の活性化、照射を受けた腫瘍内部でのI型インターフェロン誘導に依存した抗腫瘍効果を促す。マウスのがんモデルにおいて、腫瘍内I型インターフェロン誘導はアブスコパル効果招来には欠かせない。
放射線治療と抗CTLA-4抗体併用療法で治療を受けた患者に見られるアブスコパル効果のメカニズムはよく分かっていない。今回我々は、一般に抗CTLA-4抗体単剤療法、もしくは抗CTLA-4抗体と化学療法併用では有意な腫瘍縮小効果が得られないとされる進行非小細胞肺がんを研究対象とした。既治療進行非小細胞肺がん患者に対して、放射線治療と抗CTLA-4抗体の併用療法が抗腫瘍T細胞を誘導することを報告する。奏効割合は参加患者のうち18%で、病勢コントロールが得られたのは31%だった。放射線治療後に血清中インターフェロンβが増加することと、放射線治療後早期に劇的に血中T細胞クローンが変化することが最も強い効果予測因子であり、前臨床試験で得られたデータを裏付けることとなった。腫瘍縮小効果が認められたある患者の免疫機能解析を行ったところ、放射線治療により増幅された遺伝子由来の新規がん特異抗原を認識するCD8陽性T細胞が体内で急速に増えていることが分かった。免疫原性を持つ遺伝子変異産物が放射線治療により免疫システムにさらされることがアブスコパル効果の発生に必要であるとする仮説を支持する結果だった。
背景:
姑息的放射線照射とイピリムマブ(抗CTLA-4抗体)の併用療法によるアブスコパル効果で完全寛解が長期持続している進行非小細胞肺がん患者の症例経験から、今回の臨床試験を企画した。病巣局所への姑息的放射線照射が、病巣それ自体をいわば「体内ワクチン」として免疫系に認識させ、さらにCTLA-4受容体をブロックすることによる抗腫瘍免疫反応との相乗効果を引き起こす、という仮説を検証することにした。
方法:
今回の第II相試験は単施設単アーム試験であり、試験デザインとしてサイモンのoptimal two-stage designを採用した。第1段階では10人の患者を組み入れ、全くアブスコパル効果が確認されなかった場合にはこの時点で無効中止とした。1人以上の患者でアブスコパル効果が確認出来たら、第2段階としてさらに29人の患者を組み入れることにした。全体として少なくとも4人(10.25%)でアブスコパル効果が確認できなければ無効とした。姑息的放射線治療は画像誘導放射線治療(image guided radiothrapy, IGRT)あるいは強度変調放射線治療(intensity modulated radiotherapy, IMRT)の手法を用いたリニアック外照射を用い、任意の1ヶ所の病巣に照射することとした。第I相部分(13人)では6GyX5回、第II相部分(26人)では9.5GyX3回の照射スケジュールとした。イピリムマブは3mg/kg/回の投与量で、1回目を放射線治療1日目に合わせて投与し、病勢進行、患者死亡、忍容不能の毒性発生、患者の臨床試験参加同意撤回のいずれかのイベントが発生するまで、3週間ごとに4コース反復した。主要評価項目は放射線照射範囲外における腫瘍縮小効果(Abscopal Response Rate, ARR)とした。プロトコール治療開始日を1日目とし、88日目に施行したPET/CTで効果判定を行った。効果判定の基準としては、irRCとRECIST1.1を併用した。
結果:
2014年06月から2015年04月までに39人の患者を集積した。年齢中央値は68歳(48-97)、男性16人(41%)、腺がん34人(87%)、扁平上皮がん3人(8%)、3レジメン以上の化学療法歴がある患者が17人(45%)、20-pack-year超の喫煙歴を有する患者が23人(61%)、転移のある臓器数の中央値は3(1-6)で、内訳は骨16人(41%)、脳16人(41%)、肝9人(23%)、肺34人(90%)、軟部組織他23人(61%)だった。ドライバー遺伝子変異(陽性者数/検索総数)はEGFRが6/29(21%)、ALKが0/19(0%)、ROS1が0/6(0%)、RETが1/11(9%)、KRASが7/20(35%)だった。39人中21人(54%)がプロトコール治療を完遂し、88日目のPET/CTによる効果判定を受けた。1人はプロトコール治療を完遂したものの、効果判定を受けなかった。17人はプロトコール治療を完遂できず、うち8人は治療中に死亡し、9人は治療中に病勢進行を来した。ARRは18%(7/39)だった。プロトコール治療を完遂した集団に限定すればARRは33%(7/21)で、7人中2人は完全奏効、5人は部分奏効だった。加えて5人は病勢安定の状態にあったため、放射線照射範囲外における病勢コントロール割合(Abscopal Control Rate, ACR)は31%(12/39)だった。生存者の経過観察期間中央値は43ヶ月(38-47)で、全患者集団における生存期間中央値は7.4ヶ月(95%信頼区間4.4-12.6)だった。プロトコール治療を完遂した患者集団では、生存期間中央値は13.0ヶ月(95%信頼区間10.6-25.2)であり、完遂できなかった患者集団の3.0ヶ月(95%信頼区間2.5-3.5)に比べて有意に延長していた(p<0.001)。放射線照射範囲外における病勢コントロールが得られた患者集団では、生存期間中央値は20.4ヶ月(95%信頼区間12.9-未到達)で、そうでない患者集団の3.5ヶ月(95%信頼区間3.1-7.4)に比べて有意に延長していた(p<0.001)。プロトコール治療を完遂した21人のうち4人はデータカットオフ時点で生存しており(うち3人では病勢コントロールが得られていた)、それぞれの生存期間は38ヶ月、42ヶ月、44ヶ月、47ヶ月だった。治療開始前に採取された腫瘍組織でのPD-L1発現状態、腫瘍組織へのCD8陽性T細胞の浸潤状態、放射線照射部位や照射スケジュールは、治療効果予測因子とはならなかった。プロトコール治療を完遂した患者集団21人において、放射線照射範囲外における病勢コントロールが得られた患者は12人で、そのうちEGFR遺伝子変異が検索されていたのは9人、陽性だったのは0人だったが、病勢進行と判定された残り9人のうち、EGFR遺伝子変異が検索されていたのは8人、陽性だったのは4人で、EGFR遺伝子変異陽性者には有意に病勢進行の患者が多かった(p=0.029)。
2021年08月19日
姑息的放射線照射による遠隔腫瘍縮小(アブスコパル)効果と免疫チェックポイント阻害薬 その1
免疫チェックポイント阻害薬がこれから実地臨床で使えるようになりそうだという時期に、「アブスコパル効果」という聞きなれない用語に触れ、頭にこびりついている。
放射線治療、または別の種類の局所療法が、標的の腫瘍を縮小させるだけでなく、離れている未治療の腫瘍も縮小させることをアブスコパル効果というそうだ。
放射線治療により物理的にがん細胞・組織が破壊され、そこから流出したがん細胞特有の蛋白質その他の構成要素(がん特異抗原)を患者の免疫システムが認識し、免疫反応が未治療の病巣を攻撃するものと理解した。
免疫チェックポイント阻害薬を使用するにあたり、放射線治療歴のある患者の方が治療効果が高いという報告が当時垣間見られており、免疫チェックポイント阻害薬は放射線治療によるアブスコパル効果を増強するのかもしれないという仮説が提唱されていた。
あれから6-7年もたっただろうか。
実臨床でも、確かに放射線治療歴のある患者の方が免疫チェックポイント阻害薬が効きやすい手ごたえがある。
局所進行非小細胞肺がんにおける化学放射線療法+デュルバルマブ併用療法の生存期間延長効果はPACIFIC試験で示されているし、これまた実臨床においてそれらしい感触は得られている。
進行期非小細胞肺がんの患者で、あるいはもしかしたら小細胞肺がんの患者でさえも、適切に化学療法や免疫チェックポイント阻害薬と根治的、ないしは姑息的な放射線治療を組み合わせることにより、より良好な治療効果が得られるかもしれない。
これまたあくまで仮説の域を出ないが、がん特異抗原の抽出という目的ならば、定位照射で、かつ照射範囲を絞って、放射線治療による毒性を極力低減し、薬物療法に与える影響を少なくするというコンセプトが成り立つだろう。
また、照射対象とする病巣についても、原発巣よりもより悪性度が高いと予想される転移巣を対象とする方が理に叶っていると考えられる。
こうしたコンセプトの臨床試験は、第II相の段階では既に結果が出ており、統合解析で良好な成績が示されていたので取り上げた。
これを読んで、姑息照射の適応がある病巣には躊躇なくなんらかの照射を行い、その前後で免疫チェックポイント阻害薬を使うようにしたいと思った。
今回は抗PD-1阻害薬であるペンブロリズマブに関する試験を取り上げるが、次回はさらに一歩進んで、抗CTLA-4抗体と放射線治療の併用に関する試験を取り上げたい。
Pembrolizumab with or without radiotherapy for metastatic non-small-cell lung cancer: a pooled analysis of two randomised trials
Willemijn S M E Theelen et al., Lancet Respir Med. 2021 May;9(5):467-475.
doi: 10.1016/S2213-2600(20)30391-X. Epub 2020 Oct 20.
背景:
放射線治療は免疫チェックポイント阻害薬による抗腫瘍効果を増強するかもしれない。第II相PEMBRO-RT試験と第I / II相MDACC試験において、進行非小細胞肺がんの患者をペンブロリズマブ+放射線治療併用療法群(Pembro-RT群)とペンブロリズマブ単独療法群(Pembro群)に無作為に割り付けた。これらの臨床試験を個別に解析したところ、併用療法群の有効性が示唆されたものの、対象患者数が少なかったことで奏効割合やその他の評価項目に統計学的有意差を認めなかった。そのため、進行非小細胞肺がん患者における免疫チェックポイント阻害薬の効果を放射線治療が増強するかどうかを推測するために、両試験に統合的解析を行った。
方法:
PEMBRO-RT試験とMDACC試験の適格条件は、18歳以上の進行非小細胞肺がん患者で、照射範囲外の測定可能病変として少なくとも1か所の放射線非照射予定部位を有することとした。PEMBRO-RT試験では、化学療法治療歴を有することが求められたが、MDACC試験では治療歴の有無は問われなかった。免疫チェックポイント阻害薬による治療歴のないことを条件とした。PEMBRO-RT試験では、割付調整因子を喫煙歴(<10-pack years vs ≧10 pack-years)として、対象患者をPembro-RT群とPembro群に1:1の割合で無作為に割り付けた。MDACC試験では、放射線治療スケジュールの忍容性に基づいて2群のコホートに対象患者を組み入れ、Pembro-RT群とPembro群に1:1の割合で無作為に割り付けた。放射線治療の性質上、どちらの試験でも盲検化はできなかった。両群ともに、ペンブロリズマブは1回200mgを3週間後ごとに経静脈投与した。PEMBRO-RT試験におけるペンブロリズマブの初回投与は、放射線治療(24Gyを3回分割照射)の最終照射に引き続いて1週間以内に行った。一方MDACC試験におけるペンブロリズマブの投与は、放射線治療(50Gyを4回分割照射、もしくは45Gyを15回分割照射)の初回照射と同時に行った。「放射線照射を行っていない病巣」のみを効果判定の対象とした。今回の統合解析における評価項目は、放射線照射範囲外の病巣における奏効割合(abscopal response rate, ARR)、放射線照射範囲外の病巣における病勢コントロール割合(abscopal disease control rate, ACR)、プロトコール治療開始後12週間目でのARRおよびACR、無増悪生存期間(PFS)、全生存期間(OS)とした。解析手法として、itention-to-treat解析を採用した。
結果:
全体として148人の患者が統合解析の対象となり、76人がPembro群、72人がPembro-RT群に割り付けられた。追跡期間中央値は33ヶ月(四分位間32.4-33.6)だった。148人中124人(84%)は非扁平上皮がんであり、111人(75%)は化学療法治療歴があった。両治療群に、PD-L1発現状態や転移巣の状態を含めた背景因子の偏りはなかった。Pembro-RT群において、放射線照射部位として頻度が高かったのは肺転移巣(72人中28人(39%))、胸郭内リンパ節(72人中15人(21%))、肺原発巣(72人中12人(17%))だった。ARRはPebro群で19.7%(76人中15人)、Pembro-RT群で41.7%(72人中30人)だった(オッズ比2.96、95%信頼区間1.42-6.20、p=0.0039)。ACRはPembro群で43.4%(76人中33人)、pembro-RT群で65.3%(72人中47人)だった(オッズ比2.51、95%信頼区間1.28-4.91、p=0.0071)。PFS中央値はPembro群で4.4ヶ月(四分位間2.9-5.9)、Pembro-RT群で9.0ヶ月(四分位間6.8-11.2)だった(ハザード比0.67、95%信頼区間0.45-0.99、p=0.045)。OS中央値はPembro群で8.7ヶ月(四分位間6.4-11.0)、Pembro-RT群で19.2ヶ月(14.6-23.8)だった(ハザード比0.67、95%信頼区間0.54-0.84、p=0.0004)。今回の統合解析において、未知の有害事象は確認できなかった。
結論:
進行期非小細胞肺がん患者のペンブロリズマブ単剤療法に放射線治療を上乗せすることにより、奏効割合他の治療効果が有意に向上した。今回の結果が、無作為化第III相臨床試験で検証されることが期待される。
また、プラチナ併用化学療法+ペンブロリズマブ+三次元/定位照射の生存期間延長効果を検証する第III相試験も既に進行中である。
こうした興味深いコンセプトを問う臨床試験は、伝統的にフランスで好んで計画される傾向がある。
エスプリを感じる。
PD-1 Inhibitor and Chemotherapy With Concurrent Irradiation at Varied Tumour Sites in Advanced Non-small Cell Lung Cancer (NIRVANA-LUNG)
ClinicalTrials.gov Identifier: NCT03774732
・三次元照射もしくは定位照射可能な原発巣/転移巣を有する進行非小細胞肺がん患者が対象
・プラチナ併用化学療法+ペンブロリズマブ併用療法に姑息的な三次元照射もしくは定位照射を上乗せすることの有効性と安全性を検証する第III相臨床試験
・主要評価項目は全生存期間で、2年生存割合を評価する
・フランス国内の23施設で、症例数460人を目標に実施中の多施設共同第III相試験
放射線治療、または別の種類の局所療法が、標的の腫瘍を縮小させるだけでなく、離れている未治療の腫瘍も縮小させることをアブスコパル効果というそうだ。
放射線治療により物理的にがん細胞・組織が破壊され、そこから流出したがん細胞特有の蛋白質その他の構成要素(がん特異抗原)を患者の免疫システムが認識し、免疫反応が未治療の病巣を攻撃するものと理解した。
免疫チェックポイント阻害薬を使用するにあたり、放射線治療歴のある患者の方が治療効果が高いという報告が当時垣間見られており、免疫チェックポイント阻害薬は放射線治療によるアブスコパル効果を増強するのかもしれないという仮説が提唱されていた。
あれから6-7年もたっただろうか。
実臨床でも、確かに放射線治療歴のある患者の方が免疫チェックポイント阻害薬が効きやすい手ごたえがある。
局所進行非小細胞肺がんにおける化学放射線療法+デュルバルマブ併用療法の生存期間延長効果はPACIFIC試験で示されているし、これまた実臨床においてそれらしい感触は得られている。
進行期非小細胞肺がんの患者で、あるいはもしかしたら小細胞肺がんの患者でさえも、適切に化学療法や免疫チェックポイント阻害薬と根治的、ないしは姑息的な放射線治療を組み合わせることにより、より良好な治療効果が得られるかもしれない。
これまたあくまで仮説の域を出ないが、がん特異抗原の抽出という目的ならば、定位照射で、かつ照射範囲を絞って、放射線治療による毒性を極力低減し、薬物療法に与える影響を少なくするというコンセプトが成り立つだろう。
また、照射対象とする病巣についても、原発巣よりもより悪性度が高いと予想される転移巣を対象とする方が理に叶っていると考えられる。
こうしたコンセプトの臨床試験は、第II相の段階では既に結果が出ており、統合解析で良好な成績が示されていたので取り上げた。
これを読んで、姑息照射の適応がある病巣には躊躇なくなんらかの照射を行い、その前後で免疫チェックポイント阻害薬を使うようにしたいと思った。
今回は抗PD-1阻害薬であるペンブロリズマブに関する試験を取り上げるが、次回はさらに一歩進んで、抗CTLA-4抗体と放射線治療の併用に関する試験を取り上げたい。
Pembrolizumab with or without radiotherapy for metastatic non-small-cell lung cancer: a pooled analysis of two randomised trials
Willemijn S M E Theelen et al., Lancet Respir Med. 2021 May;9(5):467-475.
doi: 10.1016/S2213-2600(20)30391-X. Epub 2020 Oct 20.
背景:
放射線治療は免疫チェックポイント阻害薬による抗腫瘍効果を増強するかもしれない。第II相PEMBRO-RT試験と第I / II相MDACC試験において、進行非小細胞肺がんの患者をペンブロリズマブ+放射線治療併用療法群(Pembro-RT群)とペンブロリズマブ単独療法群(Pembro群)に無作為に割り付けた。これらの臨床試験を個別に解析したところ、併用療法群の有効性が示唆されたものの、対象患者数が少なかったことで奏効割合やその他の評価項目に統計学的有意差を認めなかった。そのため、進行非小細胞肺がん患者における免疫チェックポイント阻害薬の効果を放射線治療が増強するかどうかを推測するために、両試験に統合的解析を行った。
方法:
PEMBRO-RT試験とMDACC試験の適格条件は、18歳以上の進行非小細胞肺がん患者で、照射範囲外の測定可能病変として少なくとも1か所の放射線非照射予定部位を有することとした。PEMBRO-RT試験では、化学療法治療歴を有することが求められたが、MDACC試験では治療歴の有無は問われなかった。免疫チェックポイント阻害薬による治療歴のないことを条件とした。PEMBRO-RT試験では、割付調整因子を喫煙歴(<10-pack years vs ≧10 pack-years)として、対象患者をPembro-RT群とPembro群に1:1の割合で無作為に割り付けた。MDACC試験では、放射線治療スケジュールの忍容性に基づいて2群のコホートに対象患者を組み入れ、Pembro-RT群とPembro群に1:1の割合で無作為に割り付けた。放射線治療の性質上、どちらの試験でも盲検化はできなかった。両群ともに、ペンブロリズマブは1回200mgを3週間後ごとに経静脈投与した。PEMBRO-RT試験におけるペンブロリズマブの初回投与は、放射線治療(24Gyを3回分割照射)の最終照射に引き続いて1週間以内に行った。一方MDACC試験におけるペンブロリズマブの投与は、放射線治療(50Gyを4回分割照射、もしくは45Gyを15回分割照射)の初回照射と同時に行った。「放射線照射を行っていない病巣」のみを効果判定の対象とした。今回の統合解析における評価項目は、放射線照射範囲外の病巣における奏効割合(abscopal response rate, ARR)、放射線照射範囲外の病巣における病勢コントロール割合(abscopal disease control rate, ACR)、プロトコール治療開始後12週間目でのARRおよびACR、無増悪生存期間(PFS)、全生存期間(OS)とした。解析手法として、itention-to-treat解析を採用した。
結果:
全体として148人の患者が統合解析の対象となり、76人がPembro群、72人がPembro-RT群に割り付けられた。追跡期間中央値は33ヶ月(四分位間32.4-33.6)だった。148人中124人(84%)は非扁平上皮がんであり、111人(75%)は化学療法治療歴があった。両治療群に、PD-L1発現状態や転移巣の状態を含めた背景因子の偏りはなかった。Pembro-RT群において、放射線照射部位として頻度が高かったのは肺転移巣(72人中28人(39%))、胸郭内リンパ節(72人中15人(21%))、肺原発巣(72人中12人(17%))だった。ARRはPebro群で19.7%(76人中15人)、Pembro-RT群で41.7%(72人中30人)だった(オッズ比2.96、95%信頼区間1.42-6.20、p=0.0039)。ACRはPembro群で43.4%(76人中33人)、pembro-RT群で65.3%(72人中47人)だった(オッズ比2.51、95%信頼区間1.28-4.91、p=0.0071)。PFS中央値はPembro群で4.4ヶ月(四分位間2.9-5.9)、Pembro-RT群で9.0ヶ月(四分位間6.8-11.2)だった(ハザード比0.67、95%信頼区間0.45-0.99、p=0.045)。OS中央値はPembro群で8.7ヶ月(四分位間6.4-11.0)、Pembro-RT群で19.2ヶ月(14.6-23.8)だった(ハザード比0.67、95%信頼区間0.54-0.84、p=0.0004)。今回の統合解析において、未知の有害事象は確認できなかった。
結論:
進行期非小細胞肺がん患者のペンブロリズマブ単剤療法に放射線治療を上乗せすることにより、奏効割合他の治療効果が有意に向上した。今回の結果が、無作為化第III相臨床試験で検証されることが期待される。
また、プラチナ併用化学療法+ペンブロリズマブ+三次元/定位照射の生存期間延長効果を検証する第III相試験も既に進行中である。
こうした興味深いコンセプトを問う臨床試験は、伝統的にフランスで好んで計画される傾向がある。
エスプリを感じる。
PD-1 Inhibitor and Chemotherapy With Concurrent Irradiation at Varied Tumour Sites in Advanced Non-small Cell Lung Cancer (NIRVANA-LUNG)
ClinicalTrials.gov Identifier: NCT03774732
・三次元照射もしくは定位照射可能な原発巣/転移巣を有する進行非小細胞肺がん患者が対象
・プラチナ併用化学療法+ペンブロリズマブ併用療法に姑息的な三次元照射もしくは定位照射を上乗せすることの有効性と安全性を検証する第III相臨床試験
・主要評価項目は全生存期間で、2年生存割合を評価する
・フランス国内の23施設で、症例数460人を目標に実施中の多施設共同第III相試験
2021年07月15日
肺がん診療におけるステロイド薬の使い方
少し前と比べると、肺がん診療におけるステロイド薬の使い方、考え方はとても複雑になった。
例を挙げて考えてみたい。
1)化学療法施行時の制吐薬として
デキサメサゾンが一般的に用いられるが、各治療の催吐性リスクに応じて、他の制吐薬とともに使用量が変わる。
とはいえ、この用途ではかなり明確にガイドラインに定められており、少なくとも初回治療時に悩むことはあまりない。
さらに言えば、初回治療時に良好に嘔気が制御されたら、その後用量調整をすることはほぼないだろう。
2)悪液質に対する支持療法として
最近になってアナモレリンが使えるようになったが、悪液質対策としてはステロイド薬の方が遥かに歴史が長く、使用している医師は多いだろう。
使用するステロイド薬、使用する量は医師によってさまざまである。
3)がん性リンパ管症に対する支持療法として
呼吸器領域では、がん性リンパ管症に対する支持療法としてステロイド薬がしばしば用いられる。
患者体重1kg当たり0.5mgのプレドニゾロンを使用するのが一般的ではないだろうか。
4)放射線肺臓炎に対する治療として
感覚として、胸部放射線治療後1-3ヶ月程度で放射線肺臓炎が顕在化することが多いように感じる。
放射線肺臓炎はそもそも長く続く病態なので、患者体重1kg当たり0.5mgのプレドニゾロンを開始し、病状に合わせて漸減しながら月単位で継続することが多い。
厄介なのは、放射線肺臓炎がまだ落ち着いていないうちに肺がんの病勢が悪化したときだ。
一般に10mg/日以上のプレドニゾロンを投与しながらがん薬物療法を行うのは困難なので、どこかで折り合いをつけなければならない。
しかし、一昔前に比べれば、前後対向二門→off cord planningで計60Gyという古典的な照射方法から、定位照射、サイバーナイフ照射、重粒子線と照射法が多様になり、少なくとも定位照射やサイバーナイフでは放射線肺臓炎が軽微に抑えられ、治療の必要がないか、あるいはプレドニゾロンを使ってもより少量、より短期間に抑えられるようになった。
また、これも傾向として、間質性肺炎の治療時のようにじっくり時間をかけて漸減するよりも、比較的短期間で減量、中止を目指し、再燃したら一定量からまた再開、という使い方をされることが増えたように感じる。
5)化学療法による薬剤性肺障害に対して
肺がんのみならず、多領域のがん種の化学療法においても、薬剤性肺障害はしばしば経験する。
薬剤性肺障害が発生したら被疑薬は中止、状況に応じてステロイドを投与し、効果が出るように天を仰ぐ。
深刻な場合は、メチルプレドニゾロンパルス療法まで行う。
6)分子標的薬による薬剤性肺障害に対して
お手軽、安全、安心をモットーに、2002年夏(もう20年も経つのか!)ゲフィチニブを嚆矢としてデビューした分子標的薬だが、上市されて間もなく、我々は薬剤性肺障害の脅威を知ることになった。
ざっと発症率5%、死亡率3%という特徴があり、我が国でも訴訟問題に発展し、海外では薬事承認取り消しにまで追い込まれた。
結局治療は被疑薬の中止とステロイド投与しかないというのが実情で、これは今も昔も変わらない。
7)免疫チェックポイント阻害薬による各種有害事象に対して
近年大きく変わったのはここだろう。
甲状腺機能異常やインシュリン依存性糖尿病といった、生理活性物質の制御もしくは補充で対応するしかないものはともかくとして、多くの免疫関連有害事象にはまずステロイドが使用される。
長く効き続ける免疫チェックポイント阻害薬の性質上、免疫関連有害事象も放射線肺臓炎と同様長期にわたり続くことが多く、いったん始めたステロイドをどのくらいの期間で中止に持っていくかというのは、なかなか難しい命題である。
1)は決まりきった使い方があるし、2)、3)は言ってしまえば患者が天寿を全うするまでひたすら一定量を使い続けるだけなので、そんなに困らない。
もっとも、3)ならば状況が許せばステロイドより先にがん薬物療法を行い、効果に期待するだろう。
問題は4)以下である。
ステロイド薬を使うにあたり、次なるステップのがん薬物療法に適確につなげるために、出口戦略を考えなければならない。
ステロイド薬を早く減らし過ぎればそれぞれの有害事象がぶり返すし、かといってダラダラとステロイド薬を続ければ次治療のタイミングを失ってしまう恐れがある。
例を挙げて考えてみたい。
1)化学療法施行時の制吐薬として
デキサメサゾンが一般的に用いられるが、各治療の催吐性リスクに応じて、他の制吐薬とともに使用量が変わる。
とはいえ、この用途ではかなり明確にガイドラインに定められており、少なくとも初回治療時に悩むことはあまりない。
さらに言えば、初回治療時に良好に嘔気が制御されたら、その後用量調整をすることはほぼないだろう。
2)悪液質に対する支持療法として
最近になってアナモレリンが使えるようになったが、悪液質対策としてはステロイド薬の方が遥かに歴史が長く、使用している医師は多いだろう。
使用するステロイド薬、使用する量は医師によってさまざまである。
3)がん性リンパ管症に対する支持療法として
呼吸器領域では、がん性リンパ管症に対する支持療法としてステロイド薬がしばしば用いられる。
患者体重1kg当たり0.5mgのプレドニゾロンを使用するのが一般的ではないだろうか。
4)放射線肺臓炎に対する治療として
感覚として、胸部放射線治療後1-3ヶ月程度で放射線肺臓炎が顕在化することが多いように感じる。
放射線肺臓炎はそもそも長く続く病態なので、患者体重1kg当たり0.5mgのプレドニゾロンを開始し、病状に合わせて漸減しながら月単位で継続することが多い。
厄介なのは、放射線肺臓炎がまだ落ち着いていないうちに肺がんの病勢が悪化したときだ。
一般に10mg/日以上のプレドニゾロンを投与しながらがん薬物療法を行うのは困難なので、どこかで折り合いをつけなければならない。
しかし、一昔前に比べれば、前後対向二門→off cord planningで計60Gyという古典的な照射方法から、定位照射、サイバーナイフ照射、重粒子線と照射法が多様になり、少なくとも定位照射やサイバーナイフでは放射線肺臓炎が軽微に抑えられ、治療の必要がないか、あるいはプレドニゾロンを使ってもより少量、より短期間に抑えられるようになった。
また、これも傾向として、間質性肺炎の治療時のようにじっくり時間をかけて漸減するよりも、比較的短期間で減量、中止を目指し、再燃したら一定量からまた再開、という使い方をされることが増えたように感じる。
5)化学療法による薬剤性肺障害に対して
肺がんのみならず、多領域のがん種の化学療法においても、薬剤性肺障害はしばしば経験する。
薬剤性肺障害が発生したら被疑薬は中止、状況に応じてステロイドを投与し、効果が出るように天を仰ぐ。
深刻な場合は、メチルプレドニゾロンパルス療法まで行う。
6)分子標的薬による薬剤性肺障害に対して
お手軽、安全、安心をモットーに、2002年夏(もう20年も経つのか!)ゲフィチニブを嚆矢としてデビューした分子標的薬だが、上市されて間もなく、我々は薬剤性肺障害の脅威を知ることになった。
ざっと発症率5%、死亡率3%という特徴があり、我が国でも訴訟問題に発展し、海外では薬事承認取り消しにまで追い込まれた。
結局治療は被疑薬の中止とステロイド投与しかないというのが実情で、これは今も昔も変わらない。
7)免疫チェックポイント阻害薬による各種有害事象に対して
近年大きく変わったのはここだろう。
甲状腺機能異常やインシュリン依存性糖尿病といった、生理活性物質の制御もしくは補充で対応するしかないものはともかくとして、多くの免疫関連有害事象にはまずステロイドが使用される。
長く効き続ける免疫チェックポイント阻害薬の性質上、免疫関連有害事象も放射線肺臓炎と同様長期にわたり続くことが多く、いったん始めたステロイドをどのくらいの期間で中止に持っていくかというのは、なかなか難しい命題である。
1)は決まりきった使い方があるし、2)、3)は言ってしまえば患者が天寿を全うするまでひたすら一定量を使い続けるだけなので、そんなに困らない。
もっとも、3)ならば状況が許せばステロイドより先にがん薬物療法を行い、効果に期待するだろう。
問題は4)以下である。
ステロイド薬を使うにあたり、次なるステップのがん薬物療法に適確につなげるために、出口戦略を考えなければならない。
ステロイド薬を早く減らし過ぎればそれぞれの有害事象がぶり返すし、かといってダラダラとステロイド薬を続ければ次治療のタイミングを失ってしまう恐れがある。
2021年07月01日
アンサーとセファランチン、放射線治療とリンパ球
セファランチン、最近めっきり使わなくなってしまった薬の1つである。
とても不思議な薬で、効能・効果は、
「放射線による白血球減少」「円形脱毛症・粃糠性脱毛症」
とされている。
かつて、胸部放射線治療を開始した患者さんによく処方していたが、効果があるのかないのかよく分からず、いつからか処方しなくなった。
インタビューフォームを確認しても、有効性については以下のような記載しかない。
「放射線による白血球減少症に対する効果:放射線による白血球減少症 264 例に対する有効率は、「有効」以上で 64.8%(171/264)、「やや
有効」以上で 83.3%(220/264)であった」
一方、アンサー皮下注は、そもそも使ったことがない。
この薬はセファランチンよりももっとトンガっていて、効能・効果は、
「放射線療法による白血球減少症」
と潔いくらいにこの用法に特化した薬である。
1日1回皮下注射、週に2回を放射線治療継続中は継続するとのこと。
こちらは二重盲検比較試験で有効性が検証されており、
「放射線療法に起因する白血球減少症に対するアンサー皮下注 20μgの臨床的有用性を、肺癌患者において感染症併発を指標とし、プラセボ(生理食塩液)を対照とした二重盲検比較試験により検討した。その結果、感染症併発の発生率は、アンサー皮下注 20μg群 6.7%、プラセボ群21.2%でアンサー皮下注 20μg群の方が低値であった。また感染症の累積発生率および疑感染を含む 3 段階の感染症併発の検討では、アンサー皮下注 20μg群で感染症の併発が有意に抑制されていた」
とのこと。
さらに、インタビューフォームを注意深く読んでみると、開発の経緯の項に
「本剤は 1956 年に日本医科大学皮膚科学教室 丸山千里博士により、人型結核菌青山 B 株から製造された結核菌体抽出物質である」
「本剤は基礎的検討で造血機能亢進作用並びに白血球減少回復促進作用が見出され、1986 年から臨床試験を開始し、放射線治療時の白血球減少に対する有用性が確認された」
とある。
・・・早い話が、丸山ワクチンのB液ということですか?
B液だけとはいえ、保険適応の薬として市販されているとは知らなかった。
コロニー刺激因子やIL-3の発現を誘導して、顆粒球や単球を増やすとのこと。
なぜこんなことを書き始めたかというと、III期局所進行非小細胞肺がん放射線治療中のリンパ球が多く保たれる方が、生命予後がよいという話を聞いたからである。
この論文では、放射線治療中のリンパ球最低値が≦500ケ/μLのグループと>500ケ/μLのグループとで比較したところ、後者の方が無増悪生存期間、全生存期間共に統計学的有意に優れていたとのこと。
じゃあリンパ球を増やす薬を併用しながら治療すればいいんじゃない?ということでアンサーとセファランチンを調べてみたのだが、残念ながらリンパ球を増やすような薬ではなかったようだ。
Treatment-duration is related to changes in peripheral lymphocyte counts during definitive radiotherapy for unresectable stage III NSCLC
Luke R G Pike et al., Radiat Oncol. 2019 May 27;14(1):86.
doi: 10.1186/s13014-019-1287-z.
背景:
非小細胞肺がん治療における根治的胸部放射線照射中における分割照射方法が、リンパ球減少症の程度に、さらには患者の生命予後に影響を与えるかどうかを検証した。
方法:
切除不能III期非小細胞肺がん患者で、異なる照射量・分割方法により根治的胸部放射線照射を受けた115人の患者を対象とした。カルテと臨床検査データを見直して、放射線治療中のリンパ球数の変化を評価した。リンパ球数と臨床経過の相関を解析した。
結果:
患者全体におけるリンパ球数減少値の中央値は1,300/μL(四分位区間は950-1510/μL)だった。全体のうち63人(54.8%)は、リンパ球数<500/μLと高度のリンパ球減少症に見舞われており、この状態になるまでの期間の中央値は放射線治療開始から5週目であり、放射線治療終了時や総照射量が最大になった時点ではなかった。高度のリンパ球減少を来すリスクは当初5週間で増加し(オッズ比は3.455、p=0.007)、その後はリスク増加は確認できなかった(オッズ比0.562、p=0.216)。リンパ球数の中央値は、放射線治療を完遂してから2ヶ月経過しても低値のままであり、治療開始前の水準には回復しなかった。高度の好中球減少に至らないことは独立した予後良好因子で、多変数解析で交絡因子を調整したあとでも、有意に無増悪生存期間(ハザード比0.544、p=0.010)、全生存期間(ハザード比0.463、p=0.011)を延長していた。高度のリンパ球減少は、全治療期間4週以内(3Gy/回×20回)の患者集団の方が、全治療期間4週間超(2Gy/回×30回)の患者集団よりも頻度が低かった(32.1% vs 62.1%、オッズ比0.289で71.1%の相対リスク低下、p=0.006)。多変数解析では、全治療期間4週以内であることがリンパ球減少のリスクを低減する独立した因子だった(オッズ比0.322、p=0.032)。
結論:
切除不能III期非小細胞肺がん患者において、3Gy/回×20回の放射線照射法は有意に高度のリンパ球減少リスクを低下させ、生命予後を改善することが示された。
とても不思議な薬で、効能・効果は、
「放射線による白血球減少」「円形脱毛症・粃糠性脱毛症」
とされている。
かつて、胸部放射線治療を開始した患者さんによく処方していたが、効果があるのかないのかよく分からず、いつからか処方しなくなった。
インタビューフォームを確認しても、有効性については以下のような記載しかない。
「放射線による白血球減少症に対する効果:放射線による白血球減少症 264 例に対する有効率は、「有効」以上で 64.8%(171/264)、「やや
有効」以上で 83.3%(220/264)であった」
一方、アンサー皮下注は、そもそも使ったことがない。
この薬はセファランチンよりももっとトンガっていて、効能・効果は、
「放射線療法による白血球減少症」
と潔いくらいにこの用法に特化した薬である。
1日1回皮下注射、週に2回を放射線治療継続中は継続するとのこと。
こちらは二重盲検比較試験で有効性が検証されており、
「放射線療法に起因する白血球減少症に対するアンサー皮下注 20μgの臨床的有用性を、肺癌患者において感染症併発を指標とし、プラセボ(生理食塩液)を対照とした二重盲検比較試験により検討した。その結果、感染症併発の発生率は、アンサー皮下注 20μg群 6.7%、プラセボ群21.2%でアンサー皮下注 20μg群の方が低値であった。また感染症の累積発生率および疑感染を含む 3 段階の感染症併発の検討では、アンサー皮下注 20μg群で感染症の併発が有意に抑制されていた」
とのこと。
さらに、インタビューフォームを注意深く読んでみると、開発の経緯の項に
「本剤は 1956 年に日本医科大学皮膚科学教室 丸山千里博士により、人型結核菌青山 B 株から製造された結核菌体抽出物質である」
「本剤は基礎的検討で造血機能亢進作用並びに白血球減少回復促進作用が見出され、1986 年から臨床試験を開始し、放射線治療時の白血球減少に対する有用性が確認された」
とある。
・・・早い話が、丸山ワクチンのB液ということですか?
B液だけとはいえ、保険適応の薬として市販されているとは知らなかった。
コロニー刺激因子やIL-3の発現を誘導して、顆粒球や単球を増やすとのこと。
なぜこんなことを書き始めたかというと、III期局所進行非小細胞肺がん放射線治療中のリンパ球が多く保たれる方が、生命予後がよいという話を聞いたからである。
この論文では、放射線治療中のリンパ球最低値が≦500ケ/μLのグループと>500ケ/μLのグループとで比較したところ、後者の方が無増悪生存期間、全生存期間共に統計学的有意に優れていたとのこと。
じゃあリンパ球を増やす薬を併用しながら治療すればいいんじゃない?ということでアンサーとセファランチンを調べてみたのだが、残念ながらリンパ球を増やすような薬ではなかったようだ。
Treatment-duration is related to changes in peripheral lymphocyte counts during definitive radiotherapy for unresectable stage III NSCLC
Luke R G Pike et al., Radiat Oncol. 2019 May 27;14(1):86.
doi: 10.1186/s13014-019-1287-z.
背景:
非小細胞肺がん治療における根治的胸部放射線照射中における分割照射方法が、リンパ球減少症の程度に、さらには患者の生命予後に影響を与えるかどうかを検証した。
方法:
切除不能III期非小細胞肺がん患者で、異なる照射量・分割方法により根治的胸部放射線照射を受けた115人の患者を対象とした。カルテと臨床検査データを見直して、放射線治療中のリンパ球数の変化を評価した。リンパ球数と臨床経過の相関を解析した。
結果:
患者全体におけるリンパ球数減少値の中央値は1,300/μL(四分位区間は950-1510/μL)だった。全体のうち63人(54.8%)は、リンパ球数<500/μLと高度のリンパ球減少症に見舞われており、この状態になるまでの期間の中央値は放射線治療開始から5週目であり、放射線治療終了時や総照射量が最大になった時点ではなかった。高度のリンパ球減少を来すリスクは当初5週間で増加し(オッズ比は3.455、p=0.007)、その後はリスク増加は確認できなかった(オッズ比0.562、p=0.216)。リンパ球数の中央値は、放射線治療を完遂してから2ヶ月経過しても低値のままであり、治療開始前の水準には回復しなかった。高度の好中球減少に至らないことは独立した予後良好因子で、多変数解析で交絡因子を調整したあとでも、有意に無増悪生存期間(ハザード比0.544、p=0.010)、全生存期間(ハザード比0.463、p=0.011)を延長していた。高度のリンパ球減少は、全治療期間4週以内(3Gy/回×20回)の患者集団の方が、全治療期間4週間超(2Gy/回×30回)の患者集団よりも頻度が低かった(32.1% vs 62.1%、オッズ比0.289で71.1%の相対リスク低下、p=0.006)。多変数解析では、全治療期間4週以内であることがリンパ球減少のリスクを低減する独立した因子だった(オッズ比0.322、p=0.032)。
結論:
切除不能III期非小細胞肺がん患者において、3Gy/回×20回の放射線照射法は有意に高度のリンパ球減少リスクを低下させ、生命予後を改善することが示された。
2021年06月20日
PACIFIC試験における5年生存割合は42.9%
いよいよPACIFIC試験の5年生存割合データが出てきた。
デュルバルマブを使用していない患者の5年生存割合33.4%も十分立派な数字だと思うが、デュルバルマブを使用するとこれが42.9%にまで跳ね上がる。
ここまでくると、もはやIII期の患者に手術をする、という選択はしにくくなる。
術前治療や術後治療で42.9%よりも高い5年生存割合をたたき出さないと、手術の意義は乏しいと言わざるを得ない。
Five-year survival outcomes with durvalumab after chemoradiotherapy in unresectable stage III NSCLC: An update from the PACIFIC trial.
David R. Spigel et al., 2021 ASCO Annual Meeting, abst.#8511
背景:
プラチナ併用化学療法+同時併用根治的胸部放射線療法後に病勢進行を認めなかった切除不能III期非小細胞肺がん患者を対象としたプラセボ対照第III相PACIFIC試験において、デュルバルマブは全生存期間(OS、層別化ハザード比0.68、95%信頼区間0.53-0.87、p=0.0025、データカットオフは2018年03月22日)および無増悪生存期間(PFS、層別化ハザード比0.52、95%信頼区間0.42-0.65、p<0.0001、データカットオフ2017年02月13日)ともに改善し、その後のデータ更新でも同様の有用性が維持されていた。デュルバルマブによる有害事象は管理可能であり、患者本人申告によるQoL調査でも、プラセボに対して有害な影響は見られなかった。こうした発見により、化学放射線療法後のデュルバルマブ地固め療法(PACIFICレジメン)は本試験参加者のような患者集団にとっての標準治療となった。今回は、最後の参加者が登録されてから約5年間経過したため、OSとPFSについて探索的な解析を行った。
方法:
WHO-PS 0/1(PD-L1発現状態は問わない)で、同時併用化学放射線療法(少なくとも2コース以上は併用)の後に病勢進行に至らなかった適格患者を対象として、2:1の割合でデュルバルマブ(D)群とプラセボ(P)群に割り付けた。同時併用化学放射線療法(根治的胸部放射線照射として、典型的には計60-66Gyを30-33回で分割投与)終了後1-42日の間に、D群ではデュルバルマブを10mg/kgで2週間ごとに12ヶ月間投与し、P群ではプラセボを同様に投与した。層別化因子は年齢(65歳未満 vs 65歳以上)、性別、喫煙歴(喫煙経験者 vs 非喫煙経験者)とした。主要評価項目はIntent-to-treat(ITT)解析による全生存期間及び無増悪生存期間(RECIST vsr.1.1準拠で、独立判定委員会による)とした。ハザード比と95%信頼区間はITT集団における層別化ログランク検定により算出した。60ヶ月経過時点での全生存期間および無増悪生存期間の中央値は、カプランマイヤー法で算出した。
結果:
全体で713人の患者が無作為割付を受け、そのうち709人がプロトコール治療を受けた。D群に割り付けられたのが476人、うちプロトコール治療を受けたのが473人、P群に割り付けられたのが237人、うちプロトコール治療を受けたのが236人だった。参加した患者のうち最後の1人がプロトコール治療を完遂したのが2017年05月だった。2021年1月11日までの段階で(全患者の追跡期間中央値は34.2ヶ月で、範囲は0.2-74.7ヶ月)、t全生存期間(中央値はD群47.5ヶ月、P群29.1ヶ月、ハザード比0.72、95%信頼区間0.59-0.89)、無増悪生存期間(中央値はD群16.9ヶ月、P群5.6ヶ月、95%信頼区間0.45-0.68、ハザード比0.55)と、当初の解析時点と同様にD群がOS、PFSを有意に延長するという傾向を維持していた。5年生存割合はD群42.9%、P群33.4%、5年無再発生存割合はD群33.1%、P群19.0%だった。
結論:
PACIFIC試験の5年間追跡調査結果から、今回の生存期間解析の最新データはPACIFICレジメンの全生存期間、無増悪生存期間延長効果を実証した。D群の42.9%が5年後も生きていると見積もられており、5年経過後も約1/3の患者は病勢進行なく生存している。
デュルバルマブを使用していない患者の5年生存割合33.4%も十分立派な数字だと思うが、デュルバルマブを使用するとこれが42.9%にまで跳ね上がる。
ここまでくると、もはやIII期の患者に手術をする、という選択はしにくくなる。
術前治療や術後治療で42.9%よりも高い5年生存割合をたたき出さないと、手術の意義は乏しいと言わざるを得ない。
Five-year survival outcomes with durvalumab after chemoradiotherapy in unresectable stage III NSCLC: An update from the PACIFIC trial.
David R. Spigel et al., 2021 ASCO Annual Meeting, abst.#8511
背景:
プラチナ併用化学療法+同時併用根治的胸部放射線療法後に病勢進行を認めなかった切除不能III期非小細胞肺がん患者を対象としたプラセボ対照第III相PACIFIC試験において、デュルバルマブは全生存期間(OS、層別化ハザード比0.68、95%信頼区間0.53-0.87、p=0.0025、データカットオフは2018年03月22日)および無増悪生存期間(PFS、層別化ハザード比0.52、95%信頼区間0.42-0.65、p<0.0001、データカットオフ2017年02月13日)ともに改善し、その後のデータ更新でも同様の有用性が維持されていた。デュルバルマブによる有害事象は管理可能であり、患者本人申告によるQoL調査でも、プラセボに対して有害な影響は見られなかった。こうした発見により、化学放射線療法後のデュルバルマブ地固め療法(PACIFICレジメン)は本試験参加者のような患者集団にとっての標準治療となった。今回は、最後の参加者が登録されてから約5年間経過したため、OSとPFSについて探索的な解析を行った。
方法:
WHO-PS 0/1(PD-L1発現状態は問わない)で、同時併用化学放射線療法(少なくとも2コース以上は併用)の後に病勢進行に至らなかった適格患者を対象として、2:1の割合でデュルバルマブ(D)群とプラセボ(P)群に割り付けた。同時併用化学放射線療法(根治的胸部放射線照射として、典型的には計60-66Gyを30-33回で分割投与)終了後1-42日の間に、D群ではデュルバルマブを10mg/kgで2週間ごとに12ヶ月間投与し、P群ではプラセボを同様に投与した。層別化因子は年齢(65歳未満 vs 65歳以上)、性別、喫煙歴(喫煙経験者 vs 非喫煙経験者)とした。主要評価項目はIntent-to-treat(ITT)解析による全生存期間及び無増悪生存期間(RECIST vsr.1.1準拠で、独立判定委員会による)とした。ハザード比と95%信頼区間はITT集団における層別化ログランク検定により算出した。60ヶ月経過時点での全生存期間および無増悪生存期間の中央値は、カプランマイヤー法で算出した。
結果:
全体で713人の患者が無作為割付を受け、そのうち709人がプロトコール治療を受けた。D群に割り付けられたのが476人、うちプロトコール治療を受けたのが473人、P群に割り付けられたのが237人、うちプロトコール治療を受けたのが236人だった。参加した患者のうち最後の1人がプロトコール治療を完遂したのが2017年05月だった。2021年1月11日までの段階で(全患者の追跡期間中央値は34.2ヶ月で、範囲は0.2-74.7ヶ月)、t全生存期間(中央値はD群47.5ヶ月、P群29.1ヶ月、ハザード比0.72、95%信頼区間0.59-0.89)、無増悪生存期間(中央値はD群16.9ヶ月、P群5.6ヶ月、95%信頼区間0.45-0.68、ハザード比0.55)と、当初の解析時点と同様にD群がOS、PFSを有意に延長するという傾向を維持していた。5年生存割合はD群42.9%、P群33.4%、5年無再発生存割合はD群33.1%、P群19.0%だった。
結論:
PACIFIC試験の5年間追跡調査結果から、今回の生存期間解析の最新データはPACIFICレジメンの全生存期間、無増悪生存期間延長効果を実証した。D群の42.9%が5年後も生きていると見積もられており、5年経過後も約1/3の患者は病勢進行なく生存している。
2021年01月11日
学会報告0005:脳転移再発、定位放射線照射後の長期生存
小細胞肺がんであろうが、非小細胞肺がんであろうが、脳転移のみの再燃、再発というのはなかなか悩ましい。
ドライバー遺伝子変異を伴っており、分子標的薬が使えるならばまだしも。
放射線治療を終えた後の治療方針となると、薬物療法が脳転移に効きにくいのはある程度分かっているので、次の治療を計画しがたい。
とはいえ、経過観察だけでも、結構長生きする人はいる。
近々、最近脳梗塞を起こしたそんな肺がん患者が、リハビリ目的で当院に転院してくる予定。
前回退院からゆうに5年以上経過しているが、その間に脳転移再発を経験し、定位脳照射を受け、後期高齢者ながら独居で頑張っていたようだ。
脳転移が見つかったとき、放射線治療よりも薬物療法を優先する考え方もあるが、私はやはり確実な効果が期待できる定位放射線治療を優先したい。
こういう患者に遭遇すると、どうしてもそんな気持ちになる。
<学会報告0005>
出典:2020年 日本肺癌学会支部会 / 日本呼吸器内視鏡学会支部会
・60代男性、喫煙者
・限局型肺小細胞癌と確定診断
・シスプラチン+エトポシド併用療法+根治的胸部放射線照射
・完全奏効が得られた
・引き続き、予防的全脳照射を行った
・初回治療から2年後、左小脳半球に単発の脳転移を来し再燃
・カルボプラチン+エトポシド併用療法を行うも脳転移巣は縮小せず
・手術は本人が希望せず
・定位脳照射施行
・定位照射後5年以上無増悪生存し、認知機能障害を認めず
ドライバー遺伝子変異を伴っており、分子標的薬が使えるならばまだしも。
放射線治療を終えた後の治療方針となると、薬物療法が脳転移に効きにくいのはある程度分かっているので、次の治療を計画しがたい。
とはいえ、経過観察だけでも、結構長生きする人はいる。
近々、最近脳梗塞を起こしたそんな肺がん患者が、リハビリ目的で当院に転院してくる予定。
前回退院からゆうに5年以上経過しているが、その間に脳転移再発を経験し、定位脳照射を受け、後期高齢者ながら独居で頑張っていたようだ。
脳転移が見つかったとき、放射線治療よりも薬物療法を優先する考え方もあるが、私はやはり確実な効果が期待できる定位放射線治療を優先したい。
こういう患者に遭遇すると、どうしてもそんな気持ちになる。
<学会報告0005>
出典:2020年 日本肺癌学会支部会 / 日本呼吸器内視鏡学会支部会
・60代男性、喫煙者
・限局型肺小細胞癌と確定診断
・シスプラチン+エトポシド併用療法+根治的胸部放射線照射
・完全奏効が得られた
・引き続き、予防的全脳照射を行った
・初回治療から2年後、左小脳半球に単発の脳転移を来し再燃
・カルボプラチン+エトポシド併用療法を行うも脳転移巣は縮小せず
・手術は本人が希望せず
・定位脳照射施行
・定位照射後5年以上無増悪生存し、認知機能障害を認めず
2020年09月10日
ONO-4538-52/TASUKI-52試験
小野薬品工業から、以下のようなプレスリリースが発出されていたようだ。
参加患者の約70%を日本人が占めていたとのこと。
https://www.ono.co.jp/jpnw/PDF/n20_0803.pdf
<化学療法未治療の根治照射不能なIIIB / IV期又は再発の非扁平上皮非小細胞肺がんを対象とした第Ⅲ相臨床試験において、オプジーボ、ベバシズマブと化学療法の併用療法群が、有意な無増悪生存期間の延長を示す>
2020/08/03
小野薬品工業株式会社(本社:大阪市中央区、代表取締役社長:相良 暁、以下、当社)は、本日、ヒト型抗ヒト PD-1 モノクローナル抗体、オプジーボ®(一般名:ニボルマブ)点滴静注(以下、オプジーボ)について、化学療法未治療の根治照射不能なⅢB/Ⅳ期又は再発の非扁平上皮非小細胞肺がん(NSCLC)患者を対象に、オプジーボ、抗 VEGF(Vascular Endothelial Growth Factor:血管内皮増殖因子)ヒト化モノクローナル抗体であるベバシズマブと化学療法の併用療法群(オプジーボ併用療法群:275 例)をプラセボ、ベバシズマブと化学療法の併用療法群(対照併用療法群:275 例)と比較評価した第Ⅲ相臨床試験(ONO-4538-52/TASUKI-52)のトップライン結果が得られましたので、お知らせします。本試験において、予め計画していた中間解析で、オプジーボ併用療法群が、対照併用療法群と比較して、主要評価項目である無増悪生存期間(PFS)で統計学的に有意な延長を示しました。本試験におけるオプジーボ併用療法群の安全性プロファイルは、化学療法未治療の NSCLC 治療において免疫チェックポイント阻害剤、およびベバシズマブと化学療法の併用療法でこれまでに認められているものと一貫していました。
<ONO-4538-52/TASUKI-52 試験について>
本試験は、化学療法未治療の根治照射不能なⅢB/Ⅳ期又は再発の非扁平上皮 NSCLC を対象に、オプジーボ、ベバシズマブと化学療法の併用療法群(オプジーボ併用療法群:275 例)をプラセボ、ベバシズマブと化学療法の併用療法群(対照併用療法群:275 例)と比較評価した多施設共同二重盲検無作為化プラセボ対照第Ⅲ相試験(ONO-4538-52/TASUKI-52)です。オプジーボ併用療法群の患者には、オプジーボ 360 mg、カルボプラチン AUC 6、パクリタキセル 200 mg/m2およびベバシズマブ 15 mg/kg を 3 週間 1 サイクルとして投与し、対照併用療法群の患者には、プラセボ、カルボプラチン AUC 6、パクリタキセル 200 mg/m2およびベバシズマブ 15 mg/kg を 3 週間 1 サイクルとして投与しました。両群ともカルボプラチンおよびパクリタキセルは 4 サイクルまで投与し、安全に投与を継続することが可能と判断された場合は最大 6 サイクルまで投与継続可能としました。その後、オプジーボ併用療法群ではオプジーボおよびベバシズマブの投与を、対照併用療法群ではプラセボおよびベバシズマブの投与を病勢進行又は許容できない毒性が確認されるまで継続しました。本試験の主要評価項目は、独立画像判定委員会の評価に基づくPFSです。副次評価項目は、全生存期間(OS)、実施医療機関の医師判定に基づく PFS および奏効率(ORR)などです。
参加患者の約70%を日本人が占めていたとのこと。
https://www.ono.co.jp/jpnw/PDF/n20_0803.pdf
<化学療法未治療の根治照射不能なIIIB / IV期又は再発の非扁平上皮非小細胞肺がんを対象とした第Ⅲ相臨床試験において、オプジーボ、ベバシズマブと化学療法の併用療法群が、有意な無増悪生存期間の延長を示す>
2020/08/03
小野薬品工業株式会社(本社:大阪市中央区、代表取締役社長:相良 暁、以下、当社)は、本日、ヒト型抗ヒト PD-1 モノクローナル抗体、オプジーボ®(一般名:ニボルマブ)点滴静注(以下、オプジーボ)について、化学療法未治療の根治照射不能なⅢB/Ⅳ期又は再発の非扁平上皮非小細胞肺がん(NSCLC)患者を対象に、オプジーボ、抗 VEGF(Vascular Endothelial Growth Factor:血管内皮増殖因子)ヒト化モノクローナル抗体であるベバシズマブと化学療法の併用療法群(オプジーボ併用療法群:275 例)をプラセボ、ベバシズマブと化学療法の併用療法群(対照併用療法群:275 例)と比較評価した第Ⅲ相臨床試験(ONO-4538-52/TASUKI-52)のトップライン結果が得られましたので、お知らせします。本試験において、予め計画していた中間解析で、オプジーボ併用療法群が、対照併用療法群と比較して、主要評価項目である無増悪生存期間(PFS)で統計学的に有意な延長を示しました。本試験におけるオプジーボ併用療法群の安全性プロファイルは、化学療法未治療の NSCLC 治療において免疫チェックポイント阻害剤、およびベバシズマブと化学療法の併用療法でこれまでに認められているものと一貫していました。
<ONO-4538-52/TASUKI-52 試験について>
本試験は、化学療法未治療の根治照射不能なⅢB/Ⅳ期又は再発の非扁平上皮 NSCLC を対象に、オプジーボ、ベバシズマブと化学療法の併用療法群(オプジーボ併用療法群:275 例)をプラセボ、ベバシズマブと化学療法の併用療法群(対照併用療法群:275 例)と比較評価した多施設共同二重盲検無作為化プラセボ対照第Ⅲ相試験(ONO-4538-52/TASUKI-52)です。オプジーボ併用療法群の患者には、オプジーボ 360 mg、カルボプラチン AUC 6、パクリタキセル 200 mg/m2およびベバシズマブ 15 mg/kg を 3 週間 1 サイクルとして投与し、対照併用療法群の患者には、プラセボ、カルボプラチン AUC 6、パクリタキセル 200 mg/m2およびベバシズマブ 15 mg/kg を 3 週間 1 サイクルとして投与しました。両群ともカルボプラチンおよびパクリタキセルは 4 サイクルまで投与し、安全に投与を継続することが可能と判断された場合は最大 6 サイクルまで投与継続可能としました。その後、オプジーボ併用療法群ではオプジーボおよびベバシズマブの投与を、対照併用療法群ではプラセボおよびベバシズマブの投与を病勢進行又は許容できない毒性が確認されるまで継続しました。本試験の主要評価項目は、独立画像判定委員会の評価に基づくPFSです。副次評価項目は、全生存期間(OS)、実施医療機関の医師判定に基づく PFS および奏効率(ORR)などです。
2020年07月15日
第3世代EGFRチロシンキナーゼ阻害薬使用後の中枢神経転移を有する患者に、オシメルチニブ「倍返し」
オシメルチニブを含む第3世代チロシンキナーゼ阻害薬使用後に中枢神経転移(脳転移、髄膜癌腫症を含む)で病勢進行に至った患者に、オシメルチニブを「倍返し」するという臨床試験が行われたようだ。
毒性について、肝障害に関する記載はないが、下痢はGrade 2以下ながら40-50%に見られたとのことで、やはり無視できない毒性なのだろう。
A phase II, multicenter, two cohort study of 160 mg osimertinib in EGFR T790M-positive non-small cell lung cancer patients with brain metastases or leptomeningeal disease who progressed on prior EGFR TKI therapy
S.Park et al., Ann Oncol in press, 2020
https://doi.org/10.1016/j.annonc.2020.06.017
背景:
EGFR遺伝子変異陽性非小細胞肺がん患者で、EGFRチロシンキナーゼ阻害薬による治療を受けた人のうち、40%程度は脳転移や髄膜癌腫症による病勢進行に至る。オシメルチニブは第3世代、非可逆性、経口投与のEGFRチロシンキナーゼ阻害薬であるが、活動性中枢神経転移に対する効果を示している。しかし、脳転移や髄膜癌腫症に対するオシメルチニブ160mg/日(通常用量である80mg/日の2倍量)治療がどの程度の効果を示すのかは明らかでない。
患者と方法:
今回の前向き単アーム、2コホートから構成される臨床試験は、EGFRチロシンキナーゼ阻害薬による前治療ののちに病勢進行に至った進行非小細胞肺がん患者で、T790M耐性変異が確認され、脳転移もしくは髄膜癌腫症を有するものを対象に、オシメルチニブ160mg/日内服治療の効果を検証する試験である。主要評価項目は各コホートごとに個別に設定した。すなわち、脳転移コホートでは奏効割合とし、期待奏効割合を30%と見積もった。一方髄膜癌腫症コホートでは生存期間とし、期待生存期間を5か月と見積もった。
結果:
経過観察期間中央値は、脳転移コホートで10.1ヶ月、髄膜癌腫症コホートで9.6ヶ月だった。脳転移コホート(計40人)では、頭蓋内病巣に関する奏効割合は55.0%、同じく病勢コントロール割合は77.5%だった。無増悪生存期間中央値は7.6ヶ月(95%信頼区間は5.0-16.6ヶ月)、生存期間中央値は16.9ヶ月(95%信頼区間は7.9ヶ月-未到達)だった。髄膜癌腫症コホート(計40人)では、頭蓋内病巣に関する病勢コントロール割合は92.5%、完全奏効割合は12.5%だった。生存期間中央値は13.3ヶ月(95%信頼区間は9.1ヶ月から未到達)だった。無増悪生存期間中央値は8.0ヶ月(95%信頼区間は7.2ヶ月から未到達)だった。前治療でどのT790M耐性変異に活性を示すEGFRチロシンキナーゼ阻害薬を使用したかのサブグループ解析では、オシメルチニブ80mg/日とその他の第3世代EGFRチロシンキナーゼ阻害薬の間で、無増悪生存期間の有意差は認められなかった(脳転移コホート18人ではp=0.39、髄膜癌腫症コホート17人ではp=0.85)。脳転移コホートでは、脳転移巣に対する放射線治療歴は無増悪生存期間延長に関する予後良好因子だった(ハザード比0.42、p=0.04)。主要な有害事象は食欲不振、下痢、発疹だったが、ほとんどGrade 1-2に留まっていた。
結論:
160mg/回のオシメルチニブ投与は、今回の治療対象となった患者に対して有望な腫瘍縮小効果と生存期間延長効果を示し、毒性も許容範囲内だった。
毒性について、肝障害に関する記載はないが、下痢はGrade 2以下ながら40-50%に見られたとのことで、やはり無視できない毒性なのだろう。
A phase II, multicenter, two cohort study of 160 mg osimertinib in EGFR T790M-positive non-small cell lung cancer patients with brain metastases or leptomeningeal disease who progressed on prior EGFR TKI therapy
S.Park et al., Ann Oncol in press, 2020
https://doi.org/10.1016/j.annonc.2020.06.017
背景:
EGFR遺伝子変異陽性非小細胞肺がん患者で、EGFRチロシンキナーゼ阻害薬による治療を受けた人のうち、40%程度は脳転移や髄膜癌腫症による病勢進行に至る。オシメルチニブは第3世代、非可逆性、経口投与のEGFRチロシンキナーゼ阻害薬であるが、活動性中枢神経転移に対する効果を示している。しかし、脳転移や髄膜癌腫症に対するオシメルチニブ160mg/日(通常用量である80mg/日の2倍量)治療がどの程度の効果を示すのかは明らかでない。
患者と方法:
今回の前向き単アーム、2コホートから構成される臨床試験は、EGFRチロシンキナーゼ阻害薬による前治療ののちに病勢進行に至った進行非小細胞肺がん患者で、T790M耐性変異が確認され、脳転移もしくは髄膜癌腫症を有するものを対象に、オシメルチニブ160mg/日内服治療の効果を検証する試験である。主要評価項目は各コホートごとに個別に設定した。すなわち、脳転移コホートでは奏効割合とし、期待奏効割合を30%と見積もった。一方髄膜癌腫症コホートでは生存期間とし、期待生存期間を5か月と見積もった。
結果:
経過観察期間中央値は、脳転移コホートで10.1ヶ月、髄膜癌腫症コホートで9.6ヶ月だった。脳転移コホート(計40人)では、頭蓋内病巣に関する奏効割合は55.0%、同じく病勢コントロール割合は77.5%だった。無増悪生存期間中央値は7.6ヶ月(95%信頼区間は5.0-16.6ヶ月)、生存期間中央値は16.9ヶ月(95%信頼区間は7.9ヶ月-未到達)だった。髄膜癌腫症コホート(計40人)では、頭蓋内病巣に関する病勢コントロール割合は92.5%、完全奏効割合は12.5%だった。生存期間中央値は13.3ヶ月(95%信頼区間は9.1ヶ月から未到達)だった。無増悪生存期間中央値は8.0ヶ月(95%信頼区間は7.2ヶ月から未到達)だった。前治療でどのT790M耐性変異に活性を示すEGFRチロシンキナーゼ阻害薬を使用したかのサブグループ解析では、オシメルチニブ80mg/日とその他の第3世代EGFRチロシンキナーゼ阻害薬の間で、無増悪生存期間の有意差は認められなかった(脳転移コホート18人ではp=0.39、髄膜癌腫症コホート17人ではp=0.85)。脳転移コホートでは、脳転移巣に対する放射線治療歴は無増悪生存期間延長に関する予後良好因子だった(ハザード比0.42、p=0.04)。主要な有害事象は食欲不振、下痢、発疹だったが、ほとんどGrade 1-2に留まっていた。
結論:
160mg/回のオシメルチニブ投与は、今回の治療対象となった患者に対して有望な腫瘍縮小効果と生存期間延長効果を示し、毒性も許容範囲内だった。
2020年07月12日
KEYNOTE-799試験 化学免疫放射線療法
現在のところ、局所進行非小細胞肺がんにおける免疫チェックポイント阻害薬の出番は、化学放射線療法後のデュルバルマブ維持療法のみである。
今回の臨床試験では、ペンブロリズマブを同時併用で開始して、最大17コース(1年間)続けるというもの。
治療スケジュールがトリッキーで、コホートA、コホートBともにexperimental armという香りがする。
第III相試験へ発展していくのだろうが、さてreference armをどうするか。
デュルバルマブ維持療法とのhead to headとするのか、いったん通常の化学放射線療法(海外の臨床試験なので、シスプラチン+エトポシド+放射線治療かな)との比較で勝って、デュルバルマブと同じ位置に上るのを目指すのか。
後者なら、まだデュルバルマブの立ち位置は安泰だろう。
なぜって、治療内容が煩雑だから、デュルバルマブに勝たない限りは誰もやろうとしないだろう。
Phase II study of pembrolizumab (pembro) plus platinum doublet chemotherapy and radiotherapy as first-line therapy for unresectable, locally advanced stage III NSCLC: KEYNOTE-799.
Salma K. Jabbour et al., ASCO 2020 Abst.#9008
背景:
KEYNOTE-799試験は切除不能・局所進行III期非小細胞肺がんに対する化学放射線+ペンブロリズマブ併用療法を評価する臨床試験である。
方法:
今回の第II相、非無作為化、オープンラベル臨床試験において、病理学的に確定診断され、RECIST ver1.1における測定可能病変を有する切除不能未治療IIIA-IIIC期非小細胞肺がん患者を対象とした。コホートAではカルボプラチン6AUC+パクリタキセル200mg/㎡を①コース目で投与、3週間後以降の②、③コース目ではにカルボプラチン2AUC+パクリタキセル45mg/㎡を毎週投与した。コホートBではシスプラチン75mg/㎡+ペメトレキセド500mg/㎡を3週間ごとに①-③コース目まで投与した。どちらの治療を選ぶかは担当医の判断で選択可能とし、コホートBの治療は非扁平上皮がんの患者のみ選択可能とした。コホートA、B共通の治療として、ペンブロリズマブ200mg/㎡を3週ごとに、治療開始時から最高⑰コースまで投与し、併せて化学療法②、③コース施行中に併せて胸部放射線治療(1回2グレイ、30回分割照射、総線量60Gy)を行うこととした。主要評価項目は奏効割合およびGrade 3以上の肺臓炎発生割合とした。安全性評価は全ての患者に対して行い、有効性評価は15週以上の追跡調査ができた患者のみを対象とした。
結果:
2020年1月3日までに、コホートAに112人、コホートBに73人の患者が登録された。コホートAの63人、コホートBの52人は、この時点でもプロトコール治療を継続していた。コホートAにおける追跡期間中央値は8.3ヶ月(0.7-14.0ヶ月)、コホートBにおける追跡期間中央値は5.8ヶ月(0.2-13.7ヶ月)だった。奏効割合はコホートAで67.0%(90%信頼区間は58.9-74.3%)、コホートBで56.6%(90%信頼区間は44.4-68.2%)だった。Grade3以上の肺臓炎はコホートAで9人(8.0%、90%信頼区間は3.4-13.6%)、コホートBで4人(5.5%、90%信頼区間は1.8-12.1%)だった。治療関連のGrade3以上の有害事象はコホートAで72人(64.3%)、コホートBで30人(41.1%)に認めた。コホートAにおいて、肺臓炎による治療関連死を4人認めた。コホートAの患者登録は既に終了し、コホートBでは現在も集積中である。
・KEYNOTE-799試験 概略
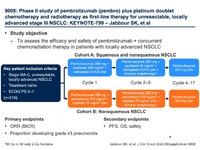
・KEYNOTE-799試験 効果

・keynote-799試験 有害事象

今回の臨床試験では、ペンブロリズマブを同時併用で開始して、最大17コース(1年間)続けるというもの。
治療スケジュールがトリッキーで、コホートA、コホートBともにexperimental armという香りがする。
第III相試験へ発展していくのだろうが、さてreference armをどうするか。
デュルバルマブ維持療法とのhead to headとするのか、いったん通常の化学放射線療法(海外の臨床試験なので、シスプラチン+エトポシド+放射線治療かな)との比較で勝って、デュルバルマブと同じ位置に上るのを目指すのか。
後者なら、まだデュルバルマブの立ち位置は安泰だろう。
なぜって、治療内容が煩雑だから、デュルバルマブに勝たない限りは誰もやろうとしないだろう。
Phase II study of pembrolizumab (pembro) plus platinum doublet chemotherapy and radiotherapy as first-line therapy for unresectable, locally advanced stage III NSCLC: KEYNOTE-799.
Salma K. Jabbour et al., ASCO 2020 Abst.#9008
背景:
KEYNOTE-799試験は切除不能・局所進行III期非小細胞肺がんに対する化学放射線+ペンブロリズマブ併用療法を評価する臨床試験である。
方法:
今回の第II相、非無作為化、オープンラベル臨床試験において、病理学的に確定診断され、RECIST ver1.1における測定可能病変を有する切除不能未治療IIIA-IIIC期非小細胞肺がん患者を対象とした。コホートAではカルボプラチン6AUC+パクリタキセル200mg/㎡を①コース目で投与、3週間後以降の②、③コース目ではにカルボプラチン2AUC+パクリタキセル45mg/㎡を毎週投与した。コホートBではシスプラチン75mg/㎡+ペメトレキセド500mg/㎡を3週間ごとに①-③コース目まで投与した。どちらの治療を選ぶかは担当医の判断で選択可能とし、コホートBの治療は非扁平上皮がんの患者のみ選択可能とした。コホートA、B共通の治療として、ペンブロリズマブ200mg/㎡を3週ごとに、治療開始時から最高⑰コースまで投与し、併せて化学療法②、③コース施行中に併せて胸部放射線治療(1回2グレイ、30回分割照射、総線量60Gy)を行うこととした。主要評価項目は奏効割合およびGrade 3以上の肺臓炎発生割合とした。安全性評価は全ての患者に対して行い、有効性評価は15週以上の追跡調査ができた患者のみを対象とした。
結果:
2020年1月3日までに、コホートAに112人、コホートBに73人の患者が登録された。コホートAの63人、コホートBの52人は、この時点でもプロトコール治療を継続していた。コホートAにおける追跡期間中央値は8.3ヶ月(0.7-14.0ヶ月)、コホートBにおける追跡期間中央値は5.8ヶ月(0.2-13.7ヶ月)だった。奏効割合はコホートAで67.0%(90%信頼区間は58.9-74.3%)、コホートBで56.6%(90%信頼区間は44.4-68.2%)だった。Grade3以上の肺臓炎はコホートAで9人(8.0%、90%信頼区間は3.4-13.6%)、コホートBで4人(5.5%、90%信頼区間は1.8-12.1%)だった。治療関連のGrade3以上の有害事象はコホートAで72人(64.3%)、コホートBで30人(41.1%)に認めた。コホートAにおいて、肺臓炎による治療関連死を4人認めた。コホートAの患者登録は既に終了し、コホートBでは現在も集積中である。
・KEYNOTE-799試験 概略

・KEYNOTE-799試験 効果

・keynote-799試験 有害事象

2020年07月06日
間質性肺炎合併患者に対する定位放射線照射
多分大分県は、定位放射線照射を行う環境に恵まれている。
定型的な定位放射線照射が可能な施設が複数ある上、サイバーナイフを利用した高精度の定位照射も可能である。
https://keiwakai.oita.jp/oka-hp/cyber/
定位照射を受けた肺がん患者さん、追跡調査をしている中でも随分とたくさん拝見するようになった。
間質性肺炎を合併していても定位照射は可能だろうか、という相談を受けたので、1件の論文報告と、1件の学会発表を紹介する。
間質性肺炎を合併していない患者さんに比べると、当然放射線肺臓炎のリスクが増す。
とは言え、他に治療手段がなくて、危険性を理解したうえで治療を受けたい、という方は、一度は放射線治療医に相談する価値があるだろう。
Stereotactic Body Radiotherapy for Lung Cancer Patients With Idiopathic Interstitial Pneumonias
Yuichiro Tsurugai,et al.
Radiother Oncol 2017 Nov;125(2):310-316.
doi:10.1016/j.radonc.2017.08.026.
目的:
肺がん患者のうち、特発性間質性肺炎を合併している患者としていない患者に対して定位放射線照射を行った際の毒性と生命予後について比較検討した。
方法:
2005年から2016年にかけて、定位放射線照射を行った肺がん患者のうち、臨床病期T1N0M0からT4N0M0までの患者、もしくは術後の局所孤発性再発を来した患者で、根治目的で40-60Gyを5分割で照射した者を評価対象とした。全ての対象患者に関する放射線肺臓炎の発生頻度と、T1a-T2aの患者を対象として局所再発割合や全生存期間解析を行った。
結果:
総計508人の患者が評価対象となり、42人の特発性間質性肺炎患者が含まれていた。追跡期間中央値は32.3ヶ月(範囲は6.0-120.9ヶ月)だった。特発性間質性肺炎患者においては、有意にGrade 3以上の放射線肺臓炎を来す患者が多かった(12% vs 3%, p=0.009)。2年局所再発割合は両群ともに低かった(3.4% vs 5.6%, p=0.38)。2年生存割合は特発性間質性肺炎患者で有意に低かった(42.2% vs 80.9%, p<0.001)が、肺がんによる死亡割合は同等だった(p=0.74)
結論:
特発性間質性肺炎を合併した肺がん患者においても、定位放射線照射は忍容可能な毒性に留まる一方で、有望な局所病勢制御を達成した。特発性間質性肺炎を合併した早期肺がん患者において、定位放射線照射は理に叶った治療選択肢となり得る。
O-30.肺癌定位放射線治療において,間質性変化は重篤な肺傷害のリスクとなりうるか?
斎藤彰俊ら、第55回日本肺癌学会総会、2014年11月
目的:
通常の放射線治療において,間質性肺炎は放射線肺傷害の危険因子とされている.しかし肺癌への体幹部定位放射線治療(SBRT)では,間質性肺炎がどの程度,重篤な肺傷害の危険因子となりうるのか知られていない.間質性変化を伴った肺癌患者につき,SBRT後の重篤な肺傷害の発生と,治療前の画像や血液データとの関係を検討した.
方法:
2002年1月から2013年4月の期間中,SBRTを施行された374名の肺癌症例のうち,5mmスライス厚のCT肺野条件で胸膜下優位に網状影や蜂巣肺が認められる,画像上“間質性変化”をもつ39症例を対象とした.白血球値,CRP,LDH,KL-6,SP-D,Brinkman Index,画像上の間質性変化領域がみられる肺葉数,計画標的体積(PTV),20Gy以上照射される体積の割合(V20)につきそれぞれ,重篤な肺傷害を生じた群と生じなかった群とで,t検定で比較した.P<.05を有意差ありとした.
結果:
39症例のうち,致死性の肺傷害をきたした症例は2例(5.1%)であった.その2例については,治療前の白血球値が異常高値を呈し,間質性変化が3肺葉以上に及んでいた.他の因子では,重篤な肺傷害を生じた群と生じなかった群で,有意差がみられなかった.
結論:
白血球値が高く,間質性変化が広範囲にみられる肺癌症例については,SBRT後に重篤な肺傷害をきたす可能性がある.
定型的な定位放射線照射が可能な施設が複数ある上、サイバーナイフを利用した高精度の定位照射も可能である。
https://keiwakai.oita.jp/oka-hp/cyber/
定位照射を受けた肺がん患者さん、追跡調査をしている中でも随分とたくさん拝見するようになった。
間質性肺炎を合併していても定位照射は可能だろうか、という相談を受けたので、1件の論文報告と、1件の学会発表を紹介する。
間質性肺炎を合併していない患者さんに比べると、当然放射線肺臓炎のリスクが増す。
とは言え、他に治療手段がなくて、危険性を理解したうえで治療を受けたい、という方は、一度は放射線治療医に相談する価値があるだろう。
Stereotactic Body Radiotherapy for Lung Cancer Patients With Idiopathic Interstitial Pneumonias
Yuichiro Tsurugai,et al.
Radiother Oncol 2017 Nov;125(2):310-316.
doi:10.1016/j.radonc.2017.08.026.
目的:
肺がん患者のうち、特発性間質性肺炎を合併している患者としていない患者に対して定位放射線照射を行った際の毒性と生命予後について比較検討した。
方法:
2005年から2016年にかけて、定位放射線照射を行った肺がん患者のうち、臨床病期T1N0M0からT4N0M0までの患者、もしくは術後の局所孤発性再発を来した患者で、根治目的で40-60Gyを5分割で照射した者を評価対象とした。全ての対象患者に関する放射線肺臓炎の発生頻度と、T1a-T2aの患者を対象として局所再発割合や全生存期間解析を行った。
結果:
総計508人の患者が評価対象となり、42人の特発性間質性肺炎患者が含まれていた。追跡期間中央値は32.3ヶ月(範囲は6.0-120.9ヶ月)だった。特発性間質性肺炎患者においては、有意にGrade 3以上の放射線肺臓炎を来す患者が多かった(12% vs 3%, p=0.009)。2年局所再発割合は両群ともに低かった(3.4% vs 5.6%, p=0.38)。2年生存割合は特発性間質性肺炎患者で有意に低かった(42.2% vs 80.9%, p<0.001)が、肺がんによる死亡割合は同等だった(p=0.74)
結論:
特発性間質性肺炎を合併した肺がん患者においても、定位放射線照射は忍容可能な毒性に留まる一方で、有望な局所病勢制御を達成した。特発性間質性肺炎を合併した早期肺がん患者において、定位放射線照射は理に叶った治療選択肢となり得る。
O-30.肺癌定位放射線治療において,間質性変化は重篤な肺傷害のリスクとなりうるか?
斎藤彰俊ら、第55回日本肺癌学会総会、2014年11月
目的:
通常の放射線治療において,間質性肺炎は放射線肺傷害の危険因子とされている.しかし肺癌への体幹部定位放射線治療(SBRT)では,間質性肺炎がどの程度,重篤な肺傷害の危険因子となりうるのか知られていない.間質性変化を伴った肺癌患者につき,SBRT後の重篤な肺傷害の発生と,治療前の画像や血液データとの関係を検討した.
方法:
2002年1月から2013年4月の期間中,SBRTを施行された374名の肺癌症例のうち,5mmスライス厚のCT肺野条件で胸膜下優位に網状影や蜂巣肺が認められる,画像上“間質性変化”をもつ39症例を対象とした.白血球値,CRP,LDH,KL-6,SP-D,Brinkman Index,画像上の間質性変化領域がみられる肺葉数,計画標的体積(PTV),20Gy以上照射される体積の割合(V20)につきそれぞれ,重篤な肺傷害を生じた群と生じなかった群とで,t検定で比較した.P<.05を有意差ありとした.
結果:
39症例のうち,致死性の肺傷害をきたした症例は2例(5.1%)であった.その2例については,治療前の白血球値が異常高値を呈し,間質性変化が3肺葉以上に及んでいた.他の因子では,重篤な肺傷害を生じた群と生じなかった群で,有意差がみられなかった.
結論:
白血球値が高く,間質性変化が広範囲にみられる肺癌症例については,SBRT後に重篤な肺傷害をきたす可能性がある.
2020年05月31日
oligometaに対するEGFRチロシンキナーゼ阻害薬と定位放射線照射の併用療法
少数の遠隔転移を有するEGFR遺伝子変異陽性進行非小細胞肺がんに対する局所療法の有効性について。
個人的な見解に過ぎないが、方法論としては放射線治療のほか、手術も考えていいのではないかと思っている。
局所症状の治療ないしは予防に役立つし、腫瘍の性質を詳しく知るのに役立つ。
幸いなことに、大分ではサイバーナイフを用いた精密な定位照射が可能である。
今回の報告を踏まえると、ときにはIV期の患者であっても、適応を考えていいだろう。
First-line tyrosine kinase inhibitor with or without aggressive upfront local radiation therapy in patients with EGFRm oligometastatic non-small cell lung cancer: Interim results of a randomized phase III, open-label clinical trial (SINDAS) (NCT02893332).
Xiaoshan Wang et al.
2020 ASCO Virtual Scientific Program
abst.#9508
背景:
少数の遠隔転移を伴う(oligometastatic)進行非小細胞肺がん患者に対して、病勢制御の目的で積極的に局所療法を加えていくことが効果的かどうかはよくわかっていない。今回の多施設共同、無作為化、オープンラベル、第III相臨床試験は、EGFR遺伝子変異陽性で、少数の遠隔転移を伴う未治療進行非小細胞肺がん患者を対象に、診断時点で確認された全ての遠隔転移巣に対して定位放射線治療を治療初期から行った際の無増悪生存期間と全生存期間を検証した。
方法:
本試験は、中国国内で異なる行政単位(省)に属する5か所の医療機関の共同で行われた。適格条件は、病理学的に確認された原発性肺腺がんであること、遺伝子変異検索によりEGFR遺伝子変異が確認されていること、臨床病期IV期であること、5か所以下の遠隔転移巣を伴うこと、ECOG-PSが2以下であること、全身治療(薬物療法)未施行であること、無作為化前の段階で脳転移が確認されていないこと、とした。試験参加者は、EGFRチロシンキナーゼ阻害薬単剤療法のみを受ける群(標準治療群)と、EGFRチロシンキナーゼ阻害薬を使用しつつ、全ての遠隔転移巣に対して定位放射線照射を並行して行う群(試験治療群)に無作為に割り付けられた。主要評価項目は無増悪生存期間、副次評価項目は全生存期間とした。
結果:
2016年1月から2019年1月にかけて、133人の患者が登録され、65人(48.8%)が標準治療群に、68人(51.1%)が試験治療群に割り付けられた。追跡期間中央値19.6ヶ月(四分位区間は9.4から41.0ヶ月)の時点で、無増悪生存期間中央値は標準治療群で12.5ヶ月、試験治療群で20.2ヶ月だった(ハザード比0.6188、95%信頼区間0.3949-0.9697、p<0.001)。全生存期間中央値は標準治療群で17.4ヶ月、試験治療群で25.5ヶ月だった(ハザード比0.6824、95%信頼区間0.4654-1.001、p<0.001)。有害事象は両群間で同等で、治療関連死は認めなかった。Grade 3/4の有害事象として、肺臓炎は標準治療群の2.9%、試験治療群の7.3%で認め、食道炎は標準治療群の3.0%、試験治療群の4.4%で認めたが、いずれも有意差はつかなかった。
結論:
少数の遠隔転移を伴うEGFR遺伝子変異陽性原発性肺腺がんの患者に対し、EGFRチロシンキナーゼ阻害薬と定位放射線治療の併用療法は、EGFRチロシンキナーゼ単剤療法と比較して、無増悪生存期間と全生存期間を有意に改善した
本報告を受けて、というわけではないだろうが、令和2年04月の診療報酬改定で、定位放射線照射はオリゴ転移(5個以内)で算定可能となったとのこと。
本ブログをご覧になった方から教えて頂いた。
参考までに、令和2年度の診療報酬点数表から抜粋して、一部加筆して記載を残す。
M001-3 直線加速器による放射線治療(一連につき)
1 定位放射線治療の場合:63,000点=630,000円
2 1以外の場合:8,000点=80,000円
注
1 定位放射線治療のうち、患者の体幹部に対して行われるものについては、別に 厚生労働大臣が定める施設基準に適合しているものとして地方厚生局長等に届け 出た保険医療機関において行われる場合に限り算定する。
2 定位放射線治療について、別に厚生労働大臣が定める施設基準に適合している ものとして地方厚生局長等に届け出た保険医療機関において、呼吸性移動対策を 行った場合は、定位放射線治療呼吸性移動対策加算として、所定点数に次の点数 を加算する。
イ 動体追尾法 10,000点=100,000円
ロ その他 5,000点=50,000円
通知
(1) 直線加速器による放射線治療は、実施された直線加速器による体外照射を一連で評価し たものであり、「M001」体外照射を算定する場合は、当該点数は算定できない。
(2) 定位放射線治療とは、直線加速器(マイクロトロンを含む。)により極小照射野で線量 を集中的に照射する治療法であり、頭頸部に対する治療については、照射中心の固定精度 が2ミリメートル以内であるものをいい、体幹部に対する治療については、照射中心の固 定精度が5ミリメートル以内であるものをいう。
(3) 定位放射線治療における頭頸部に対する治療については、頭頸部腫瘍(頭蓋内腫瘍を含 む。)及び脳動静脈奇形に対して行った場合にのみ算定し、体幹部に対する治療について は、原発病巣が直径5センチメートル以下であり転移病巣のない原発性肺癌、原発性肝癌 又は原発性腎癌、3個以内で他病巣のない転移性肺癌又は転移性肝癌、転移病巣のない限 局性の前立腺癌又は膵癌、直径5センチメートル以下の転移性脊椎腫瘍、5個以内のオリ ゴ転移及び脊髄動静脈奇形(頸部脊髄動静脈奇形を含む。)に対して行った場合にのみ算 定し、数か月間の一連の治療過程に複数回の治療を行った場合であっても、所定点数は1 回のみ算定する。
(4) 定位放射線治療については、定位型手術枠又はこれと同等の固定精度を持つ固定装置を取 り付ける際等の麻酔、位置決め等に係る画像診断、検査、放射線治療管理等の当該治療に伴 う一連の費用は所定点数に含まれ、別に算定できない。
(5) 「注2」の呼吸性移動対策とは、呼吸による移動長が 10 ミリメートルを超える肺がん、 肝がん又は腎がんに対し、治療計画時及び毎回の照射時に呼吸運動(量)を計測する装置 又は実時間位置画像装置等を用いて、呼吸性移動による照射範囲の拡大を低減する対策の ことをいい、呼吸性移動のために必要な照射野の拡大が三次元的な各方向に対しそれぞれ 5ミリメートル以下となることが、治療前に計画され、照射時に確認されるものをいう。 なお、治療前の治療計画の際に、照射範囲計画について記録し、毎回照射時に実際の照射 範囲について記録の上、検証すること。
(6) 「注2」の「イ」動体追尾法は、自由呼吸の下で、呼吸運動と腫瘍位置との関係を分析 し、呼吸運動に合わせて照射野を移動して照射する方法、又は呼吸運動に合わせて腫瘍の 近傍のマーカー等をエックス線透視し、決められた位置を通過する時に照射する方法のい ずれかの場合に算定する。
個人的な見解に過ぎないが、方法論としては放射線治療のほか、手術も考えていいのではないかと思っている。
局所症状の治療ないしは予防に役立つし、腫瘍の性質を詳しく知るのに役立つ。
幸いなことに、大分ではサイバーナイフを用いた精密な定位照射が可能である。
今回の報告を踏まえると、ときにはIV期の患者であっても、適応を考えていいだろう。
First-line tyrosine kinase inhibitor with or without aggressive upfront local radiation therapy in patients with EGFRm oligometastatic non-small cell lung cancer: Interim results of a randomized phase III, open-label clinical trial (SINDAS) (NCT02893332).
Xiaoshan Wang et al.
2020 ASCO Virtual Scientific Program
abst.#9508
背景:
少数の遠隔転移を伴う(oligometastatic)進行非小細胞肺がん患者に対して、病勢制御の目的で積極的に局所療法を加えていくことが効果的かどうかはよくわかっていない。今回の多施設共同、無作為化、オープンラベル、第III相臨床試験は、EGFR遺伝子変異陽性で、少数の遠隔転移を伴う未治療進行非小細胞肺がん患者を対象に、診断時点で確認された全ての遠隔転移巣に対して定位放射線治療を治療初期から行った際の無増悪生存期間と全生存期間を検証した。
方法:
本試験は、中国国内で異なる行政単位(省)に属する5か所の医療機関の共同で行われた。適格条件は、病理学的に確認された原発性肺腺がんであること、遺伝子変異検索によりEGFR遺伝子変異が確認されていること、臨床病期IV期であること、5か所以下の遠隔転移巣を伴うこと、ECOG-PSが2以下であること、全身治療(薬物療法)未施行であること、無作為化前の段階で脳転移が確認されていないこと、とした。試験参加者は、EGFRチロシンキナーゼ阻害薬単剤療法のみを受ける群(標準治療群)と、EGFRチロシンキナーゼ阻害薬を使用しつつ、全ての遠隔転移巣に対して定位放射線照射を並行して行う群(試験治療群)に無作為に割り付けられた。主要評価項目は無増悪生存期間、副次評価項目は全生存期間とした。
結果:
2016年1月から2019年1月にかけて、133人の患者が登録され、65人(48.8%)が標準治療群に、68人(51.1%)が試験治療群に割り付けられた。追跡期間中央値19.6ヶ月(四分位区間は9.4から41.0ヶ月)の時点で、無増悪生存期間中央値は標準治療群で12.5ヶ月、試験治療群で20.2ヶ月だった(ハザード比0.6188、95%信頼区間0.3949-0.9697、p<0.001)。全生存期間中央値は標準治療群で17.4ヶ月、試験治療群で25.5ヶ月だった(ハザード比0.6824、95%信頼区間0.4654-1.001、p<0.001)。有害事象は両群間で同等で、治療関連死は認めなかった。Grade 3/4の有害事象として、肺臓炎は標準治療群の2.9%、試験治療群の7.3%で認め、食道炎は標準治療群の3.0%、試験治療群の4.4%で認めたが、いずれも有意差はつかなかった。
結論:
少数の遠隔転移を伴うEGFR遺伝子変異陽性原発性肺腺がんの患者に対し、EGFRチロシンキナーゼ阻害薬と定位放射線治療の併用療法は、EGFRチロシンキナーゼ単剤療法と比較して、無増悪生存期間と全生存期間を有意に改善した
本報告を受けて、というわけではないだろうが、令和2年04月の診療報酬改定で、定位放射線照射はオリゴ転移(5個以内)で算定可能となったとのこと。
本ブログをご覧になった方から教えて頂いた。
参考までに、令和2年度の診療報酬点数表から抜粋して、一部加筆して記載を残す。
M001-3 直線加速器による放射線治療(一連につき)
1 定位放射線治療の場合:63,000点=630,000円
2 1以外の場合:8,000点=80,000円
注
1 定位放射線治療のうち、患者の体幹部に対して行われるものについては、別に 厚生労働大臣が定める施設基準に適合しているものとして地方厚生局長等に届け 出た保険医療機関において行われる場合に限り算定する。
2 定位放射線治療について、別に厚生労働大臣が定める施設基準に適合している ものとして地方厚生局長等に届け出た保険医療機関において、呼吸性移動対策を 行った場合は、定位放射線治療呼吸性移動対策加算として、所定点数に次の点数 を加算する。
イ 動体追尾法 10,000点=100,000円
ロ その他 5,000点=50,000円
通知
(1) 直線加速器による放射線治療は、実施された直線加速器による体外照射を一連で評価し たものであり、「M001」体外照射を算定する場合は、当該点数は算定できない。
(2) 定位放射線治療とは、直線加速器(マイクロトロンを含む。)により極小照射野で線量 を集中的に照射する治療法であり、頭頸部に対する治療については、照射中心の固定精度 が2ミリメートル以内であるものをいい、体幹部に対する治療については、照射中心の固 定精度が5ミリメートル以内であるものをいう。
(3) 定位放射線治療における頭頸部に対する治療については、頭頸部腫瘍(頭蓋内腫瘍を含 む。)及び脳動静脈奇形に対して行った場合にのみ算定し、体幹部に対する治療について は、原発病巣が直径5センチメートル以下であり転移病巣のない原発性肺癌、原発性肝癌 又は原発性腎癌、3個以内で他病巣のない転移性肺癌又は転移性肝癌、転移病巣のない限 局性の前立腺癌又は膵癌、直径5センチメートル以下の転移性脊椎腫瘍、5個以内のオリ ゴ転移及び脊髄動静脈奇形(頸部脊髄動静脈奇形を含む。)に対して行った場合にのみ算 定し、数か月間の一連の治療過程に複数回の治療を行った場合であっても、所定点数は1 回のみ算定する。
(4) 定位放射線治療については、定位型手術枠又はこれと同等の固定精度を持つ固定装置を取 り付ける際等の麻酔、位置決め等に係る画像診断、検査、放射線治療管理等の当該治療に伴 う一連の費用は所定点数に含まれ、別に算定できない。
(5) 「注2」の呼吸性移動対策とは、呼吸による移動長が 10 ミリメートルを超える肺がん、 肝がん又は腎がんに対し、治療計画時及び毎回の照射時に呼吸運動(量)を計測する装置 又は実時間位置画像装置等を用いて、呼吸性移動による照射範囲の拡大を低減する対策の ことをいい、呼吸性移動のために必要な照射野の拡大が三次元的な各方向に対しそれぞれ 5ミリメートル以下となることが、治療前に計画され、照射時に確認されるものをいう。 なお、治療前の治療計画の際に、照射範囲計画について記録し、毎回照射時に実際の照射 範囲について記録の上、検証すること。
(6) 「注2」の「イ」動体追尾法は、自由呼吸の下で、呼吸運動と腫瘍位置との関係を分析 し、呼吸運動に合わせて照射野を移動して照射する方法、又は呼吸運動に合わせて腫瘍の 近傍のマーカー等をエックス線透視し、決められた位置を通過する時に照射する方法のい ずれかの場合に算定する。
2020年04月11日
脳転移、髄膜癌腫症とペンブロリズマブ
様々ある肺がんの合併症の中でも、厄介極まりないものに髄膜癌腫症(がん性髄膜炎)がある。
何度煮え湯を飲まされたことか。
髄膜癌腫症を発症すると、進行性の神経症状のために一気にPSが低下し、がん薬物療法の継続が困難となってしまう。
脳転移ならば、まだ放射線治療という手段があるからいいが、脳と脊髄を覆う脳脊髄腔がまとめて冒される髄膜癌腫症となると、そうはいかない。
脳神経外科に依頼して、オンマイヤーリザーバーを留置して治療することがあると教科書には載っているが、実際に見たことはない。
全脳・全脊髄照射をやっている施設もあるというが、これも実際に見たことはない。
ドライバー遺伝子変異陽性の患者なら、オシメルチニブとか、アレクチニブとかで、ある程度の効果が期待できる。
それではドライバー遺伝子変異陰性だったらどうすればいいのか、という話。
放射線治療で病巣からがん抗原を炙り出して、そこにペンブロリズマブをかませる、というのは、よいアイデアかもしれない。
それでも、TPSがそこそこ陽性の患者に絞った方が良さそうだが。
海外の第II相臨床試験の結果と、国内の症例報告について取り上げる。
どちらも興味深い話。
とくに、ドライバー遺伝子変異陰性の髄膜癌腫症の患者が症状発現後2年にわたり無増悪生存しているというのは、症例報告とは言えとても興味深い話である。
Pembrolizumab for management of patients with NSCLC and brain metastases: long-term results and biomarker analysis from a non-randomised, open-label, phase 2 trial.
Goldberg SB et al. Lancet Oncol 2020
doi: 10.1016/S1470-2045(20)30111-X.
背景:
未治療の脳転移を有する非小細胞肺がんや悪性黒色腫の患者を対象とし、中枢神経系病変に対するPD-1阻害効果を検証するため、ペンブロリズマブ単剤療法の第II相試験を行った。今回は、非小細胞肺がんコホートについての直近の分析結果を報告する。
方法:
本試験はエール大学がんセンター単施設で、オープンラベル、第II相試験として行った。18歳以上、5-20mm大の脳転移を少なくとも1か所有するIV期の非小細胞肺がん患者で、脳転移に対しては未治療もしくは放射線治療後に増悪しつつある、神経症状がない、もしくはコルチコステロイド投与を必要としない、ECOG-PS 0もしくは1の患者を対象とした。中枢神経病変の評価は、modified RECIST基準を用いて行った。参加にあたり、他臓器の病変の有無は問われなかった。患者は、ペンブロリズマブ 10mg/kgを2週間ごとに静脈内投与された。患者を2つのコホートに分けた。コホート1は、PD-L1発現が少なくとも1%以上ある患者、コホート2は、PD-L1発現が1%未満、もしくは評価不能だった患者とした。主要評価項目は脳転移巣の奏効割合(部分奏効もしくは完全奏効の患者の割合)とした。治療を受けたすべての患者を有効性および安全性の評価対象とした。現時点で、本試験の患者集積は終了している。
結果:
2014年3月31日から2018年5月21日までに、42人の患者がプロトコール治療を受けた。経過観察期間中央値は8.3ヶ月(四分位間は4.5-26.2ヶ月)だった。コホート1の患者群37人のうち、11人(29.7%、95%信頼区間は15.9-47.0%)で奏効が得られ、うち4人では完全に病巣が消失していた。病勢コントロール割合は40.5%だった。奏効持続期間中央値は5.7ヶ月だった。7人(18.9%)では、中枢神経系に加えて、その他の病巣でも奏効が得られた。無増悪生存期間中央値は1.9ヶ月、中枢神経系無増悪生存期間中央値は2.3ヶ月で、1年無増悪生存割合は33%だった。生存期間中央値は9.9ヶ月で、1年生存割合は40%、2年生存割合は34%だった。Grade 3-4の有害事象は、肺臓炎2人、構成失行1人、大腸炎1人、副腎機能障害1人、高血糖1人、高カリウム血症1人だった。深刻な有害事象は42人中6人(14%)で認め、肺臓炎2人、急性腎障害1人、大腸炎1人、高カリウム血症1人、副腎機能障害1人だった。治療関連死は認めなかった。
Whole-brain Radiation and Pembrolizumab Treatment for a Non-small-cell Lung Cancer Patient with Meningeal Carcinomatosis Lacking Driver Oncogenes Led to a Long-term Survival: A Case Report.
Nakashima K et al., Intern Med 2020
doi: 10.2169/internalmedicine.4232-19.
進行原発性肺腺癌、PD-L1 60%陽性、ドライバー遺伝子変異陰性、二次化学療法の後に突然のめまい、聴覚障害、意識障害に見舞われ、髄膜癌腫症と診断した66歳女性について報告する。全脳照射とペンブロリズマブ投与を行い、引き続く三次化学療法とペンブロリズマブの併用療法を現在も継続している。本論文を執筆した段階で、髄膜癌腫症発覚から病状の進行なく、23ヶ月が経過している。今回の経験から、全脳照射と免疫チェックポイント阻害薬の併用療法は、髄膜癌腫症を発症したドライバー遺伝子変異陰性非小細胞肺がん患者に対して効果的と考える。
何度煮え湯を飲まされたことか。
髄膜癌腫症を発症すると、進行性の神経症状のために一気にPSが低下し、がん薬物療法の継続が困難となってしまう。
脳転移ならば、まだ放射線治療という手段があるからいいが、脳と脊髄を覆う脳脊髄腔がまとめて冒される髄膜癌腫症となると、そうはいかない。
脳神経外科に依頼して、オンマイヤーリザーバーを留置して治療することがあると教科書には載っているが、実際に見たことはない。
全脳・全脊髄照射をやっている施設もあるというが、これも実際に見たことはない。
ドライバー遺伝子変異陽性の患者なら、オシメルチニブとか、アレクチニブとかで、ある程度の効果が期待できる。
それではドライバー遺伝子変異陰性だったらどうすればいいのか、という話。
放射線治療で病巣からがん抗原を炙り出して、そこにペンブロリズマブをかませる、というのは、よいアイデアかもしれない。
それでも、TPSがそこそこ陽性の患者に絞った方が良さそうだが。
海外の第II相臨床試験の結果と、国内の症例報告について取り上げる。
どちらも興味深い話。
とくに、ドライバー遺伝子変異陰性の髄膜癌腫症の患者が症状発現後2年にわたり無増悪生存しているというのは、症例報告とは言えとても興味深い話である。
Pembrolizumab for management of patients with NSCLC and brain metastases: long-term results and biomarker analysis from a non-randomised, open-label, phase 2 trial.
Goldberg SB et al. Lancet Oncol 2020
doi: 10.1016/S1470-2045(20)30111-X.
背景:
未治療の脳転移を有する非小細胞肺がんや悪性黒色腫の患者を対象とし、中枢神経系病変に対するPD-1阻害効果を検証するため、ペンブロリズマブ単剤療法の第II相試験を行った。今回は、非小細胞肺がんコホートについての直近の分析結果を報告する。
方法:
本試験はエール大学がんセンター単施設で、オープンラベル、第II相試験として行った。18歳以上、5-20mm大の脳転移を少なくとも1か所有するIV期の非小細胞肺がん患者で、脳転移に対しては未治療もしくは放射線治療後に増悪しつつある、神経症状がない、もしくはコルチコステロイド投与を必要としない、ECOG-PS 0もしくは1の患者を対象とした。中枢神経病変の評価は、modified RECIST基準を用いて行った。参加にあたり、他臓器の病変の有無は問われなかった。患者は、ペンブロリズマブ 10mg/kgを2週間ごとに静脈内投与された。患者を2つのコホートに分けた。コホート1は、PD-L1発現が少なくとも1%以上ある患者、コホート2は、PD-L1発現が1%未満、もしくは評価不能だった患者とした。主要評価項目は脳転移巣の奏効割合(部分奏効もしくは完全奏効の患者の割合)とした。治療を受けたすべての患者を有効性および安全性の評価対象とした。現時点で、本試験の患者集積は終了している。
結果:
2014年3月31日から2018年5月21日までに、42人の患者がプロトコール治療を受けた。経過観察期間中央値は8.3ヶ月(四分位間は4.5-26.2ヶ月)だった。コホート1の患者群37人のうち、11人(29.7%、95%信頼区間は15.9-47.0%)で奏効が得られ、うち4人では完全に病巣が消失していた。病勢コントロール割合は40.5%だった。奏効持続期間中央値は5.7ヶ月だった。7人(18.9%)では、中枢神経系に加えて、その他の病巣でも奏効が得られた。無増悪生存期間中央値は1.9ヶ月、中枢神経系無増悪生存期間中央値は2.3ヶ月で、1年無増悪生存割合は33%だった。生存期間中央値は9.9ヶ月で、1年生存割合は40%、2年生存割合は34%だった。Grade 3-4の有害事象は、肺臓炎2人、構成失行1人、大腸炎1人、副腎機能障害1人、高血糖1人、高カリウム血症1人だった。深刻な有害事象は42人中6人(14%)で認め、肺臓炎2人、急性腎障害1人、大腸炎1人、高カリウム血症1人、副腎機能障害1人だった。治療関連死は認めなかった。
Whole-brain Radiation and Pembrolizumab Treatment for a Non-small-cell Lung Cancer Patient with Meningeal Carcinomatosis Lacking Driver Oncogenes Led to a Long-term Survival: A Case Report.
Nakashima K et al., Intern Med 2020
doi: 10.2169/internalmedicine.4232-19.
進行原発性肺腺癌、PD-L1 60%陽性、ドライバー遺伝子変異陰性、二次化学療法の後に突然のめまい、聴覚障害、意識障害に見舞われ、髄膜癌腫症と診断した66歳女性について報告する。全脳照射とペンブロリズマブ投与を行い、引き続く三次化学療法とペンブロリズマブの併用療法を現在も継続している。本論文を執筆した段階で、髄膜癌腫症発覚から病状の進行なく、23ヶ月が経過している。今回の経験から、全脳照射と免疫チェックポイント阻害薬の併用療法は、髄膜癌腫症を発症したドライバー遺伝子変異陰性非小細胞肺がん患者に対して効果的と考える。
2020年03月10日
全脳照射の時、海馬を避けることに意味はあるのか
転移性脳腫瘍を有する患者さんに対する海馬回避全脳照射、話には聞いていたし、実際に他の診療施設から紹介を受けた患者さんに、この治療の経験者がいた。
現在、大分でやっている施設があるかどうかは知らない。
どの程度のエビデンスがあるのかも知らなかった。
今回取り上げる第III相臨床試験、主要評価項目で認知機能に焦点を当て、生存期間解析は副次評価項目扱いとしている点がユニークである。
この結果が全うなものならば、放射線治療設備を有する病院では、直ちに検討し始めるべきではないだろうか。
また、全脳照射を行う患者に対して、全員にメマンチンを使うというのも我が国の実地臨床とは乖離があり、この点をどうするか考える必要がある。
Hippocampal Avoidance During Whole-Brain Radiotherapy Plus Memantine for Patients With Brain Metastases: Phase III Trial NRG Oncology CC001
Paul D. Brown et al. J Clin Oncol 2020
DOI: 10.1200/JCO.19.02767
目的:
海馬領域の中で、放射線による変性を来しやすい部分への放射線照射量の多寡は、認知機能障害との関連することが指摘されている。
転移性脳腫瘍に対する全脳照射を行う際、強度変調放射線照射を利用して海馬領域を回避することにより、認知機能を維持できるのではないかと仮説を立てた。
方法:
今回の第III相臨床試験では、転移性脳腫瘍を有する成人を対象とした。海馬回避全脳照射とメマンチンを併用する群(HA-WBRT群)と、通常全脳照射とメマンチンを併用する群(WBRT群)に患者を割り付けた。主要評価項目は、認知機能障害発生期間(TTCF, 少なくとも1種の認知機能評価テストにおいて、評価が下がるまでの期間)とした。副次評価項目は全生存期間(OS)、頭蓋内病変無増悪生存期間(icPFS)、毒性、患者による症状評価とした。
結果:
2015年7月から2018年3月までの期間に、518人が無作為割付された。生存患者の追跡期間中央値は7.9ヶ月だった。認知機能障害リスクは、HA-WBRT群の方がWBRT群より低かった(調整ハザード比は0.74、95%信頼区間は0.58-0.95、p=0.02)。この違いは、追跡開始から4ヶ月時点での実務的能力低下(23.3% vs 40.4%, p=0.01)や6ヶ月時点での学習能力低下(11.5% vs 24.7%, p=0.049)や記憶力低下(16.4% vs 33.3%, p=0.02)に起因していた。治療群間において、OS、icPFS、毒性の差は認めなかった。6ヶ月時点において、HA-WBRT群では疲労(p=0.04)、物事を想起する能力の低下(p=0.01)、会話能力の低下(p=0.049)、神経症状により生活に支障をきたすこと(p=0.008)、認知機能低下症状(p=0.01)がより少なかった。
結論:
転移性脳腫瘍を有する患者に対するメマンチン内服併用海馬回避全脳照射は、認知機能を維持し、照射に起因すると思われる有害事象症状を軽減し、かつic-PFSやOSは同等だった。海馬領域に病巣のない転移性脳腫瘍を有し、全脳照射を検討されているPS良好の患者においては、海馬回避全脳照射は標準治療ととらえられるべきである。
現在、大分でやっている施設があるかどうかは知らない。
どの程度のエビデンスがあるのかも知らなかった。
今回取り上げる第III相臨床試験、主要評価項目で認知機能に焦点を当て、生存期間解析は副次評価項目扱いとしている点がユニークである。
この結果が全うなものならば、放射線治療設備を有する病院では、直ちに検討し始めるべきではないだろうか。
また、全脳照射を行う患者に対して、全員にメマンチンを使うというのも我が国の実地臨床とは乖離があり、この点をどうするか考える必要がある。
Hippocampal Avoidance During Whole-Brain Radiotherapy Plus Memantine for Patients With Brain Metastases: Phase III Trial NRG Oncology CC001
Paul D. Brown et al. J Clin Oncol 2020
DOI: 10.1200/JCO.19.02767
目的:
海馬領域の中で、放射線による変性を来しやすい部分への放射線照射量の多寡は、認知機能障害との関連することが指摘されている。
転移性脳腫瘍に対する全脳照射を行う際、強度変調放射線照射を利用して海馬領域を回避することにより、認知機能を維持できるのではないかと仮説を立てた。
方法:
今回の第III相臨床試験では、転移性脳腫瘍を有する成人を対象とした。海馬回避全脳照射とメマンチンを併用する群(HA-WBRT群)と、通常全脳照射とメマンチンを併用する群(WBRT群)に患者を割り付けた。主要評価項目は、認知機能障害発生期間(TTCF, 少なくとも1種の認知機能評価テストにおいて、評価が下がるまでの期間)とした。副次評価項目は全生存期間(OS)、頭蓋内病変無増悪生存期間(icPFS)、毒性、患者による症状評価とした。
結果:
2015年7月から2018年3月までの期間に、518人が無作為割付された。生存患者の追跡期間中央値は7.9ヶ月だった。認知機能障害リスクは、HA-WBRT群の方がWBRT群より低かった(調整ハザード比は0.74、95%信頼区間は0.58-0.95、p=0.02)。この違いは、追跡開始から4ヶ月時点での実務的能力低下(23.3% vs 40.4%, p=0.01)や6ヶ月時点での学習能力低下(11.5% vs 24.7%, p=0.049)や記憶力低下(16.4% vs 33.3%, p=0.02)に起因していた。治療群間において、OS、icPFS、毒性の差は認めなかった。6ヶ月時点において、HA-WBRT群では疲労(p=0.04)、物事を想起する能力の低下(p=0.01)、会話能力の低下(p=0.049)、神経症状により生活に支障をきたすこと(p=0.008)、認知機能低下症状(p=0.01)がより少なかった。
結論:
転移性脳腫瘍を有する患者に対するメマンチン内服併用海馬回避全脳照射は、認知機能を維持し、照射に起因すると思われる有害事象症状を軽減し、かつic-PFSやOSは同等だった。海馬領域に病巣のない転移性脳腫瘍を有し、全脳照射を検討されているPS良好の患者においては、海馬回避全脳照射は標準治療ととらえられるべきである。




