2015年07月31日
日本臨床腫瘍学会3日目
2015/7/18の日本臨床腫瘍学会で見聞きした内容です。
今回はALK陽性肺癌に関するランチョンセミナーから。
出典を細かく確認しておらず、一部不正確なデータが含まれているかもしれませんので、あらかじめご了承ください。
<ALK再構成陽性肺癌に対する日本での治療戦略>東北大学 井上彰先生
・国立がん研究センターで切除された早期肺腺癌のdriver oncogene検索結果:Kohno et al, Cancer Sci, 2013
・Crizotinibの臨床試験
PROFILE1007:2nd line crizotinib vs 化学療法 無増悪生存期間は延長、全生存期間は有意差なし
PROFILE1014:1st line crizotinib vs 化学療法 無増悪生存期間は延長、全生存期間は有意差なし
・肺癌の細胞診・組織診検体を採取するときには、RNA保存液を準備しよう
・crizotinibの有害事象:嘔吐(中等度催吐リスク群の治療に分類される)、下痢、浮腫、視覚障害
・薬剤性間質性肺炎とMUC4遺伝子多型の相関
各多型の陽性割合 TKI肺障害 IPF急性増悪 ドセタキセル肺障害 crizotinib肺障害
MUC4 SNP typeA 36% 45% 15% 2%
MUC4 SNP typeB 37% 40% 14% 2%
・Alectinibの効果:奏効割合 94%、病勢コントロール割合 96%、無増悪生存期間中央値 30か月以上、まさに異次元の領域!
・Alectinibの臨床試験には14人の脳転移を有する患者さんが含まれていたが、3年後に脳転移増悪に至ったのは6人だけ
・Alectinibの毒性はほとんどないに等しい
・JP28927試験:crizotinib耐性化後にAlectinibを投与しても、50%程度の奏効割合が期待できる(Nakagawa et al, ASCO 2014)
・CeritinibはIGF1受容体も阻害する→血糖値が高くなる
・CrizotinibとAlectinibを直接比較するALEX試験、J-ALEX試験が進行中、J-ALEXは200人を集積する我が国の試験だが、2015年7月に患者集積が終了し、追跡調査、結果待ちの状態になった。主要評価項目は無増悪生存期間、副次評価項目は奏効割合、全生存期間、安全性。
<ALK再構成陽性肺癌に対する米国での治療戦略>David Ross Camidge先生
・当初、crizotinibはMET阻害薬として開発されたが、その他の標的分子としてALK、ROS1が含まれていた
・PROFILE1007試験:Shaw et al, NEJM 2013
治療効果はcrizotinib>Pemetrexed>Docetaxelの順番だったが、Pemetrexedの効果は比較的長く続く傾向にあり、長期間治療が継続できる患者が多かった。
・PROFILE1014試験
対照群であるCDDP+Pemetrexed群では、治療コース数の上限は6コースとされ、Pemetrexedの維持療法は許容されていなかったため、PROFILE1007のPemetrexed群に比べて早期に再燃することが多かった。
→以上から、ALK再構成陽性肺癌患者においては、Pemetrexed維持療法は有望な治療選択肢と考えて良い
・脳転移に関する報告:Costa, J Clin Oncol 2015
・Crizotinib耐性化後の各治療薬の成績(?)-出典不明
奏効割合 脳転移無増悪期間中央値 無増悪生存期間中央値
AP26113(Brigatinib) 56.4% 6.9ヶ月 データなし
Ceritinib 54.5% 6.3ヶ月 18.4ヶ月
Alectinib 69.2% 12.3ヶ月 30ヶ月以上
・Crizotinib / Ceritinib耐性後の脳転移陽性例に対するAlectinibの効果:Gainor et al, J Thorac Oncol 2015
・Alectinib耐性症例の報告:Katayama et al, Clin Cancer Res 2014
・Crizotinib / Alectinib / Ceritinib耐性ALK陽性肺癌に対するPF-06463922の第I相試験:Shaw et al, ASCO 2015
今回はALK陽性肺癌に関するランチョンセミナーから。
出典を細かく確認しておらず、一部不正確なデータが含まれているかもしれませんので、あらかじめご了承ください。
<ALK再構成陽性肺癌に対する日本での治療戦略>東北大学 井上彰先生
・国立がん研究センターで切除された早期肺腺癌のdriver oncogene検索結果:Kohno et al, Cancer Sci, 2013
・Crizotinibの臨床試験
PROFILE1007:2nd line crizotinib vs 化学療法 無増悪生存期間は延長、全生存期間は有意差なし
PROFILE1014:1st line crizotinib vs 化学療法 無増悪生存期間は延長、全生存期間は有意差なし
・肺癌の細胞診・組織診検体を採取するときには、RNA保存液を準備しよう
・crizotinibの有害事象:嘔吐(中等度催吐リスク群の治療に分類される)、下痢、浮腫、視覚障害
・薬剤性間質性肺炎とMUC4遺伝子多型の相関
各多型の陽性割合 TKI肺障害 IPF急性増悪 ドセタキセル肺障害 crizotinib肺障害
MUC4 SNP typeA 36% 45% 15% 2%
MUC4 SNP typeB 37% 40% 14% 2%
・Alectinibの効果:奏効割合 94%、病勢コントロール割合 96%、無増悪生存期間中央値 30か月以上、まさに異次元の領域!
・Alectinibの臨床試験には14人の脳転移を有する患者さんが含まれていたが、3年後に脳転移増悪に至ったのは6人だけ
・Alectinibの毒性はほとんどないに等しい
・JP28927試験:crizotinib耐性化後にAlectinibを投与しても、50%程度の奏効割合が期待できる(Nakagawa et al, ASCO 2014)
・CeritinibはIGF1受容体も阻害する→血糖値が高くなる
・CrizotinibとAlectinibを直接比較するALEX試験、J-ALEX試験が進行中、J-ALEXは200人を集積する我が国の試験だが、2015年7月に患者集積が終了し、追跡調査、結果待ちの状態になった。主要評価項目は無増悪生存期間、副次評価項目は奏効割合、全生存期間、安全性。
<ALK再構成陽性肺癌に対する米国での治療戦略>David Ross Camidge先生
・当初、crizotinibはMET阻害薬として開発されたが、その他の標的分子としてALK、ROS1が含まれていた
・PROFILE1007試験:Shaw et al, NEJM 2013
治療効果はcrizotinib>Pemetrexed>Docetaxelの順番だったが、Pemetrexedの効果は比較的長く続く傾向にあり、長期間治療が継続できる患者が多かった。
・PROFILE1014試験
対照群であるCDDP+Pemetrexed群では、治療コース数の上限は6コースとされ、Pemetrexedの維持療法は許容されていなかったため、PROFILE1007のPemetrexed群に比べて早期に再燃することが多かった。
→以上から、ALK再構成陽性肺癌患者においては、Pemetrexed維持療法は有望な治療選択肢と考えて良い
・脳転移に関する報告:Costa, J Clin Oncol 2015
・Crizotinib耐性化後の各治療薬の成績(?)-出典不明
奏効割合 脳転移無増悪期間中央値 無増悪生存期間中央値
AP26113(Brigatinib) 56.4% 6.9ヶ月 データなし
Ceritinib 54.5% 6.3ヶ月 18.4ヶ月
Alectinib 69.2% 12.3ヶ月 30ヶ月以上
・Crizotinib / Ceritinib耐性後の脳転移陽性例に対するAlectinibの効果:Gainor et al, J Thorac Oncol 2015
・Alectinib耐性症例の報告:Katayama et al, Clin Cancer Res 2014
・Crizotinib / Alectinib / Ceritinib耐性ALK陽性肺癌に対するPF-06463922の第I相試験:Shaw et al, ASCO 2015
2015年07月30日
日本臨床腫瘍学会2日目
ちょっと間が空いてしまいましたが、2015/7/17の日本臨床腫瘍学会で見聞きしたことのメモです。
<免疫チェックポイント阻害剤の現状と今後の展望>Dr Roy S Herbst
・mutational burden:腫瘍によって遺伝子異常の数が異なり、遺伝子異常が少ないものもあれば多いものもある。
Alexandrov et al, Nature 500, 415-421, 2013

・免疫チェックポイント阻害薬は、遺伝子異常が多い腫瘍の方が効きやすい傾向がある。
・前立腺癌、MMR遺伝子異常を伴う大腸癌、骨髄腫、膵癌には免疫チェックポイント阻害薬は効かない。
・免疫療法のキーワードは”特異性”、”免疫記憶”、”適応性”
・T細胞は腫瘍細胞を認識、攻撃する機能を持つ。
・PD-L1の発現は免疫のスイッチをオフにすることができる。
・Nivolumabの臨床試験、CheckMate017(肺扁平上皮癌)、057(肺非扁平上皮癌)
・MK3475(pembrolizumb)
・MPDL3280(抗PD-L1抗体)の第I相試験報告(Herbst et al, Nature, 2014 / Rizvi 2014)
奏効割合 喫煙者 非喫煙者
Nivolumab 26% 8%
MK3475 26% 10%
MPDL3280 26% 0%
・免疫チェックポイント阻害薬の臨床試験で見られる生存曲線は、分子標的薬のそれよりは化学療法のそれに近いが、長期生存が多く認められるのが特徴
・抗体医薬のIgG classの違い
→IgG1抗体医薬に比べると、IgG4抗体やengineered IgG1抗体はADCC活性が40%程度低くなる。
・免疫関連有害事象あれこれ
→甲状腺炎、甲状腺機能低下症、甲状腺機能亢進症、下垂体炎、下垂体機能低下症、副腎機能不全、神経障害、髄膜炎、ギランバレー症候群、虹彩炎、ブドウ膜炎、などなど
・内分泌器官に関連した有害事象は非可逆的
・CheckMate063試験
・PD-L1抗体陽性率とPembrolizumabの効果の相関
→Garon et al, NEJM 2015
・POPLAR study
・MPDL3280と化学療法の併用(Liu et al, ASCO 2015)
・有望な奏効割合が示されれば、生存に関する最終結果が出ていなくても迅速承認される可能性あり
・免疫チェックポイント阻害薬は、免疫染色によって治療効果予測ができるかもしれないが、使用する抗体によって陽性割合がバラバラなのが問題。
・小細胞癌において、pembrolizumabの奏効割合は35%程度、ChackMate 063試験と同様に、Nivolumab+Ipilimumab併用療法の開発も進行中。
<免疫チェックポイント阻害剤の現状と今後の展望>Dr Roy S Herbst
・mutational burden:腫瘍によって遺伝子異常の数が異なり、遺伝子異常が少ないものもあれば多いものもある。
Alexandrov et al, Nature 500, 415-421, 2013

・免疫チェックポイント阻害薬は、遺伝子異常が多い腫瘍の方が効きやすい傾向がある。
・前立腺癌、MMR遺伝子異常を伴う大腸癌、骨髄腫、膵癌には免疫チェックポイント阻害薬は効かない。
・免疫療法のキーワードは”特異性”、”免疫記憶”、”適応性”
・T細胞は腫瘍細胞を認識、攻撃する機能を持つ。
・PD-L1の発現は免疫のスイッチをオフにすることができる。
・Nivolumabの臨床試験、CheckMate017(肺扁平上皮癌)、057(肺非扁平上皮癌)
・MK3475(pembrolizumb)
・MPDL3280(抗PD-L1抗体)の第I相試験報告(Herbst et al, Nature, 2014 / Rizvi 2014)
奏効割合 喫煙者 非喫煙者
Nivolumab 26% 8%
MK3475 26% 10%
MPDL3280 26% 0%
・免疫チェックポイント阻害薬の臨床試験で見られる生存曲線は、分子標的薬のそれよりは化学療法のそれに近いが、長期生存が多く認められるのが特徴
・抗体医薬のIgG classの違い
→IgG1抗体医薬に比べると、IgG4抗体やengineered IgG1抗体はADCC活性が40%程度低くなる。
・免疫関連有害事象あれこれ
→甲状腺炎、甲状腺機能低下症、甲状腺機能亢進症、下垂体炎、下垂体機能低下症、副腎機能不全、神経障害、髄膜炎、ギランバレー症候群、虹彩炎、ブドウ膜炎、などなど
・内分泌器官に関連した有害事象は非可逆的
・CheckMate063試験
・PD-L1抗体陽性率とPembrolizumabの効果の相関
→Garon et al, NEJM 2015
・POPLAR study
・MPDL3280と化学療法の併用(Liu et al, ASCO 2015)
・有望な奏効割合が示されれば、生存に関する最終結果が出ていなくても迅速承認される可能性あり
・免疫チェックポイント阻害薬は、免疫染色によって治療効果予測ができるかもしれないが、使用する抗体によって陽性割合がバラバラなのが問題。
・小細胞癌において、pembrolizumabの奏効割合は35%程度、ChackMate 063試験と同様に、Nivolumab+Ipilimumab併用療法の開発も進行中。
2015年07月19日
日本臨床腫瘍学会1日目の続きの続き
<Immuno-Oncology ・・・The New Frontier. Dr Naiyer Rizvi>
・世界全体での肺がん罹患数は年間182万人、死亡数は152万人
・従来の三大治療、すなわち手術・放射線・殺細胞性抗腫瘍薬/分子標的薬に、免疫療法を加えて四大治療と呼ぶべき状況になりつつある
・1970年代の樹状細胞の発見から1990年代の免疫チェックポイント分子の発見を経て、現在に至るまでの腫瘍免疫学の歴史を概観
・腫瘍細胞とCD4陽性細胞との抗原提示・認識のやりとりと、腫瘍細胞とCD8陽性細胞との抗原認識・攻撃のやりとりの簡単なまとめ
・腫瘍細胞上の、免疫賦活作用を持つ蛋白群(CD28, OX40, GITR, CD137, CD27, HVEM)と免疫寛容を招く蛋白群(CTLA4, PD-L1, TIM-3, BTLA, VISTA, LAG3)
・免疫寛容に関する文献紹介
Vasely et al, Ann Rev Immunol 235-271, 2011
Zitvogel et al, Lancet Resp Med, 2013
・PD-L1の活性化には2つのメカニズムがある→Innate resistance, Adaptive resistance
・T細胞を介した免疫調節療法には、4つの方法がある
1)ワクチン/アジュバント療法
2)T細胞受容体の改変
3)共刺激受容体アゴニストに対する抗体療法(CD40, CD137, CD27, OX40)
4)免疫チェックポイント阻害療法(PD1, LAG3,PDL1/2, CTLA4)
・腫瘍細胞が体内に出来てから腫瘍免疫が成立するまでの7段階・・・Chen DS et al, Immunity 1-10, 2013
1)release of cancer cell
2)Cancer antigen presentation
3)Priming and activation(CTLA4, CD137, OX40, CD27)
4)-6)・・・筆記が追いつかず
7)Cancer cell Killing・・・CARS
・免疫チェックポイント阻害薬と有害事象およびその発現時期
皮膚毒性、肝炎、膵炎、腸炎および下痢、下垂体炎、甲状腺炎、副腎機能不全、肺障害
・免疫関連有害事象のGrade分類→発現してから治療反応性を見極めるまではGradeがつけられない?
Grade 1:支持療法と治療中断で対応可能
Grade 2:治療中断後も1週間以上症状が続き、PSL 0.5mg/kg程度のステロイドカバーが必要
Grade 3-4:PLS 1-2mg/kg程度の治療が1ヶ月以上必要で、その後徐々に減量
・ニボルマブによる肺障害症例の画像供覧→右肺下葉S8-9に片側性に胸膜直下をスペアするような浸潤影が出現しており、ステロイド投与後に緩やかに改善→organizing pneumonia様で、TKIによる肺障害とは雰囲気が異なる
・免疫チェックポイント阻害薬の効果発現の4パターン
Walchok et al, Clin Cancer Res 7412-7420, 2009
Hoos et al, Ann Oncol viii47-52, 2012
1)治療初期から腫瘍が縮小
2)一旦増大して、その後腫瘍縮小
3)???・・・2)との違いがわからず
4)一旦増大、新規病変も出現するも、その後どちらも縮小
→果たしてどのタイミングで効果判定をするべきなのか、それとも毒性が軽微なら可能な限り続けるべきなのか?
<AURA study>O1-8-1
・日本人は24人が参加、うちT790M陽性患者は55.6%
・奏効割合は67%
・肺障害は2人で発現し、うち1人(4.2%)では治療中止
・参加者全体での肺毒性発現割合は2.7%
・日本人では2人(8.5%)の治療関連死→有害事象が少なく安全な治療とは今のところ言いがたい
・AZD9291への耐性化変異が確認されている(Nature Med 560-562 2015, Cancer Res 2489-2500 2015)
・C797S耐性変異は耐性化した患者の40%に発現していたが、全てEx. 19 del.の患者だった
<AURA study - 1st line cohort>O1-8-2
・AZD9291はin vitroではEx.19 del.陽性のPC1細胞株の耐性化を遅らせる
・全患者60人中5人の患者において、未治療の状態でT790Mが確認されている
・主な有害事象は皮疹、下痢、胃炎だった
・肺障害は3人で認められ、うち2人は日本人だった
・全体での奏効割合は63%(80mg cohort)、83%(160mg cohort)、73%(total)
・日本人での奏効割合は57%(80mg cohort)、88%(160mg cohort)、73%(total)
・Ex. 19とEx.21での奏効割合はほぼ同じ
・進行中の臨床試験:AURA3(AZD9291 vs chemotherapy)、FLAURA(1st line AZD9291 vs Gefitinib/Erlotinib)
<JO28638 study 1st line Erlotinib+Onartuzumab>
・Onartuzumabは抗MET抗体で、METへのHGF会合を阻害する
・EGFR遺伝子変異陽性で、MET-IHC陽性の患者が70%を占める
・MET-Lung study(OAM4971g)の試験結果を受けて、本試験を含めて全てのOnartuzumab関連試験が中止された
・無増悪生存期間中央値8.5ヶ月、生存期間中央値15.6ヶ月、奏効割合68.9%、病勢コントロール割合88.5%、肺障害発現割合6.6%
<ErlotinibとBevacizumab併用療法のin vitroでの解析>
・T790M陽性細胞に対する併用効果(縮小効果)は少ないが、Bevacizumabを中止すると早期に再増殖→再増殖を抑制する効果はありそう
・MET増幅細胞に対する併用効果は高い
<EGFR陽性肺がんの再生検に関する後方視的検討>愛知県がんセンター
・2005年から2015年にかけて肺がん患者700人余りを対象に調査、再生検を行ったのが120人、EGFR陽性例は68人
・Ex. 19 / Ex. 21 / others = 32人 / 35人 / 2人(うち1人はdoublet)
・T790M陽性は36人(52.9%)、陰性は32人、以下のデータはT790M陽性患者、陰性患者別に提示
・TBLBで診断できたのは6人、6人
・他の部位の生検で診断できたのは6人、10人
・胸水で診断できたのは16人、13人
・無増悪生存期間中央値は18ヶ月、11ヶ月(p=0.04)
・局所再燃例は70%、34%(p=0.014)
・生存期間中央値は68ヶ月、29ヶ月
・T790Mは初回治療後の無増悪生存期間が長い、局所再燃例が多い、生存期間中央値が長いという特徴がある
・参考文献
Clin Cancer Res 2015(高感度PCR、digital PCR)
Cancer 119 4325-32, 2013
Hata et al, Clin Cancer Res 2240-2247, 2013
これで1日目の内容は大体終わり。
・世界全体での肺がん罹患数は年間182万人、死亡数は152万人
・従来の三大治療、すなわち手術・放射線・殺細胞性抗腫瘍薬/分子標的薬に、免疫療法を加えて四大治療と呼ぶべき状況になりつつある
・1970年代の樹状細胞の発見から1990年代の免疫チェックポイント分子の発見を経て、現在に至るまでの腫瘍免疫学の歴史を概観
・腫瘍細胞とCD4陽性細胞との抗原提示・認識のやりとりと、腫瘍細胞とCD8陽性細胞との抗原認識・攻撃のやりとりの簡単なまとめ
・腫瘍細胞上の、免疫賦活作用を持つ蛋白群(CD28, OX40, GITR, CD137, CD27, HVEM)と免疫寛容を招く蛋白群(CTLA4, PD-L1, TIM-3, BTLA, VISTA, LAG3)
・免疫寛容に関する文献紹介
Vasely et al, Ann Rev Immunol 235-271, 2011
Zitvogel et al, Lancet Resp Med, 2013
・PD-L1の活性化には2つのメカニズムがある→Innate resistance, Adaptive resistance
・T細胞を介した免疫調節療法には、4つの方法がある
1)ワクチン/アジュバント療法
2)T細胞受容体の改変
3)共刺激受容体アゴニストに対する抗体療法(CD40, CD137, CD27, OX40)
4)免疫チェックポイント阻害療法(PD1, LAG3,PDL1/2, CTLA4)
・腫瘍細胞が体内に出来てから腫瘍免疫が成立するまでの7段階・・・Chen DS et al, Immunity 1-10, 2013
1)release of cancer cell
2)Cancer antigen presentation
3)Priming and activation(CTLA4, CD137, OX40, CD27)
4)-6)・・・筆記が追いつかず
7)Cancer cell Killing・・・CARS
・免疫チェックポイント阻害薬と有害事象およびその発現時期
皮膚毒性、肝炎、膵炎、腸炎および下痢、下垂体炎、甲状腺炎、副腎機能不全、肺障害
・免疫関連有害事象のGrade分類→発現してから治療反応性を見極めるまではGradeがつけられない?
Grade 1:支持療法と治療中断で対応可能
Grade 2:治療中断後も1週間以上症状が続き、PSL 0.5mg/kg程度のステロイドカバーが必要
Grade 3-4:PLS 1-2mg/kg程度の治療が1ヶ月以上必要で、その後徐々に減量
・ニボルマブによる肺障害症例の画像供覧→右肺下葉S8-9に片側性に胸膜直下をスペアするような浸潤影が出現しており、ステロイド投与後に緩やかに改善→organizing pneumonia様で、TKIによる肺障害とは雰囲気が異なる
・免疫チェックポイント阻害薬の効果発現の4パターン
Walchok et al, Clin Cancer Res 7412-7420, 2009
Hoos et al, Ann Oncol viii47-52, 2012
1)治療初期から腫瘍が縮小
2)一旦増大して、その後腫瘍縮小
3)???・・・2)との違いがわからず
4)一旦増大、新規病変も出現するも、その後どちらも縮小
→果たしてどのタイミングで効果判定をするべきなのか、それとも毒性が軽微なら可能な限り続けるべきなのか?
<AURA study>O1-8-1
・日本人は24人が参加、うちT790M陽性患者は55.6%
・奏効割合は67%
・肺障害は2人で発現し、うち1人(4.2%)では治療中止
・参加者全体での肺毒性発現割合は2.7%
・日本人では2人(8.5%)の治療関連死→有害事象が少なく安全な治療とは今のところ言いがたい
・AZD9291への耐性化変異が確認されている(Nature Med 560-562 2015, Cancer Res 2489-2500 2015)
・C797S耐性変異は耐性化した患者の40%に発現していたが、全てEx. 19 del.の患者だった
<AURA study - 1st line cohort>O1-8-2
・AZD9291はin vitroではEx.19 del.陽性のPC1細胞株の耐性化を遅らせる
・全患者60人中5人の患者において、未治療の状態でT790Mが確認されている
・主な有害事象は皮疹、下痢、胃炎だった
・肺障害は3人で認められ、うち2人は日本人だった
・全体での奏効割合は63%(80mg cohort)、83%(160mg cohort)、73%(total)
・日本人での奏効割合は57%(80mg cohort)、88%(160mg cohort)、73%(total)
・Ex. 19とEx.21での奏効割合はほぼ同じ
・進行中の臨床試験:AURA3(AZD9291 vs chemotherapy)、FLAURA(1st line AZD9291 vs Gefitinib/Erlotinib)
<JO28638 study 1st line Erlotinib+Onartuzumab>
・Onartuzumabは抗MET抗体で、METへのHGF会合を阻害する
・EGFR遺伝子変異陽性で、MET-IHC陽性の患者が70%を占める
・MET-Lung study(OAM4971g)の試験結果を受けて、本試験を含めて全てのOnartuzumab関連試験が中止された
・無増悪生存期間中央値8.5ヶ月、生存期間中央値15.6ヶ月、奏効割合68.9%、病勢コントロール割合88.5%、肺障害発現割合6.6%
<ErlotinibとBevacizumab併用療法のin vitroでの解析>
・T790M陽性細胞に対する併用効果(縮小効果)は少ないが、Bevacizumabを中止すると早期に再増殖→再増殖を抑制する効果はありそう
・MET増幅細胞に対する併用効果は高い
<EGFR陽性肺がんの再生検に関する後方視的検討>愛知県がんセンター
・2005年から2015年にかけて肺がん患者700人余りを対象に調査、再生検を行ったのが120人、EGFR陽性例は68人
・Ex. 19 / Ex. 21 / others = 32人 / 35人 / 2人(うち1人はdoublet)
・T790M陽性は36人(52.9%)、陰性は32人、以下のデータはT790M陽性患者、陰性患者別に提示
・TBLBで診断できたのは6人、6人
・他の部位の生検で診断できたのは6人、10人
・胸水で診断できたのは16人、13人
・無増悪生存期間中央値は18ヶ月、11ヶ月(p=0.04)
・局所再燃例は70%、34%(p=0.014)
・生存期間中央値は68ヶ月、29ヶ月
・T790Mは初回治療後の無増悪生存期間が長い、局所再燃例が多い、生存期間中央値が長いという特徴がある
・参考文献
Clin Cancer Res 2015(高感度PCR、digital PCR)
Cancer 119 4325-32, 2013
Hata et al, Clin Cancer Res 2240-2247, 2013
これで1日目の内容は大体終わり。
2015年07月18日
日本臨床腫瘍学会総会1日目のつづき
以下、個人的メモです。
参考にされる方はどうぞ。
2015/7/16
<国立がん研究センター東病院 杉山先生>
・40歳以下の若年成人の原発性肺腺癌患者を検索、123人抽出。
・外科切除した患者は48人。
・切除標本を利用可能なのが45人いたので、まずはPCR-invader法でEGFR遺伝子変異を解析。
・Exon 19 deletionが16人、Exon 21 point mutationが2人、計18人。
・EGFR mutation陰性が27人、この人たちを次世代シーケンサーで解析。
・EGFR変異が15人(!)、ALK再構成が6人、ROS1再構成が2人、KRAS変異が1人、ERBB2変異が1人、MAPK変異が1人、ERBB3変異が1人、ERBB4変異が1人。
・年をとるほどExon 19 deletionが減って、Exon 21 point mutationが増える!?
<Dr Herbst discussion>
・ECOG1594 studyでplatinum doubletが標準治療に位置づけられてから、すっかり世界観がかわってしまった。
・umbrella trial(臓器別/がん種別の臨床試験)からbasket trial(driver oncogene別の臨床試験)の時代へ
・ARCHEMIST study, LUNG-MAP study, NCI-MATCH study
<国立がん研究センター東病院 葉先生>
・LC-scrum Japanの枠組みを用いてRET陽性肺癌をスクリーニング
・RET陽性肺癌に対してvandetanib(ZD6494)を用いる医師主導第II相、多施設共同単アーム臨床試験。
・vandetanibはアストラゼネカ社より無償供給を受けて患者さんに使用。
・RT-PCTとFISH両方でRET陽性となった患者さんが対象。
・2nd line以降の治療となる。
・主要評価項目は奏効割合で、期待奏効割合を60%、閾値奏効割合を30%、αエラー0.05、検出力0.80として、目標症例数は17例。
・2013年2月から2015年5月までで患者集積終了。
・2016年には結果を公表する予定。
・RET陽性患者はLC-scrumでスクリーニングした1536人のうち34人(2.2%)で確認された。
・承認申請時は、コンパニオン診断法も併せて申請する予定。
・サンプルは保管している。
<nedaplatin+DOC vs CDDP+DOC for advanced Sq phase III、大阪府立成人病センター 駄賀先生>
・nedaplatin+DOC群177人、CDDP+DOC群172人
・後治療が入ったのはneda群78%、CDDP群76.7%
・治療関連死はneda群で2.3%、CDDP群で1.7%
・生存期間中央値はneda群で13.6ヶ月、CDDP群で11.4ヶ月、HR 0.81、p=0.039
・無増悪生存期間中央値はneda群で4.9ヶ月、CDDP群で4.5ヶ月、HR 0.83、p=0.05
<LUX-Lung 8、Dr James Yang>
・afatinib vs erlotinib for advanced Sq phase III
・主要評価項目は無増悪生存期間(PFS)
・mPFSはafatinibで2.6ヶ月、erlotinibで1.9ヶ月、HR 0.81(0.69-0.96)、p=0.0103
・東アジア人が両アームともに22%組み入れられており、東アジア人はafatinibで有意にPFSが延長、HR 0.62
・生存期間中央値はafatinib 7.9ヶ月、erlotinib 6.8ヶ月、p=0.0077
・EGFR遺伝子変異陽性例は14人で、東アジア人以外にも認められた
・実地臨床では、1st line:platinum doublet、2nd line:DOC、3rd line:afatinibと考えるのが妥当だろう
<WJOG5910L beyond PDにおけるbevacizumab(BV)投与の意義を検証するランダム化第II相試験 九州がんセンター 瀬戸先生>
・大腸がんではbeyond PDでのBV継続投与の有効性が示されている
・主要評価項目は無増悪生存期間、副次評価項目は全生存期間、奏効割合、安全性
・初回治療としてplatinum doublet+BVを行い、PD確定後2nd lineに入る前に、DOC単剤群とDOC+BV併用群に割付。
・DOC群/DOC+BV群とすると、年齢中央値:67 vs 64.5、無増悪生存期間中央値:3.4ヶ月 vs 4.4ヶ月、生存期間中央値:11.0ヶ月 vs 13.1ヶ月、奏効割合:26% vs 36%
・1st line治療終了後の期間が長いほどDOC+BV群の治療効果が良好。
・第III相試験に入る前に、AVAALLの結果を見てから判断する。
<CBDCA+weekly PTx+BV for elderly phase II>
・70歳以上の患者さんが対象
・目標症例数を36人に設定
・EGFR遺伝子変異を約40%で検出
・奏効割合は69.4%、病勢コントロール割合は94.4%、無増悪生存期間中央値は8.4ヶ月、全生存期間中央値は29.2ヶ月、年齢中央値は75歳だった。
<非小細胞肺癌二次治療におけるRamcirumabの効果を検討する第II相試験(JVCG試験) 都立駒込病院 細見先生>
・Ramcirumabは抗VEGFR2抗体
・海外では、REVEL studyで既にPFS、OS延長効果が示されている
・2014年12月にFDA承認済み
・主要評価項目はPFS、副次評価項目は奏効割合、OS、安全性
・今回は、前治療としてEGFR-TKI治療歴のない患者の解析を依頼
・いずれ、EGFR-TKI治療歴のある患者も検索し、ESMO2015で発表予定
・DOC+Rmab (n=76)/ DOC単剤(n=81人)、mPFS:5.22ヶ月 vs 4.21ヶ月、mOS:15.15ヶ月 vs 13.13ヶ月、奏効割合:28.9% vs 18.5%、病勢コントロール割合: 78.9% vs 70.4%
・REVEL studyと遜色ない結果が得られた。
<ランダム化試験、ここに眠る-1946年生、2015年没 赤十字医療センター 国頭 英夫先生>
・1946年 肺結核に対するストレプトマイシンの効果を調べる臨床試験が組まれたのがそもそもの始まり
・JCOG0707 study: 完全切除後の非小細胞肺癌に対する術後補助療法として、S-1のUFTに対する優越性を検証する第III相試験、2014年12月にやっと患者集積終了、結果が出るまでにあとどのくらいかかるかわからない、立案から結果が出るまでにゆうに10年以上かかる
・臨床試験に参加できる患者と実臨床で診療する患者には、かなりの差異がある。
・赤十字医療センターと東大病院で、代表的な臨床試験のクライテリアを満たす人がどのくらいいるのか調べてみたところ、FACS study(17%, 33%)、JCOG 0803 for elderly(28%, 47%)、CBDCA+PTX+BV(15%, 15%)
・この状況で、臨床試験で得られた結果を一般化していいのだろうか
・飛行機から地上へと落下するに当たり、パラシュートを用いる群と自由落下する群の二群比較試験に関するメタアナリシスの報告(Gordon et al, BMJ 327, 1459-61, 2003)
・主要評価項目は着地成功率とし、無作為化比較試験をデータベースから検索したが、1件も検出できなかった
・飛行機から地上へと落下するに当たり、地上落下に対するパラシュート使用の優越性はいまだかつて証明されていない
・今後、クロスオーバーを規定した上で、無作為化比較試験で立証する必要がある・・・のか!?
・こんなわかりきったエンドポイントを、わざわざ立証する必要があるのか?
・BRAF V600E変異を有する悪性黒色腫に対するvemurafenibの有効性は、第II相試験で奏効割合47.5%と示されていた
・それまでの標準治療はDTICだが、奏効割合は5%
・vemurafenibとDTICを比較する第III相臨床試験が組まれ(BRIM3 study)、2011年にNEJMに論文報告されている
・crossover禁止と規定された試験だったが、これだけ圧倒的な差を、クロスオーバーを禁止して(DTIC群がPDとなったらただ死を待つだけ)まで検証するのは、倫理的に許容される行いなのか?
・分子標的薬が第III相臨床試験を行わずとも承認されてしかるべき条件6つ(Sharma et al, Nature Rev Clin Oncol 208-214 2011)
・LUX-Lung 8で、AfatinibとErlotinibを進行扁平上皮癌の二次治療で比較するのは、イチローとマー君に相撲で優劣を競わせるようなもの
・KEYNOTE-001試験は第I相臨床試験なのに、なんと参加者は495人!3+3デザインでずっとやってきた者としてはまったく受け入れられない
・Colorectal Cancerの免疫チェックポイント阻害薬に対するMMRをからめた臨床試験→プロトコールに記載された予定患者数と実際の患者数に食い違いがあり、さらにはNew England Journal of Medicineに記載された患者数もまた食い違っている
・・・疲れたので今夜はここまで。
参考にされる方はどうぞ。
2015/7/16
<国立がん研究センター東病院 杉山先生>
・40歳以下の若年成人の原発性肺腺癌患者を検索、123人抽出。
・外科切除した患者は48人。
・切除標本を利用可能なのが45人いたので、まずはPCR-invader法でEGFR遺伝子変異を解析。
・Exon 19 deletionが16人、Exon 21 point mutationが2人、計18人。
・EGFR mutation陰性が27人、この人たちを次世代シーケンサーで解析。
・EGFR変異が15人(!)、ALK再構成が6人、ROS1再構成が2人、KRAS変異が1人、ERBB2変異が1人、MAPK変異が1人、ERBB3変異が1人、ERBB4変異が1人。
・年をとるほどExon 19 deletionが減って、Exon 21 point mutationが増える!?
<Dr Herbst discussion>
・ECOG1594 studyでplatinum doubletが標準治療に位置づけられてから、すっかり世界観がかわってしまった。
・umbrella trial(臓器別/がん種別の臨床試験)からbasket trial(driver oncogene別の臨床試験)の時代へ
・ARCHEMIST study, LUNG-MAP study, NCI-MATCH study
<国立がん研究センター東病院 葉先生>
・LC-scrum Japanの枠組みを用いてRET陽性肺癌をスクリーニング
・RET陽性肺癌に対してvandetanib(ZD6494)を用いる医師主導第II相、多施設共同単アーム臨床試験。
・vandetanibはアストラゼネカ社より無償供給を受けて患者さんに使用。
・RT-PCTとFISH両方でRET陽性となった患者さんが対象。
・2nd line以降の治療となる。
・主要評価項目は奏効割合で、期待奏効割合を60%、閾値奏効割合を30%、αエラー0.05、検出力0.80として、目標症例数は17例。
・2013年2月から2015年5月までで患者集積終了。
・2016年には結果を公表する予定。
・RET陽性患者はLC-scrumでスクリーニングした1536人のうち34人(2.2%)で確認された。
・承認申請時は、コンパニオン診断法も併せて申請する予定。
・サンプルは保管している。
<nedaplatin+DOC vs CDDP+DOC for advanced Sq phase III、大阪府立成人病センター 駄賀先生>
・nedaplatin+DOC群177人、CDDP+DOC群172人
・後治療が入ったのはneda群78%、CDDP群76.7%
・治療関連死はneda群で2.3%、CDDP群で1.7%
・生存期間中央値はneda群で13.6ヶ月、CDDP群で11.4ヶ月、HR 0.81、p=0.039
・無増悪生存期間中央値はneda群で4.9ヶ月、CDDP群で4.5ヶ月、HR 0.83、p=0.05
<LUX-Lung 8、Dr James Yang>
・afatinib vs erlotinib for advanced Sq phase III
・主要評価項目は無増悪生存期間(PFS)
・mPFSはafatinibで2.6ヶ月、erlotinibで1.9ヶ月、HR 0.81(0.69-0.96)、p=0.0103
・東アジア人が両アームともに22%組み入れられており、東アジア人はafatinibで有意にPFSが延長、HR 0.62
・生存期間中央値はafatinib 7.9ヶ月、erlotinib 6.8ヶ月、p=0.0077
・EGFR遺伝子変異陽性例は14人で、東アジア人以外にも認められた
・実地臨床では、1st line:platinum doublet、2nd line:DOC、3rd line:afatinibと考えるのが妥当だろう
<WJOG5910L beyond PDにおけるbevacizumab(BV)投与の意義を検証するランダム化第II相試験 九州がんセンター 瀬戸先生>
・大腸がんではbeyond PDでのBV継続投与の有効性が示されている
・主要評価項目は無増悪生存期間、副次評価項目は全生存期間、奏効割合、安全性
・初回治療としてplatinum doublet+BVを行い、PD確定後2nd lineに入る前に、DOC単剤群とDOC+BV併用群に割付。
・DOC群/DOC+BV群とすると、年齢中央値:67 vs 64.5、無増悪生存期間中央値:3.4ヶ月 vs 4.4ヶ月、生存期間中央値:11.0ヶ月 vs 13.1ヶ月、奏効割合:26% vs 36%
・1st line治療終了後の期間が長いほどDOC+BV群の治療効果が良好。
・第III相試験に入る前に、AVAALLの結果を見てから判断する。
<CBDCA+weekly PTx+BV for elderly phase II>
・70歳以上の患者さんが対象
・目標症例数を36人に設定
・EGFR遺伝子変異を約40%で検出
・奏効割合は69.4%、病勢コントロール割合は94.4%、無増悪生存期間中央値は8.4ヶ月、全生存期間中央値は29.2ヶ月、年齢中央値は75歳だった。
<非小細胞肺癌二次治療におけるRamcirumabの効果を検討する第II相試験(JVCG試験) 都立駒込病院 細見先生>
・Ramcirumabは抗VEGFR2抗体
・海外では、REVEL studyで既にPFS、OS延長効果が示されている
・2014年12月にFDA承認済み
・主要評価項目はPFS、副次評価項目は奏効割合、OS、安全性
・今回は、前治療としてEGFR-TKI治療歴のない患者の解析を依頼
・いずれ、EGFR-TKI治療歴のある患者も検索し、ESMO2015で発表予定
・DOC+Rmab (n=76)/ DOC単剤(n=81人)、mPFS:5.22ヶ月 vs 4.21ヶ月、mOS:15.15ヶ月 vs 13.13ヶ月、奏効割合:28.9% vs 18.5%、病勢コントロール割合: 78.9% vs 70.4%
・REVEL studyと遜色ない結果が得られた。
<ランダム化試験、ここに眠る-1946年生、2015年没 赤十字医療センター 国頭 英夫先生>
・1946年 肺結核に対するストレプトマイシンの効果を調べる臨床試験が組まれたのがそもそもの始まり
・JCOG0707 study: 完全切除後の非小細胞肺癌に対する術後補助療法として、S-1のUFTに対する優越性を検証する第III相試験、2014年12月にやっと患者集積終了、結果が出るまでにあとどのくらいかかるかわからない、立案から結果が出るまでにゆうに10年以上かかる
・臨床試験に参加できる患者と実臨床で診療する患者には、かなりの差異がある。
・赤十字医療センターと東大病院で、代表的な臨床試験のクライテリアを満たす人がどのくらいいるのか調べてみたところ、FACS study(17%, 33%)、JCOG 0803 for elderly(28%, 47%)、CBDCA+PTX+BV(15%, 15%)
・この状況で、臨床試験で得られた結果を一般化していいのだろうか
・飛行機から地上へと落下するに当たり、パラシュートを用いる群と自由落下する群の二群比較試験に関するメタアナリシスの報告(Gordon et al, BMJ 327, 1459-61, 2003)
・主要評価項目は着地成功率とし、無作為化比較試験をデータベースから検索したが、1件も検出できなかった
・飛行機から地上へと落下するに当たり、地上落下に対するパラシュート使用の優越性はいまだかつて証明されていない
・今後、クロスオーバーを規定した上で、無作為化比較試験で立証する必要がある・・・のか!?
・こんなわかりきったエンドポイントを、わざわざ立証する必要があるのか?
・BRAF V600E変異を有する悪性黒色腫に対するvemurafenibの有効性は、第II相試験で奏効割合47.5%と示されていた
・それまでの標準治療はDTICだが、奏効割合は5%
・vemurafenibとDTICを比較する第III相臨床試験が組まれ(BRIM3 study)、2011年にNEJMに論文報告されている
・crossover禁止と規定された試験だったが、これだけ圧倒的な差を、クロスオーバーを禁止して(DTIC群がPDとなったらただ死を待つだけ)まで検証するのは、倫理的に許容される行いなのか?
・分子標的薬が第III相臨床試験を行わずとも承認されてしかるべき条件6つ(Sharma et al, Nature Rev Clin Oncol 208-214 2011)
・LUX-Lung 8で、AfatinibとErlotinibを進行扁平上皮癌の二次治療で比較するのは、イチローとマー君に相撲で優劣を競わせるようなもの
・KEYNOTE-001試験は第I相臨床試験なのに、なんと参加者は495人!3+3デザインでずっとやってきた者としてはまったく受け入れられない
・Colorectal Cancerの免疫チェックポイント阻害薬に対するMMRをからめた臨床試験→プロトコールに記載された予定患者数と実際の患者数に食い違いがあり、さらにはNew England Journal of Medicineに記載された患者数もまた食い違っている
・・・疲れたので今夜はここまで。
2015年07月16日
日本臨床腫瘍学会総会1日目
第13回日本臨床腫瘍学会学術集会が開幕しました。
いつもの如く、備忘録です。
<LC-scrum Japanのお話(国立がん研究センター東病院、後藤功一先生)>
・Driver mutationの頻度(Kohno 2013)
・LURET studyは患者集積終了(17人)
・2015年3月6日の時点で1536人の患者さんが参加
・そのうち、1423人の解析が終了(93%)
・RET 2%, ROS1 4%, ALK 2%をそれぞれ検出、残りの92%はION AmpliSeqで網羅的解析へ
・RET 34人のうち19人がLURET studyに参加
・ROS1 61人のうち26人は0012-01 study(crizotinib for ROS1 grobal trial)に参加
・ION AmpliSeqでEGFR 8%, HER2 4%, KRAS 21%などを検出
・HER2の患者さんは、HOT1303-B studyでTrastuzumab投与を検討
・最近は、Oncomic Cancer Panel(OCP)を用いて解析している
・RET陽性患者さんは、次の臨床試験としてALL-RET study(Alectinib)を計画中
・2015年6月30日の段階で、参加者は1755人となった
・対象を扁平上皮癌、小細胞癌に広げた
・小細胞癌では、PI3K阻害薬であるPF-05212384のstudyが始まる予定で、主要評価項目は奏効割合
<NCI-MATCH trial(National Cancer Institute, Naoko Takebe>
・NCI-MATCH studyをbasket trialとして進行中
・がん種を問わず、同じ遺伝子変異を持つ疾病では同じ薬で治療しようというコンセプト
・LC-scrum同様、OCP AmpliSeq studyを用いている
・4つのlaboで分担して解析しているが、結果の一致率は99%以上であることを確認している
<SCRUM-Japan GI-screen(国立がん研究センター東病院、吉野孝之先生>
・colorectal cancerでHER2m(+)なら、Trastuzumab+lapatinibでORR>30%, DCR: 78%
まだまだ話題はありますが、今夜はここまで。
いつもの如く、備忘録です。
<LC-scrum Japanのお話(国立がん研究センター東病院、後藤功一先生)>
・Driver mutationの頻度(Kohno 2013)
・LURET studyは患者集積終了(17人)
・2015年3月6日の時点で1536人の患者さんが参加
・そのうち、1423人の解析が終了(93%)
・RET 2%, ROS1 4%, ALK 2%をそれぞれ検出、残りの92%はION AmpliSeqで網羅的解析へ
・RET 34人のうち19人がLURET studyに参加
・ROS1 61人のうち26人は0012-01 study(crizotinib for ROS1 grobal trial)に参加
・ION AmpliSeqでEGFR 8%, HER2 4%, KRAS 21%などを検出
・HER2の患者さんは、HOT1303-B studyでTrastuzumab投与を検討
・最近は、Oncomic Cancer Panel(OCP)を用いて解析している
・RET陽性患者さんは、次の臨床試験としてALL-RET study(Alectinib)を計画中
・2015年6月30日の段階で、参加者は1755人となった
・対象を扁平上皮癌、小細胞癌に広げた
・小細胞癌では、PI3K阻害薬であるPF-05212384のstudyが始まる予定で、主要評価項目は奏効割合
<NCI-MATCH trial(National Cancer Institute, Naoko Takebe>
・NCI-MATCH studyをbasket trialとして進行中
・がん種を問わず、同じ遺伝子変異を持つ疾病では同じ薬で治療しようというコンセプト
・LC-scrum同様、OCP AmpliSeq studyを用いている
・4つのlaboで分担して解析しているが、結果の一致率は99%以上であることを確認している
<SCRUM-Japan GI-screen(国立がん研究センター東病院、吉野孝之先生>
・colorectal cancerでHER2m(+)なら、Trastuzumab+lapatinibでORR>30%, DCR: 78%
まだまだ話題はありますが、今夜はここまで。
2015年07月15日
米国でのgefitinib復権
我が国でこそ当たり前に使えるgefitinibですが、2002年に世界で初めて我が国で使用可能になって以降、様々な紆余曲折を経てきました。
大規模臨床試験で使用の意義が示せない、発売直後に露見した薬剤性肺障害の問題により、発売後数年間は逆風にさらされました。
そんな中、2004年にはEGFR遺伝子変異と薬効の相関が示され、2007年には非小細胞肺癌二次治療におけるドセタキセルとの非劣性(INTEREST study)が示されました。
後に我が国のNEJ、WJTOGにより化学療法に対する優越性が示され、EGFR遺伝子変異陽性肺癌の標準治療として確立されます。
Erlotinib、Afatinibとともに、EGFR遺伝子変異陽性肺癌の初回標準治療として定着しました。
そんな中、米国では長らくGefitinibは承認されてきませんでしたが、2015年7月13日付でついに承認されたようです。
市販後臨床試験である第Ⅳ相試験 IFUM(IRESSA Follow-Up Measure)が承認の主たる根拠で、Iressa Pan-ASia Study (IPASS)の結果で臨床データを補完して、承認にいたったとのことだそうです。
昨今の傾向で、我々にとっては大きな問題でもある、コンパニオン診断キットとの抱き合わせ承認のようですね。
FDAはコンパニオン診断キット(テラスクリーンEGFR RGQ PCRキット)を用いてEGFR遺伝子変異陽性(Ex.19 欠失変異もしくはEx.21 置換変異)を有すると診断された進行非小細胞肺癌に対して、Gefitinib(イレッサ)を承認した。
Gefitinibの承認は、多施設共同、単アーム、オープンラベルの、EGFR遺伝子変異陽性の未治療進行非小細胞肺癌患者106人を対象に、Gefitnib 250mgを病勢進行もしくは毒性中止に至るまで継続する臨床試験の結果に基づく。主たる評価項目はRECIST Ver.1.1に基づく奏効割合とし、独立した中央効果判定および担当医判定によるとした。
中央効果判定における奏効割合は50%(95%信頼区間:41-59%)、奏効期間中央値は6.0ヶ月だった。担当医判定による奏効割合は70%(61-78%)で、奏効期間中央値は8.3ヶ月だった。
Gefitinibの効果はまた、進行肺腺癌の初回治療に関する無作為化多施設共同オープンラベル臨床試験の探索的サブセット解析にも支持されている。患者はGefitinib 250mg/日もしくはカルボプラチン+パクリタキセル併用化学療法6コースのいずれかに1:1の比率で割り付けられた。評価項目には無増悪生存期間、奏効割合が含まれ、評価は中央効果判定によった。
サブセット解析の対象となったのは、登録患者1,217人のうち15%を占める186人のEGFR陽性、画像的に測定可能病変を有し中央効果判定可能な患者群だった。88人がGefitnib群に、98人がカルボプラチン+パクリタキセル群に割り付けられていた。
PFSに関するハザード比は0.54(0.38-0.79)で、無増悪生存期間中央値はGefitinib群で10.9ヶ月、カルボプラチン+パクリタキセル併用群で7.4ヶ月だった。加えて、奏効割合はGefitinib群で67%(56%-77%)、奏効状態は9.6ヶ月持続、一方でカルボプラチン+パクリタキセル群では41%(31%-51%)、奏効状態は5.5ヶ月持続した。
Gefitinibの安全性は、二重盲見プラセボ対照試験に於ける1692人の患者データに基づいて評価された。Gefitinibを使用した1129人において20%以上の頻度で認められたのは、皮膚障害、肝機能障害(AST,ALT上昇)、蛋白尿、下痢だった。Grade 3/4の合併症として2%以上に認められたのは蛋白尿、下痢、肝機能障害(AST,ALT上昇)、食欲不振、皮膚障害だった。Gefitnibで治療を受けた患者のうち約5%は、副作用を理由に治療を中止していた。
重篤で稀な副作用は、3つの無作為化臨床試験でGefitinib単剤治療を受けた2462人の非小細胞肺癌患者を対象に評価された。間質性肺炎が1.3%、致死的な肝障害が0.04%、Grade 3の視覚障害が0.1%だった。
Gefitinibの推奨用量は250mg/日を1日1回服用で、服用のタイミングは空腹時、食後いずれでもよい。治療は病勢進行もしくは忍容不能な毒性がない限りは継続すべきである。
第3世代EGFR阻害薬が効果に優れ、毒性が軽微であることから、耐性遺伝子変異の有無を問わずに初回治療から使用してもいいのでは?という議論が出始めています。
AZD9291 vs Gefitinib / Erlotinibの結果を見てから判断ということになりそうですが、その一方で、AZD9291に対するC797S耐性変異が既に報告されており、しかもこの耐性変異にはGefitinibが有効である、という話が聞こえてきています。
AZD9291に耐性化した際の次治療としてGefitnibを使用できるようにしておくために今回FDAが承認した、と見るのは、あまりにうがちすぎた見方でしょうか?
Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M.
Thress KS et al.
Nat Med. 2015 Jun;21(6):560-2.
本論文では、上皮増殖因子受容体(EFGR)チロシンキナーゼ阻害剤(TKI)であるAZD9291に対する抵抗性が生じた進行性肺がん患者の血漿中無細胞画分DNA(cfDNA)について調べた。まず、7人の患者のcfDNAについて次世代塩基配列解読を行ない、獲得型 EGFR C797S変異が1人の患者で検出された。この変異型 EGFR 構築体を発現させた細胞株はAZD9291抵抗性を示すようになった。次に、AZD9291を投与された患者15人から集めた一連のcfDNA試料について、ドロップレットデジタルPCRを行った。治療前には全ての試料にT790M変異が存在したが、AZD9291抵抗性が生じると、3種類の分子サブタイプが出現した。すなわち、6例ではC797S変異が獲得されており、5例ではT790M変異は維持されているがC797S変異は獲得されておらず、4例では元からの EGFR 活性型変異が存在するにもかかわらずT790M変異が失われていた。この結果は、腫瘍がAZD9291抵抗性を獲得する機序の多様性についての手掛かりをもたらし、 EGFR C797S変異によって仲介される薬剤抵抗性に打ち勝つことができる治療法の必要性をはっきりと示している。
大規模臨床試験で使用の意義が示せない、発売直後に露見した薬剤性肺障害の問題により、発売後数年間は逆風にさらされました。
そんな中、2004年にはEGFR遺伝子変異と薬効の相関が示され、2007年には非小細胞肺癌二次治療におけるドセタキセルとの非劣性(INTEREST study)が示されました。
後に我が国のNEJ、WJTOGにより化学療法に対する優越性が示され、EGFR遺伝子変異陽性肺癌の標準治療として確立されます。
Erlotinib、Afatinibとともに、EGFR遺伝子変異陽性肺癌の初回標準治療として定着しました。
そんな中、米国では長らくGefitinibは承認されてきませんでしたが、2015年7月13日付でついに承認されたようです。
市販後臨床試験である第Ⅳ相試験 IFUM(IRESSA Follow-Up Measure)が承認の主たる根拠で、Iressa Pan-ASia Study (IPASS)の結果で臨床データを補完して、承認にいたったとのことだそうです。
昨今の傾向で、我々にとっては大きな問題でもある、コンパニオン診断キットとの抱き合わせ承認のようですね。
FDAはコンパニオン診断キット(テラスクリーンEGFR RGQ PCRキット)を用いてEGFR遺伝子変異陽性(Ex.19 欠失変異もしくはEx.21 置換変異)を有すると診断された進行非小細胞肺癌に対して、Gefitinib(イレッサ)を承認した。
Gefitinibの承認は、多施設共同、単アーム、オープンラベルの、EGFR遺伝子変異陽性の未治療進行非小細胞肺癌患者106人を対象に、Gefitnib 250mgを病勢進行もしくは毒性中止に至るまで継続する臨床試験の結果に基づく。主たる評価項目はRECIST Ver.1.1に基づく奏効割合とし、独立した中央効果判定および担当医判定によるとした。
中央効果判定における奏効割合は50%(95%信頼区間:41-59%)、奏効期間中央値は6.0ヶ月だった。担当医判定による奏効割合は70%(61-78%)で、奏効期間中央値は8.3ヶ月だった。
Gefitinibの効果はまた、進行肺腺癌の初回治療に関する無作為化多施設共同オープンラベル臨床試験の探索的サブセット解析にも支持されている。患者はGefitinib 250mg/日もしくはカルボプラチン+パクリタキセル併用化学療法6コースのいずれかに1:1の比率で割り付けられた。評価項目には無増悪生存期間、奏効割合が含まれ、評価は中央効果判定によった。
サブセット解析の対象となったのは、登録患者1,217人のうち15%を占める186人のEGFR陽性、画像的に測定可能病変を有し中央効果判定可能な患者群だった。88人がGefitnib群に、98人がカルボプラチン+パクリタキセル群に割り付けられていた。
PFSに関するハザード比は0.54(0.38-0.79)で、無増悪生存期間中央値はGefitinib群で10.9ヶ月、カルボプラチン+パクリタキセル併用群で7.4ヶ月だった。加えて、奏効割合はGefitinib群で67%(56%-77%)、奏効状態は9.6ヶ月持続、一方でカルボプラチン+パクリタキセル群では41%(31%-51%)、奏効状態は5.5ヶ月持続した。
Gefitinibの安全性は、二重盲見プラセボ対照試験に於ける1692人の患者データに基づいて評価された。Gefitinibを使用した1129人において20%以上の頻度で認められたのは、皮膚障害、肝機能障害(AST,ALT上昇)、蛋白尿、下痢だった。Grade 3/4の合併症として2%以上に認められたのは蛋白尿、下痢、肝機能障害(AST,ALT上昇)、食欲不振、皮膚障害だった。Gefitnibで治療を受けた患者のうち約5%は、副作用を理由に治療を中止していた。
重篤で稀な副作用は、3つの無作為化臨床試験でGefitinib単剤治療を受けた2462人の非小細胞肺癌患者を対象に評価された。間質性肺炎が1.3%、致死的な肝障害が0.04%、Grade 3の視覚障害が0.1%だった。
Gefitinibの推奨用量は250mg/日を1日1回服用で、服用のタイミングは空腹時、食後いずれでもよい。治療は病勢進行もしくは忍容不能な毒性がない限りは継続すべきである。
第3世代EGFR阻害薬が効果に優れ、毒性が軽微であることから、耐性遺伝子変異の有無を問わずに初回治療から使用してもいいのでは?という議論が出始めています。
AZD9291 vs Gefitinib / Erlotinibの結果を見てから判断ということになりそうですが、その一方で、AZD9291に対するC797S耐性変異が既に報告されており、しかもこの耐性変異にはGefitinibが有効である、という話が聞こえてきています。
AZD9291に耐性化した際の次治療としてGefitnibを使用できるようにしておくために今回FDAが承認した、と見るのは、あまりにうがちすぎた見方でしょうか?
Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M.
Thress KS et al.
Nat Med. 2015 Jun;21(6):560-2.
本論文では、上皮増殖因子受容体(EFGR)チロシンキナーゼ阻害剤(TKI)であるAZD9291に対する抵抗性が生じた進行性肺がん患者の血漿中無細胞画分DNA(cfDNA)について調べた。まず、7人の患者のcfDNAについて次世代塩基配列解読を行ない、獲得型 EGFR C797S変異が1人の患者で検出された。この変異型 EGFR 構築体を発現させた細胞株はAZD9291抵抗性を示すようになった。次に、AZD9291を投与された患者15人から集めた一連のcfDNA試料について、ドロップレットデジタルPCRを行った。治療前には全ての試料にT790M変異が存在したが、AZD9291抵抗性が生じると、3種類の分子サブタイプが出現した。すなわち、6例ではC797S変異が獲得されており、5例ではT790M変異は維持されているがC797S変異は獲得されておらず、4例では元からの EGFR 活性型変異が存在するにもかかわらずT790M変異が失われていた。この結果は、腫瘍がAZD9291抵抗性を獲得する機序の多様性についての手掛かりをもたらし、 EGFR C797S変異によって仲介される薬剤抵抗性に打ち勝つことができる治療法の必要性をはっきりと示している。
2015年07月13日
HER2遺伝子変異陽性肺癌
最近、職場での出来事を書いていなかったので、久し振りに報告します。
LC-scrum Japanへの登録を目指していた患者さんのその後の話です。
前回の内容は以下を参照のこと。
http://oitahaiganpractice.junglekouen.com/e799772.html
結局、その後気管支鏡下縦隔リンパ節生検をやりました。
併せて、病勢進行により悪性胸水も合併したため、胸水も採取しました。
これらをひとまとめにして、ようやく6月中旬に患者登録、検体提出にこぎつけました。
ちょうど臨床試験計画の改訂に伴い、登録ができない期間に当たってしまったり、なんやかんやと躓きましたが、諦めなくてよかった。
この場をお借りして、大分大学病院、国立がん研究センター東病院、SRLの諸氏に厚く御礼申し上げます。
LC-scrum Japanへの提出を目指し始めてからこれまでに、患者さんには劇的な変化が起こりました。
とにかく病勢進行が速い。
病勢悪化を確認したのは4月の段階のCTで、明らかな他臓器転移は左副腎のみでした。
5月に再検査したところ、肺内多発転移、骨多発転移、皮下多発転移、筋多発転移、左胸水、心嚢液貯留、脳多発転移と、わずか1ヶ月であっという間に全身に広がってしまいました。
これはLC-scrum Japanの結果が出るまで待っていられないと、ドセタキセルによる二次治療を行いました。
有害事象はそれほど強くありませんでしたが、まったく効果は得られず、①コースで終了しました。
その後は患者さんの状態が日に日に悪くなるのを眺めつつ、結果が返ってくるのを待つしかありませんでした。
結果は6月下旬からポツリポツリ帰ってき始めて、最終結果が戻ってきたのが先週末でした。
RET陰性、ROS1はコメント付きながら陰性、そして最後に唯一帰ってきたのが・・・HER2遺伝子変異陽性という結果でした。
HER2遺伝子変異が肺癌でも認められる、というのはなんとなく知っていましたが、自分の患者さんとして経験するのは初めてです。
目の前では当の患者さんが車椅子に乗って酸素吸入をしながら、PS3-4の状態でフウフウ言っています。
腰砕けになりながら、わらをもつかむ思いでいろいろと調べ始めました。
HER2と言えば、乳癌の領域では非常によく知られています。
EGFRと同じERBB膜蛋白グループに属します(EGFRは別名ERBB1, HER2は別名ERBB2です)。
肺癌でHER2遺伝子変異が認められると最初に報告したのは、2004年におけるこのNatureの論文ではないでしょうか。
120人の肺癌を集め、その4%にHER2遺伝子変異を認め、対象を腺癌に絞ると実に10%にHER2遺伝子変異が見られたと言います。
http://www.nature.com/nature/journal/v431/n7008/full/431525b.html
岡山大学のShigematsu先生は、日本、台湾、オーストラリアのHER2陽性肺癌患者さんについて、以下のように報告しています。
http://cancerres.aacrjournals.org/content/65/5/1642.long

非小細胞肺癌の6-35%にはHER2蛋白の過剰発現が、10-20%にはHER2遺伝子増幅が見られるとされています。
一方、HER2遺伝子変異は非小細胞肺がん全体の2-4%に留まると言われています。
HER2過剰発現や遺伝子増幅を有する患者さんを対象に、抗がん薬+トラスツズマブ併用療法の臨床試験が組まれましたが、残念ながらこれはnegative studyでした。
しかしながら、Cappuzo先生は以下のように、一部のHER2陽性肺癌患者にトラスツズマブがよく効くという事例を報告しています。
http://www.nejm.org/doi/full/10.1056/NEJMc060020

そんななか、HER2遺伝子変異に対してAfatinibを使う報告もちらちらと出始めます。
こちらは、ベルギーのDe Greve先生の症例報告です。
http://www.lungcancerjournal.info/article/S0169-5002(12)00021-9/pdf
HER2遺伝子変異陽性で、Afatinibを使って効果が得られた3症例を取り扱っています。
こちらはスペインのMazieres先生の論文。
3800人の患者さんをスクリーニングして、HER2遺伝子変異を証明できたのは65人(1.7%)。
http://jco.ascopubs.org/content/31/16/1997.long


生存曲線を見る限り、IV期であっても生存期間中央値は2年前後のようです。
何らかの形で、ほぼ全てのIV期HER2遺伝子変異陽性患者さんが、HER2阻害薬を使われています。
トラスツズマブを使われた15人の病勢コントロール割合は96%、Afatinibを使われた4人の病勢コントロール割合は100%でした。
最後にもう一度、ベルギーのDe Greve先生の最近の論文から。
第II相臨床試験として、HER2遺伝子変異陽性肺癌患者さんに、Afatnibを使用しました。
一連の資料の中では、Cohort3というのが、Afatinibを服用したグループです。



完全奏効、部分奏効には至っていませんが、病勢コントロール割合は71%でした。
文献を見ると、EGFR遺伝子変異に対するEGFR阻害薬だとか、ALK再構成肺癌に対するALK阻害薬ほどには劇的な効果を示さなさそうです。
最後に、日経メディカルからこんな話題も。
2014年5月16日の記事から抜粋です。
<HER2変異のある固形癌対象のPB272(neratinib)のフェーズ2試験が順調、コホート拡大に>
米Puma Biotechnology社は、5月14日、HER2変異を有する固形癌患者の単剤療法として、PB272(neratinib)を検討するフェーズ2試験(baske試験)で、最初に登録を始めたコホートの拡大を行ったと発表した。拡大されたコホートには、HER2陰性(HER2遺伝子増幅やHER2過剰発現がない)だが、HER2変異を有する転移性乳癌患者が含まれている。
basket試験は国際的な多施設共同オープンラベル試験で、2013年10月に開始された。HER2変異を有する固形癌患者を対象に、PB272の連日投与における安全性と有効性を評価する。
試験コホートは、(1) 膀胱/尿路癌、(2) 結腸/直腸癌、(3) 子宮体癌、(4) 胃/食道癌、 (5) 卵巣癌、(6) EGFR変異および/またはEGFR増幅の原発性脳腫瘍、 (7) HER3変異を有する固形癌、(8) HER2変異を有する他の全ての固形癌、に分けられている。
私の患者さんにとっては、このneratinibの臨床試験に参加するのがベストの選択肢のように思われますが、残念ながらそこまでの体力は残されていないようです。
LC-scrum Japanへの登録を目指していた患者さんのその後の話です。
前回の内容は以下を参照のこと。
http://oitahaiganpractice.junglekouen.com/e799772.html
結局、その後気管支鏡下縦隔リンパ節生検をやりました。
併せて、病勢進行により悪性胸水も合併したため、胸水も採取しました。
これらをひとまとめにして、ようやく6月中旬に患者登録、検体提出にこぎつけました。
ちょうど臨床試験計画の改訂に伴い、登録ができない期間に当たってしまったり、なんやかんやと躓きましたが、諦めなくてよかった。
この場をお借りして、大分大学病院、国立がん研究センター東病院、SRLの諸氏に厚く御礼申し上げます。
LC-scrum Japanへの提出を目指し始めてからこれまでに、患者さんには劇的な変化が起こりました。
とにかく病勢進行が速い。
病勢悪化を確認したのは4月の段階のCTで、明らかな他臓器転移は左副腎のみでした。
5月に再検査したところ、肺内多発転移、骨多発転移、皮下多発転移、筋多発転移、左胸水、心嚢液貯留、脳多発転移と、わずか1ヶ月であっという間に全身に広がってしまいました。
これはLC-scrum Japanの結果が出るまで待っていられないと、ドセタキセルによる二次治療を行いました。
有害事象はそれほど強くありませんでしたが、まったく効果は得られず、①コースで終了しました。
その後は患者さんの状態が日に日に悪くなるのを眺めつつ、結果が返ってくるのを待つしかありませんでした。
結果は6月下旬からポツリポツリ帰ってき始めて、最終結果が戻ってきたのが先週末でした。
RET陰性、ROS1はコメント付きながら陰性、そして最後に唯一帰ってきたのが・・・HER2遺伝子変異陽性という結果でした。
HER2遺伝子変異が肺癌でも認められる、というのはなんとなく知っていましたが、自分の患者さんとして経験するのは初めてです。
目の前では当の患者さんが車椅子に乗って酸素吸入をしながら、PS3-4の状態でフウフウ言っています。
腰砕けになりながら、わらをもつかむ思いでいろいろと調べ始めました。
HER2と言えば、乳癌の領域では非常によく知られています。
EGFRと同じERBB膜蛋白グループに属します(EGFRは別名ERBB1, HER2は別名ERBB2です)。
肺癌でHER2遺伝子変異が認められると最初に報告したのは、2004年におけるこのNatureの論文ではないでしょうか。
120人の肺癌を集め、その4%にHER2遺伝子変異を認め、対象を腺癌に絞ると実に10%にHER2遺伝子変異が見られたと言います。
http://www.nature.com/nature/journal/v431/n7008/full/431525b.html
岡山大学のShigematsu先生は、日本、台湾、オーストラリアのHER2陽性肺癌患者さんについて、以下のように報告しています。
http://cancerres.aacrjournals.org/content/65/5/1642.long

非小細胞肺癌の6-35%にはHER2蛋白の過剰発現が、10-20%にはHER2遺伝子増幅が見られるとされています。
一方、HER2遺伝子変異は非小細胞肺がん全体の2-4%に留まると言われています。
HER2過剰発現や遺伝子増幅を有する患者さんを対象に、抗がん薬+トラスツズマブ併用療法の臨床試験が組まれましたが、残念ながらこれはnegative studyでした。
しかしながら、Cappuzo先生は以下のように、一部のHER2陽性肺癌患者にトラスツズマブがよく効くという事例を報告しています。
http://www.nejm.org/doi/full/10.1056/NEJMc060020

そんななか、HER2遺伝子変異に対してAfatinibを使う報告もちらちらと出始めます。
こちらは、ベルギーのDe Greve先生の症例報告です。
http://www.lungcancerjournal.info/article/S0169-5002(12)00021-9/pdf
HER2遺伝子変異陽性で、Afatinibを使って効果が得られた3症例を取り扱っています。
こちらはスペインのMazieres先生の論文。
3800人の患者さんをスクリーニングして、HER2遺伝子変異を証明できたのは65人(1.7%)。
http://jco.ascopubs.org/content/31/16/1997.long



生存曲線を見る限り、IV期であっても生存期間中央値は2年前後のようです。
何らかの形で、ほぼ全てのIV期HER2遺伝子変異陽性患者さんが、HER2阻害薬を使われています。
トラスツズマブを使われた15人の病勢コントロール割合は96%、Afatinibを使われた4人の病勢コントロール割合は100%でした。
最後にもう一度、ベルギーのDe Greve先生の最近の論文から。
第II相臨床試験として、HER2遺伝子変異陽性肺癌患者さんに、Afatnibを使用しました。
一連の資料の中では、Cohort3というのが、Afatinibを服用したグループです。



完全奏効、部分奏効には至っていませんが、病勢コントロール割合は71%でした。
文献を見ると、EGFR遺伝子変異に対するEGFR阻害薬だとか、ALK再構成肺癌に対するALK阻害薬ほどには劇的な効果を示さなさそうです。
最後に、日経メディカルからこんな話題も。
2014年5月16日の記事から抜粋です。
<HER2変異のある固形癌対象のPB272(neratinib)のフェーズ2試験が順調、コホート拡大に>
米Puma Biotechnology社は、5月14日、HER2変異を有する固形癌患者の単剤療法として、PB272(neratinib)を検討するフェーズ2試験(baske試験)で、最初に登録を始めたコホートの拡大を行ったと発表した。拡大されたコホートには、HER2陰性(HER2遺伝子増幅やHER2過剰発現がない)だが、HER2変異を有する転移性乳癌患者が含まれている。
basket試験は国際的な多施設共同オープンラベル試験で、2013年10月に開始された。HER2変異を有する固形癌患者を対象に、PB272の連日投与における安全性と有効性を評価する。
試験コホートは、(1) 膀胱/尿路癌、(2) 結腸/直腸癌、(3) 子宮体癌、(4) 胃/食道癌、 (5) 卵巣癌、(6) EGFR変異および/またはEGFR増幅の原発性脳腫瘍、 (7) HER3変異を有する固形癌、(8) HER2変異を有する他の全ての固形癌、に分けられている。
私の患者さんにとっては、このneratinibの臨床試験に参加するのがベストの選択肢のように思われますが、残念ながらそこまでの体力は残されていないようです。
2015年07月07日
Best of ASCO 2015
Best of ASCO 2015で印象に残ったことを記します。
・Abst. #5001 未治療の高リスク局所進行、もしくは進行前立腺癌に対する治療を検討するSTAMPEDE試験
ドセタキセルによる化学療法は、初期治療の段階でホルモン療法と同時に開始した方が生命予後を改善する。
昨年のASCOまでは、初回治療はホルモン療法で行うべきで、化学療法は行うべきではないとされていた。
治療を提供する医師が腫瘍内科医か泌尿器科医かによって、化学療法や放射線療法が行われる比率が異なる(Cancer Manag Res 2011; 3: 233-245)
・Abst. #4501 尿路上皮癌に対する抗PD-L1抗体:Atezolizumabの臨床効果
既に標準治療が行われた尿路上皮癌の患者さんを対象にした第I相試験。
94%は白金製剤併用化学療法を、72%は2レジメン以上の化学療法を施行済み。
腫瘍組織を用いて、免疫担当細胞のPD-L1発現状態を確認の上、Atezolizumabの治療を開始。
尿路上皮癌の腫瘍細胞はほとんどPD-L1を発現していないので、今回は調べなかった。
免疫担当細胞の5%以上がPD-L1を発現する群では奏効割合50%、完全奏効割合20%を達成。
PD-L1低発現群でも17%の奏効割合。
全生存期間は高発現群では1年を超える見通しで、低発現群では8ヶ月。
現在、パクリタキセル、ドセタキセル、ビンフルニンのどれかひとつから選択する群を対照群として、第III相試験が進行中。
・Abst. #4506 既治療進行腎細胞癌に対するLenvatinibとEverolimusに関連したランダム化第II相試験
これまで、2nd lineでの進行腎細胞癌の治療成績は、生存期間中央値で15ヶ月程度だった。
LenvatinibはVEGF-R1/2/3とFGFR 1/2/3/4の阻害作用を有するmultitarget tyrosine kinase inhibitorである。
既に1レジメンのVEGF標的治療を受けた患者さんを対象に、Lenvatinib+Everolimus併用療法、Lenvatinib単剤療法、Everolimus単剤療法の3群に分けて治療。
併用療法群の無増悪生存期間中央値は14.6ヶ月、生存期間中央値は25.5ヶ月で、過去の成績を大きく上回る。
今後、Nivolumabとの比較(無増悪生存期間中央値4.2ヶ月、生存期間中央値25ヶ月)に話題が移りそう。
Nivolumabの方が毒性が軽い。
・Abst. #9500 癌に関連した悪液質に対するAnamorelinの効果を検証する第III相試験
悪液質(カヘキシア)は成人における体重減少、食思不振、炎症、インシュリン抵抗性、筋崩壊の促進を伴う。
「6ヶ月以内に5%以上の体重減少を示す、もしくは、サルコペニアやもともとBMI<20の人では2%以上の体重減少を示す場合」、がん関連食思不振・悪液質症候群と定義される。
サルコペニア単独では、筋量は減るが、相対的に死亡が増えるため、体重はあまり減らない。
悪液質はがん患者さんの40%に出現し、がん死の原因の20%を占める。
非小細胞肺癌患者さんを対象に、食欲亢進蛋白であるグレリンのアゴニスト、Anamorelinの効果を検証する第III相試験が行われた。
体重は増えたが、筋力や全生存期間の改善は認めなかった。
体重が増えることは、患者さんの利益になり得るのか。
現場からは、癌の進行とともに体重が減っていくことへの患者さんの嘆きは確かに存在するとの声が聞こえてくるが・・・
・Abst. #9501 骨転移を有する患者さんに対するゾレドロン酸4週間隔投与法と12週間隔投与法を比較する第III相試験
12週間隔でも4週間隔と遜色ない抗っかが得られ、非劣性が証明された。
肺癌の領域では、ゾレドロン酸12週間隔投与法とdenosumabの比較試験が必要。
→http://oitahaiganpractice.junglekouen.com/e647677.html
・Abst. #LBA4 1-3個の脳転移を有する患者さんに対する、定位脳照射単独と全脳照射/定位脳照射併用の比較第III相試験
併用療法の方が治療後の認知機能が有意に低下する(短期記憶障害と構語障害が主な有害事象)。
併用療法の方が局所制御率が良好(3ヶ月以内の中枢神経再燃:6.3% vs 24.7%, 6ヶ月以内の中枢神経再燃は11.6% vs 35.4%)
全生存期間は有意差なし(定位脳照射単独で10.4ヶ月、併用療法で7.4ヶ月)
今回はここまで。
・Abst. #5001 未治療の高リスク局所進行、もしくは進行前立腺癌に対する治療を検討するSTAMPEDE試験
ドセタキセルによる化学療法は、初期治療の段階でホルモン療法と同時に開始した方が生命予後を改善する。
昨年のASCOまでは、初回治療はホルモン療法で行うべきで、化学療法は行うべきではないとされていた。
治療を提供する医師が腫瘍内科医か泌尿器科医かによって、化学療法や放射線療法が行われる比率が異なる(Cancer Manag Res 2011; 3: 233-245)
・Abst. #4501 尿路上皮癌に対する抗PD-L1抗体:Atezolizumabの臨床効果
既に標準治療が行われた尿路上皮癌の患者さんを対象にした第I相試験。
94%は白金製剤併用化学療法を、72%は2レジメン以上の化学療法を施行済み。
腫瘍組織を用いて、免疫担当細胞のPD-L1発現状態を確認の上、Atezolizumabの治療を開始。
尿路上皮癌の腫瘍細胞はほとんどPD-L1を発現していないので、今回は調べなかった。
免疫担当細胞の5%以上がPD-L1を発現する群では奏効割合50%、完全奏効割合20%を達成。
PD-L1低発現群でも17%の奏効割合。
全生存期間は高発現群では1年を超える見通しで、低発現群では8ヶ月。
現在、パクリタキセル、ドセタキセル、ビンフルニンのどれかひとつから選択する群を対照群として、第III相試験が進行中。
・Abst. #4506 既治療進行腎細胞癌に対するLenvatinibとEverolimusに関連したランダム化第II相試験
これまで、2nd lineでの進行腎細胞癌の治療成績は、生存期間中央値で15ヶ月程度だった。
LenvatinibはVEGF-R1/2/3とFGFR 1/2/3/4の阻害作用を有するmultitarget tyrosine kinase inhibitorである。
既に1レジメンのVEGF標的治療を受けた患者さんを対象に、Lenvatinib+Everolimus併用療法、Lenvatinib単剤療法、Everolimus単剤療法の3群に分けて治療。
併用療法群の無増悪生存期間中央値は14.6ヶ月、生存期間中央値は25.5ヶ月で、過去の成績を大きく上回る。
今後、Nivolumabとの比較(無増悪生存期間中央値4.2ヶ月、生存期間中央値25ヶ月)に話題が移りそう。
Nivolumabの方が毒性が軽い。
・Abst. #9500 癌に関連した悪液質に対するAnamorelinの効果を検証する第III相試験
悪液質(カヘキシア)は成人における体重減少、食思不振、炎症、インシュリン抵抗性、筋崩壊の促進を伴う。
「6ヶ月以内に5%以上の体重減少を示す、もしくは、サルコペニアやもともとBMI<20の人では2%以上の体重減少を示す場合」、がん関連食思不振・悪液質症候群と定義される。
サルコペニア単独では、筋量は減るが、相対的に死亡が増えるため、体重はあまり減らない。
悪液質はがん患者さんの40%に出現し、がん死の原因の20%を占める。
非小細胞肺癌患者さんを対象に、食欲亢進蛋白であるグレリンのアゴニスト、Anamorelinの効果を検証する第III相試験が行われた。
体重は増えたが、筋力や全生存期間の改善は認めなかった。
体重が増えることは、患者さんの利益になり得るのか。
現場からは、癌の進行とともに体重が減っていくことへの患者さんの嘆きは確かに存在するとの声が聞こえてくるが・・・
・Abst. #9501 骨転移を有する患者さんに対するゾレドロン酸4週間隔投与法と12週間隔投与法を比較する第III相試験
12週間隔でも4週間隔と遜色ない抗っかが得られ、非劣性が証明された。
肺癌の領域では、ゾレドロン酸12週間隔投与法とdenosumabの比較試験が必要。
→http://oitahaiganpractice.junglekouen.com/e647677.html
・Abst. #LBA4 1-3個の脳転移を有する患者さんに対する、定位脳照射単独と全脳照射/定位脳照射併用の比較第III相試験
併用療法の方が治療後の認知機能が有意に低下する(短期記憶障害と構語障害が主な有害事象)。
併用療法の方が局所制御率が良好(3ヶ月以内の中枢神経再燃:6.3% vs 24.7%, 6ヶ月以内の中枢神経再燃は11.6% vs 35.4%)
全生存期間は有意差なし(定位脳照射単独で10.4ヶ月、併用療法で7.4ヶ月)
今回はここまで。
2015年07月07日
G-CSFの使い方
分子標的療法花盛りで、このブログで取り上げる話題も、殺細胞性抗腫瘍薬よりも分子標的薬、抗体医薬、免疫チェックポイント阻害薬といった話題の方が多くなってきています。
そのため、殺細胞性抗腫瘍薬の代表的や有害事象である発熱性好中球減少に関する話題に触れることは、あまりありませんでした。
今回、Best of ASCO 2015のランチョンセミナーで兵庫県立がんセンター腫瘍内科の松本光史先生が持続型G-CSF製剤のジーラスタに関連した話題でお話されていたので、ちょっと復習します。
まずは、発熱性好中球減少症に対するG-CSFの使い方に関して、日本癌治療学会のガイドラインから要点を抜粋します。
http://jsco-cpg.jp/guideline/30.html
<発熱性好中球減少症の定義>

学会によって、少しずつ発熱性好中球減少症の定義は異なるようです。
従来からよく言われるのは、「38℃以上の発熱があり、好中球数が500未満になったとき」というところだと思います。
<G-CSFを使用するにあたっての基本的考え方>

この時点で、肺癌領域でのG-CSF使用の機会は、ほとんどないことが読み取れます。
一般に、局所進行期における放射線化学療法、完全切除後の術後補助化学療法を除き、肺癌の化学療法を治癒の目的で行うことはありません。
のちに示すように、放射線治療とG-CSFの同時併用はできませんし、術後補助化学療法でG-CSFを併用してまで治療に固執することもありません(術後補助化学療法をしなくても治癒している可能性がある患者さんですから)。
さらに、G-CSFを使用することが前提となっている治療は、小細胞癌における一部の治療レジメンくらいです。
したがって、G-CSFを肺癌患者さんに使用することはほぼ考えなくてよい、以上・・・という考え方も成り立つかもしれません。
<一次予防としてのG-CSFの適正使用>

発熱性好中球減少を起こす頻度が20%を超える治療レジメンでは、一次予防としてG-CSFを使用してよい、と書いています。
そんなレジメンは、肺癌領域ではガイドラインに記されていません。
該当するとすれば、2番目の項目に関連して、発熱性好中球減少を発症しやすい患者( 65歳以上の高齢者など)では使用してよい、という項目でしょうか。
<高齢者とG-CSF>

肺癌をはじめとした固形がんを有する65歳以上の患者さんでは、G-CSFの使用はあまり勧めない、という感じです。
<放射線治療とG-CSF>

G-CSFを使って細胞分裂が盛んになると、その分だけ放射線感受性も増し、好中球が生まれた端から放射線治療によって死滅していきます。
そのため、G-CSFを使用する際は放射線治療を休止します。
<治療的使用とG-CSF>

発熱性好中球減少を来していたとしても、その治療目的でのG-CSF投与は、やってもいいよ、という程度の推奨です。
こうやって書いてくると、なんだかG-CSFを使う気をなくします。
少なくとも、自分の実地臨床で、一次予防や二次予防でG-CSFを使用することはほぼありません。
発熱性好中球減少を患者さんが発症したときに、一時的に使用するくらいです。
そして、次コースでは治療量を減らして、できるだけ発熱性好中球減少を起こさないように努めます。
G-CSFを使うときは、使うタイミングも重要なようです。
投与タイミングが早すぎると、かえって好中球減少を助長してしまうようです。
次に示すのは、今回の講演で取り上げられた持続型G-CSFを治療当日に使用するか、治療24時間以降に使用するかで好中球減少の程度を見たものです。
乳がんや非ホジキンリンパ腫の患者さんでは、明らかに好中球減少の度合いが増しています。
細かい機序は分かりませんが、G-CSFは抗がん薬治療後24時間以上たってからが妥当なようです。
Burris et al., J Oncol Pract, 133-140, 2010

一方、投与のタイミングが遅くなるほど、発熱性好中球減少の状態が遷延することも報告されています。
Koumakis et al., Oncology 28-35, 1999
したがって、G-CSFは抗がん薬治療後24時間後-72時間後の間に使用するのが適切なようです。
また、G-CSF使用後の急性骨髄性白血病や骨髄異形成症候群のレビューも報告されています。
Lyman et al., J Clin Oncol 2914-2924, 2010
これによると、G-CSF使用時の急性骨髄性白血病や骨髄異形成症候群の合併は全体の0.41%で見られたそうです。
一方、G-CSFを併用した方がフォローアップ期間中の死亡リスクは軽減したようです。
ここまでの内容だったら、あまりG-CSFは使わなくてもいいかな、なんて気がします。
そもそもあまり使う必要に迫られることはないし、それほど大きな効果も期待できないし、少ないとはいえ血液悪性腫瘍を合併するリスクがあるし、と考えていました。
しかし、乳がん患者さんを対象にしたPegfilgrastimの効果を目の当たりにして、ちょっと気持ちが揺れ動きました。
以下にパンフレットから抜粋したデータを示します。
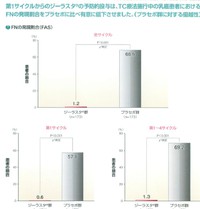

圧倒的にPegfilgrastim(ジーラスタ)を用いた方が有利です。
ジーラスタを使用した際のFN発現割合、入院の発生割合、抗生物質使用割合は全て有意差を以てプラセボ群に勝っています。
TC療法の毒性はこんなにもきついのか、という点も目を引きますが、これだけ圧倒的な差がついてしまっているのなら、他の固形がんでもジーラスタを使った方がいいのでは、という気になります。
化学療法1コース当たり1回投与ということで、ジーラスタ1キットは106,660円ですから、毎コースこの費用が別途掛かってきます。
講演会でのコメントは、ガイドラインにあまり縛られずに、G-CSFの適応を個別に判断しましょう、ということでした。
少なくとも、発熱性好中球減少の頻度や危険性を示したうえで、ジーラスタを使うかどうか、患者さんと話し合ってあらかじめ決めておいた方がいいでしょうね。
そのため、殺細胞性抗腫瘍薬の代表的や有害事象である発熱性好中球減少に関する話題に触れることは、あまりありませんでした。
今回、Best of ASCO 2015のランチョンセミナーで兵庫県立がんセンター腫瘍内科の松本光史先生が持続型G-CSF製剤のジーラスタに関連した話題でお話されていたので、ちょっと復習します。
まずは、発熱性好中球減少症に対するG-CSFの使い方に関して、日本癌治療学会のガイドラインから要点を抜粋します。
http://jsco-cpg.jp/guideline/30.html
<発熱性好中球減少症の定義>

学会によって、少しずつ発熱性好中球減少症の定義は異なるようです。
従来からよく言われるのは、「38℃以上の発熱があり、好中球数が500未満になったとき」というところだと思います。
<G-CSFを使用するにあたっての基本的考え方>

この時点で、肺癌領域でのG-CSF使用の機会は、ほとんどないことが読み取れます。
一般に、局所進行期における放射線化学療法、完全切除後の術後補助化学療法を除き、肺癌の化学療法を治癒の目的で行うことはありません。
のちに示すように、放射線治療とG-CSFの同時併用はできませんし、術後補助化学療法でG-CSFを併用してまで治療に固執することもありません(術後補助化学療法をしなくても治癒している可能性がある患者さんですから)。
さらに、G-CSFを使用することが前提となっている治療は、小細胞癌における一部の治療レジメンくらいです。
したがって、G-CSFを肺癌患者さんに使用することはほぼ考えなくてよい、以上・・・という考え方も成り立つかもしれません。
<一次予防としてのG-CSFの適正使用>

発熱性好中球減少を起こす頻度が20%を超える治療レジメンでは、一次予防としてG-CSFを使用してよい、と書いています。
そんなレジメンは、肺癌領域ではガイドラインに記されていません。
該当するとすれば、2番目の項目に関連して、発熱性好中球減少を発症しやすい患者( 65歳以上の高齢者など)では使用してよい、という項目でしょうか。
<高齢者とG-CSF>

肺癌をはじめとした固形がんを有する65歳以上の患者さんでは、G-CSFの使用はあまり勧めない、という感じです。
<放射線治療とG-CSF>

G-CSFを使って細胞分裂が盛んになると、その分だけ放射線感受性も増し、好中球が生まれた端から放射線治療によって死滅していきます。
そのため、G-CSFを使用する際は放射線治療を休止します。
<治療的使用とG-CSF>

発熱性好中球減少を来していたとしても、その治療目的でのG-CSF投与は、やってもいいよ、という程度の推奨です。
こうやって書いてくると、なんだかG-CSFを使う気をなくします。
少なくとも、自分の実地臨床で、一次予防や二次予防でG-CSFを使用することはほぼありません。
発熱性好中球減少を患者さんが発症したときに、一時的に使用するくらいです。
そして、次コースでは治療量を減らして、できるだけ発熱性好中球減少を起こさないように努めます。
G-CSFを使うときは、使うタイミングも重要なようです。
投与タイミングが早すぎると、かえって好中球減少を助長してしまうようです。
次に示すのは、今回の講演で取り上げられた持続型G-CSFを治療当日に使用するか、治療24時間以降に使用するかで好中球減少の程度を見たものです。
乳がんや非ホジキンリンパ腫の患者さんでは、明らかに好中球減少の度合いが増しています。
細かい機序は分かりませんが、G-CSFは抗がん薬治療後24時間以上たってからが妥当なようです。
Burris et al., J Oncol Pract, 133-140, 2010

一方、投与のタイミングが遅くなるほど、発熱性好中球減少の状態が遷延することも報告されています。
Koumakis et al., Oncology 28-35, 1999
したがって、G-CSFは抗がん薬治療後24時間後-72時間後の間に使用するのが適切なようです。
また、G-CSF使用後の急性骨髄性白血病や骨髄異形成症候群のレビューも報告されています。
Lyman et al., J Clin Oncol 2914-2924, 2010
これによると、G-CSF使用時の急性骨髄性白血病や骨髄異形成症候群の合併は全体の0.41%で見られたそうです。
一方、G-CSFを併用した方がフォローアップ期間中の死亡リスクは軽減したようです。
ここまでの内容だったら、あまりG-CSFは使わなくてもいいかな、なんて気がします。
そもそもあまり使う必要に迫られることはないし、それほど大きな効果も期待できないし、少ないとはいえ血液悪性腫瘍を合併するリスクがあるし、と考えていました。
しかし、乳がん患者さんを対象にしたPegfilgrastimの効果を目の当たりにして、ちょっと気持ちが揺れ動きました。
以下にパンフレットから抜粋したデータを示します。


圧倒的にPegfilgrastim(ジーラスタ)を用いた方が有利です。
ジーラスタを使用した際のFN発現割合、入院の発生割合、抗生物質使用割合は全て有意差を以てプラセボ群に勝っています。
TC療法の毒性はこんなにもきついのか、という点も目を引きますが、これだけ圧倒的な差がついてしまっているのなら、他の固形がんでもジーラスタを使った方がいいのでは、という気になります。
化学療法1コース当たり1回投与ということで、ジーラスタ1キットは106,660円ですから、毎コースこの費用が別途掛かってきます。
講演会でのコメントは、ガイドラインにあまり縛られずに、G-CSFの適応を個別に判断しましょう、ということでした。
少なくとも、発熱性好中球減少の頻度や危険性を示したうえで、ジーラスタを使うかどうか、患者さんと話し合ってあらかじめ決めておいた方がいいでしょうね。
2015年07月01日
Boehringer Ingelheim Lung Cancer Conference 2015(その4)
標記の内容としては、最後の備忘録です。
<非扁平上皮癌(EGFR遺伝子変異陰性、ALK遺伝子転座陰性)に対する治療戦略>
国立がん研究センター中央病院呼吸器内科 後藤 悌先生
・化学療法、小分子化合物、免疫チェックポイント阻害薬の他に、抗VEGF療法がある。
・従来非小細胞肺癌領域ではBevacizumabが使用されてきたが、抗VEGF-R2抗体としてramcirumabが開発された。
・ramcirumabについては、ASCO2014で有効性が報告されている(REVEL study)。
・非小細胞肺癌(腺癌、扁平上皮癌いずれも含む)の二次治療において、標準治療であるdocetaxel単剤療法と比較して、docetaxel+ramcirumab療法が有意に全生存期間、無増悪生存期間を延長し、奏効割合も有意に高かった。
→http://oitahaiganpractice.junglekouen.com/e738312.html
・ASCO2015において、REVEL studyにおける非扁平上皮癌のサブセット解析が報告された(abst. #8055)
・全体の73%(n=912)を占めた非扁平上皮癌のうち、腺癌は79%(n=725)だった。
・生存に関する結果は下表のとおりで、全体の結果とあまり変わりはなかった。

・REVEL studyでは、docetaxelの日本国内承認用量を超える75mg/㎡が使用されたため、60mg/㎡の承認用量での国内ランダム化第II相試験が行われ、ASCO2015で都立駒込病院の細見幸生先生が発表した。
・生存に関する結果は以下の通りで、REVEL studyと遜色ない結果だった。
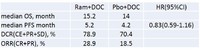
・がん抗原研究についての文献紹介 - Schumacher / Rizvi, Science 2015
・アブスコパル効果(放射線治療を行った際に、照射野外に腫瘍縮小効果が認められること→腫瘍免疫を考える上で興味深い現象)
→Golden et al, Lancet Oncol 2015
<パネルディスカッション>
・69歳男性、腺癌、IV期、副腎転移あり、EGFR遺伝子変異陰性、ALK再構成陰性。
一次治療:シスプラチン+ペメトレキセド→ペメトレキセド維持療法→病勢進行で治療終了。
喫煙歴は1日20本×20年間。
腫瘍およびその周囲のPD-L1発現状態は未知。
さて、以下のどの治療がよいか、会場全体でアンケート・・・。
1) Nivolumab:44%
2) docetaxel+ramcirumab :13%
3) docetaxel単剤:23%
4) nab-paclitaxel単剤:3%
5) Erlotinib:2%
6) Carboplatin+Paclitaxel+Bevacizumab:13%
7) その他:2%
・非扁平上皮癌、IV期、EGFR遺伝子変異陰性、ALK再構成陰性の患者さんに二次治療を開始する予定。
Nivolumabを使おうと考える際の根拠は・・・?会場全体でアンケート。
1) 特になし(全ての患者さんで使う):33%
2) 75歳以下、もしくはPS良好ならOK:10%
3) 喫煙者:4%
4) PD-L1陽性(強度は問わない):32%
5) PD-L1強陽性:19%
6) その他:2%
<今後期待される治療法>
・ROS1陽性肺癌に対するCrizotinibなどの分子標的薬
・RET陽性肺癌に対するCabozantinib、Vandetanibなど
・BRAF陽性肺癌に対するDabrafenib+Trametinib
・KRAS陽性肺癌に対する治療Selumetinib+docetaxel: Lancet Oncol 2013
・VEGFを標的とした治療
・免疫チェックポイント阻害薬
→効果が高い腫瘍の条件は・・・
免疫原性の高い抗原を有する腫瘍
腫瘍の生存が免疫チェックポイント経路に依存している(Immuno-checkpoint pathway addiction)
T細胞が活動しており、その活動性が可逆的である
・ミスマッチ修復遺伝子との関連:pembrolizumabの効果予測にミスマッチ修復遺伝子の有無が有効という論文がありますが、これはまた改めて。
やっと終わった。
あー疲れた。
・・・今週末はBest of ASCO Japan 2015があるから、またこの調子かな・・・。
<非扁平上皮癌(EGFR遺伝子変異陰性、ALK遺伝子転座陰性)に対する治療戦略>
国立がん研究センター中央病院呼吸器内科 後藤 悌先生
・化学療法、小分子化合物、免疫チェックポイント阻害薬の他に、抗VEGF療法がある。
・従来非小細胞肺癌領域ではBevacizumabが使用されてきたが、抗VEGF-R2抗体としてramcirumabが開発された。
・ramcirumabについては、ASCO2014で有効性が報告されている(REVEL study)。
・非小細胞肺癌(腺癌、扁平上皮癌いずれも含む)の二次治療において、標準治療であるdocetaxel単剤療法と比較して、docetaxel+ramcirumab療法が有意に全生存期間、無増悪生存期間を延長し、奏効割合も有意に高かった。
→http://oitahaiganpractice.junglekouen.com/e738312.html
・ASCO2015において、REVEL studyにおける非扁平上皮癌のサブセット解析が報告された(abst. #8055)
・全体の73%(n=912)を占めた非扁平上皮癌のうち、腺癌は79%(n=725)だった。
・生存に関する結果は下表のとおりで、全体の結果とあまり変わりはなかった。

・REVEL studyでは、docetaxelの日本国内承認用量を超える75mg/㎡が使用されたため、60mg/㎡の承認用量での国内ランダム化第II相試験が行われ、ASCO2015で都立駒込病院の細見幸生先生が発表した。
・生存に関する結果は以下の通りで、REVEL studyと遜色ない結果だった。

・がん抗原研究についての文献紹介 - Schumacher / Rizvi, Science 2015
・アブスコパル効果(放射線治療を行った際に、照射野外に腫瘍縮小効果が認められること→腫瘍免疫を考える上で興味深い現象)
→Golden et al, Lancet Oncol 2015
<パネルディスカッション>
・69歳男性、腺癌、IV期、副腎転移あり、EGFR遺伝子変異陰性、ALK再構成陰性。
一次治療:シスプラチン+ペメトレキセド→ペメトレキセド維持療法→病勢進行で治療終了。
喫煙歴は1日20本×20年間。
腫瘍およびその周囲のPD-L1発現状態は未知。
さて、以下のどの治療がよいか、会場全体でアンケート・・・。
1) Nivolumab:44%
2) docetaxel+ramcirumab :13%
3) docetaxel単剤:23%
4) nab-paclitaxel単剤:3%
5) Erlotinib:2%
6) Carboplatin+Paclitaxel+Bevacizumab:13%
7) その他:2%
・非扁平上皮癌、IV期、EGFR遺伝子変異陰性、ALK再構成陰性の患者さんに二次治療を開始する予定。
Nivolumabを使おうと考える際の根拠は・・・?会場全体でアンケート。
1) 特になし(全ての患者さんで使う):33%
2) 75歳以下、もしくはPS良好ならOK:10%
3) 喫煙者:4%
4) PD-L1陽性(強度は問わない):32%
5) PD-L1強陽性:19%
6) その他:2%
<今後期待される治療法>
・ROS1陽性肺癌に対するCrizotinibなどの分子標的薬
・RET陽性肺癌に対するCabozantinib、Vandetanibなど
・BRAF陽性肺癌に対するDabrafenib+Trametinib
・KRAS陽性肺癌に対する治療Selumetinib+docetaxel: Lancet Oncol 2013
・VEGFを標的とした治療
・免疫チェックポイント阻害薬
→効果が高い腫瘍の条件は・・・
免疫原性の高い抗原を有する腫瘍
腫瘍の生存が免疫チェックポイント経路に依存している(Immuno-checkpoint pathway addiction)
T細胞が活動しており、その活動性が可逆的である
・ミスマッチ修復遺伝子との関連:pembrolizumabの効果予測にミスマッチ修復遺伝子の有無が有効という論文がありますが、これはまた改めて。
やっと終わった。
あー疲れた。
・・・今週末はBest of ASCO Japan 2015があるから、またこの調子かな・・・。



