2020年01月29日
肺がん周術期の薬物療法
2019年日本臨床腫瘍学会、備忘録。
・EVAN試験:N1-N2の患者が対象で、N2は全体の64%
・ADJUVANT(CTONG1103試験) Lancet oncol. 2018, 139-148
・LACEのメタアナリシス J Clin Oncol 3552-, 2008
ハザード比は0.89にとどまる
・ECOG1505:ASCO2015
術後化学療法にベバシズマブを上乗せしたが、negative studyに終わった
・SELECT試験:Pennell et al., J Clin Oncol 2019, https://www.ncbi.nlm.nih.gov/pubmed/30444685
stage IA-IIIAのEGFR遺伝子変異陽性非小細胞肺がん患者を対象に、根治切除をして、術後補助化学療法をして、さらにエルロチニブを登用する臨床試験。
単アームの第II相試験
2年無病生存割合は88%
5年無病生存割合は56%
5年全生存割合は86%
・RADIANT試験:Kelly et al., J Clin Oncol 2015
EGFR遺伝子変異陽性の患者が対象。
無病生存期間は、エルロチニブ群で46.4ヶ月、プラセボ群で28.5ヶ月、ハザード比0.61(95%信頼区間0.38-0.98)
66か月後の段階でも生存期間中央値には到達しておらず、5年生存割合は50%以上
IALT試験でも、5年生存割合は50%程度だった
・CTONG1103試験
EGFR遺伝子変異陽性、N1-N2、遠隔転移なしの患者が対象で、術後補助治療としてのゲフィチニブ群(G群)とシスプラチン+ビノレルビン併用化学療法(PV群)を比較する第III相試験。
無病生存期間中央値はG群で28.7ヶ月、PV群で18.0ヶ月、ハザード比0.60、p=0.005だった。
3年無病生存割合はG群27%、PV群で34%だった。
全生存期間中央値は両群ともに未到達。
・EVAN試験:https://www.ncbi.nlm.nih.gov/pubmed/30150014
stage IIIのEGFR遺伝子変異陽性非小細胞肺がん患者を対象に、術後補助化学療法としてのシスプラチン+ビノレルビン併用療法とエルロチニブ単剤療法を比較する
・ADAURA試験
IB-IIIA期のEGFR遺伝子変異陽性非小細胞肺がん患者根治切除例に対して、術後そのまま補助化学療法をせずにオシメルチニブを投与する群と、術後シスプラチン+ビノレルビン併用療法群を比較することになり、主要評価項目は無病生存期間だった。
・EMERGING試験: Wu et al.,J Clin Oncol 2019
N2の遺伝子変異陽性の患者を対象に、術前術後にエルロチニブを服用する群(E群)とシスプラチン+ビノレルビン併用療法群(PV群)が設定された第II相試験。
無病生存期間中央値はE群21.5ヶ月、PV群で11.9ヶ月、ハザード比0.42、p=0.003。
術前治療時の奏効割合はE群54.1%、PV群34.3%。
全生存期間は未到達。
・EVAN試験:N1-N2の患者が対象で、N2は全体の64%
・ADJUVANT(CTONG1103試験) Lancet oncol. 2018, 139-148
・LACEのメタアナリシス J Clin Oncol 3552-, 2008
ハザード比は0.89にとどまる
・ECOG1505:ASCO2015
術後化学療法にベバシズマブを上乗せしたが、negative studyに終わった
・SELECT試験:Pennell et al., J Clin Oncol 2019, https://www.ncbi.nlm.nih.gov/pubmed/30444685
stage IA-IIIAのEGFR遺伝子変異陽性非小細胞肺がん患者を対象に、根治切除をして、術後補助化学療法をして、さらにエルロチニブを登用する臨床試験。
単アームの第II相試験
2年無病生存割合は88%
5年無病生存割合は56%
5年全生存割合は86%
・RADIANT試験:Kelly et al., J Clin Oncol 2015
EGFR遺伝子変異陽性の患者が対象。
無病生存期間は、エルロチニブ群で46.4ヶ月、プラセボ群で28.5ヶ月、ハザード比0.61(95%信頼区間0.38-0.98)
66か月後の段階でも生存期間中央値には到達しておらず、5年生存割合は50%以上
IALT試験でも、5年生存割合は50%程度だった
・CTONG1103試験
EGFR遺伝子変異陽性、N1-N2、遠隔転移なしの患者が対象で、術後補助治療としてのゲフィチニブ群(G群)とシスプラチン+ビノレルビン併用化学療法(PV群)を比較する第III相試験。
無病生存期間中央値はG群で28.7ヶ月、PV群で18.0ヶ月、ハザード比0.60、p=0.005だった。
3年無病生存割合はG群27%、PV群で34%だった。
全生存期間中央値は両群ともに未到達。
・EVAN試験:https://www.ncbi.nlm.nih.gov/pubmed/30150014
stage IIIのEGFR遺伝子変異陽性非小細胞肺がん患者を対象に、術後補助化学療法としてのシスプラチン+ビノレルビン併用療法とエルロチニブ単剤療法を比較する
・ADAURA試験
IB-IIIA期のEGFR遺伝子変異陽性非小細胞肺がん患者根治切除例に対して、術後そのまま補助化学療法をせずにオシメルチニブを投与する群と、術後シスプラチン+ビノレルビン併用療法群を比較することになり、主要評価項目は無病生存期間だった。
・EMERGING試験: Wu et al.,J Clin Oncol 2019
N2の遺伝子変異陽性の患者を対象に、術前術後にエルロチニブを服用する群(E群)とシスプラチン+ビノレルビン併用療法群(PV群)が設定された第II相試験。
無病生存期間中央値はE群21.5ヶ月、PV群で11.9ヶ月、ハザード比0.42、p=0.003。
術前治療時の奏効割合はE群54.1%、PV群34.3%。
全生存期間は未到達。
2020年01月29日
免疫チェックポイント阻害薬への失望・・・治療標的なし、個別化医療でもなし
これも2019年の日本臨床腫瘍学会総会から。
ユニークな視点の発表だ。
そして、ところどころ頷ける。
・ASCO2019、Abst.#9013
KEYNOTE-189試験におけるPFS2(無作為割付から二次治療後の病勢進行までの期間)は、PD-L1発現の多寡によらず、すべての患者においてペンブロリズマブ群がよかった。
対照群の33.5%では、二次治療ができずに患者が亡くなった。
PFS2の中央値は、ペンブロリズマブ群で17.0ヶ月、対照群で9.0ヶ月、ハザード比0.49(95%信頼区間は0.40-0.59)
・いつまで治療を続けるのか:CheckMate-153試験:ESMO2017
ニボルマブを病勢進行まで続ける群と、ニボルマブを1年間続けて中断、病勢進行を確認してから再開する群を比較
無増悪生存期間のハザード比0.42(95%信頼区間は0.33-0.71)
全生存期間のハザード比0.63(95%信頼区間0.33-1.20)
継続すると、無増悪生存期間は延長することがわかった
・免疫チェックポイント阻害薬使用後の長期生存例
診断時、胸水と脳転移を合併していた患者。
2014年1月から、ニボルマブを使用→2017年7月に脳転移、肝転移の悪化で病勢進行→ニボルマブ+イピリムマブ併用療法→2018年6月に部分奏効状態へ→その後治療中断したが、無増悪生存中
・IMpower133試験
QoL, OS>PFS
PETやTumor mutational burden(TMB)は治療効果判定の基準として万能ではない
ユニークな視点の発表だ。
そして、ところどころ頷ける。
・ASCO2019、Abst.#9013
KEYNOTE-189試験におけるPFS2(無作為割付から二次治療後の病勢進行までの期間)は、PD-L1発現の多寡によらず、すべての患者においてペンブロリズマブ群がよかった。
対照群の33.5%では、二次治療ができずに患者が亡くなった。
PFS2の中央値は、ペンブロリズマブ群で17.0ヶ月、対照群で9.0ヶ月、ハザード比0.49(95%信頼区間は0.40-0.59)
・いつまで治療を続けるのか:CheckMate-153試験:ESMO2017
ニボルマブを病勢進行まで続ける群と、ニボルマブを1年間続けて中断、病勢進行を確認してから再開する群を比較
無増悪生存期間のハザード比0.42(95%信頼区間は0.33-0.71)
全生存期間のハザード比0.63(95%信頼区間0.33-1.20)
継続すると、無増悪生存期間は延長することがわかった
・免疫チェックポイント阻害薬使用後の長期生存例
診断時、胸水と脳転移を合併していた患者。
2014年1月から、ニボルマブを使用→2017年7月に脳転移、肝転移の悪化で病勢進行→ニボルマブ+イピリムマブ併用療法→2018年6月に部分奏効状態へ→その後治療中断したが、無増悪生存中
・IMpower133試験
QoL, OS>PFS
PETやTumor mutational burden(TMB)は治療効果判定の基準として万能ではない
2020年01月29日
免疫チェックポイント阻害薬時代の肺がん長期生存
2019年の日本臨床腫瘍学会の備忘録。 まとめ切れていなかったノートを発掘した。
箇条書きで。
・ECOG1594試験:Schiller et al., N Engl J Med 2002
プラチナ製剤+(1990年代の)新規抗がん薬併用化学療法の意義づけとなった、記念碑的な臨床試験
1200人程度が参加
主要な研究機関で、PS 0-1の患者を対象として行われた臨床試験だったにもかかわらず、生存期間中央値は8か月間そこそこだった
・実地臨床における肺がんの生存期間中央値:ACS Cancer Facts and Figures 2019
1975年-1988年:10-12ヶ月
2008年-2014年:20ヶ月
・どんな治療法なら肺がんは治るのか
→やっぱり手術でしょう
肺がんCT検診による早期肺癌発見・治療の臨床試験:NELSON trial
標準検診群で発見された肺がんの病期別割合:IA期は10%、IV期は50%
CT検診群で発見された肺がんの病期別割合:IA期は50%、IV期は10%
・PACIFIC試験
対象患者全体では・・・
デュルバルマブ群:生存期間中央値未到達、12ヶ月生存割合83%、24ヶ月生存割合66.3%、36ヶ月生存割合57.0%
標準治療群:生存期間中央値28.7ヶ月、12ヶ月生存割合75.3%、24ヶ月生存割合55.6%、36ヶ月生存割合43.5%
PD-L!≧1%の患者群では・・・
デュルバルマブ群:生存期間中央値未到達
標準治療群:生存期間中央値29.1ヶ月、ハザード比は0.53
PD-L1<1%の患者群では・・・
デュルバルマブ群:生存期間中央値未到達
標準治療群:生存期間中央値未到達、生存曲線は両群で交差する
→PD-L1陰性の患者には、デュルバルマブはお勧めできない
・J-ALEX試験の最新データ:ASCO2019
ALK融合遺伝子陽性の患者に対するアレクチニブ初回投与の有効性を検証、対照群はクリゾチニブ
ハザード比0.34(95%信頼区間は0.17-0.71)
・G12C KRAS遺伝子変異と分子標的治療
・ドライバー遺伝子変異陽性の肺がん患者には免疫チェックポイント阻害薬は無効、化学療法と併用しても無効
・IMpower150試験
EGFR遺伝子変異陽性の患者でも有効だった
無増悪生存期間中央値はABCP療法で10.2ヶ月、BCP療法で6.1ヶ月、ハザード比0.41
生存期間中央値はABCP療法で未到達、BCP療法で17.5ヶ月、ハザード比0.54(95%信頼区間は0.29-1.03)
肝転移陽性の患者群でも、ABCP群の方が治療経過良好だった
生存期間中央値はABCP群で13.3ヶ月、BCP群で9.4ヶ月、ハザード比0.52(95%信頼区間は0.33-0.82)
・KEYNOTE-189試験
肝転移があってもなくても治療効果あり
・KEYNOTE-001試験
TPS≧50%なら、5年生存割合は29.6%
TPS 1-49%なら、5年生存割合15.7%
・KEYNOTE-024試験の結果が更新された(Reck et al., J Clin Oncol 2019)
・KEYNOTE-042試験の結果が更新された(Mok et al., J Clin Oncol / Lancet 2019)
・KEYNOTE-010試験
3年生存割合はペンブロリズマブ群で35%、ドセタキセル群で13%
ペンブロリズマブ群において
48人は病勢進行を迎えることなく2年間のペンブロリズマブ投与期間を終えた
25人は病勢進行によりペンブロリズマブの投与を中止した
箇条書きで。
・ECOG1594試験:Schiller et al., N Engl J Med 2002
プラチナ製剤+(1990年代の)新規抗がん薬併用化学療法の意義づけとなった、記念碑的な臨床試験
1200人程度が参加
主要な研究機関で、PS 0-1の患者を対象として行われた臨床試験だったにもかかわらず、生存期間中央値は8か月間そこそこだった
・実地臨床における肺がんの生存期間中央値:ACS Cancer Facts and Figures 2019
1975年-1988年:10-12ヶ月
2008年-2014年:20ヶ月
・どんな治療法なら肺がんは治るのか
→やっぱり手術でしょう
肺がんCT検診による早期肺癌発見・治療の臨床試験:NELSON trial
標準検診群で発見された肺がんの病期別割合:IA期は10%、IV期は50%
CT検診群で発見された肺がんの病期別割合:IA期は50%、IV期は10%
・PACIFIC試験
対象患者全体では・・・
デュルバルマブ群:生存期間中央値未到達、12ヶ月生存割合83%、24ヶ月生存割合66.3%、36ヶ月生存割合57.0%
標準治療群:生存期間中央値28.7ヶ月、12ヶ月生存割合75.3%、24ヶ月生存割合55.6%、36ヶ月生存割合43.5%
PD-L!≧1%の患者群では・・・
デュルバルマブ群:生存期間中央値未到達
標準治療群:生存期間中央値29.1ヶ月、ハザード比は0.53
PD-L1<1%の患者群では・・・
デュルバルマブ群:生存期間中央値未到達
標準治療群:生存期間中央値未到達、生存曲線は両群で交差する
→PD-L1陰性の患者には、デュルバルマブはお勧めできない
・J-ALEX試験の最新データ:ASCO2019
ALK融合遺伝子陽性の患者に対するアレクチニブ初回投与の有効性を検証、対照群はクリゾチニブ
ハザード比0.34(95%信頼区間は0.17-0.71)
・G12C KRAS遺伝子変異と分子標的治療
・ドライバー遺伝子変異陽性の肺がん患者には免疫チェックポイント阻害薬は無効、化学療法と併用しても無効
・IMpower150試験
EGFR遺伝子変異陽性の患者でも有効だった
無増悪生存期間中央値はABCP療法で10.2ヶ月、BCP療法で6.1ヶ月、ハザード比0.41
生存期間中央値はABCP療法で未到達、BCP療法で17.5ヶ月、ハザード比0.54(95%信頼区間は0.29-1.03)
肝転移陽性の患者群でも、ABCP群の方が治療経過良好だった
生存期間中央値はABCP群で13.3ヶ月、BCP群で9.4ヶ月、ハザード比0.52(95%信頼区間は0.33-0.82)
・KEYNOTE-189試験
肝転移があってもなくても治療効果あり
・KEYNOTE-001試験
TPS≧50%なら、5年生存割合は29.6%
TPS 1-49%なら、5年生存割合15.7%
・KEYNOTE-024試験の結果が更新された(Reck et al., J Clin Oncol 2019)
・KEYNOTE-042試験の結果が更新された(Mok et al., J Clin Oncol / Lancet 2019)
・KEYNOTE-010試験
3年生存割合はペンブロリズマブ群で35%、ドセタキセル群で13%
ペンブロリズマブ群において
48人は病勢進行を迎えることなく2年間のペンブロリズマブ投与期間を終えた
25人は病勢進行によりペンブロリズマブの投与を中止した
2020年01月28日
肺がんと過剰診断
2020/01/27(月)の朝のNHKニュースだったか。
線虫を使って、15種類のがんを早期発見する技術の商業運用が始まるとのこと。
線虫が、尿に含まれるがん患者特有の物質をかぎ分けるらしい。
陽性なら、とりあえずどれかのがんである確率が85%程度ある、という説明だった。
尿一滴で検査ができるそうなので、
1)まず、がんにかかっているかどうかを本検査で調べる
2)陰性なら以上で終わり
3)陽性なら、15種類のうち、どのがんにかかっているのか、個別の検査を行う
という流れになるらしい。
画期的な検査だ、といえる。
がんの早期発見のきっかけをつかむ、患者にとっては身体的苦痛を伴わないありがたい検査。
これによって、がんの早期発見、早期治療につながるのではないかと、期待している人は多いだろう。
一方で、取り扱いが難しい検査だ、ともいえる。
陽性なら、85%程度の確率で、体のどこかにがんが隠れている。
では、どうやってそのがんをあぶりだすか。
15種類のがんをくまなく調べるために、様々な検査を受けることになる。
そして、結局なにも見つからなかったとき、真にがんがない、つまり、線虫検査の結果が偽陽性だったと、受け入れられるか。
あるいは、精密検査の精度の問題で、正しく診断ができなかっただけだとして、答えを求めて漂流し続けるか。
要は心の持ちようだと思うが、不安に駆り立てられやすい患者にとっては、線虫検査は陽性だったが、精密検査を受けて結局何も見つからなかったというのは、胸をかきむしられるようにつらい出来事なのではないだろうか。
そして、今回のNHKの報道でも、先だって博多で開催された肺がんCT検診講習会のときも、「過剰診断」の話題が取り上げられていた。
CT検診で微小な異常陰影を見つけて、それを手術して早期肺癌と診断できたとする。
手術したことで患者が長生きできたのか、手術しなくても長生きできたのか、それはわからない。
実際のところ、非常にゆっくりした経過をとる肺がんというのは、存在する。
それでも、早期肺がんを切除して非難されることは、ほとんどない。
誰もが、肺がんは予後不良の病気であり、治癒可能な治療があればするに越したことはないと考えるからだ。
一方、肺がんCT検診講習会で取り上げられていたのは、韓国における甲状腺がんの取り扱いだった。
エコー検査で甲状腺がんの検診を大規模に行い、甲状腺がんが疑われる患者はできる限り手術をしたとのこと。
こうした取り組みで、韓国では甲状腺がんの罹患数が20年間で15倍に急増し、世界的な批判を招いたそうだ。
「韓国に行って道行く人の首を見てみてください、手術痕のある方がいかに多いかに驚かれると思います」
と、どこまで本当でどこまで冗談かわからない話を演者の先生がされていた。
ただ、こうした甲状腺がんの早期発見、早期治療により甲状腺がん患者の生存率が向上したかというと、そうではないそうだ。
https://synodos.jp/fukushima_report/21930
検診による早期発見、早期治療の取り組みとして、韓国の甲状腺がんプロジェクトはうまくいかなかった例としてよく知られているらしく、この件を話題に挙げると韓国の先生方は苦い顔をされる、とのことだった。
しかし、ある医療介入が患者の利益につながらなかった、という事実をきちんと後世に伝えることは、とても勇気のいる、そして意義のあることだと、私は思う。
間違いなく、甲状腺がん領域における我々の実地臨床に大きなインパクトを与える報告だ。
隣国でこうした国家的な取り組みが成され、きちんと国際的に報告されていることを我々は称賛すべきだし、大いに学ぶべきだ。
肺がんCT検診による早期発見、早期手術も、ある種の早期腺がんにおいては同じようなことが言えるかもしれない。
また、甲状腺がんや肺がん以外の領域でも同じような話はあるはずで、それぞれ慎重に考えなければならない。
日々高齢者を診療していて、私が最も危惧するのは、前立腺がんの診療だ。
PSAにより早期発見ができるようになったのはいいことだが、住民健診におけるPSAのスクリーニング、もしかしたら甲状腺がんのエコー検査に通じるところがあるのではなかろうか。
こうした問題は腫瘍内科領域ではなく、個別の臓器別診療科で検討しておくべき事柄だろう。
線虫検査は、膵がんをはじめとして、個別の臓器別がんをかぎ分ける線虫を開発する方向に発展しつつあるそうだ。
肺がん患者なら肺がんの線虫が、大腸癌なら大腸がんの線虫が反応する、となれば、もう少し精密検査の範囲を絞り込むことができて、真に有用な検査となるだろう。
検診や早期診断、過剰診断の話題になったとき、私は、「がん」という疾患の定義を考えさせられる。
無治療で長期生存しうる病気を、いかに客観的診断根拠があるとはいえ、「がん」とか「悪性腫瘍」とかみだりに呼んでいいものか。
そして、そうした病気の早期診断や早期治療に大量のお金や医療資源を投入していいものなのか、考えてしまう。
線虫を使って、15種類のがんを早期発見する技術の商業運用が始まるとのこと。
線虫が、尿に含まれるがん患者特有の物質をかぎ分けるらしい。
陽性なら、とりあえずどれかのがんである確率が85%程度ある、という説明だった。
尿一滴で検査ができるそうなので、
1)まず、がんにかかっているかどうかを本検査で調べる
2)陰性なら以上で終わり
3)陽性なら、15種類のうち、どのがんにかかっているのか、個別の検査を行う
という流れになるらしい。
画期的な検査だ、といえる。
がんの早期発見のきっかけをつかむ、患者にとっては身体的苦痛を伴わないありがたい検査。
これによって、がんの早期発見、早期治療につながるのではないかと、期待している人は多いだろう。
一方で、取り扱いが難しい検査だ、ともいえる。
陽性なら、85%程度の確率で、体のどこかにがんが隠れている。
では、どうやってそのがんをあぶりだすか。
15種類のがんをくまなく調べるために、様々な検査を受けることになる。
そして、結局なにも見つからなかったとき、真にがんがない、つまり、線虫検査の結果が偽陽性だったと、受け入れられるか。
あるいは、精密検査の精度の問題で、正しく診断ができなかっただけだとして、答えを求めて漂流し続けるか。
要は心の持ちようだと思うが、不安に駆り立てられやすい患者にとっては、線虫検査は陽性だったが、精密検査を受けて結局何も見つからなかったというのは、胸をかきむしられるようにつらい出来事なのではないだろうか。
そして、今回のNHKの報道でも、先だって博多で開催された肺がんCT検診講習会のときも、「過剰診断」の話題が取り上げられていた。
CT検診で微小な異常陰影を見つけて、それを手術して早期肺癌と診断できたとする。
手術したことで患者が長生きできたのか、手術しなくても長生きできたのか、それはわからない。
実際のところ、非常にゆっくりした経過をとる肺がんというのは、存在する。
それでも、早期肺がんを切除して非難されることは、ほとんどない。
誰もが、肺がんは予後不良の病気であり、治癒可能な治療があればするに越したことはないと考えるからだ。
一方、肺がんCT検診講習会で取り上げられていたのは、韓国における甲状腺がんの取り扱いだった。
エコー検査で甲状腺がんの検診を大規模に行い、甲状腺がんが疑われる患者はできる限り手術をしたとのこと。
こうした取り組みで、韓国では甲状腺がんの罹患数が20年間で15倍に急増し、世界的な批判を招いたそうだ。
「韓国に行って道行く人の首を見てみてください、手術痕のある方がいかに多いかに驚かれると思います」
と、どこまで本当でどこまで冗談かわからない話を演者の先生がされていた。
ただ、こうした甲状腺がんの早期発見、早期治療により甲状腺がん患者の生存率が向上したかというと、そうではないそうだ。
https://synodos.jp/fukushima_report/21930
検診による早期発見、早期治療の取り組みとして、韓国の甲状腺がんプロジェクトはうまくいかなかった例としてよく知られているらしく、この件を話題に挙げると韓国の先生方は苦い顔をされる、とのことだった。
しかし、ある医療介入が患者の利益につながらなかった、という事実をきちんと後世に伝えることは、とても勇気のいる、そして意義のあることだと、私は思う。
間違いなく、甲状腺がん領域における我々の実地臨床に大きなインパクトを与える報告だ。
隣国でこうした国家的な取り組みが成され、きちんと国際的に報告されていることを我々は称賛すべきだし、大いに学ぶべきだ。
肺がんCT検診による早期発見、早期手術も、ある種の早期腺がんにおいては同じようなことが言えるかもしれない。
また、甲状腺がんや肺がん以外の領域でも同じような話はあるはずで、それぞれ慎重に考えなければならない。
日々高齢者を診療していて、私が最も危惧するのは、前立腺がんの診療だ。
PSAにより早期発見ができるようになったのはいいことだが、住民健診におけるPSAのスクリーニング、もしかしたら甲状腺がんのエコー検査に通じるところがあるのではなかろうか。
こうした問題は腫瘍内科領域ではなく、個別の臓器別診療科で検討しておくべき事柄だろう。
線虫検査は、膵がんをはじめとして、個別の臓器別がんをかぎ分ける線虫を開発する方向に発展しつつあるそうだ。
肺がん患者なら肺がんの線虫が、大腸癌なら大腸がんの線虫が反応する、となれば、もう少し精密検査の範囲を絞り込むことができて、真に有用な検査となるだろう。
検診や早期診断、過剰診断の話題になったとき、私は、「がん」という疾患の定義を考えさせられる。
無治療で長期生存しうる病気を、いかに客観的診断根拠があるとはいえ、「がん」とか「悪性腫瘍」とかみだりに呼んでいいものか。
そして、そうした病気の早期診断や早期治療に大量のお金や医療資源を投入していいものなのか、考えてしまう。
2020年01月26日
虫歯や歯周病と肺がん
虫歯や歯周病は、肺がんの治療と関係がある。
誰しも、日頃から口腔ケアをきちんとするに越したことはないけれど、肺がんと診断されたらいよいよ重要となる。
呼吸器外科では、この患者さんに手術をしよう、と決めたら、即日歯科口腔外科に相談をしている。
現代の肺がん診療における患者指導の一環として、口腔ケア指導は禁煙指導と同じくらいの意義があるのではないだろうか。
口腔ケアを適切に行うことの意義は、考えるに大きく2点。
1)感染症予防
手術前後の時期や、肺がん薬物療法をする時期の歯周病、口内炎、肺炎を予防する。
手術前後は、経過によっては安静臥床の期間が長くなり、それだけ肺炎を合併する確率が高くなる。
肺がん薬物療法中は免疫力が低下し、歯周病や口内炎のために食事摂取困難となることもあれば、肺炎を合併することもある。
口腔内、歯肉を清潔に保つことは、それ自体がこうした合併症の予防に役立つ。
2)骨転移治療
骨転移が明らかになった時、その進行や病的骨折を予防するために、ゾレドロン酸やデノスマブを併用する。
この種の治療は、何らかの理由でがん薬物療法ができなくなったときも継続できるし、生活の質を保つためには大切な治療である。
それぞれ、月に1回だけ使用する注射薬だが、虫歯や歯周病に対してきちんと歯科診療を終えていることが前提となる。
そうでないと、「顎骨壊死」といって、顎の骨が崩れていく合併症が発生することがある。
虫歯や歯周病のケアができていないことが、骨転移の治療をできなくするリスクにつながるというわけだ。
今の職場では、誤嚥性肺炎の患者さんの嚥下機能評価を行い、その患者さんにあった食事のあり方やリハビリを考える取り組みもしている。
ここでも口腔ケアの果たす役割は大きい。
嚥下障害がある患者さんは、ほぼ例外なく口腔内に問題を抱えている。
適切な歯科診療に患者さんをつないであげるだけで、嚥下機能が改善し、誤嚥のリスクを減らしつつよりおいしい食事が食べられるようになることをしょっちゅう経験する。
認知機能低下の一項目として、
「口腔ケアを適切にできないこと」
を加えてもいいのではないかと思うくらいだ。
肺がん領域のみならず、嚥下障害・誤嚥性肺炎診療の領域も診療するようになり、口腔ケアの重要性は身に染みた。
かつて、高校の同級生が勤めていた歯科へ治療に通ったが、結局多忙なためdrop outしてしまった。
今の職場に移り、3年前から自宅近くの歯科で治療を再開した。
当初は、
「虫歯が20本はあります」
「1本は神経を抜かないとどうにもなりませんね」
「親知らずも3本残っています」
「親知らずのうち1本は、歯肉の中に横向きに埋まっていて、当院では対処できません」
「他の歯の治療がすべて終わったら、歯科口腔外科に紹介しましょう」
と言われてゲッソリしたが、2年半くらいかけて、埋没した親知らずを除いて全ての治療を完了し、今も月に1回、メンテナンスに通っている。
あとは最後の1本の親知らず、暖かくなったら、職場でお世話になっている知人の先生に抜いてもらおうと考えている。
私の肺にも、異形腺腫様過形成か微小腺がんかを思わせる病巣がいくつかある。
歯科定期受診は、将来がんになったときのための先行投資。
誰しも、日頃から口腔ケアをきちんとするに越したことはないけれど、肺がんと診断されたらいよいよ重要となる。
呼吸器外科では、この患者さんに手術をしよう、と決めたら、即日歯科口腔外科に相談をしている。
現代の肺がん診療における患者指導の一環として、口腔ケア指導は禁煙指導と同じくらいの意義があるのではないだろうか。
口腔ケアを適切に行うことの意義は、考えるに大きく2点。
1)感染症予防
手術前後の時期や、肺がん薬物療法をする時期の歯周病、口内炎、肺炎を予防する。
手術前後は、経過によっては安静臥床の期間が長くなり、それだけ肺炎を合併する確率が高くなる。
肺がん薬物療法中は免疫力が低下し、歯周病や口内炎のために食事摂取困難となることもあれば、肺炎を合併することもある。
口腔内、歯肉を清潔に保つことは、それ自体がこうした合併症の予防に役立つ。
2)骨転移治療
骨転移が明らかになった時、その進行や病的骨折を予防するために、ゾレドロン酸やデノスマブを併用する。
この種の治療は、何らかの理由でがん薬物療法ができなくなったときも継続できるし、生活の質を保つためには大切な治療である。
それぞれ、月に1回だけ使用する注射薬だが、虫歯や歯周病に対してきちんと歯科診療を終えていることが前提となる。
そうでないと、「顎骨壊死」といって、顎の骨が崩れていく合併症が発生することがある。
虫歯や歯周病のケアができていないことが、骨転移の治療をできなくするリスクにつながるというわけだ。
今の職場では、誤嚥性肺炎の患者さんの嚥下機能評価を行い、その患者さんにあった食事のあり方やリハビリを考える取り組みもしている。
ここでも口腔ケアの果たす役割は大きい。
嚥下障害がある患者さんは、ほぼ例外なく口腔内に問題を抱えている。
適切な歯科診療に患者さんをつないであげるだけで、嚥下機能が改善し、誤嚥のリスクを減らしつつよりおいしい食事が食べられるようになることをしょっちゅう経験する。
認知機能低下の一項目として、
「口腔ケアを適切にできないこと」
を加えてもいいのではないかと思うくらいだ。
肺がん領域のみならず、嚥下障害・誤嚥性肺炎診療の領域も診療するようになり、口腔ケアの重要性は身に染みた。
かつて、高校の同級生が勤めていた歯科へ治療に通ったが、結局多忙なためdrop outしてしまった。
今の職場に移り、3年前から自宅近くの歯科で治療を再開した。
当初は、
「虫歯が20本はあります」
「1本は神経を抜かないとどうにもなりませんね」
「親知らずも3本残っています」
「親知らずのうち1本は、歯肉の中に横向きに埋まっていて、当院では対処できません」
「他の歯の治療がすべて終わったら、歯科口腔外科に紹介しましょう」
と言われてゲッソリしたが、2年半くらいかけて、埋没した親知らずを除いて全ての治療を完了し、今も月に1回、メンテナンスに通っている。
あとは最後の1本の親知らず、暖かくなったら、職場でお世話になっている知人の先生に抜いてもらおうと考えている。
私の肺にも、異形腺腫様過形成か微小腺がんかを思わせる病巣がいくつかある。
歯科定期受診は、将来がんになったときのための先行投資。
2020年01月24日
浸潤型粘液産生性腺がんは、PET陰性だったっけ?
Invsive Mucinous Adenocarcinoma(IMA).
日本語に直せば、「浸潤型粘液産生性腺がん」といったところか。
ある程度以上の年代の医師には、この呼称よりも、いわゆる野口分類における"mucinous BAC"の方が馴染み深いだろう。
過去に経験した中から、典型的なレントゲン、CT、切除肺の肉眼像、切除肺の顕微鏡像を示す。

レントゲンでは、一見右中下肺野の肺炎のように見える。

CTでも、右下葉の大葉性肺炎と言われれば、そう見える。
そう考えて抗生物質で治療してもよくならない、というのがミソ。
苦しまぎれにステロイドを使ってみても、やっぱりよくならない。

原因がわからないからということで生検をして初めて診断がついて、運よく切除できた肺をスライスすると、こんな感じ。
中ほどから左側、透明感があってコラーゲンを豊富に含んだように見えるプルンプルンしているところが、肺がんの病巣。
プルンプルンしているところには豊富な粘液が含まれている(コラーゲンではない)。

顕微鏡で見れば、こんな感じである。
肺胞上皮を置換するように進展・増殖する腺癌の中でも、杯細胞様の腫瘍細胞が豊富な粘液を伴いながら増殖していく。
これと同じような病歴、画像経過を示す患者が、最近いた。
残念ながら既に両肺にわたって影が広がっていて、高度の呼吸不全を伴っていた。
進行期で、これから緩和医療に向かう。
PETを撮影したところ、両肺にまたがる病巣において、ほとんどは淡い集積しか示していなかった。
一方で、同じinvasive mucinous adenocarcinomaと気管支鏡診断した患者のPETを示す。



恐ろしいことに、病巣への集積は極めて淡く、良性と判断されかねない。
この方は確定診断してからPETを撮影したのでそうは診断されなかったが、果たして未確診の状態で検査をしても肺がんと診断されたかどうか。
PET陰性でも肺がんでないとは言いきれない典型例だ。
日本語に直せば、「浸潤型粘液産生性腺がん」といったところか。
ある程度以上の年代の医師には、この呼称よりも、いわゆる野口分類における"mucinous BAC"の方が馴染み深いだろう。
過去に経験した中から、典型的なレントゲン、CT、切除肺の肉眼像、切除肺の顕微鏡像を示す。

レントゲンでは、一見右中下肺野の肺炎のように見える。

CTでも、右下葉の大葉性肺炎と言われれば、そう見える。
そう考えて抗生物質で治療してもよくならない、というのがミソ。
苦しまぎれにステロイドを使ってみても、やっぱりよくならない。

原因がわからないからということで生検をして初めて診断がついて、運よく切除できた肺をスライスすると、こんな感じ。
中ほどから左側、透明感があってコラーゲンを豊富に含んだように見えるプルンプルンしているところが、肺がんの病巣。
プルンプルンしているところには豊富な粘液が含まれている(コラーゲンではない)。

顕微鏡で見れば、こんな感じである。
肺胞上皮を置換するように進展・増殖する腺癌の中でも、杯細胞様の腫瘍細胞が豊富な粘液を伴いながら増殖していく。
これと同じような病歴、画像経過を示す患者が、最近いた。
残念ながら既に両肺にわたって影が広がっていて、高度の呼吸不全を伴っていた。
進行期で、これから緩和医療に向かう。
PETを撮影したところ、両肺にまたがる病巣において、ほとんどは淡い集積しか示していなかった。
一方で、同じinvasive mucinous adenocarcinomaと気管支鏡診断した患者のPETを示す。



恐ろしいことに、病巣への集積は極めて淡く、良性と判断されかねない。
この方は確定診断してからPETを撮影したのでそうは診断されなかったが、果たして未確診の状態で検査をしても肺がんと診断されたかどうか。
PET陰性でも肺がんでないとは言いきれない典型例だ。
2020年01月23日
電子たばこと肺障害(EVALI)
電子たばこと肺障害の話題は、昨年(2019年)ごろから取り沙汰されるようになった。
米国では規制の対象となっているようだが、我が国ではそうした動きはまだ見られない。
New England Jourlal of Medicineに関連記事が載っていたので、軽く目を通してみた。
https://www.nejm.org/doi/full/10.1056/NEJMp1916171?query=TOC
米国の電子たばこには、ニコチンの成分だけでなく、マリファナの主成分tetrahydrocannabinol (THC, the psychoactive ingredient in marijuana)を含むものも少なくないらしい。
そして、問題なのは、米国の学生の間でこうした電子たばこが急速に普及していることで、実に高校生の27.5%、中学生の10.5%が電子たばこを使用しているという。
そして、2020年の1月7日までに全米50州から2602人の電子たばこ関連肺障害(EVALI, e-cigarette, or vaping, product use–associated lung injury)が報告され、そのうち57人が死亡している。
発症者の年齢中央値は24歳、18-34歳の年齢層が62%を占め、18歳未満が16%を占めていたということだ。
34歳以下で全体の80%を占めるわけで、若い世代にとっての健康問題であることがよく分かる。
気管支肺胞洗浄の検査を受けた51人のほとんどで、洗浄液からTHCが検出されたとのこと。
これは、対岸の火事ではない。
若い人たちは、友人、家族、そしてオンラインで商品を取り扱う業者から電子たばこを入手しているという。
我が国で、こうした事態が起こらないと、言いきれるだろうか。
米国では規制の対象となっているようだが、我が国ではそうした動きはまだ見られない。
New England Jourlal of Medicineに関連記事が載っていたので、軽く目を通してみた。
https://www.nejm.org/doi/full/10.1056/NEJMp1916171?query=TOC
米国の電子たばこには、ニコチンの成分だけでなく、マリファナの主成分tetrahydrocannabinol (THC, the psychoactive ingredient in marijuana)を含むものも少なくないらしい。
そして、問題なのは、米国の学生の間でこうした電子たばこが急速に普及していることで、実に高校生の27.5%、中学生の10.5%が電子たばこを使用しているという。
そして、2020年の1月7日までに全米50州から2602人の電子たばこ関連肺障害(EVALI, e-cigarette, or vaping, product use–associated lung injury)が報告され、そのうち57人が死亡している。
発症者の年齢中央値は24歳、18-34歳の年齢層が62%を占め、18歳未満が16%を占めていたということだ。
34歳以下で全体の80%を占めるわけで、若い世代にとっての健康問題であることがよく分かる。
気管支肺胞洗浄の検査を受けた51人のほとんどで、洗浄液からTHCが検出されたとのこと。
これは、対岸の火事ではない。
若い人たちは、友人、家族、そしてオンラインで商品を取り扱う業者から電子たばこを入手しているという。
我が国で、こうした事態が起こらないと、言いきれるだろうか。
2020年01月22日
スタッフが流す涙
先日、「がんと老衰」という記事を書いた。
http://oitahaiganpractice.junglekouen.com/e968813.html
2件目に扱った90歳過ぎの女性も、結局この記事を書いた翌日に永眠された。
例によって、私と看護スタッフ、リハビリスタッフ、医療ソーシャルワーカーが集まって、フェアウェル・カンファレンスを行った。
私からは
・患者が夫と二人で暮らしていたこと
・15年前に夫に先立たれてから一人暮らしをしていたこと
・徐々に認知症が進み独居生活ができなくなったこと
・5年前から息子さん夫婦と同居していたこと
・息子さんは本人の病状経過を「これからリハビリをして元気になるだろう、なってほしい」と楽観的に捉えていたこと
・お嫁さんは「これまでの経過を見て、意思疎通もできない高度の認知症と治療適応のない進行胃癌、慢性腎不全を抱えた義母が元気になるわけがない」と現実を見据えていたこと
・主治医としては、この病状で、経鼻栄養を維持するために身体抑制を続けながら経管栄養を継続するのは心が痛んだが、リハビリ継続のためにやむを得ず栄養継続したこと
・病状が悪化してからは、少しでも本人の苦痛をとるために、経鼻胃管を抜いて、身体抑制を解除したこと
・この方にリハビリや経管栄養をすることが、医学的にも倫理的にも意味があることだったのか、今でも悩んでいること
・かといって、リハビリ適応がないからと転院受け入れを断るのは、急性期病院の立場を考えると忍びなかったこと
・リハビリ継続のために転院してきた当院で、いきなり終末期医療に舵を切る決断ができなかったこと
などを話した。
リハビリのスタッフは口をそろえて、短期間の介入で、しかも本人との意思疎通はほとんどはかれず、何もしてあげられなかったと話していた。
そして、看護スタッフが話し始めるのを聞いて、参加していた誰もが絶句した。
まだキャリアの浅いスタッフだが、意思疎通もできなかった患者を思い起こして、A4の用紙にまとめた思いの丈を、しゃくりあげながら語り始めた。
・意思疎通はほとんどできなかった
・事故防止のためにやむを得ず身体抑制を継続していたが、身体抑制が解除できないかユニット会議で絶えず話し合い続けた
・2時間ごとの体位変換、経管栄養により際限なく続く下痢の対処、褥瘡予防のスキンケア、その他の介入を一所懸命に続けた
・全部本人のためにと思ってやってきたが、病状が悪化したときに経鼻胃管も抑制も解除して、その時になって初めて、本人の眉間に寄っていた深いしわがなくなり、優しい表情になって最期を迎えた
・病状悪化時、主治医から説明があったとき、まだ息子さんが治療に希望を持っているのを感じた
・主治医はこれ以上無理な治療をして苦しませない方がいい、自然な形で見守ってあげた方がいいと言っていたが、息子さんの立場になってみれば、もう少し粘り強く治療してあげてもよかったんじゃないかと思った
その場に重苦しい沈黙が漂った。
険悪な、という意味ではなく、ああ、この人は、意思疎通もできなかったこの患者さんのために、こんなに溢れるような気持ちを抱いてくれていたんだなあと、そんな思いに浸るような雰囲気が漂っていた。
思わず、私の頭をよぎったのは、「悪いニュースの伝え方:SPIKES」の「E」だった。
別に悪いニュースを伝えているわけでもないし、目の前にいるのは患者でも家族でもなく、ともに働くスタッフなのだが、グリーフケアをしている気分になった。
http://oitahaiganpractice.junglekouen.com/e355848.html
http://oitahaiganpractice.junglekouen.com/e534618.html
しばしの沈黙ののち、私から看護スタッフに問いかけた。
「私も最善の治療ができたとは思っていなくて、冒頭にお伝えしたように今でも悩んでいます」
「私は肺がんの内科診療を専門分野としてきただけに、どうしてもこの患者さんのような方を見ると、緩和医療的・終末期医療的な立場で物事を考えてしまいます」
「進行期肺がんの内科診療と比べて、認知症高齢者の医療が難しいのは、ときに本人の意向が確認できないということです」
「今回の患者さんの経過を振り返って、あなたは経管栄養の継続を含めて、最大限できる治療を続けることと、最後の一時期のように医療行為を中止して、安らかに最期を迎えて頂くことと、どちらが本人が幸せだと思いますか?」
その看護スタッフは、しばし考えたのち、本人の表情を見ていたら、やはり最後のひと時の方が幸せだったように思うと答えた。
その後、私からは以下のようにお話をした。
・我々医療者の不文律としてよく言われることに、"First, do no harm."という言葉がある
・治療云々を語る前に、まず医療行為によって患者が不利益を被らないようにしなければならない
・不利益は受け取る側にとっても変わり得るけれど、まずは本人が不利益と感じるかどうかが大事だろう
・今回のこの方の病状で、経鼻経管栄養による延命・それに伴う長期の身体抑制は、私は"harm"だったと思い、反省している
・どれが"harm"で、どれが"treatment"なのかは、患者や家族を診ながら、その都度判断していくしかない
・誰もが認める「正解の診療」なんて、そもそもどこにもない
・進行期肺がんの患者の診療では、いつまで"harm"となり得る積極的治療をして、いつから患者の苦痛緩和を唯一の判断基準とする支持療法期に移行するべきか、絶えず考えている
・これからもみんなで知恵を出し合いながら、より医療の質を高めていきたい
たくさん患者を診ていると、やがて麻痺してしまいがちな、初めて担当患者をこの手で看取ったときの気持ちを、今日のフェアウェル・カンファレンスは取り戻させてくれた。
社会人になって私が最初に看取った患者は、胸水貯留に苦しむ80代前半の、自動車修理工場経営者の進行期肺がん患者だった。
いろいろなことを教えてもらった。
多職種で集まってカンファレンスを行うとよい知恵が出ることが多いが、多職種フェアウェル・カンファレンスは、知恵だけではなくて感情や経験を共有できる、という意味で、とても意義のある取り組みだと思う。
http://oitahaiganpractice.junglekouen.com/e968813.html
2件目に扱った90歳過ぎの女性も、結局この記事を書いた翌日に永眠された。
例によって、私と看護スタッフ、リハビリスタッフ、医療ソーシャルワーカーが集まって、フェアウェル・カンファレンスを行った。
私からは
・患者が夫と二人で暮らしていたこと
・15年前に夫に先立たれてから一人暮らしをしていたこと
・徐々に認知症が進み独居生活ができなくなったこと
・5年前から息子さん夫婦と同居していたこと
・息子さんは本人の病状経過を「これからリハビリをして元気になるだろう、なってほしい」と楽観的に捉えていたこと
・お嫁さんは「これまでの経過を見て、意思疎通もできない高度の認知症と治療適応のない進行胃癌、慢性腎不全を抱えた義母が元気になるわけがない」と現実を見据えていたこと
・主治医としては、この病状で、経鼻栄養を維持するために身体抑制を続けながら経管栄養を継続するのは心が痛んだが、リハビリ継続のためにやむを得ず栄養継続したこと
・病状が悪化してからは、少しでも本人の苦痛をとるために、経鼻胃管を抜いて、身体抑制を解除したこと
・この方にリハビリや経管栄養をすることが、医学的にも倫理的にも意味があることだったのか、今でも悩んでいること
・かといって、リハビリ適応がないからと転院受け入れを断るのは、急性期病院の立場を考えると忍びなかったこと
・リハビリ継続のために転院してきた当院で、いきなり終末期医療に舵を切る決断ができなかったこと
などを話した。
リハビリのスタッフは口をそろえて、短期間の介入で、しかも本人との意思疎通はほとんどはかれず、何もしてあげられなかったと話していた。
そして、看護スタッフが話し始めるのを聞いて、参加していた誰もが絶句した。
まだキャリアの浅いスタッフだが、意思疎通もできなかった患者を思い起こして、A4の用紙にまとめた思いの丈を、しゃくりあげながら語り始めた。
・意思疎通はほとんどできなかった
・事故防止のためにやむを得ず身体抑制を継続していたが、身体抑制が解除できないかユニット会議で絶えず話し合い続けた
・2時間ごとの体位変換、経管栄養により際限なく続く下痢の対処、褥瘡予防のスキンケア、その他の介入を一所懸命に続けた
・全部本人のためにと思ってやってきたが、病状が悪化したときに経鼻胃管も抑制も解除して、その時になって初めて、本人の眉間に寄っていた深いしわがなくなり、優しい表情になって最期を迎えた
・病状悪化時、主治医から説明があったとき、まだ息子さんが治療に希望を持っているのを感じた
・主治医はこれ以上無理な治療をして苦しませない方がいい、自然な形で見守ってあげた方がいいと言っていたが、息子さんの立場になってみれば、もう少し粘り強く治療してあげてもよかったんじゃないかと思った
その場に重苦しい沈黙が漂った。
険悪な、という意味ではなく、ああ、この人は、意思疎通もできなかったこの患者さんのために、こんなに溢れるような気持ちを抱いてくれていたんだなあと、そんな思いに浸るような雰囲気が漂っていた。
思わず、私の頭をよぎったのは、「悪いニュースの伝え方:SPIKES」の「E」だった。
別に悪いニュースを伝えているわけでもないし、目の前にいるのは患者でも家族でもなく、ともに働くスタッフなのだが、グリーフケアをしている気分になった。
http://oitahaiganpractice.junglekouen.com/e355848.html
http://oitahaiganpractice.junglekouen.com/e534618.html
しばしの沈黙ののち、私から看護スタッフに問いかけた。
「私も最善の治療ができたとは思っていなくて、冒頭にお伝えしたように今でも悩んでいます」
「私は肺がんの内科診療を専門分野としてきただけに、どうしてもこの患者さんのような方を見ると、緩和医療的・終末期医療的な立場で物事を考えてしまいます」
「進行期肺がんの内科診療と比べて、認知症高齢者の医療が難しいのは、ときに本人の意向が確認できないということです」
「今回の患者さんの経過を振り返って、あなたは経管栄養の継続を含めて、最大限できる治療を続けることと、最後の一時期のように医療行為を中止して、安らかに最期を迎えて頂くことと、どちらが本人が幸せだと思いますか?」
その看護スタッフは、しばし考えたのち、本人の表情を見ていたら、やはり最後のひと時の方が幸せだったように思うと答えた。
その後、私からは以下のようにお話をした。
・我々医療者の不文律としてよく言われることに、"First, do no harm."という言葉がある
・治療云々を語る前に、まず医療行為によって患者が不利益を被らないようにしなければならない
・不利益は受け取る側にとっても変わり得るけれど、まずは本人が不利益と感じるかどうかが大事だろう
・今回のこの方の病状で、経鼻経管栄養による延命・それに伴う長期の身体抑制は、私は"harm"だったと思い、反省している
・どれが"harm"で、どれが"treatment"なのかは、患者や家族を診ながら、その都度判断していくしかない
・誰もが認める「正解の診療」なんて、そもそもどこにもない
・進行期肺がんの患者の診療では、いつまで"harm"となり得る積極的治療をして、いつから患者の苦痛緩和を唯一の判断基準とする支持療法期に移行するべきか、絶えず考えている
・これからもみんなで知恵を出し合いながら、より医療の質を高めていきたい
たくさん患者を診ていると、やがて麻痺してしまいがちな、初めて担当患者をこの手で看取ったときの気持ちを、今日のフェアウェル・カンファレンスは取り戻させてくれた。
社会人になって私が最初に看取った患者は、胸水貯留に苦しむ80代前半の、自動車修理工場経営者の進行期肺がん患者だった。
いろいろなことを教えてもらった。
多職種で集まってカンファレンスを行うとよい知恵が出ることが多いが、多職種フェアウェル・カンファレンスは、知恵だけではなくて感情や経験を共有できる、という意味で、とても意義のある取り組みだと思う。
2020年01月21日
ECOG-ACRIN 5508試験・・・COMPASS試験と絡めて
COMPASS試験の企画立案時、本試験がしばしば引き合いに出されていた。
http://oitahaiganpractice.junglekouen.com/e969044.html
個人的には、きつい末梢神経障害に悩まされるパクリタキセルを含むECOG-ACRIN 5508レジメンは、好きじゃない。
少なくとも、自分の実地臨床では、ほぼ使用しない。
しかし、歴史的背景を踏まえると、今回取り扱うECOG-ACRIN 5508試験の方が、臨床試験立案の王道といえる。
ECOG4599試験レジメンを標準治療コントロール群として、維持療法フェーズにおける新規治療の優越性を検証しようというコンセプトだった。
論文の統計学的事項の部分にもしっかりと記述がなされており、スキがない。
ただし、そうであるが故に、switch maintenanceのコンセプトとならざるを得ない。
対するCOMPASS試験は、continuation maintenanceのコンセプトで、二次療法以降の治療選択肢を温存するという意図もあったのだろうが、「標準治療コントロール群のない」第III相臨床試験だった。
結局、どちらの臨床試験も主要評価項目は達成できなかった。
一方、その後各試験がどう発展しているかというと・・・
ECOG-ACRIN 5508試験の結果は、既にIMpower150試験において、ABCP療法の一部として既に受け入れられている。
http://oitahaiganpractice.junglekouen.com/e935130.html
http://oitahaiganpractice.junglekouen.com/e968054.html
早い話が、ECOG-ACRIN 5508試験が公表される前に、既にその発展形が早々と公表を終えて、実地臨床に組み込まれていたということだ。
おそらくは、IMpower150試験の立案の段階で、ECOG-ACRIN 5508試験の趨勢は参考にされていたのだろう。
この辺が企業主導のグローバル試験の推進力というか、免疫チェックポイント関連試験の勢いというか。
対象患者集団が完全に競合するECOG-ACRIN 5508試験とIMpower150試験、実際には患者集積期間が重複するのは2015年3月から2015年4月のわずか1ヶ月間だった。
ECOG-ACRIN 5508試験は患者集積に4年8か月を必要とした一方で、IMpower150試験が患者集積に要したのはわずか1年9ヶ月だった。
COMPASS試験の発展形はAPPLE試験だが、ようやく試験自体が単緒についたところであり、結果が出て実地臨床に反映されるまでにはまだまだ相当の時間を要するだろう。
また、COMPASS試験のレジメンが標準治療としてふさわしいかどうか(ECOG4599レジメンと少なくとも非劣勢なのか)はどこにもデータがないわけで、その状態で次のAPPLE試験へ進むのは果たして正しいことなのか、その結果が実地臨床でスムーズに受け入れられるのか、考えておく必要があるだろう。
もうひとつ、COMPASS試験とECOG-ACRIN 5508試験、あるいはその他のベバシズマブを含む臨床試験や維持療法コンセプトを含む臨床試験の解釈をするにあたり、踏まえておかなければならないことがある。
比較対象となっている患者集団は、かなり「選ばれた集団」であるということだ。
実地臨床でベバシズマブを使うとなると、非扁平上皮非小細胞肺がんで、空洞性病変があってはダメ、脳転移巣があっても局所療法済みで安定期、血痰や喀血があってはダメ、大血管浸潤があってはダメ、主要な下気道への浸潤があってはダメ、コントロール不良の高血圧があってはダメ、治療開始から1年以内に狭心症や心筋梗塞・脳梗塞の既往があってはダメ、と、ダメダメ尽くし。
これだけで、かなり対象患者は絞られる。
さらには、これが最も厄介なのだが、導入化学療法を少なくとも3コースは完遂し、CR/PR/SDの状態を維持していなければならない。
治療開始前に、治療が完遂できるか、治療後にCR/PR/SDであるかなんて、予測できるわけがない。
そして、維持療法に進めなかった患者は完全に結果解析の蚊帳の外である。
実際に、COMPASS試験参加者のうち維持療法に進めなかった907-599=308人(34.0%)の患者と、ECOG-ACRIN 5508試験参加者のうち維持療法に進めなかった1516-874=642人(42.3%)の患者のその後なんて、論文のどこにも扱われていない。
以前、進行非小細胞肺がん患者のうち、ベバシズマブを使用できる条件を満たす患者は半数にも満たないと聞いたことがある。
これら試験に参加した患者は、ベバシズマブを使える条件をクリアした「選ばれた集団」なのに、そのうち維持療法に進めるのはざっと58-65%、多く見積もっても進行非小細胞肺がん患者全体の30-35%というところだろう。
当然この30-35%の中には、ドライバー遺伝子変異陽性の患者も含まれるので、こうした患者を除くとさらに少なくなる。
結局、対象者はEGFR遺伝子変異陽性の日本人肺がん患者の数より少なくなるだろう。
希少フラクションとまではいわないが、少なくとも多数派ではない。
Pemetrexed, Bevacizumab, or the Combination As Maintenance Therapy for Advanced Nonsquamous Non-Small-Cell Lung Cancer: ECOG-ACRIN 5508.
Ramalingam et al.,J Clin Oncol. 2019 Sep 10;37(26):2360-2367.
doi: 10.1200/JCO.19.01006. Epub 2019 Jul 30.
目的:
ペメトレキセドとベバシズマブは、進行非扁平上皮非小細胞肺がんの維持療法の際に使用される。ベバシズマブとペメトレキセドの併用療法もまた有効である。今回、最適な維持療法を決める目的で、無作為化試験を計画した。
対象患者と方法:
前治療歴のない進行非扁平上皮非小細胞肺がん患者を対象とし、カルボプラチン(6AUC)、パクリタキセル(200mg/㎡)、ベバシズマブ(15mg/kg)併用療法を最大4コースまで施行した。4コースの治療後、病勢進行に至っていない患者を、以下の維持療法に無作為に割り付けた;B群:ベバシズマブ(15mg/kg)、P群:ペメトレキセド(500mg/㎡)、併用群:ベバシズマブ(15mg/kg)+ペメトレキセド(500mg/㎡)。主要評価項目は全生存期間とし、B群を比較対照群とした(B群に対するP群、もしくは併用群の優越性を検証する試験デザインとした)

結果:
1,516人の患者が登録され、そのうち874人(57%)が導入療法完遂後に3群の維持療法へ無作為割付された。経過観察期間中央値は50.6ヶ月で、無作為化からの生存期間中央値はB群 14.4ヶ月に対しP群 15.9ヶ月(ハザード比 0.86、p=0.12)、併用群16.4ヶ月(ハザード比 0.9、p=0.028)だった。無増悪生存期間中央値はB群、P群、併用群でそれぞれ4.2ヶ月、5.1ヶ月(ハザード比 0.85、p=0.06)、7.5ヶ月(ハザード比 0.67、p<0.001)だった。また、Grade 3/4の毒性発現率は、B群で29%、P群で37%、併用群で51%だった。


結論:
進行非扁平上皮非小細胞肺がんに対する維持療法として、ベバシズマブ単剤療法もしくはペメトレキセド単剤療法は有効だった。一方、生存期間延長効果の欠如と毒性増強の理由から、ベバシズマブとペメトレキセドの併用維持療法は推奨できない。
本文より:
・脳転移を有する患者は、手術や放射線治療といった局所療法を行ったうえで、治療後少なくとも2週間経過して、脳転移の病勢進行の所見を認めないことを条件とした
・(ベバシズマブ使用の)除外基準として、以下を定めた
1)コントロール不良の高血圧症がある
2)試験登録から遡ること4週間以内に一定量の血痰を認めた
3)試験登録から遡ること12か月以内に、動脈閉塞イベント(狭心症、心筋梗塞、脳梗塞など)を認めないこと
4)試験登録から遡ること6週間以内に胸腹部の外科手術をされている
5)心血管疾患を有する
6)肺の空洞性病変を認める
・2,011年の一時期、パクリタキセルが国家的に不足していたため、代替としてドセタキセル75mg/㎡を使用した時期があった
・導入化学療法時は、毒性により4コースの化学療法が不能となった場合には、3コースの治療が終わった段階で完全奏効、部分奏効、病勢安定のどれかであった場合には、維持療法への移行を許可した
・毒性による治療の遅延は最長3週間まで許容された
・忍容可能年齢の女性では、血清を用いた妊娠反応テストを行い、妊娠患者を除外した
・プロトコール治療が終了したのちも、当初2年間は3か月ごとに、2年目から5年目までは6か月ごとに追跡踏査した
・主要評価項目は全生存期間で、無作為割付から患者死亡に至るまでの期間とする
・副次評価項目は無増悪生存期間
・統計学的デザインは、81%の検出力を以て、25%のハザード比縮小を検出するデザインとした
・B群と併用群の比較では、片側検定で有意水準は0.0125とした
・B群とペメトレキセド群の比較では両側検定で有意水準は0.025とした
・P群と併用群の直接比較は計画しなかった
・25%のハザード比縮小は、全生存期間の33.3%改善を意味し、生存期間は12ヶ月から16ヶ月に延長するものと見込まれた
・2,010年8月から2,015年4月の間に、総計1,516人の患者が本試験に参加した
・導入化学療法ののち、874人(57%)が各維持療法群に無作為に割り付けられた
・導入化学療法の奏効割合は30.3%だった
・参加した患者全体の生存期間中央値(参加登録をしてから患者死亡に至るまでの期間)は13.1ヶ月だった
・経過観察期間中央値50.6ヶ月において、P群の生存期間中央値は15.9ヶ月で、B群では14.4ヶ月(ハザード比 0.86、97.5%信頼区間は0.70-1.07、p=0.12)だった
・同様に、併用群の生存期間中央値は16.4ヶ月で、B群では14.4ヶ月(ハザード比 0.90、97.5%信頼区間は0.73-1.12、p=0.28)だった
・無増悪生存期間中央値は、P群で5.1ヶ月、B群では4.2ヶ月(ハザード比 0.85、97.5%信頼区間は0.69-1.03、p=0.06)だった
・同様に、併用群の無増悪生存期間は7.5ヶ月、B群では4.2ヶ月(ハザード比 0.67、97.5%信頼区間は0.55-0.82、p<0.001)だった
・維持療法期間中の奏効割合(97.5%信頼区間)はB群で12.5%(8.5-17.6)、P群で18.7%(13.9-24.4)、21.2%(16-27)だった
・本試験は、分子標的療法がドライバー遺伝子変異陽性非小細胞肺がん患者の初回標準治療となるより前の時代に企画立案された臨床試験である
http://oitahaiganpractice.junglekouen.com/e969044.html
個人的には、きつい末梢神経障害に悩まされるパクリタキセルを含むECOG-ACRIN 5508レジメンは、好きじゃない。
少なくとも、自分の実地臨床では、ほぼ使用しない。
しかし、歴史的背景を踏まえると、今回取り扱うECOG-ACRIN 5508試験の方が、臨床試験立案の王道といえる。
ECOG4599試験レジメンを標準治療コントロール群として、維持療法フェーズにおける新規治療の優越性を検証しようというコンセプトだった。
論文の統計学的事項の部分にもしっかりと記述がなされており、スキがない。
ただし、そうであるが故に、switch maintenanceのコンセプトとならざるを得ない。
対するCOMPASS試験は、continuation maintenanceのコンセプトで、二次療法以降の治療選択肢を温存するという意図もあったのだろうが、「標準治療コントロール群のない」第III相臨床試験だった。
結局、どちらの臨床試験も主要評価項目は達成できなかった。
一方、その後各試験がどう発展しているかというと・・・
ECOG-ACRIN 5508試験の結果は、既にIMpower150試験において、ABCP療法の一部として既に受け入れられている。
http://oitahaiganpractice.junglekouen.com/e935130.html
http://oitahaiganpractice.junglekouen.com/e968054.html
早い話が、ECOG-ACRIN 5508試験が公表される前に、既にその発展形が早々と公表を終えて、実地臨床に組み込まれていたということだ。
おそらくは、IMpower150試験の立案の段階で、ECOG-ACRIN 5508試験の趨勢は参考にされていたのだろう。
この辺が企業主導のグローバル試験の推進力というか、免疫チェックポイント関連試験の勢いというか。
対象患者集団が完全に競合するECOG-ACRIN 5508試験とIMpower150試験、実際には患者集積期間が重複するのは2015年3月から2015年4月のわずか1ヶ月間だった。
ECOG-ACRIN 5508試験は患者集積に4年8か月を必要とした一方で、IMpower150試験が患者集積に要したのはわずか1年9ヶ月だった。
COMPASS試験の発展形はAPPLE試験だが、ようやく試験自体が単緒についたところであり、結果が出て実地臨床に反映されるまでにはまだまだ相当の時間を要するだろう。
また、COMPASS試験のレジメンが標準治療としてふさわしいかどうか(ECOG4599レジメンと少なくとも非劣勢なのか)はどこにもデータがないわけで、その状態で次のAPPLE試験へ進むのは果たして正しいことなのか、その結果が実地臨床でスムーズに受け入れられるのか、考えておく必要があるだろう。
もうひとつ、COMPASS試験とECOG-ACRIN 5508試験、あるいはその他のベバシズマブを含む臨床試験や維持療法コンセプトを含む臨床試験の解釈をするにあたり、踏まえておかなければならないことがある。
比較対象となっている患者集団は、かなり「選ばれた集団」であるということだ。
実地臨床でベバシズマブを使うとなると、非扁平上皮非小細胞肺がんで、空洞性病変があってはダメ、脳転移巣があっても局所療法済みで安定期、血痰や喀血があってはダメ、大血管浸潤があってはダメ、主要な下気道への浸潤があってはダメ、コントロール不良の高血圧があってはダメ、治療開始から1年以内に狭心症や心筋梗塞・脳梗塞の既往があってはダメ、と、ダメダメ尽くし。
これだけで、かなり対象患者は絞られる。
さらには、これが最も厄介なのだが、導入化学療法を少なくとも3コースは完遂し、CR/PR/SDの状態を維持していなければならない。
治療開始前に、治療が完遂できるか、治療後にCR/PR/SDであるかなんて、予測できるわけがない。
そして、維持療法に進めなかった患者は完全に結果解析の蚊帳の外である。
実際に、COMPASS試験参加者のうち維持療法に進めなかった907-599=308人(34.0%)の患者と、ECOG-ACRIN 5508試験参加者のうち維持療法に進めなかった1516-874=642人(42.3%)の患者のその後なんて、論文のどこにも扱われていない。
以前、進行非小細胞肺がん患者のうち、ベバシズマブを使用できる条件を満たす患者は半数にも満たないと聞いたことがある。
これら試験に参加した患者は、ベバシズマブを使える条件をクリアした「選ばれた集団」なのに、そのうち維持療法に進めるのはざっと58-65%、多く見積もっても進行非小細胞肺がん患者全体の30-35%というところだろう。
当然この30-35%の中には、ドライバー遺伝子変異陽性の患者も含まれるので、こうした患者を除くとさらに少なくなる。
結局、対象者はEGFR遺伝子変異陽性の日本人肺がん患者の数より少なくなるだろう。
希少フラクションとまではいわないが、少なくとも多数派ではない。
Pemetrexed, Bevacizumab, or the Combination As Maintenance Therapy for Advanced Nonsquamous Non-Small-Cell Lung Cancer: ECOG-ACRIN 5508.
Ramalingam et al.,J Clin Oncol. 2019 Sep 10;37(26):2360-2367.
doi: 10.1200/JCO.19.01006. Epub 2019 Jul 30.
目的:
ペメトレキセドとベバシズマブは、進行非扁平上皮非小細胞肺がんの維持療法の際に使用される。ベバシズマブとペメトレキセドの併用療法もまた有効である。今回、最適な維持療法を決める目的で、無作為化試験を計画した。
対象患者と方法:
前治療歴のない進行非扁平上皮非小細胞肺がん患者を対象とし、カルボプラチン(6AUC)、パクリタキセル(200mg/㎡)、ベバシズマブ(15mg/kg)併用療法を最大4コースまで施行した。4コースの治療後、病勢進行に至っていない患者を、以下の維持療法に無作為に割り付けた;B群:ベバシズマブ(15mg/kg)、P群:ペメトレキセド(500mg/㎡)、併用群:ベバシズマブ(15mg/kg)+ペメトレキセド(500mg/㎡)。主要評価項目は全生存期間とし、B群を比較対照群とした(B群に対するP群、もしくは併用群の優越性を検証する試験デザインとした)

結果:
1,516人の患者が登録され、そのうち874人(57%)が導入療法完遂後に3群の維持療法へ無作為割付された。経過観察期間中央値は50.6ヶ月で、無作為化からの生存期間中央値はB群 14.4ヶ月に対しP群 15.9ヶ月(ハザード比 0.86、p=0.12)、併用群16.4ヶ月(ハザード比 0.9、p=0.028)だった。無増悪生存期間中央値はB群、P群、併用群でそれぞれ4.2ヶ月、5.1ヶ月(ハザード比 0.85、p=0.06)、7.5ヶ月(ハザード比 0.67、p<0.001)だった。また、Grade 3/4の毒性発現率は、B群で29%、P群で37%、併用群で51%だった。


結論:
進行非扁平上皮非小細胞肺がんに対する維持療法として、ベバシズマブ単剤療法もしくはペメトレキセド単剤療法は有効だった。一方、生存期間延長効果の欠如と毒性増強の理由から、ベバシズマブとペメトレキセドの併用維持療法は推奨できない。
本文より:
・脳転移を有する患者は、手術や放射線治療といった局所療法を行ったうえで、治療後少なくとも2週間経過して、脳転移の病勢進行の所見を認めないことを条件とした
・(ベバシズマブ使用の)除外基準として、以下を定めた
1)コントロール不良の高血圧症がある
2)試験登録から遡ること4週間以内に一定量の血痰を認めた
3)試験登録から遡ること12か月以内に、動脈閉塞イベント(狭心症、心筋梗塞、脳梗塞など)を認めないこと
4)試験登録から遡ること6週間以内に胸腹部の外科手術をされている
5)心血管疾患を有する
6)肺の空洞性病変を認める
・2,011年の一時期、パクリタキセルが国家的に不足していたため、代替としてドセタキセル75mg/㎡を使用した時期があった
・導入化学療法時は、毒性により4コースの化学療法が不能となった場合には、3コースの治療が終わった段階で完全奏効、部分奏効、病勢安定のどれかであった場合には、維持療法への移行を許可した
・毒性による治療の遅延は最長3週間まで許容された
・忍容可能年齢の女性では、血清を用いた妊娠反応テストを行い、妊娠患者を除外した
・プロトコール治療が終了したのちも、当初2年間は3か月ごとに、2年目から5年目までは6か月ごとに追跡踏査した
・主要評価項目は全生存期間で、無作為割付から患者死亡に至るまでの期間とする
・副次評価項目は無増悪生存期間
・統計学的デザインは、81%の検出力を以て、25%のハザード比縮小を検出するデザインとした
・B群と併用群の比較では、片側検定で有意水準は0.0125とした
・B群とペメトレキセド群の比較では両側検定で有意水準は0.025とした
・P群と併用群の直接比較は計画しなかった
・25%のハザード比縮小は、全生存期間の33.3%改善を意味し、生存期間は12ヶ月から16ヶ月に延長するものと見込まれた
・2,010年8月から2,015年4月の間に、総計1,516人の患者が本試験に参加した
・導入化学療法ののち、874人(57%)が各維持療法群に無作為に割り付けられた
・導入化学療法の奏効割合は30.3%だった
・参加した患者全体の生存期間中央値(参加登録をしてから患者死亡に至るまでの期間)は13.1ヶ月だった
・経過観察期間中央値50.6ヶ月において、P群の生存期間中央値は15.9ヶ月で、B群では14.4ヶ月(ハザード比 0.86、97.5%信頼区間は0.70-1.07、p=0.12)だった
・同様に、併用群の生存期間中央値は16.4ヶ月で、B群では14.4ヶ月(ハザード比 0.90、97.5%信頼区間は0.73-1.12、p=0.28)だった
・無増悪生存期間中央値は、P群で5.1ヶ月、B群では4.2ヶ月(ハザード比 0.85、97.5%信頼区間は0.69-1.03、p=0.06)だった
・同様に、併用群の無増悪生存期間は7.5ヶ月、B群では4.2ヶ月(ハザード比 0.67、97.5%信頼区間は0.55-0.82、p<0.001)だった
・維持療法期間中の奏効割合(97.5%信頼区間)はB群で12.5%(8.5-17.6)、P群で18.7%(13.9-24.4)、21.2%(16-27)だった
・本試験は、分子標的療法がドライバー遺伝子変異陽性非小細胞肺がん患者の初回標準治療となるより前の時代に企画立案された臨床試験である
2020年01月18日
COMPASS試験
COMPASS試験。
結果的にnegative trialになってしまったが、カルボプラチン+ペメトレキセド+ベバシズマブ併用療法⇒ペメトレキセド+ベバシズマブ維持療法を、日本人・未治療進行非扁平上皮非小細胞肺がん・ベバシズマブ使用可能・EGFR遺伝子変異陰性の患者を対象に行ったときの貴重なデータを残してくれた。
具体的なデータとして、治療開始前に患者に提供できるのは、実地臨床に携わる者としてはありがたい。
本治療を適用する機会はそれほど多くないかもしれないが、末梢神経障害の不快な有害事象を回避しつつ、胸水制御・腫瘍縮小を積極的に狙いたい際には有力な治療選択肢になるだろう。
企画立案時は、なんちゅう高コスト体質の臨床試験だと揶揄されていた。
しかし、免疫チェックポイント阻害薬がこれだけ広く使われるようになってしまってから、コスト面では相対的にCOMPASS試験のインパクトがかすんでしまった。
これって、恐ろしいことだ。
PB群が生存期間を3ヶ月強伸ばすのに、追加でかかったコストは2,600,000円くらいだが、プラチナ併用化学療法と、それに免疫チェックポイント阻害薬を併用した場合の上乗せコストは、こんなものでは済むまい。
日本人の進行非扁平上皮非小細胞肺がん患者を対象としてシスプラチン+ペメトレキセド併用化学療法→ペメトレキセド維持療法、いわゆるPARAMOUNTレジメンを施行した際の生存期間中央値は、確か24ヶ月を超えていたと思われる。
ベバシズマブ使用可能な患者が比較的予後良好群であろうことを考えると、無理にベバシズマブを使わなくてもいいような気がする。
じゃあ免疫チェックポイント阻害薬もいらないのでは、と言いたいところだが、こちらは長期生存につながる可能性があるので、今後我が国の実地臨床における長期追跡調査を踏まえないと結論が出せない。
COMPASS試験は、企画立案から波乱含みで、さらには試験進行中にPointBreak試験やAVAPERL試験が全生存期間を延長できないことが明らかとなったという逆風が吹き、更には免疫チェックポイント阻害薬関連臨床試験の怒涛のごとき報告ラッシュに翻弄されつつも、なんとかこうして完遂できた。
お疲れさまでしたと申し上げたい。
後日、ECOG-ACRIN 5508試験も取り上げたい。
以下、気になった点をまとめておく。
・今回治療対象となった患者の背景(ベバシズマブ使用可能患者に限られているので、比較的予後良好な患者集団と考えていいだろう)で、全体の無増悪生存期間中央値が7.1ヶ月、全生存期間中央値が21.1ヶ月というのは、利便性や毒性、コストを考えると満足できるものなのか
→ベバシズマブ使用不可の患者でも適用できるカルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法のKEYNOTE-189試験における無増悪生存期間中央値は9.0ヶ月、全生存期間中央値は22.0ヶ月で、化学療法感受性の人種差を考慮すると、日本人ではさらに成績が良い可能性がある
http://oitahaiganpractice.junglekouen.com/e963871.html
・導入化学療法開始からの生存期間中央値の差は26.6ヶ月-23.4ヶ月=3.2ヶ月で、B群とPB群の維持療法にかかるコスト中央値の差は2,614,000円、ゆえに生存期間中央値を1ヶ月伸ばすのに要したコストは816,875円となる
→できれば、導入化学療法から維持療法まで含めたコストを、KEYNOTE-189レジメンと比較しておきたい
・維持療法開始後の治療関連死は、ペメトレキセド+ベバシズマブ併用療法群にしか出ていない
・COMPASS試験からの派生試験であるWJOG11218L/APPLE試験は、対照群としてアテゾリズマブ+ペメトレキセド+カルボプラチン併用療法、つまりIMpower132レジメンであるが、IMpower132試験が(physically and economically)toxic newであるアテゾリズマブをカルボプラチン+ペメトレキセド併用療法に加えたにもかかわらず主要評価項目の一つである全生存期間を達成できなかったのに、それを対照群に据えて説得力があるのか、そしてさらにtoxic newであるベバシズマブを加えたにもかかわらず、主要評価項目を無増悪生存期間にして、positive studyになったとしても果たして実地臨床に馴染んでいくのか
http://oitahaiganpractice.junglekouen.com/e968081.html
Randomized Phase III Study of Continuation Maintenance Bevacizumab With or Without Pemetrexed in Advanced Nonsquamous Non-Small-Cell Lung Cancer: COMPASS (WJOG5610L).
Seto et al., J Clin Oncol. 2019 Dec 27:JCO1901494. doi: 10.1200/JCO.19.01494. [Epub ahead of print]
背景:
非小細胞肺がん患者は、これまで維持療法により恩恵を被ってきた。今回のCOMPASS試験では、カルボプラチン+ペメトレキセド+ベバシズマブ併用化学療法後のベバシズマブ維持療法にペメトレキセド維持療法を上乗せする場合としない場合の有効性と安全性を評価した。
患者と方法:
EGFR遺伝子変異(Exon19欠失変異 / Exon21L858R点変異)を伴わない未治療進行非扁平上皮非小細胞肺がん患者を対象とし、一次治療としてカルボプラチン6AUC、ペメトレキセド500mg/㎡、ベバシズマブ15mg/kg併用療法を3週間間隔で4コース行った。この導入療法の間に病勢進行を認めなかった患者を、以下のPB群、B群に1:1の比率で無作為に割り付けた。PB群ではペメトレキセド500mg/㎡とベバシズマブ15mg/kgを、B群ではベバシズマブ15mg/kgを、3週間間隔で病勢進行もしくは忍容不能の毒性が発現するまで継続投与した。主要評価項目は、無作為割り付け後の全生存期間とした。

結果:
2010年9月から2015年9月までの間に、907人の患者が導入療法を受けた。そのうち、599人が無作為割付の対象となった。298人がPB群に、301人がB群に割り付けられた。無作為割り付けからの全生存期間中央値は、PB群23.3ヶ月、B群19.6ヶ月だった(ハザード比0.87、95%信頼区間は0.73-1.05、片側ログランク検定におけるp値=0.069)。EGFR遺伝子が野生型だったサブグループにおいては、全生存期間のハザード比は0.82(95%信頼区間は0.68-0.99、片側ログランク検定におけるp値=0.020)だった。無増悪生存期間中央値はPB群5.7ヶ月、B群4.0ヶ月(ハザード比0.67、95%信頼区間は0.57-0.79、ログランク両側検定におけるp値は<0.001)だった。毒性については、同様の治療を扱った過去の報告とかわりなかった。




結論:
主要評価項目である全生存期間について、PB群で統計学的に有意な改善は認められなかった。しかしながら、無増悪生存期間と野生型EGFRの患者群における全生存期間はPB群で延長していた。
本文より:
・プラチナ併用化学療法は、分子標的療法や免疫チェックポイント阻害薬隆盛の現在にあっても、有効な治療選択肢のひとつである
・ドライバー遺伝子変異のない患者における化学療法+免疫チェックポイント阻害薬併用療法、あるいはドライバー遺伝子変異があっても、分子標的治療ののちに病勢進行に至った患者における化学療法といった活躍の場がある
・JMEN試験において、ペメトレキセドのswitchメンテナンス療法の有効性が、PARAMOUNT試験において、ペメトレキセドのcontinuationメンテナンス療法の有効性が示された。
・AVAPERL試験では、シスプラチン+ペメトレキセド+ベバシズマブ併用療法後のペメトレキセド+ベバシズマブ維持療法により、ベバシズマブ維持療法と比較して無増悪生存期間が延長することが示されたが、シスプラチンが実地臨床であまり用いられないため普及しなかった
・今回のCOMPASS試験を企画立案した時点では、まだPARAMAOUNT試験の結果は文献化されておらず、ペメトレキセド維持療法も普及していなかった
・PointBreak試験では、カルボプラチン+ペメトレキセド+ベバシズマブ併用療法後のペメトレキセド+ベバシズマブ維持療法とカルボプラチン+パクリタキセル+ベバシズマブ併用療法後のベバシズマブ維持療法が比較され、有意な無増悪生存期間の延長と神経毒性、脱毛の有害事象軽減が示されたが、全生存期間の延長には至らなかった
・ECOG5508試験では、カルボプラチン+パクリタキセル+ベバシズマブ併用療法後のペメトレキセド+ベバシズマブ維持療法、ベバシズマブ維持療法、ペメトレキセド維持療法が比較され、ペメトレキセド+ベバシズマブ維持療法で無増悪生存期間の有意な延長を認めたものの、全生存期間の有意な延長は得られなかった
・ECOG5508試験ではペメトレキセド+ベバシズマブのswitchメンテナンス療法の有効性が検証された一方で、今回のCOMPASS試験ではペメトレキセド+ベバシズマブのcontinuationメンテナンス療法の有効性を検証した
・COMPASS試験は、当初はECOG5508試験と同様に、導入療法後のペメトレキセド+ベバシズマブ維持療法、ベバシズマブ維持療法、ペメトレキセド維持療法の3群の有効性を比較するコンセプトとして立案した
・最終的には、ECOG4599試験におけるベバシズマブ維持療法が全生存期間を延長したことの歴史的意義を鑑みて、ベバシズマブ維持療法にペメトレキセドを上乗せすることで生命予後の改善が得られるかを検証するコンセプトとし、ペメトレキセド+ベバシズマブ維持療法、ベバシズマブ維持療法の2群を比較することになった
・適格条件は20歳以上、化学療法未治療、病理組織診/細胞診で局所進行/進行/術後再発非扁平上皮非小細胞肺がんと診断されている、RECIST1.1における測定可能病変を有する、ECOG-PSが0か1である、骨髄・肝・腎機能が保たれている、とした
・無症候性、あるいは治療後で、ステロイド投与を必要としない脳転移症例は登録可能とした
・扁平上皮がんを含むもの、血痰があるもの、コントロール不良の高血圧患者、感受性EGFR遺伝子変異を有する患者は除外した
・割付調整因子は治療施設、組織型、導入療法後の腫瘍縮小効果とした
・効果判定は、導入療法中は2コース後と4コース後に、維持療法中は、当初6か月間は6週間ごとに、以後は12週ごとに行った
・性別、PS、導入療法後の腫瘍縮小効果、組織型、病期、年齢、EGFR遺伝子変異の状態、喫煙歴について、サブグループ解析を行うこととした
・主要評価項目は、無作為割り付け後の全生存期間とした
・副次評価項目は、無作為割り付け後の無増悪生存期間、導入療法開始後の全生存期間と無増悪生存期間、安全性とした
・全生存期間解析において、620人の無作為割り付け患者が必要で、85%の検出率、有意水準0.05の片側検定、全生存期間中央値がB群で13ヶ月、PB群で16.5ヶ月、ハザード比換算で0.787の条件では507件の死亡イベントが必要だった
・当初は導入療法から維持療法へ移行する患者の割合を80%と見込み、775人を導入療法へ組み込む必要があると見積もっていた
・実際には、維持療法へ移行する患者の割合は66.0%で、結局907人を導入療法へ組み込むことになった
・2010年9月から2015年9月にかけて、907人の患者を71施設から登録した
・907人のうち、895人が導入化学療法を開始した
・導入化学療法開始後に、不適格例や不適切な治療前インフォームドコンセント確認例が、計39人発覚したため、導入化学療法開始時点での解析対象は856人となった
・導入化学療法を完遂し、維持療法開始対象となった患者は、599人だった
・維持療法を開始できなかった患者を除外して、維持療法開始時点での解析対象は594人(B群295人、PB群299人)だった
・データカットオフ時点で、594人全てで維持療法が終了していた
・維持療法施行中央値は、B群で4.0コース(1-36コース)、PB群で6.0コース(1-63コース)だった
・維持療法中に病勢進行によりプロトコール治療終了となったのは、B群で226人(76.6%)、PB群で203人(67.9%)だった
・維持療法中に毒性によりプロトコール治療終了となったのは、B群で59人(19.7%)、PB群で60人(20.3%)だった
・病勢進行、毒性中止のいずれの理由でもなく治療終了となったのは、B群で10人(3.4%)、PB群で36人(12%)で、この36人中23人(7.7%)は(経済的な理由で)患者の意思により終了していた
・プロトコール治療終了後、二次治療以降の治療を受けたのはB群で268人(90.8%)、PB群で251人(83.9%)だった
・後治療で免疫チェックポイント阻害薬を使用したのは、全体の12.5%にのぼった
・二次治療まで行った患者は、全体の87.4%にのぼった
・三次治療まで行った患者は、全体の61.3%にのぼった
・四次治療まで行った患者は、全体の40.6%にのぼった
・経過観察期間中央値は、導入化学療法開始時点からでは63.3ヶ月、二次治療開始時点からでは59.9ヶ月だった
・維持療法開始に至った患者594人のうち、経過観察期間内に470人が死亡していた
・維持療法開始時点からの生存期間中央値はB群で19.6ヶ月、PB群で23.3ヶ月だった(ハザード比0.87、95%信頼区間0.73-1.05、p=0.069)
・維持療法開始時点からの無増悪生存期間中央値はB群で4.0ヶ月、PB群で5.7ヶ月だった(ハザード比0.67、95%信頼区間0.57-0.79、p<0.001)
・EGFR野生型の患者のみを解析対象としたところ、維持療法開始時点からの生存期間中央値はB群で18.8ヶ月、PB群で23.3ヶ月だった(ハザード比0.82、95%信頼区間0.68-0.99、p=0.020)
・維持療法開始対象となった患者の、導入化学療法開始時点からの生存期間中央値は、B群で23.4ヶ月、PB群で26.6ヶ月、無増悪生存期間中央値は、B群で7.3ヶ月、PB群で9.0ヶ月だった
・導入化学療法の対象となった856人を対象に導入化学療法開始時点からの解析をすると、生存期間中央値は21.1ヶ月、無増悪生存期間中央値は7.1ヶ月だった
・導入化学療法開始から維持療法開始までの間に、治療関連死を5人認めた(間質性肺炎3人、呼吸器感染症2人)
・維持療法中には、PB群においてのみ治療関連死を4人認めた(間質性肺炎2人、肺胞出血1人、呼吸器感染症1人)
・維持療法にかかるコストの中央値はB群で1,917,000円(四分位区間は901,000-3,505,000円)で、PB群では4,531,000円(四分位区間は1,986,000-8,463,000円)だった
・現在、PB群の治療にアテゾリズマブを絡め、免疫チェックポイント阻害薬の追加効果を検証するWJOG11218L/APPLE試験が我が国で進行中である
→ベバシズマブ使用可能な進行非扁平上皮非小細胞肺がん患者を対象に、アテゾリズマブ+ペメトレキセド+カルボプラチン併用療法後のアテゾリズマブ+ペメトレキセド維持療法群(APP群)とアテゾリズマブ+ペメトレキセド+カルボプラチン+ベバシズマブ併用療法後のアテゾリズマブ+ペメトレキセド+カルボプラチン+ベバシズマブ維持療法群(APPB群)を比較する第III相臨床試験で、主要評価項目は無増悪生存期間
結果的にnegative trialになってしまったが、カルボプラチン+ペメトレキセド+ベバシズマブ併用療法⇒ペメトレキセド+ベバシズマブ維持療法を、日本人・未治療進行非扁平上皮非小細胞肺がん・ベバシズマブ使用可能・EGFR遺伝子変異陰性の患者を対象に行ったときの貴重なデータを残してくれた。
具体的なデータとして、治療開始前に患者に提供できるのは、実地臨床に携わる者としてはありがたい。
本治療を適用する機会はそれほど多くないかもしれないが、末梢神経障害の不快な有害事象を回避しつつ、胸水制御・腫瘍縮小を積極的に狙いたい際には有力な治療選択肢になるだろう。
企画立案時は、なんちゅう高コスト体質の臨床試験だと揶揄されていた。
しかし、免疫チェックポイント阻害薬がこれだけ広く使われるようになってしまってから、コスト面では相対的にCOMPASS試験のインパクトがかすんでしまった。
これって、恐ろしいことだ。
PB群が生存期間を3ヶ月強伸ばすのに、追加でかかったコストは2,600,000円くらいだが、プラチナ併用化学療法と、それに免疫チェックポイント阻害薬を併用した場合の上乗せコストは、こんなものでは済むまい。
日本人の進行非扁平上皮非小細胞肺がん患者を対象としてシスプラチン+ペメトレキセド併用化学療法→ペメトレキセド維持療法、いわゆるPARAMOUNTレジメンを施行した際の生存期間中央値は、確か24ヶ月を超えていたと思われる。
ベバシズマブ使用可能な患者が比較的予後良好群であろうことを考えると、無理にベバシズマブを使わなくてもいいような気がする。
じゃあ免疫チェックポイント阻害薬もいらないのでは、と言いたいところだが、こちらは長期生存につながる可能性があるので、今後我が国の実地臨床における長期追跡調査を踏まえないと結論が出せない。
COMPASS試験は、企画立案から波乱含みで、さらには試験進行中にPointBreak試験やAVAPERL試験が全生存期間を延長できないことが明らかとなったという逆風が吹き、更には免疫チェックポイント阻害薬関連臨床試験の怒涛のごとき報告ラッシュに翻弄されつつも、なんとかこうして完遂できた。
お疲れさまでしたと申し上げたい。
後日、ECOG-ACRIN 5508試験も取り上げたい。
以下、気になった点をまとめておく。
・今回治療対象となった患者の背景(ベバシズマブ使用可能患者に限られているので、比較的予後良好な患者集団と考えていいだろう)で、全体の無増悪生存期間中央値が7.1ヶ月、全生存期間中央値が21.1ヶ月というのは、利便性や毒性、コストを考えると満足できるものなのか
→ベバシズマブ使用不可の患者でも適用できるカルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法のKEYNOTE-189試験における無増悪生存期間中央値は9.0ヶ月、全生存期間中央値は22.0ヶ月で、化学療法感受性の人種差を考慮すると、日本人ではさらに成績が良い可能性がある
http://oitahaiganpractice.junglekouen.com/e963871.html
・導入化学療法開始からの生存期間中央値の差は26.6ヶ月-23.4ヶ月=3.2ヶ月で、B群とPB群の維持療法にかかるコスト中央値の差は2,614,000円、ゆえに生存期間中央値を1ヶ月伸ばすのに要したコストは816,875円となる
→できれば、導入化学療法から維持療法まで含めたコストを、KEYNOTE-189レジメンと比較しておきたい
・維持療法開始後の治療関連死は、ペメトレキセド+ベバシズマブ併用療法群にしか出ていない
・COMPASS試験からの派生試験であるWJOG11218L/APPLE試験は、対照群としてアテゾリズマブ+ペメトレキセド+カルボプラチン併用療法、つまりIMpower132レジメンであるが、IMpower132試験が(physically and economically)toxic newであるアテゾリズマブをカルボプラチン+ペメトレキセド併用療法に加えたにもかかわらず主要評価項目の一つである全生存期間を達成できなかったのに、それを対照群に据えて説得力があるのか、そしてさらにtoxic newであるベバシズマブを加えたにもかかわらず、主要評価項目を無増悪生存期間にして、positive studyになったとしても果たして実地臨床に馴染んでいくのか
http://oitahaiganpractice.junglekouen.com/e968081.html
Randomized Phase III Study of Continuation Maintenance Bevacizumab With or Without Pemetrexed in Advanced Nonsquamous Non-Small-Cell Lung Cancer: COMPASS (WJOG5610L).
Seto et al., J Clin Oncol. 2019 Dec 27:JCO1901494. doi: 10.1200/JCO.19.01494. [Epub ahead of print]
背景:
非小細胞肺がん患者は、これまで維持療法により恩恵を被ってきた。今回のCOMPASS試験では、カルボプラチン+ペメトレキセド+ベバシズマブ併用化学療法後のベバシズマブ維持療法にペメトレキセド維持療法を上乗せする場合としない場合の有効性と安全性を評価した。
患者と方法:
EGFR遺伝子変異(Exon19欠失変異 / Exon21L858R点変異)を伴わない未治療進行非扁平上皮非小細胞肺がん患者を対象とし、一次治療としてカルボプラチン6AUC、ペメトレキセド500mg/㎡、ベバシズマブ15mg/kg併用療法を3週間間隔で4コース行った。この導入療法の間に病勢進行を認めなかった患者を、以下のPB群、B群に1:1の比率で無作為に割り付けた。PB群ではペメトレキセド500mg/㎡とベバシズマブ15mg/kgを、B群ではベバシズマブ15mg/kgを、3週間間隔で病勢進行もしくは忍容不能の毒性が発現するまで継続投与した。主要評価項目は、無作為割り付け後の全生存期間とした。

結果:
2010年9月から2015年9月までの間に、907人の患者が導入療法を受けた。そのうち、599人が無作為割付の対象となった。298人がPB群に、301人がB群に割り付けられた。無作為割り付けからの全生存期間中央値は、PB群23.3ヶ月、B群19.6ヶ月だった(ハザード比0.87、95%信頼区間は0.73-1.05、片側ログランク検定におけるp値=0.069)。EGFR遺伝子が野生型だったサブグループにおいては、全生存期間のハザード比は0.82(95%信頼区間は0.68-0.99、片側ログランク検定におけるp値=0.020)だった。無増悪生存期間中央値はPB群5.7ヶ月、B群4.0ヶ月(ハザード比0.67、95%信頼区間は0.57-0.79、ログランク両側検定におけるp値は<0.001)だった。毒性については、同様の治療を扱った過去の報告とかわりなかった。




結論:
主要評価項目である全生存期間について、PB群で統計学的に有意な改善は認められなかった。しかしながら、無増悪生存期間と野生型EGFRの患者群における全生存期間はPB群で延長していた。
本文より:
・プラチナ併用化学療法は、分子標的療法や免疫チェックポイント阻害薬隆盛の現在にあっても、有効な治療選択肢のひとつである
・ドライバー遺伝子変異のない患者における化学療法+免疫チェックポイント阻害薬併用療法、あるいはドライバー遺伝子変異があっても、分子標的治療ののちに病勢進行に至った患者における化学療法といった活躍の場がある
・JMEN試験において、ペメトレキセドのswitchメンテナンス療法の有効性が、PARAMOUNT試験において、ペメトレキセドのcontinuationメンテナンス療法の有効性が示された。
・AVAPERL試験では、シスプラチン+ペメトレキセド+ベバシズマブ併用療法後のペメトレキセド+ベバシズマブ維持療法により、ベバシズマブ維持療法と比較して無増悪生存期間が延長することが示されたが、シスプラチンが実地臨床であまり用いられないため普及しなかった
・今回のCOMPASS試験を企画立案した時点では、まだPARAMAOUNT試験の結果は文献化されておらず、ペメトレキセド維持療法も普及していなかった
・PointBreak試験では、カルボプラチン+ペメトレキセド+ベバシズマブ併用療法後のペメトレキセド+ベバシズマブ維持療法とカルボプラチン+パクリタキセル+ベバシズマブ併用療法後のベバシズマブ維持療法が比較され、有意な無増悪生存期間の延長と神経毒性、脱毛の有害事象軽減が示されたが、全生存期間の延長には至らなかった
・ECOG5508試験では、カルボプラチン+パクリタキセル+ベバシズマブ併用療法後のペメトレキセド+ベバシズマブ維持療法、ベバシズマブ維持療法、ペメトレキセド維持療法が比較され、ペメトレキセド+ベバシズマブ維持療法で無増悪生存期間の有意な延長を認めたものの、全生存期間の有意な延長は得られなかった
・ECOG5508試験ではペメトレキセド+ベバシズマブのswitchメンテナンス療法の有効性が検証された一方で、今回のCOMPASS試験ではペメトレキセド+ベバシズマブのcontinuationメンテナンス療法の有効性を検証した
・COMPASS試験は、当初はECOG5508試験と同様に、導入療法後のペメトレキセド+ベバシズマブ維持療法、ベバシズマブ維持療法、ペメトレキセド維持療法の3群の有効性を比較するコンセプトとして立案した
・最終的には、ECOG4599試験におけるベバシズマブ維持療法が全生存期間を延長したことの歴史的意義を鑑みて、ベバシズマブ維持療法にペメトレキセドを上乗せすることで生命予後の改善が得られるかを検証するコンセプトとし、ペメトレキセド+ベバシズマブ維持療法、ベバシズマブ維持療法の2群を比較することになった
・適格条件は20歳以上、化学療法未治療、病理組織診/細胞診で局所進行/進行/術後再発非扁平上皮非小細胞肺がんと診断されている、RECIST1.1における測定可能病変を有する、ECOG-PSが0か1である、骨髄・肝・腎機能が保たれている、とした
・無症候性、あるいは治療後で、ステロイド投与を必要としない脳転移症例は登録可能とした
・扁平上皮がんを含むもの、血痰があるもの、コントロール不良の高血圧患者、感受性EGFR遺伝子変異を有する患者は除外した
・割付調整因子は治療施設、組織型、導入療法後の腫瘍縮小効果とした
・効果判定は、導入療法中は2コース後と4コース後に、維持療法中は、当初6か月間は6週間ごとに、以後は12週ごとに行った
・性別、PS、導入療法後の腫瘍縮小効果、組織型、病期、年齢、EGFR遺伝子変異の状態、喫煙歴について、サブグループ解析を行うこととした
・主要評価項目は、無作為割り付け後の全生存期間とした
・副次評価項目は、無作為割り付け後の無増悪生存期間、導入療法開始後の全生存期間と無増悪生存期間、安全性とした
・全生存期間解析において、620人の無作為割り付け患者が必要で、85%の検出率、有意水準0.05の片側検定、全生存期間中央値がB群で13ヶ月、PB群で16.5ヶ月、ハザード比換算で0.787の条件では507件の死亡イベントが必要だった
・当初は導入療法から維持療法へ移行する患者の割合を80%と見込み、775人を導入療法へ組み込む必要があると見積もっていた
・実際には、維持療法へ移行する患者の割合は66.0%で、結局907人を導入療法へ組み込むことになった
・2010年9月から2015年9月にかけて、907人の患者を71施設から登録した
・907人のうち、895人が導入化学療法を開始した
・導入化学療法開始後に、不適格例や不適切な治療前インフォームドコンセント確認例が、計39人発覚したため、導入化学療法開始時点での解析対象は856人となった
・導入化学療法を完遂し、維持療法開始対象となった患者は、599人だった
・維持療法を開始できなかった患者を除外して、維持療法開始時点での解析対象は594人(B群295人、PB群299人)だった
・データカットオフ時点で、594人全てで維持療法が終了していた
・維持療法施行中央値は、B群で4.0コース(1-36コース)、PB群で6.0コース(1-63コース)だった
・維持療法中に病勢進行によりプロトコール治療終了となったのは、B群で226人(76.6%)、PB群で203人(67.9%)だった
・維持療法中に毒性によりプロトコール治療終了となったのは、B群で59人(19.7%)、PB群で60人(20.3%)だった
・病勢進行、毒性中止のいずれの理由でもなく治療終了となったのは、B群で10人(3.4%)、PB群で36人(12%)で、この36人中23人(7.7%)は(経済的な理由で)患者の意思により終了していた
・プロトコール治療終了後、二次治療以降の治療を受けたのはB群で268人(90.8%)、PB群で251人(83.9%)だった
・後治療で免疫チェックポイント阻害薬を使用したのは、全体の12.5%にのぼった
・二次治療まで行った患者は、全体の87.4%にのぼった
・三次治療まで行った患者は、全体の61.3%にのぼった
・四次治療まで行った患者は、全体の40.6%にのぼった
・経過観察期間中央値は、導入化学療法開始時点からでは63.3ヶ月、二次治療開始時点からでは59.9ヶ月だった
・維持療法開始に至った患者594人のうち、経過観察期間内に470人が死亡していた
・維持療法開始時点からの生存期間中央値はB群で19.6ヶ月、PB群で23.3ヶ月だった(ハザード比0.87、95%信頼区間0.73-1.05、p=0.069)
・維持療法開始時点からの無増悪生存期間中央値はB群で4.0ヶ月、PB群で5.7ヶ月だった(ハザード比0.67、95%信頼区間0.57-0.79、p<0.001)
・EGFR野生型の患者のみを解析対象としたところ、維持療法開始時点からの生存期間中央値はB群で18.8ヶ月、PB群で23.3ヶ月だった(ハザード比0.82、95%信頼区間0.68-0.99、p=0.020)
・維持療法開始対象となった患者の、導入化学療法開始時点からの生存期間中央値は、B群で23.4ヶ月、PB群で26.6ヶ月、無増悪生存期間中央値は、B群で7.3ヶ月、PB群で9.0ヶ月だった
・導入化学療法の対象となった856人を対象に導入化学療法開始時点からの解析をすると、生存期間中央値は21.1ヶ月、無増悪生存期間中央値は7.1ヶ月だった
・導入化学療法開始から維持療法開始までの間に、治療関連死を5人認めた(間質性肺炎3人、呼吸器感染症2人)
・維持療法中には、PB群においてのみ治療関連死を4人認めた(間質性肺炎2人、肺胞出血1人、呼吸器感染症1人)
・維持療法にかかるコストの中央値はB群で1,917,000円(四分位区間は901,000-3,505,000円)で、PB群では4,531,000円(四分位区間は1,986,000-8,463,000円)だった
・現在、PB群の治療にアテゾリズマブを絡め、免疫チェックポイント阻害薬の追加効果を検証するWJOG11218L/APPLE試験が我が国で進行中である
→ベバシズマブ使用可能な進行非扁平上皮非小細胞肺がん患者を対象に、アテゾリズマブ+ペメトレキセド+カルボプラチン併用療法後のアテゾリズマブ+ペメトレキセド維持療法群(APP群)とアテゾリズマブ+ペメトレキセド+カルボプラチン+ベバシズマブ併用療法後のアテゾリズマブ+ペメトレキセド+カルボプラチン+ベバシズマブ維持療法群(APPB群)を比較する第III相臨床試験で、主要評価項目は無増悪生存期間
2020年01月18日
KEYNOTE-604試験・・・どう受け止めるか
進展型小細胞肺がんの領域に、アテゾリズマブだけでなくペンブロリズマブも分け入ってきた。
本当にこの2つの薬は競合する。
既に実地臨床で使われているアテゾリズマブ+カルボプラチン+エトポシド併用療法は、IMpower133試験の結果に基づいている。
http://oitahaiganpractice.junglekouen.com/e966769.html
http://oitahaiganpractice.junglekouen.com/e961932.html
http://oitahaiganpractice.junglekouen.com/e943506.html
今回のKEYNOTE-604試験、ハザード比と95%信頼区間を見ると、無増悪生存期間、全生存期間いずれも統計学的有意に延長しているように見える。
しかし実際には、事前に設定した有意水準を達成したのは無増悪生存期間のみで、全生存期間では達成できなかったらしい。
主要評価項目を複数としたが故の悩ましい結論なのだろう。
いまだプレスリリースの段階ではあるが、今後詳細なデータが示されるのを待ちたい。
以下、MSD社の2020年01月15日付のプレスリリースから抜粋。
KEYTRUDA®(ペムブロリズマブ)、
進展型小細胞肺がんの初回治療において化学療法との併用療法が
化学療法単独と比較して無増悪生存期間を有意に改善
第3相KEYNOTE-604試験のもう一つの主要評価項目である全生存期間は
統計学的には有意な改善を認めず
データは今後の医学学会で発表予定
2020年1月6日 ニュージャージー州ケニルワース ― Merck & Co., Inc., Kenilworth, N.J., U.S.A.(米国とカナダ以外ではMSD)は本日、進展型小細胞肺がん(ES-SCLC)患者の初回治療において、抗PD-1抗体KEYTRUDA®(一般名:ペムブロリズマブ)と化学療法との併用療法が第3相KEYNOTE-604試験における二つの主要評価項目の一つである無増悪生存期間(PFS)を延長したことを発表しました。この試験で、KEYTRUDA®と化学療法(エトポシド+シスプラチンまたはカルボプラチン)の併用療法では、前回の中間解析で、化学療法単独と比較してPFSが統計学的に有意に改善しました(HR=0.75 [95% CI, 0.61-0.91])。この試験の最終解析で、KEYTRUDA®と化学療法の併用療法では化学療法単独と比較して全生存期間(OS)も延長しましたが、事前に設定された解析計画としては統計学的に有意な改善が示されませんでした(HR=0.80 [95% CI, 0.64-0.98])。本試験におけるKEYTRUDA®の安全性プロファイルは、これまでに報告されている試験の結果と一貫していました。この結果は今後の医学学会で発表するとともに、規制当局と協議を進めます。
・KEYNOTE-604試験について
KEYNOTE-604試験は、新たにES-SCLCと診断された患者を対象としてKEYTRUDA®と化学療法の併用療法を化学療法単独と比較する無作為化二重盲検プラセボ対照第3相試験です(ClinicalTrials.gov, NCT03066778)。二つの主要評価項目はOSおよびPFSでした。副次評価項目は、客観的奏効率(ORR)、奏効期間(DOR)、安全性、QoL(quality of life、生活の質)などでした。この試験では登録患者453名を次のいずれかに無作為に割り付けました。
KEYTRUDA®(200 mg固定用量を各21日サイクルの初日に投与)およびエトポシド(100 mg/m2を初日、2日目、3日目に投与)および治験責任医師が選択するプラチナ製剤(カルボプラチンAUC 5を初日に投与またはシスプラチン75 mg/m2を初日に投与)
プラセボおよびエトポシド(100 mg/m2を初日、2日目、3日目に投与)および治験責任医師が選択するプラチナ製剤(カルボプラチンAUC 5 mg/mL/分を初日に投与またはシスプラチン75 mg/m2を初日に投与)
本当にこの2つの薬は競合する。
既に実地臨床で使われているアテゾリズマブ+カルボプラチン+エトポシド併用療法は、IMpower133試験の結果に基づいている。
http://oitahaiganpractice.junglekouen.com/e966769.html
http://oitahaiganpractice.junglekouen.com/e961932.html
http://oitahaiganpractice.junglekouen.com/e943506.html
今回のKEYNOTE-604試験、ハザード比と95%信頼区間を見ると、無増悪生存期間、全生存期間いずれも統計学的有意に延長しているように見える。
しかし実際には、事前に設定した有意水準を達成したのは無増悪生存期間のみで、全生存期間では達成できなかったらしい。
主要評価項目を複数としたが故の悩ましい結論なのだろう。
いまだプレスリリースの段階ではあるが、今後詳細なデータが示されるのを待ちたい。
以下、MSD社の2020年01月15日付のプレスリリースから抜粋。
KEYTRUDA®(ペムブロリズマブ)、
進展型小細胞肺がんの初回治療において化学療法との併用療法が
化学療法単独と比較して無増悪生存期間を有意に改善
第3相KEYNOTE-604試験のもう一つの主要評価項目である全生存期間は
統計学的には有意な改善を認めず
データは今後の医学学会で発表予定
2020年1月6日 ニュージャージー州ケニルワース ― Merck & Co., Inc., Kenilworth, N.J., U.S.A.(米国とカナダ以外ではMSD)は本日、進展型小細胞肺がん(ES-SCLC)患者の初回治療において、抗PD-1抗体KEYTRUDA®(一般名:ペムブロリズマブ)と化学療法との併用療法が第3相KEYNOTE-604試験における二つの主要評価項目の一つである無増悪生存期間(PFS)を延長したことを発表しました。この試験で、KEYTRUDA®と化学療法(エトポシド+シスプラチンまたはカルボプラチン)の併用療法では、前回の中間解析で、化学療法単独と比較してPFSが統計学的に有意に改善しました(HR=0.75 [95% CI, 0.61-0.91])。この試験の最終解析で、KEYTRUDA®と化学療法の併用療法では化学療法単独と比較して全生存期間(OS)も延長しましたが、事前に設定された解析計画としては統計学的に有意な改善が示されませんでした(HR=0.80 [95% CI, 0.64-0.98])。本試験におけるKEYTRUDA®の安全性プロファイルは、これまでに報告されている試験の結果と一貫していました。この結果は今後の医学学会で発表するとともに、規制当局と協議を進めます。
・KEYNOTE-604試験について
KEYNOTE-604試験は、新たにES-SCLCと診断された患者を対象としてKEYTRUDA®と化学療法の併用療法を化学療法単独と比較する無作為化二重盲検プラセボ対照第3相試験です(ClinicalTrials.gov, NCT03066778)。二つの主要評価項目はOSおよびPFSでした。副次評価項目は、客観的奏効率(ORR)、奏効期間(DOR)、安全性、QoL(quality of life、生活の質)などでした。この試験では登録患者453名を次のいずれかに無作為に割り付けました。
KEYTRUDA®(200 mg固定用量を各21日サイクルの初日に投与)およびエトポシド(100 mg/m2を初日、2日目、3日目に投与)および治験責任医師が選択するプラチナ製剤(カルボプラチンAUC 5を初日に投与またはシスプラチン75 mg/m2を初日に投与)
プラセボおよびエトポシド(100 mg/m2を初日、2日目、3日目に投与)および治験責任医師が選択するプラチナ製剤(カルボプラチンAUC 5 mg/mL/分を初日に投与またはシスプラチン75 mg/m2を初日に投与)
2020年01月17日
高齢進行非小細胞肺癌の治療に関する、セカンドオピニオン・・・?
コメント欄で、相談を受けた。
患者さん、ご家族からのセカンドオピニオンだったらこの場ではお引き受けしないのだが、今回はどうも若手の先生からのご様子。
こんなのもセカンドオピニオンというんだろうか。
少しでもお力になれれば、この先生のモチベーション向上につながればと思い、私のわかる範囲で考えを述べさせていただいた。
個人情報保護の観点からは問題なさそうだと判断し、参考になるように1本の記事にまとめておく。
http://oitahaiganpractice.junglekouen.com/e873583.html
Posted by 駆け出し腫瘍内科医 at 2020年01月16日 10:58
こんにちは。いつもお疲れ様です。
TS-1は何も治療薬が無い人に使うもので、効果はあまり無いと思っていて今まで避けてきました。
この記事を読んで、考えを変える機会になります。
高齢で非小細胞肺がん、EGFRuncommonでTKIやICIの効果が見込めずに治療に行き詰まってしまいました。
なかなかエビデンスのない治療は出来ない環境に身を置いており、悩んでしまいました。
全く治療を諦めていない、頑張りたいとおっしゃるこの方に使う価値はありますでしょうか?
他のレジメンのお考えもお聞かせ下さいませんか?
ご本人もご家族もゼロではないなら可能性に賭けたいと言われています。
私も何とか生存期間を延ばしてあげたいのです。
駆け出し腫瘍内科医さんへ
コメントありがとうございます。
先生のように、この領域を自分の生業として選び、患者さんとともに歩んでくださる方が、私の備忘録を参考にしてくださって、とても光栄です。
まず、高齢であっても、理解力があり、治療意欲があり、PSがよく、治療中のリスク管理ができる方であれば、積極的に治療を考えて差し上げるべきだと思います。
まず、この方が初回治療という前提で記載します。
文面から、非小細胞肺癌(NOS, not otherwise specified)、EGFRはwild typeではなく、uncommon mutationが認められたということですね。
uncommon mutationの詳細が分かりませんが、少なくともアファチニブやオシメルチニブを試してみる可能性はあると受け止めましたが、いかがでしょうか。
http://oitahaiganpractice.junglekouen.com/e752613.html
http://oitahaiganpractice.junglekouen.com/e923314.html
http://oitahaiganpractice.junglekouen.com/e968312.html
また、ICIを検討すべき局面もあるかも知れませんので、組織検体が残っていればKRAS遺伝子変異やTPSは検索しておいた方がよいかもしれません。
http://oitahaiganpractice.junglekouen.com/e968478.html
臓器機能が保たれており、PSが良ければ、CBDCA+PEM併用化学療法も一つの選択肢です。
http://oitahaiganpractice.junglekouen.com/e957732.html
単剤療法であれば、高齢者進行非小細胞肺癌の標準治療はドセタキセル単剤で、その他にビノレルビン単剤、ジェムシタビン単剤も選択肢に挙がります。肺がん診療ガイドラインにも記載されているはずです。
ドセタキセル単剤はビノレルビン単剤に対して、我が国発の臨床試験において優越性を示しています。
既にドセタキセル単剤治療はやった後で、二次治療を考えているということであれば、S-1を考えてもいいと思います。
若年肺がんの世界(これは個人的な見解ですが、非小細胞肺癌患者の年齢中央値が75歳を超え、これからも高齢化が進むことを考えると、75歳以上が多数派、75歳以下が若年肺がんというサブグループと捉えた方がしっくりくるような気がします)では、ドセタキセルは二次治療でラムシルマブと併用されることが多くなっており、S-1やICIとの関係性も相俟って、単剤治療としての意義が薄れつつあります。
そろそろ、75歳以上のpopulationにおける初回治療として、S-1がDOCに置き換わってもいい時代が来ているように思います。
S-1を使用されるのであれば、有害事象発生には他の殺細胞性抗腫瘍薬同様にきちんと目を配ってください。
私が初めてS-1を使用している患者に触れたのは、結核療養所に勤務していた時でした。
胃癌の治療としてS-1を服用していた50代の女性患者が肺結核を合併して、私が担当医として治療しました。
骨髄抑制は、同系列のUFTよりは強く、点滴の殺細胞性抗腫瘍薬よりは弱いという印象です。
こんな人もいました。
cT2bN0M1a(悪性胸水)の肺扁平上皮がんの患者さん。診断当時は80代半ばで、劇的にS-1初回治療が効いたものの、薬剤性肺障害でS-1を中止せざるを得なくなりました。その後も頑張っておられ、最近4th line アテゾリズマブ④コースでPDとなったものの、診断からの全生存期間は1900日を超え、昨年秋には90歳の誕生日を迎えられました。
随分昔に、こんな記事を書いたこともありました。
参考にしてください。
http://oitahaiganpractice.junglekouen.com/e790212.html
記事並みに長々と書いてしまってスミマセン。
参考にしてください。
他の方の参考になるように、1件の記事にまとめさせていただきます。
患者さん、ご家族からのセカンドオピニオンだったらこの場ではお引き受けしないのだが、今回はどうも若手の先生からのご様子。
こんなのもセカンドオピニオンというんだろうか。
少しでもお力になれれば、この先生のモチベーション向上につながればと思い、私のわかる範囲で考えを述べさせていただいた。
個人情報保護の観点からは問題なさそうだと判断し、参考になるように1本の記事にまとめておく。
http://oitahaiganpractice.junglekouen.com/e873583.html
Posted by 駆け出し腫瘍内科医 at 2020年01月16日 10:58
こんにちは。いつもお疲れ様です。
TS-1は何も治療薬が無い人に使うもので、効果はあまり無いと思っていて今まで避けてきました。
この記事を読んで、考えを変える機会になります。
高齢で非小細胞肺がん、EGFRuncommonでTKIやICIの効果が見込めずに治療に行き詰まってしまいました。
なかなかエビデンスのない治療は出来ない環境に身を置いており、悩んでしまいました。
全く治療を諦めていない、頑張りたいとおっしゃるこの方に使う価値はありますでしょうか?
他のレジメンのお考えもお聞かせ下さいませんか?
ご本人もご家族もゼロではないなら可能性に賭けたいと言われています。
私も何とか生存期間を延ばしてあげたいのです。
駆け出し腫瘍内科医さんへ
コメントありがとうございます。
先生のように、この領域を自分の生業として選び、患者さんとともに歩んでくださる方が、私の備忘録を参考にしてくださって、とても光栄です。
まず、高齢であっても、理解力があり、治療意欲があり、PSがよく、治療中のリスク管理ができる方であれば、積極的に治療を考えて差し上げるべきだと思います。
まず、この方が初回治療という前提で記載します。
文面から、非小細胞肺癌(NOS, not otherwise specified)、EGFRはwild typeではなく、uncommon mutationが認められたということですね。
uncommon mutationの詳細が分かりませんが、少なくともアファチニブやオシメルチニブを試してみる可能性はあると受け止めましたが、いかがでしょうか。
http://oitahaiganpractice.junglekouen.com/e752613.html
http://oitahaiganpractice.junglekouen.com/e923314.html
http://oitahaiganpractice.junglekouen.com/e968312.html
また、ICIを検討すべき局面もあるかも知れませんので、組織検体が残っていればKRAS遺伝子変異やTPSは検索しておいた方がよいかもしれません。
http://oitahaiganpractice.junglekouen.com/e968478.html
臓器機能が保たれており、PSが良ければ、CBDCA+PEM併用化学療法も一つの選択肢です。
http://oitahaiganpractice.junglekouen.com/e957732.html
単剤療法であれば、高齢者進行非小細胞肺癌の標準治療はドセタキセル単剤で、その他にビノレルビン単剤、ジェムシタビン単剤も選択肢に挙がります。肺がん診療ガイドラインにも記載されているはずです。
ドセタキセル単剤はビノレルビン単剤に対して、我が国発の臨床試験において優越性を示しています。
既にドセタキセル単剤治療はやった後で、二次治療を考えているということであれば、S-1を考えてもいいと思います。
若年肺がんの世界(これは個人的な見解ですが、非小細胞肺癌患者の年齢中央値が75歳を超え、これからも高齢化が進むことを考えると、75歳以上が多数派、75歳以下が若年肺がんというサブグループと捉えた方がしっくりくるような気がします)では、ドセタキセルは二次治療でラムシルマブと併用されることが多くなっており、S-1やICIとの関係性も相俟って、単剤治療としての意義が薄れつつあります。
そろそろ、75歳以上のpopulationにおける初回治療として、S-1がDOCに置き換わってもいい時代が来ているように思います。
S-1を使用されるのであれば、有害事象発生には他の殺細胞性抗腫瘍薬同様にきちんと目を配ってください。
私が初めてS-1を使用している患者に触れたのは、結核療養所に勤務していた時でした。
胃癌の治療としてS-1を服用していた50代の女性患者が肺結核を合併して、私が担当医として治療しました。
骨髄抑制は、同系列のUFTよりは強く、点滴の殺細胞性抗腫瘍薬よりは弱いという印象です。
こんな人もいました。
cT2bN0M1a(悪性胸水)の肺扁平上皮がんの患者さん。診断当時は80代半ばで、劇的にS-1初回治療が効いたものの、薬剤性肺障害でS-1を中止せざるを得なくなりました。その後も頑張っておられ、最近4th line アテゾリズマブ④コースでPDとなったものの、診断からの全生存期間は1900日を超え、昨年秋には90歳の誕生日を迎えられました。
随分昔に、こんな記事を書いたこともありました。
参考にしてください。
http://oitahaiganpractice.junglekouen.com/e790212.html
記事並みに長々と書いてしまってスミマセン。
参考にしてください。
他の方の参考になるように、1件の記事にまとめさせていただきます。
Posted by tak at
12:20
│Comments(0)
│高齢者肺癌│遺伝子変異│個別化医療│分子標的薬・抗体医薬│有害事象│化学療法│免疫チェックポイント阻害薬│セカンドオピニオン・個別相談に関して
2020年01月15日
みんな、初診時の胸部レントゲン写真くらい、ちゃんと撮ろうよ
ここ数年というもの、ずっと感じている。
CTを撮影しても、胸部レントゲン写真を撮影しない医者が多くなった。
別に、風邪をひいて受診した患者全員で胸部レントゲン写真を撮ろうというのではない。
しかし、肺がんの疑いがある患者を診療しようというのに、胸部レントゲン写真すら撮影しないのはいかがなものだろう。
私のように、20世紀末に医者になったような輩は、胸部レントゲン写真ひとつにしても、技術革新のただなかを生きてきた。
医者になりたての頃は、胸部レントゲン写真は「シャウカステンにフィルムを掲げて」見るものだった。
CTはすでに普及していたが、まだ高精細のHRCT(high resolution CT、もはや死語かも)の黎明期にあった。
研修医の頃は、丈夫なボール紙で作られた重たいフィルム袋を、患者の数だけ抱えてカンファレンスルームに赴いていたものだ。
レントゲン読影技術というのは実地で人に教わらないと身につきにくい。
茶道のお手前のように、レントゲン写真を正しく読影するための手順がある。
「そもそも、このレントゲン写真は適正に撮影されたものか」というところから始めなければならない。
適正な条件でなければ、放射線部に再撮影を依頼するのだ。
そのくらい、読影の質にこだわるように教わった。
宮崎の病院に勤務していたころ、副院長の放射線科医の先生は、一般内科としても業務をこなしていた。
胸部レントゲン写真1枚読影するのに30分もかけて、診療が回るわけないじゃん、と外来看護師は陰口をたたいていた。
そのくらい、昔気質のエキスパートは、胸部レントゲン写真1枚を読影するのにも全身全霊を傾けていたのだ。
今となっては、全ての放射線検査画像が、モニター上で見るものとなった。
読影に適正な写真のサイズ、というものを、果たしてどれくらいの医師が意識しながら仕事をしているだろうか。
胸部レントゲン写真の微妙なニュアンスというものは、モニターでは到底表現しきれないだろうと、私は思っている。
修業時代に部長のN先生から直接胸部レントゲン写真の読影をご教示いただけたのは、得難い経験だった。
夜な夜な画像読影室で落ち合って、シャウカステンの光に照らされながら部長と二人きりでその日の画像について議論する、そんな日々だった。
胸部レントゲン写真一枚で、肺がんの進行期と診断できることもある。
胸水貯留を伴っているとか、明らかな両側肺転移を認めるとかなら、誰でもわかる。
私がシビれたのは、末梢の孤立結節影のみで、リンパ節腫大や胸水の所見もない写真を見て、上司が進行期肺がんと断言したときだった。
「ほら、見てごらん、ここの肋骨の輪郭が見えなくなってるでしょ。こりゃ溶骨性の骨転移だよ。残念だけど、進行期だね。」
とのこと。
後日CTを撮影したところ、果たして当の肋骨には溶骨性骨転移があった。
肺がん診療において、胸部レントゲン写真というのは、その患者の病状のありよう、進行の様を雄弁に物語る。
過去の写真との比較をしながら経過説明をするにあたって、患者・家族にとってはCTよりも遥かに分かりやすい。
そして、初診時の胸部レントゲン写真というのは、まさにそのときに撮っておかないと取り返しがつかない。
検査や治療のために変化が加わると、もともと初診時はどうだったのか、ということが検証できなくなる。
経過の早い肺癌なら、初診からたった2週間経過していても、初診時とはガラッと変わった雰囲気になっていることは十二分にあり得る。
一定の肺がん診療経験のある臨床医なら、誰しも心当たりがあるだろう。
無駄な放射線被爆を避けたい、というのなら、無駄なCT撮影を減らすべきだ。
長期間にわたりCTのみで経過観察されている肺がん患者を診ると、本当にそう思う。
CTを撮影しても、胸部レントゲン写真を撮影しない医者が多くなった。
別に、風邪をひいて受診した患者全員で胸部レントゲン写真を撮ろうというのではない。
しかし、肺がんの疑いがある患者を診療しようというのに、胸部レントゲン写真すら撮影しないのはいかがなものだろう。
私のように、20世紀末に医者になったような輩は、胸部レントゲン写真ひとつにしても、技術革新のただなかを生きてきた。
医者になりたての頃は、胸部レントゲン写真は「シャウカステンにフィルムを掲げて」見るものだった。
CTはすでに普及していたが、まだ高精細のHRCT(high resolution CT、もはや死語かも)の黎明期にあった。
研修医の頃は、丈夫なボール紙で作られた重たいフィルム袋を、患者の数だけ抱えてカンファレンスルームに赴いていたものだ。
レントゲン読影技術というのは実地で人に教わらないと身につきにくい。
茶道のお手前のように、レントゲン写真を正しく読影するための手順がある。
「そもそも、このレントゲン写真は適正に撮影されたものか」というところから始めなければならない。
適正な条件でなければ、放射線部に再撮影を依頼するのだ。
そのくらい、読影の質にこだわるように教わった。
宮崎の病院に勤務していたころ、副院長の放射線科医の先生は、一般内科としても業務をこなしていた。
胸部レントゲン写真1枚読影するのに30分もかけて、診療が回るわけないじゃん、と外来看護師は陰口をたたいていた。
そのくらい、昔気質のエキスパートは、胸部レントゲン写真1枚を読影するのにも全身全霊を傾けていたのだ。
今となっては、全ての放射線検査画像が、モニター上で見るものとなった。
読影に適正な写真のサイズ、というものを、果たしてどれくらいの医師が意識しながら仕事をしているだろうか。
胸部レントゲン写真の微妙なニュアンスというものは、モニターでは到底表現しきれないだろうと、私は思っている。
修業時代に部長のN先生から直接胸部レントゲン写真の読影をご教示いただけたのは、得難い経験だった。
夜な夜な画像読影室で落ち合って、シャウカステンの光に照らされながら部長と二人きりでその日の画像について議論する、そんな日々だった。
胸部レントゲン写真一枚で、肺がんの進行期と診断できることもある。
胸水貯留を伴っているとか、明らかな両側肺転移を認めるとかなら、誰でもわかる。
私がシビれたのは、末梢の孤立結節影のみで、リンパ節腫大や胸水の所見もない写真を見て、上司が進行期肺がんと断言したときだった。
「ほら、見てごらん、ここの肋骨の輪郭が見えなくなってるでしょ。こりゃ溶骨性の骨転移だよ。残念だけど、進行期だね。」
とのこと。
後日CTを撮影したところ、果たして当の肋骨には溶骨性骨転移があった。
肺がん診療において、胸部レントゲン写真というのは、その患者の病状のありよう、進行の様を雄弁に物語る。
過去の写真との比較をしながら経過説明をするにあたって、患者・家族にとってはCTよりも遥かに分かりやすい。
そして、初診時の胸部レントゲン写真というのは、まさにそのときに撮っておかないと取り返しがつかない。
検査や治療のために変化が加わると、もともと初診時はどうだったのか、ということが検証できなくなる。
経過の早い肺癌なら、初診からたった2週間経過していても、初診時とはガラッと変わった雰囲気になっていることは十二分にあり得る。
一定の肺がん診療経験のある臨床医なら、誰しも心当たりがあるだろう。
無駄な放射線被爆を避けたい、というのなら、無駄なCT撮影を減らすべきだ。
長期間にわたりCTのみで経過観察されている肺がん患者を診ると、本当にそう思う。
2020年01月12日
METエクソン14スキッピング変異に対する治療開発のその後・・・CapmatinibとTepotinib
METエクソン14スキッピング変異にクリゾチニブが効く、という話題を取り上げて、はや3年が経過した。
http://oitahaiganpractice.junglekouen.com/e888165.html
2019年のASCOで、ほかにもCapmatinibやTepotinibが効く、という発表があった。
忘れないように取り上げておく。
以下を見る限り、クリゾチニブと比較して、遥かにMETエクソン14スキッピング変異による産物への阻害活性が高い薬たちのようだ。

出現頻度は肺腺がんの3-4%ということだから、ALK融合遺伝子陽性患者の割合と遜色ない。
これら両者で、最大8%となると、無視してはならない割合だ。
ROS1やBRAF-V600Eなどより、METエクソン14skipの方が優先度合いが高くなりそうだ。
九州がんセンターから立案された、本遺伝子変異を有する患者に対するクリゾチニブの効果・安全性を検討するCo-MET試験も、すでに患者登録は終了していると聞く。
そろそろ、本遺伝子変異に対しても、実地臨床で診断・治療の道が開かれる頃だろうか。
Capmatinib (INC280) in METΔex14-mutated advanced non-small cell lung cancer (NSCLC): Efficacy data from the phase II GEOMETRY mono-1 study.
Juergen Wolf. et al., 2019 ASCO Annual Meeting Abst. #9004
背景:
Capmatinibは高い活性を有する選択的MET阻害薬である。GEOMETRY mono-1試験のこれまでのデータから、METエクソン14スキッピング変異を有する非小細胞肺がん患者において臨床的意義のある奏効割合と対応可能な毒性プロファイルが明らかになっている(コホート4は1-2レジメンの治療歴のある患者集団で、コホート5bは治療歴のない患者集団だが、とりわけコホート5bでは奏効割合が高かった)。今回は、奏効持続期間と無増悪生存期間に関する結果を提示する。
方法:
GEOMETRY mono-1は第II相、マルチコホートの、多施設共同臨床試験である。METエクソン14スキッピング変異もしくはMET遺伝子増幅を有する進行非小細胞肺がんの患者6コホートを対象に、Capmatinibの効果を評価するのが目的である。適格基準は、18歳以上、ECOG-PS 0-1、ALK融合遺伝子あるいはEGFR遺伝子変異いずれも陰性、stage IIIB/IVとした。METエクソン14スキッピング変異を有する患者が(MET遺伝子増幅の状態とは関係なく)コホート4あるいはコホート5bに割り付けられ、Capmatinib 400mgを1日2回服用した。主要評価項目は奏効割合とした。主な副次評価項目は奏効持続期間とした。
結果:
2018年11月08日までに、METエクソン14スキッピング変異を有する患者97人(コホート4 69人、コホート5b 28人)が治療効果の評価が可能な状態にあった。コホート4における奏効割合は39.1%(95%信頼区間は27.6-51.6%)で、コホート5bにおける奏効割合は71.4%(51.3-86.8%)だった。今回の解析を行った段階ではまだデータは未成熟であったが、治療効果の持続性については期待できる効果が得られた。奏効持続期間中央値はコホート4で9.72ヶ月(95%信頼区間は4.27-11.14ヶ月)、コホート5bで8.41ヶ月(95%信頼区間は5.55-未到達)だった。無増悪生存期間中央値はコホート4で5.42ヶ月(95%信頼区間は4.17-6.97ヶ月)、コホート5bで9.13(95%信頼区間は5.52-13.86ヶ月)だった。安全性については、既報と特に変わりなかった。発現頻度が25%を超える、最も発現頻度が高く両コホートに共通する有害事象は、末梢浮腫(49.2%)、嘔気(43.2%)、嘔吐(28.3%)で、ほとんどの有害事象はGrade 1もしくは2だった。
結論:
CapmatinibはMET14スキッピング変異を持つ進行非小細胞肺がん患者の治療選択肢として、過去の治療歴に関わらず有望な治療選択肢である。


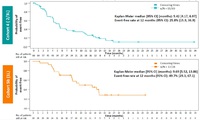

Phase II study of tepotinib in NSCLC patients with METex14 mutations.
Paul K. Paik.et al., 2019 ASCO Annual Meeting, Abst. #9005
背景:
非小細胞肺がんの3-4%に認められると報告されているMETエクソン14スキッピング変異は、腫瘍化に関わり、MET阻害薬に感受性で、リキッドバイオプシーで検出可能である。今回は現在進行中のtepotinib(高い選択性を有するMET阻害薬)に関する単アーム第II相臨床試験・・・リキッドバイオプシーもしくは生検によってMET14スキッピング変異陽性の非小細胞肺がんと診断された患者を対象とした臨床試験・・・について報告する。
方法:
EGFR遺伝子変異、ALK融合遺伝子陰性の進行非小細胞肺がん患者を対象に、リキッドバイオプシーでMET14スキッピング変異が確認された患者(集積目標は60人以上)あるいは生検でMET14スキッピング変異が確認された患者(集積目標は60人以上、リキッドバイオプシー陽性例との重複も予測して)を前向きに登録し、病勢進行・忍容不能の毒性・治療同意取り下げのいずれかに至るまでtepotinib 500mg1日1回を服用させた。主要評価項目は独立した評価委員会の評価による奏効割合、副次評価項目は担当医の評価による奏効割合と安全性とした。
結果:
これまでに、85人(リキッドバイオプシー群55人、生検群52人)の患者が本試験に登録された。2018年10月16日のデータカットオフ時点までに、リキッドバイオプシー群の中で評価可能だった患者35人において、奏効割合は委員会評価で51.4%、担当医評価で63.9%だった。同様に、生検群の中で評価可能だった41人において、奏効割合は委員会評価で41.5%、担当医評価で58.5%だった。奏効持続期間や、治療ラインごとの奏効割合は図表に示すとおりだった。有害事象について評価可能だった69人の患者において、10%以上の出現頻度で認められた有害事象は、末梢浮腫が47.8%、下痢が18.8%、嘔気が15.9%、衰弱が10.1%だった。Grade 4の有害事象や、患者死亡に至る毒性は認めなかった。治療の永続的な中止に至ったのは2人(2.9%)で、理由は間質性肺炎が1人、嘔吐下痢が1人だった。
結論:
リキッドバイオプシーもしくは通常生検で検出されたMETエクソン14スキッピング変異陽性の非小細胞肺がん患者に対し、tipotinibは治療ラインとは関係なく、有望な活性を示した。毒性は忍容可能であった。現在も本試験は進行中である。

http://oitahaiganpractice.junglekouen.com/e888165.html
2019年のASCOで、ほかにもCapmatinibやTepotinibが効く、という発表があった。
忘れないように取り上げておく。
以下を見る限り、クリゾチニブと比較して、遥かにMETエクソン14スキッピング変異による産物への阻害活性が高い薬たちのようだ。

出現頻度は肺腺がんの3-4%ということだから、ALK融合遺伝子陽性患者の割合と遜色ない。
これら両者で、最大8%となると、無視してはならない割合だ。
ROS1やBRAF-V600Eなどより、METエクソン14skipの方が優先度合いが高くなりそうだ。
九州がんセンターから立案された、本遺伝子変異を有する患者に対するクリゾチニブの効果・安全性を検討するCo-MET試験も、すでに患者登録は終了していると聞く。
そろそろ、本遺伝子変異に対しても、実地臨床で診断・治療の道が開かれる頃だろうか。
Capmatinib (INC280) in METΔex14-mutated advanced non-small cell lung cancer (NSCLC): Efficacy data from the phase II GEOMETRY mono-1 study.
Juergen Wolf. et al., 2019 ASCO Annual Meeting Abst. #9004
背景:
Capmatinibは高い活性を有する選択的MET阻害薬である。GEOMETRY mono-1試験のこれまでのデータから、METエクソン14スキッピング変異を有する非小細胞肺がん患者において臨床的意義のある奏効割合と対応可能な毒性プロファイルが明らかになっている(コホート4は1-2レジメンの治療歴のある患者集団で、コホート5bは治療歴のない患者集団だが、とりわけコホート5bでは奏効割合が高かった)。今回は、奏効持続期間と無増悪生存期間に関する結果を提示する。
方法:
GEOMETRY mono-1は第II相、マルチコホートの、多施設共同臨床試験である。METエクソン14スキッピング変異もしくはMET遺伝子増幅を有する進行非小細胞肺がんの患者6コホートを対象に、Capmatinibの効果を評価するのが目的である。適格基準は、18歳以上、ECOG-PS 0-1、ALK融合遺伝子あるいはEGFR遺伝子変異いずれも陰性、stage IIIB/IVとした。METエクソン14スキッピング変異を有する患者が(MET遺伝子増幅の状態とは関係なく)コホート4あるいはコホート5bに割り付けられ、Capmatinib 400mgを1日2回服用した。主要評価項目は奏効割合とした。主な副次評価項目は奏効持続期間とした。
結果:
2018年11月08日までに、METエクソン14スキッピング変異を有する患者97人(コホート4 69人、コホート5b 28人)が治療効果の評価が可能な状態にあった。コホート4における奏効割合は39.1%(95%信頼区間は27.6-51.6%)で、コホート5bにおける奏効割合は71.4%(51.3-86.8%)だった。今回の解析を行った段階ではまだデータは未成熟であったが、治療効果の持続性については期待できる効果が得られた。奏効持続期間中央値はコホート4で9.72ヶ月(95%信頼区間は4.27-11.14ヶ月)、コホート5bで8.41ヶ月(95%信頼区間は5.55-未到達)だった。無増悪生存期間中央値はコホート4で5.42ヶ月(95%信頼区間は4.17-6.97ヶ月)、コホート5bで9.13(95%信頼区間は5.52-13.86ヶ月)だった。安全性については、既報と特に変わりなかった。発現頻度が25%を超える、最も発現頻度が高く両コホートに共通する有害事象は、末梢浮腫(49.2%)、嘔気(43.2%)、嘔吐(28.3%)で、ほとんどの有害事象はGrade 1もしくは2だった。
結論:
CapmatinibはMET14スキッピング変異を持つ進行非小細胞肺がん患者の治療選択肢として、過去の治療歴に関わらず有望な治療選択肢である。





Phase II study of tepotinib in NSCLC patients with METex14 mutations.
Paul K. Paik.et al., 2019 ASCO Annual Meeting, Abst. #9005
背景:
非小細胞肺がんの3-4%に認められると報告されているMETエクソン14スキッピング変異は、腫瘍化に関わり、MET阻害薬に感受性で、リキッドバイオプシーで検出可能である。今回は現在進行中のtepotinib(高い選択性を有するMET阻害薬)に関する単アーム第II相臨床試験・・・リキッドバイオプシーもしくは生検によってMET14スキッピング変異陽性の非小細胞肺がんと診断された患者を対象とした臨床試験・・・について報告する。
方法:
EGFR遺伝子変異、ALK融合遺伝子陰性の進行非小細胞肺がん患者を対象に、リキッドバイオプシーでMET14スキッピング変異が確認された患者(集積目標は60人以上)あるいは生検でMET14スキッピング変異が確認された患者(集積目標は60人以上、リキッドバイオプシー陽性例との重複も予測して)を前向きに登録し、病勢進行・忍容不能の毒性・治療同意取り下げのいずれかに至るまでtepotinib 500mg1日1回を服用させた。主要評価項目は独立した評価委員会の評価による奏効割合、副次評価項目は担当医の評価による奏効割合と安全性とした。
結果:
これまでに、85人(リキッドバイオプシー群55人、生検群52人)の患者が本試験に登録された。2018年10月16日のデータカットオフ時点までに、リキッドバイオプシー群の中で評価可能だった患者35人において、奏効割合は委員会評価で51.4%、担当医評価で63.9%だった。同様に、生検群の中で評価可能だった41人において、奏効割合は委員会評価で41.5%、担当医評価で58.5%だった。奏効持続期間や、治療ラインごとの奏効割合は図表に示すとおりだった。有害事象について評価可能だった69人の患者において、10%以上の出現頻度で認められた有害事象は、末梢浮腫が47.8%、下痢が18.8%、嘔気が15.9%、衰弱が10.1%だった。Grade 4の有害事象や、患者死亡に至る毒性は認めなかった。治療の永続的な中止に至ったのは2人(2.9%)で、理由は間質性肺炎が1人、嘔吐下痢が1人だった。
結論:
リキッドバイオプシーもしくは通常生検で検出されたMETエクソン14スキッピング変異陽性の非小細胞肺がん患者に対し、tipotinibは治療ラインとは関係なく、有望な活性を示した。毒性は忍容可能であった。現在も本試験は進行中である。

2020年01月10日
セカンドオピニオン・個別相談に関する告知事項
先ほど、セカンドオピニオン・個別相談に関するご相談を、スマートフォン・携帯電話からのメールで頂きました。
お答えしたいのですが、パソコンからではお返事ができません。
エラーで帰ってきてしまいます。
スマートフォン・携帯電話からメールでご連絡を頂いた場合、パソコンからではお返事できないことがほとんどです。
これらの方法でご連絡をくださる方は、住所・氏名をメールにご記載ください。
追って私から、必要書類を郵送させていただきます。
最初の連絡でいきなり住所・氏名を伝えるのは気が引ける、という方は、パソコンからメールでご連絡をください。
その際は、私の連絡先をメールで返送し、改めてそちらへ郵便でご連絡を頂きます。
どうぞよろしくお願いいたします。
お答えしたいのですが、パソコンからではお返事ができません。
エラーで帰ってきてしまいます。
スマートフォン・携帯電話からメールでご連絡を頂いた場合、パソコンからではお返事できないことがほとんどです。
これらの方法でご連絡をくださる方は、住所・氏名をメールにご記載ください。
追って私から、必要書類を郵送させていただきます。
最初の連絡でいきなり住所・氏名を伝えるのは気が引ける、という方は、パソコンからメールでご連絡をください。
その際は、私の連絡先をメールで返送し、改めてそちらへ郵便でご連絡を頂きます。
どうぞよろしくお願いいたします。
2020年01月08日
免疫チェックポイント阻害薬後の丸山ワクチン
今日のお昼過ぎ、病棟カンファレンスをしていたら、近郊の中核医療機関の呼吸器内科医からご連絡をいただいた。
進行期原発性肺がんに対して、初回治療でペンブロリズマブを使っていたが病勢進行に至り、次の治療を考えているところ。
患者さんから丸山ワクチンを使ってみたいと要望があったらしい。
丸山ワクチンという単語に触れるのは、実に1年ぶり。
昨年は自分より若い進行肺小細胞がんの患者さんに使っていた。
しかし、免疫チェックポイント阻害薬使用後の患者さんに丸山ワクチンを検討するのは初めてだ。
化学療法歴のない患者さんに丸山ワクチンを検討するのもまた、初めてである。
これまでのところ、自分の経験としては丸山ワクチンが有効だったためしはないので、あまり積極的にお勧めする気にはなれない。
でも、面談をして希望されたら、お手伝いしたいと思う。
進行期原発性肺がんに対して、初回治療でペンブロリズマブを使っていたが病勢進行に至り、次の治療を考えているところ。
患者さんから丸山ワクチンを使ってみたいと要望があったらしい。
丸山ワクチンという単語に触れるのは、実に1年ぶり。
昨年は自分より若い進行肺小細胞がんの患者さんに使っていた。
しかし、免疫チェックポイント阻害薬使用後の患者さんに丸山ワクチンを検討するのは初めてだ。
化学療法歴のない患者さんに丸山ワクチンを検討するのもまた、初めてである。
これまでのところ、自分の経験としては丸山ワクチンが有効だったためしはないので、あまり積極的にお勧めする気にはなれない。
でも、面談をして希望されたら、お手伝いしたいと思う。
2020年01月07日
KRAS遺伝子変異とペンブロリズマブのいい関係
欧州臨床腫瘍学会(ESMO)のImmuno-Oncology Congress 2019で、以下のようにKRAS遺伝子変異とペンブロリズマブの治療効果の相関関係が報告されていた様子。
「PD-L1は治療効果予測因子として不十分」
だの、
「TMBはPD-L1より治療効果予測因子として優れている」
だのと議論されるようになって久しいが、実際のところは、PD-L1発現状態は治療効果予測因子として十分有用だというのが私の認識である。
TMBはそれにかかる手間やコスト(なんといってもPD-L1は免疫染色で勝負がつく点で、費用/効果比が優れている)の点ではまだ実用的とは言えないだろう。
今回取り上げるKRAS変異検索も、すでに我が国の実地臨床で施行可能であり、免疫チェックポイント阻害薬が使われるようになった当初から治療効果予測因子としてしばしば取り上げられていたにも関わらず、あまり普及していない。
KRAS変異検索のために貴重な組織サンプルもコストもかかってしまう、というデメリットはある。
しかし、KEYNOTE-042の結果を鵜呑みにして、PD-L1<50%の患者にむやみやたらとペンブロリズマブ単剤療法を行うよりは、KRAS変異を検索し、その結果を参考にして、もし陽性ならPD-L1<50%でもトライする、陰性なら化学療法と併用するとか、PD-L1<50%かつKRAS変異陰性の高齢者なら化学療法を先行させるとか、そんな応用法があってもいいのではないだろうか。
今回の研究結果はとても興味深いのだが、結論のところで読者をミスリードするような記載がなされているのは誠に残念であり、こうした点にも商業的な思惑が含まれているのかもしれない。
なお、下記の内容は、原文にかなり追記を加えたものであることを断っておく。もちろん、結果を毀損するような追記はしていない。
Association of KRAS mutational status with response to pembrolizumab monotherapy given as first-line therapy for PD-L1-positive advanced non-squamous NSCLC in KEYNOTE-042
R S Herbst et al. Annals of Oncology, Volume 30, Issue Supplement_11, December 2019
背景:
KRASの体細胞変異は、地域差はあるものの原発性肺腺癌の概ね15-30%で認められ、予後不良因子とされている。今回、KEYNOTE-042試験(PD-L1陽性(TPS≧1%)の進行非小細胞肺がんの患者を対象に、ペンブロリズマブ単剤療法とプラチナ併用化学療法の初回治療としての効果を比較した第III相臨床試験)において集積された患者の中で、非扁平上皮非小細胞肺がん患者における治療効果とKRAS変異の関連性について探索的検討を行った。
方法:
上記のうち、腫瘍組織とそれに対応する正常組織が両方とも利用可能な患者に対し、全エクソームシーケンシング(WES)の手法を用いてKRAS変異状態とtumor mutational burden(TMB)を評価した。KRAS変異、TMB、PD-L1発現状態それぞれの相関関係と、KRAS変異もしくはKRAS G12C変異と治療効果の相関関係について探索的検討を行った。
結果:
非扁平非小細胞肺がん患者782人のうち、301人(38%)がWESで解析可能で、かつ腫瘍組織とそれに対応する正常組織のDNAを入手可能だった。KRAS変異は69人(23%)に認められ、そのうち30人はペンブロリズマブ群に、39人は化学療法群に割り付けられていた。また、KRAS変異患者のうち、29人(10%)がG12C変異で、12人がペンブロリズマブ群に、17人は化学療法群に割り付けられていた。KRAS変異のない患者は232人で、127人がペンブロリズマブ群に、105人が化学療法群に割り付けられていた。KRAS変異を有する患者では、PD-L1の発現亢進(中央値は60%(四分位区間は10-95%) vs 35%(10-80%))、TMB高値(中央値は191(129-288) vs 105(56-226)変異/エクソーム)の傾向が強かった。KRAS変異を有する患者において、ペンブロリズマブ群の奏効割合は56.7%、化学療法群の奏効割合は18.0%だった。KRAS変異のない患者では、ペンブロリズマブ群の奏効割合は29.1%、化学療法群の奏効割合は21.0%だった。KRAS変異を有する患者において、無増悪生存期間中央値はペンブロリズマブ群で12ヶ月、化学療法群で6ヶ月(ハザード比0.51、95%信頼区間0.29-0.87)だった。KRAS変異のない患者では、無増悪生存期間中央値はペンブロリズマブ群で6ヶ月、化学療法群で6ヶ月(ハザード比1.00、95%信頼区間0.75-1.34)だった。KRAS変異を有する患者において、全生存期間中央値はペンブロリズマブ群で28ヶ月、化学療法群で11ヶ月(ハザード比0.42、95%信頼区間0.22-0.81)だった。KRAS変異のない患者では、全生存期間中央値はペンブロリズマブ群で15ヶ月、化学療法群で12ヶ月(ハザード比0.86、95%信頼区間は0.63-1.18)だった。
KRAS変異の頻度がそこそこで、KRAS G12C変異の頻度が低かったために、信頼区間の間隔は幅広くなった。

結論:
今回の探索的解析から、ペンブロリズマブ単剤療法はPD-L1陽性の進行非扁平非小細胞肺がん患者においては、KRAS変異の状態にかかわらず標準初回治療の1つの選択肢として考慮すべきことが分かった。と同時に、KRAS変異を治療標的とした今後の非小細胞肺がん初回治療の臨床試験においては、ペンブロリズマブを含む治療レジメンを対象群とすべきことも示唆している。
「PD-L1は治療効果予測因子として不十分」
だの、
「TMBはPD-L1より治療効果予測因子として優れている」
だのと議論されるようになって久しいが、実際のところは、PD-L1発現状態は治療効果予測因子として十分有用だというのが私の認識である。
TMBはそれにかかる手間やコスト(なんといってもPD-L1は免疫染色で勝負がつく点で、費用/効果比が優れている)の点ではまだ実用的とは言えないだろう。
今回取り上げるKRAS変異検索も、すでに我が国の実地臨床で施行可能であり、免疫チェックポイント阻害薬が使われるようになった当初から治療効果予測因子としてしばしば取り上げられていたにも関わらず、あまり普及していない。
KRAS変異検索のために貴重な組織サンプルもコストもかかってしまう、というデメリットはある。
しかし、KEYNOTE-042の結果を鵜呑みにして、PD-L1<50%の患者にむやみやたらとペンブロリズマブ単剤療法を行うよりは、KRAS変異を検索し、その結果を参考にして、もし陽性ならPD-L1<50%でもトライする、陰性なら化学療法と併用するとか、PD-L1<50%かつKRAS変異陰性の高齢者なら化学療法を先行させるとか、そんな応用法があってもいいのではないだろうか。
今回の研究結果はとても興味深いのだが、結論のところで読者をミスリードするような記載がなされているのは誠に残念であり、こうした点にも商業的な思惑が含まれているのかもしれない。
なお、下記の内容は、原文にかなり追記を加えたものであることを断っておく。もちろん、結果を毀損するような追記はしていない。
Association of KRAS mutational status with response to pembrolizumab monotherapy given as first-line therapy for PD-L1-positive advanced non-squamous NSCLC in KEYNOTE-042
R S Herbst et al. Annals of Oncology, Volume 30, Issue Supplement_11, December 2019
背景:
KRASの体細胞変異は、地域差はあるものの原発性肺腺癌の概ね15-30%で認められ、予後不良因子とされている。今回、KEYNOTE-042試験(PD-L1陽性(TPS≧1%)の進行非小細胞肺がんの患者を対象に、ペンブロリズマブ単剤療法とプラチナ併用化学療法の初回治療としての効果を比較した第III相臨床試験)において集積された患者の中で、非扁平上皮非小細胞肺がん患者における治療効果とKRAS変異の関連性について探索的検討を行った。
方法:
上記のうち、腫瘍組織とそれに対応する正常組織が両方とも利用可能な患者に対し、全エクソームシーケンシング(WES)の手法を用いてKRAS変異状態とtumor mutational burden(TMB)を評価した。KRAS変異、TMB、PD-L1発現状態それぞれの相関関係と、KRAS変異もしくはKRAS G12C変異と治療効果の相関関係について探索的検討を行った。
結果:
非扁平非小細胞肺がん患者782人のうち、301人(38%)がWESで解析可能で、かつ腫瘍組織とそれに対応する正常組織のDNAを入手可能だった。KRAS変異は69人(23%)に認められ、そのうち30人はペンブロリズマブ群に、39人は化学療法群に割り付けられていた。また、KRAS変異患者のうち、29人(10%)がG12C変異で、12人がペンブロリズマブ群に、17人は化学療法群に割り付けられていた。KRAS変異のない患者は232人で、127人がペンブロリズマブ群に、105人が化学療法群に割り付けられていた。KRAS変異を有する患者では、PD-L1の発現亢進(中央値は60%(四分位区間は10-95%) vs 35%(10-80%))、TMB高値(中央値は191(129-288) vs 105(56-226)変異/エクソーム)の傾向が強かった。KRAS変異を有する患者において、ペンブロリズマブ群の奏効割合は56.7%、化学療法群の奏効割合は18.0%だった。KRAS変異のない患者では、ペンブロリズマブ群の奏効割合は29.1%、化学療法群の奏効割合は21.0%だった。KRAS変異を有する患者において、無増悪生存期間中央値はペンブロリズマブ群で12ヶ月、化学療法群で6ヶ月(ハザード比0.51、95%信頼区間0.29-0.87)だった。KRAS変異のない患者では、無増悪生存期間中央値はペンブロリズマブ群で6ヶ月、化学療法群で6ヶ月(ハザード比1.00、95%信頼区間0.75-1.34)だった。KRAS変異を有する患者において、全生存期間中央値はペンブロリズマブ群で28ヶ月、化学療法群で11ヶ月(ハザード比0.42、95%信頼区間0.22-0.81)だった。KRAS変異のない患者では、全生存期間中央値はペンブロリズマブ群で15ヶ月、化学療法群で12ヶ月(ハザード比0.86、95%信頼区間は0.63-1.18)だった。
KRAS変異の頻度がそこそこで、KRAS G12C変異の頻度が低かったために、信頼区間の間隔は幅広くなった。

結論:
今回の探索的解析から、ペンブロリズマブ単剤療法はPD-L1陽性の進行非扁平非小細胞肺がん患者においては、KRAS変異の状態にかかわらず標準初回治療の1つの選択肢として考慮すべきことが分かった。と同時に、KRAS変異を治療標的とした今後の非小細胞肺がん初回治療の臨床試験においては、ペンブロリズマブを含む治療レジメンを対象群とすべきことも示唆している。
2020年01月05日
歴史は勝者によって作られる・・・闇に葬られる臨床試験
私が臨床試験の英語論文に目を通し始めた2,000年代初頭に比べると、肺がん領域の臨床試験デザインや結果報告には、かなり製薬企業の思惑が反映されるようになった気がする。
折に触れて繰り返しているが、臨床試験の結果を学習するのは当たり前で、結果がどんな真実を物語っているのかを、雑音を排して自分なりに正しく理解、考察する能力が、実際の患者診療にあたる我々に求められている。
「企業が資金供与していた臨床試験は、NIHが資金供与していた臨床試験(オッズ比 2.27、95%信頼区間1.31-4.00)や研究機関が資金供与していた臨床試験(オッズ比1.55、95%信頼区間1.15-2.00)よりも文献化されていない傾向が強かった」
自分の企業の収益につながらない、もしくは収益悪化につながる臨床試験は、形式的に公表しても敢えて論文化して検索可能にするような手間はかけない、ということかもしれない。
この一文の持つ重みを、よく知っておかなければならない。
Publication Rate and Characteristics of Lung Cancer Clinical Trials
Ghassan Al-Shbool et al.
JAMA Netw Open. 2019;2(11):e1914531. doi:10.1001/jamanetworkopen.2019.14531
背景:
臨床試験は、実地臨床をより良いものにするにあたって、重要な役割を果たしている。臨床試験の結果を適切に公表しないことは、学術論文の価値を損ない、ひいては患者治療においても悪影響を及ぼしうる。米国でも、全世界においても、肺がんはがんによる死亡原因の筆頭である。胸部悪性腫瘍の臨床試験結果が適切に報告されているかどうかについて検証した研究は不足している。肺がんの臨床試験データベースに登録された臨床試験がどの程度公表されているか、調査した。
方法:
今回の横断的研究において、2,000年01月01日から2,016年08月07日の間に研究を終了した肺がんの登録済み臨床試験を、2,018年08月08日にClinicalTrials.govから検索した。18歳以上の患者を適格とし、"completed(臨床試験終了)"もしくは"terminated(臨床試験中止)"の状態にある、治療介入を伴う第II相もしくは第III相臨床試験を対象とした。National Clinical Trial identifier、臨床試験のタイトル、キーワードを用いて、3つのデータベースから検索した。PubMedとGoogle Sclolarを分担研究者のうち2人がそれぞれ独立に、その後あと1人がEMBASEを用いて、論文化されていない臨床試験を検索した。続いて、論文化されていない臨床試験の研究者に対して、電子メールで問い合わせを行った。結果は、以下の2つのカテゴリーに分類した(①文献化された(peer-review制度が整備されている雑誌に掲載された)、②文献化されていない(学会会議録やClinicalTrials.govに結果が報告されたのみのものも含む))。ロジスティック回帰分析を用いて、論文化されなかったことに関わる背景を解析した。統計解析には、R statistical software version 3.4を用いた。解析は2,019年07月15日に行った。本研究は、the Strengthening the Reporting of Observational Studies in Epidemiology(STROBE)のガイドラインに従い、the policy of the Human Subject Protecion Program at Georgetown University Medical Centerに沿って行った。また、倫理審査は適用せず、インフォームド・コンセントも要求しなかった。
結果:
1,294件の臨床試験を解析対象とした。臨床試験終了の状態にあったのは1,038件(80.2%)、臨床試験中止の状態にあったのは256件(19.8%)だった。臨床試験終了もしくは臨床試験中止から今回の解析までの経過期間中央値は116ヶ月(四分位区間は81-147ヶ月)だった。1,038件の終了した臨床試験のうち、702件(67.6%)は文献化されており、336件(32.4%)は文献化が確認できなかった。文献化が確認できなかった336件のうち、研究者の連絡先が分かったのは183件(54.5%)だった。電子メールを送ったところ、そのうち102件(55.7%)からは回答があった。そのうち51件は文献化されており、51件は文献化されていないことが確認できた。結局のところ、終了した臨床試験のうち753件(72.5%)は文献化され、285件(27.5%)は文献化されていなかった。背景因子を解析したところ、企業が資金供与していた臨床試験は、NIHが資金供与していた臨床試験(オッズ比 2.27、95%信頼区間1.31-4.00)や研究機関が資金供与していた臨床試験(オッズ比1.55、95%信頼区間1.15-2.00)よりも文献化されていない傾向が強かった。多施設共同臨床試験は、単施設で行った臨床試験よりも文献化されやすい傾向にあった(オッズ比 2.78、95%信頼区間2.08-3.73)。登録患者数が少ない臨床試験(100人未満)と比較して、登録患者数が多い臨床試験は論文化されやすい傾向にあった(500人を超える臨床試験はオッズ比 3.43、95%信頼区間1.83-6.64、100人以上500人以下の臨床試験はオッズ比 2.87、95%信頼区間2.08-3.73)。無作為化されているか否か、第2相か第3相かは、文献化されやすいかどうかとは関連がなかった。中止された256件の臨床試験のうち、72件(28.1%)は文献化され、184件(71.9%)は文献化されていなかった。臨床試験中止に至った理由は様々で、患者集積がうまく進まなかった(119件、46.5%)、有効性が乏しいと判断された(30件、11.7%)、有害事象のために中止した(22件、8.6%)、その他(主要研究者が参加施設を退職した、など、38件、14.8%)、不明(47件、18.4%)だった。
結論:
ClinicalTrials.govに登録された肺がんの臨床試験のうち、2,016年までに終了したものの中で、4件に1件は論文化されないままとなっており、胸部悪性腫瘍の分野における文献化バイアスへの関心をさらに高める結果となった。非文献化率は中止された臨床試験で高く、3分の1以上はどういった形でも報告されていなかった。
折に触れて繰り返しているが、臨床試験の結果を学習するのは当たり前で、結果がどんな真実を物語っているのかを、雑音を排して自分なりに正しく理解、考察する能力が、実際の患者診療にあたる我々に求められている。
「企業が資金供与していた臨床試験は、NIHが資金供与していた臨床試験(オッズ比 2.27、95%信頼区間1.31-4.00)や研究機関が資金供与していた臨床試験(オッズ比1.55、95%信頼区間1.15-2.00)よりも文献化されていない傾向が強かった」
自分の企業の収益につながらない、もしくは収益悪化につながる臨床試験は、形式的に公表しても敢えて論文化して検索可能にするような手間はかけない、ということかもしれない。
この一文の持つ重みを、よく知っておかなければならない。
Publication Rate and Characteristics of Lung Cancer Clinical Trials
Ghassan Al-Shbool et al.
JAMA Netw Open. 2019;2(11):e1914531. doi:10.1001/jamanetworkopen.2019.14531
背景:
臨床試験は、実地臨床をより良いものにするにあたって、重要な役割を果たしている。臨床試験の結果を適切に公表しないことは、学術論文の価値を損ない、ひいては患者治療においても悪影響を及ぼしうる。米国でも、全世界においても、肺がんはがんによる死亡原因の筆頭である。胸部悪性腫瘍の臨床試験結果が適切に報告されているかどうかについて検証した研究は不足している。肺がんの臨床試験データベースに登録された臨床試験がどの程度公表されているか、調査した。
方法:
今回の横断的研究において、2,000年01月01日から2,016年08月07日の間に研究を終了した肺がんの登録済み臨床試験を、2,018年08月08日にClinicalTrials.govから検索した。18歳以上の患者を適格とし、"completed(臨床試験終了)"もしくは"terminated(臨床試験中止)"の状態にある、治療介入を伴う第II相もしくは第III相臨床試験を対象とした。National Clinical Trial identifier、臨床試験のタイトル、キーワードを用いて、3つのデータベースから検索した。PubMedとGoogle Sclolarを分担研究者のうち2人がそれぞれ独立に、その後あと1人がEMBASEを用いて、論文化されていない臨床試験を検索した。続いて、論文化されていない臨床試験の研究者に対して、電子メールで問い合わせを行った。結果は、以下の2つのカテゴリーに分類した(①文献化された(peer-review制度が整備されている雑誌に掲載された)、②文献化されていない(学会会議録やClinicalTrials.govに結果が報告されたのみのものも含む))。ロジスティック回帰分析を用いて、論文化されなかったことに関わる背景を解析した。統計解析には、R statistical software version 3.4を用いた。解析は2,019年07月15日に行った。本研究は、the Strengthening the Reporting of Observational Studies in Epidemiology(STROBE)のガイドラインに従い、the policy of the Human Subject Protecion Program at Georgetown University Medical Centerに沿って行った。また、倫理審査は適用せず、インフォームド・コンセントも要求しなかった。
結果:
1,294件の臨床試験を解析対象とした。臨床試験終了の状態にあったのは1,038件(80.2%)、臨床試験中止の状態にあったのは256件(19.8%)だった。臨床試験終了もしくは臨床試験中止から今回の解析までの経過期間中央値は116ヶ月(四分位区間は81-147ヶ月)だった。1,038件の終了した臨床試験のうち、702件(67.6%)は文献化されており、336件(32.4%)は文献化が確認できなかった。文献化が確認できなかった336件のうち、研究者の連絡先が分かったのは183件(54.5%)だった。電子メールを送ったところ、そのうち102件(55.7%)からは回答があった。そのうち51件は文献化されており、51件は文献化されていないことが確認できた。結局のところ、終了した臨床試験のうち753件(72.5%)は文献化され、285件(27.5%)は文献化されていなかった。背景因子を解析したところ、企業が資金供与していた臨床試験は、NIHが資金供与していた臨床試験(オッズ比 2.27、95%信頼区間1.31-4.00)や研究機関が資金供与していた臨床試験(オッズ比1.55、95%信頼区間1.15-2.00)よりも文献化されていない傾向が強かった。多施設共同臨床試験は、単施設で行った臨床試験よりも文献化されやすい傾向にあった(オッズ比 2.78、95%信頼区間2.08-3.73)。登録患者数が少ない臨床試験(100人未満)と比較して、登録患者数が多い臨床試験は論文化されやすい傾向にあった(500人を超える臨床試験はオッズ比 3.43、95%信頼区間1.83-6.64、100人以上500人以下の臨床試験はオッズ比 2.87、95%信頼区間2.08-3.73)。無作為化されているか否か、第2相か第3相かは、文献化されやすいかどうかとは関連がなかった。中止された256件の臨床試験のうち、72件(28.1%)は文献化され、184件(71.9%)は文献化されていなかった。臨床試験中止に至った理由は様々で、患者集積がうまく進まなかった(119件、46.5%)、有効性が乏しいと判断された(30件、11.7%)、有害事象のために中止した(22件、8.6%)、その他(主要研究者が参加施設を退職した、など、38件、14.8%)、不明(47件、18.4%)だった。
結論:
ClinicalTrials.govに登録された肺がんの臨床試験のうち、2,016年までに終了したものの中で、4件に1件は論文化されないままとなっており、胸部悪性腫瘍の分野における文献化バイアスへの関心をさらに高める結果となった。非文献化率は中止された臨床試験で高く、3分の1以上はどういった形でも報告されていなかった。
2020年01月05日
第II相試験において、メトホルミンがEGFR阻害薬の治療効果を増強
安価で、おそらく世界中のどこでも手に入る2型糖尿病治療薬、メトホルミン。
ほかの分野で汎用されているこうした薬を、抗がん治療と組み合わせる試みは、以前からいくつも試されてきた。
そして、ことごとくその効果が否定されてきた。
最近、急性心筋梗塞患者に対する治療の効果を、痛風治療薬であるコルヒチンが改善したという報告があった。
メトホルミンもそういった薬であってくれるとよいが。
ぜひ、我が国で医師主導第III相試験をやってほしい。
Effect of Metformin Plus Tyrosine Kinase Inhibitors Compared With Tyrosine Kinase Inhibitors Alone in Patients With Epidermal Growth Factor Receptor–Mutated Lung Adenocarcinoma
A Phase 2 Randomized Clinical Trial
Oscar Arrieta. et al. JAMA Oncol. 2019;5(11):e192553. doi:10.1001/jamaoncol.2019.2553
背景:
メトホルミンは2型糖尿病の治療薬だが、抗腫瘍薬として近年再認識されつつある。前臨床試験およびレトロスペクティブ研究により、肺がんを含む様々な悪性新生物に対して治療効果を示すことが示されてきた。とりわけ、メトホルミンとEGFR阻害薬の相乗効果に関するエビデンスが蓄積されてきている。
目的:
進行肺腺がんの患者に対して、EGFR阻害薬単剤治療を行った場合に対し、EGFR阻害薬とメトホルミンを併用した場合に、無増悪生存期間を延長するかどうかを検証すること。
臨床試験デザインと患者:
オープンラベル無作為化第II相臨床試験として、メキシコシティーのthe Instituto Nacional de Cancerología (INCan)において実施された。18歳以上、組織学的にIIIB-IV期の肺腺がんと診断され、EGFR遺伝子変異陽性の患者を対象とした。
プロトコール治療:
患者は、EGFR阻害薬+メトホルミン併用療法群(EM群)かEGFR阻害薬単剤療法群(E群)に無作為に割り付けられた。EGFR阻害薬はエルロチニブ、アファチニブ、ゲフィチニブのいずれかを用いることとし、メトホルミンは250mg/回を1日2回服用することとした。プロトコール治療は忍容不能の毒性が出現するか、患者が治療同意を取り下げるまで継続することとした。
評価指標:
主要評価項目は、intent-to-treat解析による無増悪生存期間とした。副次評価項目には奏効割合、病勢コントロール割合、全生存期間、安全性を含めた。
結果:
2016年3月31日から2017年12月31日の期間に、139人の患者を登録し、E群に70人、EM群に69人を割り付けた。平均年齢は59.4歳、65.5%が女性だった。無増悪生存期間中央値は、EM群において有意に延長しており、EM群13.1ヶ月(95%信頼区間は9.8-16.3ヶ月)に対してE群9.9ヶ月(95%信頼区間は7.5-12.2ヶ月)、ハザード比は0.60(95%信頼区間は0.40-0.94、p=0.03)だった。生存期間中央値もEM群において有意に延長しており、EM群31.7ヶ月(95%信頼区間は20.5-42.8ヶ月)に対してE群17.5ヶ月(95%信頼区間は11.4-23.7ヶ月)だった(p=0.02)。
結論:
本試験は、EGFR阻害薬にメトホルミンを上乗せすることにより進行肺腺がん患者の無増悪生存期間を有意に改善することを示した初の前向き臨床試験である。第III相臨床試験でこの結果を再確認する必要がある。
ほかの分野で汎用されているこうした薬を、抗がん治療と組み合わせる試みは、以前からいくつも試されてきた。
そして、ことごとくその効果が否定されてきた。
最近、急性心筋梗塞患者に対する治療の効果を、痛風治療薬であるコルヒチンが改善したという報告があった。
メトホルミンもそういった薬であってくれるとよいが。
ぜひ、我が国で医師主導第III相試験をやってほしい。
Effect of Metformin Plus Tyrosine Kinase Inhibitors Compared With Tyrosine Kinase Inhibitors Alone in Patients With Epidermal Growth Factor Receptor–Mutated Lung Adenocarcinoma
A Phase 2 Randomized Clinical Trial
Oscar Arrieta. et al. JAMA Oncol. 2019;5(11):e192553. doi:10.1001/jamaoncol.2019.2553
背景:
メトホルミンは2型糖尿病の治療薬だが、抗腫瘍薬として近年再認識されつつある。前臨床試験およびレトロスペクティブ研究により、肺がんを含む様々な悪性新生物に対して治療効果を示すことが示されてきた。とりわけ、メトホルミンとEGFR阻害薬の相乗効果に関するエビデンスが蓄積されてきている。
目的:
進行肺腺がんの患者に対して、EGFR阻害薬単剤治療を行った場合に対し、EGFR阻害薬とメトホルミンを併用した場合に、無増悪生存期間を延長するかどうかを検証すること。
臨床試験デザインと患者:
オープンラベル無作為化第II相臨床試験として、メキシコシティーのthe Instituto Nacional de Cancerología (INCan)において実施された。18歳以上、組織学的にIIIB-IV期の肺腺がんと診断され、EGFR遺伝子変異陽性の患者を対象とした。
プロトコール治療:
患者は、EGFR阻害薬+メトホルミン併用療法群(EM群)かEGFR阻害薬単剤療法群(E群)に無作為に割り付けられた。EGFR阻害薬はエルロチニブ、アファチニブ、ゲフィチニブのいずれかを用いることとし、メトホルミンは250mg/回を1日2回服用することとした。プロトコール治療は忍容不能の毒性が出現するか、患者が治療同意を取り下げるまで継続することとした。
評価指標:
主要評価項目は、intent-to-treat解析による無増悪生存期間とした。副次評価項目には奏効割合、病勢コントロール割合、全生存期間、安全性を含めた。
結果:
2016年3月31日から2017年12月31日の期間に、139人の患者を登録し、E群に70人、EM群に69人を割り付けた。平均年齢は59.4歳、65.5%が女性だった。無増悪生存期間中央値は、EM群において有意に延長しており、EM群13.1ヶ月(95%信頼区間は9.8-16.3ヶ月)に対してE群9.9ヶ月(95%信頼区間は7.5-12.2ヶ月)、ハザード比は0.60(95%信頼区間は0.40-0.94、p=0.03)だった。生存期間中央値もEM群において有意に延長しており、EM群31.7ヶ月(95%信頼区間は20.5-42.8ヶ月)に対してE群17.5ヶ月(95%信頼区間は11.4-23.7ヶ月)だった(p=0.02)。
結論:
本試験は、EGFR阻害薬にメトホルミンを上乗せすることにより進行肺腺がん患者の無増悪生存期間を有意に改善することを示した初の前向き臨床試験である。第III相臨床試験でこの結果を再確認する必要がある。
2020年01月03日
"uncommon / マイナー"なEGFR遺伝子変異陽性肺がんに対するオシメルチニブの効果
オシメルチニブは他のEGFR阻害薬と比較して、野生型EGFRへの親和性が低く、変異型EGFRへの親和性が高い(一言でいえば、変異型EGFRへの選択性が高い)ことから、Exon 19やExon 21、T790M以外の変異タイプ(いわゆるuncommon mutation、言い換えればマイナーな遺伝子変異)にも有効なのではないか、場合によっては、むしろuncommon mutationの方がよい治療対象になるのではないかといわれていた。
今回の論文は、そこに一定の解を与えるものである。
無増悪生存期間中央値は8.2ヶ月とcommon mutationに対するオシメルチニブの成績を考えるとやや低い気もするが、これは致し方ないところだろう。
全生存期間中央値がいまだ未到達というのは頼もしい。
Osimertinib for Patients With Non–Small-Cell Lung Cancer Harboring Uncommon EGFR Mutations: A Multicenter, Open-Label, Phase II Trial (KCSG-LU15-09)
Jang Ho Cho et al., DOI: 10.1200/JCO.19.00931 Journal of Clinical Oncology
Published online December 11, 2019.
目的:
EGFR遺伝子変異陽性非小細胞肺がん患者の約10%は、いわゆる"uncommon"な遺伝子変異を有している。今回は、こうした"uncommon"なEGFR遺伝子変異を有する非小細胞肺がんの患者を対象に、オシメルチニブ療法の有効性と安全性を検討した。
患者と方法:
多施設共同、単アーム、オープンラベル、第II相臨床試験として韓国国内で本試験を行った。患者は組織学的に診断された進行もしくは術後再発のEGFR遺伝子変異陽性非小細胞肺がん患者とした。EGFR遺伝子変異としてはExon 19欠失変異、L858R一塩基置換変異、T790M一塩基置換変異、Exon 20挿入変異は除外した。主要評価項目は奏効割合とし、RECIST1.1基準を用いて6週間ごとに評価した。副次的評価項目は無増悪生存期間、奏効持続期間、安全性とした
結果:
2016年03月から2017年10月にかけて、37人の患者が登録された。治療開始後に臨床試験参加の同意を取り下げた1人を除くすべての患者が効果判定対象となった。年齢中央値は60歳で、22人(61%)は男性だった。61%の患者は初回治療としてオシメルチニブを使用した。検出されたEGFR遺伝子変異の内訳は、G719X(19人、53%)、L861Q(9人、25%)、S768I(8人、22%)、その他(4人、11%)だった。奏効割合は50%(36人中18人、95%信頼区間は33-67%)だった。無増悪生存期間中央値は8.2ヶ月(95%信頼区間は5.9-10.5ヶ月)で、生存期間中央値は未到達だった。奏効持続期間中央値は11.2ヶ月(95%信頼区間は7.7-14.7ヶ月)だった。有害事象は発疹(11人、31%)、掻痒(9人、25%)、食欲不振(9人、25%)、下痢(8人、22%)、呼吸困難(8人、22%)だった。
結論:
オシメルチニブは"uncommon"なEGFR遺伝子変異を有する非小細胞肺がん患者において、良好な治療効果と忍容(対応)可能な毒性を示した。
今回の論文は、そこに一定の解を与えるものである。
無増悪生存期間中央値は8.2ヶ月とcommon mutationに対するオシメルチニブの成績を考えるとやや低い気もするが、これは致し方ないところだろう。
全生存期間中央値がいまだ未到達というのは頼もしい。
Osimertinib for Patients With Non–Small-Cell Lung Cancer Harboring Uncommon EGFR Mutations: A Multicenter, Open-Label, Phase II Trial (KCSG-LU15-09)
Jang Ho Cho et al., DOI: 10.1200/JCO.19.00931 Journal of Clinical Oncology
Published online December 11, 2019.
目的:
EGFR遺伝子変異陽性非小細胞肺がん患者の約10%は、いわゆる"uncommon"な遺伝子変異を有している。今回は、こうした"uncommon"なEGFR遺伝子変異を有する非小細胞肺がんの患者を対象に、オシメルチニブ療法の有効性と安全性を検討した。
患者と方法:
多施設共同、単アーム、オープンラベル、第II相臨床試験として韓国国内で本試験を行った。患者は組織学的に診断された進行もしくは術後再発のEGFR遺伝子変異陽性非小細胞肺がん患者とした。EGFR遺伝子変異としてはExon 19欠失変異、L858R一塩基置換変異、T790M一塩基置換変異、Exon 20挿入変異は除外した。主要評価項目は奏効割合とし、RECIST1.1基準を用いて6週間ごとに評価した。副次的評価項目は無増悪生存期間、奏効持続期間、安全性とした
結果:
2016年03月から2017年10月にかけて、37人の患者が登録された。治療開始後に臨床試験参加の同意を取り下げた1人を除くすべての患者が効果判定対象となった。年齢中央値は60歳で、22人(61%)は男性だった。61%の患者は初回治療としてオシメルチニブを使用した。検出されたEGFR遺伝子変異の内訳は、G719X(19人、53%)、L861Q(9人、25%)、S768I(8人、22%)、その他(4人、11%)だった。奏効割合は50%(36人中18人、95%信頼区間は33-67%)だった。無増悪生存期間中央値は8.2ヶ月(95%信頼区間は5.9-10.5ヶ月)で、生存期間中央値は未到達だった。奏効持続期間中央値は11.2ヶ月(95%信頼区間は7.7-14.7ヶ月)だった。有害事象は発疹(11人、31%)、掻痒(9人、25%)、食欲不振(9人、25%)、下痢(8人、22%)、呼吸困難(8人、22%)だった。
結論:
オシメルチニブは"uncommon"なEGFR遺伝子変異を有する非小細胞肺がん患者において、良好な治療効果と忍容(対応)可能な毒性を示した。




