2020年07月29日
ついに岩手県でもCoVID-19発生
ついに「聖域」岩手県でも新型コロナウイルス感染患者が発生した様子。
こうしてみると、大分県はいつの間にか、相対的に患者数が少ない都道府県になってしまった。
着実に感染は交通網を介して広がっていると感じられる。
県外移動者、旅行者が増えたのだから、当然の帰結だろう。
私もつい最近、墓参のため、県外に自家用車で移動したので、偉そうなことは言えない。
不必要な移動は相応の感染リスクで報いられるということを自覚して行動したい。

こうしてみると、大分県はいつの間にか、相対的に患者数が少ない都道府県になってしまった。
着実に感染は交通網を介して広がっていると感じられる。
県外移動者、旅行者が増えたのだから、当然の帰結だろう。
私もつい最近、墓参のため、県外に自家用車で移動したので、偉そうなことは言えない。
不必要な移動は相応の感染リスクで報いられるということを自覚して行動したい。

2020年07月29日
経気管支肺生検の下準備
他のがんと同じく、肺がんも確定診断がつかなければ治療指針が立てられない。
多岐にわたるドライバー遺伝子変異の検索、PD-L1発現状態の情報が不可欠となり、気管支鏡による生検診断の重要性は増す一方である。
研修医の頃には気管支鏡の正しく持つことすら満足にできなかった私も、もう気管支鏡を握り続けて20年になる。
今の勤め先では、気管支鏡ナビゲーションシステムは辛うじて利用可能だが、気管支鏡下超音波走査(EBUS)やガイドシース法は利用できず、気管支鏡下生検そのものは古典的なやり方で行っている。
自分なりに今の手法が完成形と考えているので、その方法を残しておく。
1、まずは「枝読み」をする。
どの気管支をたどっていけば目的とする病巣に到達できるか、見通しを立てる。
気管支鏡ナビゲーションシステムを利用できる環境にあれば、利用する。
私の場合は「BF-Navi」を利用しており、薄切CTの縦隔条件データを利用すると末梢まで追跡できることが多い。
気管支鏡ナビゲーションシステムが利用できない環境では、以下の書籍で勉強して、CT画像から気管支を追跡する。
・栗本 典昭 先生,森田 克彦先生による書籍「末梢病変を捉える気管支鏡“枝読み”術」
BF-Naviとマニュアルでの枝読み、両方行って突き合わせるとなおよい。
2、枝の見取り図を作成する。
私が初めて気管支鏡に接したころは、まだ電子スコープは普及しておらず、ファイバースコープを利用していた。
光源にファイバースコープを接続して、気管支の所見をリアルタイムに確認できるのは術者のみ、所見はレンズの部分にマウントしたフィルムカメラで撮影して、のちに現像してから確認をするといった、今からすると考えられないようなローテク検査だった。
しかし、だからこそこの見取り図を作成することの大切さが身に沁みて分かっている。
主要な気管支の分岐部は、写真に収めて所見用紙にスケッチを残す習慣が身についている。
ここでいう見取り図とは、この気管支分岐の所見を紙に書きだすことをいう。
病巣に至るまでに経由する気管支を紙に書きだすのだ。
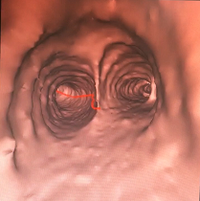









この見取り図を検査中に傍らに置き、所見を確認しながら病巣に近づいていく。
末梢に進むとやむを得ず視野を上下反転させたり、左右にローテーションさせたりする必要に迫られるため、気管支鏡ナビゲーションシステムのモニター画像に頼っていると位置を見失ってしまうことがある。
紙に書きだしておけば、気管支鏡の操作とともに助手に紙を回転させてもらえば事足りるので、モニターよりも遥かに同期させやすい。
これ以上は気管支鏡が進まない、というところまで来たら、そこからどの気管支側面に沿わせて鉗子やブラシを入れていけば病巣に近づくかを確認しながら、続きの作業をする。
3、鉗子やブラシが病巣に当たっているかどうかを確認する。
EBUSを利用できる環境にあればEBUSを利用すればよいし、なければ透視で確認する。
EBUSがあってもなくても、透視での確認は必須である。
そのため、見取り図では必ず病巣の部位を胸部レントゲンの模式図上に明記しておく。
若手の先生を見ていると、透視で的中しているかどうかをないがしろにしているように思われることが多々ある。
鉗子やブラシで病巣にアプローチしたとき、透視所見で病巣が動いているかどうかは、的中しているかどうかを見る上で大切だと思う。
また、EBUSで的中したとしても、その経路イメージをレントゲン撮影しておき、のちに通常鉗子でアプローチして十分量の組織を採取することが欠かせない。
これをしておかないと、組織量不足で遺伝子変異やPD-L1の評価ができないことになりかねない。
基本的にはこれだけ。
あとは、気管支鏡のハンドリング、鉗子やブラシのモディファイ、誘導鉗子の利用などの細かいテクニック、検査中の迅速細胞診などの付随事項はあるが、診断率を上げるための基本は上記の1、2、3だと思う。
今回例示した患者の病巣は長径10mm未満、透視画像ではほぼ不可視だったが、予定通りの気管支を追跡できた。
病理診断の中間報告が先ほど返ってきた。
P40(扁平上皮癌で陽性)とTTF-1(腺癌で陽性)の免疫染色を追加するとのことなので、低分化な非小細胞肺癌であることは間違いなさそう。
結果がどう出るか楽しみだ。
多岐にわたるドライバー遺伝子変異の検索、PD-L1発現状態の情報が不可欠となり、気管支鏡による生検診断の重要性は増す一方である。
研修医の頃には気管支鏡の正しく持つことすら満足にできなかった私も、もう気管支鏡を握り続けて20年になる。
今の勤め先では、気管支鏡ナビゲーションシステムは辛うじて利用可能だが、気管支鏡下超音波走査(EBUS)やガイドシース法は利用できず、気管支鏡下生検そのものは古典的なやり方で行っている。
自分なりに今の手法が完成形と考えているので、その方法を残しておく。
1、まずは「枝読み」をする。
どの気管支をたどっていけば目的とする病巣に到達できるか、見通しを立てる。
気管支鏡ナビゲーションシステムを利用できる環境にあれば、利用する。
私の場合は「BF-Navi」を利用しており、薄切CTの縦隔条件データを利用すると末梢まで追跡できることが多い。
気管支鏡ナビゲーションシステムが利用できない環境では、以下の書籍で勉強して、CT画像から気管支を追跡する。
・栗本 典昭 先生,森田 克彦先生による書籍「末梢病変を捉える気管支鏡“枝読み”術」
BF-Naviとマニュアルでの枝読み、両方行って突き合わせるとなおよい。
2、枝の見取り図を作成する。
私が初めて気管支鏡に接したころは、まだ電子スコープは普及しておらず、ファイバースコープを利用していた。
光源にファイバースコープを接続して、気管支の所見をリアルタイムに確認できるのは術者のみ、所見はレンズの部分にマウントしたフィルムカメラで撮影して、のちに現像してから確認をするといった、今からすると考えられないようなローテク検査だった。
しかし、だからこそこの見取り図を作成することの大切さが身に沁みて分かっている。
主要な気管支の分岐部は、写真に収めて所見用紙にスケッチを残す習慣が身についている。
ここでいう見取り図とは、この気管支分岐の所見を紙に書きだすことをいう。
病巣に至るまでに経由する気管支を紙に書きだすのだ。

この見取り図を検査中に傍らに置き、所見を確認しながら病巣に近づいていく。
末梢に進むとやむを得ず視野を上下反転させたり、左右にローテーションさせたりする必要に迫られるため、気管支鏡ナビゲーションシステムのモニター画像に頼っていると位置を見失ってしまうことがある。
紙に書きだしておけば、気管支鏡の操作とともに助手に紙を回転させてもらえば事足りるので、モニターよりも遥かに同期させやすい。
これ以上は気管支鏡が進まない、というところまで来たら、そこからどの気管支側面に沿わせて鉗子やブラシを入れていけば病巣に近づくかを確認しながら、続きの作業をする。
3、鉗子やブラシが病巣に当たっているかどうかを確認する。
EBUSを利用できる環境にあればEBUSを利用すればよいし、なければ透視で確認する。
EBUSがあってもなくても、透視での確認は必須である。
そのため、見取り図では必ず病巣の部位を胸部レントゲンの模式図上に明記しておく。
若手の先生を見ていると、透視で的中しているかどうかをないがしろにしているように思われることが多々ある。
鉗子やブラシで病巣にアプローチしたとき、透視所見で病巣が動いているかどうかは、的中しているかどうかを見る上で大切だと思う。
また、EBUSで的中したとしても、その経路イメージをレントゲン撮影しておき、のちに通常鉗子でアプローチして十分量の組織を採取することが欠かせない。
これをしておかないと、組織量不足で遺伝子変異やPD-L1の評価ができないことになりかねない。
基本的にはこれだけ。
あとは、気管支鏡のハンドリング、鉗子やブラシのモディファイ、誘導鉗子の利用などの細かいテクニック、検査中の迅速細胞診などの付随事項はあるが、診断率を上げるための基本は上記の1、2、3だと思う。
今回例示した患者の病巣は長径10mm未満、透視画像ではほぼ不可視だったが、予定通りの気管支を追跡できた。
病理診断の中間報告が先ほど返ってきた。
P40(扁平上皮癌で陽性)とTTF-1(腺癌で陽性)の免疫染色を追加するとのことなので、低分化な非小細胞肺癌であることは間違いなさそう。
結果がどう出るか楽しみだ。
2020年07月26日
レイ・ダリオが経験したセカンド・オピニオン
ものの考え方が偏らないようにと思って、週末はできるだけ一般書を読むようにしている。
今読んでいるのは、レイ・ダリオの「PRINCIPLES」という書籍。
金融の会社を長く経営してきた方のようだが、人生や仕事においてよって立つ原理・原則をまとめたのだそうだ。
全社員、考え方や成功、失敗を徹底的にオープンにし、議論するという企業風土でずっとやってきたらしい。
そんな彼が体験したセカンド・オピニオンの逸話。
「最悪に備え、最善に期待する」ということと、セカンド・オピニオンでありがちな医師の心理がよく描かれているので、引用する。
信頼性の高い人のさまざまな角度から見た意見を聞くアプローチは人生に大きな影響を与える。
私にとっては生死を分かつ違いをもたらした。
2013年06月、ジョンズ・ホプキンス病院で私は定期人間ドックを受けた。
そこで私は前がん症状のバレット食道高度異形成があるといわれた。
異形成はがんの初期段階で、食道がんに発展する確率は比較的高い。
年間15%のケースだという。
食道がんは死に至るものだ。
だから治療をしないでいれば、3ねんから5年でがんにかかり死ぬだろう。
このような場合には食道を切除するのが通常だが、私の場合何か特別な状態があって、それができないということだった。
医者は様子見を勧めた。
その後の何週間で、私は死に備えた計画を立てつつ、生きるために戦った。
この診断を受けて、大切な人たちが私なしでもやっていけるようにし、残りの時間で彼らと人生を楽しむ時間が取れることをラッキーだと思った。
生まれたばかりの初孫と触れ合う時間があるだろう。
だが、あって当たり前と思うほどの時間はない。
だがここまで読んでお察しの通り、私は、たとえ専門家から最善だと言われても鵜呑みにせず、信頼性のある人から多面的な意見を聞きたいと思った。
そこで私の家庭医であるグレーザー先生に頼んで、この病気の領域に詳しい4人の専門家にアポを取った。
最初に訪問したのは、ある大手のがん専門病院の胸部手術の部長だった。
彼女は私の状況は進行が速いといい、最初の医者が言ったのとは異なり治療できる手術があるといった。
食道と胃を摘出し、少し残した食道と腸をつなげるやり方だ。
手術で死亡する確率は10%、寝たきりになる確率は70%だと言った。
だが生存の確率が高いので、彼女の提案は真剣に検討する必要があった。
私は彼女に、最初に診断して様子見を勧めたジョンズ・ホプキンス病院の医者と話をしてほしいと思った。
そこで、その場ですぐ、もう1人の医者に電話をして相手の見方をどう思うか尋ねた。
これは瞠目の経験だった。
2人の医者は私が個別に会ったときには全く異なる意見を言っていたのに、2人が電話で話すと、意見の違いを少なくして相手を持ち上げるようにした。
最善の回答を出そうとせず、プロとしての礼儀を前面に押し出したのだ。
それでも2人の見方が違うことは明らかで、彼らの話を聞いて私の理解は深まった。
翌日、私は第三の医者に会った。
世界的に襲名な専門家、研究科で別の著名な病院にいた。
彼は、3ヶ月おきに内視鏡検査をすれば問題がないといった。
彼は、これは体内に出た皮膚がんのようなもので、観察を続け、新たに成長して血流に転移する前に切除してしまえば、大丈夫だという。
彼によれば、このような観察措置をした患者の結果は食道を切除した場合と変わりがないという。
平たく言えば、患者はがんで死んでいないということだった。
ときどき検査を受けて、ちょっと切除すること以外は正常な生活を送れるというのだ。
まとめると、48時間の間に、死の宣告から開腹手術、そして最後に多少不便になるが簡単な、異常があるかどうかを見て悪くなる前に切除する方法へたどり着いた。
この医者は間違っているのか?
グレーザー先生と一緒にあと2人の世界的に有名な専門家に会った。
2人は内視鏡検査をしてもいいだろうというので、私はそれに従うことにした。
彼らは私の食道から組織を切り取り、病理検査のためにラボに送った。
ショックだったとしか言えない。
組織を分析したところ、高度異形成は全くなかったのだ!
専門家ですら過ちを犯す。
徹底的にオープンになり、立派な人の意見を多方面から聞いて把握することは割に合うということだ。
他の意見を聞こうとしなかったら、私の人生は全く違ったものになっていただろう。
今読んでいるのは、レイ・ダリオの「PRINCIPLES」という書籍。
金融の会社を長く経営してきた方のようだが、人生や仕事においてよって立つ原理・原則をまとめたのだそうだ。
全社員、考え方や成功、失敗を徹底的にオープンにし、議論するという企業風土でずっとやってきたらしい。
そんな彼が体験したセカンド・オピニオンの逸話。
「最悪に備え、最善に期待する」ということと、セカンド・オピニオンでありがちな医師の心理がよく描かれているので、引用する。
信頼性の高い人のさまざまな角度から見た意見を聞くアプローチは人生に大きな影響を与える。
私にとっては生死を分かつ違いをもたらした。
2013年06月、ジョンズ・ホプキンス病院で私は定期人間ドックを受けた。
そこで私は前がん症状のバレット食道高度異形成があるといわれた。
異形成はがんの初期段階で、食道がんに発展する確率は比較的高い。
年間15%のケースだという。
食道がんは死に至るものだ。
だから治療をしないでいれば、3ねんから5年でがんにかかり死ぬだろう。
このような場合には食道を切除するのが通常だが、私の場合何か特別な状態があって、それができないということだった。
医者は様子見を勧めた。
その後の何週間で、私は死に備えた計画を立てつつ、生きるために戦った。
この診断を受けて、大切な人たちが私なしでもやっていけるようにし、残りの時間で彼らと人生を楽しむ時間が取れることをラッキーだと思った。
生まれたばかりの初孫と触れ合う時間があるだろう。
だが、あって当たり前と思うほどの時間はない。
だがここまで読んでお察しの通り、私は、たとえ専門家から最善だと言われても鵜呑みにせず、信頼性のある人から多面的な意見を聞きたいと思った。
そこで私の家庭医であるグレーザー先生に頼んで、この病気の領域に詳しい4人の専門家にアポを取った。
最初に訪問したのは、ある大手のがん専門病院の胸部手術の部長だった。
彼女は私の状況は進行が速いといい、最初の医者が言ったのとは異なり治療できる手術があるといった。
食道と胃を摘出し、少し残した食道と腸をつなげるやり方だ。
手術で死亡する確率は10%、寝たきりになる確率は70%だと言った。
だが生存の確率が高いので、彼女の提案は真剣に検討する必要があった。
私は彼女に、最初に診断して様子見を勧めたジョンズ・ホプキンス病院の医者と話をしてほしいと思った。
そこで、その場ですぐ、もう1人の医者に電話をして相手の見方をどう思うか尋ねた。
これは瞠目の経験だった。
2人の医者は私が個別に会ったときには全く異なる意見を言っていたのに、2人が電話で話すと、意見の違いを少なくして相手を持ち上げるようにした。
最善の回答を出そうとせず、プロとしての礼儀を前面に押し出したのだ。
それでも2人の見方が違うことは明らかで、彼らの話を聞いて私の理解は深まった。
翌日、私は第三の医者に会った。
世界的に襲名な専門家、研究科で別の著名な病院にいた。
彼は、3ヶ月おきに内視鏡検査をすれば問題がないといった。
彼は、これは体内に出た皮膚がんのようなもので、観察を続け、新たに成長して血流に転移する前に切除してしまえば、大丈夫だという。
彼によれば、このような観察措置をした患者の結果は食道を切除した場合と変わりがないという。
平たく言えば、患者はがんで死んでいないということだった。
ときどき検査を受けて、ちょっと切除すること以外は正常な生活を送れるというのだ。
まとめると、48時間の間に、死の宣告から開腹手術、そして最後に多少不便になるが簡単な、異常があるかどうかを見て悪くなる前に切除する方法へたどり着いた。
この医者は間違っているのか?
グレーザー先生と一緒にあと2人の世界的に有名な専門家に会った。
2人は内視鏡検査をしてもいいだろうというので、私はそれに従うことにした。
彼らは私の食道から組織を切り取り、病理検査のためにラボに送った。
ショックだったとしか言えない。
組織を分析したところ、高度異形成は全くなかったのだ!
専門家ですら過ちを犯す。
徹底的にオープンになり、立派な人の意見を多方面から聞いて把握することは割に合うということだ。
他の意見を聞こうとしなかったら、私の人生は全く違ったものになっていただろう。
2020年07月23日
国内感染状況と全国新幹線網
新型コロナウイルスPCR陽性者数、全国的に増加の一途をたどっている。
発症者の年代、地域、背景など、多様性に富み始めた。
東京都を除いたGo To トラベル キャンペーンが始まったそう。
お出かけする前に、以下の2枚の地図をよく見比べてほしい。
お出かけする方は、どうかご無事で。
そして、医療に過度の期待をしないように。
自分の身は自分で守るしかない。


発症者の年代、地域、背景など、多様性に富み始めた。
東京都を除いたGo To トラベル キャンペーンが始まったそう。
お出かけする前に、以下の2枚の地図をよく見比べてほしい。
お出かけする方は、どうかご無事で。
そして、医療に過度の期待をしないように。
自分の身は自分で守るしかない。


2020年07月20日
線を引いて、のちに検証する
以前、勤め先で感染対策委員会の委員長を務めていたときは、インフルエンザ流行期の対策立案で、随分と「線引き」に苦労した。
今では随分一般的になった「濃厚接触者」という用語。
院内でインフルエンザ患者が発生したとき、どんな患者・職員を「濃厚接触者」としてオセルタミビル予防内服対象者とするか、随分と考えた。
結局、「2m以内の距離で」「30分間以上」インフルエンザ患者の近くにいた人を「濃厚接触者」と定義した。
そのため、この基準を満たさないように、インフルエンザ流行シーズン中はリハビリスタッフの介入時間を30分以内に制限するなどした。
濃厚接触患者の隔離期間を「48時間」とするのか、「72時間」とするのかでも、随分と議論になった。
面会制限も然り。
インフルエンザ流行期は、乳幼児や「生徒」さんには面会を控えていただくようにした。
要するに、高校生以下は面会禁止、ということである。
随分と煩雑な手続きが必要で、後任に職責を譲ってからはかなり見直しが進められ、改善した。
こうした経緯を経て、院内でのインフルエンザ感染拡大は、随分と抑えられるようになった。
翻って新型コロナウイルスである。
もはやだれの目にも疑いなく、新型コロナウイルスは季節の制約を受けない。
高温多湿のこの時期の日本でも全くお構いなしである。
メキシコから世界へと瞬く間に広がった2009年の新型インフルエンザを彷彿とさせる。
新型コロナウイルスは、すでに半年以上も活発に猛威をふるい続けている。
全く出口が見通せない。
現在勤め先の病院では、
「福岡と、九州外の都道府県および海外からの家族、知人の病院建物内立ち入り、面会は禁止する」
という方針が貫かれている。
我が国における現在の流行状況を見るに、これは全く妥当な対応で、むしろ強化しなくてもいいのだろうかという気になる。
「面会ができないのなら、本人が外泊して、そこに家族が会いに行くのならいいだろう」
という声も聞こえてきそうだが、ことはそう簡単ではない。
もし万が一ご家族が、無症状ながら新型コロナウイルスの潜伏感染を起こしており、それが本人へ移されたら、その後どうなるだろうか。
本人の体調悪化もさることながら、新型コロナウイルスに感染した状態で外泊から戻ってきたら、そこから他の患者や病院スタッフに広がったら、と想像すると、空恐ろしい。
とはいえ、今のままでは、いつまでたっても本州に住んでいるご家族との面会の見通しが立たない。
進行肺がんで、このまま病状が進行するとそれほど長生きは期待できない、となると、この懸念はさらに強まる。
線の引き方が、すこぶる難しい。
今では随分一般的になった「濃厚接触者」という用語。
院内でインフルエンザ患者が発生したとき、どんな患者・職員を「濃厚接触者」としてオセルタミビル予防内服対象者とするか、随分と考えた。
結局、「2m以内の距離で」「30分間以上」インフルエンザ患者の近くにいた人を「濃厚接触者」と定義した。
そのため、この基準を満たさないように、インフルエンザ流行シーズン中はリハビリスタッフの介入時間を30分以内に制限するなどした。
濃厚接触患者の隔離期間を「48時間」とするのか、「72時間」とするのかでも、随分と議論になった。
面会制限も然り。
インフルエンザ流行期は、乳幼児や「生徒」さんには面会を控えていただくようにした。
要するに、高校生以下は面会禁止、ということである。
随分と煩雑な手続きが必要で、後任に職責を譲ってからはかなり見直しが進められ、改善した。
こうした経緯を経て、院内でのインフルエンザ感染拡大は、随分と抑えられるようになった。
翻って新型コロナウイルスである。
もはやだれの目にも疑いなく、新型コロナウイルスは季節の制約を受けない。
高温多湿のこの時期の日本でも全くお構いなしである。
メキシコから世界へと瞬く間に広がった2009年の新型インフルエンザを彷彿とさせる。
新型コロナウイルスは、すでに半年以上も活発に猛威をふるい続けている。
全く出口が見通せない。
現在勤め先の病院では、
「福岡と、九州外の都道府県および海外からの家族、知人の病院建物内立ち入り、面会は禁止する」
という方針が貫かれている。
我が国における現在の流行状況を見るに、これは全く妥当な対応で、むしろ強化しなくてもいいのだろうかという気になる。
「面会ができないのなら、本人が外泊して、そこに家族が会いに行くのならいいだろう」
という声も聞こえてきそうだが、ことはそう簡単ではない。
もし万が一ご家族が、無症状ながら新型コロナウイルスの潜伏感染を起こしており、それが本人へ移されたら、その後どうなるだろうか。
本人の体調悪化もさることながら、新型コロナウイルスに感染した状態で外泊から戻ってきたら、そこから他の患者や病院スタッフに広がったら、と想像すると、空恐ろしい。
とはいえ、今のままでは、いつまでたっても本州に住んでいるご家族との面会の見通しが立たない。
進行肺がんで、このまま病状が進行するとそれほど長生きは期待できない、となると、この懸念はさらに強まる。
線の引き方が、すこぶる難しい。
2020年07月19日
SARS-CoV-2の傾向と対策
経済を救うために警戒を緩めて、予想通り揺り返しがやってきた。
国の施策を批判する向きもあるが、経済を救うためにやむを得ず、という面もあるのだろう。
新型コロナ感染は免れたけれど、経営や生活に困窮して自ら命を絶つ、というような事態も十分に起こりえる。
難しい話は抜きにして、ごくごく基本的なことをおさらい。
・手を洗う
・うがいをする
・歯を磨く
・帰ってきたら着替える
・帰ってきたら風呂に入る
・まめに換気する
・たくさん人がいるところには行かない
・閉鎖空間内には行かない
・周りの人との距離を保つ
・マスクは「自分が新型コロナウイルスを持っているかも」と疑い、「自分以外の人を守るために」身に着ける
・生活行動半径をできる限り小さくする
・雨の降ってない日はマスクを外して散歩する
・今目の前で起こっていることは、2週間前の出来事を映す鏡と心得る
これからどうなるかは、我々は経験として知っている。
どんなことをすれば感染者が減ってくるかも経験として知っている。
知識としてでなく、経験として知っている、ということが大きい。
今年上半期の経験を活かそう。
医療従事者としての矜持を保ち、行動を律しよう。
がん薬物療法をしている患者が発熱した場合、もはやSARS-CoV-2 PCRはmust-doだろうか。
国の施策を批判する向きもあるが、経済を救うためにやむを得ず、という面もあるのだろう。
新型コロナ感染は免れたけれど、経営や生活に困窮して自ら命を絶つ、というような事態も十分に起こりえる。
難しい話は抜きにして、ごくごく基本的なことをおさらい。
・手を洗う
・うがいをする
・歯を磨く
・帰ってきたら着替える
・帰ってきたら風呂に入る
・まめに換気する
・たくさん人がいるところには行かない
・閉鎖空間内には行かない
・周りの人との距離を保つ
・マスクは「自分が新型コロナウイルスを持っているかも」と疑い、「自分以外の人を守るために」身に着ける
・生活行動半径をできる限り小さくする
・雨の降ってない日はマスクを外して散歩する
・今目の前で起こっていることは、2週間前の出来事を映す鏡と心得る
これからどうなるかは、我々は経験として知っている。
どんなことをすれば感染者が減ってくるかも経験として知っている。
知識としてでなく、経験として知っている、ということが大きい。
今年上半期の経験を活かそう。
医療従事者としての矜持を保ち、行動を律しよう。
がん薬物療法をしている患者が発熱した場合、もはやSARS-CoV-2 PCRはmust-doだろうか。
2020年07月15日
患者提案型・医師主導治験「KISEKI trial」、計画進行中
EGFRチロシンキナーゼ阻害薬既治療T790M耐性変異陰性、もしくは中枢神経系転移による病勢進行後の非小細胞肺がん患者を対象としたオシメルチニブ投与の有効性を検証する「KISEKI」試験が進行中とのこと。
おそらく実地臨床では既に一定数行われているであろう本治療、しっかり検証して頂けるとありがたい。
応援しています。
https://oncolo.jp/feature/20200707t
おそらく実地臨床では既に一定数行われているであろう本治療、しっかり検証して頂けるとありがたい。
応援しています。
https://oncolo.jp/feature/20200707t
2020年07月15日
第3世代EGFRチロシンキナーゼ阻害薬使用後の中枢神経転移を有する患者に、オシメルチニブ「倍返し」
オシメルチニブを含む第3世代チロシンキナーゼ阻害薬使用後に中枢神経転移(脳転移、髄膜癌腫症を含む)で病勢進行に至った患者に、オシメルチニブを「倍返し」するという臨床試験が行われたようだ。
毒性について、肝障害に関する記載はないが、下痢はGrade 2以下ながら40-50%に見られたとのことで、やはり無視できない毒性なのだろう。
A phase II, multicenter, two cohort study of 160 mg osimertinib in EGFR T790M-positive non-small cell lung cancer patients with brain metastases or leptomeningeal disease who progressed on prior EGFR TKI therapy
S.Park et al., Ann Oncol in press, 2020
https://doi.org/10.1016/j.annonc.2020.06.017
背景:
EGFR遺伝子変異陽性非小細胞肺がん患者で、EGFRチロシンキナーゼ阻害薬による治療を受けた人のうち、40%程度は脳転移や髄膜癌腫症による病勢進行に至る。オシメルチニブは第3世代、非可逆性、経口投与のEGFRチロシンキナーゼ阻害薬であるが、活動性中枢神経転移に対する効果を示している。しかし、脳転移や髄膜癌腫症に対するオシメルチニブ160mg/日(通常用量である80mg/日の2倍量)治療がどの程度の効果を示すのかは明らかでない。
患者と方法:
今回の前向き単アーム、2コホートから構成される臨床試験は、EGFRチロシンキナーゼ阻害薬による前治療ののちに病勢進行に至った進行非小細胞肺がん患者で、T790M耐性変異が確認され、脳転移もしくは髄膜癌腫症を有するものを対象に、オシメルチニブ160mg/日内服治療の効果を検証する試験である。主要評価項目は各コホートごとに個別に設定した。すなわち、脳転移コホートでは奏効割合とし、期待奏効割合を30%と見積もった。一方髄膜癌腫症コホートでは生存期間とし、期待生存期間を5か月と見積もった。
結果:
経過観察期間中央値は、脳転移コホートで10.1ヶ月、髄膜癌腫症コホートで9.6ヶ月だった。脳転移コホート(計40人)では、頭蓋内病巣に関する奏効割合は55.0%、同じく病勢コントロール割合は77.5%だった。無増悪生存期間中央値は7.6ヶ月(95%信頼区間は5.0-16.6ヶ月)、生存期間中央値は16.9ヶ月(95%信頼区間は7.9ヶ月-未到達)だった。髄膜癌腫症コホート(計40人)では、頭蓋内病巣に関する病勢コントロール割合は92.5%、完全奏効割合は12.5%だった。生存期間中央値は13.3ヶ月(95%信頼区間は9.1ヶ月から未到達)だった。無増悪生存期間中央値は8.0ヶ月(95%信頼区間は7.2ヶ月から未到達)だった。前治療でどのT790M耐性変異に活性を示すEGFRチロシンキナーゼ阻害薬を使用したかのサブグループ解析では、オシメルチニブ80mg/日とその他の第3世代EGFRチロシンキナーゼ阻害薬の間で、無増悪生存期間の有意差は認められなかった(脳転移コホート18人ではp=0.39、髄膜癌腫症コホート17人ではp=0.85)。脳転移コホートでは、脳転移巣に対する放射線治療歴は無増悪生存期間延長に関する予後良好因子だった(ハザード比0.42、p=0.04)。主要な有害事象は食欲不振、下痢、発疹だったが、ほとんどGrade 1-2に留まっていた。
結論:
160mg/回のオシメルチニブ投与は、今回の治療対象となった患者に対して有望な腫瘍縮小効果と生存期間延長効果を示し、毒性も許容範囲内だった。
毒性について、肝障害に関する記載はないが、下痢はGrade 2以下ながら40-50%に見られたとのことで、やはり無視できない毒性なのだろう。
A phase II, multicenter, two cohort study of 160 mg osimertinib in EGFR T790M-positive non-small cell lung cancer patients with brain metastases or leptomeningeal disease who progressed on prior EGFR TKI therapy
S.Park et al., Ann Oncol in press, 2020
https://doi.org/10.1016/j.annonc.2020.06.017
背景:
EGFR遺伝子変異陽性非小細胞肺がん患者で、EGFRチロシンキナーゼ阻害薬による治療を受けた人のうち、40%程度は脳転移や髄膜癌腫症による病勢進行に至る。オシメルチニブは第3世代、非可逆性、経口投与のEGFRチロシンキナーゼ阻害薬であるが、活動性中枢神経転移に対する効果を示している。しかし、脳転移や髄膜癌腫症に対するオシメルチニブ160mg/日(通常用量である80mg/日の2倍量)治療がどの程度の効果を示すのかは明らかでない。
患者と方法:
今回の前向き単アーム、2コホートから構成される臨床試験は、EGFRチロシンキナーゼ阻害薬による前治療ののちに病勢進行に至った進行非小細胞肺がん患者で、T790M耐性変異が確認され、脳転移もしくは髄膜癌腫症を有するものを対象に、オシメルチニブ160mg/日内服治療の効果を検証する試験である。主要評価項目は各コホートごとに個別に設定した。すなわち、脳転移コホートでは奏効割合とし、期待奏効割合を30%と見積もった。一方髄膜癌腫症コホートでは生存期間とし、期待生存期間を5か月と見積もった。
結果:
経過観察期間中央値は、脳転移コホートで10.1ヶ月、髄膜癌腫症コホートで9.6ヶ月だった。脳転移コホート(計40人)では、頭蓋内病巣に関する奏効割合は55.0%、同じく病勢コントロール割合は77.5%だった。無増悪生存期間中央値は7.6ヶ月(95%信頼区間は5.0-16.6ヶ月)、生存期間中央値は16.9ヶ月(95%信頼区間は7.9ヶ月-未到達)だった。髄膜癌腫症コホート(計40人)では、頭蓋内病巣に関する病勢コントロール割合は92.5%、完全奏効割合は12.5%だった。生存期間中央値は13.3ヶ月(95%信頼区間は9.1ヶ月から未到達)だった。無増悪生存期間中央値は8.0ヶ月(95%信頼区間は7.2ヶ月から未到達)だった。前治療でどのT790M耐性変異に活性を示すEGFRチロシンキナーゼ阻害薬を使用したかのサブグループ解析では、オシメルチニブ80mg/日とその他の第3世代EGFRチロシンキナーゼ阻害薬の間で、無増悪生存期間の有意差は認められなかった(脳転移コホート18人ではp=0.39、髄膜癌腫症コホート17人ではp=0.85)。脳転移コホートでは、脳転移巣に対する放射線治療歴は無増悪生存期間延長に関する予後良好因子だった(ハザード比0.42、p=0.04)。主要な有害事象は食欲不振、下痢、発疹だったが、ほとんどGrade 1-2に留まっていた。
結論:
160mg/回のオシメルチニブ投与は、今回の治療対象となった患者に対して有望な腫瘍縮小効果と生存期間延長効果を示し、毒性も許容範囲内だった。
2020年07月12日
KEYNOTE-799試験 化学免疫放射線療法
現在のところ、局所進行非小細胞肺がんにおける免疫チェックポイント阻害薬の出番は、化学放射線療法後のデュルバルマブ維持療法のみである。
今回の臨床試験では、ペンブロリズマブを同時併用で開始して、最大17コース(1年間)続けるというもの。
治療スケジュールがトリッキーで、コホートA、コホートBともにexperimental armという香りがする。
第III相試験へ発展していくのだろうが、さてreference armをどうするか。
デュルバルマブ維持療法とのhead to headとするのか、いったん通常の化学放射線療法(海外の臨床試験なので、シスプラチン+エトポシド+放射線治療かな)との比較で勝って、デュルバルマブと同じ位置に上るのを目指すのか。
後者なら、まだデュルバルマブの立ち位置は安泰だろう。
なぜって、治療内容が煩雑だから、デュルバルマブに勝たない限りは誰もやろうとしないだろう。
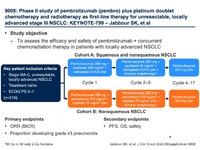
Phase II study of pembrolizumab (pembro) plus platinum doublet chemotherapy and radiotherapy as first-line therapy for unresectable, locally advanced stage III NSCLC: KEYNOTE-799.
Salma K. Jabbour et al., ASCO 2020 Abst.#9008
背景:
KEYNOTE-799試験は切除不能・局所進行III期非小細胞肺がんに対する化学放射線+ペンブロリズマブ併用療法を評価する臨床試験である。
方法:
今回の第II相、非無作為化、オープンラベル臨床試験において、病理学的に確定診断され、RECIST ver1.1における測定可能病変を有する切除不能未治療IIIA-IIIC期非小細胞肺がん患者を対象とした。コホートAではカルボプラチン6AUC+パクリタキセル200mg/㎡を①コース目で投与、3週間後以降の②、③コース目ではにカルボプラチン2AUC+パクリタキセル45mg/㎡を毎週投与した。コホートBではシスプラチン75mg/㎡+ペメトレキセド500mg/㎡を3週間ごとに①-③コース目まで投与した。どちらの治療を選ぶかは担当医の判断で選択可能とし、コホートBの治療は非扁平上皮がんの患者のみ選択可能とした。コホートA、B共通の治療として、ペンブロリズマブ200mg/㎡を3週ごとに、治療開始時から最高⑰コースまで投与し、併せて化学療法②、③コース施行中に併せて胸部放射線治療(1回2グレイ、30回分割照射、総線量60Gy)を行うこととした。主要評価項目は奏効割合およびGrade 3以上の肺臓炎発生割合とした。安全性評価は全ての患者に対して行い、有効性評価は15週以上の追跡調査ができた患者のみを対象とした。
結果:
2020年1月3日までに、コホートAに112人、コホートBに73人の患者が登録された。コホートAの63人、コホートBの52人は、この時点でもプロトコール治療を継続していた。コホートAにおける追跡期間中央値は8.3ヶ月(0.7-14.0ヶ月)、コホートBにおける追跡期間中央値は5.8ヶ月(0.2-13.7ヶ月)だった。奏効割合はコホートAで67.0%(90%信頼区間は58.9-74.3%)、コホートBで56.6%(90%信頼区間は44.4-68.2%)だった。Grade3以上の肺臓炎はコホートAで9人(8.0%、90%信頼区間は3.4-13.6%)、コホートBで4人(5.5%、90%信頼区間は1.8-12.1%)だった。治療関連のGrade3以上の有害事象はコホートAで72人(64.3%)、コホートBで30人(41.1%)に認めた。コホートAにおいて、肺臓炎による治療関連死を4人認めた。コホートAの患者登録は既に終了し、コホートBでは現在も集積中である。
・KEYNOTE-799試験 概略
・KEYNOTE-799試験 効果

・keynote-799試験 有害事象

今回の臨床試験では、ペンブロリズマブを同時併用で開始して、最大17コース(1年間)続けるというもの。
治療スケジュールがトリッキーで、コホートA、コホートBともにexperimental armという香りがする。
第III相試験へ発展していくのだろうが、さてreference armをどうするか。
デュルバルマブ維持療法とのhead to headとするのか、いったん通常の化学放射線療法(海外の臨床試験なので、シスプラチン+エトポシド+放射線治療かな)との比較で勝って、デュルバルマブと同じ位置に上るのを目指すのか。
後者なら、まだデュルバルマブの立ち位置は安泰だろう。
なぜって、治療内容が煩雑だから、デュルバルマブに勝たない限りは誰もやろうとしないだろう。
Phase II study of pembrolizumab (pembro) plus platinum doublet chemotherapy and radiotherapy as first-line therapy for unresectable, locally advanced stage III NSCLC: KEYNOTE-799.
Salma K. Jabbour et al., ASCO 2020 Abst.#9008
背景:
KEYNOTE-799試験は切除不能・局所進行III期非小細胞肺がんに対する化学放射線+ペンブロリズマブ併用療法を評価する臨床試験である。
方法:
今回の第II相、非無作為化、オープンラベル臨床試験において、病理学的に確定診断され、RECIST ver1.1における測定可能病変を有する切除不能未治療IIIA-IIIC期非小細胞肺がん患者を対象とした。コホートAではカルボプラチン6AUC+パクリタキセル200mg/㎡を①コース目で投与、3週間後以降の②、③コース目ではにカルボプラチン2AUC+パクリタキセル45mg/㎡を毎週投与した。コホートBではシスプラチン75mg/㎡+ペメトレキセド500mg/㎡を3週間ごとに①-③コース目まで投与した。どちらの治療を選ぶかは担当医の判断で選択可能とし、コホートBの治療は非扁平上皮がんの患者のみ選択可能とした。コホートA、B共通の治療として、ペンブロリズマブ200mg/㎡を3週ごとに、治療開始時から最高⑰コースまで投与し、併せて化学療法②、③コース施行中に併せて胸部放射線治療(1回2グレイ、30回分割照射、総線量60Gy)を行うこととした。主要評価項目は奏効割合およびGrade 3以上の肺臓炎発生割合とした。安全性評価は全ての患者に対して行い、有効性評価は15週以上の追跡調査ができた患者のみを対象とした。
結果:
2020年1月3日までに、コホートAに112人、コホートBに73人の患者が登録された。コホートAの63人、コホートBの52人は、この時点でもプロトコール治療を継続していた。コホートAにおける追跡期間中央値は8.3ヶ月(0.7-14.0ヶ月)、コホートBにおける追跡期間中央値は5.8ヶ月(0.2-13.7ヶ月)だった。奏効割合はコホートAで67.0%(90%信頼区間は58.9-74.3%)、コホートBで56.6%(90%信頼区間は44.4-68.2%)だった。Grade3以上の肺臓炎はコホートAで9人(8.0%、90%信頼区間は3.4-13.6%)、コホートBで4人(5.5%、90%信頼区間は1.8-12.1%)だった。治療関連のGrade3以上の有害事象はコホートAで72人(64.3%)、コホートBで30人(41.1%)に認めた。コホートAにおいて、肺臓炎による治療関連死を4人認めた。コホートAの患者登録は既に終了し、コホートBでは現在も集積中である。
・KEYNOTE-799試験 概略

・KEYNOTE-799試験 効果

・keynote-799試験 有害事象

2020年07月12日
いまさらと言われるのを覚悟でLUME-Lung 1試験のおさらい
以下の記事を書いてから、どうももやもやして仕方がないので、LUME-Lung 1試験の要約をきちんと残しておくことにした。
「進行性線維化を伴う間質性肺炎」の患者にニンテダニブを導入し、その上で二次治療以降でドセタキセルを使用する、という状況は起こりうるのでは・・・。
レトロスペクティブな検討でもいいので、ニンテダニブを使用しつつ他の薬物療法を行った患者の治療成績を見てみたいところだ。
ところで、本試験における治療関連死の確率はやや高い。
ドセタキセル+ニンテダニブ併用療法群において治療関連死の割合が5.3%というのは、無視できない数字である。
ドセタキセル単剤療法でも3.8%に上っており、参加施設における実地臨床の安全性そのものが問われかねない結果である。
・「進行性線維化を伴う間質性肺疾患」へ、ニンテダニブが使用可能に
http://oitahaiganpractice.junglekouen.com/e975490.html
Docetaxel plus nintedanib versus docetaxel plus placebo in patients with previously treated non-small-cell lung cancer (LUME-Lung 1): a phase 3, double-blind, randomised controlled trial
Martin Reck et al., Lancet Oncol VOLUME 15, ISSUE 2, P143-155, FEBRUARY 01, 2014
背景:
第III相LUME-Lung 1試験は非小細胞肺がん患者に対する二次治療としてのドセタキセル+ニンテダニブ併用療法の有効性と安全性を評価した試験である。
方法:
27ヶ国、211の参加施設から、初回化学療法後に病勢進行に至ったIIIB / IV期の非小細胞肺がん患者を集積した。割付調整因子はECOG-PS、過去のベバシズマブ投与歴、組織型、脳転移の有無とした。1:1の比率で無作為割付を行った。DN群では、ドセタキセル75mg/㎡を1日目に点滴投与し、ニンテダニブ200mg/回を1日2回、2日目から21日目まで服用した。D群では、ドセタキセル75mg/㎡を1日目に点滴投与し、偽薬を1日2回、2日目から21日目まで服用した。両群ともにプロトコール治療を3週ごとに反復し、忍容不能の有害事象が起こるまで、あるいは病勢進行に至るまで治療を継続した。担当医も患者もどちらの治療群に割り付けられたかは知らされなかった。主要評価項目は中央評価による無増悪生存期間とし、714件のイベントが発生した時点で解析することとした。主な副次評価項目は全生存期間とし、1121件のイベントが発生した時点で、ステップワイズ法に沿って以下の患者群について段階的に解析することにした。①初回化学療法から9か月以内に病勢進行に至った腺がん患者について、②腺がん患者全体について、③全患者について。
結果:
2008年12月23日から2011年2月9日にかけて、1314人の患者を無作為割付した。655人はDN群に、659人はD群に割り付けられた。追跡期間中央値7.1ヶ月(四分位範囲は3.8-11.0ヶ月)の時点で主要評価項目に関する解析を行った。無増悪生存期間はDN群で有意に改善していた(中央値はDN群3.4ヶ月(95%信頼区間は2.9-3.9ヶ月)、D群2.7ヶ月(95%信頼区間は2.6-2.8ヶ月)、ハザード比0.79(95%信頼区間は0.68-0.92)、p=0.0019)。追跡期間中央値31.7ヶ月(四分位範囲27.8-36.1ヶ月)の時点で、初回化学療法から9か月以内に病勢進行に至った腺がん患者集団において、DN群(206人)はD群(199人)に対して有意に生存期間が延長していた(中央値はDN群10.9ヶ月(95%信頼区間は8.5-12.6ヶ月)、D群7.9ヶ月(95%信頼区間は6.7-9.1ヶ月)、ハザード比0.75(95%信頼区間は0.60-0.92)、p=0.0073)。同様の結果は腺がん患者全体でも認められ、DN群(322人)はD群(336人)に対して有意に生存期間が延長していた(中央値はDN群12.6ヶ月(95%信頼区間は10.6-15.1ヶ月)、D群10.3ヶ月(95%信頼区間は8.6-12.2ヶ月)、ハザード比0.83(95%信頼区間は0.70-0.99)、p=0.0359)。しかし、全患者を対象とすると、生存期間に有意差は認められなかった(中央値はDN群10.1ヶ月(95%信頼区間は8.8-11.2ヶ月)、D群9.1ヶ月(95%信頼区間は8.4-10.4ヶ月)、ハザード比0.94(95%信頼区間は0.83-1.05、p=0.2720)。Grade 3以上の有害事象はDN群でD群より多く認められ、主なものは下痢(6.6% vs 2.6%)、可逆性のALT上昇(7.8% vs 0.9%)、可逆性のAST上昇(3.4% vs 0.5%)だった。DN群のうち35人(5.3%)、D群のうち25人(3.8%)は有害事象により死亡した。主な死因としては敗血症(DN群5人、D群1人)、肺炎(DN群2人、D群7人)、呼吸不全(DN群4人、D群0人)、肺塞栓症(DN群0人、D群3人)が挙がった。
結論:
プラチナ併用化学療法後に病勢進行に至った進行非小細胞肺がん患者に対する二次治療として、ドセタキセル+ニンテダニブ併用療法は、とりわけ腺がん患者に対して有効だった。
・無増悪生存曲線

・生存期間曲線
上段から順に①、②、③

「進行性線維化を伴う間質性肺炎」の患者にニンテダニブを導入し、その上で二次治療以降でドセタキセルを使用する、という状況は起こりうるのでは・・・。
レトロスペクティブな検討でもいいので、ニンテダニブを使用しつつ他の薬物療法を行った患者の治療成績を見てみたいところだ。
ところで、本試験における治療関連死の確率はやや高い。
ドセタキセル+ニンテダニブ併用療法群において治療関連死の割合が5.3%というのは、無視できない数字である。
ドセタキセル単剤療法でも3.8%に上っており、参加施設における実地臨床の安全性そのものが問われかねない結果である。
・「進行性線維化を伴う間質性肺疾患」へ、ニンテダニブが使用可能に
http://oitahaiganpractice.junglekouen.com/e975490.html
Docetaxel plus nintedanib versus docetaxel plus placebo in patients with previously treated non-small-cell lung cancer (LUME-Lung 1): a phase 3, double-blind, randomised controlled trial
Martin Reck et al., Lancet Oncol VOLUME 15, ISSUE 2, P143-155, FEBRUARY 01, 2014
背景:
第III相LUME-Lung 1試験は非小細胞肺がん患者に対する二次治療としてのドセタキセル+ニンテダニブ併用療法の有効性と安全性を評価した試験である。
方法:
27ヶ国、211の参加施設から、初回化学療法後に病勢進行に至ったIIIB / IV期の非小細胞肺がん患者を集積した。割付調整因子はECOG-PS、過去のベバシズマブ投与歴、組織型、脳転移の有無とした。1:1の比率で無作為割付を行った。DN群では、ドセタキセル75mg/㎡を1日目に点滴投与し、ニンテダニブ200mg/回を1日2回、2日目から21日目まで服用した。D群では、ドセタキセル75mg/㎡を1日目に点滴投与し、偽薬を1日2回、2日目から21日目まで服用した。両群ともにプロトコール治療を3週ごとに反復し、忍容不能の有害事象が起こるまで、あるいは病勢進行に至るまで治療を継続した。担当医も患者もどちらの治療群に割り付けられたかは知らされなかった。主要評価項目は中央評価による無増悪生存期間とし、714件のイベントが発生した時点で解析することとした。主な副次評価項目は全生存期間とし、1121件のイベントが発生した時点で、ステップワイズ法に沿って以下の患者群について段階的に解析することにした。①初回化学療法から9か月以内に病勢進行に至った腺がん患者について、②腺がん患者全体について、③全患者について。
結果:
2008年12月23日から2011年2月9日にかけて、1314人の患者を無作為割付した。655人はDN群に、659人はD群に割り付けられた。追跡期間中央値7.1ヶ月(四分位範囲は3.8-11.0ヶ月)の時点で主要評価項目に関する解析を行った。無増悪生存期間はDN群で有意に改善していた(中央値はDN群3.4ヶ月(95%信頼区間は2.9-3.9ヶ月)、D群2.7ヶ月(95%信頼区間は2.6-2.8ヶ月)、ハザード比0.79(95%信頼区間は0.68-0.92)、p=0.0019)。追跡期間中央値31.7ヶ月(四分位範囲27.8-36.1ヶ月)の時点で、初回化学療法から9か月以内に病勢進行に至った腺がん患者集団において、DN群(206人)はD群(199人)に対して有意に生存期間が延長していた(中央値はDN群10.9ヶ月(95%信頼区間は8.5-12.6ヶ月)、D群7.9ヶ月(95%信頼区間は6.7-9.1ヶ月)、ハザード比0.75(95%信頼区間は0.60-0.92)、p=0.0073)。同様の結果は腺がん患者全体でも認められ、DN群(322人)はD群(336人)に対して有意に生存期間が延長していた(中央値はDN群12.6ヶ月(95%信頼区間は10.6-15.1ヶ月)、D群10.3ヶ月(95%信頼区間は8.6-12.2ヶ月)、ハザード比0.83(95%信頼区間は0.70-0.99)、p=0.0359)。しかし、全患者を対象とすると、生存期間に有意差は認められなかった(中央値はDN群10.1ヶ月(95%信頼区間は8.8-11.2ヶ月)、D群9.1ヶ月(95%信頼区間は8.4-10.4ヶ月)、ハザード比0.94(95%信頼区間は0.83-1.05、p=0.2720)。Grade 3以上の有害事象はDN群でD群より多く認められ、主なものは下痢(6.6% vs 2.6%)、可逆性のALT上昇(7.8% vs 0.9%)、可逆性のAST上昇(3.4% vs 0.5%)だった。DN群のうち35人(5.3%)、D群のうち25人(3.8%)は有害事象により死亡した。主な死因としては敗血症(DN群5人、D群1人)、肺炎(DN群2人、D群7人)、呼吸不全(DN群4人、D群0人)、肺塞栓症(DN群0人、D群3人)が挙がった。
結論:
プラチナ併用化学療法後に病勢進行に至った進行非小細胞肺がん患者に対する二次治療として、ドセタキセル+ニンテダニブ併用療法は、とりわけ腺がん患者に対して有効だった。
・無増悪生存曲線

・生存期間曲線
上段から順に①、②、③

2020年07月10日
局所進行非小細胞肺癌に対する術前化学免疫療法
術前化学療法にデュルバルマブを絡めて、治療成績を上げようというコンセプトの第II相試験。
似たような試験は我が国でも行われているが、期待していいのではないだろうか。
SAKK 16/14: Anti-PD-L1 antibody durvalumab in addition to neoadjuvant chemotherapy in patients with stage IIIA(N2) non-small cell lung cancer (NSCLC)—A multicenter single-arm phase II trial.
Sacha Rothschild et al., ASCO 2020, Abst #9016
背景:
切除可能なstage IIIA(N2)非小細胞肺がんに対し、術前化学療法としてシスプラチン+ドセタキセル併用療法を3コース行い、その後に根治切除術を行うことは標準治療の一つとして受け入れられており(ホントか?)、1年無病生存割合は48%、5年生存割合は37%とされている。PD-1 / PD-L1阻害薬は切除可能非小細胞肺がんに対して高い奏効割合を示している(ホントか??)。
方法:
SAKK 16/14試験はオープンラベルの単アーム第II相臨床試験で、組織型・遺伝子変異の有無・PD-L1発現状態を問わず、stage IIIA(T1-3N2M0)の切除可能な非小細胞肺がん患者68人を対象とした。術前化学療法はシスプラチン100mg/㎡+ドセタキセル85mg/㎡の併用化学療法を3週間ごとに③コース施行し、その後にデュルバルマブ750mg/回を2週間ごとに②コース施行する内容とした。根治切除術施行後も、1年間にわたりデュルバルマブを2週間ごとに1年間投与することにした。主要評価項目は1年無病生存割合とした。SAKK 16/00試験における1年無病生存割合は48%だったが、本試験ではこれを65%まで改善すると仮定した。今回は67人の評価可能患者を解析し、主要評価項目と奏効割合のデータを提示する。
結果:
2016年06月から2019年01月の期間に68人の患者が登録され、評価可能患者は67人(男性35人、女性32人)だった。年齢中央値は61歳(41歳-74歳)、52人(77.6%)はWHO-PS 0だった。95.5%に喫煙経験があった。腺がんが55.2%、扁平上皮がんが32.8%を占めていた。診断時点のT因子は、T1が22.4%、T2が49.3%、T3が28.4%だった。81.1%の患者が根治切除術を受けた。根治切除術ができなかった主な理由は病勢進行(33.3%)だった。片肺切除に至った患者は5人(9.1%)に上った。43人が一葉切除を、7人が二葉切除を受けた。術後30日以内に死亡した手術関連死が1人(1.8%)だけ認められた。また、別の1人は術後の出血性合併症で死亡したが、術前治療とは関連がなさそうだった。術前化学療法後の奏効割合は44.8%(95%信頼区間は32.6-57.4%)で、追加の術前免疫療法後の奏効割合は59.7%(95%信頼区間は46.4-71.9%)だった。1年無病生存割合は73.3%(90%信頼区間は62.5-81.4%)だった。
・SAKK 16/14試験 概略

・SAKK 16/14試験 生存曲線

似たような試験は我が国でも行われているが、期待していいのではないだろうか。
SAKK 16/14: Anti-PD-L1 antibody durvalumab in addition to neoadjuvant chemotherapy in patients with stage IIIA(N2) non-small cell lung cancer (NSCLC)—A multicenter single-arm phase II trial.
Sacha Rothschild et al., ASCO 2020, Abst #9016
背景:
切除可能なstage IIIA(N2)非小細胞肺がんに対し、術前化学療法としてシスプラチン+ドセタキセル併用療法を3コース行い、その後に根治切除術を行うことは標準治療の一つとして受け入れられており(ホントか?)、1年無病生存割合は48%、5年生存割合は37%とされている。PD-1 / PD-L1阻害薬は切除可能非小細胞肺がんに対して高い奏効割合を示している(ホントか??)。
方法:
SAKK 16/14試験はオープンラベルの単アーム第II相臨床試験で、組織型・遺伝子変異の有無・PD-L1発現状態を問わず、stage IIIA(T1-3N2M0)の切除可能な非小細胞肺がん患者68人を対象とした。術前化学療法はシスプラチン100mg/㎡+ドセタキセル85mg/㎡の併用化学療法を3週間ごとに③コース施行し、その後にデュルバルマブ750mg/回を2週間ごとに②コース施行する内容とした。根治切除術施行後も、1年間にわたりデュルバルマブを2週間ごとに1年間投与することにした。主要評価項目は1年無病生存割合とした。SAKK 16/00試験における1年無病生存割合は48%だったが、本試験ではこれを65%まで改善すると仮定した。今回は67人の評価可能患者を解析し、主要評価項目と奏効割合のデータを提示する。
結果:
2016年06月から2019年01月の期間に68人の患者が登録され、評価可能患者は67人(男性35人、女性32人)だった。年齢中央値は61歳(41歳-74歳)、52人(77.6%)はWHO-PS 0だった。95.5%に喫煙経験があった。腺がんが55.2%、扁平上皮がんが32.8%を占めていた。診断時点のT因子は、T1が22.4%、T2が49.3%、T3が28.4%だった。81.1%の患者が根治切除術を受けた。根治切除術ができなかった主な理由は病勢進行(33.3%)だった。片肺切除に至った患者は5人(9.1%)に上った。43人が一葉切除を、7人が二葉切除を受けた。術後30日以内に死亡した手術関連死が1人(1.8%)だけ認められた。また、別の1人は術後の出血性合併症で死亡したが、術前治療とは関連がなさそうだった。術前化学療法後の奏効割合は44.8%(95%信頼区間は32.6-57.4%)で、追加の術前免疫療法後の奏効割合は59.7%(95%信頼区間は46.4-71.9%)だった。1年無病生存割合は73.3%(90%信頼区間は62.5-81.4%)だった。
・SAKK 16/14試験 概略

・SAKK 16/14試験 生存曲線

2020年07月09日
CITYSCAPE試験 Tiragolumab+アテゾリズマブ併用療法 第II相
少し前に、抗TIGIT抗体Tiragolumabについて、以下のような記事を書いた。
http://oitahaiganpractice.junglekouen.com/e974049.html
今年のASCO年次総会で、Tiragolumabのランダム化第II相試験についての報告があったようだ。
どうもPD-L1≧50%ならば、Tiragolumabとアテゾリズマブの相乗効果がさらに高まる様子。
当然のことながら、Tiragolumabとペンブロリズマブを併用したらどうなるんだろう、という発想が浮かんでくる。
実地臨床に使えるようになったときは、当面Tiragolumabとアテゾリズマブの併用しか認めない、ということになるんだろうけど。
それから最近思うこと。
PD-L1を評価するにあたっての免疫染色試薬は、ほぼ22C3抗体に絞られたとみていいだろう。
さまざまな抗体が用いられ、その相関関係はどうなのか、等々の検討が行われたはずだが、結局落ち着くべきところに落ち着いた、ということなんだろうな。
規格が統一されるのは、実務上はとても喜ばしいことだ。
ドライバー遺伝子変異検索においても、同じような規格統一が行われることを切に望んでいる。
Primary analysis of a randomized, double-blind, phase II study of the anti-TIGIT antibody tiragolumab (tira) plus atezolizumab (atezo) versus placebo plus atezo as first-line (1L) treatment in patients with PD-L1-selected NSCLC (CITYSCAPE).
Delvys Rodriguez-Abreu et al., ASCO 2020 Abst. #9503
背景:
免疫調整受容体TIGITは新しい抑制性免疫チェックポイント分子で、非小細胞肺がんを含む多種のがんにおいて、活性化T細胞やNK細胞に発現している。第I相試験(GO30103試験)では、TIGITとPD-L1双方のシグナル伝達系をtiragolumabとアテゾリズマブを用いて共に阻害することにより、未治療のPD-L1陽性非小細胞肺がん患者の奏効割合をPD-1 / PD-L1いずれかのみを阻害する治療に比べて改善する可能性が示された。今回は非小細胞肺がん患者に対する初回治療として、tiragolumabとアテゾリズマブの併用療法の有効性と安全性を検証する第II相試験を計画した。対照群としてプラセボとアテゾリズマブの併用療法を設定した。
方法:
今回の二重盲検プラセボ併用無作為化前向き臨床試験において、PD-L1陽性(TPS≧1%, 使用抗体は22C3 IHC pharmDx Dako assay)、未治療、測定可能病変を有する、ECOG PS 0-1、EGFRもしくはALK遺伝子異常をもたない、局所進行もしくは進行非小細胞肺がん患者を対象とした。対象となった患者は1:1の割合で、TA群(Tiragolumab 600mg静注+アテゾリズマブ1200mg静注、3週ごと)もしくはPA群(プラセボ+アテゾリズマブ1200mg静注、3週ごと)に無作為に割り付けられた。割付調整因子はPD-L1発現状態(TPS≧50% vs TPS 1-49%)、組織型、喫煙歴とした。主要評価項目は担当医評価による奏効割合と無増悪生存期間とした。その他の副次評価項目は奏効持続期間、全生存期間、安全性とした。探索的評価項目として、PD-L1発現ごとの奏効割合、無増悪生存割合をおいた。
結果:
135人の患者がPA群(68人)とTA群(n=67)に割り付けられた。2019年1月30日、追跡期間中央値5.9ヶ月の初回中間解析の時点で、TA群はPA群に対して奏効割合と無増悪生存期間中央値を有意に改善していた。一方、治療関連の有害事象はPA群の72%、TA群の80.6%で認められた。Grade 3以上の有害事象はPA群の19.1%、TA群の14.9%に認められた。患者の治療意志撤回にまで波及するような事例は、PA群の10.3%、TA群の7.5%で認められた。さらに6ヶ月経過した、2019年12月2日、追跡期間中央値10.9ヶ月の時点でも、奏効割合はTA群で37.3%(95%信頼区間は25.0%-49.6%)、PA群で20.6%(95%信頼区間は10.2%-30.9%)、無増悪生存期間中央値はTA群で5.6ヶ月(95%信頼区間は4.2-10.4ヶ月)、PA群で3.9ヶ月(95%信頼区間は2.7-4.5ヶ月)、ハザード比0.58(95%信頼区間は0.38-0.89)と、TA群優位の状態が維持されていた。PD-L1≧50%の患者群では、奏効割合はTA群で66%、PA群で24%で、無増悪生存期間中央値はTA群で未到達(95%信頼区間は5.5ヶ月から未到達)、PA群で4.1ヶ月(95%信頼区間は2.1-4.7ヶ月)、ハザード比0.30(95%信頼区間は0.15-0.61)と、TA群の優位性がさらに高まっていた。一方でTPS 1-49%の患者群では、奏効割合はTA群で16%、PA群で18%で、無増悪生存期間中央値はTA群で4.0ヶ月(95%信頼区間は1.6-5.6ヶ月)、PA群で3.6ヶ月(95%信頼区間は1.5-5.5ヶ月)、ハザード比は0.89(95%信頼区間は0.53-1.49)で、TA群の優位性は失われていた。安全性は忍容可能だった。
・CITYSCAPE試験 概略

・CITYSCAPE試験 奏効割合

・CITYSCAPE試験 無増悪生存曲線

・CITYSCAPE試験 PD-L1発現割合ごとの無増悪生存曲線

http://oitahaiganpractice.junglekouen.com/e974049.html
今年のASCO年次総会で、Tiragolumabのランダム化第II相試験についての報告があったようだ。
どうもPD-L1≧50%ならば、Tiragolumabとアテゾリズマブの相乗効果がさらに高まる様子。
当然のことながら、Tiragolumabとペンブロリズマブを併用したらどうなるんだろう、という発想が浮かんでくる。
実地臨床に使えるようになったときは、当面Tiragolumabとアテゾリズマブの併用しか認めない、ということになるんだろうけど。
それから最近思うこと。
PD-L1を評価するにあたっての免疫染色試薬は、ほぼ22C3抗体に絞られたとみていいだろう。
さまざまな抗体が用いられ、その相関関係はどうなのか、等々の検討が行われたはずだが、結局落ち着くべきところに落ち着いた、ということなんだろうな。
規格が統一されるのは、実務上はとても喜ばしいことだ。
ドライバー遺伝子変異検索においても、同じような規格統一が行われることを切に望んでいる。
Primary analysis of a randomized, double-blind, phase II study of the anti-TIGIT antibody tiragolumab (tira) plus atezolizumab (atezo) versus placebo plus atezo as first-line (1L) treatment in patients with PD-L1-selected NSCLC (CITYSCAPE).
Delvys Rodriguez-Abreu et al., ASCO 2020 Abst. #9503
背景:
免疫調整受容体TIGITは新しい抑制性免疫チェックポイント分子で、非小細胞肺がんを含む多種のがんにおいて、活性化T細胞やNK細胞に発現している。第I相試験(GO30103試験)では、TIGITとPD-L1双方のシグナル伝達系をtiragolumabとアテゾリズマブを用いて共に阻害することにより、未治療のPD-L1陽性非小細胞肺がん患者の奏効割合をPD-1 / PD-L1いずれかのみを阻害する治療に比べて改善する可能性が示された。今回は非小細胞肺がん患者に対する初回治療として、tiragolumabとアテゾリズマブの併用療法の有効性と安全性を検証する第II相試験を計画した。対照群としてプラセボとアテゾリズマブの併用療法を設定した。
方法:
今回の二重盲検プラセボ併用無作為化前向き臨床試験において、PD-L1陽性(TPS≧1%, 使用抗体は22C3 IHC pharmDx Dako assay)、未治療、測定可能病変を有する、ECOG PS 0-1、EGFRもしくはALK遺伝子異常をもたない、局所進行もしくは進行非小細胞肺がん患者を対象とした。対象となった患者は1:1の割合で、TA群(Tiragolumab 600mg静注+アテゾリズマブ1200mg静注、3週ごと)もしくはPA群(プラセボ+アテゾリズマブ1200mg静注、3週ごと)に無作為に割り付けられた。割付調整因子はPD-L1発現状態(TPS≧50% vs TPS 1-49%)、組織型、喫煙歴とした。主要評価項目は担当医評価による奏効割合と無増悪生存期間とした。その他の副次評価項目は奏効持続期間、全生存期間、安全性とした。探索的評価項目として、PD-L1発現ごとの奏効割合、無増悪生存割合をおいた。
結果:
135人の患者がPA群(68人)とTA群(n=67)に割り付けられた。2019年1月30日、追跡期間中央値5.9ヶ月の初回中間解析の時点で、TA群はPA群に対して奏効割合と無増悪生存期間中央値を有意に改善していた。一方、治療関連の有害事象はPA群の72%、TA群の80.6%で認められた。Grade 3以上の有害事象はPA群の19.1%、TA群の14.9%に認められた。患者の治療意志撤回にまで波及するような事例は、PA群の10.3%、TA群の7.5%で認められた。さらに6ヶ月経過した、2019年12月2日、追跡期間中央値10.9ヶ月の時点でも、奏効割合はTA群で37.3%(95%信頼区間は25.0%-49.6%)、PA群で20.6%(95%信頼区間は10.2%-30.9%)、無増悪生存期間中央値はTA群で5.6ヶ月(95%信頼区間は4.2-10.4ヶ月)、PA群で3.9ヶ月(95%信頼区間は2.7-4.5ヶ月)、ハザード比0.58(95%信頼区間は0.38-0.89)と、TA群優位の状態が維持されていた。PD-L1≧50%の患者群では、奏効割合はTA群で66%、PA群で24%で、無増悪生存期間中央値はTA群で未到達(95%信頼区間は5.5ヶ月から未到達)、PA群で4.1ヶ月(95%信頼区間は2.1-4.7ヶ月)、ハザード比0.30(95%信頼区間は0.15-0.61)と、TA群の優位性がさらに高まっていた。一方でTPS 1-49%の患者群では、奏効割合はTA群で16%、PA群で18%で、無増悪生存期間中央値はTA群で4.0ヶ月(95%信頼区間は1.6-5.6ヶ月)、PA群で3.6ヶ月(95%信頼区間は1.5-5.5ヶ月)、ハザード比は0.89(95%信頼区間は0.53-1.49)で、TA群の優位性は失われていた。安全性は忍容可能だった。
・CITYSCAPE試験 概略

・CITYSCAPE試験 奏効割合

・CITYSCAPE試験 無増悪生存曲線

・CITYSCAPE試験 PD-L1発現割合ごとの無増悪生存曲線

2020年07月06日
間質性肺炎合併患者に対する定位放射線照射
多分大分県は、定位放射線照射を行う環境に恵まれている。
定型的な定位放射線照射が可能な施設が複数ある上、サイバーナイフを利用した高精度の定位照射も可能である。
https://keiwakai.oita.jp/oka-hp/cyber/
定位照射を受けた肺がん患者さん、追跡調査をしている中でも随分とたくさん拝見するようになった。
間質性肺炎を合併していても定位照射は可能だろうか、という相談を受けたので、1件の論文報告と、1件の学会発表を紹介する。
間質性肺炎を合併していない患者さんに比べると、当然放射線肺臓炎のリスクが増す。
とは言え、他に治療手段がなくて、危険性を理解したうえで治療を受けたい、という方は、一度は放射線治療医に相談する価値があるだろう。
Stereotactic Body Radiotherapy for Lung Cancer Patients With Idiopathic Interstitial Pneumonias
Yuichiro Tsurugai,et al.
Radiother Oncol 2017 Nov;125(2):310-316.
doi:10.1016/j.radonc.2017.08.026.
目的:
肺がん患者のうち、特発性間質性肺炎を合併している患者としていない患者に対して定位放射線照射を行った際の毒性と生命予後について比較検討した。
方法:
2005年から2016年にかけて、定位放射線照射を行った肺がん患者のうち、臨床病期T1N0M0からT4N0M0までの患者、もしくは術後の局所孤発性再発を来した患者で、根治目的で40-60Gyを5分割で照射した者を評価対象とした。全ての対象患者に関する放射線肺臓炎の発生頻度と、T1a-T2aの患者を対象として局所再発割合や全生存期間解析を行った。
結果:
総計508人の患者が評価対象となり、42人の特発性間質性肺炎患者が含まれていた。追跡期間中央値は32.3ヶ月(範囲は6.0-120.9ヶ月)だった。特発性間質性肺炎患者においては、有意にGrade 3以上の放射線肺臓炎を来す患者が多かった(12% vs 3%, p=0.009)。2年局所再発割合は両群ともに低かった(3.4% vs 5.6%, p=0.38)。2年生存割合は特発性間質性肺炎患者で有意に低かった(42.2% vs 80.9%, p<0.001)が、肺がんによる死亡割合は同等だった(p=0.74)
結論:
特発性間質性肺炎を合併した肺がん患者においても、定位放射線照射は忍容可能な毒性に留まる一方で、有望な局所病勢制御を達成した。特発性間質性肺炎を合併した早期肺がん患者において、定位放射線照射は理に叶った治療選択肢となり得る。
O-30.肺癌定位放射線治療において,間質性変化は重篤な肺傷害のリスクとなりうるか?
斎藤彰俊ら、第55回日本肺癌学会総会、2014年11月
目的:
通常の放射線治療において,間質性肺炎は放射線肺傷害の危険因子とされている.しかし肺癌への体幹部定位放射線治療(SBRT)では,間質性肺炎がどの程度,重篤な肺傷害の危険因子となりうるのか知られていない.間質性変化を伴った肺癌患者につき,SBRT後の重篤な肺傷害の発生と,治療前の画像や血液データとの関係を検討した.
方法:
2002年1月から2013年4月の期間中,SBRTを施行された374名の肺癌症例のうち,5mmスライス厚のCT肺野条件で胸膜下優位に網状影や蜂巣肺が認められる,画像上“間質性変化”をもつ39症例を対象とした.白血球値,CRP,LDH,KL-6,SP-D,Brinkman Index,画像上の間質性変化領域がみられる肺葉数,計画標的体積(PTV),20Gy以上照射される体積の割合(V20)につきそれぞれ,重篤な肺傷害を生じた群と生じなかった群とで,t検定で比較した.P<.05を有意差ありとした.
結果:
39症例のうち,致死性の肺傷害をきたした症例は2例(5.1%)であった.その2例については,治療前の白血球値が異常高値を呈し,間質性変化が3肺葉以上に及んでいた.他の因子では,重篤な肺傷害を生じた群と生じなかった群で,有意差がみられなかった.
結論:
白血球値が高く,間質性変化が広範囲にみられる肺癌症例については,SBRT後に重篤な肺傷害をきたす可能性がある.
定型的な定位放射線照射が可能な施設が複数ある上、サイバーナイフを利用した高精度の定位照射も可能である。
https://keiwakai.oita.jp/oka-hp/cyber/
定位照射を受けた肺がん患者さん、追跡調査をしている中でも随分とたくさん拝見するようになった。
間質性肺炎を合併していても定位照射は可能だろうか、という相談を受けたので、1件の論文報告と、1件の学会発表を紹介する。
間質性肺炎を合併していない患者さんに比べると、当然放射線肺臓炎のリスクが増す。
とは言え、他に治療手段がなくて、危険性を理解したうえで治療を受けたい、という方は、一度は放射線治療医に相談する価値があるだろう。
Stereotactic Body Radiotherapy for Lung Cancer Patients With Idiopathic Interstitial Pneumonias
Yuichiro Tsurugai,et al.
Radiother Oncol 2017 Nov;125(2):310-316.
doi:10.1016/j.radonc.2017.08.026.
目的:
肺がん患者のうち、特発性間質性肺炎を合併している患者としていない患者に対して定位放射線照射を行った際の毒性と生命予後について比較検討した。
方法:
2005年から2016年にかけて、定位放射線照射を行った肺がん患者のうち、臨床病期T1N0M0からT4N0M0までの患者、もしくは術後の局所孤発性再発を来した患者で、根治目的で40-60Gyを5分割で照射した者を評価対象とした。全ての対象患者に関する放射線肺臓炎の発生頻度と、T1a-T2aの患者を対象として局所再発割合や全生存期間解析を行った。
結果:
総計508人の患者が評価対象となり、42人の特発性間質性肺炎患者が含まれていた。追跡期間中央値は32.3ヶ月(範囲は6.0-120.9ヶ月)だった。特発性間質性肺炎患者においては、有意にGrade 3以上の放射線肺臓炎を来す患者が多かった(12% vs 3%, p=0.009)。2年局所再発割合は両群ともに低かった(3.4% vs 5.6%, p=0.38)。2年生存割合は特発性間質性肺炎患者で有意に低かった(42.2% vs 80.9%, p<0.001)が、肺がんによる死亡割合は同等だった(p=0.74)
結論:
特発性間質性肺炎を合併した肺がん患者においても、定位放射線照射は忍容可能な毒性に留まる一方で、有望な局所病勢制御を達成した。特発性間質性肺炎を合併した早期肺がん患者において、定位放射線照射は理に叶った治療選択肢となり得る。
O-30.肺癌定位放射線治療において,間質性変化は重篤な肺傷害のリスクとなりうるか?
斎藤彰俊ら、第55回日本肺癌学会総会、2014年11月
目的:
通常の放射線治療において,間質性肺炎は放射線肺傷害の危険因子とされている.しかし肺癌への体幹部定位放射線治療(SBRT)では,間質性肺炎がどの程度,重篤な肺傷害の危険因子となりうるのか知られていない.間質性変化を伴った肺癌患者につき,SBRT後の重篤な肺傷害の発生と,治療前の画像や血液データとの関係を検討した.
方法:
2002年1月から2013年4月の期間中,SBRTを施行された374名の肺癌症例のうち,5mmスライス厚のCT肺野条件で胸膜下優位に網状影や蜂巣肺が認められる,画像上“間質性変化”をもつ39症例を対象とした.白血球値,CRP,LDH,KL-6,SP-D,Brinkman Index,画像上の間質性変化領域がみられる肺葉数,計画標的体積(PTV),20Gy以上照射される体積の割合(V20)につきそれぞれ,重篤な肺傷害を生じた群と生じなかった群とで,t検定で比較した.P<.05を有意差ありとした.
結果:
39症例のうち,致死性の肺傷害をきたした症例は2例(5.1%)であった.その2例については,治療前の白血球値が異常高値を呈し,間質性変化が3肺葉以上に及んでいた.他の因子では,重篤な肺傷害を生じた群と生じなかった群で,有意差がみられなかった.
結論:
白血球値が高く,間質性変化が広範囲にみられる肺癌症例については,SBRT後に重篤な肺傷害をきたす可能性がある.
2020年07月01日
CheckMate227試験とCheckMate9LA試験
免疫チェックポイント阻害薬は、高額医療でありながらも、肺がん薬物療法の領域では確固たる地位を築いた。
ドライバー遺伝子変異陰性なら、早い段階で免疫チェックポイント阻害薬を使用する余地がある。
PD-L1発現割合が50%以上ならペンブロリズマブ単剤で、それ以下なら化学療法と免疫チェックポイント阻害薬の併用が有効とされている。
しかし、ここ1年間くらい、方々で耳にすることがある。
それは、
・免疫チェックポイント単独では、治療開始初期の病勢進行により、一定期間は生存曲線が化学療法群に劣る
・PD-L1高発現であっても、免疫チェックポイント阻害薬と化学療法を併用することで、治療開始初期の病勢進行を抑えられ、かつ免疫チェックポイント阻害薬による長期奏効が期待できるのではないか
ということだった。
じゃあ、もうPD-L1なんて測定しなくてもいいんじゃない?と思う。
ニボルマブ+イピリムマブ併用療法の有効性を検証するCheckMate-227試験では、PD-L1の発現状態にかかわらず、治療成績はあまり変わらない。
そして、実際にニボルマブ+イピリムマブ併用療法に治療初期の化学療法を追加する第III相臨床試験が行われた。
結局、ニボルマブ+イピリムマブ+化学療法併用が有意に全生存期間を延長したということである。
それも、最初の中間解析時点よりも、2回目の解析時点の方が、両群間の生存曲線が末広がりに広がって、比例ハザード性を綺麗に保っていることがよくわかる。
あっぱれあっぱれ、と賞賛したいところだが・・・。
この治療、どのくらい実地臨床で浸透するだろうか。
化学療法単独での生存期間中央値が10.8ヶ月というのは、ちょっと成績が悪すぎないだろうか。
Nivolumab (NIVO) + ipilimumab (IPI) + 2 cycles of platinum-doublet chemotherapy (chemo) vs 4 cycles chemo as first-line (1L) treatment (tx) for stage IV/recurrent non-small cell lung cancer (NSCLC): CheckMate 9LA.
Martin Reck, et al. ASCO 2020 Abst. #9501
背景:
ニボルマブ+イピリムマブ併用療法は、進行非小細胞肺がんの一次治療において、PD-L1発現状態にかかわらず全生存期間と奏効持続期間を化学療法に比べて改善することが、CheckMate-227試験において示されている。我々は、一定のコース数に限定した化学療法をニボルマブ+イピリムマブ併用療法治療初期に組み合わせることにより、PD-1とCTLA-4の二重阻害によって得られる持続的な生存期間延長効果が立ち上がるまでの、早期の病勢コントロールが得られるのではないかと仮説を立てた。CheckMate9LA試験は第III相ランダム化比較試験であり、進行・再発非小細胞肺がん患者の一次治療において、ニボルマブ+イピリムマブ+2コースの化学療法併用療法と、化学療法単独の効果を評価した。
方法:
成人した患者で、治療歴がなく、組織学的に診断が確認されたIV期もしくは術後再発の非小細胞肺がん患者で、ECOG-PSは0-1、EGFRもしくはALKの遺伝子異常を認めない患者を対象に、1:1の割合で以下の治療群に無作為割付を行った。NI-Chemo群では、ニボルマブ360mg/回を3週ごと、イピリムマブ1mg/kgを6週ごと、化学療法を治療開始から2コース投与し、患者数は361人だった。Chemo群では化学療法のみを4コース投与し、患者数は358人だった。割付調整因子はPD-L1の発現状態(1%未満 vs 1%以上)、性別、組織型(扁平上皮がん vs 非扁平上皮がん)とした。化学療法の内容は、組織型に応じて決めることとした。非扁平上皮非小細胞肺がんの患者で、Chemo群に割り付けられた患者は、ペメトレキセド維持療法を受けられることとした。NI-Chemo群の患者は、病勢進行が確認されるまで、忍容不能の毒性が出現するまで、あるいは投与期間が2年間に達するまでは、ニボルマブ、イピリムマブの投与を継続することとした。主要評価項目は全生存期間で、322件のイベントが発生した時点で中間解析を行うこととした。副次評価項目は無増悪生存期間、奏効割合、PD-L1発現状態ごとのサブグループ解析とした。探索的評価項目として、安全性・忍容性を設定した。
結果:
患者背景は治療群間で均等だった。中間解析(経過観察期間の最短値は8.1ヶ月)時点で、全生存期間は有意にNI-Chemo群で延長していた(ハザード比0.69、96.71%信頼区間は0.55-0.87、p=0.0006)。統計学的に有意な無増悪生存期間の延長、奏効割合の改善も確認された。さらに観察期間を長くとった(経過観察期間最短値は12.7ヶ月)ところ、Chemo群に対するNI-Chemo群の全生存期間延長における優位性は維持されており、生存期間中央値はNI-Chemo群で15.6ヶ月、Chemo群で10.9ヶ月だった(ハザード比0.66、95%信頼区間は0.55-0.80)。1年生存割合はNI-Chemo群で63%、Chemo群で47%だった。PD-L1や組織型に即した様々なサブグループ解析を行っても、NI-Chemo群の優位性は変わらなかった。Grade 3-4の治療関連有害事象は、NI-Chemo群で47%、Chemo群で38%だった。
結論:
CheckMate 9LA試験は主要評価項目を達成し、ニボルマブ+イピリムマブ+治療初期の化学療法併用レジメンは、化学療法単独と比して有意に全生存期間を延長した。新規の毒性は認めなかった。
・CheckMate227試験 概略

・CheckMate227試験 PD-L1陽性患者の生存曲線

・CheckMate227試験 PD-L1陰性患者の生存曲線

・CheckMate227試験 奏効割合と奏効持続期間

・CheckMate9LA試験 概略

・CheckMate9LA試験 生存曲線

・CheckMate9LA試験 無増悪生存曲線

・CheckMate9LA試験 奏効持続期間

ドライバー遺伝子変異陰性なら、早い段階で免疫チェックポイント阻害薬を使用する余地がある。
PD-L1発現割合が50%以上ならペンブロリズマブ単剤で、それ以下なら化学療法と免疫チェックポイント阻害薬の併用が有効とされている。
しかし、ここ1年間くらい、方々で耳にすることがある。
それは、
・免疫チェックポイント単独では、治療開始初期の病勢進行により、一定期間は生存曲線が化学療法群に劣る
・PD-L1高発現であっても、免疫チェックポイント阻害薬と化学療法を併用することで、治療開始初期の病勢進行を抑えられ、かつ免疫チェックポイント阻害薬による長期奏効が期待できるのではないか
ということだった。
じゃあ、もうPD-L1なんて測定しなくてもいいんじゃない?と思う。
ニボルマブ+イピリムマブ併用療法の有効性を検証するCheckMate-227試験では、PD-L1の発現状態にかかわらず、治療成績はあまり変わらない。
そして、実際にニボルマブ+イピリムマブ併用療法に治療初期の化学療法を追加する第III相臨床試験が行われた。
結局、ニボルマブ+イピリムマブ+化学療法併用が有意に全生存期間を延長したということである。
それも、最初の中間解析時点よりも、2回目の解析時点の方が、両群間の生存曲線が末広がりに広がって、比例ハザード性を綺麗に保っていることがよくわかる。
あっぱれあっぱれ、と賞賛したいところだが・・・。
この治療、どのくらい実地臨床で浸透するだろうか。
化学療法単独での生存期間中央値が10.8ヶ月というのは、ちょっと成績が悪すぎないだろうか。
Nivolumab (NIVO) + ipilimumab (IPI) + 2 cycles of platinum-doublet chemotherapy (chemo) vs 4 cycles chemo as first-line (1L) treatment (tx) for stage IV/recurrent non-small cell lung cancer (NSCLC): CheckMate 9LA.
Martin Reck, et al. ASCO 2020 Abst. #9501
背景:
ニボルマブ+イピリムマブ併用療法は、進行非小細胞肺がんの一次治療において、PD-L1発現状態にかかわらず全生存期間と奏効持続期間を化学療法に比べて改善することが、CheckMate-227試験において示されている。我々は、一定のコース数に限定した化学療法をニボルマブ+イピリムマブ併用療法治療初期に組み合わせることにより、PD-1とCTLA-4の二重阻害によって得られる持続的な生存期間延長効果が立ち上がるまでの、早期の病勢コントロールが得られるのではないかと仮説を立てた。CheckMate9LA試験は第III相ランダム化比較試験であり、進行・再発非小細胞肺がん患者の一次治療において、ニボルマブ+イピリムマブ+2コースの化学療法併用療法と、化学療法単独の効果を評価した。
方法:
成人した患者で、治療歴がなく、組織学的に診断が確認されたIV期もしくは術後再発の非小細胞肺がん患者で、ECOG-PSは0-1、EGFRもしくはALKの遺伝子異常を認めない患者を対象に、1:1の割合で以下の治療群に無作為割付を行った。NI-Chemo群では、ニボルマブ360mg/回を3週ごと、イピリムマブ1mg/kgを6週ごと、化学療法を治療開始から2コース投与し、患者数は361人だった。Chemo群では化学療法のみを4コース投与し、患者数は358人だった。割付調整因子はPD-L1の発現状態(1%未満 vs 1%以上)、性別、組織型(扁平上皮がん vs 非扁平上皮がん)とした。化学療法の内容は、組織型に応じて決めることとした。非扁平上皮非小細胞肺がんの患者で、Chemo群に割り付けられた患者は、ペメトレキセド維持療法を受けられることとした。NI-Chemo群の患者は、病勢進行が確認されるまで、忍容不能の毒性が出現するまで、あるいは投与期間が2年間に達するまでは、ニボルマブ、イピリムマブの投与を継続することとした。主要評価項目は全生存期間で、322件のイベントが発生した時点で中間解析を行うこととした。副次評価項目は無増悪生存期間、奏効割合、PD-L1発現状態ごとのサブグループ解析とした。探索的評価項目として、安全性・忍容性を設定した。
結果:
患者背景は治療群間で均等だった。中間解析(経過観察期間の最短値は8.1ヶ月)時点で、全生存期間は有意にNI-Chemo群で延長していた(ハザード比0.69、96.71%信頼区間は0.55-0.87、p=0.0006)。統計学的に有意な無増悪生存期間の延長、奏効割合の改善も確認された。さらに観察期間を長くとった(経過観察期間最短値は12.7ヶ月)ところ、Chemo群に対するNI-Chemo群の全生存期間延長における優位性は維持されており、生存期間中央値はNI-Chemo群で15.6ヶ月、Chemo群で10.9ヶ月だった(ハザード比0.66、95%信頼区間は0.55-0.80)。1年生存割合はNI-Chemo群で63%、Chemo群で47%だった。PD-L1や組織型に即した様々なサブグループ解析を行っても、NI-Chemo群の優位性は変わらなかった。Grade 3-4の治療関連有害事象は、NI-Chemo群で47%、Chemo群で38%だった。
結論:
CheckMate 9LA試験は主要評価項目を達成し、ニボルマブ+イピリムマブ+治療初期の化学療法併用レジメンは、化学療法単独と比して有意に全生存期間を延長した。新規の毒性は認めなかった。
・CheckMate227試験 概略

・CheckMate227試験 PD-L1陽性患者の生存曲線

・CheckMate227試験 PD-L1陰性患者の生存曲線

・CheckMate227試験 奏効割合と奏効持続期間

・CheckMate9LA試験 概略

・CheckMate9LA試験 生存曲線

・CheckMate9LA試験 無増悪生存曲線

・CheckMate9LA試験 奏効持続期間




