2016年05月28日
DurvalumabとOsimertinibの併用療法(ELCC2016)
EGFR遺伝子変異陽性非小細胞肺癌に対する、DurvalumabとOsimertinibの併用療法
一言で言ってしまうと、有望な腫瘍縮小効果が確認されたものの、40%近くで間質性肺炎を合併したそうです。
EGFR阻害薬単剤で間質性肺炎を合併する確率は一般に2-3%とされているので、40%は看過できない割合です。
5人治療したら2人が間質性肺炎を合併する・・・ちょっと考えたくありませんね。
Date: 15 Apr 2016
Topic: Lung and other thoracic tumours / Cancer Immunology and Immunotherapy / Anticancer agents & Biologic therapy
TATTON試験は、Osimertinib 80mg/日内服に様々な薬を併用する第Ib相試験である。併用薬は、Durvalumab(抗PD-L1モノクローナル抗体)、Savolitinib(MET阻害薬)、またはSelumetinib(MEK1/2阻害薬)で、EGFR遺伝子変異陽性進行肺癌患者を対象とした。Osimertinib+Durvalumab併用療法は本試験のひとつの治療群に過ぎないが、2つのパートに分かれている。パートAはEGFR阻害薬による治療歴のある進行非小細胞肺癌患者を対象とした用量設定試験であり、パートBはEGFR阻害薬による治療歴がない進行期の患者を対象とした拡大試験である。
Osimertinib(AZD9291)は経口・不可逆的第3世代EGFR阻害薬で、EGFR遺伝子変異陽性ないしはT790M耐性変異陽性肺癌患者を治療対象としており、一方のDurvalumab(MEDI4736)は高親和性ヒトIgG1クラスモノクローナル抗体で、PD-1とCD80双方に結合するとされるPD-L1をブロックする。
今回は、TATTON試験におけるOsimertinib+Durvalumab併用療法のパートA,Bから得られた最新の安全性データが報告された。TATTON試験では免疫チェックポイント阻害薬に不適格な患者、間質性肺炎の既往がある患者は除外された。
パートAの患者は、EGFR阻害薬治療を受けた後に病勢進行となった患者で構成されていた。パートBの患者では、腫瘍生検とT790M変異に関する中央診断が義務付けられていた。パートAの患者では、Osimertinib 80mg/日の服用とDurvalumabを2週に1回、3mg/kgもしくは10mg/kg静注で治療され、パートBの患者では、Osimertinib 80mg/日の服用とDurvalumabを2週に1回、10mg/kg静注で治療された。
主要評価項目は安全性と忍容性であり、副次評価項目は臨床効果だった。
データ解析時点で、Osimertinib+Durvalumab併用療法はパートAで23人の患者に、パートBで11人の患者に投与された。パートAにおいて、全グレードで頻度が高かった有害事象は、嘔気(39%)、嘔吐(39%)、貧血(35%)、下痢(35%)だった。パートBでは55%に下痢が、45%に嘔気が見られた。
間質性肺炎はパートAでは6人(26%)に認め、うち2人はGrade 3 / 4だった。同様にパートBでは7人(64%)に認め、うち3人はGrade 3 / 4だった。間質性肺炎による死亡例はなかった。ほとんどの患者は副腎皮質ステロイドの投与を受けた。治療開始から間質性肺炎発症までの日数の中央値は69日だった。
パートAでは、21人(91.3%)の患者において奏効を認めた。明らかな腫瘍縮小を認めた(PRin)のは12人(52.2%)、そのうち腫瘍縮小が一定期間持続した(PR確定)のは9人(39.1%)だった。病勢安定は9人(31.9%)で確認された。
パートBでは、10人の患者が評価可能であり、8人(80%)がPRinであり、うち7人(70%)はPR確定、病勢安定は2人(20%)で確認された。
今回の報告では、間質性肺炎合併割合が38%で、そのうち5人がGrade 3 / 4であり、OsimertinibもしくはDurvalumabの単剤療法に比べると遥かに頻度が高いが、間質性肺炎の重症度には明らかな差異はなかった。一方、EGFR遺伝子変異陽性非小細胞肺癌患者に対するOsimertinib+Durvalumab併用療法は有望な臨床効果をもたらした。特に、EGFR阻害薬既治療の患者での奏効割合は、T790M陽性患者で67%、T790M陰性患者では21%、EGFR遺伝子変異陽性で治療歴のない患者では70%だった。
Osimertinib+Durvalumab併用療法の安全性・忍容性については更なる調査が必要と判断され、結果としてTATTON試験におけるOseimertinib+Durvalumab併用療法の患者登録は中断されている。
引用文献
136O. Osimertinib combined with durvalumab in EGFR-mutant non-small cell lung cancer: Results from the TATTON phase Ib trial
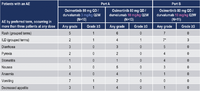
計3人以上報告された有害事象の一覧

Osimertinib+Durvalumab併用療法ではそれぞれの単剤療法に比べて間質性肺炎発症数が増加したが、重症度はかわりなかった

腫瘍縮小効果は有望だった
一言で言ってしまうと、有望な腫瘍縮小効果が確認されたものの、40%近くで間質性肺炎を合併したそうです。
EGFR阻害薬単剤で間質性肺炎を合併する確率は一般に2-3%とされているので、40%は看過できない割合です。
5人治療したら2人が間質性肺炎を合併する・・・ちょっと考えたくありませんね。
Date: 15 Apr 2016
Topic: Lung and other thoracic tumours / Cancer Immunology and Immunotherapy / Anticancer agents & Biologic therapy
TATTON試験は、Osimertinib 80mg/日内服に様々な薬を併用する第Ib相試験である。併用薬は、Durvalumab(抗PD-L1モノクローナル抗体)、Savolitinib(MET阻害薬)、またはSelumetinib(MEK1/2阻害薬)で、EGFR遺伝子変異陽性進行肺癌患者を対象とした。Osimertinib+Durvalumab併用療法は本試験のひとつの治療群に過ぎないが、2つのパートに分かれている。パートAはEGFR阻害薬による治療歴のある進行非小細胞肺癌患者を対象とした用量設定試験であり、パートBはEGFR阻害薬による治療歴がない進行期の患者を対象とした拡大試験である。
Osimertinib(AZD9291)は経口・不可逆的第3世代EGFR阻害薬で、EGFR遺伝子変異陽性ないしはT790M耐性変異陽性肺癌患者を治療対象としており、一方のDurvalumab(MEDI4736)は高親和性ヒトIgG1クラスモノクローナル抗体で、PD-1とCD80双方に結合するとされるPD-L1をブロックする。
今回は、TATTON試験におけるOsimertinib+Durvalumab併用療法のパートA,Bから得られた最新の安全性データが報告された。TATTON試験では免疫チェックポイント阻害薬に不適格な患者、間質性肺炎の既往がある患者は除外された。
パートAの患者は、EGFR阻害薬治療を受けた後に病勢進行となった患者で構成されていた。パートBの患者では、腫瘍生検とT790M変異に関する中央診断が義務付けられていた。パートAの患者では、Osimertinib 80mg/日の服用とDurvalumabを2週に1回、3mg/kgもしくは10mg/kg静注で治療され、パートBの患者では、Osimertinib 80mg/日の服用とDurvalumabを2週に1回、10mg/kg静注で治療された。
主要評価項目は安全性と忍容性であり、副次評価項目は臨床効果だった。
データ解析時点で、Osimertinib+Durvalumab併用療法はパートAで23人の患者に、パートBで11人の患者に投与された。パートAにおいて、全グレードで頻度が高かった有害事象は、嘔気(39%)、嘔吐(39%)、貧血(35%)、下痢(35%)だった。パートBでは55%に下痢が、45%に嘔気が見られた。
間質性肺炎はパートAでは6人(26%)に認め、うち2人はGrade 3 / 4だった。同様にパートBでは7人(64%)に認め、うち3人はGrade 3 / 4だった。間質性肺炎による死亡例はなかった。ほとんどの患者は副腎皮質ステロイドの投与を受けた。治療開始から間質性肺炎発症までの日数の中央値は69日だった。
パートAでは、21人(91.3%)の患者において奏効を認めた。明らかな腫瘍縮小を認めた(PRin)のは12人(52.2%)、そのうち腫瘍縮小が一定期間持続した(PR確定)のは9人(39.1%)だった。病勢安定は9人(31.9%)で確認された。
パートBでは、10人の患者が評価可能であり、8人(80%)がPRinであり、うち7人(70%)はPR確定、病勢安定は2人(20%)で確認された。
今回の報告では、間質性肺炎合併割合が38%で、そのうち5人がGrade 3 / 4であり、OsimertinibもしくはDurvalumabの単剤療法に比べると遥かに頻度が高いが、間質性肺炎の重症度には明らかな差異はなかった。一方、EGFR遺伝子変異陽性非小細胞肺癌患者に対するOsimertinib+Durvalumab併用療法は有望な臨床効果をもたらした。特に、EGFR阻害薬既治療の患者での奏効割合は、T790M陽性患者で67%、T790M陰性患者では21%、EGFR遺伝子変異陽性で治療歴のない患者では70%だった。
Osimertinib+Durvalumab併用療法の安全性・忍容性については更なる調査が必要と判断され、結果としてTATTON試験におけるOseimertinib+Durvalumab併用療法の患者登録は中断されている。
引用文献
136O. Osimertinib combined with durvalumab in EGFR-mutant non-small cell lung cancer: Results from the TATTON phase Ib trial

計3人以上報告された有害事象の一覧

Osimertinib+Durvalumab併用療法ではそれぞれの単剤療法に比べて間質性肺炎発症数が増加したが、重症度はかわりなかった

腫瘍縮小効果は有望だった
2016年05月25日
2016年05月24日
EGFR遺伝子変異陽性、胸水貯留で再燃、どうする?
以前当院を2nd opinionで受診された患者さんから、久し振りに連絡がありました。
60代女性、EGFR遺伝子変異陽性(Exon 19欠失変異)、胸水貯留あり。
イレッサ、タルセバ、ジオトリフを使い継いできた方ですが、最近胸水貯留が目立つようになり、胸水穿刺をしたとのこと。
現在、胸水検体を用いたT790M変異検査の結果を待っているところなのだそうです。
まさにタグリッソの臨床導入を目前に控えた、タイムリーなご質問と思いましたので、本人の許可を得て一部修正してやり取りを掲載します。
ご覧になっている方の参考になれば幸いです。
------------------------------------------------------------------------------------------------------------------------------------
いずれ胸水が増えてきたら検査してみるとおっしゃっていましたが、その時が来た、ということなのですね。
> T790Mが検出された場合、タグリッソが使えるようになるまで、
> ①このまま無治療で行くか、化学療法をするか、どちらが良いのでしょう。
> 私としては化学療法は怖いので受けたくないのですが、無治療と言うのもキツイかなぁと思っているのです。
> 胸水が増えると胸からゴボゴボと嫌な音がするし、痛みも有るし。
> でも、胸水をその都度抜きならがタグリッソを待つのも有りかと。
タグリッソが使えない状況なら、まずは化学療法をお勧めします。
あなたはたしか、胸水(癌性胸膜炎)以外にははっきりした病巣はなかったですね。
癌性胸膜炎には、アバスチン併用化学療法がよく効くと言われています。
しかし、今のところEvidence based medicineの観点からは、実地臨床でアバスチンと併用可能な薬はカルボプラチン+パクリタキセルのみですが、脱毛と末梢神経障害は避けられません。
あなたがおっしゃっておられるように、胸水穿刺を外来で繰り返しながらタグリッソの上市を待つ、という選択肢もあっていいでしょう。
しかし、有効な薬があるのなら、まずはそちらから使っておきたいというのが、我々の考え方です。
> ②化学療法をするとしたら何回するのでしょうか?
> 担当医には髪の毛は抜けても良いけど、吐き気には弱いと伝えていますので、薬は絞られて来るのではないかと思いますが、化学療法は受けた事が無いのでよく分かりません。
> タグリッソが使える様になるまでの繋ぎとして、例えば一回だけとかの化学療法が出来るものなのでしょうか。
> そしてそれは効果が有るのでしょうか。
> 又、一回だけ受けて、のちにその治療が又続きから出来るものなのでしょうか。
化学療法の治療回数は、治療方法によって異なります。
つなぎとして化学療法をするかどうかは担当医の考え方次第ですね。
効果があるかどうかはやってみないとわかりません、というのが本音ですが、いわゆる奏効割合(測定可能な腫瘍が半分以下に小さくなる人の割合)は上記のカルボプラチン+パクリタキセル+アバスチン初回化学療法で欧米人で約35%、日本人で約60%程度とされています。
特に胸水貯留への効果は高いと言われていますので、あなたにはしっくりきます。
1コースだけやって、タグリッソに切り替えて、タグリッソが効かなくなったら2コース目移行を再開、という選択肢もありですし、イレッサに戻る、という選択肢もありです。
> もう一つの場合の
> T760Mが検出されなかった時は、
> ③間を置かずに2回目の検査をするか、一旦化学療法をして、間を置いて2回目の検査をするか。
> どちらの方が良いのでしょうか。
> 時間を置いたらその間にT790M変異が起こるとかそんな事はないのでしょうか。
> 今回の検査でT790Mが出てなかったら化学療法になると思います。
> 胸水も十分溜まっている感じがするので、又抜いて検査に出す事は出来ると思いますが、間を置いて出す方が良いとかありますか?
胸水でT790Mが検出されない可能性はもちろんあります。
局所麻酔下で胸腔内にカメラを挿入し、胸水ではなくて腫瘍細胞がたくさんいるであろう胸膜そのものを採取するやり方もあります。
胸水を再度抜くよりも、一度そちらにトライした方がいい気がします。
それでもT790M陰性ならば、化学療法を開始する方がいいでしょう。
化学療法後に再増悪となったら、その際に改めてT790Mを調べるといいでしょう。
> ④先生の予想で構いませんので、私に効きそうな 化学療法を教えて下さい。
>担当医にAかBの治療のどちらにしますかと尋ねられた時の為に少しでも勉強しておこうと思います。
Evidence basedでの実地臨床で行うなら、カルボプラチン+パクリタキセル+アバスチン併用療法がベストだと思います。
④-⑥コース行って、効果が持続していればその後アバスチンのみ継続することになります。
アバスチン単独維持療法まで来れば、その後3ヶ月程度すればまた髪の毛が生えてきます。
ただし、手足のしびれ(末梢神経障害)でいやな思いをすることはあるでしょうし、しびれは一旦起こってしまうと、ほとんどの場合ずっと改善せずに症状が続きます。
病院によっては、シスプラチン+ペメトレキセド+アバスチンとか、カルボプラチン+ペメトレキセド+アバスチンとかも実地臨床でやっているかもしれません。
これらは脱毛や末梢神経障害が軽いはずです。
たしかシスプラチン+ペメトレキセド+アバスチン併用化学療法は、病院によっては臨床試験が現在も継続中だったと思います。
参加するための基準がありますので、興味があれば担当医に質問してみてください。
それから、胸水がたまるのが不快であれば、胸の中にビニールの管を入れて胸水を排除して、そのあと胸水がたまりにくくするような治療(胸腔ドレナージ・胸膜癒着術)もあります。
しかし、これをあなたに一度やってしまうと、胸水や胸膜を使ったT790M検査ができなくなります。
そのため、今のところ担当医は見合わせているのでしょう。
もし局所麻酔下胸腔鏡、胸膜生検を希望されるのであれば、この胸腔ドレナージ・胸膜癒着術を受ける前に一度担当医にご相談ください。
僕の患者さんに、T790Mが1年ちょっと前から判明していた人がいたのですが、九州がんセンターに紹介しても臨床試験適応外と言われ、ようやく実地臨床で使えるようになりそうだと思っていたら、先日待ち切れずに天国に旅立ってしまいました。
あなたは若いし体力もありそうですし、T790Mが陽性でも陰性でも、前向きに治療に取り組んでください。
> 「局所麻酔下で胸腔内にカメラを挿入し、胸水ではなくて腫瘍細胞がたくさんいるであろう胸膜そのものを採取するやり方」
> これは、痛いのでしょうね。気管支鏡より大掛かりな感じですか。
> 外来でするのでしょうか。
> もう一度だけ胸水で検査して、ダメだったら化学療法を行って、その後に3度目のトライをもしも受け付けて貰えるならば、その時に胸膜
採取すると言うのは有りでしょうか。
> 胸膜採取でT790Mの検出率が高くなるなら、痛くても受ける価値は有りますね。
> 3回の検査を受けられればの話ですが。
> もしも2回までしか出来ないならば胸膜採取が良いですね。
局所麻酔をしっかり行えば、検査中の痛みはそれほどないと思います。
ただ、検査後に胸水排除用のドレーン(ビニールの管)を残しますが、局所麻酔が切れた後にこちらの痛みが出ます。
通常は気管支鏡と同じ検査室で行っています。
一定量の胸水がたまっていれば検査自体はできますので、何度か胸水穿刺を試してからでもいいでしょう。
胸水よりも胸膜組織の方がT790M検出率が高い、というデータはありませんし、あくまで「がん細胞の含有量が多いから」「ほかの細胞が
含まれる割合が少ないから」検出率が高まるだろう、という推測に基づいています。
がん遺伝子変異を網羅的に解析するLC-SCRUMの成果報告を聞いていますと、胸水ではがん細胞以外の細胞が含まれることが多く、異常が検出される頻度が低いそうです。
> 次の質問ですが
> 「1コースだけやって、タグリッソに切り替えて、タグリッソが効かなくなったら2コース目移行を再開、という選択肢もありですし、イレッサに戻る、という選択肢もありです。 」
> この場合、イレッサではなく、ジオトリフに戻る事は出来ますか?
> 私の場合、イレッサよりジオトリフが断然合っていました。
タグリッソ使用後に耐性化した場合、C797Sという耐性変異が出現することが知られており、これに対してはイレッサの効果が高いそうです。
しかし、そもそもC797Sは実地臨床ではまだ検査できませんし、C797S以外にも耐性変異はありますし、C797Sにタルセバやジオトリフが効くかどうかのデータ自体がありません。
ですので、毒性の観点から、ジオトリフを優先的に使う、という考え方もあっていいと思います。
> 次の質問ですが、アバスチン+カルボプラチン+パクリタキセルの脱毛は全然かまわないのですが、末梢神経の痺れが継続するのは嫌ですね。
> ガン友さんもそれで運転が苦手になったと言っていました。
僕の患者さんは、程度の差こそあれ、ほぼ100%が末梢神経障害で困っていました。ひどくなると、箸も持てなくなることがあります。
>シスプラチン+ペメトレキセド+アバスチン併用化学療法は、末梢神経の痺れが少ないなら、私としてはそちらの方が良いと思いますが、効果はどちらが有りますか。
> もしも効果が変わらないのであれば私がその試験に適応かどうか担当医に質問してみようと思います。
> 吐き気に弱いのですが前者と後者では吐き気の出方はどうでしょうか。
シスプラチン+ペメトレキセド+アバスチン併用化学療法は、日本人のデータはまだありません(だからこそ臨床試験をしているわけです)。
海外で行われた臨床試験では、測定可能な病変が半分以上に縮小する割合は54.2%と報告されており、前述のカルボプラチン+パクリタキセル+アバスチン療法よりも優れていました。
治療開始から、明らかな病勢悪化に至るまでの平均期間は10か月程度と報告されています。
数字だけ見れば、EGFR遺伝子変異陽性患者さんに対するイレッサの治療成績と大きな差はないですね。
シスプラチンを使う分だけ吐き気は出やすいかも知れませんが、最近の化学療法は吐き気止めが格段に進歩しているので、予想されているほどにはきつくないと思いますよ。
> 先生もおっしゃってますがタバコは本当に嫌ですね、私は吸ったことが有りませんが、肺がんになってからは特に憎く思えます。
> 通っている病院の駐車場の横で入院患者が吸っているのを見かけます。
僕の学生の頃は、男性の半数程度は喫煙者だったので、全体としてみると喫煙者は減少しているようですね。
日本たばこ産業の子会社ががん関連の治療薬を販売していることなどを知っている立場からすると、喫煙者は搾取されている人種なんだとかわいそうに感じます。
しかし、ニボルマブのような薬が出てくると、我々の生活にも影響しますので、喫煙者対策は本当に切実になってきました。
極端な言い方かもしれませんが、日本では法的に喫煙を禁止してほしいと願っています。
せめても、日本たばこ産業やたばこ農家に国のお金を使ってほしくないです。
60代女性、EGFR遺伝子変異陽性(Exon 19欠失変異)、胸水貯留あり。
イレッサ、タルセバ、ジオトリフを使い継いできた方ですが、最近胸水貯留が目立つようになり、胸水穿刺をしたとのこと。
現在、胸水検体を用いたT790M変異検査の結果を待っているところなのだそうです。
まさにタグリッソの臨床導入を目前に控えた、タイムリーなご質問と思いましたので、本人の許可を得て一部修正してやり取りを掲載します。
ご覧になっている方の参考になれば幸いです。
------------------------------------------------------------------------------------------------------------------------------------
いずれ胸水が増えてきたら検査してみるとおっしゃっていましたが、その時が来た、ということなのですね。
> T790Mが検出された場合、タグリッソが使えるようになるまで、
> ①このまま無治療で行くか、化学療法をするか、どちらが良いのでしょう。
> 私としては化学療法は怖いので受けたくないのですが、無治療と言うのもキツイかなぁと思っているのです。
> 胸水が増えると胸からゴボゴボと嫌な音がするし、痛みも有るし。
> でも、胸水をその都度抜きならがタグリッソを待つのも有りかと。
タグリッソが使えない状況なら、まずは化学療法をお勧めします。
あなたはたしか、胸水(癌性胸膜炎)以外にははっきりした病巣はなかったですね。
癌性胸膜炎には、アバスチン併用化学療法がよく効くと言われています。
しかし、今のところEvidence based medicineの観点からは、実地臨床でアバスチンと併用可能な薬はカルボプラチン+パクリタキセルのみですが、脱毛と末梢神経障害は避けられません。
あなたがおっしゃっておられるように、胸水穿刺を外来で繰り返しながらタグリッソの上市を待つ、という選択肢もあっていいでしょう。
しかし、有効な薬があるのなら、まずはそちらから使っておきたいというのが、我々の考え方です。
> ②化学療法をするとしたら何回するのでしょうか?
> 担当医には髪の毛は抜けても良いけど、吐き気には弱いと伝えていますので、薬は絞られて来るのではないかと思いますが、化学療法は受けた事が無いのでよく分かりません。
> タグリッソが使える様になるまでの繋ぎとして、例えば一回だけとかの化学療法が出来るものなのでしょうか。
> そしてそれは効果が有るのでしょうか。
> 又、一回だけ受けて、のちにその治療が又続きから出来るものなのでしょうか。
化学療法の治療回数は、治療方法によって異なります。
つなぎとして化学療法をするかどうかは担当医の考え方次第ですね。
効果があるかどうかはやってみないとわかりません、というのが本音ですが、いわゆる奏効割合(測定可能な腫瘍が半分以下に小さくなる人の割合)は上記のカルボプラチン+パクリタキセル+アバスチン初回化学療法で欧米人で約35%、日本人で約60%程度とされています。
特に胸水貯留への効果は高いと言われていますので、あなたにはしっくりきます。
1コースだけやって、タグリッソに切り替えて、タグリッソが効かなくなったら2コース目移行を再開、という選択肢もありですし、イレッサに戻る、という選択肢もありです。
> もう一つの場合の
> T760Mが検出されなかった時は、
> ③間を置かずに2回目の検査をするか、一旦化学療法をして、間を置いて2回目の検査をするか。
> どちらの方が良いのでしょうか。
> 時間を置いたらその間にT790M変異が起こるとかそんな事はないのでしょうか。
> 今回の検査でT790Mが出てなかったら化学療法になると思います。
> 胸水も十分溜まっている感じがするので、又抜いて検査に出す事は出来ると思いますが、間を置いて出す方が良いとかありますか?
胸水でT790Mが検出されない可能性はもちろんあります。
局所麻酔下で胸腔内にカメラを挿入し、胸水ではなくて腫瘍細胞がたくさんいるであろう胸膜そのものを採取するやり方もあります。
胸水を再度抜くよりも、一度そちらにトライした方がいい気がします。
それでもT790M陰性ならば、化学療法を開始する方がいいでしょう。
化学療法後に再増悪となったら、その際に改めてT790Mを調べるといいでしょう。
> ④先生の予想で構いませんので、私に効きそうな 化学療法を教えて下さい。
>担当医にAかBの治療のどちらにしますかと尋ねられた時の為に少しでも勉強しておこうと思います。
Evidence basedでの実地臨床で行うなら、カルボプラチン+パクリタキセル+アバスチン併用療法がベストだと思います。
④-⑥コース行って、効果が持続していればその後アバスチンのみ継続することになります。
アバスチン単独維持療法まで来れば、その後3ヶ月程度すればまた髪の毛が生えてきます。
ただし、手足のしびれ(末梢神経障害)でいやな思いをすることはあるでしょうし、しびれは一旦起こってしまうと、ほとんどの場合ずっと改善せずに症状が続きます。
病院によっては、シスプラチン+ペメトレキセド+アバスチンとか、カルボプラチン+ペメトレキセド+アバスチンとかも実地臨床でやっているかもしれません。
これらは脱毛や末梢神経障害が軽いはずです。
たしかシスプラチン+ペメトレキセド+アバスチン併用化学療法は、病院によっては臨床試験が現在も継続中だったと思います。
参加するための基準がありますので、興味があれば担当医に質問してみてください。
それから、胸水がたまるのが不快であれば、胸の中にビニールの管を入れて胸水を排除して、そのあと胸水がたまりにくくするような治療(胸腔ドレナージ・胸膜癒着術)もあります。
しかし、これをあなたに一度やってしまうと、胸水や胸膜を使ったT790M検査ができなくなります。
そのため、今のところ担当医は見合わせているのでしょう。
もし局所麻酔下胸腔鏡、胸膜生検を希望されるのであれば、この胸腔ドレナージ・胸膜癒着術を受ける前に一度担当医にご相談ください。
僕の患者さんに、T790Mが1年ちょっと前から判明していた人がいたのですが、九州がんセンターに紹介しても臨床試験適応外と言われ、ようやく実地臨床で使えるようになりそうだと思っていたら、先日待ち切れずに天国に旅立ってしまいました。
あなたは若いし体力もありそうですし、T790Mが陽性でも陰性でも、前向きに治療に取り組んでください。
> 「局所麻酔下で胸腔内にカメラを挿入し、胸水ではなくて腫瘍細胞がたくさんいるであろう胸膜そのものを採取するやり方」
> これは、痛いのでしょうね。気管支鏡より大掛かりな感じですか。
> 外来でするのでしょうか。
> もう一度だけ胸水で検査して、ダメだったら化学療法を行って、その後に3度目のトライをもしも受け付けて貰えるならば、その時に胸膜
採取すると言うのは有りでしょうか。
> 胸膜採取でT790Mの検出率が高くなるなら、痛くても受ける価値は有りますね。
> 3回の検査を受けられればの話ですが。
> もしも2回までしか出来ないならば胸膜採取が良いですね。
局所麻酔をしっかり行えば、検査中の痛みはそれほどないと思います。
ただ、検査後に胸水排除用のドレーン(ビニールの管)を残しますが、局所麻酔が切れた後にこちらの痛みが出ます。
通常は気管支鏡と同じ検査室で行っています。
一定量の胸水がたまっていれば検査自体はできますので、何度か胸水穿刺を試してからでもいいでしょう。
胸水よりも胸膜組織の方がT790M検出率が高い、というデータはありませんし、あくまで「がん細胞の含有量が多いから」「ほかの細胞が
含まれる割合が少ないから」検出率が高まるだろう、という推測に基づいています。
がん遺伝子変異を網羅的に解析するLC-SCRUMの成果報告を聞いていますと、胸水ではがん細胞以外の細胞が含まれることが多く、異常が検出される頻度が低いそうです。
> 次の質問ですが
> 「1コースだけやって、タグリッソに切り替えて、タグリッソが効かなくなったら2コース目移行を再開、という選択肢もありですし、イレッサに戻る、という選択肢もありです。 」
> この場合、イレッサではなく、ジオトリフに戻る事は出来ますか?
> 私の場合、イレッサよりジオトリフが断然合っていました。
タグリッソ使用後に耐性化した場合、C797Sという耐性変異が出現することが知られており、これに対してはイレッサの効果が高いそうです。
しかし、そもそもC797Sは実地臨床ではまだ検査できませんし、C797S以外にも耐性変異はありますし、C797Sにタルセバやジオトリフが効くかどうかのデータ自体がありません。
ですので、毒性の観点から、ジオトリフを優先的に使う、という考え方もあっていいと思います。
> 次の質問ですが、アバスチン+カルボプラチン+パクリタキセルの脱毛は全然かまわないのですが、末梢神経の痺れが継続するのは嫌ですね。
> ガン友さんもそれで運転が苦手になったと言っていました。
僕の患者さんは、程度の差こそあれ、ほぼ100%が末梢神経障害で困っていました。ひどくなると、箸も持てなくなることがあります。
>シスプラチン+ペメトレキセド+アバスチン併用化学療法は、末梢神経の痺れが少ないなら、私としてはそちらの方が良いと思いますが、効果はどちらが有りますか。
> もしも効果が変わらないのであれば私がその試験に適応かどうか担当医に質問してみようと思います。
> 吐き気に弱いのですが前者と後者では吐き気の出方はどうでしょうか。
シスプラチン+ペメトレキセド+アバスチン併用化学療法は、日本人のデータはまだありません(だからこそ臨床試験をしているわけです)。
海外で行われた臨床試験では、測定可能な病変が半分以上に縮小する割合は54.2%と報告されており、前述のカルボプラチン+パクリタキセル+アバスチン療法よりも優れていました。
治療開始から、明らかな病勢悪化に至るまでの平均期間は10か月程度と報告されています。
数字だけ見れば、EGFR遺伝子変異陽性患者さんに対するイレッサの治療成績と大きな差はないですね。
シスプラチンを使う分だけ吐き気は出やすいかも知れませんが、最近の化学療法は吐き気止めが格段に進歩しているので、予想されているほどにはきつくないと思いますよ。
> 先生もおっしゃってますがタバコは本当に嫌ですね、私は吸ったことが有りませんが、肺がんになってからは特に憎く思えます。
> 通っている病院の駐車場の横で入院患者が吸っているのを見かけます。
僕の学生の頃は、男性の半数程度は喫煙者だったので、全体としてみると喫煙者は減少しているようですね。
日本たばこ産業の子会社ががん関連の治療薬を販売していることなどを知っている立場からすると、喫煙者は搾取されている人種なんだとかわいそうに感じます。
しかし、ニボルマブのような薬が出てくると、我々の生活にも影響しますので、喫煙者対策は本当に切実になってきました。
極端な言い方かもしれませんが、日本では法的に喫煙を禁止してほしいと願っています。
せめても、日本たばこ産業やたばこ農家に国のお金を使ってほしくないです。
2016年05月20日
DurvalumabとGefitinibの併用療法(ELCC2016)
DurvalumabとGefitinibの併用療法に関する初期の報告がELCC2016で成されたようです。
わずか20人の治療経過に関する報告ですが、奏効割合は80%程度、病勢コントロール割合はほぼ100%と有望です。
これからさらに患者数を増やして検証作業がされるようです。
そのほかにもさまざまな組み合わせで免疫チェックポイント阻害薬+チロシンキナーゼ阻害薬の臨床試験が進行していますが、どちらかというと免疫チェックポイント阻害薬の効果が低いとされるdriver oncogene addicted NSCLCに対するこうした治療コンセプトの妥当性は、今回の報告を見る限り確たる背景が乏しいようで、今後どのように展開していくのか未知数です。
・Durvalumab+Gefitinib併用療法の第I相試験について、ELCC2016の"Best Abstracts"セッションにおいて初期の結果報告がなされた
・Durvalumabは人型IgG1モノクローナル抗体で、PD-L1とPD-1もしくはPD-L1とCD-80の相互作用を阻害する
・GefitinibはEGFR阻害薬
・対象はEGFR遺伝子変異陽性の、EGFR阻害薬治療歴のない非小細胞肺癌患者
・忍容性と抗腫瘍活性について、有望な結果だった
・今回報告されたのは、Durvalumab+Gefitinib併用療法の第I相オープンラベル多施設共同臨床試験の、容量設定段階試験のupdated dataだった
・Exon 19 deletion変異の患者が11人、Exon 21 L858R変異の患者が8人参加した
・患者は2つの治療群に割り付けられた
・1群では、Durvalumab 10mg/kgを2週間に1回、Gefitinib 250mg/日を毎日使用した
・2群では、Gefitinib 250mg/日を毎日、4週間使用し、引き続いて1群と同様の治療を行った
・患者背景は2群間で同様だった
・主要評価項目は安全性、副次評価項目は奏効割合、薬物動態、免疫源性とされた
・ほとんどの患者で、安全性は良好だった
・最も頻度の高かった有害事象は下痢で、1群で80%、2群で60%に認められた
・1群では70%にALT上昇、60%に発疹を認めた
・2群では60%にALT上昇、同じく60%に掻痒症を認めた
・無症候性のAST/ALT上昇は両群で認められたが、2群のほうがより高頻度で高度だった
・ALT/AST増加に対しては、使用量の減量もしくはステロイド投与で対応した
・Grade 3/4の有害事象によって治療継続不能になった患者は2群にのみ認められ、3人はALTもしくはASTの増加が、1人は肺臓炎が原因だった
・19人(1群のうち9人、2群のうち10人)で、治療開始から8週以降の効果判定ができた
・奏効割合は1群で77.8%(9人中7人が奏効)、2群で80%(10人中8人が奏効)だった
・1群のうち1人は完全奏効だった
・8週以上病勢安定を保っている患者は1群で2人、2群で1人認められた
・24週以上病勢安定を保っている患者は2群で1人認められた
・抗PD-1 / PD-L1抗体療法は非小細胞肺癌の二次治療で確立され、奏効割合は20%以上である
・治療効果は長期間持続し、これにより目覚しい長期生存が得られる
・化学療法と比較して、治療関連有害事象の頻度は低く、全Gradeで50-69%、Grade 3 / 4で8-16%であり、そのうちGrade 3 /4の免疫関連有害事象は約5%とされる
・治療中止が必要となる有害事象も同様に5%程度である
・PD-L1の免疫染色結果が抗PD-1 / PD-L1抗体単剤療法の効果予測に有効と目されている
・免疫チェックポイント阻害薬とチロシンキナーゼ阻害薬の併用は野心的な治療であり、有効性を示唆する基礎データは乏しい
・EGFR遺伝子変異陽性の早期非小細胞肺癌では、PD-L1発現は増強しているようである
・しかしながら、進行したEGFR遺伝子変異陽性非小細胞肺癌では、抗PD-1 / PD-L1抗体療法の効果はむしろ低い
・にも拘らず、免疫療法とチロシンキナーゼ阻害薬併用療法の臨床試験は多数進行中である
-EGFR遺伝子変異陽性非小細胞肺癌に対するDurvalumab+Gefitinib併用療法
-EGFR遺伝子変異陽性非小細胞肺癌に対するDurvalumab+Osimertinib併用療法
-EGFR遺伝子変異陽性非小細胞肺癌で、Erlotinib治療後に病勢進行に至った際のNivolumab+Erlotinib併用療法
-ALK再構成陽性非小細胞肺癌で、Crizotinib治療後に病勢進行に至った際のNivolumab+Ceritinib併用療法
-EGFR遺伝子変異陽性非小細胞肺癌に対するAtezorizumab+Erlotinib併用療法
-ALK再構成陽性非小細胞肺癌で、Crizotinib治療後に病勢進行に至った際のAtezorizumab+Alectinib併用療法
-EGFR遺伝子変異陽性非小細胞肺癌で、Erlotinib治療後に病勢進行に至った際のPembrolizumab+Rociletinib併用療法
-EGFR遺伝子変異陽性非小細胞肺癌で、Pembrolizumab治療後に病勢進行に至った際のPembrolizumab+Afatinib併用療法
-ALK再構成陽性非小細胞肺癌に対するPembrolizumab+Crizotinib併用療法
-KRAS変異陽性非小細胞肺癌に対するPembrolizumab+Dabrafenib / Trametinib併用療法
・今回の結果を受けて、Durvalumab 10mg/kgの隔週投与とGefitinib 250mg/日の連日投与を併用する設定で更なる開発を進めることになった
・治療開始前後の生検組織や血液検体を用いたバイオマーカーの探索が進行中で、EGFR阻害薬と免疫療法併用時の効果発現メカニズムが今後明らかになっていく予定である
reference
57O. Efficacy, safety and tolerability of MEDI4736 (durvalumab [D]), a human IgG1 anti-programmed cell death-ligand-1 (PD-L1) antibody, combined with gefitinib (G): A phase I expansion in TKI-naïve patients (pts) with EGFR mutant NSCLC
わずか20人の治療経過に関する報告ですが、奏効割合は80%程度、病勢コントロール割合はほぼ100%と有望です。
これからさらに患者数を増やして検証作業がされるようです。
そのほかにもさまざまな組み合わせで免疫チェックポイント阻害薬+チロシンキナーゼ阻害薬の臨床試験が進行していますが、どちらかというと免疫チェックポイント阻害薬の効果が低いとされるdriver oncogene addicted NSCLCに対するこうした治療コンセプトの妥当性は、今回の報告を見る限り確たる背景が乏しいようで、今後どのように展開していくのか未知数です。
・Durvalumab+Gefitinib併用療法の第I相試験について、ELCC2016の"Best Abstracts"セッションにおいて初期の結果報告がなされた
・Durvalumabは人型IgG1モノクローナル抗体で、PD-L1とPD-1もしくはPD-L1とCD-80の相互作用を阻害する
・GefitinibはEGFR阻害薬
・対象はEGFR遺伝子変異陽性の、EGFR阻害薬治療歴のない非小細胞肺癌患者
・忍容性と抗腫瘍活性について、有望な結果だった
・今回報告されたのは、Durvalumab+Gefitinib併用療法の第I相オープンラベル多施設共同臨床試験の、容量設定段階試験のupdated dataだった
・Exon 19 deletion変異の患者が11人、Exon 21 L858R変異の患者が8人参加した
・患者は2つの治療群に割り付けられた
・1群では、Durvalumab 10mg/kgを2週間に1回、Gefitinib 250mg/日を毎日使用した
・2群では、Gefitinib 250mg/日を毎日、4週間使用し、引き続いて1群と同様の治療を行った
・患者背景は2群間で同様だった
・主要評価項目は安全性、副次評価項目は奏効割合、薬物動態、免疫源性とされた
・ほとんどの患者で、安全性は良好だった
・最も頻度の高かった有害事象は下痢で、1群で80%、2群で60%に認められた
・1群では70%にALT上昇、60%に発疹を認めた
・2群では60%にALT上昇、同じく60%に掻痒症を認めた
・無症候性のAST/ALT上昇は両群で認められたが、2群のほうがより高頻度で高度だった
・ALT/AST増加に対しては、使用量の減量もしくはステロイド投与で対応した
・Grade 3/4の有害事象によって治療継続不能になった患者は2群にのみ認められ、3人はALTもしくはASTの増加が、1人は肺臓炎が原因だった
・19人(1群のうち9人、2群のうち10人)で、治療開始から8週以降の効果判定ができた
・奏効割合は1群で77.8%(9人中7人が奏効)、2群で80%(10人中8人が奏効)だった
・1群のうち1人は完全奏効だった
・8週以上病勢安定を保っている患者は1群で2人、2群で1人認められた
・24週以上病勢安定を保っている患者は2群で1人認められた
・抗PD-1 / PD-L1抗体療法は非小細胞肺癌の二次治療で確立され、奏効割合は20%以上である
・治療効果は長期間持続し、これにより目覚しい長期生存が得られる
・化学療法と比較して、治療関連有害事象の頻度は低く、全Gradeで50-69%、Grade 3 / 4で8-16%であり、そのうちGrade 3 /4の免疫関連有害事象は約5%とされる
・治療中止が必要となる有害事象も同様に5%程度である
・PD-L1の免疫染色結果が抗PD-1 / PD-L1抗体単剤療法の効果予測に有効と目されている
・免疫チェックポイント阻害薬とチロシンキナーゼ阻害薬の併用は野心的な治療であり、有効性を示唆する基礎データは乏しい
・EGFR遺伝子変異陽性の早期非小細胞肺癌では、PD-L1発現は増強しているようである
・しかしながら、進行したEGFR遺伝子変異陽性非小細胞肺癌では、抗PD-1 / PD-L1抗体療法の効果はむしろ低い
・にも拘らず、免疫療法とチロシンキナーゼ阻害薬併用療法の臨床試験は多数進行中である
-EGFR遺伝子変異陽性非小細胞肺癌に対するDurvalumab+Gefitinib併用療法
-EGFR遺伝子変異陽性非小細胞肺癌に対するDurvalumab+Osimertinib併用療法
-EGFR遺伝子変異陽性非小細胞肺癌で、Erlotinib治療後に病勢進行に至った際のNivolumab+Erlotinib併用療法
-ALK再構成陽性非小細胞肺癌で、Crizotinib治療後に病勢進行に至った際のNivolumab+Ceritinib併用療法
-EGFR遺伝子変異陽性非小細胞肺癌に対するAtezorizumab+Erlotinib併用療法
-ALK再構成陽性非小細胞肺癌で、Crizotinib治療後に病勢進行に至った際のAtezorizumab+Alectinib併用療法
-EGFR遺伝子変異陽性非小細胞肺癌で、Erlotinib治療後に病勢進行に至った際のPembrolizumab+Rociletinib併用療法
-EGFR遺伝子変異陽性非小細胞肺癌で、Pembrolizumab治療後に病勢進行に至った際のPembrolizumab+Afatinib併用療法
-ALK再構成陽性非小細胞肺癌に対するPembrolizumab+Crizotinib併用療法
-KRAS変異陽性非小細胞肺癌に対するPembrolizumab+Dabrafenib / Trametinib併用療法
・今回の結果を受けて、Durvalumab 10mg/kgの隔週投与とGefitinib 250mg/日の連日投与を併用する設定で更なる開発を進めることになった
・治療開始前後の生検組織や血液検体を用いたバイオマーカーの探索が進行中で、EGFR阻害薬と免疫療法併用時の効果発現メカニズムが今後明らかになっていく予定である
reference
57O. Efficacy, safety and tolerability of MEDI4736 (durvalumab [D]), a human IgG1 anti-programmed cell death-ligand-1 (PD-L1) antibody, combined with gefitinib (G): A phase I expansion in TKI-naïve patients (pts) with EGFR mutant NSCLC
2016年05月19日
OsimertinibとCeritinib、薬価収載完了
2016年5月18日にOsimertinibとCeritinibが薬価収載された模様です。
http://オンコロジー.com/news/160518k01
Osimertinibは1日あたり23932.6円→月間717978円、年間8735339円
Ceritinibは1日あたり31485円→月間944550円、年間11492025円
の薬代です。
http://オンコロジー.com/news/160518k01
Osimertinibは1日あたり23932.6円→月間717978円、年間8735339円
Ceritinibは1日あたり31485円→月間944550円、年間11492025円
の薬代です。
2016年05月18日
分子標的発現状態の時間的・空間的多様性(ELCC2016)
かなり専門的な話になりますが、"temporal heterogeneity"というのは特発性肺線維症における組織所見・HRCT所見を示す用語でした。
昨今はこの"heterogeneity"が肺がんの領域にも輸入され、原発巣と転移巣における腫瘍性状の多様性を表現する用語になっています。
今回の報告はその"tumor heterogeneity"を裏付ける報告で、再生検を行うにあたって知っておくべき内容です。
原発巣よりも、アプローチ可能な転移巣から再生検する方が、適切な治療戦略を立てる上では理にかなっているのかもしれません。
原発巣と転移巣では、分子標的プロファイルが異なる
Date: 15 Apr 2016
Topic: Pathology/Molecular biology / Lung and other thoracic tumours
・10764件の非小細胞肺癌組織バンクの検体を、採取部位別に分類(原発巣、リンパ節転移巣、遠隔転移巣)し、分子標的の発現状態について解析した
・免疫組織化学、in-situ-hybridisation(ISH)法、Sangerシーケンス法、次世代シーケンサーを用いた
・既にある治療薬の効果予測ができるバイオマーカーについて、原発巣、リンパ節転移巣、遠隔転移巣における発現状態を調査し、154人では同一の患者における各病巣の発現状態を比較した
・扁平上皮癌、腺癌に対して、さまざまなバイオマーカーの発現が検討された
・ALK再構成の発現割合は2.4%
・ROS1再構成の発現割合は1.0%
・HER2増幅の発現割合は2.9%
・cMET増幅の発現割合は4.0%
・EGFR過剰発現の割合は49.2%
・EGFR遺伝子増幅の割合は29.5%
・EGFR遺伝子変異の割合は12.3%
・PD-L1発現の割合は25%
・他に化学療法の効果予測因子としてBRCA1 、BRCA2、ERCC1、TUBB3、RRM1、TOPO1、TSについても検討された
・原発巣と転移巣の間に、バイオマーカー発現状態の相違が見てとれた
・腺癌患者におけるリンパ節転移巣と原発巣でのバイオマーカー発現頻度は、以下のように異なっていた
-ALK-IHC陽性率:8% vs 1%
-PD-L1陽性率:36% vs 25%
-ROS1再構成率:3% vs 1%
-EGFR-IHC陽性率:50% vs 39%
-EGFR-ISH陽性率:39% vs 28%
・cMET増幅の割合は、遠隔転移巣では7%で認めたのに対して、原発巣では3%だった
・扁平上皮癌では、ALK発現率はリンパ節転移巣で10%、原発巣では1%だった
・PD-L1発現率はリンパ節転移巣で42%、原発巣で33%だった
・治療戦略を立てるに当たり、腫瘍組織採取と分子プロファイリングを行うことが重要なのは言うまでもないが、病巣によって、採取時期によってバイオマーカーの発現状態が異なることも踏まえておかなければならない

昨今はこの"heterogeneity"が肺がんの領域にも輸入され、原発巣と転移巣における腫瘍性状の多様性を表現する用語になっています。
今回の報告はその"tumor heterogeneity"を裏付ける報告で、再生検を行うにあたって知っておくべき内容です。
原発巣よりも、アプローチ可能な転移巣から再生検する方が、適切な治療戦略を立てる上では理にかなっているのかもしれません。
原発巣と転移巣では、分子標的プロファイルが異なる
Date: 15 Apr 2016
Topic: Pathology/Molecular biology / Lung and other thoracic tumours
・10764件の非小細胞肺癌組織バンクの検体を、採取部位別に分類(原発巣、リンパ節転移巣、遠隔転移巣)し、分子標的の発現状態について解析した
・免疫組織化学、in-situ-hybridisation(ISH)法、Sangerシーケンス法、次世代シーケンサーを用いた
・既にある治療薬の効果予測ができるバイオマーカーについて、原発巣、リンパ節転移巣、遠隔転移巣における発現状態を調査し、154人では同一の患者における各病巣の発現状態を比較した
・扁平上皮癌、腺癌に対して、さまざまなバイオマーカーの発現が検討された
・ALK再構成の発現割合は2.4%
・ROS1再構成の発現割合は1.0%
・HER2増幅の発現割合は2.9%
・cMET増幅の発現割合は4.0%
・EGFR過剰発現の割合は49.2%
・EGFR遺伝子増幅の割合は29.5%
・EGFR遺伝子変異の割合は12.3%
・PD-L1発現の割合は25%
・他に化学療法の効果予測因子としてBRCA1 、BRCA2、ERCC1、TUBB3、RRM1、TOPO1、TSについても検討された
・原発巣と転移巣の間に、バイオマーカー発現状態の相違が見てとれた
・腺癌患者におけるリンパ節転移巣と原発巣でのバイオマーカー発現頻度は、以下のように異なっていた
-ALK-IHC陽性率:8% vs 1%
-PD-L1陽性率:36% vs 25%
-ROS1再構成率:3% vs 1%
-EGFR-IHC陽性率:50% vs 39%
-EGFR-ISH陽性率:39% vs 28%
・cMET増幅の割合は、遠隔転移巣では7%で認めたのに対して、原発巣では3%だった
・扁平上皮癌では、ALK発現率はリンパ節転移巣で10%、原発巣では1%だった
・PD-L1発現率はリンパ節転移巣で42%、原発巣で33%だった
・治療戦略を立てるに当たり、腫瘍組織採取と分子プロファイリングを行うことが重要なのは言うまでもないが、病巣によって、採取時期によってバイオマーカーの発現状態が異なることも踏まえておかなければならない

2016年05月18日
一次治療、二次治療でのOsimertinib(ELCC2016)
ELCC2016で、Osimertinibの一次治療、二次治療におけるupdate dataが報告されていました。
ただし、それぞれ第I相試験、第II相試験の結果に過ぎないですし、一次治療の報告に至っては無増悪生存期間中央値の報告結果が追跡期間中央値よりも短いので、本来はまだ発表されてはならないデータだと思います。
しかしながら、「無増悪生存期間が16.6ヶ月よりも長くなりそう」というメッセージ自体が大きな意味を持っています。
Ramalingam教授が述べているように、従来のEGFR阻害薬の治療効果を遥かに凌駕しそうなのは間違いありません。
いまのところOsimertinibを初回治療から使用できるようになる目処は立っていませんが、FLAURA試験の結果が明らかになれば、おのずと適用条件が見直されることになるでしょう。
一方、二次治療における効果はもはや折り紙つきといっていいでしょう。
もはや、化学療法との比較試験を行うこと自体が倫理的に許されるのかどうか、という段階にあるような気がします。
Date: 14 Apr 2016
Topic: Lung and other thoracic tumours / Anticancer agents & Biologic therapy
・EGFR阻害薬はEGFR遺伝子変異を有する非小細胞肺癌の標準治療である
・EGFR阻害薬を使用しても、50-60%程度はT790M耐性変異により治療耐性になる
・OsimertinibはExon 19 / 21遺伝子変異およびT790M耐性変異に対する阻害薬である
・EGFR遺伝子変異を有する局所進行もしくは進行非小細胞肺癌患者を対象としたAURA試験の第I相試験、expansion cohortから、一次治療としてOsimertinibを投与された60人の患者について解析した
・30人は80mg/日、30人は160mg/日を内服した
・追跡期間の中央値は16.6ヶ月だった
・奏効割合は77%
・無増悪生存期間中央値は160mg/日内服群で19.3ヶ月、80mg/日内服群では中央値未到達(解析時点で、半数以上の患者が再発なく生存中)だった。
・有害事象はわずかで、80mg/日内服群ではちょうど10%の患者が毒性のために減量が必要になった程度だった
・発表者であるSuresh Ramalingam教授は、「奏効割合はこれまでのどのEGFR阻害薬よりも優れている。また、PFSもこれまでのEGFR阻害薬が10-13ヶ月程度だったのに比べれば、雲泥の差がある」と述べている
・500人以上の患者を対象に、初回治療としてのOsimertinibとErlotinib / Gefitinibを比較する第III相FLAURA試験の結果は、1年半以内には明らかになると目されている
・EGFR阻害薬治療歴がある、EGFR遺伝子変異陽性、T790M耐性変異陽性の非小細胞肺癌患者を対象としたAURA試験からの解析データが報告された
・奏効割合は第I相試験の用量設定部分からの63人では71%、2つの第II相試験からの411人では66%だった
・無増悪生存期間中央値は第I相試験では9.7ヶ月、第II相試験では11ヶ月だった
・間質性肺炎やQT延長の頻度はそれほど高くなかった
References
1. LBA1_PR: Osimertinib as first-line treatment for EGFR mutation-positive advanced NSCLC: updated efficacy and safety results from two Phase I expansion cohorts. S. Ramalingam, US. Thursday 14th April 2016 – 15:30-15:45 New strategies for EGFR addicted NSCLC Room B
LBA2_PR: Osimertinib (AZD9291) in pre-treated pts with T790M-positive advanced NSCLC: updated Phase 1 (P1) and pooled Phase 2 (P2) results. J. Yang, Taiwan. Thursday 14th April 2016 – 15:45-16:00 New strategies for EGFR addicted NSCLC Room B
ただし、それぞれ第I相試験、第II相試験の結果に過ぎないですし、一次治療の報告に至っては無増悪生存期間中央値の報告結果が追跡期間中央値よりも短いので、本来はまだ発表されてはならないデータだと思います。
しかしながら、「無増悪生存期間が16.6ヶ月よりも長くなりそう」というメッセージ自体が大きな意味を持っています。
Ramalingam教授が述べているように、従来のEGFR阻害薬の治療効果を遥かに凌駕しそうなのは間違いありません。
いまのところOsimertinibを初回治療から使用できるようになる目処は立っていませんが、FLAURA試験の結果が明らかになれば、おのずと適用条件が見直されることになるでしょう。
一方、二次治療における効果はもはや折り紙つきといっていいでしょう。
もはや、化学療法との比較試験を行うこと自体が倫理的に許されるのかどうか、という段階にあるような気がします。
Date: 14 Apr 2016
Topic: Lung and other thoracic tumours / Anticancer agents & Biologic therapy
・EGFR阻害薬はEGFR遺伝子変異を有する非小細胞肺癌の標準治療である
・EGFR阻害薬を使用しても、50-60%程度はT790M耐性変異により治療耐性になる
・OsimertinibはExon 19 / 21遺伝子変異およびT790M耐性変異に対する阻害薬である
・EGFR遺伝子変異を有する局所進行もしくは進行非小細胞肺癌患者を対象としたAURA試験の第I相試験、expansion cohortから、一次治療としてOsimertinibを投与された60人の患者について解析した
・30人は80mg/日、30人は160mg/日を内服した
・追跡期間の中央値は16.6ヶ月だった
・奏効割合は77%
・無増悪生存期間中央値は160mg/日内服群で19.3ヶ月、80mg/日内服群では中央値未到達(解析時点で、半数以上の患者が再発なく生存中)だった。
・有害事象はわずかで、80mg/日内服群ではちょうど10%の患者が毒性のために減量が必要になった程度だった
・発表者であるSuresh Ramalingam教授は、「奏効割合はこれまでのどのEGFR阻害薬よりも優れている。また、PFSもこれまでのEGFR阻害薬が10-13ヶ月程度だったのに比べれば、雲泥の差がある」と述べている
・500人以上の患者を対象に、初回治療としてのOsimertinibとErlotinib / Gefitinibを比較する第III相FLAURA試験の結果は、1年半以内には明らかになると目されている
・EGFR阻害薬治療歴がある、EGFR遺伝子変異陽性、T790M耐性変異陽性の非小細胞肺癌患者を対象としたAURA試験からの解析データが報告された
・奏効割合は第I相試験の用量設定部分からの63人では71%、2つの第II相試験からの411人では66%だった
・無増悪生存期間中央値は第I相試験では9.7ヶ月、第II相試験では11ヶ月だった
・間質性肺炎やQT延長の頻度はそれほど高くなかった
References
1. LBA1_PR: Osimertinib as first-line treatment for EGFR mutation-positive advanced NSCLC: updated efficacy and safety results from two Phase I expansion cohorts. S. Ramalingam, US. Thursday 14th April 2016 – 15:30-15:45 New strategies for EGFR addicted NSCLC Room B
LBA2_PR: Osimertinib (AZD9291) in pre-treated pts with T790M-positive advanced NSCLC: updated Phase 1 (P1) and pooled Phase 2 (P2) results. J. Yang, Taiwan. Thursday 14th April 2016 – 15:45-16:00 New strategies for EGFR addicted NSCLC Room B
2016年05月17日
ニボルマブと経済
よく取りざたされる免疫チェックポイント阻害薬と医療費の問題ですが、「週間医学界新聞」の第3165号(2016年3月7日)に対談が掲載されています。
免疫チェックポイント阻害薬の臨床的特徴と問題点、さらには医療費との関連を考える上で何が問題なのか、よくまとめられています。
現在肺癌に対してニボルマブを使っている患者さんと医療従事者はもちろんのこと、医療経済や我が国の財政に興味がある人には一読を勧めます。
http://www.igaku-shoin.co.jp/paperDetail.do?id=PA03165_01
要点をまとめると、以下の通りです。
・免疫チェックポイント阻害薬の嚆矢であるニボルマブが、悪性黒色腫に続いて非小細胞肺癌に対しても使えるようになった
・肺癌を半分よりも小さくする確率は20%程度
・小さくしないまでも、大きくならないようにして患者さんを長生きさせる割合はまだ高いかも知れないが、いまのところはっきりしない
・多彩な副作用が出る可能性があるが、全体としての副作用の割合はそれほど高くない
・一度効いたら効果が長く続く患者がいる
・ニボルマブを1年間使用し続けると、ニボルマブ代だけで3500万円かかる
・医療費の年間自己負担額は最高でも200万円程度で、残る3300万円は国家財政で賄うことになる
・効果予測因子がわかっていないため、使用可能な全ての患者に使わざるを得ない(あなたには効果が期待できませんから使えません、とは現時点では言えない)
・多く見積もっても、ニボルマブによる恩恵を受ける患者は4人に1人
・残る3人に使った3500万円×3=1億500万円は完全に無駄なコストで、有効例1人のために年間1億4000万円を費やすことになる
・現時点では、効いている間はずっと続けなければならない
・現時点では、どの段階で無効として治療を中止していいのかもわからない
・肺癌患者の年間発生数を10万人、手術される患者などを除いてニボルマブの投与対象となる患者数を5万人と見積もる
・5万人全員にニボルマブを使うと1兆7500億円となる
・日本の医療費は現在年間40兆円、薬剤費は10兆円、そこにニボルマブの1兆7500億円が上乗せされる
・単一疾患に対する延命治療のための単一治療の薬代が、国民医療費の5%、国民薬剤費の20%を占めることになる
・我が国の医療者には、コストに対する問題意識はあるものの、それをどうにかしようという行動を起こす人はほぼいない。
・むしろ、「医は仁術であり、コストのことなど語るのは間違っている」という風潮がある
・その結果、コストを度外視した臨床試験が溢れ、費用対効果を検証する仕組みもできていない
・当面ニボルマブの薬価は下がらないだろう
・現在、ニボルマブの効果を見込めない患者を抽出するための臨床試験を計画中だが、難航するだろう
・「ふつうは使えない薬ですが、こういった因子があるからあなたには効果が見込めますよ」だったら誰もが参加するが、「みなさんが普通に使える薬ですが、こういった因子があるからあなたにはこの治療はできませんよ」という臨床試験に誰が参加したがるだろうか
・「一定の年齢を迎えたら対症療法しかしない」のか、「社会全体として経済的に崩壊する」のか、選択しなければならない
これに対して、「国際医薬品情報」誌の2016年4月25日号で、他の先生が反論しています。
要点は以下の通りです。
・オプジーボの費用は1兆7500億円までにはならない
・1500億円を超えるような売り上げの医薬品は最大50%薬価が引き下げられるので、費用は半分の8750億円程度になるのではないか
・ニボルマブの2019年の日本売上高はトムソン・ロイター社が805億円、ブルームバーグ社が1345億円と見積もっている
・ニボルマブが日本経済に与える波及効果も考えておく必要がある
・ニボルマブの2020年の年間世界売上高はトムソン・ロイター社が6兆8200億円、ブルームバーグ社が11兆4000億円と見積もっている
・小野薬品工業は日本・韓国・台湾でしかニボルマブを販売できないが、その他の世界で販売しているブリストル・マイヤーズ・スクイブ社から米国での売り上げの4%、欧州での売り上げの15%をロイヤルティーとして受け取ることになっており、この恩恵は大きい
・・・ということなのですが、どちらかというと前半の話の方が受け入れられる内容のように思います。
「医師は、患者がいて、使える薬があるのなら、その患者が薬代を払えなかったとしても治療せざるを得ない」
「薬代は社会全体で負担しなければならない」
という状況で、さらに我々は、
「既に我が国では、国民一人当たり800万円、国として1000兆円の借金を背負っている」
「この状況で、国は消費税増税を更に先送りしようとしている」
「仮に我が国の経済が好転しても、その反作用を世界のどこかが引き受けることになる」
ということも理解しておかなければなりません。
もはや、経済と医療は決して切り離せない関係になっています。
以前も引用しましたが、以下のリンクに我々日本国民の借金が垣間見えます。
http://www.kh-web.org/fin/
・・・タバコはやめてください。
タバコを吸い続けるのなら、少なくとも心疾患、脳血管疾患、頭頸部・呼吸器・泌尿器関連の悪性腫瘍に関しては自分の資産で賄える範囲の治療だけをして、後の治療は放棄してください。
免疫チェックポイント阻害薬の臨床的特徴と問題点、さらには医療費との関連を考える上で何が問題なのか、よくまとめられています。
現在肺癌に対してニボルマブを使っている患者さんと医療従事者はもちろんのこと、医療経済や我が国の財政に興味がある人には一読を勧めます。
http://www.igaku-shoin.co.jp/paperDetail.do?id=PA03165_01
要点をまとめると、以下の通りです。
・免疫チェックポイント阻害薬の嚆矢であるニボルマブが、悪性黒色腫に続いて非小細胞肺癌に対しても使えるようになった
・肺癌を半分よりも小さくする確率は20%程度
・小さくしないまでも、大きくならないようにして患者さんを長生きさせる割合はまだ高いかも知れないが、いまのところはっきりしない
・多彩な副作用が出る可能性があるが、全体としての副作用の割合はそれほど高くない
・一度効いたら効果が長く続く患者がいる
・ニボルマブを1年間使用し続けると、ニボルマブ代だけで3500万円かかる
・医療費の年間自己負担額は最高でも200万円程度で、残る3300万円は国家財政で賄うことになる
・効果予測因子がわかっていないため、使用可能な全ての患者に使わざるを得ない(あなたには効果が期待できませんから使えません、とは現時点では言えない)
・多く見積もっても、ニボルマブによる恩恵を受ける患者は4人に1人
・残る3人に使った3500万円×3=1億500万円は完全に無駄なコストで、有効例1人のために年間1億4000万円を費やすことになる
・現時点では、効いている間はずっと続けなければならない
・現時点では、どの段階で無効として治療を中止していいのかもわからない
・肺癌患者の年間発生数を10万人、手術される患者などを除いてニボルマブの投与対象となる患者数を5万人と見積もる
・5万人全員にニボルマブを使うと1兆7500億円となる
・日本の医療費は現在年間40兆円、薬剤費は10兆円、そこにニボルマブの1兆7500億円が上乗せされる
・単一疾患に対する延命治療のための単一治療の薬代が、国民医療費の5%、国民薬剤費の20%を占めることになる
・我が国の医療者には、コストに対する問題意識はあるものの、それをどうにかしようという行動を起こす人はほぼいない。
・むしろ、「医は仁術であり、コストのことなど語るのは間違っている」という風潮がある
・その結果、コストを度外視した臨床試験が溢れ、費用対効果を検証する仕組みもできていない
・当面ニボルマブの薬価は下がらないだろう
・現在、ニボルマブの効果を見込めない患者を抽出するための臨床試験を計画中だが、難航するだろう
・「ふつうは使えない薬ですが、こういった因子があるからあなたには効果が見込めますよ」だったら誰もが参加するが、「みなさんが普通に使える薬ですが、こういった因子があるからあなたにはこの治療はできませんよ」という臨床試験に誰が参加したがるだろうか
・「一定の年齢を迎えたら対症療法しかしない」のか、「社会全体として経済的に崩壊する」のか、選択しなければならない
これに対して、「国際医薬品情報」誌の2016年4月25日号で、他の先生が反論しています。
要点は以下の通りです。
・オプジーボの費用は1兆7500億円までにはならない
・1500億円を超えるような売り上げの医薬品は最大50%薬価が引き下げられるので、費用は半分の8750億円程度になるのではないか
・ニボルマブの2019年の日本売上高はトムソン・ロイター社が805億円、ブルームバーグ社が1345億円と見積もっている
・ニボルマブが日本経済に与える波及効果も考えておく必要がある
・ニボルマブの2020年の年間世界売上高はトムソン・ロイター社が6兆8200億円、ブルームバーグ社が11兆4000億円と見積もっている
・小野薬品工業は日本・韓国・台湾でしかニボルマブを販売できないが、その他の世界で販売しているブリストル・マイヤーズ・スクイブ社から米国での売り上げの4%、欧州での売り上げの15%をロイヤルティーとして受け取ることになっており、この恩恵は大きい
・・・ということなのですが、どちらかというと前半の話の方が受け入れられる内容のように思います。
「医師は、患者がいて、使える薬があるのなら、その患者が薬代を払えなかったとしても治療せざるを得ない」
「薬代は社会全体で負担しなければならない」
という状況で、さらに我々は、
「既に我が国では、国民一人当たり800万円、国として1000兆円の借金を背負っている」
「この状況で、国は消費税増税を更に先送りしようとしている」
「仮に我が国の経済が好転しても、その反作用を世界のどこかが引き受けることになる」
ということも理解しておかなければなりません。
もはや、経済と医療は決して切り離せない関係になっています。
以前も引用しましたが、以下のリンクに我々日本国民の借金が垣間見えます。
http://www.kh-web.org/fin/
・・・タバコはやめてください。
タバコを吸い続けるのなら、少なくとも心疾患、脳血管疾患、頭頸部・呼吸器・泌尿器関連の悪性腫瘍に関しては自分の資産で賄える範囲の治療だけをして、後の治療は放棄してください。
2016年05月13日
rociletinibの治療開発中止・・・
Osimertinibと同時にNew England Journal of Medicine誌を飾ったもうひとつの第3世代EGFR阻害薬、Rociletinibが、ひっそりと退場することになりました。
薬効もさることながら、2nd biopsyとliquid biopsyの在り方について非常に示唆に富む結果を提供してくれたcompoundなのですが、risk and benefitの点から、Osimertinibと並び立つほどのものではないとFDAも、さらには開発したClovis社自身も判断を下したようです。
FDAはともかくとして、Clovis社にとっては、痛恨の出来事でしょう。
BRCA陽性進行卵巣癌に対するPARP1 inhibitor, rucaparibの開発が順調に進めばいいのですが、こちらまでコケてしまったら、会社としては非常に大きなダメージを負うことになるでしょうね。
ちょっと長いですが、興味のある方は下記の顛末をご覧になってみてください。
効果・安全性の面で、OsimertinibとRociletinibを比較するのに、ちょうどよい内容だと思います。
<FDA諮問委員会、肺がん治療薬の迅速承認を勧告せず(2016/5/11、ケアネットの記事より引用)>
元の記事は、
FDA Panel Denies Accelerated Approval of Lung Cancer Drug
Nick Mulcahy / Medscape 2016/04/12
肺がん患者のあるサブセットに対する実験的治療の経口薬、rociletinib(商品名:Xegafi、Clovis Oncology)が、FDA(米国食品医薬品局)の迅速承認を勧告されなかった。FDAの抗がん剤諮問委員会(ODAC)は代わりに、規制当局の決定前に提出されることになっている進行中の第III相無作為化試験の結果を待つことを12対1の投票により採択した。
rociletinibは、上皮成長因子受容体(EGFR)T790M変異のある非小細胞肺がん(NSCLC)患者への使用を目的とした第3世代チロシンキナーゼ阻害薬(TKI)である。委員会は、EGFR標的療法が行われた転移性EGFR変異陽性NSCLC患者に対するrociletinibの早期試験のデータを精査した。
データは2つの単群試験から成り、rociletinibは全奏効率(ORR)30%、奏効期間中央値8.9ヵ月を示した。
多数のODAC委員が、この結果が競合薬剤のosimertinib(商品名:Tagrisso、AstraZeneca)に比べ見劣りすることを示唆した。Medscape Medical Newsが報じたように、osimertinibは2015年11月、同じ患者集団に対する治療薬としてFDAに迅速承認された。osimertinibはORR 59%、奏効期間中央値12ヵ月を示し、この患者サブセットに対する最初の承認薬となった。
rociletinibのヒアリングの際、osimertinib は“触れたくない話題”であった、とODAC委員であるメイヨークリニック(ミネソタ州ロチェスター)のGrzegorz S. Nowakowski氏は語った。osimertinibはrociletinibに比べ、少ない毒性で高い有効性を示した。
同じくODAC委員である、米国国立がん研究所(メリーランド州ベセスダ)のArun Rajan氏は、「ほかの治療選択肢がなければ、違うほうに投票していたであろう」と述べた。
rociletinibが、TKIの1次治療で進行した転移性EGFR変異陽性NSCLC患者に使用可能なほかの治療より優れているか否かについても懸念がある。ほかの治療にはnivolumab、pemetrexed、docetaxelの単剤またはramucirumabとの併用などがあり、いずれも全生存期間(OS)の改善を示している。しかしながら、こうした薬剤のEGFR T790M変異陽性NSCLCのサブグループに対する効果は検討されていない。
迅速承認の資格を得るには、その薬剤が既存の治療薬よりも優れていることを示さなければならない、とFDAのmedical officerであるLola Fashoyin-Aje氏は指摘する。しかし、rociletinibに関するさらなるデータを待つという投票結果は、本薬剤の毒性と有効性、現在提出されているデータの質に対する委員会の懸念の表れでもある。
rociletinibのORRデータには効果が確定していない患者も含まれていた、とFashoyin-Aje氏は述べ、ORRデータは効果が確定した患者のみをベースにすべきであると指摘した。
Clovis社が提案する推奨用量(625mgを1日2回)に、臨床的および臨床薬学的データによる説得力のある裏付けがあるかという点にも疑問がある。委員会メンバーは、リスク(とくにQTc延長に関して)が許容できるものかについても懸念を抱いていた。
ODAC委員は最終的に、EGFR-TKIおよびプラチナ2剤併用化学療法で進行したEGFR変異陽性NSCLCに対してrociletinibと単独の化学療法(pemetrexed、docetaxel、gemcitabine)とを比較した、多国間無作為化オープンラベル試験TIGER-3のrociletinibのデータを待つことを選んだ。
以上の内容からは、既にOsimertinibが迅速承認された現状では、同系統の薬剤でless effective, more toxicなRociletinibまで迅速承認する必要はない、第III相試験の結果を見定めてからでも遅くはない、との思惑が見えます。
開発を断念しなければならないほどの状態ではないですが、仮に承認までこぎつけたとしても上記の内容から、「二番手」「使いにくい」「OsimertinibよりもRociletinibを選ぶ理由が乏しい」という受け止め方をされてしまうでしょう。
そこに持ってきてこの記事。
Clovis Oncology、苦渋の決断です。
http://global.onclive.com/web-exclusives/clovis-ends-development-of-rociletinib-in-lung-cancer
<Clovis社はRociletinibの臨床開発を中止する決断を下した>
Jason M. Broderick @jasoncology Published Online: Friday, May 6, 2016
Clovis社は、T790M耐性変異陽性の非小細胞肺癌に対する治療薬として有望と目されていたEGFR阻害薬、Rociletinibの臨床開発を中止した。Clovis社の声明によると、現在参照可能なデータからは、新規医薬品としての承認は出来ないと示唆するような通達をFDAから受け取ったとのことである。Clovis社は第III相試験であるTIGER-3試験を含む現在進行中のRociletinib関連の臨床試験への患者登録を全て中止し、EUにおけるRociletinibの通常承認手続きも見送ることにした。担当医から治療継続を勧められた現在治療中の患者に対しては、Clovis社より引き続きRociletinibが提供される。
既報のRociletinib関連臨床試験のupdated dataが当初報告されたよりも低い奏効割合を示したこと、FDAの諮問機関であるODACにおいて委員がRociletinibの承認について否定的な見解を示したこと、Rociletinibと競合する主要な医薬品であるOsimertinibがFDAによって承認されたこと、といった経緯を経て、Rociletinib開発はこの最終的な局面に至った。
「治療困難なこのT790M二次耐性化非小細胞肺癌において、Rociletinibは治療選択肢の一つとして有望なのだが、ことここに至り慙愧に堪えない」というのは、Clovis社のCEOであるPatrick J.Mahaffyのコメントである。ODACはCO-1686-008(TIGER-X)試験およびCO-1686-019(TIGER-2)試験におけるRociletinibの効果・安全性に関する初期の報告が、Rociletinibの迅速承認を勧告するデータとして適切かどうかを検討していたが、2016年4月の多数決では12対1で迅速承認を認めないとの結論になった。 ODACはまた、FDAがRociletinibを承認するかどうか判断するにあたっては、(今回Clovis社が中止することを決定した)第III相臨床試験であるCO-1686-020(TIGER-3)試験の結果のを確認することが必須であるとも勧告した。オープンラベル、多施設共同で行われたTIGER-3試験は、EGFR-TKIおよびプラチナ併用化学療法双方を受けた後に病勢進行に至ったEGFR遺伝子変異陽性進行非小細胞肺癌患者を対象に、Rociletinib単剤療法と単剤化学療法(pemetrexed, docetaxel, gemcitabineのうちどれか)を比較する臨床試験だった。TIGER-XおよびTIGER-2試験の統合解析では、T790M遺伝子変異陽性で、少なくとも1種のEGFR-TKI治療後に病勢進行に至った進行非小細胞肺癌患者325人に対するRociletinib(用量は500mg-750mg, 1日2回)の奏効割合は30.2%(95%信頼区間は25.2-35.5%)だった。625mg/回を服用していた患者群(n=170)では奏効割合32%(95%信頼区間は25-40%)、奏効持続期間中央値は8.8ヶ月、500mg/回を服用していた患者群(n=79)では奏効割合23%(95%信頼区間は14-34%)、奏効持続期間中央値は9.1ヶ月だった。安全性の面では、ODACはTIGER-XとTIGER-2試験に参加し、500mg/回、625mg/回、750mg/回、1000mg/回それぞれを1日2回服用した患者を評価対象とした。30%以上と頻度の高かった全Gradeの有害事象は、下痢、高血糖、疲労、嘔気、食欲不振、QT延長、嘔吐だった。 10%以上と頻度の高かったGrade 3/4の有害事象は、高血糖とQT延長だった。Rociletinib減量は全患者の51%に対して成され、原因としては高血糖(22%)、QT延長(11%)が多かった。57%の患者は内服中断を経験し、その原因としては高血糖(22%)、QT延長(10%)、嘔気(10%)が多かった。Rociletinib治療中止に至ったのは全体の11%で、頻度が高かったのはQT延長(2%)、肺炎/肺臓炎(2%)だった。全体の47%の患者が重篤な有害事象を経験したが、その内訳は悪性腫瘍の進行(16%)、高血糖(8%)、肺炎(4%)だった。少なくとも1度は500msecを超えるQT延長を経験した患者は、全体の17%に上った。ODACの文書によると、Torsades de ointesを経験した患者を1人、突然死に至った患者を2人(発症日は内服開始から4日目、13日目)含んでいた。
FDAによる優先審査対象となったRociletinib臨床開発初期のrolling登録は2015年7月に完了した。しかし、登録終了から90日目に予定されていた会議において、TIGER-XおよびTIGER-2試験における奏効割合のupdated dataが報告され、それを受けたFDAはODACのヒアリングまでに追加のデータを提出するように要求した。当初FDAに提出されたデータによると、T790M陽性(n=243)の患者においては、53%の奏効割合、85%の病勢コントロール割合を認めた。TIGER-X試験は、500-1000mg/回の用量範囲内でrociletinibを投与された456人のEGFR遺伝子変異陽性非小細胞肺癌患者を評価対象とした。参加した患者の年齢中央値は63歳、10%は糖尿病の既往があり、41%は中枢神経系への転移を有していた。前治療レジメン数の中央値は2であり、約半数(44%)の患者に少なくとも1種のEGFR-TKI使用歴があった。2015年4月27日のdata cut offの段階では、測定可能病変を有するT790M陽性患者で、500-625mg/回のrociletinibを服用したもの(n=270)の無増悪生存期間中央値は8.0ヶ月だった。治療開始前に中枢神経系転移を有していた患者では、無増悪生存期間中央値は10.3ヶ月だった。Clovis社は、その後の無増悪生存期間のupdated dataを公表しなかった。安全性においては、500mg/回投与群における高頻度の有害事象として高血糖(35%)、下痢(33%)、疲労(29%)、食欲不振(15%)、筋けいれん(14%)、体重減少(10%)、嘔吐(8%)が挙がった。Grade 3のQT延長は2.5%に認められた。500mg/回投与群では、間質性肺炎発症例はなかった。治療中止に至った有害事象は500mg/回投与群の2.5%に認められた。Grade 3/4の高血糖は50mg/回投与群の17%に認められた。高血糖を補正するために、血糖値モニタリングと治療アルゴリズム導入が行われ、必要に応じて経口血糖降下薬が使用された。2014年9月にこれらの措置が取られるまでには、Grade 3/4の高血糖は22%に認められた。血糖モニタリングと治療アルゴリズムを導入した後は、Grade 3/4の高血糖は8%まで低下した。単アーム第II相試験であるTIGER-2試験はEGFR T790M変異陽性患者における二次治療としてのrociletinibの有効性と安全性を検証するものだった。
薬効もさることながら、2nd biopsyとliquid biopsyの在り方について非常に示唆に富む結果を提供してくれたcompoundなのですが、risk and benefitの点から、Osimertinibと並び立つほどのものではないとFDAも、さらには開発したClovis社自身も判断を下したようです。
FDAはともかくとして、Clovis社にとっては、痛恨の出来事でしょう。
BRCA陽性進行卵巣癌に対するPARP1 inhibitor, rucaparibの開発が順調に進めばいいのですが、こちらまでコケてしまったら、会社としては非常に大きなダメージを負うことになるでしょうね。
ちょっと長いですが、興味のある方は下記の顛末をご覧になってみてください。
効果・安全性の面で、OsimertinibとRociletinibを比較するのに、ちょうどよい内容だと思います。
<FDA諮問委員会、肺がん治療薬の迅速承認を勧告せず(2016/5/11、ケアネットの記事より引用)>
元の記事は、
FDA Panel Denies Accelerated Approval of Lung Cancer Drug
Nick Mulcahy / Medscape 2016/04/12
肺がん患者のあるサブセットに対する実験的治療の経口薬、rociletinib(商品名:Xegafi、Clovis Oncology)が、FDA(米国食品医薬品局)の迅速承認を勧告されなかった。FDAの抗がん剤諮問委員会(ODAC)は代わりに、規制当局の決定前に提出されることになっている進行中の第III相無作為化試験の結果を待つことを12対1の投票により採択した。
rociletinibは、上皮成長因子受容体(EGFR)T790M変異のある非小細胞肺がん(NSCLC)患者への使用を目的とした第3世代チロシンキナーゼ阻害薬(TKI)である。委員会は、EGFR標的療法が行われた転移性EGFR変異陽性NSCLC患者に対するrociletinibの早期試験のデータを精査した。
データは2つの単群試験から成り、rociletinibは全奏効率(ORR)30%、奏効期間中央値8.9ヵ月を示した。
多数のODAC委員が、この結果が競合薬剤のosimertinib(商品名:Tagrisso、AstraZeneca)に比べ見劣りすることを示唆した。Medscape Medical Newsが報じたように、osimertinibは2015年11月、同じ患者集団に対する治療薬としてFDAに迅速承認された。osimertinibはORR 59%、奏効期間中央値12ヵ月を示し、この患者サブセットに対する最初の承認薬となった。
rociletinibのヒアリングの際、osimertinib は“触れたくない話題”であった、とODAC委員であるメイヨークリニック(ミネソタ州ロチェスター)のGrzegorz S. Nowakowski氏は語った。osimertinibはrociletinibに比べ、少ない毒性で高い有効性を示した。
同じくODAC委員である、米国国立がん研究所(メリーランド州ベセスダ)のArun Rajan氏は、「ほかの治療選択肢がなければ、違うほうに投票していたであろう」と述べた。
rociletinibが、TKIの1次治療で進行した転移性EGFR変異陽性NSCLC患者に使用可能なほかの治療より優れているか否かについても懸念がある。ほかの治療にはnivolumab、pemetrexed、docetaxelの単剤またはramucirumabとの併用などがあり、いずれも全生存期間(OS)の改善を示している。しかしながら、こうした薬剤のEGFR T790M変異陽性NSCLCのサブグループに対する効果は検討されていない。
迅速承認の資格を得るには、その薬剤が既存の治療薬よりも優れていることを示さなければならない、とFDAのmedical officerであるLola Fashoyin-Aje氏は指摘する。しかし、rociletinibに関するさらなるデータを待つという投票結果は、本薬剤の毒性と有効性、現在提出されているデータの質に対する委員会の懸念の表れでもある。
rociletinibのORRデータには効果が確定していない患者も含まれていた、とFashoyin-Aje氏は述べ、ORRデータは効果が確定した患者のみをベースにすべきであると指摘した。
Clovis社が提案する推奨用量(625mgを1日2回)に、臨床的および臨床薬学的データによる説得力のある裏付けがあるかという点にも疑問がある。委員会メンバーは、リスク(とくにQTc延長に関して)が許容できるものかについても懸念を抱いていた。
ODAC委員は最終的に、EGFR-TKIおよびプラチナ2剤併用化学療法で進行したEGFR変異陽性NSCLCに対してrociletinibと単独の化学療法(pemetrexed、docetaxel、gemcitabine)とを比較した、多国間無作為化オープンラベル試験TIGER-3のrociletinibのデータを待つことを選んだ。
以上の内容からは、既にOsimertinibが迅速承認された現状では、同系統の薬剤でless effective, more toxicなRociletinibまで迅速承認する必要はない、第III相試験の結果を見定めてからでも遅くはない、との思惑が見えます。
開発を断念しなければならないほどの状態ではないですが、仮に承認までこぎつけたとしても上記の内容から、「二番手」「使いにくい」「OsimertinibよりもRociletinibを選ぶ理由が乏しい」という受け止め方をされてしまうでしょう。
そこに持ってきてこの記事。
Clovis Oncology、苦渋の決断です。
http://global.onclive.com/web-exclusives/clovis-ends-development-of-rociletinib-in-lung-cancer
<Clovis社はRociletinibの臨床開発を中止する決断を下した>
Jason M. Broderick @jasoncology Published Online: Friday, May 6, 2016
Clovis社は、T790M耐性変異陽性の非小細胞肺癌に対する治療薬として有望と目されていたEGFR阻害薬、Rociletinibの臨床開発を中止した。Clovis社の声明によると、現在参照可能なデータからは、新規医薬品としての承認は出来ないと示唆するような通達をFDAから受け取ったとのことである。Clovis社は第III相試験であるTIGER-3試験を含む現在進行中のRociletinib関連の臨床試験への患者登録を全て中止し、EUにおけるRociletinibの通常承認手続きも見送ることにした。担当医から治療継続を勧められた現在治療中の患者に対しては、Clovis社より引き続きRociletinibが提供される。
既報のRociletinib関連臨床試験のupdated dataが当初報告されたよりも低い奏効割合を示したこと、FDAの諮問機関であるODACにおいて委員がRociletinibの承認について否定的な見解を示したこと、Rociletinibと競合する主要な医薬品であるOsimertinibがFDAによって承認されたこと、といった経緯を経て、Rociletinib開発はこの最終的な局面に至った。
「治療困難なこのT790M二次耐性化非小細胞肺癌において、Rociletinibは治療選択肢の一つとして有望なのだが、ことここに至り慙愧に堪えない」というのは、Clovis社のCEOであるPatrick J.Mahaffyのコメントである。ODACはCO-1686-008(TIGER-X)試験およびCO-1686-019(TIGER-2)試験におけるRociletinibの効果・安全性に関する初期の報告が、Rociletinibの迅速承認を勧告するデータとして適切かどうかを検討していたが、2016年4月の多数決では12対1で迅速承認を認めないとの結論になった。 ODACはまた、FDAがRociletinibを承認するかどうか判断するにあたっては、(今回Clovis社が中止することを決定した)第III相臨床試験であるCO-1686-020(TIGER-3)試験の結果のを確認することが必須であるとも勧告した。オープンラベル、多施設共同で行われたTIGER-3試験は、EGFR-TKIおよびプラチナ併用化学療法双方を受けた後に病勢進行に至ったEGFR遺伝子変異陽性進行非小細胞肺癌患者を対象に、Rociletinib単剤療法と単剤化学療法(pemetrexed, docetaxel, gemcitabineのうちどれか)を比較する臨床試験だった。TIGER-XおよびTIGER-2試験の統合解析では、T790M遺伝子変異陽性で、少なくとも1種のEGFR-TKI治療後に病勢進行に至った進行非小細胞肺癌患者325人に対するRociletinib(用量は500mg-750mg, 1日2回)の奏効割合は30.2%(95%信頼区間は25.2-35.5%)だった。625mg/回を服用していた患者群(n=170)では奏効割合32%(95%信頼区間は25-40%)、奏効持続期間中央値は8.8ヶ月、500mg/回を服用していた患者群(n=79)では奏効割合23%(95%信頼区間は14-34%)、奏効持続期間中央値は9.1ヶ月だった。安全性の面では、ODACはTIGER-XとTIGER-2試験に参加し、500mg/回、625mg/回、750mg/回、1000mg/回それぞれを1日2回服用した患者を評価対象とした。30%以上と頻度の高かった全Gradeの有害事象は、下痢、高血糖、疲労、嘔気、食欲不振、QT延長、嘔吐だった。 10%以上と頻度の高かったGrade 3/4の有害事象は、高血糖とQT延長だった。Rociletinib減量は全患者の51%に対して成され、原因としては高血糖(22%)、QT延長(11%)が多かった。57%の患者は内服中断を経験し、その原因としては高血糖(22%)、QT延長(10%)、嘔気(10%)が多かった。Rociletinib治療中止に至ったのは全体の11%で、頻度が高かったのはQT延長(2%)、肺炎/肺臓炎(2%)だった。全体の47%の患者が重篤な有害事象を経験したが、その内訳は悪性腫瘍の進行(16%)、高血糖(8%)、肺炎(4%)だった。少なくとも1度は500msecを超えるQT延長を経験した患者は、全体の17%に上った。ODACの文書によると、Torsades de ointesを経験した患者を1人、突然死に至った患者を2人(発症日は内服開始から4日目、13日目)含んでいた。
FDAによる優先審査対象となったRociletinib臨床開発初期のrolling登録は2015年7月に完了した。しかし、登録終了から90日目に予定されていた会議において、TIGER-XおよびTIGER-2試験における奏効割合のupdated dataが報告され、それを受けたFDAはODACのヒアリングまでに追加のデータを提出するように要求した。当初FDAに提出されたデータによると、T790M陽性(n=243)の患者においては、53%の奏効割合、85%の病勢コントロール割合を認めた。TIGER-X試験は、500-1000mg/回の用量範囲内でrociletinibを投与された456人のEGFR遺伝子変異陽性非小細胞肺癌患者を評価対象とした。参加した患者の年齢中央値は63歳、10%は糖尿病の既往があり、41%は中枢神経系への転移を有していた。前治療レジメン数の中央値は2であり、約半数(44%)の患者に少なくとも1種のEGFR-TKI使用歴があった。2015年4月27日のdata cut offの段階では、測定可能病変を有するT790M陽性患者で、500-625mg/回のrociletinibを服用したもの(n=270)の無増悪生存期間中央値は8.0ヶ月だった。治療開始前に中枢神経系転移を有していた患者では、無増悪生存期間中央値は10.3ヶ月だった。Clovis社は、その後の無増悪生存期間のupdated dataを公表しなかった。安全性においては、500mg/回投与群における高頻度の有害事象として高血糖(35%)、下痢(33%)、疲労(29%)、食欲不振(15%)、筋けいれん(14%)、体重減少(10%)、嘔吐(8%)が挙がった。Grade 3のQT延長は2.5%に認められた。500mg/回投与群では、間質性肺炎発症例はなかった。治療中止に至った有害事象は500mg/回投与群の2.5%に認められた。Grade 3/4の高血糖は50mg/回投与群の17%に認められた。高血糖を補正するために、血糖値モニタリングと治療アルゴリズム導入が行われ、必要に応じて経口血糖降下薬が使用された。2014年9月にこれらの措置が取られるまでには、Grade 3/4の高血糖は22%に認められた。血糖モニタリングと治療アルゴリズムを導入した後は、Grade 3/4の高血糖は8%まで低下した。単アーム第II相試験であるTIGER-2試験はEGFR T790M変異陽性患者における二次治療としてのrociletinibの有効性と安全性を検証するものだった。
2016年05月11日
欧州から見たエルロチニブ+ベバシツマブ併用療法
本ブログではときどき、EGFR遺伝子変異陽性患者さんに対するEGFR-TKI+抗VEGF抗体併用療法について触れてきました。
よく知られているのはエルロチニブ+ベバシツマブの併用効果を検証した国内第II相試験であるJO25567試験です。
論文化後に記載した過去のブログ記事のリンクを以下に記します。
http://oitahaiganpractice.junglekouen.com/e751839.html
このときは、
「第III相試験では検証されないようなので、実臨床で使うかどうかは各医師の判断に委ねられた」
と書きましたが、現在はNEJ026試験として第III相試験が進行中です。
ですから、少なくとも日本国内ではNEJ026試験の結果を待ってから実臨床で使うかどうかを判断するのが王道です。
エルロチニブとベバシツマブの製造元であるRocheが、以下に示すようなプレスリリースを行っています。
http://www.roche.com/media/store/releases/med-cor-2016-04-29b.htm
簡単に内容をまとめると、
「日本で行われたJO25567試験の結果、EGFR遺伝子変異陽性患者に対する初回治療としてエルロチニブ+ベバシツマブ併用療法は非常に有望なので、EU域内では治療選択肢のひとつとして承認されるのが望ましい、とCHMPが推奨している」
ということです。
CHMPは、日本でいえば厚生労働省、米国で言えば食品医薬品局(FDA)に相当する機関と思われ、事実上EU域内ではエルロチニブ+ベバシツマブ併用療法が実地臨床で用いられる道が開けたと考えていいでしょう。
プレスリリースの内容を拝見していてふと目についた一文は、
" The EU filing was based primarily on data from the pivotal phase II JO25567 study."
というくだりです。
一般に、我が国の臨床試験成果は欧米人からはすんなり受け入れられない傾向があります。
JO25567試験は日本人しか参加していない、それも第II相試験です。
この結果を以て欧米諸国の一般臨床が変わる、というのは、ちょっとあり得ないようなお話です。
第III相試験の結果を待つとか、欧米で追試して確認するとか、そういったプロセスを経るのが普通です。
そういった「常識」からすると、欧米人がこのJO25567試験を"pivotal"と表現するのは、極めて異例です。
JO25567試験は各治療群間でクロスオーバーをしない規定だったと聞いています(論文には記載されていませんが)。
そうすると、無増悪生存期間のみならず全生存期間においても優越性が証明されるのでは、と予想されますが、不思議なことにベバシツマブが関わる臨床試験では、無増悪生存期間が延長しても全生存期間が延長しないことが多いようです。
EUがこれから向かおうとしているように、慢性骨髄性白血病に対するイマチニブや、T790M陽性TKI既治療EGFR遺伝子変異陽性肺癌に対するOsimertinibよろしく、第II相試験の結果を以てエルロチニブ+ベバシツマブ併用療法を本格的に実臨床に導入するのか、あるいはJO25567試験のmature OS dataを待つのか、はたまたNEJ026試験結果を見定めてから判断するのか。
今回のプレスリリースは、我々の在り方に一石を投じる出来事のように思います。
よく知られているのはエルロチニブ+ベバシツマブの併用効果を検証した国内第II相試験であるJO25567試験です。
論文化後に記載した過去のブログ記事のリンクを以下に記します。
http://oitahaiganpractice.junglekouen.com/e751839.html
このときは、
「第III相試験では検証されないようなので、実臨床で使うかどうかは各医師の判断に委ねられた」
と書きましたが、現在はNEJ026試験として第III相試験が進行中です。
ですから、少なくとも日本国内ではNEJ026試験の結果を待ってから実臨床で使うかどうかを判断するのが王道です。
エルロチニブとベバシツマブの製造元であるRocheが、以下に示すようなプレスリリースを行っています。
http://www.roche.com/media/store/releases/med-cor-2016-04-29b.htm
簡単に内容をまとめると、
「日本で行われたJO25567試験の結果、EGFR遺伝子変異陽性患者に対する初回治療としてエルロチニブ+ベバシツマブ併用療法は非常に有望なので、EU域内では治療選択肢のひとつとして承認されるのが望ましい、とCHMPが推奨している」
ということです。
CHMPは、日本でいえば厚生労働省、米国で言えば食品医薬品局(FDA)に相当する機関と思われ、事実上EU域内ではエルロチニブ+ベバシツマブ併用療法が実地臨床で用いられる道が開けたと考えていいでしょう。
プレスリリースの内容を拝見していてふと目についた一文は、
" The EU filing was based primarily on data from the pivotal phase II JO25567 study."
というくだりです。
一般に、我が国の臨床試験成果は欧米人からはすんなり受け入れられない傾向があります。
JO25567試験は日本人しか参加していない、それも第II相試験です。
この結果を以て欧米諸国の一般臨床が変わる、というのは、ちょっとあり得ないようなお話です。
第III相試験の結果を待つとか、欧米で追試して確認するとか、そういったプロセスを経るのが普通です。
そういった「常識」からすると、欧米人がこのJO25567試験を"pivotal"と表現するのは、極めて異例です。
JO25567試験は各治療群間でクロスオーバーをしない規定だったと聞いています(論文には記載されていませんが)。
そうすると、無増悪生存期間のみならず全生存期間においても優越性が証明されるのでは、と予想されますが、不思議なことにベバシツマブが関わる臨床試験では、無増悪生存期間が延長しても全生存期間が延長しないことが多いようです。
EUがこれから向かおうとしているように、慢性骨髄性白血病に対するイマチニブや、T790M陽性TKI既治療EGFR遺伝子変異陽性肺癌に対するOsimertinibよろしく、第II相試験の結果を以てエルロチニブ+ベバシツマブ併用療法を本格的に実臨床に導入するのか、あるいはJO25567試験のmature OS dataを待つのか、はたまたNEJ026試験結果を見定めてから判断するのか。
今回のプレスリリースは、我々の在り方に一石を投じる出来事のように思います。




