2017年07月30日
ICIsと分子標的薬の口演発表まとめ
2017年7月29日 日本臨床腫瘍学会総会3日目(神戸市)
口演発表のまとめ
O3-1-2:
日本人の非小細胞肺癌患者に対するニボルマブの間質性肺疾患:死亡リスク因子の検討
・発表内容をはしょりすぎていて、結局結論がわからなかった
・今回の中間解析時点で、間質性肺疾患として160人が報告された
・感染症など病因が明らかなものや、病状が悪くてCTが撮影できなかったものなど、計20人を解析対象から除外した
・免疫チェックポイント阻害薬関連間質性肺炎の画像的特徴
1)腫瘍周囲への陰影出現(peritumoral infiltration)
2)既存の放射線性線維化肺や感染巣の悪化
3)肺癌病巣がある側の肺で陰影が優勢
・画像所見を以下のごとく分類
1)急性間質性肺炎様パターン
2)Faint infiltrationパターン
3)過敏性肺臓炎様パターン
4)器質化肺炎 / 好酸球性肺炎様パターン
5)非特異的間質性肺炎様パターン
・全体を典型例と非典型例に分類
・典型例は92人、そのうち23人(25%)は死亡
・非典型例は48人、そのうち5人(10%)は死亡
・予後不良とされる急性間質性肺炎様パターンは20人(全体の14.3%)で、そのうち14人(70%)は死亡した
・予後良好とされる器質化肺炎 / 好酸球性肺炎パターンは61人(全体の43.6%)で、そのうち6人(9.8%)は死亡した
・急性間質性肺炎様パターン以外の患者120人中14人(10.8%)が死亡した
→免疫チェックポイント阻害薬関連の間質性肺炎は、殺細胞性抗がん薬関連の間質性肺炎より予後良好とされていたが、実際にはそうでもない(10人に1人は死亡する)
→典型例として発症したら4人に1人は死亡するというのは、結構深刻な気がする
→男性、治療前CRP>5mg/dlが間質性肺炎による死亡リスク因子とのこと
O3-1-3:
日本人の非小細胞肺癌患者に対するニボルマブの間質性肺疾患:中間集計における発症リスク因子の検討
・市販後臨床調査は総数3,635人で解析予定
・直近までに、ニボルマブの使用登録をした患者数は10,606人に上る
・今回は、1,005人の時点で中間解析を行った
・間質性肺炎発症報告数は58人(5.8%)で、11人(1.1%)が死亡した
・間質性肺炎発症の危険因子は、75歳以上であること、CTで既存肺に異常陰影を認めること、二次治療の使用であること、の3点だった
→O3-1-2とは解析の母集団が異なるため、わかりにくい
→危険因子がそのまま非小細胞肺癌におけるニボルマブの適用条件というのは、どうなんだろうか
→三次治療移行で使った方が安全性が高いということか
→そういえば、gefitinibで間質性肺炎の緊急安全性情報が出され、その後の調査で判明した間質性肺炎合併率は5.7%くらいだった
→実感としては、gefitinibによる間質性肺炎は当時ほどには見なくなった
O3-1-4:
非小細胞肺癌におけるNivolumabの治療効果と早期免疫関連有害事象の関係についての前向き観察研究
・免疫関連有害事象が出ると免疫チェックポイント阻害薬の治療効果が出やすいとするレトロスペクティブな報告は既にいくつかある
→Freeman et al., Clin Cancer Res 2016
→Hasan et al., Oncoimmunology 2016
・今回は、非小細胞肺癌に対するNivolumab療法開始後2週間以内に免疫関連有害事象が出るかどうかと治療効果の関連性を前向きに検討した
・対象患者数は43人
・早期免疫関連有害事象は発疹、下痢、発熱が多かった
・無増悪生存期間は早期免疫関連有害事象あり群で有意に延長していた(p=0.012)

O3-2-1:
Updated survival outcomes of NEJ005 / TCOG0902, a randomized pII of gefitinib and chemotherapy in EGFR-mutant NSCLC
・EGFR遺伝子変異陽性の進行非小細胞肺癌患者に対し、CBDCA+PEM+gefitinib併用療法→PEM+gefitinib維持療法を行うか、CBDCA+PEM併用療法→gefitinib療法→PEM維持療法→gefitinib維持療法・・・と交代療法を行うか

・後治療にOsimertinibは入っていない
→第III相試験であるNEJ009では、Osimertinibの影響をどのように考えるかが難しい
→FLAURA試験がpositiveとなってしまった以上、NEJ009の結論が出たときに、GefitinibをOsimertinibに置き換えたらどうなるのか、Osimertnib単剤と今回の併用療法ではどちらを優先するべきなのか、という議論が当然出てくるだろう
O3-2-2:
Randomaized phase 1b / 3 study of erlotinib plus ramcirumab ( RAM ) in first-line EGFR mut(+) stage IV NSCLC: phase 1b safety
・RELAY study: NCT02411448
・phase 1bに12人組み入れ、忍容性ありと認められればphase IIIに進む段取り
・日本から7人、欧米から7人が参加
・全ての患者に、なんらかの有害事象が出た
・日本人では、下痢を6人(86%)で認めた
・既知の有害事象のみだったため、現在はphase III試験が進行中
O3-2-3:
EGFR遺伝子変異陽性進行非扁平上皮非小細胞肺癌に対するアファチニブ+ベバシツマブ併用療法の第I相試験
・既報では、この患者群に対するErlotinib+bevacizumab併用療法の無増悪生存期間中央値は16ヶ月、Gefitinib+bevacizumab併用療法の無増悪生存期間中央値は14.4ヶ月
・それでは、Afatinibではどうなるか
・Afatinib 30mg/日+Bevacizumab 15mg/kgを開始量として、第I相試験を行った
・3+3 cohortで開始
・5人で試験終了
・Afatinib 30mg/日+Bevacizumab 15mg/kgでは用量制限毒性は出現せず
・Afatinib 40mg/日+Bevacizumab 15mg/kgでは2人中2人でGrade 3の下痢
・以上から、推奨用量はAfatinib 30mg/日+Bevacizumab 15mg/kgに決定
・奏効割合は40%
・病勢コントロール割合は100%
・無増悪生存期間は8.7ヶ月から18.2ヶ月
・現在は10-20人程度を組み入れ予定のexpansion cohort studyを実施中
O3-3-5:
LUX-Lung 8 (LL-8)phase III trial: Long-term response to second-line afatinib in patients with advanced SCC of the lung
・基本的には後出しじゃんけんの解析
・LL-8で1年以上生存した患者21人を検証
・この患者群での奏効割合は48%、生存期間中央値は21.1ヶ月(12.9-31.6)、ちなみに全体の生存期間中央値は7.9ヶ月
・21人中4人は50mg/日へ増量されており、それ以外の患者でも40mg/日で維持された患者が多かった
・この患者群での治療継続期間中央値は17.6ヶ月
・この患者群でErbB familyの変異解析をしてみた
EGFR遺伝子変異陽性(R1052K, V8431, L858R):全体の20%
HER2遺伝子変異陽性(E395L, Q57R):全体の20%
ErbB4遺伝子変異陽性(G668V):全体の10%
残りの50%はwild type
→Afatinibの毒性に耐えられた患者は長生きできたということだろうか
→1年以上生存できなかった患者との比較はされていなかったので、単に治療がよく効いた患者を解析したというだけの報告で、なんともコメントのしようがない
→目新しいのはErbB familyの解析をしたことだが、臨床的にどの程度の意義があるのかはよくわからない(対照群でもやっていて、差が出ていれば話は違うけれど)
O3-4-1:
Phase II study of Crizotinib in East Asian patients with ROS1+ advanced non-small cell lung cancer ( NSCLC )
・ROS1肺癌はgrobalには肺癌の1-2%、日本国内では2-4%程度
・ROS1+, ALK-が確認された患者が対象で、前治療は3レジメンまで許容

・前治療のレジメン数によらず、奏効割合はほぼ70%
・主な有害事象は嘔気や下痢で、ALK陽性肺癌に対してCrizotinibを使ったときとさしてかわらない
・RT-PCRとFISHの結果の相同性はある程度担保されている
O3-4-2:
Afatinib vs Gefitinib in patients with EGFRm+ NSCLC: Updated OS data from the phase IIb trial LUX-Lung 7 ( LL-7 )
・2016年12月5日時点でcut off, updated analysis

・自施設のみで調べた感じでは、Afatinib群でもGefitinib群でも、PD後にT790Mが検出された患者は46-47%程度という実感
→後治療のデータ、ことにT790M出現割合と第3世代TKI使用後の成績は興味深い
→FLAURA studyの結果示されるOSのデータによっては、治療シーケンスを考える必要が出てくるだろうが、早くて来年、場合によっては再来年以降にならないと見通せないだろう
O3-4-3:
First-line Afatinib for advanced EGFRm+ NSCLC: analysis of long term responders ( LTRs ) in the LUX-Lung 3, 6, 7 trials
・LTRsを「3年以上治療を継続された人」と定義
・LTRsで各種解析
・Afatinibを使用した患者のうちLTRはおおむね10-12%程度
・LL7において、LTRはGefitinib群の4%だった
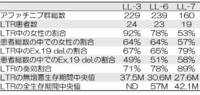
→O3-3-5同様、後出しじゃんけん解析
→女性、Ex.19 del.にLTRが多い
口演発表のまとめ
O3-1-2:
日本人の非小細胞肺癌患者に対するニボルマブの間質性肺疾患:死亡リスク因子の検討
・発表内容をはしょりすぎていて、結局結論がわからなかった
・今回の中間解析時点で、間質性肺疾患として160人が報告された
・感染症など病因が明らかなものや、病状が悪くてCTが撮影できなかったものなど、計20人を解析対象から除外した
・免疫チェックポイント阻害薬関連間質性肺炎の画像的特徴
1)腫瘍周囲への陰影出現(peritumoral infiltration)
2)既存の放射線性線維化肺や感染巣の悪化
3)肺癌病巣がある側の肺で陰影が優勢
・画像所見を以下のごとく分類
1)急性間質性肺炎様パターン
2)Faint infiltrationパターン
3)過敏性肺臓炎様パターン
4)器質化肺炎 / 好酸球性肺炎様パターン
5)非特異的間質性肺炎様パターン
・全体を典型例と非典型例に分類
・典型例は92人、そのうち23人(25%)は死亡
・非典型例は48人、そのうち5人(10%)は死亡
・予後不良とされる急性間質性肺炎様パターンは20人(全体の14.3%)で、そのうち14人(70%)は死亡した
・予後良好とされる器質化肺炎 / 好酸球性肺炎パターンは61人(全体の43.6%)で、そのうち6人(9.8%)は死亡した
・急性間質性肺炎様パターン以外の患者120人中14人(10.8%)が死亡した
→免疫チェックポイント阻害薬関連の間質性肺炎は、殺細胞性抗がん薬関連の間質性肺炎より予後良好とされていたが、実際にはそうでもない(10人に1人は死亡する)
→典型例として発症したら4人に1人は死亡するというのは、結構深刻な気がする
→男性、治療前CRP>5mg/dlが間質性肺炎による死亡リスク因子とのこと
O3-1-3:
日本人の非小細胞肺癌患者に対するニボルマブの間質性肺疾患:中間集計における発症リスク因子の検討
・市販後臨床調査は総数3,635人で解析予定
・直近までに、ニボルマブの使用登録をした患者数は10,606人に上る
・今回は、1,005人の時点で中間解析を行った
・間質性肺炎発症報告数は58人(5.8%)で、11人(1.1%)が死亡した
・間質性肺炎発症の危険因子は、75歳以上であること、CTで既存肺に異常陰影を認めること、二次治療の使用であること、の3点だった
→O3-1-2とは解析の母集団が異なるため、わかりにくい
→危険因子がそのまま非小細胞肺癌におけるニボルマブの適用条件というのは、どうなんだろうか
→三次治療移行で使った方が安全性が高いということか
→そういえば、gefitinibで間質性肺炎の緊急安全性情報が出され、その後の調査で判明した間質性肺炎合併率は5.7%くらいだった
→実感としては、gefitinibによる間質性肺炎は当時ほどには見なくなった
O3-1-4:
非小細胞肺癌におけるNivolumabの治療効果と早期免疫関連有害事象の関係についての前向き観察研究
・免疫関連有害事象が出ると免疫チェックポイント阻害薬の治療効果が出やすいとするレトロスペクティブな報告は既にいくつかある
→Freeman et al., Clin Cancer Res 2016
→Hasan et al., Oncoimmunology 2016
・今回は、非小細胞肺癌に対するNivolumab療法開始後2週間以内に免疫関連有害事象が出るかどうかと治療効果の関連性を前向きに検討した
・対象患者数は43人
・早期免疫関連有害事象は発疹、下痢、発熱が多かった
・無増悪生存期間は早期免疫関連有害事象あり群で有意に延長していた(p=0.012)

O3-2-1:
Updated survival outcomes of NEJ005 / TCOG0902, a randomized pII of gefitinib and chemotherapy in EGFR-mutant NSCLC
・EGFR遺伝子変異陽性の進行非小細胞肺癌患者に対し、CBDCA+PEM+gefitinib併用療法→PEM+gefitinib維持療法を行うか、CBDCA+PEM併用療法→gefitinib療法→PEM維持療法→gefitinib維持療法・・・と交代療法を行うか

・後治療にOsimertinibは入っていない
→第III相試験であるNEJ009では、Osimertinibの影響をどのように考えるかが難しい
→FLAURA試験がpositiveとなってしまった以上、NEJ009の結論が出たときに、GefitinibをOsimertinibに置き換えたらどうなるのか、Osimertnib単剤と今回の併用療法ではどちらを優先するべきなのか、という議論が当然出てくるだろう
O3-2-2:
Randomaized phase 1b / 3 study of erlotinib plus ramcirumab ( RAM ) in first-line EGFR mut(+) stage IV NSCLC: phase 1b safety
・RELAY study: NCT02411448
・phase 1bに12人組み入れ、忍容性ありと認められればphase IIIに進む段取り
・日本から7人、欧米から7人が参加
・全ての患者に、なんらかの有害事象が出た
・日本人では、下痢を6人(86%)で認めた
・既知の有害事象のみだったため、現在はphase III試験が進行中
O3-2-3:
EGFR遺伝子変異陽性進行非扁平上皮非小細胞肺癌に対するアファチニブ+ベバシツマブ併用療法の第I相試験
・既報では、この患者群に対するErlotinib+bevacizumab併用療法の無増悪生存期間中央値は16ヶ月、Gefitinib+bevacizumab併用療法の無増悪生存期間中央値は14.4ヶ月
・それでは、Afatinibではどうなるか
・Afatinib 30mg/日+Bevacizumab 15mg/kgを開始量として、第I相試験を行った
・3+3 cohortで開始
・5人で試験終了
・Afatinib 30mg/日+Bevacizumab 15mg/kgでは用量制限毒性は出現せず
・Afatinib 40mg/日+Bevacizumab 15mg/kgでは2人中2人でGrade 3の下痢
・以上から、推奨用量はAfatinib 30mg/日+Bevacizumab 15mg/kgに決定
・奏効割合は40%
・病勢コントロール割合は100%
・無増悪生存期間は8.7ヶ月から18.2ヶ月
・現在は10-20人程度を組み入れ予定のexpansion cohort studyを実施中
O3-3-5:
LUX-Lung 8 (LL-8)phase III trial: Long-term response to second-line afatinib in patients with advanced SCC of the lung
・基本的には後出しじゃんけんの解析
・LL-8で1年以上生存した患者21人を検証
・この患者群での奏効割合は48%、生存期間中央値は21.1ヶ月(12.9-31.6)、ちなみに全体の生存期間中央値は7.9ヶ月
・21人中4人は50mg/日へ増量されており、それ以外の患者でも40mg/日で維持された患者が多かった
・この患者群での治療継続期間中央値は17.6ヶ月
・この患者群でErbB familyの変異解析をしてみた
EGFR遺伝子変異陽性(R1052K, V8431, L858R):全体の20%
HER2遺伝子変異陽性(E395L, Q57R):全体の20%
ErbB4遺伝子変異陽性(G668V):全体の10%
残りの50%はwild type
→Afatinibの毒性に耐えられた患者は長生きできたということだろうか
→1年以上生存できなかった患者との比較はされていなかったので、単に治療がよく効いた患者を解析したというだけの報告で、なんともコメントのしようがない
→目新しいのはErbB familyの解析をしたことだが、臨床的にどの程度の意義があるのかはよくわからない(対照群でもやっていて、差が出ていれば話は違うけれど)
O3-4-1:
Phase II study of Crizotinib in East Asian patients with ROS1+ advanced non-small cell lung cancer ( NSCLC )
・ROS1肺癌はgrobalには肺癌の1-2%、日本国内では2-4%程度
・ROS1+, ALK-が確認された患者が対象で、前治療は3レジメンまで許容

・前治療のレジメン数によらず、奏効割合はほぼ70%
・主な有害事象は嘔気や下痢で、ALK陽性肺癌に対してCrizotinibを使ったときとさしてかわらない
・RT-PCRとFISHの結果の相同性はある程度担保されている
O3-4-2:
Afatinib vs Gefitinib in patients with EGFRm+ NSCLC: Updated OS data from the phase IIb trial LUX-Lung 7 ( LL-7 )
・2016年12月5日時点でcut off, updated analysis

・自施設のみで調べた感じでは、Afatinib群でもGefitinib群でも、PD後にT790Mが検出された患者は46-47%程度という実感
→後治療のデータ、ことにT790M出現割合と第3世代TKI使用後の成績は興味深い
→FLAURA studyの結果示されるOSのデータによっては、治療シーケンスを考える必要が出てくるだろうが、早くて来年、場合によっては再来年以降にならないと見通せないだろう
O3-4-3:
First-line Afatinib for advanced EGFRm+ NSCLC: analysis of long term responders ( LTRs ) in the LUX-Lung 3, 6, 7 trials
・LTRsを「3年以上治療を継続された人」と定義
・LTRsで各種解析
・Afatinibを使用した患者のうちLTRはおおむね10-12%程度
・LL7において、LTRはGefitinib群の4%だった

→O3-3-5同様、後出しじゃんけん解析
→女性、Ex.19 del.にLTRが多い
2017年07月30日
BVと腸穿孔、driver変異とNivolumab
2017年7月29日 日本臨床腫瘍学会総会3日目(神戸市)
<ポスター発表>
P3-138:
非小細胞肺がんにおけるBevacizumabに関連した腸穿孔の臨床背景の検討
・解析対象患者総数は314人
・腸穿孔を合併した患者は7人(2.2%)
・7人中6人は、1コース目もしくは2コース目に腸穿孔を合併した
・原因不明4人、潰瘍性大腸炎2人、転移1人
・腸穿孔発症に関連する危険因子
Grade 3以上の下痢:HR 11.37(2.37-54.50 ), p=0.0024
Grade 2以上の胃炎:HR 4.60 ( 1.01-21.04 ) , p=0.0492
発熱性好中球減少合併:HR 9.16 ( 1.98-42.49 ), p=0.0047
初回治療時点でのPS 1:HR 11.07 ( 2.37-51.63 ), p=0.0022
→発症すると外科的対応が必要となるだけに、内科医としては難儀な合併症
→日頃から外科医と良い関係性を保つことが大切
→治療開始前のPS1、治療開始後の高度の下痢と発熱性好中球減少が危険因子というのは、知っていて損はない
P3-142:
EGFR / ALK遺伝子変異陽性の進行非扁平上皮非小細胞肺癌に対するニボルマブ治療
・解析対象となったのはニボルマブ投与を受けた患者総数59人
・そのうち、EGFR遺伝子変異陽性患者は16人、ALK陽性患者は2人

P3-144:
ニボルマブ投与を行ったEGFR遺伝子変異陽性非小細胞肺癌症例における効果と有害事象の調査について
・ニボルマブ投与を受けたEGFR遺伝子変異陽性患者13人の解析を行った

→実地臨床でEGFR遺伝子変異陽性の患者に対してNivolumabを使用した場合、治療開始後の生存期間中央値は10-12ヶ月といったところか
→どちらも各地方のhigh volume centerからの報告であるためか、比較的患者層が若い
→高齢者を対象とした場合、もっと成績は悪くなるのでは
→P3-142でドライバー遺伝子変異陰性の患者群と比べると、生命予後はそれほど変わらない
<ポスター発表>
P3-138:
非小細胞肺がんにおけるBevacizumabに関連した腸穿孔の臨床背景の検討
・解析対象患者総数は314人
・腸穿孔を合併した患者は7人(2.2%)
・7人中6人は、1コース目もしくは2コース目に腸穿孔を合併した
・原因不明4人、潰瘍性大腸炎2人、転移1人
・腸穿孔発症に関連する危険因子
Grade 3以上の下痢:HR 11.37(2.37-54.50 ), p=0.0024
Grade 2以上の胃炎:HR 4.60 ( 1.01-21.04 ) , p=0.0492
発熱性好中球減少合併:HR 9.16 ( 1.98-42.49 ), p=0.0047
初回治療時点でのPS 1:HR 11.07 ( 2.37-51.63 ), p=0.0022
→発症すると外科的対応が必要となるだけに、内科医としては難儀な合併症
→日頃から外科医と良い関係性を保つことが大切
→治療開始前のPS1、治療開始後の高度の下痢と発熱性好中球減少が危険因子というのは、知っていて損はない
P3-142:
EGFR / ALK遺伝子変異陽性の進行非扁平上皮非小細胞肺癌に対するニボルマブ治療
・解析対象となったのはニボルマブ投与を受けた患者総数59人
・そのうち、EGFR遺伝子変異陽性患者は16人、ALK陽性患者は2人

P3-144:
ニボルマブ投与を行ったEGFR遺伝子変異陽性非小細胞肺癌症例における効果と有害事象の調査について
・ニボルマブ投与を受けたEGFR遺伝子変異陽性患者13人の解析を行った

→実地臨床でEGFR遺伝子変異陽性の患者に対してNivolumabを使用した場合、治療開始後の生存期間中央値は10-12ヶ月といったところか
→どちらも各地方のhigh volume centerからの報告であるためか、比較的患者層が若い
→高齢者を対象とした場合、もっと成績は悪くなるのでは
→P3-142でドライバー遺伝子変異陰性の患者群と比べると、生命予後はそれほど変わらない
2017年07月30日
ASCO / JSMO joint symposium
2017年7月28日 日本臨床腫瘍学会総会2日目(神戸市)
AJ-1の講演内容を見ると、欧米と日本でのドラッグ・ラグはだいぶん是正されてきた様子。
ASCO / JSMO Joint Symposium
AJ-1:
Expanding the Reach of Targeted Therapy in Lung Cancer
<EGFR>(in USA, 15% of all NSCLC)
・EGFR mutationとEGFR阻害薬の効果が相関していることの発見
・NEJ-002試験がpositiveとなった
→gefitinibは日本で2002年に承認、米国では2015年まで待たなければならなかった
・Afatinibは日本では2013年に承認、米国では2014年に承認
・real worldにおけるEGFR阻害薬の効果
→日本では生存期間中央値は30.8ヶ月(Inoue et al., Jpn J Clin Oncol 2016)
https://www.ncbi.nlm.nih.gov/pubmed/26977054
→米国では生存期間中央値は30.9ヶ月(Liu et al., J Thorac Oncol 2016)
<ALK>(in USA, 5% of all NSCLC)
・PROFILE 1014, crizotinib
日本では2012年に承認、米国では2013年に正式承認
・J-ALEX study, Hida et al., Lancet 2017, Alectinib
日本では2014年に承認、米国では2015年に承認
<ROS1>(in USA, 1% of all NSCLC)
・Shaw et al., N Engl J Med, 1963-, 2017
Crizotinibが有効、日本では2017年に承認、米国では2016年に承認
<BRAF>(in USA, 1% of all NSCLC)
・BRF 113948 study, Planchard et al., Lancet Oncol 2016, 984-993
→https://www.ncbi.nlm.nih.gov/pubmed/27283860
ORR 64%, mPFS 9.7M
Dabrafenib+Trametinibが有効、米国では2017年に承認
<others>
・MET exon 14 skipping mutation
・NTRK
・RET
・development medication for rare cancers
Single arm studyで、PFS 9-10ヶ月以上が承認のための相場
AJ-2:
Development of Nationwide Genomic Screening Project ( LC-SCRUM-Japan ) for the Establishment of Cancer Precision Medicine
・From Histology to Molecular Target for Decision Making
In Japan, EGFRm 53%, KRASm 9.4%, ALKr 3.8%
・At the beginning of LC-SCRUM pfoject, only RETr, ALKr and ROS1r are screened for confirmed EGFRm negative patients
→If RETr(+), recommend to entry LURET study, investigator initiated trial.
・Crizotinib for ROS1r(+) NSCLC for East-Asian population: ASCO 2016 abst.#9022
・Overall survival analysis in LC-SCRUM participant
N=1,147
Driver mutation(+) and Targeted Therapy(+): n=123: mOS 44.2M ( 30M – not reached )
Driver mutation(+) and Targeted Therapy(-): n=450: mOS 29.3M ( 24.4M – 49.9M )
Driver mutation(-): n=574: mOS 30.6M ( 26.5M – 48.6M )
AJ-3:
Combination Therapy with Molecularly Targeted Agents in Lung Cancer
・EGFRm(+) patients survival in “Real World” Japan
5-year OS rate: 21.5% ( overall n=1,657) and 13.8% ( stage IV patients only )
Median OS: 29.7M ( 28.1M – 31.4M )
Upfront chemotherapy may be related to higher 5-year OS rate.
Upfront chemotherapy may be related to longer chemotherapy period.
→Maybe there are selection biases.


・concurrent chemotherapy and TKI
Randomized phase II NEJ005 updated data: mOS 41.9M vs 30.7M
→Oizumi et al., ASCO 2017 abst.#9038
→Randomized phase III NEJ009 ongoing ( accrual finished, follow up ongoing )
・intercalated gefitinib phase II study: mOS 48M
→Kanda et al., Lung Cancer. 2015 Sep;89(3):287-93
→https://www.ncbi.nlm.nih.gov/pubmed/26169499
・Erlotinib + Bevacizumab therapy
JO25567 study ( phase II )
NEJ026 study ( phase III, accrual finished )
・RELAY study
Erlotinib + Bevacizumab vs Erlotinib ( phase III study, primary endpoint:PFS )
・FLAURA study press released as “positive” on 27 / 07 / 2017
・WJOG8715L: Osimertinib + Bevacizumab phase II
・J-SONIC trial: NSCLC with IPF patientsにChemotherapy + nintedanib
・座長からの要請事項:real world’s EGFRm NSCLC患者について、今後も長期フォローした方がいいのでは?
AJ-4:
Current Status of Liquid Biopsy in Lung Cancer
・Liquid Biopsy is…
→non – invasive genomic diagnostic tool, Oxnard et al., Clin Cancer Res 2014
→drug resistance monitoring tool
→pharmacodynamics research tool
・positive predictive value ( PPV ):
100% for EGFRm detection
100% for KRASm detection
79% for T790M detection
・Sensitivity
82% for Exon 19 deletion detection
72% for Exon 21 point mutation detection
77% for T790M resistance detection
64% for KRASm detection
→Sacher et al., JAMA Oncol. 2016 Aug 1;2(8):1014-22
→https://www.ncbi.nlm.nih.gov/pubmed/27055085
・Plasma genotyping and Tissue genotyping
T790M confirmed from Tissue → well correlated to PFS
T790M confirmed from Plasma → not well correlated to PFS
→Oxnard et al. J Clin Oncol 2016
・ctDNA monitoring by NGS assay
26人のOsimertinib resistant patients
9人がT790M(+)で、そのうち6人がC797S(+), 3人がC797S(-)
17人がT790M(-)で、4人が小細胞癌転化、MET異常が3人、BRAF異常が1人、KRASmも1人
AJ-1の講演内容を見ると、欧米と日本でのドラッグ・ラグはだいぶん是正されてきた様子。
ASCO / JSMO Joint Symposium
AJ-1:
Expanding the Reach of Targeted Therapy in Lung Cancer
<EGFR>(in USA, 15% of all NSCLC)
・EGFR mutationとEGFR阻害薬の効果が相関していることの発見
・NEJ-002試験がpositiveとなった
→gefitinibは日本で2002年に承認、米国では2015年まで待たなければならなかった
・Afatinibは日本では2013年に承認、米国では2014年に承認
・real worldにおけるEGFR阻害薬の効果
→日本では生存期間中央値は30.8ヶ月(Inoue et al., Jpn J Clin Oncol 2016)
https://www.ncbi.nlm.nih.gov/pubmed/26977054
→米国では生存期間中央値は30.9ヶ月(Liu et al., J Thorac Oncol 2016)
<ALK>(in USA, 5% of all NSCLC)
・PROFILE 1014, crizotinib
日本では2012年に承認、米国では2013年に正式承認
・J-ALEX study, Hida et al., Lancet 2017, Alectinib
日本では2014年に承認、米国では2015年に承認
<ROS1>(in USA, 1% of all NSCLC)
・Shaw et al., N Engl J Med, 1963-, 2017
Crizotinibが有効、日本では2017年に承認、米国では2016年に承認
<BRAF>(in USA, 1% of all NSCLC)
・BRF 113948 study, Planchard et al., Lancet Oncol 2016, 984-993
→https://www.ncbi.nlm.nih.gov/pubmed/27283860
ORR 64%, mPFS 9.7M
Dabrafenib+Trametinibが有効、米国では2017年に承認
<others>
・MET exon 14 skipping mutation
・NTRK
・RET
・development medication for rare cancers
Single arm studyで、PFS 9-10ヶ月以上が承認のための相場
AJ-2:
Development of Nationwide Genomic Screening Project ( LC-SCRUM-Japan ) for the Establishment of Cancer Precision Medicine
・From Histology to Molecular Target for Decision Making
In Japan, EGFRm 53%, KRASm 9.4%, ALKr 3.8%
・At the beginning of LC-SCRUM pfoject, only RETr, ALKr and ROS1r are screened for confirmed EGFRm negative patients
→If RETr(+), recommend to entry LURET study, investigator initiated trial.
・Crizotinib for ROS1r(+) NSCLC for East-Asian population: ASCO 2016 abst.#9022
・Overall survival analysis in LC-SCRUM participant
N=1,147
Driver mutation(+) and Targeted Therapy(+): n=123: mOS 44.2M ( 30M – not reached )
Driver mutation(+) and Targeted Therapy(-): n=450: mOS 29.3M ( 24.4M – 49.9M )
Driver mutation(-): n=574: mOS 30.6M ( 26.5M – 48.6M )
AJ-3:
Combination Therapy with Molecularly Targeted Agents in Lung Cancer
・EGFRm(+) patients survival in “Real World” Japan
5-year OS rate: 21.5% ( overall n=1,657) and 13.8% ( stage IV patients only )
Median OS: 29.7M ( 28.1M – 31.4M )
Upfront chemotherapy may be related to higher 5-year OS rate.
Upfront chemotherapy may be related to longer chemotherapy period.
→Maybe there are selection biases.


・concurrent chemotherapy and TKI
Randomized phase II NEJ005 updated data: mOS 41.9M vs 30.7M
→Oizumi et al., ASCO 2017 abst.#9038
→Randomized phase III NEJ009 ongoing ( accrual finished, follow up ongoing )
・intercalated gefitinib phase II study: mOS 48M
→Kanda et al., Lung Cancer. 2015 Sep;89(3):287-93
→https://www.ncbi.nlm.nih.gov/pubmed/26169499
・Erlotinib + Bevacizumab therapy
JO25567 study ( phase II )
NEJ026 study ( phase III, accrual finished )
・RELAY study
Erlotinib + Bevacizumab vs Erlotinib ( phase III study, primary endpoint:PFS )
・FLAURA study press released as “positive” on 27 / 07 / 2017
・WJOG8715L: Osimertinib + Bevacizumab phase II
・J-SONIC trial: NSCLC with IPF patientsにChemotherapy + nintedanib
・座長からの要請事項:real world’s EGFRm NSCLC患者について、今後も長期フォローした方がいいのでは?
AJ-4:
Current Status of Liquid Biopsy in Lung Cancer
・Liquid Biopsy is…
→non – invasive genomic diagnostic tool, Oxnard et al., Clin Cancer Res 2014
→drug resistance monitoring tool
→pharmacodynamics research tool
・positive predictive value ( PPV ):
100% for EGFRm detection
100% for KRASm detection
79% for T790M detection
・Sensitivity
82% for Exon 19 deletion detection
72% for Exon 21 point mutation detection
77% for T790M resistance detection
64% for KRASm detection
→Sacher et al., JAMA Oncol. 2016 Aug 1;2(8):1014-22
→https://www.ncbi.nlm.nih.gov/pubmed/27055085
・Plasma genotyping and Tissue genotyping
T790M confirmed from Tissue → well correlated to PFS
T790M confirmed from Plasma → not well correlated to PFS
→Oxnard et al. J Clin Oncol 2016
・ctDNA monitoring by NGS assay
26人のOsimertinib resistant patients
9人がT790M(+)で、そのうち6人がC797S(+), 3人がC797S(-)
17人がT790M(-)で、4人が小細胞癌転化、MET異常が3人、BRAF異常が1人、KRASmも1人
2017年07月29日
Durvalumab,Tremelimumab一次治療はPFSを延長せず
Durvalumab単剤療法、あるいはDurvalumab+Tremelimumab併用療法は、プラチナ併用化学療法に対して無増悪生存期間の有意な延長を示せなかったとのこと。
免疫チェックポイント阻害薬は無増悪生存期間を延長せずに全生存期間を延長することがあるので、まだ有効か無効かの結論を出すのは早い。
25%<PD-L1発現<50%の患者群の一次治療をどのように考えるのか、2018年前半には一定の結論が得られそうだ。
Initial Progression-Free Survival Results From the MYSTIC Trial in Stage IV NSCLC
By The ASCO Post
Posted: 7/28/2017 12:23:35 PM
Last Updated: 7/28/2017 12:23:35 PM
2017年7月27日、未治療進行(IV期)非小細胞肺癌に対する初回治療として、プラチナ併用標準化学療法に対するdurvalumab単剤療法もしくはDurvalumab+Tremelimumab併用療法の効果を比較するランダム化オープンラベル国際多施設共同第III試験であるMYSTIC trialの無増悪生存期間に関する結果(の一部)が公表された。
VENTANA PD-L1(SP263 antibody) assayでPD-L1発現が25%以上と確認された患者を対象に治療を行ったが、Durvalumab+Tremelimumab併用療法は標準治療に対して、主要評価項目である無増悪生存期間の有意な延長を示せなかった。副次評価項目であるDurvalumab単剤療法についても、無増悪生存期間の有意な延長を示せない公算が高いようだ。
本試験は他の主要評価項目である全生存期間の解析が残っているため、引き続き追跡調査される。2018年前半には、全生存期間に関する結果も公表される予定である。
免疫チェックポイント阻害薬は無増悪生存期間を延長せずに全生存期間を延長することがあるので、まだ有効か無効かの結論を出すのは早い。
25%<PD-L1発現<50%の患者群の一次治療をどのように考えるのか、2018年前半には一定の結論が得られそうだ。
Initial Progression-Free Survival Results From the MYSTIC Trial in Stage IV NSCLC
By The ASCO Post
Posted: 7/28/2017 12:23:35 PM
Last Updated: 7/28/2017 12:23:35 PM
2017年7月27日、未治療進行(IV期)非小細胞肺癌に対する初回治療として、プラチナ併用標準化学療法に対するdurvalumab単剤療法もしくはDurvalumab+Tremelimumab併用療法の効果を比較するランダム化オープンラベル国際多施設共同第III試験であるMYSTIC trialの無増悪生存期間に関する結果(の一部)が公表された。
VENTANA PD-L1(SP263 antibody) assayでPD-L1発現が25%以上と確認された患者を対象に治療を行ったが、Durvalumab+Tremelimumab併用療法は標準治療に対して、主要評価項目である無増悪生存期間の有意な延長を示せなかった。副次評価項目であるDurvalumab単剤療法についても、無増悪生存期間の有意な延長を示せない公算が高いようだ。
本試験は他の主要評価項目である全生存期間の解析が残っているため、引き続き追跡調査される。2018年前半には、全生存期間に関する結果も公表される予定である。
2017年07月28日
KEYNOTE-024の日本人サブグループ解析
2017年7月28日 日本臨床腫瘍学会総会2日目(神戸市)
KEYNOTE-024の日本人サブグループ解析。
サブグループ解析なので人数は少ないけれど、確かに有望な結果。
Plenary session 3:
PD-L1高発現の見治療非小細胞肺がんに対するPembrolizumabの国際共同ランダム化第III相比較試験(KEYNOTE-024)の日本人集団解析
・PD-L1発現>50%の進行非小細胞肺癌患者を対象に、一次治療におけるPembrolizumabとプラチナ併用化学療法を比較する第III相試験
・主要評価項目は無増悪生存期間
・副次評価項目は全生存期間、奏効割合、安全性
・化学療法群が病勢進行に至った際、Pembrolizumabへのクロスオーバーを許容する
→全体では、化学療法群の50%がPembrolizumab療法に移行した

・化学療法群は全て病勢進行に至った
・アジアから参加したのは日本人のみ、n=40, PFSのHR 0.35 ( 0.14-0.91 )
アジア以外から参加したのはn=265、PFSのHR 0.52 ( 0.38-0.72 )
以下は、discussantからの意見。
・無増悪生存期間の生存曲線は、初期に大きく落ち込む:初期耐性
→機序を明らかにする必要あり
・Peters et al., AACR 2017, tumor mutational burdenはPD-L1発現と相関せず
・Joshua et al., ASCO 2017, MET増幅があると、PD-L1陽性でも免疫チェックポイント阻害薬は無効、PD-L1>50%が6人いたが、全てPD
・Hamanishi et al., Int J Clin Oncol. 2016 Jun;21(3):462-73
→https://www.ncbi.nlm.nih.gov/pubmed/26899259
免疫チェックポイント阻害薬開発に関するoverview
KEYNOTE-024の日本人サブグループ解析。
サブグループ解析なので人数は少ないけれど、確かに有望な結果。
Plenary session 3:
PD-L1高発現の見治療非小細胞肺がんに対するPembrolizumabの国際共同ランダム化第III相比較試験(KEYNOTE-024)の日本人集団解析
・PD-L1発現>50%の進行非小細胞肺癌患者を対象に、一次治療におけるPembrolizumabとプラチナ併用化学療法を比較する第III相試験
・主要評価項目は無増悪生存期間
・副次評価項目は全生存期間、奏効割合、安全性
・化学療法群が病勢進行に至った際、Pembrolizumabへのクロスオーバーを許容する
→全体では、化学療法群の50%がPembrolizumab療法に移行した

・化学療法群は全て病勢進行に至った
・アジアから参加したのは日本人のみ、n=40, PFSのHR 0.35 ( 0.14-0.91 )
アジア以外から参加したのはn=265、PFSのHR 0.52 ( 0.38-0.72 )
以下は、discussantからの意見。
・無増悪生存期間の生存曲線は、初期に大きく落ち込む:初期耐性
→機序を明らかにする必要あり
・Peters et al., AACR 2017, tumor mutational burdenはPD-L1発現と相関せず
・Joshua et al., ASCO 2017, MET増幅があると、PD-L1陽性でも免疫チェックポイント阻害薬は無効、PD-L1>50%が6人いたが、全てPD
・Hamanishi et al., Int J Clin Oncol. 2016 Jun;21(3):462-73
→https://www.ncbi.nlm.nih.gov/pubmed/26899259
免疫チェックポイント阻害薬開発に関するoverview
2017年07月28日
EGFR遺伝子変異陽性肺癌に対する治療戦略
2017年7月28日 日本臨床腫瘍学会2日目(神戸市)
昨日に続いて、スペインからお越しになった先生のご講演。
Medical Seminer (=Lanchon Seminer) 25
Grobal Strategies for the Treatment of EGFR Mutation Positive Patient
・1st lineとしてErlotinib, Afatinib, Gefitinibを使用可能
・治療中にほぼ例外なく耐性化し、治癒には至らない
・T790M陽性が確認できたら、Osimertinibを使用可能
・liquid biopsyも利用可能になった
・アジア人におけるEGFR遺伝子変異出現頻度
中国:50.2%
香港:47.2%
フィリピン:52.3%
台湾:62.1%
タイ:53.1%
・EURTAC study: Lancet Oncol 239-246, 2012
PFSはErlotinib群で9.7ヶ月、化学療法群で5.2ヶ月
Erlotinib群にも完全奏効の患者はおらず、みんな耐性化
・これまでのところ、一次治療としては、Afatinibは化学療法に対してOS延長効果を示した唯一のEGFR阻害薬(LUX-Lung 3 and 6 pooled analysis)
・Erlotinib 25mg is equivalent to gefitinib 250mg
→Yeo et al., J Thorac Oncol. 2010 Jul;5(7):1048-53
→https://www.ncbi.nlm.nih.gov/pubmed/20512075
・EGFR阻害薬同士のHead to Head studies
→CTONG0901: Yang et al., Br J Cancer. 2017 Feb 28;116(5):568-574
https://www.ncbi.nlm.nih.gov/pubmed/28103612
→WJOG5108L: Urata et al., J Clin Oncol. 2016 Sep 20;34(27):3248-57
https://www.ncbi.nlm.nih.gov/pubmed/27022112
→LUX-Lung 7: Paz-Ares et al., Ann Oncol. 2017 Feb 1;28(2):270-277, Corral et al., ELCC #93PD
Asian subgroupではHR 0.76, non-Asian subgroupではHR 0.72
https://www.ncbi.nlm.nih.gov/pubmed/28426106
→ARCHER 1050: Mok et al., ASCO 2017
→http://oitahaiganpractice.junglekouen.com/e900757.html
Asian subgroupではHR 0.51(0.39-0.66)
Non-Asian subgroupではHR 0.89(0.57-1.39)
・脳転移を有するEGFR遺伝子変異陽性患者の取り扱い
→Magnuson et al., J Clin Oncol. 2017 Apr 1;35(10):1070-1077
→https://www.ncbi.nlm.nih.gov/pubmed/28113019
EGFR阻害薬未治療で、脳転移を合併したEGFR遺伝子変異陽性の患者を後ろ向きに検討
定位照射の後にEGFR阻害薬を使った人、全脳照射の後にEGFR阻害薬を使った人、EGFR阻害薬を使った後に脳転移巣が悪化したら定位照射か全脳照射をした人の順に全生存期間が長く、それぞれの中央値は46ヶ月、30ヶ月、25ヶ月で、EGFR阻害薬を先に使ったほうが統計学的有意に予後不良だった
→中枢神経移行のよいOsimertinibが一次治療で使えるようになったら、前向きに検証すべきテーマだ
・minor mutationの患者にはafatinibがよい
・Hata et al., Nature Med 2016
Heterogeneity, early phase T790M evolution and late phase T790M evolution
・BELIEF trial: Erlotinib+Bevacizumabの治療効果はT790M statusによって異なる
OSはallで13.2ヶ月、T790M(+)群で16ヶ月、T790(-)群で10.5ヶ月
→https://www.ncbi.nlm.nih.gov/pubmed/28408243
・各種EGFR阻害薬の脳への集積:カニクイザルとPETを用いて可視化
→Ballard et al., Clin Cancer Res. 2016 Oct 15;22(20):5130-5140
→https://www.ncbi.nlm.nih.gov/pubmed/27435396
・EURTAXにおけるExon 21変異患者とctDNAの推移
→Karachaliou et al, Expert Opin Pharmacother. 2017 Feb;18(3):295-304
→https://www.ncbi.nlm.nih.gov/pubmed/28103738
・FLAURA studyがpositiveだったと2017/07/27にプレスリリース
→http://oitahaiganpractice.junglekouen.com/e906089.html
昨日に続いて、スペインからお越しになった先生のご講演。
Medical Seminer (=Lanchon Seminer) 25
Grobal Strategies for the Treatment of EGFR Mutation Positive Patient
・1st lineとしてErlotinib, Afatinib, Gefitinibを使用可能
・治療中にほぼ例外なく耐性化し、治癒には至らない
・T790M陽性が確認できたら、Osimertinibを使用可能
・liquid biopsyも利用可能になった
・アジア人におけるEGFR遺伝子変異出現頻度
中国:50.2%
香港:47.2%
フィリピン:52.3%
台湾:62.1%
タイ:53.1%
・EURTAC study: Lancet Oncol 239-246, 2012
PFSはErlotinib群で9.7ヶ月、化学療法群で5.2ヶ月
Erlotinib群にも完全奏効の患者はおらず、みんな耐性化
・これまでのところ、一次治療としては、Afatinibは化学療法に対してOS延長効果を示した唯一のEGFR阻害薬(LUX-Lung 3 and 6 pooled analysis)
・Erlotinib 25mg is equivalent to gefitinib 250mg
→Yeo et al., J Thorac Oncol. 2010 Jul;5(7):1048-53
→https://www.ncbi.nlm.nih.gov/pubmed/20512075
・EGFR阻害薬同士のHead to Head studies
→CTONG0901: Yang et al., Br J Cancer. 2017 Feb 28;116(5):568-574
https://www.ncbi.nlm.nih.gov/pubmed/28103612
→WJOG5108L: Urata et al., J Clin Oncol. 2016 Sep 20;34(27):3248-57
https://www.ncbi.nlm.nih.gov/pubmed/27022112
→LUX-Lung 7: Paz-Ares et al., Ann Oncol. 2017 Feb 1;28(2):270-277, Corral et al., ELCC #93PD
Asian subgroupではHR 0.76, non-Asian subgroupではHR 0.72
https://www.ncbi.nlm.nih.gov/pubmed/28426106
→ARCHER 1050: Mok et al., ASCO 2017
→http://oitahaiganpractice.junglekouen.com/e900757.html
Asian subgroupではHR 0.51(0.39-0.66)
Non-Asian subgroupではHR 0.89(0.57-1.39)
・脳転移を有するEGFR遺伝子変異陽性患者の取り扱い
→Magnuson et al., J Clin Oncol. 2017 Apr 1;35(10):1070-1077
→https://www.ncbi.nlm.nih.gov/pubmed/28113019
EGFR阻害薬未治療で、脳転移を合併したEGFR遺伝子変異陽性の患者を後ろ向きに検討
定位照射の後にEGFR阻害薬を使った人、全脳照射の後にEGFR阻害薬を使った人、EGFR阻害薬を使った後に脳転移巣が悪化したら定位照射か全脳照射をした人の順に全生存期間が長く、それぞれの中央値は46ヶ月、30ヶ月、25ヶ月で、EGFR阻害薬を先に使ったほうが統計学的有意に予後不良だった
→中枢神経移行のよいOsimertinibが一次治療で使えるようになったら、前向きに検証すべきテーマだ
・minor mutationの患者にはafatinibがよい
・Hata et al., Nature Med 2016
Heterogeneity, early phase T790M evolution and late phase T790M evolution
・BELIEF trial: Erlotinib+Bevacizumabの治療効果はT790M statusによって異なる
OSはallで13.2ヶ月、T790M(+)群で16ヶ月、T790(-)群で10.5ヶ月
→https://www.ncbi.nlm.nih.gov/pubmed/28408243
・各種EGFR阻害薬の脳への集積:カニクイザルとPETを用いて可視化
→Ballard et al., Clin Cancer Res. 2016 Oct 15;22(20):5130-5140
→https://www.ncbi.nlm.nih.gov/pubmed/27435396
・EURTAXにおけるExon 21変異患者とctDNAの推移
→Karachaliou et al, Expert Opin Pharmacother. 2017 Feb;18(3):295-304
→https://www.ncbi.nlm.nih.gov/pubmed/28103738
・FLAURA studyがpositiveだったと2017/07/27にプレスリリース
→http://oitahaiganpractice.junglekouen.com/e906089.html
2017年07月28日
周術期化学療法におけるがん薬物療法専門医の役割
2017年7月28日 日本臨床腫瘍学会総会2日目(神戸市)
会員委員会企画
周術期化学療法におけるがん薬物療法専門医の役割
・・・結局のところ、各病院でルールを決めて取り組むべきことだ。
呼吸器内科医と呼吸器外科医は同じ呼吸器センターで働いていることが多いが、腫瘍内科医と呼吸器外科医は必ずしもそうではない。
いつも近くにいるかいないかというのは、結構大きな違いだと思う。
多分、他の領域でもそうではないだろうか。
「いつでも、face to faceで気楽に相談できる」というのが何より大切なのだ。
MMP1-1
外科系薬物療法専門医の立場から
・大きな大学病院の消化器外科医の先生が発言
・消化器外科系の臨床試験は術式検討のたゆまぬ繰り返し
・より低侵襲に、より効果的に
・外科医の殆どは、切除範囲を広げても癌は取り除けないし、治療成績は高まらないと漠然と考えている
・消化器外科の術前・術後には、消化器外科医でないと対応できないようなさまざまな合併症が待ち受けている
・諸問題に対応しようと思ったら、消化器外科医が薬物療法に習熟して一貫した治療を行うのが理にかなっている
MMP1-2
内科系薬物療法専門医の立場から
・大きな大学病院の腫瘍内科主任教授、臨床腫瘍学会のone of the leaderが発言
・外科とか内科とかこだわらず、それぞれの得意分野を活かしてチームとして取り組みましょう
・臓器横断的に、幅広い知識を有する臨床腫瘍医が治療に携わることは、メリットが大きい
・日本と韓国が一緒にやった、肝細胞がんに対するsorafenib療法の検証的試験
→日本では標準治療と差が出ず、韓国では圧倒的な差がついた
→患者背景も治療法も差がなく、唯一差があったのは、日本では非腫瘍内科医が、韓国では腫瘍内科医が患者を担当した
→日本の方が累積投与量が少なく、治療期間も短かった・・・有害事象をうまくマネジメントできなかったことが原因では?
・がん薬物療法専門医はそれなりに増えてきた
総数:1229人
都道府県がん診療拠点病院に在籍:326人(26.5%)
地域がん診療連携拠点病院に在籍:527人(42.9%)
がんセンターに在籍:55人(4.5%)
その他の病院に在籍:288人(23.4%)
病院以外に在籍(政府機関、研究機関、海外留学中など):33人(2.7%)
・都道府県がん診療連携拠点病院全49施設の中で、
がん薬物療法専門医がいない病院:1施設(2%)
がん薬物療法専門医が1人しかいない病院:3施設(6%)
がん薬物療法専門医が2人しかいない病院:8施設(16%)
がん薬物療法専門医が3人しかいない病院:6施設(12%)
→全体の1/3では専門医が3人以下
・地域がん診療連携拠点病院全350病院中、がん薬物療法専門医がいない病院は151施設(43.1%)
MMP1-3
呼吸器内科系薬物療法専門医の立場から
・首都圏のがんセンターに勤める肺癌領域のone of opinion leaderが発現
・先にしゃべった二人の演者、どちらにも賛成できない
・薬物療法の実務は、各臓器専門の腫瘍内科医が担当すべきだろう
・そもそも肺癌は、全体の75%が治癒不能で、外科医の出る幕はない
・術後補助化学療法を内科に依頼するにあたり、術後の5年生存割合や術後補助化学療法に期待できる効果について説明していない外科医が結構いて、信用できない
・プラチナ併用化学療法やUFTの術後補助療法なら、マンパワーがある程度ある外科ならできなくはないだろう
・術前化学療法となると、許容できる毒性や手術のタイミングを測るために、内科医と外科医の密な連携が欠かせない
・術前治療にこだわりすぎて、手術が出来なかったらなんにもならない
・今後周術期に抗がん薬、分子標的薬、免疫チェックポイント阻害薬が導入されたら、多分外科医では管理できなくなる
MMP1-4
皮膚科の立場から
・中部地方のがんセンターに勤める皮膚科医が発言
・皮膚科医は、免疫チェックポイント阻害薬を扱うようになって、考え方も考えられ方も変わった
昔の皮膚科医:
独自性が高く、閉鎖的な考え方を持ち、チーム医療には消極的
今の皮膚科医:がん薬物療法専門医のサポートをすることが多くなった
チーム医療に組み入れられるようになった
いろんな治療を見て、薬物療法への理解が進んだ
悪性黒色腫の治療を介して、他の診療科との連携が進んだ
がん薬物療法に対しては、駆け出し者の立場
昔の腫瘍内科医:
皮膚領域に対する関心が少ない、皮膚合併症は見過ごしがち、チーム医療には積極的
今の腫瘍内科医:
皮膚科医の治療をサポートしてくれる(治療選択、用量設定、有害事象管理など)
悪性黒色腫の治療に免疫チェックポイント阻害薬が導入されたことで、皮膚科領域への注目度が高まった
悪性黒色腫の患者の管理を手伝って、経験をつんで、自分たちの治療に活かそうと目論んでいる
あわよくば、悪性黒色腫の治療も皮膚科医から奪おうとしているきらいがある、縄張り荒らし
・免疫チェックポイント阻害薬と併用することで、皮膚合併症を起こしやすいとされる薬がある
去痰薬、プロトンポンプ阻害薬、ST合剤、抗痙攣薬、ベムラフェニブ、アレクチニブ
会員委員会企画
周術期化学療法におけるがん薬物療法専門医の役割
・・・結局のところ、各病院でルールを決めて取り組むべきことだ。
呼吸器内科医と呼吸器外科医は同じ呼吸器センターで働いていることが多いが、腫瘍内科医と呼吸器外科医は必ずしもそうではない。
いつも近くにいるかいないかというのは、結構大きな違いだと思う。
多分、他の領域でもそうではないだろうか。
「いつでも、face to faceで気楽に相談できる」というのが何より大切なのだ。
MMP1-1
外科系薬物療法専門医の立場から
・大きな大学病院の消化器外科医の先生が発言
・消化器外科系の臨床試験は術式検討のたゆまぬ繰り返し
・より低侵襲に、より効果的に
・外科医の殆どは、切除範囲を広げても癌は取り除けないし、治療成績は高まらないと漠然と考えている
・消化器外科の術前・術後には、消化器外科医でないと対応できないようなさまざまな合併症が待ち受けている
・諸問題に対応しようと思ったら、消化器外科医が薬物療法に習熟して一貫した治療を行うのが理にかなっている
MMP1-2
内科系薬物療法専門医の立場から
・大きな大学病院の腫瘍内科主任教授、臨床腫瘍学会のone of the leaderが発言
・外科とか内科とかこだわらず、それぞれの得意分野を活かしてチームとして取り組みましょう
・臓器横断的に、幅広い知識を有する臨床腫瘍医が治療に携わることは、メリットが大きい
・日本と韓国が一緒にやった、肝細胞がんに対するsorafenib療法の検証的試験
→日本では標準治療と差が出ず、韓国では圧倒的な差がついた
→患者背景も治療法も差がなく、唯一差があったのは、日本では非腫瘍内科医が、韓国では腫瘍内科医が患者を担当した
→日本の方が累積投与量が少なく、治療期間も短かった・・・有害事象をうまくマネジメントできなかったことが原因では?
・がん薬物療法専門医はそれなりに増えてきた
総数:1229人
都道府県がん診療拠点病院に在籍:326人(26.5%)
地域がん診療連携拠点病院に在籍:527人(42.9%)
がんセンターに在籍:55人(4.5%)
その他の病院に在籍:288人(23.4%)
病院以外に在籍(政府機関、研究機関、海外留学中など):33人(2.7%)
・都道府県がん診療連携拠点病院全49施設の中で、
がん薬物療法専門医がいない病院:1施設(2%)
がん薬物療法専門医が1人しかいない病院:3施設(6%)
がん薬物療法専門医が2人しかいない病院:8施設(16%)
がん薬物療法専門医が3人しかいない病院:6施設(12%)
→全体の1/3では専門医が3人以下
・地域がん診療連携拠点病院全350病院中、がん薬物療法専門医がいない病院は151施設(43.1%)
MMP1-3
呼吸器内科系薬物療法専門医の立場から
・首都圏のがんセンターに勤める肺癌領域のone of opinion leaderが発現
・先にしゃべった二人の演者、どちらにも賛成できない
・薬物療法の実務は、各臓器専門の腫瘍内科医が担当すべきだろう
・そもそも肺癌は、全体の75%が治癒不能で、外科医の出る幕はない
・術後補助化学療法を内科に依頼するにあたり、術後の5年生存割合や術後補助化学療法に期待できる効果について説明していない外科医が結構いて、信用できない
・プラチナ併用化学療法やUFTの術後補助療法なら、マンパワーがある程度ある外科ならできなくはないだろう
・術前化学療法となると、許容できる毒性や手術のタイミングを測るために、内科医と外科医の密な連携が欠かせない
・術前治療にこだわりすぎて、手術が出来なかったらなんにもならない
・今後周術期に抗がん薬、分子標的薬、免疫チェックポイント阻害薬が導入されたら、多分外科医では管理できなくなる
MMP1-4
皮膚科の立場から
・中部地方のがんセンターに勤める皮膚科医が発言
・皮膚科医は、免疫チェックポイント阻害薬を扱うようになって、考え方も考えられ方も変わった
昔の皮膚科医:
独自性が高く、閉鎖的な考え方を持ち、チーム医療には消極的
今の皮膚科医:がん薬物療法専門医のサポートをすることが多くなった
チーム医療に組み入れられるようになった
いろんな治療を見て、薬物療法への理解が進んだ
悪性黒色腫の治療を介して、他の診療科との連携が進んだ
がん薬物療法に対しては、駆け出し者の立場
昔の腫瘍内科医:
皮膚領域に対する関心が少ない、皮膚合併症は見過ごしがち、チーム医療には積極的
今の腫瘍内科医:
皮膚科医の治療をサポートしてくれる(治療選択、用量設定、有害事象管理など)
悪性黒色腫の治療に免疫チェックポイント阻害薬が導入されたことで、皮膚科領域への注目度が高まった
悪性黒色腫の患者の管理を手伝って、経験をつんで、自分たちの治療に活かそうと目論んでいる
あわよくば、悪性黒色腫の治療も皮膚科医から奪おうとしているきらいがある、縄張り荒らし
・免疫チェックポイント阻害薬と併用することで、皮膚合併症を起こしやすいとされる薬がある
去痰薬、プロトンポンプ阻害薬、ST合剤、抗痙攣薬、ベムラフェニブ、アレクチニブ
2017年07月28日
FLAURA positive!
ギリシャで生まれ、スペインでキャリアを積んでいるきれいな先生の講演を伺っていたら、シンガポールからやってきた先生が、
「昨日のプレスリリースで、FLAURAがpositiveになったって聞いたけど、あんたならこれからどうする?」
と質問された。
暑い中、神戸までお越しいただいてありがとうございます。
とても勉強になります。
昨日の今頃は、広東からお越しになった先生が第1世代、第2世代、第3世代のEGFR阻害薬を整理してお話ししてくださったけれど、1日にして適応を考え直さねばならなくなった。
もっとも、薬事承認されるまではまだ時間があるけれど、心の準備を整えておかなければ。
これで、gefitinibとerlotinibの出番は少なくなりそうだ。
osimertinibとdacomitinibが一次治療から使えるようになったら、afatinibの立ち位置も難しくなるだろう。
Tagrisso significantly improves progression-free survival in the Phase III FLAURA trial for lung cancer
27 July 2017
→https://www.astrazeneca.com/media-centre/press-releases/2017/tagrisso-significantly-improves-progression-free-survival-in-the-phase-iii-flaura-trial-for-lung-cancer-27072017.html
タグリッソは、第III相試験であるFLAURA試験において、EGFR遺伝子変異陽性の局所進行・進行非小細胞肺癌に対する一次治療で、主要評価項目である無増悪生存期間について、標準治療(erlotinibまたはgefitinib)に対して統計学的に有意な、そして臨床的に意味のある延長を達成した。効果・安全性・忍容性についてのプロファイルは、タグリッソ、erlotinib、gefitinibともに既知の内容と変わりなかった。FLAURA試験の評価は現在も継続しており、今後の各種学会で詳細な結果が公表される予定だ。
FLAURA試験は、未治療のEGFR遺伝子変異陽性局所進行・進行非小細胞肺癌患者を対象に、タグリッソ療法と標準療法(erlotinibまたはgefitinib)の効果を比較する、二重盲検無作為化第III相試験であり、30ヶ国から556人の患者が参加した。主要評価項目は無増悪生存期間で、副次評価項目は全生存期間、奏効割合、奏効持続期間、病勢コントロール割合、安全性、健康関連QoLである。
「昨日のプレスリリースで、FLAURAがpositiveになったって聞いたけど、あんたならこれからどうする?」
と質問された。
暑い中、神戸までお越しいただいてありがとうございます。
とても勉強になります。
昨日の今頃は、広東からお越しになった先生が第1世代、第2世代、第3世代のEGFR阻害薬を整理してお話ししてくださったけれど、1日にして適応を考え直さねばならなくなった。
もっとも、薬事承認されるまではまだ時間があるけれど、心の準備を整えておかなければ。
これで、gefitinibとerlotinibの出番は少なくなりそうだ。
osimertinibとdacomitinibが一次治療から使えるようになったら、afatinibの立ち位置も難しくなるだろう。
Tagrisso significantly improves progression-free survival in the Phase III FLAURA trial for lung cancer
27 July 2017
→https://www.astrazeneca.com/media-centre/press-releases/2017/tagrisso-significantly-improves-progression-free-survival-in-the-phase-iii-flaura-trial-for-lung-cancer-27072017.html
タグリッソは、第III相試験であるFLAURA試験において、EGFR遺伝子変異陽性の局所進行・進行非小細胞肺癌に対する一次治療で、主要評価項目である無増悪生存期間について、標準治療(erlotinibまたはgefitinib)に対して統計学的に有意な、そして臨床的に意味のある延長を達成した。効果・安全性・忍容性についてのプロファイルは、タグリッソ、erlotinib、gefitinibともに既知の内容と変わりなかった。FLAURA試験の評価は現在も継続しており、今後の各種学会で詳細な結果が公表される予定だ。
FLAURA試験は、未治療のEGFR遺伝子変異陽性局所進行・進行非小細胞肺癌患者を対象に、タグリッソ療法と標準療法(erlotinibまたはgefitinib)の効果を比較する、二重盲検無作為化第III相試験であり、30ヶ国から556人の患者が参加した。主要評価項目は無増悪生存期間で、副次評価項目は全生存期間、奏効割合、奏効持続期間、病勢コントロール割合、安全性、健康関連QoLである。
2017年07月28日
ICIsのシンポジウム
2017年7月28日 日本臨床腫瘍学会2日目(神戸市)
肺癌と免疫チェックポイント阻害薬に関する国際シンポジウム。
遅刻したため、残念ながら最初の2演題は聞き逃してしまった。
ISY 8-3
Possible biomarker for immune checkpoint inhibitor
・CheckMate 071, 057とKEYNOTE 024のsurvival curveの供覧
・抗PD-1抗体の効果とPD-L1発現の関係に関する総説
→Grigg et al.,J Immunother Cancer. 2016 Aug 16;4:48
→https://www.ncbi.nlm.nih.gov/pubmed/27532023
・Rizvi et al., Science 2015, 124-128
・国立がん研究センター東病院と大阪大学病院外科で2014年から2016年に完全切除された肺癌患者のうち、49人について切除肺と血液サンプルを検証
・扁平上皮癌21人、非扁平上皮癌28人
・CD8陽性T細胞の浸潤、PD-L1の発現、tumor mutational burdenはいずれも扁平上皮癌の方で有意に高度だった
・biomarkerとして有用そうな"factor X"について研究を進めているとのこと
ISY 8-4
Management of adverse event due to ICIs - via clinical experiences -
・ICIs(almost Nivolumab)のadverse event
common: rash, arthralgia, thyroid dysfunction
uncommon, but severe: colitis, pneumonitis, hypophysitis, type I DM
・colitis
CT scan can detect early phase of colitis (if symptoms presented).
PSL 1mg/kg/day, infliximab
・pneumonitis
prevalence in Japan
all grade: 58/1005=5.8%
>Grade 3: 34/1005=3.4%
Grade 5: 7/1005=0.7%
PSL, CPA, CsA
→Kenmotsu et al., ASCO 2017 abst.#9078
→Kato et al., ASCO 2017 abst.#9077
・hepatitis
mycophenolate mophetil
・thyroiditis
Use βblocker if hyperthyroidism with aparent symptoms
・hypophysitis
evaluation for fT3 or fT4, cortisol, ACTH at pre- and inter-treatment
TSH high, fT3 or fT4 normal: hypothyroidism
TSH low, fT3 or fT4 normal: hyperthyroidism
TSH normal, fT3 or fT4 normal: euthyroid or hypophysitis
symptoms: malaise, myalgia(on limb), diarrhea, hypereosinophilia etc.
・early onset ir-AEs are refered to favorable effects
治療開始後早期に甲状腺機能異常があると、治療効果も高い
→Osorio et al., Ann Oncol. 2017 Mar 1;28(3):583-589
→https://www.ncbi.nlm.nih.gov/pubmed/27998967
肺癌と免疫チェックポイント阻害薬に関する国際シンポジウム。
遅刻したため、残念ながら最初の2演題は聞き逃してしまった。
ISY 8-3
Possible biomarker for immune checkpoint inhibitor
・CheckMate 071, 057とKEYNOTE 024のsurvival curveの供覧
・抗PD-1抗体の効果とPD-L1発現の関係に関する総説
→Grigg et al.,J Immunother Cancer. 2016 Aug 16;4:48
→https://www.ncbi.nlm.nih.gov/pubmed/27532023
・Rizvi et al., Science 2015, 124-128
・国立がん研究センター東病院と大阪大学病院外科で2014年から2016年に完全切除された肺癌患者のうち、49人について切除肺と血液サンプルを検証
・扁平上皮癌21人、非扁平上皮癌28人
・CD8陽性T細胞の浸潤、PD-L1の発現、tumor mutational burdenはいずれも扁平上皮癌の方で有意に高度だった
・biomarkerとして有用そうな"factor X"について研究を進めているとのこと
ISY 8-4
Management of adverse event due to ICIs - via clinical experiences -
・ICIs(almost Nivolumab)のadverse event
common: rash, arthralgia, thyroid dysfunction
uncommon, but severe: colitis, pneumonitis, hypophysitis, type I DM
・colitis
CT scan can detect early phase of colitis (if symptoms presented).
PSL 1mg/kg/day, infliximab
・pneumonitis
prevalence in Japan
all grade: 58/1005=5.8%
>Grade 3: 34/1005=3.4%
Grade 5: 7/1005=0.7%
PSL, CPA, CsA
→Kenmotsu et al., ASCO 2017 abst.#9078
→Kato et al., ASCO 2017 abst.#9077
・hepatitis
mycophenolate mophetil
・thyroiditis
Use βblocker if hyperthyroidism with aparent symptoms
・hypophysitis
evaluation for fT3 or fT4, cortisol, ACTH at pre- and inter-treatment
TSH high, fT3 or fT4 normal: hypothyroidism
TSH low, fT3 or fT4 normal: hyperthyroidism
TSH normal, fT3 or fT4 normal: euthyroid or hypophysitis
symptoms: malaise, myalgia(on limb), diarrhea, hypereosinophilia etc.
・early onset ir-AEs are refered to favorable effects
治療開始後早期に甲状腺機能異常があると、治療効果も高い
→Osorio et al., Ann Oncol. 2017 Mar 1;28(3):583-589
→https://www.ncbi.nlm.nih.gov/pubmed/27998967
2017年07月28日
T-DM1 for HER2 positive NSCLC
2017年7月27日 日本臨床腫瘍学会総会(神戸市)
O1-5-6:HER2陽性非小細胞肺癌に対するT-DM1の第2相試験
・HER2陽性の患者はIHC+++ or IHC++かつFISH+ or Exon 20 mutation+の患者
・主要評価項目は奏効割合
・副次評価項目は有害事象、全生存期間、無増悪生存期間など
・閾値奏効割合は10%、期待奏効割合は30%、α=0.05、β=0.20
・予定患者数は30人とし、15人を集積した段階で中間解析を実施
・年齢中央値は67歳(45歳から77歳)
・男性7人、女性8人
・15人すべてが腺癌
・IHC+++ / IHC++かつFISH+ / Exon 20 mutation = 5 / 3 / 7
・EGFR遺伝子変異陽性患者が2人含まれていた
・CR 0人、PR 1人、奏効割合 6.7%で無効中止となった
・PRの患者も、あまり長く効果は続かなかった
O1-5-6:HER2陽性非小細胞肺癌に対するT-DM1の第2相試験
・HER2陽性の患者はIHC+++ or IHC++かつFISH+ or Exon 20 mutation+の患者
・主要評価項目は奏効割合
・副次評価項目は有害事象、全生存期間、無増悪生存期間など
・閾値奏効割合は10%、期待奏効割合は30%、α=0.05、β=0.20
・予定患者数は30人とし、15人を集積した段階で中間解析を実施
・年齢中央値は67歳(45歳から77歳)
・男性7人、女性8人
・15人すべてが腺癌
・IHC+++ / IHC++かつFISH+ / Exon 20 mutation = 5 / 3 / 7
・EGFR遺伝子変異陽性患者が2人含まれていた
・CR 0人、PR 1人、奏効割合 6.7%で無効中止となった
・PRの患者も、あまり長く効果は続かなかった
2017年07月28日
再生検がらみのポスター発表まとめ
2017年7月27日 日本臨床腫瘍学会総会(神戸市)
P1-122:当院におけるRe-biopsyの現状と問題点
腫瘍検体を用いたcobas法での検索と、血漿検体を用いたMBP-QP法での検索の比較
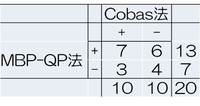
結果の一致率は11/20=55%
P1-123:EGFR遺伝子変異陽性非小細胞肺癌に対する再生検の後方視的検討
・56人を対象とした
・治療歴はgefitinib 18人、erlotinib 15人、afatinib 8人
・T790M陽性者は20人(36%)
・再生検の前後で組織型が変化したのは3人(5%)で、腺癌→小細胞癌が1人、腺癌→扁平上皮癌が1人、腺癌→大細胞神経内分泌癌が1人
P1-126:組織型転化を来たしたEGFR陽性肺癌症例の臨床的検討
・Ex.19 deletionの腺癌がEx.19 deletionの扁平上皮癌へ
・Ex.21+de novo T790Mの腺癌がEx.21+T790Mの扁平上皮癌へ
・Ex.19 deletionの腺癌がEx.19 deletionの小細胞癌へ(肝生検でも腰椎穿刺でも同じ結果だった)
・Ex.19 deletionの腺癌がEx.19 deletionの混合型小細胞癌(腺癌+小細胞癌)へ
P1-129:呼吸器内視鏡下再生検による耐性遺伝子T790Mの検出
・28人を対象とした
・腺癌26人、扁平上皮癌1人、小細胞癌1人
・再生検でT790M陽性と確認したのは10人(全体の38.5%)
・再々生検でT790M陽性と確認したのは3人、これを合わせると、T790M陽性患者は全体の48.1%)
P1-130:EGFR変異陽性非小細胞肺癌に対する、初回TKIとしてのアファチニブ投与例におけるT790M変異出現頻度の検討
・13施設での共同研究
・対象となった患者40人に再生検を行い、腫瘍細胞を採取できたのは37人
・Ex.19 deletion / Ex.21 point mutation / others = 21 / 13 / 3
・T790M陽性は16 / 37 = 43.2%
・Ex.19 deletionの患者でT790M陽性だったのは5人(23.8%)
・Ex.21 point mutationの患者でT790M陽性だったのは11人(84.6%)
・minor mutationの患者ではT790M検出されず
P1-166:非小細胞肺癌症例におけるEGFR遺伝子変異のモニタリング
・17人を対象とした
・腺癌15人、扁平上皮癌1人、NOS1人
・再生検時も組織型は変化なし
・T790Mは7人で陽性(41%)、そのうち、前治療がgefitinibだったのは6人、erlotinibだったのは1人
P1-122:当院におけるRe-biopsyの現状と問題点
腫瘍検体を用いたcobas法での検索と、血漿検体を用いたMBP-QP法での検索の比較

結果の一致率は11/20=55%
P1-123:EGFR遺伝子変異陽性非小細胞肺癌に対する再生検の後方視的検討
・56人を対象とした
・治療歴はgefitinib 18人、erlotinib 15人、afatinib 8人
・T790M陽性者は20人(36%)
・再生検の前後で組織型が変化したのは3人(5%)で、腺癌→小細胞癌が1人、腺癌→扁平上皮癌が1人、腺癌→大細胞神経内分泌癌が1人
P1-126:組織型転化を来たしたEGFR陽性肺癌症例の臨床的検討
・Ex.19 deletionの腺癌がEx.19 deletionの扁平上皮癌へ
・Ex.21+de novo T790Mの腺癌がEx.21+T790Mの扁平上皮癌へ
・Ex.19 deletionの腺癌がEx.19 deletionの小細胞癌へ(肝生検でも腰椎穿刺でも同じ結果だった)
・Ex.19 deletionの腺癌がEx.19 deletionの混合型小細胞癌(腺癌+小細胞癌)へ
P1-129:呼吸器内視鏡下再生検による耐性遺伝子T790Mの検出
・28人を対象とした
・腺癌26人、扁平上皮癌1人、小細胞癌1人
・再生検でT790M陽性と確認したのは10人(全体の38.5%)
・再々生検でT790M陽性と確認したのは3人、これを合わせると、T790M陽性患者は全体の48.1%)
P1-130:EGFR変異陽性非小細胞肺癌に対する、初回TKIとしてのアファチニブ投与例におけるT790M変異出現頻度の検討
・13施設での共同研究
・対象となった患者40人に再生検を行い、腫瘍細胞を採取できたのは37人
・Ex.19 deletion / Ex.21 point mutation / others = 21 / 13 / 3
・T790M陽性は16 / 37 = 43.2%
・Ex.19 deletionの患者でT790M陽性だったのは5人(23.8%)
・Ex.21 point mutationの患者でT790M陽性だったのは11人(84.6%)
・minor mutationの患者ではT790M検出されず
P1-166:非小細胞肺癌症例におけるEGFR遺伝子変異のモニタリング
・17人を対象とした
・腺癌15人、扁平上皮癌1人、NOS1人
・再生検時も組織型は変化なし
・T790Mは7人で陽性(41%)、そのうち、前治療がgefitinibだったのは6人、erlotinibだったのは1人
2017年07月27日
分子標的治療薬の臨床試験デザイン
2017年7月27日 日本臨床腫瘍学会総会総会(神戸市)
<教育講演1>分子標的治療の臨床試験デザイン
・biomarker driven trial designは治療効果を見るのが常に第一義であり、毒性評価その他は副次的
・exprolatory phase II
・confirmatory phase III
・seamless phase II / III
・credential of biomarker=「biomarkerがあてになる度合い」
Benefits are limited to biomarker positive population or not?
・biomarkerと効果の関連性はvery strong / strong / weak / noneで評価
・adaptive parallel Simon two state design
biomarker positive populationとbiomarker negative populationで別々にphase II studyを走らせる
・phase II / III tandem two stage design
phase II for all comers→interim analysis→promising results→phase III for all comers
phase II for all comers→interim analysis→results not promising→phase II for biomarker positive population→interim analysis→promising results→phase III for biomarker positive population only
・マスタープロトコールに関する総説
→Woodcock et al., N Engl J Med. 2017 Jul 6;377(1):62-70
→https://www.ncbi.nlm.nih.gov/pubmed/28679092
・phase III enrichment design
biomarker stratified design: biomarker positive populationでもnegative polutationでもstudyを組む
biomarker positive populationでpositive study, negative populationでnegative studyとなればbiomarkerに意味がありそう
どちらのpopulationでも結果が同じなら、biomarkerの存在意義はなさそう
・phase III sequential subgroup specific design
all comerでphase III studyをし, まずbiomarker positive populationのみで解析→negativeなら開発終了、positiveならbiomarker negative populationのみで再解析→positiveならall comerでpositiveと判断、negativeならbiomarker positive populationのみでpositive
この際、第二段階の解析でall comersでの再解析をしたら、biomarker positive populationでの差が大きかった場合に誤った結論を招く可能性があるので要注意
・basket trial: multi-disease, single target
master protocol→各臓器別にsingle arm phase II study
FDAがmicro satellite instability(+)で臓器横断的にICIsを承認したのは、basket trialの賜物
・umbrella trial: single disease, multi target
・NCI-MATCH trialはmulti-disease, multi-target
<教育講演1>分子標的治療の臨床試験デザイン
・biomarker driven trial designは治療効果を見るのが常に第一義であり、毒性評価その他は副次的
・exprolatory phase II
・confirmatory phase III
・seamless phase II / III
・credential of biomarker=「biomarkerがあてになる度合い」
Benefits are limited to biomarker positive population or not?
・biomarkerと効果の関連性はvery strong / strong / weak / noneで評価
・adaptive parallel Simon two state design
biomarker positive populationとbiomarker negative populationで別々にphase II studyを走らせる
・phase II / III tandem two stage design
phase II for all comers→interim analysis→promising results→phase III for all comers
phase II for all comers→interim analysis→results not promising→phase II for biomarker positive population→interim analysis→promising results→phase III for biomarker positive population only
・マスタープロトコールに関する総説
→Woodcock et al., N Engl J Med. 2017 Jul 6;377(1):62-70
→https://www.ncbi.nlm.nih.gov/pubmed/28679092
・phase III enrichment design
biomarker stratified design: biomarker positive populationでもnegative polutationでもstudyを組む
biomarker positive populationでpositive study, negative populationでnegative studyとなればbiomarkerに意味がありそう
どちらのpopulationでも結果が同じなら、biomarkerの存在意義はなさそう
・phase III sequential subgroup specific design
all comerでphase III studyをし, まずbiomarker positive populationのみで解析→negativeなら開発終了、positiveならbiomarker negative populationのみで再解析→positiveならall comerでpositiveと判断、negativeならbiomarker positive populationのみでpositive
この際、第二段階の解析でall comersでの再解析をしたら、biomarker positive populationでの差が大きかった場合に誤った結論を招く可能性があるので要注意
・basket trial: multi-disease, single target
master protocol→各臓器別にsingle arm phase II study
FDAがmicro satellite instability(+)で臓器横断的にICIsを承認したのは、basket trialの賜物
・umbrella trial: single disease, multi target
・NCI-MATCH trialはmulti-disease, multi-target
2017年07月27日
日本臨床腫瘍学会2017日記その1
2017年7月27日 日本臨床腫瘍学会総会(神戸市)
ISY 1-1
: Innate resistance in EGFR mutant non-small cell lung cancer patients by co-activation of receptor tyrosine kinases(RTKs).
・演者は、教授の代わりにやってきたスペインの綺麗なお姉さん
・スペインでは腺癌全体の15-16%にEGFR遺伝子変異が見られる
・BELIEF studyでは、完全奏効に至ったのは全体の5%ほど
→Rosell et al, Lancet Resp Med 2017 May;5(5):435-444, →https://www.ncbi.nlm.nih.gov/pubmed/28408243
・EGFR遺伝子変異陽性の肺癌は完全にoncogene addictedというわけではなく、他にも様々な初期耐性機構が存在する
→STAT3, YAP1, etc.
→Chaib, et al., J Natl Cancer Inst. 2017 Sep 1;109(9).
→https://www.ncbi.nlm.nih.gov/pubmed/28376152
→Codony-Selvat et al., Oncotarget. 2017 May 4. Epub ahead of print.
→https://www.ncbi.nlm.nih.gov/pubmed/28521301
・STAT3はJAK2 pathwayの下流にあり、これまでのTKIでは制御できない
・TPCA-1(STAT3の阻害薬)、AZD0530(SRC阻害薬)はいずれもEGFR-TKIと併用するとin vitroでは腫瘍制御活性を示すものの、臨床では毒性が強くて使えない
・Alternative EGFR signaling: HGF
→Gusenbauer et al., Oncogene. 2013 Aug 15;32(33):3846-56
→https://www.ncbi.nlm.nih.gov/pubmed/23045285
・AXL EGFR familyはYAP1の下流域にある
→https://www.ncbi.nlm.nih.gov/pubmed/25739674
・BMS777604: Baumann et al., Molecular Oncology in press.
・TPX-0005(STAT3阻害薬)の臨床試験
→https://clinicaltrials.gov/ct2/show/NCT03093116?term=trident&draw=1&rank=9
・AZD0530(SRC阻害薬)・・・単剤では開発がストップしているようだが・・・
ISY 1-2
:How to use various EGFR-TKIs differently
・演者は、広東からやってきたえらい先生
・なぜか"th"の発音がみんな"s"や"sh"で、わかりやすい英語でしゃべってくださるので、とても親近感が持てた
・各世代EGFR阻害薬の比較

・ARCHER1050: Dacomitinib vs Gefitinib for naive EGFRm+ NSCLC phase III
→Mok et al., ASCO 2017
脳転移を有する患者は対象に含まず
mPFsはDacomitinib 14.7ヶ月 vs Gefitinib 9.2ヶ月、HR 0.59(0.47-0.74),p<0.0001
2年PFS rateはDacomitinib 30.6% vs Gefitinib 9.6%
治療開始後6ヶ月まではほぼ同等
EGFR subtype別の解析やOSの解析はこれから
・BRAIN study: Icotinib vs 全脳照射 for EGFRm+ and brain meta. phase III
→Yang et al., Lancet Respir Med. 2017 Jul 19, Epub ahead of print
→https://www.ncbi.nlm.nih.gov/pubmed/28734822
・BLOOM study: brain meta. and AZD3759
→Ahn et al., ASCO 2017 abst. #2006
→http://abstracts.asco.org/199/AbstView_199_181288.html
・脳転移を有するoncogene addictedの患者とTKI
→Martinez et al., JAMA Oncol. 2017 May 18, Epub ahead of print
https://www.ncbi.nlm.nih.gov/pubmed/28520828
ISY 1-3
:Possibility of combination therapy with EGFR-TKI in EGFR mutant NSCLC
・BELIEF studyではEGFRm+の患者に対してErlotinibとBevacizumabの併用療法が試されたが、de novo T790M+の患者の方が、T790M-の患者よりも治療効果が高かった
→全体でのmPFSは13.2ヶ月、de novo T790M+だと16ヶ月、T790M-だと10.5ヶ月
・TKIとERK pathway阻害薬(TAK, selumetinibなど)の併用
・ErlotinibとAtezolizumabの併用試験では、G3/4の毒性が全体の57%に上った
ISY 1-4
:Drug repurposing, overcoming drug resistance mutation with tyrosine kinase inhibitor for different target
・double resistant mutation(T790M+C797S)にどう対応していくのか
・Brigatinib can overcome C797S
・Brigatinib + Cetuximab
・Brigatinib + Panitumumab
ISY 1-1
: Innate resistance in EGFR mutant non-small cell lung cancer patients by co-activation of receptor tyrosine kinases(RTKs).
・演者は、教授の代わりにやってきたスペインの綺麗なお姉さん
・スペインでは腺癌全体の15-16%にEGFR遺伝子変異が見られる
・BELIEF studyでは、完全奏効に至ったのは全体の5%ほど
→Rosell et al, Lancet Resp Med 2017 May;5(5):435-444, →https://www.ncbi.nlm.nih.gov/pubmed/28408243
・EGFR遺伝子変異陽性の肺癌は完全にoncogene addictedというわけではなく、他にも様々な初期耐性機構が存在する
→STAT3, YAP1, etc.
→Chaib, et al., J Natl Cancer Inst. 2017 Sep 1;109(9).
→https://www.ncbi.nlm.nih.gov/pubmed/28376152
→Codony-Selvat et al., Oncotarget. 2017 May 4. Epub ahead of print.
→https://www.ncbi.nlm.nih.gov/pubmed/28521301
・STAT3はJAK2 pathwayの下流にあり、これまでのTKIでは制御できない
・TPCA-1(STAT3の阻害薬)、AZD0530(SRC阻害薬)はいずれもEGFR-TKIと併用するとin vitroでは腫瘍制御活性を示すものの、臨床では毒性が強くて使えない
・Alternative EGFR signaling: HGF
→Gusenbauer et al., Oncogene. 2013 Aug 15;32(33):3846-56
→https://www.ncbi.nlm.nih.gov/pubmed/23045285
・AXL EGFR familyはYAP1の下流域にある
→https://www.ncbi.nlm.nih.gov/pubmed/25739674
・BMS777604: Baumann et al., Molecular Oncology in press.
・TPX-0005(STAT3阻害薬)の臨床試験
→https://clinicaltrials.gov/ct2/show/NCT03093116?term=trident&draw=1&rank=9
・AZD0530(SRC阻害薬)・・・単剤では開発がストップしているようだが・・・
ISY 1-2
:How to use various EGFR-TKIs differently
・演者は、広東からやってきたえらい先生
・なぜか"th"の発音がみんな"s"や"sh"で、わかりやすい英語でしゃべってくださるので、とても親近感が持てた
・各世代EGFR阻害薬の比較

・ARCHER1050: Dacomitinib vs Gefitinib for naive EGFRm+ NSCLC phase III
→Mok et al., ASCO 2017
脳転移を有する患者は対象に含まず
mPFsはDacomitinib 14.7ヶ月 vs Gefitinib 9.2ヶ月、HR 0.59(0.47-0.74),p<0.0001
2年PFS rateはDacomitinib 30.6% vs Gefitinib 9.6%
治療開始後6ヶ月まではほぼ同等
EGFR subtype別の解析やOSの解析はこれから
・BRAIN study: Icotinib vs 全脳照射 for EGFRm+ and brain meta. phase III
→Yang et al., Lancet Respir Med. 2017 Jul 19, Epub ahead of print
→https://www.ncbi.nlm.nih.gov/pubmed/28734822
・BLOOM study: brain meta. and AZD3759
→Ahn et al., ASCO 2017 abst. #2006
→http://abstracts.asco.org/199/AbstView_199_181288.html
・脳転移を有するoncogene addictedの患者とTKI
→Martinez et al., JAMA Oncol. 2017 May 18, Epub ahead of print
https://www.ncbi.nlm.nih.gov/pubmed/28520828
ISY 1-3
:Possibility of combination therapy with EGFR-TKI in EGFR mutant NSCLC
・BELIEF studyではEGFRm+の患者に対してErlotinibとBevacizumabの併用療法が試されたが、de novo T790M+の患者の方が、T790M-の患者よりも治療効果が高かった
→全体でのmPFSは13.2ヶ月、de novo T790M+だと16ヶ月、T790M-だと10.5ヶ月
・TKIとERK pathway阻害薬(TAK, selumetinibなど)の併用
・ErlotinibとAtezolizumabの併用試験では、G3/4の毒性が全体の57%に上った
ISY 1-4
:Drug repurposing, overcoming drug resistance mutation with tyrosine kinase inhibitor for different target
・double resistant mutation(T790M+C797S)にどう対応していくのか
・Brigatinib can overcome C797S
・Brigatinib + Cetuximab
・Brigatinib + Panitumumab
2017年07月16日
lorlatinib phase I / II study
ALK阻害薬の第I世代をcrizotinib、第II世代をalectinib、ceritinibとすると、第III世代のlorlatinibの開発が進んでいるようだ。
ALK阻害薬は、中枢神経移行の良さが問われることが多いのだが、lorlatinibはその点が優れているよう。
一方で、会話障害や注意力障害といった、認知症を思わせるような珍しい有害事象も報告されている。
以下の報告には記載されていないが、実地臨床に導入された場合には、それなりに問題視されるだろう。
Efficacy and safety of lorlatinib in patients (pts) with ALK+ non-small cell lung cancer (NSCLC) with one or more prior ALK tyrosine kinase inhibitor (TKI): A phase I/II study.
AT Shaw et l., ASCO 2017 abst.#9006
背景:lorlatinibは選択的で、中枢神経移行の良い、次世代のALK / ROS1チロシンキナーゼ阻害薬である。既知の殆どの耐性遺伝子変異に対して有効とされる。第I相試験、および今回報告する第II相試験では、既治療で中枢神経病変を有するALK / ROS1陽性進行非小細胞肺がん患者が多数を占める中で、lorlatnibは確固たる臨床効果を示した。第II相部分において、安全性と有効性を検証した。
方法:現在も進行中である第II相試験では、中枢神経病変に関連した症状の有無を問わず、また中枢神経病変に対する未治療・既治療を問わず、ALK陽性 / ROS1陽性非小細胞費肺がん患者を対象として、6つの拡大コホートに組み入れた(コホート1-5はALK陽性患者、コホート6はROS1陽性患者)。患者はlorlatinibを100mg/日、1日1回内服した。主要評価項目は奏効割合(ORR)と中枢神経関連奏効割合(IC-ORR)とした。
結果:今回の効果判定対象は、ALK陽性の既治療患者に限定した。データカットオフを2016年8月15日に行った。82人のALK陽性患者をコホート2-5に割り付けた。2016年3月31日までに治療を開始した患者を効果判定対象とした。52人がIC-ORRの評価対象となり、うち35人は標的病変(5mm以上の病変で、放射線治療歴がないか、放射線治療後に増大したもの)のみで奏効を判定した。次表に要約する。

コホート2:前治療はcrizotinibのみ
コホート3:前治療はcrizotinib+化学療法、もしくはcrizotinib以外のALK阻害薬1剤±化学療法
コホート4:前治療はALK阻害薬2剤±化学療法
コホート5:前治療はALK阻害薬3剤±化学療法
116人のALK陽性 / ROS1陽性進行非小細胞肺がん患者が安全性評価対象となった。以下、(全グレード、グレード3 /4)として有害事象を記載する。最も頻度の高かった有害事象は高コレステロール血症(90%, 17%)と高中性脂肪血症(72%, 17%)だった。治療中断もしくは減量につながる有害事象はそれぞれ29%, 20%報告された。14%の患者は、重篤な有害事象を経験した。5人(4%)は有害事象により治療中断に至ったが、治療関連死はなかった。データカットオフ時点で、116人中74人(64%)はlorlatinibを継続していた。
ALK阻害薬は、中枢神経移行の良さが問われることが多いのだが、lorlatinibはその点が優れているよう。
一方で、会話障害や注意力障害といった、認知症を思わせるような珍しい有害事象も報告されている。
以下の報告には記載されていないが、実地臨床に導入された場合には、それなりに問題視されるだろう。
Efficacy and safety of lorlatinib in patients (pts) with ALK+ non-small cell lung cancer (NSCLC) with one or more prior ALK tyrosine kinase inhibitor (TKI): A phase I/II study.
AT Shaw et l., ASCO 2017 abst.#9006
背景:lorlatinibは選択的で、中枢神経移行の良い、次世代のALK / ROS1チロシンキナーゼ阻害薬である。既知の殆どの耐性遺伝子変異に対して有効とされる。第I相試験、および今回報告する第II相試験では、既治療で中枢神経病変を有するALK / ROS1陽性進行非小細胞肺がん患者が多数を占める中で、lorlatnibは確固たる臨床効果を示した。第II相部分において、安全性と有効性を検証した。
方法:現在も進行中である第II相試験では、中枢神経病変に関連した症状の有無を問わず、また中枢神経病変に対する未治療・既治療を問わず、ALK陽性 / ROS1陽性非小細胞費肺がん患者を対象として、6つの拡大コホートに組み入れた(コホート1-5はALK陽性患者、コホート6はROS1陽性患者)。患者はlorlatinibを100mg/日、1日1回内服した。主要評価項目は奏効割合(ORR)と中枢神経関連奏効割合(IC-ORR)とした。
結果:今回の効果判定対象は、ALK陽性の既治療患者に限定した。データカットオフを2016年8月15日に行った。82人のALK陽性患者をコホート2-5に割り付けた。2016年3月31日までに治療を開始した患者を効果判定対象とした。52人がIC-ORRの評価対象となり、うち35人は標的病変(5mm以上の病変で、放射線治療歴がないか、放射線治療後に増大したもの)のみで奏効を判定した。次表に要約する。

コホート2:前治療はcrizotinibのみ
コホート3:前治療はcrizotinib+化学療法、もしくはcrizotinib以外のALK阻害薬1剤±化学療法
コホート4:前治療はALK阻害薬2剤±化学療法
コホート5:前治療はALK阻害薬3剤±化学療法
116人のALK陽性 / ROS1陽性進行非小細胞肺がん患者が安全性評価対象となった。以下、(全グレード、グレード3 /4)として有害事象を記載する。最も頻度の高かった有害事象は高コレステロール血症(90%, 17%)と高中性脂肪血症(72%, 17%)だった。治療中断もしくは減量につながる有害事象はそれぞれ29%, 20%報告された。14%の患者は、重篤な有害事象を経験した。5人(4%)は有害事象により治療中断に至ったが、治療関連死はなかった。データカットオフ時点で、116人中74人(64%)はlorlatinibを継続していた。
2017年07月16日
ALK陽性肺がんにALK阻害薬が効かなくなったらどうするか
ALK陽性肺がんの患者さんからご相談があった。
診断がついてからALK阻害薬を順次使用して、現在は治験中のLorlatinibを使っているとのこと。
ただし、治療効果が鈍りつつある様子。
ALK陽性肺がんは、治療が効かなくなった際の耐性化機序が多彩だ。
そして、その耐性化機序によって、次に使うべき薬がかわってくる。
残念ながら、各患者の耐性化機序を明らかにして、つぎの治療に生かす、というところまで、実地診療は追いついていない。
そんな中、今ならどんなことが出来るのか、考えてみた。
1)耐性化機序を明らかにするために再生検をして、ALK融合遺伝子検査をやり直す
保険適応外のPCR検査やLC-SCRUM、OncoPrime、大学などの研究機関を利用しないと、ALK融合遺伝子の種類までは判明しない
以下のリンクに示した研究機関なら、実費で(場合によっては再生検でなく、リキッドバイオプシーでも)調べてくれるかもしれない
http://oitahaiganpractice.junglekouen.com/e884316.html
2)耐性化機序がわかったら、それに見合った薬を使う
もし1)を経て耐性化機序が判明したら、それに見合った薬に切り替えることで、効果が期待できるかもしれない
Lorlatinibはかなり広範な耐性化機序をカバーするとされているが、Lorlatinib耐性化後のcrizotinibが効いた、という症例報告があり、実際に国内でも同じような現象が確認されているらしい
crizotinib, alectinib, ceritinib, brigatinib, lorlatinibの交代療法なんて概念が、まことしやかにささやかれているそうだ。
http://oitahaiganpractice.junglekouen.com/e833200.html
http://oitahaiganpractice.junglekouen.com/e904105.html
3)耐性化機序がわからなかったら、一度はpemetrexedを含む化学療法を試してみる
ALK陽性肺がんには、pemetrexedが高い効果を示すことが知られている
ALK阻害薬が効きにくくなったとしても、一度はトライしてみたい
その後に分子標的薬に再トライする、という考え方もありだろう
ALK陽性肺がんはなんといっても患者数が少ないため、EGFR陽性肺がん、PD-L1陽性肺がんに比べると実地臨床が変わっていくスピードが緩やかだろうと予測される。
ベストの診療にめぐり合いたいと考えるなら、ときには保険適応外の検査を受けた上で次の診療を模索することも選択肢だろう。
診断がついてからALK阻害薬を順次使用して、現在は治験中のLorlatinibを使っているとのこと。
ただし、治療効果が鈍りつつある様子。
ALK陽性肺がんは、治療が効かなくなった際の耐性化機序が多彩だ。
そして、その耐性化機序によって、次に使うべき薬がかわってくる。
残念ながら、各患者の耐性化機序を明らかにして、つぎの治療に生かす、というところまで、実地診療は追いついていない。
そんな中、今ならどんなことが出来るのか、考えてみた。
1)耐性化機序を明らかにするために再生検をして、ALK融合遺伝子検査をやり直す
保険適応外のPCR検査やLC-SCRUM、OncoPrime、大学などの研究機関を利用しないと、ALK融合遺伝子の種類までは判明しない
以下のリンクに示した研究機関なら、実費で(場合によっては再生検でなく、リキッドバイオプシーでも)調べてくれるかもしれない
http://oitahaiganpractice.junglekouen.com/e884316.html
2)耐性化機序がわかったら、それに見合った薬を使う
もし1)を経て耐性化機序が判明したら、それに見合った薬に切り替えることで、効果が期待できるかもしれない
Lorlatinibはかなり広範な耐性化機序をカバーするとされているが、Lorlatinib耐性化後のcrizotinibが効いた、という症例報告があり、実際に国内でも同じような現象が確認されているらしい
crizotinib, alectinib, ceritinib, brigatinib, lorlatinibの交代療法なんて概念が、まことしやかにささやかれているそうだ。
http://oitahaiganpractice.junglekouen.com/e833200.html
http://oitahaiganpractice.junglekouen.com/e904105.html
3)耐性化機序がわからなかったら、一度はpemetrexedを含む化学療法を試してみる
ALK陽性肺がんには、pemetrexedが高い効果を示すことが知られている
ALK阻害薬が効きにくくなったとしても、一度はトライしてみたい
その後に分子標的薬に再トライする、という考え方もありだろう
ALK陽性肺がんはなんといっても患者数が少ないため、EGFR陽性肺がん、PD-L1陽性肺がんに比べると実地臨床が変わっていくスピードが緩やかだろうと予測される。
ベストの診療にめぐり合いたいと考えるなら、ときには保険適応外の検査を受けた上で次の診療を模索することも選択肢だろう。
2017年07月10日
J-ALEX study updated data
J-ALEX試験のupdate data。
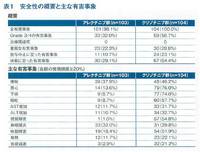
1st reportに比べて10ヶ月だけ観察期間が延びたということだが、無増悪生存期間中央値が具体的な数字になっていた。
もともと脳転移がなかった患者の中枢神経病変抑制能には、大きな差がついているようだ。
要点のみ抜粋して記載する。
Updated efficacy and safety of the j-alex study comparing alectinib (ALC) with crizotinib (CRZ) in ALK-inhibitor naïve ALK fusion positive non-small cell lung cancer (ALK+ NSCLC).
ASCO 2017 abst.#9064
Yuichi Takiguchi, Toyoaki Hida, Hiroshi Nokihara et al.
2013年11月から2015年8月までの間に、207人の患者が登録された。今回の解析では、2016年9月まででデータカットオフを行った。経過観察期間の中央値は、Alectinib群で20.5ヶ月、Crizotinib群で20.4ヶ月だった。無増悪生存期間に関するハザード比は0.38(95%信頼区間は0.26-0.55、p<0.0001)だった。無増悪生存期間中央値はAlectinib群で25.9ヶ月(95%信頼区間は20.3ヶ月以上)、Crizotinib群で10.2ヶ月(95%信頼区間は8.3-10.2ヶ月)だった。登録時に脳転移のなかった患者は164人いたが、Crizotinib群に比べてAlectinib群では中枢神経病変新出による病勢進行が有意に抑制されていた(ハザード比0.19、95%信頼区間は0.07-0.53)。一方、登録時に脳転移があった患者は43人いたが、中枢神経病変進行による病勢進行に有意な差は見いだせなかった(ハザード比0.51, 95%信頼区間は0.16-1.64)。



1st reportに比べて10ヶ月だけ観察期間が延びたということだが、無増悪生存期間中央値が具体的な数字になっていた。
もともと脳転移がなかった患者の中枢神経病変抑制能には、大きな差がついているようだ。
要点のみ抜粋して記載する。
Updated efficacy and safety of the j-alex study comparing alectinib (ALC) with crizotinib (CRZ) in ALK-inhibitor naïve ALK fusion positive non-small cell lung cancer (ALK+ NSCLC).
ASCO 2017 abst.#9064
Yuichi Takiguchi, Toyoaki Hida, Hiroshi Nokihara et al.
2013年11月から2015年8月までの間に、207人の患者が登録された。今回の解析では、2016年9月まででデータカットオフを行った。経過観察期間の中央値は、Alectinib群で20.5ヶ月、Crizotinib群で20.4ヶ月だった。無増悪生存期間に関するハザード比は0.38(95%信頼区間は0.26-0.55、p<0.0001)だった。無増悪生存期間中央値はAlectinib群で25.9ヶ月(95%信頼区間は20.3ヶ月以上)、Crizotinib群で10.2ヶ月(95%信頼区間は8.3-10.2ヶ月)だった。登録時に脳転移のなかった患者は164人いたが、Crizotinib群に比べてAlectinib群では中枢神経病変新出による病勢進行が有意に抑制されていた(ハザード比0.19、95%信頼区間は0.07-0.53)。一方、登録時に脳転移があった患者は43人いたが、中枢神経病変進行による病勢進行に有意な差は見いだせなかった(ハザード比0.51, 95%信頼区間は0.16-1.64)。




2017年07月10日
Best of ASCO 2日目 ランチョンセミナー
今年のBest of ASCOの2日目は、モーニングセミナーもランチョンセミナーも、話題は肺癌だった。
私のように肺癌診療を主たる仕事にしているものにとってはいいものの、一般の腫瘍内科医にとってはどうなのだろう。
Best of ASCOに来ると毎年思うのだが、壇上に上がるのはたいてい臓器別のspecialistであって、臓器横断的な腫瘍内科医ではない。
これって、臨床腫瘍学会のあり方としてどうなんだろう。
結局臓器別のspecialistがイニシアチブをとらざるを得ないということか。
ALK肺癌の領域は、物語としては面白い。
ALK肺癌が見出されてから10年、これまでの治療開発過程はとてもドラマティックだった。
そして、昨年のASCOでJ-ALEXの結果が示され、今年のASCOでALEXの結果により追認され、我が国で見出された疾患に対して、我が国発の治療薬がcurrent best optionであることが示された。
そんなわけで、肺癌屋は胸をときめかせながら本セミナーのようにALK肺癌を語る。
しかし、実臨床ではあまりにもALK肺癌に遭遇する機会が少なすぎて、芸能界・スポーツ界の話題を聞いているかのようだ。
2017/07/09
Best of ASCO 2017、ランチョンセミナー
<ALK陽性肺がんの未来-よりよい治療を目指して->
・ALK肺癌の研究開発
Ann Oncol supple.3 2016
米国ではBrigatinibも承認された
日本ではCrizotinib, Alectinib, Ceritinibが承認されている
CeritinibはCrizotinib耐性例のみが対象で、コンパニオン診断は規定されていない
・ALK肺癌にはPEMも効く
thymidilate synthase
Shaw et al., N Engl J Med 2385-2394, 2013
・ALK肺癌はp63の免疫染色でよく染まる→扁平上皮癌と間違えられることもある
・AlectinibはRET陽性肺癌にもよく効く
・J-ALEX study
Crizotinib群に脳転移陽性例が多かった
Takiguchi et al., ASCO 2017 Abst.#9064
updated data: mPFS 25.9M vs 10.8M, HR 0.38
・ALEX study
well balanced, brain metaは両群ともに30-40%
・Ceritinib
Alectinib PD後でも国内phase Iでは4例中2例に奏効(Nishio et al., 2017)
悪心、嘔吐、下痢は必発、80%に休薬、60%に減量を要す
ASCEND-4 study, Soria et al., Lancet 2017
・Brigatinib
Kim et al., J Clin Oncol 2017, in press
phase II ALTA study, 90mg vs 180mgの比較試験
この試験を持ってFDAは承認した
・Lorlatinib
Johnson et al., J Med Chem 4720-4744, 2014
G1202Rにも効果あり、中枢神経移行がよい
Felip et al., WCLC 2016
brain metaの患者が全体の72%を占めていても有効
前治療歴>2 regimenでも有効
Solomon et al., ASCO 2016 abst.#9009
Ou et al., ASCO 2017 abst.#9006
Sanjay, Ou et al., ASCO 2017
脂質異常、浮腫、可逆性の中枢神経障害(会話障害、注意力障害)
・脳転移陽性割合
ALK-TKI naiveで31-40%, ALK-TKI administeredで60-71%
・ALEX study brain meta. specific PFS: HR 0.16
・Shaw CCR 2015, 2745-2752: Crizotinib→CeritinibのOS
・Lin et al., Cancer Discov 2017
acquired resistance mechanism of ALK-TKI
・Ou et al., ASCO 2017 abst.#9010 and #9065
Brigatinib投与中のctDNA assay
・Crizotinib, Alectinib/Ceritinib, Lorlatinibのrotation therapy
私のように肺癌診療を主たる仕事にしているものにとってはいいものの、一般の腫瘍内科医にとってはどうなのだろう。
Best of ASCOに来ると毎年思うのだが、壇上に上がるのはたいてい臓器別のspecialistであって、臓器横断的な腫瘍内科医ではない。
これって、臨床腫瘍学会のあり方としてどうなんだろう。
結局臓器別のspecialistがイニシアチブをとらざるを得ないということか。
ALK肺癌の領域は、物語としては面白い。
ALK肺癌が見出されてから10年、これまでの治療開発過程はとてもドラマティックだった。
そして、昨年のASCOでJ-ALEXの結果が示され、今年のASCOでALEXの結果により追認され、我が国で見出された疾患に対して、我が国発の治療薬がcurrent best optionであることが示された。
そんなわけで、肺癌屋は胸をときめかせながら本セミナーのようにALK肺癌を語る。
しかし、実臨床ではあまりにもALK肺癌に遭遇する機会が少なすぎて、芸能界・スポーツ界の話題を聞いているかのようだ。
2017/07/09
Best of ASCO 2017、ランチョンセミナー
<ALK陽性肺がんの未来-よりよい治療を目指して->
・ALK肺癌の研究開発
Ann Oncol supple.3 2016
米国ではBrigatinibも承認された
日本ではCrizotinib, Alectinib, Ceritinibが承認されている
CeritinibはCrizotinib耐性例のみが対象で、コンパニオン診断は規定されていない
・ALK肺癌にはPEMも効く
thymidilate synthase
Shaw et al., N Engl J Med 2385-2394, 2013
・ALK肺癌はp63の免疫染色でよく染まる→扁平上皮癌と間違えられることもある
・AlectinibはRET陽性肺癌にもよく効く
・J-ALEX study
Crizotinib群に脳転移陽性例が多かった
Takiguchi et al., ASCO 2017 Abst.#9064
updated data: mPFS 25.9M vs 10.8M, HR 0.38
・ALEX study
well balanced, brain metaは両群ともに30-40%
・Ceritinib
Alectinib PD後でも国内phase Iでは4例中2例に奏効(Nishio et al., 2017)
悪心、嘔吐、下痢は必発、80%に休薬、60%に減量を要す
ASCEND-4 study, Soria et al., Lancet 2017
・Brigatinib
Kim et al., J Clin Oncol 2017, in press
phase II ALTA study, 90mg vs 180mgの比較試験
この試験を持ってFDAは承認した
・Lorlatinib
Johnson et al., J Med Chem 4720-4744, 2014
G1202Rにも効果あり、中枢神経移行がよい
Felip et al., WCLC 2016
brain metaの患者が全体の72%を占めていても有効
前治療歴>2 regimenでも有効
Solomon et al., ASCO 2016 abst.#9009
Ou et al., ASCO 2017 abst.#9006
Sanjay, Ou et al., ASCO 2017
脂質異常、浮腫、可逆性の中枢神経障害(会話障害、注意力障害)
・脳転移陽性割合
ALK-TKI naiveで31-40%, ALK-TKI administeredで60-71%
・ALEX study brain meta. specific PFS: HR 0.16
・Shaw CCR 2015, 2745-2752: Crizotinib→CeritinibのOS
・Lin et al., Cancer Discov 2017
acquired resistance mechanism of ALK-TKI
・Ou et al., ASCO 2017 abst.#9010 and #9065
Brigatinib投与中のctDNA assay
・Crizotinib, Alectinib/Ceritinib, Lorlatinibのrotation therapy
2017年07月09日
Best of ASCO 2017 モーニングセミナー
今年も例年の如く、Best of ASCOが開催された。
Best of ASCOは有明の東京ビッグサイトで開催されることが多い。
豪雨災害の渦中にある大分県から上京してみると、都内は嘘のような日差しで、なんだか拍子抜けしてしまった。
一部の学会・セミナーの2日目の時間割は、朝がとても早い。
私が毎年参加するものの中で、最も朝が早いのは、呼吸器内視鏡学会総会の2日目に行われるモーニングセミナーだ。
7時台から始まる。
朝食が食べられないので、近年は参加していない。
その次位にくるのが、臨床腫瘍学会総会や、Best of ASCOだろうか。
今回は、朝の8時からスポンサードセミナーが開催された。
久しぶりにスポンサードセミナーに参加してみると、演者によってバイアスのかかり方がかなり異なる。
プロレス観戦みたいなもので、聴衆もそれを踏まえて参加しなければならない。
本セミナーも、肺癌診療ガイドラインの方向性とうたってはいるが、ざっと見れば分かるようにほとんどの話題は免疫チェックポイント阻害薬にまつわるものだった。
特定のメーカーの製品に偏った話ではなかったものの、このテーマでこの内容でいいのか、という印象は拭えなかった。
2017/07/09
Best of ASCO 2017, モーニングセミナー
<肺癌診療ガイドラインの方向性>
・診断と治療の進展がめまぐるしく、毎年のように標準治療が塗り替えられる
・ガイドライン2016の主な変更点
非小細胞肺がんの初回治療に免疫チェックポイント阻害薬が登場した
・昨今の議論
免疫チェックポイント阻害薬をどのように評価するか
稀少がんのエビデンスをどのように取り扱うか
長期生存者の増加・後治療を踏まえた戦略
・免疫チェックポイント阻害薬による長期生存者
Brahmer et al., AACR 2017
Nivolumab phase I study:2年間だけNivolumabを投与
生存期間中央値は9.9ヶ月
3年生存割合18%
5年生存割合16%
・非扁平上皮癌に対するNivolumab療法後の早期病勢進行患者の取り扱い
Borghaei et al., N Engl J Med 2015
・KEYNOTE-024 study
Reck et al., N Engl J Med 2016
PD-L1発現率50%以上なら、一次治療でもPembrolizumabが優れる
OSのハザード比は0.61(95%信頼区間は0.41-0.89)、p=0.005
クロスオーバーされていながらもOSが延長した
Brahmer et al., ASCO 2017 Abst. #9000
PFS2について解析
ハザード比は0.54(0.40-0.72)、p<0.001
生存期間中央値は18.3ヶ月 vs 8.4ヶ月
・PD-L1>50%はどの程度のpopulationなのか
KEYNOTE-001: 23.2%
KEYNOTE-010: 28.5%
KEYNOTE-024: 30.2%
・Nivolumab最適使用推進ガイドライン
PD-L1<1%の非扁平上皮癌では、二次治療でも化学療法優先
・PD-L1>50%のとき、以下の患者群をどのように取り扱うか
PS 2以上
高齢者
ドライバー遺伝子異常陽性
・ドライバー遺伝子異常陽性者と免疫チェックポイント阻害薬
Lee et al., J Thorac Oncol 2016
Leighl et al., ASCO 2017
KEYNOTE trialにおける
EGFRm:mOSは6.0ヶ月、3y-OSは6.7%
EGFR wild type:mOSは12.0ヶ月、3y-OSは21.1%
WCLC 2015: PD-L1>50%でもEGFR遺伝子変異陽性だと効果は低い
・KEYNOTE-021 study
Langer et al., Lancet Oncol 2016
ランダム化第II相試験
CBDCA+PEM+Pembrolizumab→Pembrolizumab up to 2years, mPEM(-)
CBDCA+PEM→mPEM
PFSは併用療法群で優れていたが、OSは有意差がなかった
FDAは本試験を以ってCBDCA+PEM+Pembrolizumab療法を承認した
・irAE
irAE発症者の多くはresponder
Weber et al., J Clin Oncol 2016
irAEなし / ありでの奏効割合は17.8% vs 48.6%
・自己免疫性疾患を持つ患者におけるirAE(FDA調査):94/552(17%)
自己免疫疾患が悪化した患者:78/837(9.3%)
・JAMA oncologyで自己免疫疾患を有する患者30人での解析結果公表
・日本人におけるNivolumabの市販後調査、ILDの解析
Kenmotsu et al., ASCO 2017
ILD発症までの中央値:40日
ILD発症のリスクファクター
・再投与患者の解析
Santini et al., ASCO 2017
MSKCCにおけるICI投与対象者の15%がirAEを発症した
うち54%はICI再投与を受けた
24%は同じirAEを経験した
26%は当初とは異なるirAEを発症した
50%はirAEを発症しなかった
PFSは再投与をしてもしなくても変わらなかった
・稀少癌のエビデンスをどう扱うか
対象患者が少なすぎて比較試験が成り立たない
RETに対するvandetanib
ROS1に対するcrizotinib
・2017年6月27日の毎日新聞の記事
次世代シーケンサーの臨床導入、できれば2018年中に・・・厚生労働省
・進行非小細胞肺癌診療のこれから
次世代シーケンサー解析と免疫染色でのPD-L1発現解析
ドライバー遺伝子異常陽性なら分子標的薬へ
PD-L1やmutational burden陽性なら免疫チェックポイント阻害薬へ
いずれも陰性なら化学療法へ
・後治療も踏まえた治療戦略
ALEX studyではcrizotinib群からalectinib群へのクロスオーバーが多そう
一方で、alectinib群からcrizotinib群へのクロスオーバーは少なさそう
Best of ASCOは有明の東京ビッグサイトで開催されることが多い。
豪雨災害の渦中にある大分県から上京してみると、都内は嘘のような日差しで、なんだか拍子抜けしてしまった。
一部の学会・セミナーの2日目の時間割は、朝がとても早い。
私が毎年参加するものの中で、最も朝が早いのは、呼吸器内視鏡学会総会の2日目に行われるモーニングセミナーだ。
7時台から始まる。
朝食が食べられないので、近年は参加していない。
その次位にくるのが、臨床腫瘍学会総会や、Best of ASCOだろうか。
今回は、朝の8時からスポンサードセミナーが開催された。
久しぶりにスポンサードセミナーに参加してみると、演者によってバイアスのかかり方がかなり異なる。
プロレス観戦みたいなもので、聴衆もそれを踏まえて参加しなければならない。
本セミナーも、肺癌診療ガイドラインの方向性とうたってはいるが、ざっと見れば分かるようにほとんどの話題は免疫チェックポイント阻害薬にまつわるものだった。
特定のメーカーの製品に偏った話ではなかったものの、このテーマでこの内容でいいのか、という印象は拭えなかった。
2017/07/09
Best of ASCO 2017, モーニングセミナー
<肺癌診療ガイドラインの方向性>
・診断と治療の進展がめまぐるしく、毎年のように標準治療が塗り替えられる
・ガイドライン2016の主な変更点
非小細胞肺がんの初回治療に免疫チェックポイント阻害薬が登場した
・昨今の議論
免疫チェックポイント阻害薬をどのように評価するか
稀少がんのエビデンスをどのように取り扱うか
長期生存者の増加・後治療を踏まえた戦略
・免疫チェックポイント阻害薬による長期生存者
Brahmer et al., AACR 2017
Nivolumab phase I study:2年間だけNivolumabを投与
生存期間中央値は9.9ヶ月
3年生存割合18%
5年生存割合16%
・非扁平上皮癌に対するNivolumab療法後の早期病勢進行患者の取り扱い
Borghaei et al., N Engl J Med 2015
・KEYNOTE-024 study
Reck et al., N Engl J Med 2016
PD-L1発現率50%以上なら、一次治療でもPembrolizumabが優れる
OSのハザード比は0.61(95%信頼区間は0.41-0.89)、p=0.005
クロスオーバーされていながらもOSが延長した
Brahmer et al., ASCO 2017 Abst. #9000
PFS2について解析
ハザード比は0.54(0.40-0.72)、p<0.001
生存期間中央値は18.3ヶ月 vs 8.4ヶ月
・PD-L1>50%はどの程度のpopulationなのか
KEYNOTE-001: 23.2%
KEYNOTE-010: 28.5%
KEYNOTE-024: 30.2%
・Nivolumab最適使用推進ガイドライン
PD-L1<1%の非扁平上皮癌では、二次治療でも化学療法優先
・PD-L1>50%のとき、以下の患者群をどのように取り扱うか
PS 2以上
高齢者
ドライバー遺伝子異常陽性
・ドライバー遺伝子異常陽性者と免疫チェックポイント阻害薬
Lee et al., J Thorac Oncol 2016
Leighl et al., ASCO 2017
KEYNOTE trialにおける
EGFRm:mOSは6.0ヶ月、3y-OSは6.7%
EGFR wild type:mOSは12.0ヶ月、3y-OSは21.1%
WCLC 2015: PD-L1>50%でもEGFR遺伝子変異陽性だと効果は低い
・KEYNOTE-021 study
Langer et al., Lancet Oncol 2016
ランダム化第II相試験
CBDCA+PEM+Pembrolizumab→Pembrolizumab up to 2years, mPEM(-)
CBDCA+PEM→mPEM
PFSは併用療法群で優れていたが、OSは有意差がなかった
FDAは本試験を以ってCBDCA+PEM+Pembrolizumab療法を承認した
・irAE
irAE発症者の多くはresponder
Weber et al., J Clin Oncol 2016
irAEなし / ありでの奏効割合は17.8% vs 48.6%
・自己免疫性疾患を持つ患者におけるirAE(FDA調査):94/552(17%)
自己免疫疾患が悪化した患者:78/837(9.3%)
・JAMA oncologyで自己免疫疾患を有する患者30人での解析結果公表
・日本人におけるNivolumabの市販後調査、ILDの解析
Kenmotsu et al., ASCO 2017
ILD発症までの中央値:40日
ILD発症のリスクファクター
・再投与患者の解析
Santini et al., ASCO 2017
MSKCCにおけるICI投与対象者の15%がirAEを発症した
うち54%はICI再投与を受けた
24%は同じirAEを経験した
26%は当初とは異なるirAEを発症した
50%はirAEを発症しなかった
PFSは再投与をしてもしなくても変わらなかった
・稀少癌のエビデンスをどう扱うか
対象患者が少なすぎて比較試験が成り立たない
RETに対するvandetanib
ROS1に対するcrizotinib
・2017年6月27日の毎日新聞の記事
次世代シーケンサーの臨床導入、できれば2018年中に・・・厚生労働省
・進行非小細胞肺癌診療のこれから
次世代シーケンサー解析と免疫染色でのPD-L1発現解析
ドライバー遺伝子異常陽性なら分子標的薬へ
PD-L1やmutational burden陽性なら免疫チェックポイント阻害薬へ
いずれも陰性なら化学療法へ
・後治療も踏まえた治療戦略
ALEX studyではcrizotinib群からalectinib群へのクロスオーバーが多そう
一方で、alectinib群からcrizotinib群へのクロスオーバーは少なさそう
2017年07月09日
Atezolizumab一次治療
AtezolizumabでもPD-L1発現状態で層別化した初回治療の臨床試験が報告された。
第II相試験ではあるが、次につながる有望な結果のようである。
Atezolizumab as First-Line or Subsequent Treatment in PD-L1-Selected Advanced NSCLC
By Matthew Stenger
Posted: 6/23/2017 9:54:46 AM
Last Updated: 6/23/2017 9:54:46 AM
https://www.ncbi.nlm.nih.gov/pubmed/28609226
第II相BIRCH試験において、PD-L1高発現の進行非小細胞肺癌における一次治療もしくは二次治療以降において、Atezolizumabは高い奏効割合を示した。
BIRCH試験は、測定可能病変を有し、脳転移のない進行非小細胞肺癌患者659人を対象とし、1200mgのAtezolizumabを3週ごとに投与する試験デザインとし、一次治療コホート(コホート1、n=139人)、二次治療コホート(コホート2、n=268)、三次治療以降コホート(コホート3、n=252人)に分けた。腫瘍細胞もしくは腫瘍浸潤免疫細胞がSP142抗体による免疫染色で5%以上のPD-L1発現をしている患者のみを対象とした。PD-L1発現割合が腫瘍細胞の50%以上、免疫細胞の10%以上の患者を、それぞれTC3やIC3と定義した。それぞれのコホートの46%、47%がTC3やIC3に相当した。主要評価項目は奏効割合とした。
12ヶ月の追跡期間後で、奏効割合はコホート1で22%、コホート2で19%、コホート3で18%だった。それぞれのコホートにおけるTC3 / IC3の患者をサブグループ解析すると、コホート1で31%、コホート2で26%、コホート3で27%だった。奏効の有無はEGFRやKRAS遺伝子変異と関わりなかった。奏効持続期間はコホート1で9.8ヶ月、未到達、11.8ヶ月だった。それぞれのコホートにおけるTC3 / IC3の奏効持続期間は10.0ヶ月、未到達、7.2ヶ月だった。追跡期間中央値が20ヶ月と不十分であるものの、生存期間中央値は23.5ヶ月(TC3 / IC3の患者では26.9ヶ月)、15.5ヶ月(TC3 / IC3の患者では16.6ヶ月)、13.2ヶ月(TC3 / IC3の患者では17.5ヶ月)だった。
第II相試験ではあるが、次につながる有望な結果のようである。
Atezolizumab as First-Line or Subsequent Treatment in PD-L1-Selected Advanced NSCLC
By Matthew Stenger
Posted: 6/23/2017 9:54:46 AM
Last Updated: 6/23/2017 9:54:46 AM
https://www.ncbi.nlm.nih.gov/pubmed/28609226
第II相BIRCH試験において、PD-L1高発現の進行非小細胞肺癌における一次治療もしくは二次治療以降において、Atezolizumabは高い奏効割合を示した。
BIRCH試験は、測定可能病変を有し、脳転移のない進行非小細胞肺癌患者659人を対象とし、1200mgのAtezolizumabを3週ごとに投与する試験デザインとし、一次治療コホート(コホート1、n=139人)、二次治療コホート(コホート2、n=268)、三次治療以降コホート(コホート3、n=252人)に分けた。腫瘍細胞もしくは腫瘍浸潤免疫細胞がSP142抗体による免疫染色で5%以上のPD-L1発現をしている患者のみを対象とした。PD-L1発現割合が腫瘍細胞の50%以上、免疫細胞の10%以上の患者を、それぞれTC3やIC3と定義した。それぞれのコホートの46%、47%がTC3やIC3に相当した。主要評価項目は奏効割合とした。
12ヶ月の追跡期間後で、奏効割合はコホート1で22%、コホート2で19%、コホート3で18%だった。それぞれのコホートにおけるTC3 / IC3の患者をサブグループ解析すると、コホート1で31%、コホート2で26%、コホート3で27%だった。奏効の有無はEGFRやKRAS遺伝子変異と関わりなかった。奏効持続期間はコホート1で9.8ヶ月、未到達、11.8ヶ月だった。それぞれのコホートにおけるTC3 / IC3の奏効持続期間は10.0ヶ月、未到達、7.2ヶ月だった。追跡期間中央値が20ヶ月と不十分であるものの、生存期間中央値は23.5ヶ月(TC3 / IC3の患者では26.9ヶ月)、15.5ヶ月(TC3 / IC3の患者では16.6ヶ月)、13.2ヶ月(TC3 / IC3の患者では17.5ヶ月)だった。
2017年07月09日
私の周りのEGFR陽性肺癌のみなさん
今年のASCOの話題を見ていてなんとなく感じたのが、gefitinibの活躍の場が減っていそう、ということだ。
私が医師になったのが1999年。
gefitinibが実地臨床で使えるようになったのが2002年の夏。
思えば、内科医として肺癌の診療をすることの限界というか、虚しさというか、つらさを感じていた時期だった。
シスプラチンでこんなにつらい思いをしても、たった数ヶ月しか寿命が延びないのか・・・。
年をとってから肺癌になったというだけで、治療の選択肢がなくなってしまうのか・・・。
そんな中で、鳴り物入りで登場したのがgefitinibだった。
1日1回1錠だけ、7000円と高価だけど、薬を飲めばいい。
それだけでも、結構な衝撃だった。
これまでシスプラチンを点滴して、1週間嘔吐し続けた患者の立場はどうなる。
薬剤性肺障害による社会的な糾弾を受けたり、EGFR遺伝子変異と有効性の関係が明らかになって薬物療法の概念を一変させたり、最近では術後補助化学療法のpositive dataが出たり、ずっと肺癌薬物療法の考え方に一石を投じ続けている。
そして今年、実地臨床導入から15年目を迎えた。
試みに、身の回りのEGFR陽性肺がん患者さんのデータを、整理できる範囲でまとめてみる。
実際には、データ入力不足の患者が少なからずいるし、手術患者の中にもEGFR検索をしていない人がいるので、あまりきれいなデータではない。
そのときが来たら、きちんとしたデータを出したい。
中には、gefitinibを飲み続けながら、12年近く頑張っている方もいる。
・総数:106人
・男性33人、女性73人
・年齢中央値は73歳(38歳-90歳)
・手術を受けた患者は45人、手術を受けられなかった患者は61人
・腺癌が100人、腺扁平上皮癌が1人、分類不能が1人、扁平上皮癌が6人
・IA期が41人、IB期が17人、IIA期が3人、IIIA期が6人、IIIB期が6人、IV期が33人
・生存期間中央値は1015日(12日-4331日)、5年以上生存している患者は29人、5年生存割合は27%
・gefitinibを服用した患者は44人
・gefitinibを服用した患者の生存期間中央値は823日(42日-4331日)
・gefitinibを服用した患者で5年以上生存している患者は8人、5年生存割合は18%
私が医師になったのが1999年。
gefitinibが実地臨床で使えるようになったのが2002年の夏。
思えば、内科医として肺癌の診療をすることの限界というか、虚しさというか、つらさを感じていた時期だった。
シスプラチンでこんなにつらい思いをしても、たった数ヶ月しか寿命が延びないのか・・・。
年をとってから肺癌になったというだけで、治療の選択肢がなくなってしまうのか・・・。
そんな中で、鳴り物入りで登場したのがgefitinibだった。
1日1回1錠だけ、7000円と高価だけど、薬を飲めばいい。
それだけでも、結構な衝撃だった。
これまでシスプラチンを点滴して、1週間嘔吐し続けた患者の立場はどうなる。
薬剤性肺障害による社会的な糾弾を受けたり、EGFR遺伝子変異と有効性の関係が明らかになって薬物療法の概念を一変させたり、最近では術後補助化学療法のpositive dataが出たり、ずっと肺癌薬物療法の考え方に一石を投じ続けている。
そして今年、実地臨床導入から15年目を迎えた。
試みに、身の回りのEGFR陽性肺がん患者さんのデータを、整理できる範囲でまとめてみる。
実際には、データ入力不足の患者が少なからずいるし、手術患者の中にもEGFR検索をしていない人がいるので、あまりきれいなデータではない。
そのときが来たら、きちんとしたデータを出したい。
中には、gefitinibを飲み続けながら、12年近く頑張っている方もいる。
・総数:106人
・男性33人、女性73人
・年齢中央値は73歳(38歳-90歳)
・手術を受けた患者は45人、手術を受けられなかった患者は61人
・腺癌が100人、腺扁平上皮癌が1人、分類不能が1人、扁平上皮癌が6人
・IA期が41人、IB期が17人、IIA期が3人、IIIA期が6人、IIIB期が6人、IV期が33人
・生存期間中央値は1015日(12日-4331日)、5年以上生存している患者は29人、5年生存割合は27%
・gefitinibを服用した患者は44人
・gefitinibを服用した患者の生存期間中央値は823日(42日-4331日)
・gefitinibを服用した患者で5年以上生存している患者は8人、5年生存割合は18%




