2021年01月30日
RET融合遺伝子陽性肺がんに対するselpercatinibの第III相試験:LIBRETTO-431試験の概要
2021/01/28-2021/01/31の日程で、世界肺癌学会世界肺癌学会議が開催されている。
https://wclc2020.iaslc.org/
RET肺がんに対するselpercatinibの第III相試験、LIBRETTO-431試験について、最近以下の記事で触れた。
http://oitahaiganpractice.junglekouen.com/e984811.html
今回の世界肺癌会議で、本試験の概要に関するポスター発表が行われているようなので、概要を以下に記載する。
LIBRETTO-001試験についておさらいするのにもちょうどいい。
試験デザイン上、コントロール群に割り付けられた場合にはペンブロリズマブ併用を希望するかどうかを参加者は問われるようだが、その返答が割付調整因子に組み込まれている。
KEYNOTE-189試験の結果を踏まえると、適切な説明が治験担当医からなされた場合、ペンブロリズマブ併用を希望しない患者がいるとは考えにくい。
http://oitahaiganpractice.junglekouen.com/e963871.html
割付調整因子である以上は、ペンブロリズマブを希望する患者が一定数に到達した場合、その後に希望する患者は実質的にペンブロリズマブを希望できなくなる(希望しても既に枠が埋まっていて参加できない)という状況になってしまう可能性がある。
既にそうなっているのかもしれない。
なるべくそうならないように、治験担当医が説明内容を歪めるかもしれない。
倫理的にどうかと首をかしげる設定であり、将来プロトコール改訂を余儀なくされるような気がしてならない。
そしてもうひとつ。
本試験には、LIBRETTO-001試験結果に基づいて、既にRET肺がんに対するselpercatinibの使用を承認している米国は参加していない。
希少肺癌に対する治療を第II相試験の段階で承認して、実診療でselpercatinibの実力を測るのが米国流。
希少肺癌に対する治療を全世界規模の第III相試験を行って、結果を見極めてからselpercatinibを実臨床に持ち込むのがその他の国々。
我が国を含めてその他の国々では、地方に住む一般の患者がselpercatinibを使用できるようになるまでには相当の時間がかかるだろう。
肺がん原理主義者としてはその他の国々の方が保守本流だと思うのだが、RET肺がん患者の家族としては科学的妥当性なんて後付けでいいから、米国で治療を受けさせられたらと切に思う。
LIBRETTO-431: Selpercatinib in Treatment-Naïve Patients with RET Fusion-Positive Non-Small Cell Lung Cancer (NSCLC).
Koichi Goto et al., WCLC 2020 #FP14.05
背景:
Selpercatinib (LOXO-292) は高い選択性と潜在活性を有するRET阻害薬である。第I / II相のLIBRETTO-001試験において、selpercatinibはプラチナ併用化学療法治療歴のあるRET融合遺伝子陽性非小細胞肺がん患者(総患者数105人)において64%(95%信頼区間は54-73%)、治療歴のないRET融合遺伝子陽性非小細胞肺がん患者(総患者数39人)において85%(95%信頼区間は70-94%)の奏効割合を示した。治療歴のない患者においては未だ定かではないが、プラチナ併用化学療法治療歴のある患者における奏効持続期間中央値は18ヶ月(95%信頼区間は12ヶ月-未到達)、無増悪生存期間中央値は17.5ヶ月(95%信頼区間は12ヶ月-未到達)、中枢神経系奏効割合は91%(11人中10人で奏効、95%信頼区間は59-100%)だった。主な有害事象は口渇(39%)、下痢(37%)、高血圧(35%)、倦怠感(35%)だった。ほとんどの有害事象はGrade 1もしくは2と軽微な範囲にとどまっていた。主な臨床検査値異常は、ALT上昇が51%、AST上昇が45%だった。全体の5%の患者が、有害事象のために治療を中止した。
LIBRETTO-431試験は国際オープンラベルランダム化第3相臨床試験である。未治療の局所進行もしくは進行RET融合遺伝子陽性非小細胞肺がん患者を対象として、selpercatinib単剤療法とプラチナ製剤+ペメトレキセド±ペンブロリズマブ併用療法を比較する試験である。
本試験に参加する患者は、A群(selpercatinib 160mgを1日2回内服、3週間サイクルで投与)とB群(ペメトレキセド500mg/㎡、点滴静注+プラチナ製剤(担当医判断で、カルボプラチン 5AUCもしくはシスプラチン75mg/㎡のいずれかを選択)を3週間隔で4コース点滴静注)に振り分けられる。B群では、担当医判断でペンブロリズマブ200mg点滴静注を最大35コースまで使用可能とされている。ペメトレキセドとペンブロリズマブを維持療法として継続投与することも可能である。B群の患者が病勢進行に至った際、selpercatinibを次治療として使用することが認められている。プロトコール治療は、病勢進行が確認されるか、許容不能の毒性に見舞われるか、患者が治療中止を希望するか、あるいは患者が死亡するまで継続される。割付調整因子は地域(アジア地域 or それ以外の地域)、脳転移(あり or なし)、もしB群に割り付けられた場合にペンブロリズマブ併用を希望するか(する or しない)とした。RET融合遺伝子を有するか否かは、腫瘍組織検体(PCRもしくは次世代シーケンサー分析)あるいは血液検体(次世代シーケンサー分析)を用いて検索された。主な適格条件は、①18歳以上、②過去に肺がん治療歴がない、③IIIb期もしくはIIIC期で外科治療や放射線治療の適応がない、あるいはIV期の非扁平上皮非小細胞肺癌である、④RECIST 1.1準拠の測定可能病変がある、⑤ECOG-パフォーマンスステータス0-2である、とした。主な除外条件は、①既知の他のドライバー遺伝子変異を有する、②症状を伴う中枢神経系転移がある、とした。治療効果判定は病勢進行に至るか、新たな抗腫瘍治療を開始するか、患者が死亡するか、臨床試験が終了するかまで継続することとした。主要評価項目は、B群に割り付けられた場合にペンブロリズマブ併用を希望した患者群における無増悪生存期間(委員会判定による)と、全患者群における無増悪生存期間(委員会判定による)とした。副次評価項目は無増悪生存期間(担当医判定による)、奏効割合、奏効持続期間、頭蓋内病変に関する奏効割合、頭蓋内病変に関する奏効持続期間、全生存期間、呼吸器症状が悪化するまでの期間、次治療開始後に病勢進行に至るまでの期間、RET融合遺伝子の状態、安全性とした。本試験は2020年3月に開始され、現在も進行中である。
https://wclc2020.iaslc.org/
RET肺がんに対するselpercatinibの第III相試験、LIBRETTO-431試験について、最近以下の記事で触れた。
http://oitahaiganpractice.junglekouen.com/e984811.html
今回の世界肺癌会議で、本試験の概要に関するポスター発表が行われているようなので、概要を以下に記載する。
LIBRETTO-001試験についておさらいするのにもちょうどいい。
試験デザイン上、コントロール群に割り付けられた場合にはペンブロリズマブ併用を希望するかどうかを参加者は問われるようだが、その返答が割付調整因子に組み込まれている。
KEYNOTE-189試験の結果を踏まえると、適切な説明が治験担当医からなされた場合、ペンブロリズマブ併用を希望しない患者がいるとは考えにくい。
http://oitahaiganpractice.junglekouen.com/e963871.html
割付調整因子である以上は、ペンブロリズマブを希望する患者が一定数に到達した場合、その後に希望する患者は実質的にペンブロリズマブを希望できなくなる(希望しても既に枠が埋まっていて参加できない)という状況になってしまう可能性がある。
既にそうなっているのかもしれない。
なるべくそうならないように、治験担当医が説明内容を歪めるかもしれない。
倫理的にどうかと首をかしげる設定であり、将来プロトコール改訂を余儀なくされるような気がしてならない。
そしてもうひとつ。
本試験には、LIBRETTO-001試験結果に基づいて、既にRET肺がんに対するselpercatinibの使用を承認している米国は参加していない。
希少肺癌に対する治療を第II相試験の段階で承認して、実診療でselpercatinibの実力を測るのが米国流。
希少肺癌に対する治療を全世界規模の第III相試験を行って、結果を見極めてからselpercatinibを実臨床に持ち込むのがその他の国々。
我が国を含めてその他の国々では、地方に住む一般の患者がselpercatinibを使用できるようになるまでには相当の時間がかかるだろう。
肺がん原理主義者としてはその他の国々の方が保守本流だと思うのだが、RET肺がん患者の家族としては科学的妥当性なんて後付けでいいから、米国で治療を受けさせられたらと切に思う。
LIBRETTO-431: Selpercatinib in Treatment-Naïve Patients with RET Fusion-Positive Non-Small Cell Lung Cancer (NSCLC).
Koichi Goto et al., WCLC 2020 #FP14.05
背景:
Selpercatinib (LOXO-292) は高い選択性と潜在活性を有するRET阻害薬である。第I / II相のLIBRETTO-001試験において、selpercatinibはプラチナ併用化学療法治療歴のあるRET融合遺伝子陽性非小細胞肺がん患者(総患者数105人)において64%(95%信頼区間は54-73%)、治療歴のないRET融合遺伝子陽性非小細胞肺がん患者(総患者数39人)において85%(95%信頼区間は70-94%)の奏効割合を示した。治療歴のない患者においては未だ定かではないが、プラチナ併用化学療法治療歴のある患者における奏効持続期間中央値は18ヶ月(95%信頼区間は12ヶ月-未到達)、無増悪生存期間中央値は17.5ヶ月(95%信頼区間は12ヶ月-未到達)、中枢神経系奏効割合は91%(11人中10人で奏効、95%信頼区間は59-100%)だった。主な有害事象は口渇(39%)、下痢(37%)、高血圧(35%)、倦怠感(35%)だった。ほとんどの有害事象はGrade 1もしくは2と軽微な範囲にとどまっていた。主な臨床検査値異常は、ALT上昇が51%、AST上昇が45%だった。全体の5%の患者が、有害事象のために治療を中止した。
LIBRETTO-431試験は国際オープンラベルランダム化第3相臨床試験である。未治療の局所進行もしくは進行RET融合遺伝子陽性非小細胞肺がん患者を対象として、selpercatinib単剤療法とプラチナ製剤+ペメトレキセド±ペンブロリズマブ併用療法を比較する試験である。
本試験に参加する患者は、A群(selpercatinib 160mgを1日2回内服、3週間サイクルで投与)とB群(ペメトレキセド500mg/㎡、点滴静注+プラチナ製剤(担当医判断で、カルボプラチン 5AUCもしくはシスプラチン75mg/㎡のいずれかを選択)を3週間隔で4コース点滴静注)に振り分けられる。B群では、担当医判断でペンブロリズマブ200mg点滴静注を最大35コースまで使用可能とされている。ペメトレキセドとペンブロリズマブを維持療法として継続投与することも可能である。B群の患者が病勢進行に至った際、selpercatinibを次治療として使用することが認められている。プロトコール治療は、病勢進行が確認されるか、許容不能の毒性に見舞われるか、患者が治療中止を希望するか、あるいは患者が死亡するまで継続される。割付調整因子は地域(アジア地域 or それ以外の地域)、脳転移(あり or なし)、もしB群に割り付けられた場合にペンブロリズマブ併用を希望するか(する or しない)とした。RET融合遺伝子を有するか否かは、腫瘍組織検体(PCRもしくは次世代シーケンサー分析)あるいは血液検体(次世代シーケンサー分析)を用いて検索された。主な適格条件は、①18歳以上、②過去に肺がん治療歴がない、③IIIb期もしくはIIIC期で外科治療や放射線治療の適応がない、あるいはIV期の非扁平上皮非小細胞肺癌である、④RECIST 1.1準拠の測定可能病変がある、⑤ECOG-パフォーマンスステータス0-2である、とした。主な除外条件は、①既知の他のドライバー遺伝子変異を有する、②症状を伴う中枢神経系転移がある、とした。治療効果判定は病勢進行に至るか、新たな抗腫瘍治療を開始するか、患者が死亡するか、臨床試験が終了するかまで継続することとした。主要評価項目は、B群に割り付けられた場合にペンブロリズマブ併用を希望した患者群における無増悪生存期間(委員会判定による)と、全患者群における無増悪生存期間(委員会判定による)とした。副次評価項目は無増悪生存期間(担当医判定による)、奏効割合、奏効持続期間、頭蓋内病変に関する奏効割合、頭蓋内病変に関する奏効持続期間、全生存期間、呼吸器症状が悪化するまでの期間、次治療開始後に病勢進行に至るまでの期間、RET融合遺伝子の状態、安全性とした。本試験は2020年3月に開始され、現在も進行中である。
2021年01月26日
ニボルマブ+イピリムマブ±プラチナ併用化学療法 オンライン講演会
2021年01月22日、標記のテーマでオンライン講演会があった。
幸い開始時刻に間に合うように帰宅できたので、夕食は後回しにして自宅から視聴した。
とても勉強になったので、少しだけ復習した。
・免疫チェックポイント阻害薬に関わる代表的な有害事象とその症状
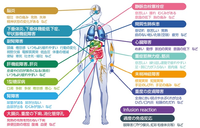
こうしてみると、症状として注意すべきチェック項目が無数にあることがよくわかる。
・肝機能障害時の対策
肝機能障害は、起こり方によっては厄介な病態である。
私は、最初にウルソを投与してお茶を濁すが、ひどくなると結構な高用量のステロイドが必要になることもある。

・皮膚障害時の対策
皮膚トラブルは比較的よく遭遇する有害事象で、なんとなくステロイド外用薬で凌ぐことが多かった。
重症度に応じて、ある程度やるべきことは決められている。

幸い開始時刻に間に合うように帰宅できたので、夕食は後回しにして自宅から視聴した。
とても勉強になったので、少しだけ復習した。
・免疫チェックポイント阻害薬に関わる代表的な有害事象とその症状

こうしてみると、症状として注意すべきチェック項目が無数にあることがよくわかる。
・肝機能障害時の対策
肝機能障害は、起こり方によっては厄介な病態である。
私は、最初にウルソを投与してお茶を濁すが、ひどくなると結構な高用量のステロイドが必要になることもある。

・皮膚障害時の対策
皮膚トラブルは比較的よく遭遇する有害事象で、なんとなくステロイド外用薬で凌ぐことが多かった。
重症度に応じて、ある程度やるべきことは決められている。

2021年01月26日
オンコマインDx Target Test マルチ CDxシステム一時供給停止
昨夜受講したwebinerで、「オンコマインDx Target Test マルチ CDxシステム」の便利さを再認識したところだった。

(サーモフィッシャーサイエンティフィックライフテクノロジーズジャパン株式会社からの通知文書より抜粋)
文字通りone-fit-allで、適正に検査ができれば(提出標本の質を保つのは簡単ではないのだが)、METエクソン14スキップ変異以外の保険診療上必要な遺伝子異常検索は、本検査のみで賄える。
受講したみなさんは、これから頑張って大きな生検組織をとって、きちんと処理をして、本検査を積極的に使うんだろうなと思っていた。
その矢先のこの通知である。
日本臨床腫瘍学会、日本肺癌学会を通して、サーモフィッシャーサイエンティフィックライフテクノロジーズジャパン株式会社から通知が来た。
この度、弊社のオンコマインDx Target Test マルチ CDxシステム(オンコマインDxTT)の供給が一時停止に至りましたことをご報告申し上げます。今回のオンコマインDxTTの供給停止につきまいては、本品のクオリティーチェックにおいて問題が検出されたことに起因しております。
これにより外注先検査センター様の当該検査受託につきましても、一時停止となる見込みです。
供給再開に向けて総力を挙げて取り組んでおりますが、供給再開時期につきましては、早くとも2021年2月15日以降となる見込みです。
なかなかうまくいかないものだ。
当面は、EGFR→ALK→METエクソン14スキップ→ROS1→BRAF等々、各担当医の判断で優先順位をつけて個別の変異検索検査を進めるしかないだろう。

(サーモフィッシャーサイエンティフィックライフテクノロジーズジャパン株式会社からの通知文書より抜粋)
文字通りone-fit-allで、適正に検査ができれば(提出標本の質を保つのは簡単ではないのだが)、METエクソン14スキップ変異以外の保険診療上必要な遺伝子異常検索は、本検査のみで賄える。
受講したみなさんは、これから頑張って大きな生検組織をとって、きちんと処理をして、本検査を積極的に使うんだろうなと思っていた。
その矢先のこの通知である。
日本臨床腫瘍学会、日本肺癌学会を通して、サーモフィッシャーサイエンティフィックライフテクノロジーズジャパン株式会社から通知が来た。
この度、弊社のオンコマインDx Target Test マルチ CDxシステム(オンコマインDxTT)の供給が一時停止に至りましたことをご報告申し上げます。今回のオンコマインDxTTの供給停止につきまいては、本品のクオリティーチェックにおいて問題が検出されたことに起因しております。
これにより外注先検査センター様の当該検査受託につきましても、一時停止となる見込みです。
供給再開に向けて総力を挙げて取り組んでおりますが、供給再開時期につきましては、早くとも2021年2月15日以降となる見込みです。
なかなかうまくいかないものだ。
当面は、EGFR→ALK→METエクソン14スキップ→ROS1→BRAF等々、各担当医の判断で優先順位をつけて個別の変異検索検査を進めるしかないだろう。
2021年01月24日
RET融合遺伝子肺癌に対するもうひとつのvandetanib第II相試験・・・韓国から
LURET試験と時期を同じくして結果が報告された、RET肺がんに対するvandetanib投与第II相試験、韓国から。
LURET試験に比べて患者背景が異なる、RETの確認方法が異なる、奏効割合が低いなど、学会発表当時はいろいろと取り沙汰された。
RET陽性肺がんに対するvandetanib、果たして未来はあるのだろうか?
Vandetanib in pretreated patients with advanced non-small cell lung cancer-harboring RET rearrangement: a phase II clinical trial
S-H Lee, et al., Ann Oncol. 2017 Feb 1;28(2):292-297.
doi: 10.1093/annonc/mdw559.
背景:
非小細胞肺がんの約1%で認めるとされるRET遺伝子再構成は、ユニークなサブセットである。我々は、RET遺伝子再構成陽性肺がん患者を対象に、vandetanib 300mg/日の治療について有効性と安全性を検証するために本試験を行った。
方法:
オープンラベル多施設共同第II相試験として本試験を企画した。FISHで確認されたRET遺伝子再構成陽性の進行もしくは術後再発非小細胞肺がん患者で、プラチナ併用化学療法後に病勢進行に至り、PSが0-2に保たれているものを対象とした。主要評価項目は奏効割合とした。
結果:
2013年7月から2015年10月の期間に18人の患者を登録した。年齢は35-71歳、3人はPS 2だった。ほとんどの患者は濃厚な前治療歴を有していた(72%の患者で、2レジメンの異なる化学療法が既に行われていた)。17人の評価可能患者のうち、部分奏効(PR)は3人(したがって奏効割合は18%)、病勢安定(SD)は8人(したがって病勢コントロール割合は65%)だった。PRもしくはSDの患者11人において、6ヶ月以上PRもしくはSDを維持した患者は8人だった。経過観察期間中央値14ヶ月の時点で、無増悪生存期間中央値は4.5ヶ月、全生存期間中央値は11.6ヶ月だった。安全性は、過去に施行されたvandetanib関連の臨床試験と大差なかった。vandetanibに関連した有害事象で頻度の高かったものは高血圧と皮疹(参加患者全体の70%以上)だった。Grade 3以上の毒性には、高血圧(3人)、QT延長(2人)、肝逸脱酵素異常(1人)で、vandetanib投与量減量を要した患者は4人いた。Grade 4 / 5に至るような有害事象は認めなかった。
結論:
vandetanibはRET遺伝子再構成陽性の既治療進行非小細胞肺がん患者に対してまずまずの効果を示した。
LURET試験に比べて患者背景が異なる、RETの確認方法が異なる、奏効割合が低いなど、学会発表当時はいろいろと取り沙汰された。
RET陽性肺がんに対するvandetanib、果たして未来はあるのだろうか?
Vandetanib in pretreated patients with advanced non-small cell lung cancer-harboring RET rearrangement: a phase II clinical trial
S-H Lee, et al., Ann Oncol. 2017 Feb 1;28(2):292-297.
doi: 10.1093/annonc/mdw559.
背景:
非小細胞肺がんの約1%で認めるとされるRET遺伝子再構成は、ユニークなサブセットである。我々は、RET遺伝子再構成陽性肺がん患者を対象に、vandetanib 300mg/日の治療について有効性と安全性を検証するために本試験を行った。
方法:
オープンラベル多施設共同第II相試験として本試験を企画した。FISHで確認されたRET遺伝子再構成陽性の進行もしくは術後再発非小細胞肺がん患者で、プラチナ併用化学療法後に病勢進行に至り、PSが0-2に保たれているものを対象とした。主要評価項目は奏効割合とした。
結果:
2013年7月から2015年10月の期間に18人の患者を登録した。年齢は35-71歳、3人はPS 2だった。ほとんどの患者は濃厚な前治療歴を有していた(72%の患者で、2レジメンの異なる化学療法が既に行われていた)。17人の評価可能患者のうち、部分奏効(PR)は3人(したがって奏効割合は18%)、病勢安定(SD)は8人(したがって病勢コントロール割合は65%)だった。PRもしくはSDの患者11人において、6ヶ月以上PRもしくはSDを維持した患者は8人だった。経過観察期間中央値14ヶ月の時点で、無増悪生存期間中央値は4.5ヶ月、全生存期間中央値は11.6ヶ月だった。安全性は、過去に施行されたvandetanib関連の臨床試験と大差なかった。vandetanibに関連した有害事象で頻度の高かったものは高血圧と皮疹(参加患者全体の70%以上)だった。Grade 3以上の毒性には、高血圧(3人)、QT延長(2人)、肝逸脱酵素異常(1人)で、vandetanib投与量減量を要した患者は4人いた。Grade 4 / 5に至るような有害事象は認めなかった。
結論:
vandetanibはRET遺伝子再構成陽性の既治療進行非小細胞肺がん患者に対してまずまずの効果を示した。
2021年01月24日
RET融合遺伝子陽性肺がんに対するlenvatinib単剤治療の第II相試験・・・ややインパクトに欠けるか
こちらは、RET融合遺伝子陽性肺がんに対してlenvatinibを用いた第II相試験。
奏効割合16%とややインパクトに欠けるうえ、毒性が高い印象。
RET融合遺伝子陽性肺がんに対する他の薬の開発状況を見る限り、lenvatinibの出番はなさそうに思う。
A phase 2 study of lenvatinib in patients with RET fusion-positive lung adenocarcinoma
Toyoaki Hida et al., Lung Cancer. 2019 Dec;138:124-130.
doi: 10.1016/j.lungcan.2019.09.011. Epub 2019 Sep 16.
背景:
非小細胞肺がんに対する免疫チェックポイント阻害薬治療に関連して治療成績が向上したにもかかわらず、いまだ多くの患者は治療に対して反応しない。それゆえ、非小細胞肺がんの患者においては、いまだに分子標的治療に関するアンメットニーズが存在する。RET融合遺伝子は非小細胞肺がんにおけるドライバー遺伝子変異として同定された。lenvatinibは血管内皮増殖因子受容体(VEGFR)1-3、線維芽細胞増殖因子受容体(FGFR)1-4、RETおよびその他の分子標的と、複数のチロシンキナーゼを阻害する薬である。今回の臨床試験では、RET融合遺伝子陽性肺腺がん患者を対象に、lenvatinibの安全性と有効性を検証した。
方法:
今回のオープンラベル多施設共同第II相試験では、RET融合遺伝子陽性肺腺がん患者に対して24mg/日のlanvatinibを経口投与した。主要評価項目は治療担当医によるRECIST ver.1.1に沿った判定での奏効割合とした。副次評価項目は安全性、忍容性、無増悪生存期間、全生存期間とした。
結果:
536人の患者をスクリーニングし、25人のRET融合遺伝子陽性患者(KIF5B-RET融合遺伝子が13人、CCDC6-RET融合遺伝子が12人)を同定しlenvatinibを投与した。奏効割合は16%(95%信頼区間は4.5-36.1%)だった。2016年2月3日のデータカットオフ時点で、無増悪生存期間中央値は7.3ヶ月(95%信頼区間は3.6-10.2ヶ月)で、生存期間中央値は未到達だった。奏効持続期間もデータカットオフ時点では推定不能だった。全ての患者が有害事象を経験していた。23人(92%)の患者でGrade 3以上の有害事象を認め、6人(24%)は有害事象により治療を中止していた。主な有害事象は高血圧(68%)、嘔気(60%)、食欲不振(52%)、蛋白尿(48%)だった。
結論:
lenvatinibはRET融合遺伝子陽性肺腺がん患者に対して抗腫瘍活性を示した。奏効割合は相対的に低かったが、無増悪生存期間中央値はそれなりに長く、この患者集団に対するlenvatinibの活性を支持していると考えられた。
奏効割合16%とややインパクトに欠けるうえ、毒性が高い印象。
RET融合遺伝子陽性肺がんに対する他の薬の開発状況を見る限り、lenvatinibの出番はなさそうに思う。
A phase 2 study of lenvatinib in patients with RET fusion-positive lung adenocarcinoma
Toyoaki Hida et al., Lung Cancer. 2019 Dec;138:124-130.
doi: 10.1016/j.lungcan.2019.09.011. Epub 2019 Sep 16.
背景:
非小細胞肺がんに対する免疫チェックポイント阻害薬治療に関連して治療成績が向上したにもかかわらず、いまだ多くの患者は治療に対して反応しない。それゆえ、非小細胞肺がんの患者においては、いまだに分子標的治療に関するアンメットニーズが存在する。RET融合遺伝子は非小細胞肺がんにおけるドライバー遺伝子変異として同定された。lenvatinibは血管内皮増殖因子受容体(VEGFR)1-3、線維芽細胞増殖因子受容体(FGFR)1-4、RETおよびその他の分子標的と、複数のチロシンキナーゼを阻害する薬である。今回の臨床試験では、RET融合遺伝子陽性肺腺がん患者を対象に、lenvatinibの安全性と有効性を検証した。
方法:
今回のオープンラベル多施設共同第II相試験では、RET融合遺伝子陽性肺腺がん患者に対して24mg/日のlanvatinibを経口投与した。主要評価項目は治療担当医によるRECIST ver.1.1に沿った判定での奏効割合とした。副次評価項目は安全性、忍容性、無増悪生存期間、全生存期間とした。
結果:
536人の患者をスクリーニングし、25人のRET融合遺伝子陽性患者(KIF5B-RET融合遺伝子が13人、CCDC6-RET融合遺伝子が12人)を同定しlenvatinibを投与した。奏効割合は16%(95%信頼区間は4.5-36.1%)だった。2016年2月3日のデータカットオフ時点で、無増悪生存期間中央値は7.3ヶ月(95%信頼区間は3.6-10.2ヶ月)で、生存期間中央値は未到達だった。奏効持続期間もデータカットオフ時点では推定不能だった。全ての患者が有害事象を経験していた。23人(92%)の患者でGrade 3以上の有害事象を認め、6人(24%)は有害事象により治療を中止していた。主な有害事象は高血圧(68%)、嘔気(60%)、食欲不振(52%)、蛋白尿(48%)だった。
結論:
lenvatinibはRET融合遺伝子陽性肺腺がん患者に対して抗腫瘍活性を示した。奏効割合は相対的に低かったが、無増悪生存期間中央値はそれなりに長く、この患者集団に対するlenvatinibの活性を支持していると考えられた。
2021年01月24日
LURET試験・・・RET陽性肺がん臨床試験の嚆矢
LC-SCRUMプロジェクトの単緒となったLURET試験。
うっかりして、きちんと記事にしていなかった。
肺がんに関連した遺伝子異常として我が国で見いだされ、しかも最初の薬物療法臨床試験がLURET試験という形で世界で初めて報告されたにも拘わらず、RET遺伝子再構成の検査と治療がまだ保険診療として我が国で認められていないというのは、何とも言えず寂しいことだ。
Vandetanib in patients with previously treated RET-rearranged advanced non-small-cell lung cancer (LURET): an open-label, multicentre phase 2 trial
Kiyotaka Yoh, et al,Lancet Respir Med. 2017 Jan;5(1):42-50.
doi: 10.1016/S2213-2600(16)30322-8. Epub 2016 Nov 4.
背景:
RET遺伝子再構成は非小細胞肺がんにおける稀なドライバー遺伝子変異である。vandetanibはRETを含む複数のチロシンキナーゼ阻害薬である。今回我々は、RET遺伝子再構成陽性進行非小細胞肺がん患者に対するvandetanibの有効性と安全性を検証した。
方法:
今回のオープンラベル多施設共同第II相試験(LURET試験)では、RET遺伝子再構成陽性進行非小細胞肺がん患者に対して連日300mgのvandetanibを経口投与した。RET遺伝子再構成陽性患者は、国内約200の参加施設ネットワークでのスクリーニングで抽出した。主要評価項目は独立委員会判定による奏効割合とした。
結果:
2013年2月7日から2015年3月19日の期間内に、1,536人のEGFR遺伝子変異陽性非小細胞肺がん患者をスクリーニングし、34人(2%)のRET融合遺伝子陽性患者を検出し、そのうち19人が本試験に登録された。効果判定対象となった17人の患者のうち、9人(53%、95%信頼区間は28-77%)で奏効を認め、主要評価項目を達成した。vandetanibによる治療を受けた19人全員について評価したところ、9人(47%、95%信頼区間は24-71%)で奏効していた。データカットオフ時点で、無増悪生存期間中央値は4.7ヶ月(95%信頼区間は2.8-8.5ヶ月)だった。Grade 3 / 4の有害事象の主なものは高血圧(11人、58%)、下痢(2人、11%)、発疹(3人、16%)、乾皮症(1人、5%)、心電図上のQT延長所見(2人、11%)だった。
結論:
RET遺伝子再構成陽性進行非小細胞肺がん患者において、vandetanibは臨床的抗腫瘍活性を示し、安全性の観点からも十分に対処可能だった。RET遺伝子再構成は非小細胞肺がんにおける分子標的治療の対象の一つと考えてよい。
うっかりして、きちんと記事にしていなかった。
肺がんに関連した遺伝子異常として我が国で見いだされ、しかも最初の薬物療法臨床試験がLURET試験という形で世界で初めて報告されたにも拘わらず、RET遺伝子再構成の検査と治療がまだ保険診療として我が国で認められていないというのは、何とも言えず寂しいことだ。
Vandetanib in patients with previously treated RET-rearranged advanced non-small-cell lung cancer (LURET): an open-label, multicentre phase 2 trial
Kiyotaka Yoh, et al,Lancet Respir Med. 2017 Jan;5(1):42-50.
doi: 10.1016/S2213-2600(16)30322-8. Epub 2016 Nov 4.
背景:
RET遺伝子再構成は非小細胞肺がんにおける稀なドライバー遺伝子変異である。vandetanibはRETを含む複数のチロシンキナーゼ阻害薬である。今回我々は、RET遺伝子再構成陽性進行非小細胞肺がん患者に対するvandetanibの有効性と安全性を検証した。
方法:
今回のオープンラベル多施設共同第II相試験(LURET試験)では、RET遺伝子再構成陽性進行非小細胞肺がん患者に対して連日300mgのvandetanibを経口投与した。RET遺伝子再構成陽性患者は、国内約200の参加施設ネットワークでのスクリーニングで抽出した。主要評価項目は独立委員会判定による奏効割合とした。
結果:
2013年2月7日から2015年3月19日の期間内に、1,536人のEGFR遺伝子変異陽性非小細胞肺がん患者をスクリーニングし、34人(2%)のRET融合遺伝子陽性患者を検出し、そのうち19人が本試験に登録された。効果判定対象となった17人の患者のうち、9人(53%、95%信頼区間は28-77%)で奏効を認め、主要評価項目を達成した。vandetanibによる治療を受けた19人全員について評価したところ、9人(47%、95%信頼区間は24-71%)で奏効していた。データカットオフ時点で、無増悪生存期間中央値は4.7ヶ月(95%信頼区間は2.8-8.5ヶ月)だった。Grade 3 / 4の有害事象の主なものは高血圧(11人、58%)、下痢(2人、11%)、発疹(3人、16%)、乾皮症(1人、5%)、心電図上のQT延長所見(2人、11%)だった。
結論:
RET遺伝子再構成陽性進行非小細胞肺がん患者において、vandetanibは臨床的抗腫瘍活性を示し、安全性の観点からも十分に対処可能だった。RET遺伝子再構成は非小細胞肺がんにおける分子標的治療の対象の一つと考えてよい。
2021年01月21日
RET肺がんに対するSelpercatinibの第III相試験 LIBRETTO-431
最近、ひょんなことからRET融合遺伝子陽性肺がん患者に触れる機会があった。
RET肺がんに対する治療については、以前SelpercatinibとPralsetinibについて書き残したことがある。
http://oitahaiganpractice.junglekouen.com/e982216.html
http://oitahaiganpractice.junglekouen.com/e982374.html
両薬剤とも米国では使用可能となっているが、我が国ではまだ保険診療で使用できない。
これらの薬のほか、アレクチニブ、vandetanib、lenvatinibを用いた臨床試験が我が国で計画、遂行されたが、まだ実臨床で使えるようにはなっていない。
アレクチニブについては第II相ALLRET試験が施行され、既に患者登録は終了し、現在は追跡期間中であると聞く。
Phase I/II study of alectinib in lung cancer with RET fusion gene: study protocol
J Med Invest. 2017;64(3.4):317-320.
doi: 10.2152/jmi.64.317.
vandetanibについては、既に第II相LURET試験が終了し、結果が報告されている。
Vandetanib in patients with previously treated RET-rearranged advanced non-small-cell lung cancer (LURET): an open-label, multicentre phase 2 trial
Lancet Respir Med. 2017 Jan;5(1):42-50.
doi: 10.1016/S2213-2600(16)30322-8. Epub 2016 Nov 4.
lenvatinibについても、vandetanib同様に既に第II相試験が終了し、結果が報告されている。
A phase 2 study of lenvatinib in patients with RET fusion-positive lung adenocarcinoma
Lung Cancer. 2019 Dec;138:124-130.
doi: 10.1016/j.lungcan.2019.09.011. Epub 2019 Sep 16.
そんな中、RET融合遺伝子陽性進行肺がん患者を対象として、Selpercatinib単剤療法とプラチナ製剤+ペメトレキセド±ペンブロリズマブ併用療法を比較する第III相国際共同臨床試験(LIBRETTO-431試験)が現在進行中である。
全世界で216施設、我が国では以下の12施設が参加している。
・国立がん研究センター東病院
・北海道大学病院
・兵庫県立がんセンター
・金沢大学附属病院
・神奈川県立がんセンター
・近畿大学病院
・静岡県立静岡がんセンター
・国立がん研究センター中央病院
・がん研有明病院
・鳥取大学医学部付属病院
・岡山大学病院
・大阪国際がんセンター
未治療、IIIB / IIIC / IV期、RET融合遺伝子陽性の非小細胞肺がん患者を対象として両治療群に1:1の割合で無作為割付し、主要評価項目は無増悪生存期間である。
病勢増悪後のクロスオーバーが許容されているため、本試験に参加すれば治療経過のどこかでSelpercatinibを使用することが保証されている。
患者総数は250人の予定で、2020年2月から登録が開始されている。
RET融合遺伝子の検出にあたり、オンコマインDx Target Test マルチ CDxシステムの結果を適用可能ということなので、実地臨床の延長線上で検索することができる。
LIBRETTO-001試験において、未治療RET陽性進行肺がん患者におけるSelpercatinibの奏効割合は85%、中枢神経系病変の奏効割合は91%ということなので、非常に高い効果が期待できる。
オンコマインDxを適用した患者で、EGFR, ALK, ROS1, BRAFといった実地臨床に適用可能な遺伝子異常が見つからなかったとしても、その他の遺伝子異常ももれなく確認したいものだ。
RET肺がんに対する治療については、以前SelpercatinibとPralsetinibについて書き残したことがある。
http://oitahaiganpractice.junglekouen.com/e982216.html
http://oitahaiganpractice.junglekouen.com/e982374.html
両薬剤とも米国では使用可能となっているが、我が国ではまだ保険診療で使用できない。
これらの薬のほか、アレクチニブ、vandetanib、lenvatinibを用いた臨床試験が我が国で計画、遂行されたが、まだ実臨床で使えるようにはなっていない。
アレクチニブについては第II相ALLRET試験が施行され、既に患者登録は終了し、現在は追跡期間中であると聞く。
Phase I/II study of alectinib in lung cancer with RET fusion gene: study protocol
J Med Invest. 2017;64(3.4):317-320.
doi: 10.2152/jmi.64.317.
vandetanibについては、既に第II相LURET試験が終了し、結果が報告されている。
Vandetanib in patients with previously treated RET-rearranged advanced non-small-cell lung cancer (LURET): an open-label, multicentre phase 2 trial
Lancet Respir Med. 2017 Jan;5(1):42-50.
doi: 10.1016/S2213-2600(16)30322-8. Epub 2016 Nov 4.
lenvatinibについても、vandetanib同様に既に第II相試験が終了し、結果が報告されている。
A phase 2 study of lenvatinib in patients with RET fusion-positive lung adenocarcinoma
Lung Cancer. 2019 Dec;138:124-130.
doi: 10.1016/j.lungcan.2019.09.011. Epub 2019 Sep 16.
そんな中、RET融合遺伝子陽性進行肺がん患者を対象として、Selpercatinib単剤療法とプラチナ製剤+ペメトレキセド±ペンブロリズマブ併用療法を比較する第III相国際共同臨床試験(LIBRETTO-431試験)が現在進行中である。
全世界で216施設、我が国では以下の12施設が参加している。
・国立がん研究センター東病院
・北海道大学病院
・兵庫県立がんセンター
・金沢大学附属病院
・神奈川県立がんセンター
・近畿大学病院
・静岡県立静岡がんセンター
・国立がん研究センター中央病院
・がん研有明病院
・鳥取大学医学部付属病院
・岡山大学病院
・大阪国際がんセンター
未治療、IIIB / IIIC / IV期、RET融合遺伝子陽性の非小細胞肺がん患者を対象として両治療群に1:1の割合で無作為割付し、主要評価項目は無増悪生存期間である。
病勢増悪後のクロスオーバーが許容されているため、本試験に参加すれば治療経過のどこかでSelpercatinibを使用することが保証されている。
患者総数は250人の予定で、2020年2月から登録が開始されている。
RET融合遺伝子の検出にあたり、オンコマインDx Target Test マルチ CDxシステムの結果を適用可能ということなので、実地臨床の延長線上で検索することができる。
LIBRETTO-001試験において、未治療RET陽性進行肺がん患者におけるSelpercatinibの奏効割合は85%、中枢神経系病変の奏効割合は91%ということなので、非常に高い効果が期待できる。
オンコマインDxを適用した患者で、EGFR, ALK, ROS1, BRAFといった実地臨床に適用可能な遺伝子異常が見つからなかったとしても、その他の遺伝子異常ももれなく確認したいものだ。
2021年01月13日
がん病状悪化時の対応と、他疾患による急変時の対応と、治療関連急変時の対応
今週の当直勤務中、他の先生が担当していた入院患者さんが急変した。
急変時の対応をどのように行うか、患者・家族・担当医の間で申し合わせがなかったので、全力で対応した。
肋骨が次々に折れる鈍い感触を感じながら心臓マッサージを行う。
AEDの自動音声が「心電図を確認します、患者から離れてください」と冷たく響くたびに、手を離してふっと我に返る。
吐物の海にまみれながら、気管内挿管をして用手的人工換気をする。
蘇生処置開始から約20分後、ベッドサイドにお越しになった家族から、「もう充分です、私が責任を持ちますので、やめてください!」との悲痛な声を聞き、気まずい沈黙とともに全てが終わった。
認知症高齢者や重症脳梗塞後遺症、反復する誤嚥性肺炎の患者を担当していると、こうしたことは本当にしばしば起こる。
起こるたびに注意喚起して、できる限り急変時の対応を患者・家族と事前協議しておくように各担当医に求めるのだが、なかなか徹底されない。
病気の急性期を乗り越えて、さあこれから元気になるためにリハビリに取り組もう、という患者・家族をつかまえて急変時対応について話し合うのは、確かに難しいことではある。
同じことは、当然肺がん患者にもいえる。
遠隔転移を有する肺がん患者は、原則として治癒不能である。
どのタイミングで話をするかはとても難しいが、治癒不能の病態である以上は、患者の心身に負担がかかる救急蘇生処置(人工呼吸管理、心マッサージ、AED)は極力行わないようにしている。
理解してもらえるように丁寧に、繰り返し、患者・家族と話をする。
というのがこれまでのスタンスだったのだが、考え直すべき時期が来ているような気もする。
ドライバー遺伝子変異を有する進行期肺がん患者が、5年を超えて長生きすることは決して珍しくない。
PD-L1高発現の進行非小細胞肺がん患者なら、免疫チェックポイント阻害薬単剤治療を規定量やり切れば、5年生存割合が80%を超えるなんて報告すら存在する。
http://oitahaiganpractice.junglekouen.com/e980235.html
中には、進行期肺がんの治療を続けながら、異時多発がんに対して手術を受けたり、他の薬物療法を受けたりする患者までいる。
治癒不能ではあるけれど、長期生存が見込める、あるいはすでに長期生存している患者に対して、十把一からげに「蘇生処置はお勧めしません」と断じてもいいものだろうか。
5年生存している進行期肺がん患者が急性心筋梗塞を起こしたらどうだろう。
5年生存している進行期肺がん患者が胃潰瘍による出血性ショックを来したらどうだろう。
5年生存している進行期肺がん患者が新型コロナウイルスによる重症肺炎を合併したらどうすべきだろう。
どれも蘇生処置や高度の医療を必要としうる病態だが、治癒不能の進行肺がんがあるので支持療法しかしません、と言えるだろうか。
最近診断された肺がんに対する手術後に急変したら、どうすればいいだろう。
単発の縦隔リンパ節転移を伴うIIIA期の非小細胞肺がん、背景に慢性閉塞性肺疾患とごく軽度の間質性肺炎がある患者。
手術をしてみたら、胸膜播種の所見を認めたため、予定術式を行えずに手術を終えた。
術後に急性呼吸不全を来し、人工呼吸管理が必要となったとき、治癒不能の肺がんと診断がついたので、人工呼吸管理はお勧めしませんと我々は言えるだろうか。
最近診断された肺がんに対する薬物療法後に急変したら、どうすればいいだろう。
多発肺内転移を伴うIVA期の進行非小細胞肺がん、無症状でPS0、ドライバー遺伝子変異陰性、TPS 5%。
化学療法+免疫チェックポイント阻害薬併用で治療をしたら、退院3日後に急性呼吸不全を来し、救急搬入された。
明らかに薬剤性肺障害の所見であるとともに、多発肺内転移は急速に増大している。
急場をしのげば、ステロイドパルス療法が著効するとともに、pseudo-progressionを経てがんの病巣も縮小に転じるかもしれない。
激烈な免疫関連有害事象を経験したその先に、長期生存が待っているかもしれない。
そこまで考えたとき、治癒不能の肺がんで、人工呼吸管理はお勧めしませんと我々は言えるだろうか。
肺がんの病態が緩やかに悪化した場合は、その後をどうするかを関係者みんなが考える時間がある。
しかし、他疾患による急変、治療関連有害事象による急変のとき、時間的にも精神的にもゆとりがない中、どうするのが最善だろうか。
治療が複雑化し、がん拠点病院でなければ治療を受けにくいいまのわが国で、更には新型コロナウイルスの問題も抱えながら、遠方から通って治療を受けている患者に対して、病状悪化時の備えをどのようにするのが正解なのだろうか。
今日の入院患者・家族と急変時対応の話をしながら、ふと考えた。
急変時の対応をどのように行うか、患者・家族・担当医の間で申し合わせがなかったので、全力で対応した。
肋骨が次々に折れる鈍い感触を感じながら心臓マッサージを行う。
AEDの自動音声が「心電図を確認します、患者から離れてください」と冷たく響くたびに、手を離してふっと我に返る。
吐物の海にまみれながら、気管内挿管をして用手的人工換気をする。
蘇生処置開始から約20分後、ベッドサイドにお越しになった家族から、「もう充分です、私が責任を持ちますので、やめてください!」との悲痛な声を聞き、気まずい沈黙とともに全てが終わった。
認知症高齢者や重症脳梗塞後遺症、反復する誤嚥性肺炎の患者を担当していると、こうしたことは本当にしばしば起こる。
起こるたびに注意喚起して、できる限り急変時の対応を患者・家族と事前協議しておくように各担当医に求めるのだが、なかなか徹底されない。
病気の急性期を乗り越えて、さあこれから元気になるためにリハビリに取り組もう、という患者・家族をつかまえて急変時対応について話し合うのは、確かに難しいことではある。
同じことは、当然肺がん患者にもいえる。
遠隔転移を有する肺がん患者は、原則として治癒不能である。
どのタイミングで話をするかはとても難しいが、治癒不能の病態である以上は、患者の心身に負担がかかる救急蘇生処置(人工呼吸管理、心マッサージ、AED)は極力行わないようにしている。
理解してもらえるように丁寧に、繰り返し、患者・家族と話をする。
というのがこれまでのスタンスだったのだが、考え直すべき時期が来ているような気もする。
ドライバー遺伝子変異を有する進行期肺がん患者が、5年を超えて長生きすることは決して珍しくない。
PD-L1高発現の進行非小細胞肺がん患者なら、免疫チェックポイント阻害薬単剤治療を規定量やり切れば、5年生存割合が80%を超えるなんて報告すら存在する。
http://oitahaiganpractice.junglekouen.com/e980235.html
中には、進行期肺がんの治療を続けながら、異時多発がんに対して手術を受けたり、他の薬物療法を受けたりする患者までいる。
治癒不能ではあるけれど、長期生存が見込める、あるいはすでに長期生存している患者に対して、十把一からげに「蘇生処置はお勧めしません」と断じてもいいものだろうか。
5年生存している進行期肺がん患者が急性心筋梗塞を起こしたらどうだろう。
5年生存している進行期肺がん患者が胃潰瘍による出血性ショックを来したらどうだろう。
5年生存している進行期肺がん患者が新型コロナウイルスによる重症肺炎を合併したらどうすべきだろう。
どれも蘇生処置や高度の医療を必要としうる病態だが、治癒不能の進行肺がんがあるので支持療法しかしません、と言えるだろうか。
最近診断された肺がんに対する手術後に急変したら、どうすればいいだろう。
単発の縦隔リンパ節転移を伴うIIIA期の非小細胞肺がん、背景に慢性閉塞性肺疾患とごく軽度の間質性肺炎がある患者。
手術をしてみたら、胸膜播種の所見を認めたため、予定術式を行えずに手術を終えた。
術後に急性呼吸不全を来し、人工呼吸管理が必要となったとき、治癒不能の肺がんと診断がついたので、人工呼吸管理はお勧めしませんと我々は言えるだろうか。
最近診断された肺がんに対する薬物療法後に急変したら、どうすればいいだろう。
多発肺内転移を伴うIVA期の進行非小細胞肺がん、無症状でPS0、ドライバー遺伝子変異陰性、TPS 5%。
化学療法+免疫チェックポイント阻害薬併用で治療をしたら、退院3日後に急性呼吸不全を来し、救急搬入された。
明らかに薬剤性肺障害の所見であるとともに、多発肺内転移は急速に増大している。
急場をしのげば、ステロイドパルス療法が著効するとともに、pseudo-progressionを経てがんの病巣も縮小に転じるかもしれない。
激烈な免疫関連有害事象を経験したその先に、長期生存が待っているかもしれない。
そこまで考えたとき、治癒不能の肺がんで、人工呼吸管理はお勧めしませんと我々は言えるだろうか。
肺がんの病態が緩やかに悪化した場合は、その後をどうするかを関係者みんなが考える時間がある。
しかし、他疾患による急変、治療関連有害事象による急変のとき、時間的にも精神的にもゆとりがない中、どうするのが最善だろうか。
治療が複雑化し、がん拠点病院でなければ治療を受けにくいいまのわが国で、更には新型コロナウイルスの問題も抱えながら、遠方から通って治療を受けている患者に対して、病状悪化時の備えをどのようにするのが正解なのだろうか。
今日の入院患者・家族と急変時対応の話をしながら、ふと考えた。
2021年01月11日
学会報告0005:脳転移再発、定位放射線照射後の長期生存
小細胞肺がんであろうが、非小細胞肺がんであろうが、脳転移のみの再燃、再発というのはなかなか悩ましい。
ドライバー遺伝子変異を伴っており、分子標的薬が使えるならばまだしも。
放射線治療を終えた後の治療方針となると、薬物療法が脳転移に効きにくいのはある程度分かっているので、次の治療を計画しがたい。
とはいえ、経過観察だけでも、結構長生きする人はいる。
近々、最近脳梗塞を起こしたそんな肺がん患者が、リハビリ目的で当院に転院してくる予定。
前回退院からゆうに5年以上経過しているが、その間に脳転移再発を経験し、定位脳照射を受け、後期高齢者ながら独居で頑張っていたようだ。
脳転移が見つかったとき、放射線治療よりも薬物療法を優先する考え方もあるが、私はやはり確実な効果が期待できる定位放射線治療を優先したい。
こういう患者に遭遇すると、どうしてもそんな気持ちになる。
<学会報告0005>
出典:2020年 日本肺癌学会支部会 / 日本呼吸器内視鏡学会支部会
・60代男性、喫煙者
・限局型肺小細胞癌と確定診断
・シスプラチン+エトポシド併用療法+根治的胸部放射線照射
・完全奏効が得られた
・引き続き、予防的全脳照射を行った
・初回治療から2年後、左小脳半球に単発の脳転移を来し再燃
・カルボプラチン+エトポシド併用療法を行うも脳転移巣は縮小せず
・手術は本人が希望せず
・定位脳照射施行
・定位照射後5年以上無増悪生存し、認知機能障害を認めず
ドライバー遺伝子変異を伴っており、分子標的薬が使えるならばまだしも。
放射線治療を終えた後の治療方針となると、薬物療法が脳転移に効きにくいのはある程度分かっているので、次の治療を計画しがたい。
とはいえ、経過観察だけでも、結構長生きする人はいる。
近々、最近脳梗塞を起こしたそんな肺がん患者が、リハビリ目的で当院に転院してくる予定。
前回退院からゆうに5年以上経過しているが、その間に脳転移再発を経験し、定位脳照射を受け、後期高齢者ながら独居で頑張っていたようだ。
脳転移が見つかったとき、放射線治療よりも薬物療法を優先する考え方もあるが、私はやはり確実な効果が期待できる定位放射線治療を優先したい。
こういう患者に遭遇すると、どうしてもそんな気持ちになる。
<学会報告0005>
出典:2020年 日本肺癌学会支部会 / 日本呼吸器内視鏡学会支部会
・60代男性、喫煙者
・限局型肺小細胞癌と確定診断
・シスプラチン+エトポシド併用療法+根治的胸部放射線照射
・完全奏効が得られた
・引き続き、予防的全脳照射を行った
・初回治療から2年後、左小脳半球に単発の脳転移を来し再燃
・カルボプラチン+エトポシド併用療法を行うも脳転移巣は縮小せず
・手術は本人が希望せず
・定位脳照射施行
・定位照射後5年以上無増悪生存し、認知機能障害を認めず
2021年01月10日
母親の子宮頸がんから転移した、子供の転移性肺がん
先日、NHKニュースや地方紙を含めた新聞報道で取り上げられていた話題。
https://www.ncc.go.jp/jp/information/pr_release/2020/20210107/index.html
母親の子宮頸がん由来のがん細胞が、経腟分娩の際に子供の肺へと吸い込まれてそこに生着し、転移性肺がんを発症したという極めて稀な症例報告が、New England Journal of Medicineに掲載された。
次世代シーケンサー解析やFISHといったおなじみのテクノロジーを用いて、子供から検出したがん組織が母親由来であったことが示されている。
学術的に見れば、
・ものすごく稀な症例をまとめて2例報告した
・がんの進行抑制に、同種免疫反応が一役かっている
・同種免疫反応が、免疫チェックポイント阻害薬の有効性にも関わっている
・(疑い例を含む)子宮頸がん合併妊娠では、帝王切開が第一選択である
というメッセージが込められているようだが、計算上は5億件に1件という極めて稀なケースのため、日常臨床に役立つかどうかはわからない。
しかし、ファンタジーとして見るならば、とても興味深い。
報道を見ているだけではわからない細部にこそ、この報告の大切な部分が記されているように感じたので、ほぼ全文を日本語訳して書き残す。
医師免許を持った小説家が好んで取り上げそうな話題ではないだろうか。
2症例ともに母親は既に亡くなった後だが、子供の病に直面し、残された父親や両家の祖父母の戸惑い、心労、治療がうまくいったときの安堵、そして、テクノロジーを駆使して調べた末に、病気が母親由来だったことが判明したときの葛藤など、様々想いを馳せるととても切なくなる。
2症例とも、最後の治療が終わってからまだ2年にも満たないようだが、母親の魂に護られてすくすくと育ってほしいと願うばかりである。
Vaginal Transmission of Cancer from Mothers with Cervical Cancer to Infants
Ayumu Arakawa et al., N Engl J Med 2021; 384:42-50
DOI: 10.1056/NEJMoa2030391
母親から子へのがんの転移は極めてまれとされており、がんに罹患した母親50万人に対して1人の割合で起こるとされている。一方、母親1000人に対して1件の割合で出産時の母親にがんの合併が認められるとされている(ため、一般の出産5億件に対して1件の割合で母親から子へのがんの転移が発生すると見積もられる)。過去に18件、こうした症例が文献報告されている。こうした報告では、母親由来の血液腫瘍(6件)、悪性黒色腫(8件)、肺がん(小細胞がん2件、腺がん1件)、子宮頸がん(神経内分泌がん2件、腺がん1件)はおそらく循環系(経胎盤的)を介して母親から胎児へと移行し、ときに母親由来の腫瘍細胞が子の多臓器(脳、骨、肝、軟部組織)へ播種性に広がっている。文献報告されている症例では、全て子が2歳未満の時点で診断されていた。いくつかの症例では、罹患した子のがん病巣の自然退縮が認められた。経胎盤的な胎児への転移は、胎盤のバリア機能や子の同種免疫反応のために、稀であろうと考えられる。
経胎盤的経路以外にも、出産時の経産道的な子への転移もまた、理論的には起こりうる。もし母親が子宮頸がんに罹患していたとすると、子は産道を通過してくるときに産道内の液体に含まれたがん細胞に暴露され、子の肺内へ母親のがん細胞が吸引されうる。したがって、子宮頸がんに罹患した女性が子を経腟分娩することは、母親から子へのがんの転移の危険因子となりうる。しかしながら、こうしたケースはまれであるがゆえに、裏付けデータが不足している。
今回我々は2件の症例について報告する。母親の子宮頸がんが子へ転移し、小児肺がんを発症したと考えられる症例である。いずれも、国立がん研究センター中央病院で行っていた臨床試験であるTOP-GEAR(Trial of Onco-Panel for Gene-profiling to Estimate both Adverse Events and Response during cancer treatment)に参加した患者の、腫瘍サンプルおよび対を成す正常組織サンプルの、次世代シーケンサー解析の結果解析からたまたま明らかになった。
<症例1>
生後23か月の男児が、痰を伴う咳が2週間続くということで近くの医療機関を受診した。CTを撮影したところ、両肺の気管支分岐に沿うような分布で、多数の腫瘤性病変を認めた。外科的肺生検を行ったところ、部分的に腺組織への分化を示す神経内分泌がんの存在が明らかとなった。
本患者が生まれる7か月前、患者の母親は子宮スメア細胞診を受けており、結果は陰性だった。本患者は妊娠39週で経腟分娩で生まれた。出産当時母親は35歳で、ヒトパピローマウイルスワクチンの接種はしていなかったが、本患者を出産してから3か月後に子宮頸部の扁平上皮がんと確定診断された。確定診断後、母親は広範子宮全摘術及び骨盤内リンパ節郭清を受け、術後補助化学療法を4コース施行された。本患者の外科的肺生検で得られた病理組織像と、母親の子宮頸がんの病理組織像が異なっていたため、この時点では母親から子へのがんの転移は想定していなかった。
両親の希望で、本患者はまめに経過観察された一方で、特段の追加治療は受けてこなかった。外科的肺生検から1年後、残存病巣が増大した。この時点で、3歳となった本患者の追加治療について検討するために、国立がん研究センター中央病院を紹介受診した。驚くべきことに、いくつかの病巣は自然退縮傾向にあった。胸部レントゲン写真で観察された円形の陰影は、両肺に未だ多数の腫瘍病変が残っていることを示唆していた。CTを撮影したところ、気管支分岐に沿って腫瘍病変が広がっていることが確認できた。本患者は、シスプラチン+イリノテカン併用療法を5コース行い、その後にカルボプラチン+エトポシド併用療法を2コース行った。いくつかの病巣は縮小し、その他の病巣は増大した。
母親の方は、術後3年の経過観察期間中に肺、肝、骨転移が明らかとなった。左肺の肺転移巣に対して外科的肺生検を行ったところ、神経内分泌分化を伴う低分化がんと病理診断された。子宮全摘術を行った際の切除標本を詳しく再検討したところ、低分化型扁平上皮がんの組織像の中に、巣状の神経内分泌分化成分を認め、腺がんの組織像を示す部分も一部混じっていた。この部分の病理組織所見は、母親の外科的肺生検標本の病理組織所見、本患者の外科的肺生検標本の病理組織所見と同様だった。
本患者の外科的肺生検がん組織、正常組織、母親の子宮頚がん組織、正常組織を用いて、次世代シーケンサーで遺伝情報を解析した。本患者、母親、どちらのがん組織からも、KRAS G13D変異、TP53 E285K変異が発見された。また、母親由来であり、母親の正常組織と子宮頸がん組織のどちらにも認められるが本患者の正常組織には見られない47ヶの一塩基多型が、本患者の外科的肺生検がん組織から検出された。このことから、本患者のがん組織は母親由来であることがわかった。また、FISH法による解析で、本患者のがん組織には性染色体でいうところのY染色体が欠けていた。全エクソンシーケンスを行ったところ、上記のKRAS変異やTP53変異のほかに20の体細胞変異が見つかり、これは母親と本患者どちらのがん組織にも認められた。本患者に受け継がれなかった母親由来のHLA class I対立遺伝子は、母親と本患者のどちらのがん組織でも欠失していた。PCR法でヒトパピローマウイルスの遺伝子検索を行ったところ、母親と本患者のがん組織から18型ヒトパピローマウイルスが検出された。
2レジメンの化学療法を施行したにもかかわらず病勢進行したため、本患者はニボルマブ療法の臨床試験に参加した。ニボルマブ単剤療法(ニボルマブ3mg/kgを2週間ごとに投与)を④コース行った後、CTで全ての病巣の縮小を認めた。また、腫瘍マーカーのpro-GRPは、治療開始前の1649pg/mlから152pg/mlまで低下した。本患者は計14コースのニボルマブ単剤療法を受けた。治療効果は、新規病変の出現なく7か月間持続した。この時点で、残存病変を切除するために肺葉切除術を施行した。切除標本中にはリンパ組織新生や石灰化を伴う一方で、残存腫瘍細胞の見られない線維化結節を認め、病理学的完全奏効を示唆する所見だった。フローサイトメトリーで解析したところ、免疫細胞が占める割合は腫瘍病巣内で88%と、非腫瘍部の33%と比較して高かった。また、腫瘍病巣内では、CD4陽性T細胞やCD8陽性T細胞と同様に、B細胞も44%と多く含まれていた。これらの所見は、抗PD-1抗体療法の治療反応として合致するものだった。本患者は、肺葉切除後12ヶ月間、無再発状態を維持している。
本患者の母親は、多発転移再発発覚後、ニボルマブ240mgを2週間ごとに使用する第II相臨床試験に参加した。しかしながら、母親の腫瘍は4コースの治療に関わらず進行し、その5か月後に母親は死亡した。免疫組織化学染色による評価では、母親の腫瘍も本患者の腫瘍も、PD-1やPD-L1を発現していなかった。
<症例2>
6歳の男の子が左胸痛を訴えて近くの医療機関を受診した。CTを撮影したところ、左肺門部に6cm大の腫瘤を認め、精査の結果、粘液産生性腺がんと診断された。本患者の母親は、本患者を妊娠しているときに子宮頸部のポリープ様腫瘍を指摘されていた。しかしながら、子宮頸部スメア細胞診では悪性所見なく、無治療経過観察で本病巣は特に変わりなく、妊娠38週で経腟分娩した。産後にあらためて子宮頸部の病巣を生検したところ、腺がんと診断され、大学病院へ紹介され、出産3か月後に広範子宮全摘術+両側付属器切除術を受けた。残念ながら、その2年後に母親はがん死した。こうした経緯があったものの、本患者が6歳になってからのがん発症であったため、母親のがんと本患者のがんは無関係と考えられていた。
本患者の腫瘍は切除困難と判断され、化学療法が行われた。シスプラチン+パクリタキセル併用療法を5コース行った後に、カルボプラチン+パクリタキセル併用療法を3コース行い、さらにパクリタキセル+イリノテカン併用療法を2コース行った。これにより部分奏効が得られ、腫瘍マーカーであるCA19-9は正常域まで低下した。この時点で治療はいったん中断された。その3ヶ月後、左肺に再燃した。再燃後の治療として、ジェムシタビン+ドセタキセル併用療法を5コース行った後にカルボプラチン+パクリタキセル併用療法を1コース行い、引き続いて左肺全摘術を施行した。術後病理所見は粘液産生性腺がんであったが、形態的特徴が通常の原発性肺がんとは異なり、むしろ母親の子宮頸部原発腺がんの病理学的特徴と類似していた。本患者は、術後15ヶ月無再発生存している。
母親の子宮頸部腫瘍と本患者の肺腫瘍を次世代シーケンサーで解析した。予想通り、正常組織は母親と本患者の間で異なる特性を示していたが、母親の腫瘍組織と本患者の腫瘍組織は遺伝子プロファイルが類似しており、母親から本患者へ腫瘍が転移したことが示唆された。どちらの腫瘍もKRASおよびSTK11の遺伝子変異を認め、母親由来であり、母親の正常組織と子宮頸がん組織のどちらにも認められるが本患者の正常組織には見られない38ヶの一塩基多型が、本患者の肺腫瘍組織から検出された。FISH法による解析で、本患者のがん組織には性染色体でいうところのY染色体が欠けていた。全エクソンシーケンスを行ったところ、上記のKRAS変異やSTK11変異のほか14の体細胞変異が見つかり、これは母親と本患者どちらのがん組織にも認められた。本患者に受け継がれなかった母親由来のHLA class I対立遺伝子は、母親と本患者のどちらのがん組織でも欠失していなかった。PCR法でヒトパピローマウイルスの遺伝子検索を行ったところ、母親と本患者のがん組織から16型ヒトパピローマウイルスが検出された。
<考察>
母親の子宮頸部から子供の肺へ転移したと考えられるがんについての2症例を報告した。男児であるにもかかわらずY染色体を欠く腫瘍であったこと、母親のがんと子供のがんが複数の体細胞性変異、ヒトパピローマウイルス遺伝子、一塩基多型を共有していたことが、この事実を示唆していた。どちらの子供でも、がんは気管支周囲に発育しており、出産の際に母親の産道でがん細胞を含む液体を吸い込むことにより、母親から子供へと転移したものと考えられた。母親から子供へと転移したと考えられる他の症例報告では、子供は脳、骨、肝臓、肺、軟部組織といった多系統の臓器転移を呈しており、これは胎盤を介した血行性転移として合致する。一方、今回の2症例においては、病巣は肺のみで、しかも気管支の分布に沿っていた。母親由来のがん細胞は羊水、産道の分泌物、子宮頸部からの出血の中に浮遊しており、経腟分娩のときに子供により吸い込まれるのだろう。今回の2症例は、経腟分娩により母親から子供へと子宮頸がんが転移しうることを示しており、子宮頸がん合併妊娠においては帝王切開が勧められるべきである。
症例1において、母親から子供に受け継がれていなかったHLA class 1対立遺伝子は、母親のがん組織、子供のがん組織、いずれにも認められなかった。こうした現象は、母親から胎児へ白血病細胞が転移した症例においても指摘されている(https://medical.nikkeibp.co.jp/leaf/all/search/cancer/news/200910/512753.html)。HLAタンパクは、同種免疫反応・拒絶反応を引き起こす主要な標的抗原であり、HLA対立遺伝子の欠失は、子供の体内で母親のがん細胞が生存するために役立っていたのかもしれない。症例1では、肺腫瘍が発見されてから1年以内にいくつかの病巣が自然退縮していた。これは、進行した神経内分泌がんでは極めて稀な現象である。加えて、本患者のがん組織がPD-1およびPD-L1のどちらも発現しておらず、さらに本来ほとんどの小児固形がんに免疫チェックポイント阻害薬が無効であるとされているにも関わらず、本患者の残存病変は抗PD-1抗体に反応して縮小した。対照的に、本患者の母親には同じ抗PD-1抗体は無効だった。症例2では、腫瘍の発育速度はとても遅く、本患者が6歳になるまで臨床症状が出現しなかった。こうしたゆっくりした発育は、進行子宮頸部腺がんではとても稀である。それゆえ、子供の体内における同種免疫反応が腫瘍発育速度に影響していたと考えられる。
https://www.ncc.go.jp/jp/information/pr_release/2020/20210107/index.html
母親の子宮頸がん由来のがん細胞が、経腟分娩の際に子供の肺へと吸い込まれてそこに生着し、転移性肺がんを発症したという極めて稀な症例報告が、New England Journal of Medicineに掲載された。
次世代シーケンサー解析やFISHといったおなじみのテクノロジーを用いて、子供から検出したがん組織が母親由来であったことが示されている。
学術的に見れば、
・ものすごく稀な症例をまとめて2例報告した
・がんの進行抑制に、同種免疫反応が一役かっている
・同種免疫反応が、免疫チェックポイント阻害薬の有効性にも関わっている
・(疑い例を含む)子宮頸がん合併妊娠では、帝王切開が第一選択である
というメッセージが込められているようだが、計算上は5億件に1件という極めて稀なケースのため、日常臨床に役立つかどうかはわからない。
しかし、ファンタジーとして見るならば、とても興味深い。
報道を見ているだけではわからない細部にこそ、この報告の大切な部分が記されているように感じたので、ほぼ全文を日本語訳して書き残す。
医師免許を持った小説家が好んで取り上げそうな話題ではないだろうか。
2症例ともに母親は既に亡くなった後だが、子供の病に直面し、残された父親や両家の祖父母の戸惑い、心労、治療がうまくいったときの安堵、そして、テクノロジーを駆使して調べた末に、病気が母親由来だったことが判明したときの葛藤など、様々想いを馳せるととても切なくなる。
2症例とも、最後の治療が終わってからまだ2年にも満たないようだが、母親の魂に護られてすくすくと育ってほしいと願うばかりである。
Vaginal Transmission of Cancer from Mothers with Cervical Cancer to Infants
Ayumu Arakawa et al., N Engl J Med 2021; 384:42-50
DOI: 10.1056/NEJMoa2030391
母親から子へのがんの転移は極めてまれとされており、がんに罹患した母親50万人に対して1人の割合で起こるとされている。一方、母親1000人に対して1件の割合で出産時の母親にがんの合併が認められるとされている(ため、一般の出産5億件に対して1件の割合で母親から子へのがんの転移が発生すると見積もられる)。過去に18件、こうした症例が文献報告されている。こうした報告では、母親由来の血液腫瘍(6件)、悪性黒色腫(8件)、肺がん(小細胞がん2件、腺がん1件)、子宮頸がん(神経内分泌がん2件、腺がん1件)はおそらく循環系(経胎盤的)を介して母親から胎児へと移行し、ときに母親由来の腫瘍細胞が子の多臓器(脳、骨、肝、軟部組織)へ播種性に広がっている。文献報告されている症例では、全て子が2歳未満の時点で診断されていた。いくつかの症例では、罹患した子のがん病巣の自然退縮が認められた。経胎盤的な胎児への転移は、胎盤のバリア機能や子の同種免疫反応のために、稀であろうと考えられる。
経胎盤的経路以外にも、出産時の経産道的な子への転移もまた、理論的には起こりうる。もし母親が子宮頸がんに罹患していたとすると、子は産道を通過してくるときに産道内の液体に含まれたがん細胞に暴露され、子の肺内へ母親のがん細胞が吸引されうる。したがって、子宮頸がんに罹患した女性が子を経腟分娩することは、母親から子へのがんの転移の危険因子となりうる。しかしながら、こうしたケースはまれであるがゆえに、裏付けデータが不足している。
今回我々は2件の症例について報告する。母親の子宮頸がんが子へ転移し、小児肺がんを発症したと考えられる症例である。いずれも、国立がん研究センター中央病院で行っていた臨床試験であるTOP-GEAR(Trial of Onco-Panel for Gene-profiling to Estimate both Adverse Events and Response during cancer treatment)に参加した患者の、腫瘍サンプルおよび対を成す正常組織サンプルの、次世代シーケンサー解析の結果解析からたまたま明らかになった。
<症例1>
生後23か月の男児が、痰を伴う咳が2週間続くということで近くの医療機関を受診した。CTを撮影したところ、両肺の気管支分岐に沿うような分布で、多数の腫瘤性病変を認めた。外科的肺生検を行ったところ、部分的に腺組織への分化を示す神経内分泌がんの存在が明らかとなった。
本患者が生まれる7か月前、患者の母親は子宮スメア細胞診を受けており、結果は陰性だった。本患者は妊娠39週で経腟分娩で生まれた。出産当時母親は35歳で、ヒトパピローマウイルスワクチンの接種はしていなかったが、本患者を出産してから3か月後に子宮頸部の扁平上皮がんと確定診断された。確定診断後、母親は広範子宮全摘術及び骨盤内リンパ節郭清を受け、術後補助化学療法を4コース施行された。本患者の外科的肺生検で得られた病理組織像と、母親の子宮頸がんの病理組織像が異なっていたため、この時点では母親から子へのがんの転移は想定していなかった。
両親の希望で、本患者はまめに経過観察された一方で、特段の追加治療は受けてこなかった。外科的肺生検から1年後、残存病巣が増大した。この時点で、3歳となった本患者の追加治療について検討するために、国立がん研究センター中央病院を紹介受診した。驚くべきことに、いくつかの病巣は自然退縮傾向にあった。胸部レントゲン写真で観察された円形の陰影は、両肺に未だ多数の腫瘍病変が残っていることを示唆していた。CTを撮影したところ、気管支分岐に沿って腫瘍病変が広がっていることが確認できた。本患者は、シスプラチン+イリノテカン併用療法を5コース行い、その後にカルボプラチン+エトポシド併用療法を2コース行った。いくつかの病巣は縮小し、その他の病巣は増大した。
母親の方は、術後3年の経過観察期間中に肺、肝、骨転移が明らかとなった。左肺の肺転移巣に対して外科的肺生検を行ったところ、神経内分泌分化を伴う低分化がんと病理診断された。子宮全摘術を行った際の切除標本を詳しく再検討したところ、低分化型扁平上皮がんの組織像の中に、巣状の神経内分泌分化成分を認め、腺がんの組織像を示す部分も一部混じっていた。この部分の病理組織所見は、母親の外科的肺生検標本の病理組織所見、本患者の外科的肺生検標本の病理組織所見と同様だった。
本患者の外科的肺生検がん組織、正常組織、母親の子宮頚がん組織、正常組織を用いて、次世代シーケンサーで遺伝情報を解析した。本患者、母親、どちらのがん組織からも、KRAS G13D変異、TP53 E285K変異が発見された。また、母親由来であり、母親の正常組織と子宮頸がん組織のどちらにも認められるが本患者の正常組織には見られない47ヶの一塩基多型が、本患者の外科的肺生検がん組織から検出された。このことから、本患者のがん組織は母親由来であることがわかった。また、FISH法による解析で、本患者のがん組織には性染色体でいうところのY染色体が欠けていた。全エクソンシーケンスを行ったところ、上記のKRAS変異やTP53変異のほかに20の体細胞変異が見つかり、これは母親と本患者どちらのがん組織にも認められた。本患者に受け継がれなかった母親由来のHLA class I対立遺伝子は、母親と本患者のどちらのがん組織でも欠失していた。PCR法でヒトパピローマウイルスの遺伝子検索を行ったところ、母親と本患者のがん組織から18型ヒトパピローマウイルスが検出された。
2レジメンの化学療法を施行したにもかかわらず病勢進行したため、本患者はニボルマブ療法の臨床試験に参加した。ニボルマブ単剤療法(ニボルマブ3mg/kgを2週間ごとに投与)を④コース行った後、CTで全ての病巣の縮小を認めた。また、腫瘍マーカーのpro-GRPは、治療開始前の1649pg/mlから152pg/mlまで低下した。本患者は計14コースのニボルマブ単剤療法を受けた。治療効果は、新規病変の出現なく7か月間持続した。この時点で、残存病変を切除するために肺葉切除術を施行した。切除標本中にはリンパ組織新生や石灰化を伴う一方で、残存腫瘍細胞の見られない線維化結節を認め、病理学的完全奏効を示唆する所見だった。フローサイトメトリーで解析したところ、免疫細胞が占める割合は腫瘍病巣内で88%と、非腫瘍部の33%と比較して高かった。また、腫瘍病巣内では、CD4陽性T細胞やCD8陽性T細胞と同様に、B細胞も44%と多く含まれていた。これらの所見は、抗PD-1抗体療法の治療反応として合致するものだった。本患者は、肺葉切除後12ヶ月間、無再発状態を維持している。
本患者の母親は、多発転移再発発覚後、ニボルマブ240mgを2週間ごとに使用する第II相臨床試験に参加した。しかしながら、母親の腫瘍は4コースの治療に関わらず進行し、その5か月後に母親は死亡した。免疫組織化学染色による評価では、母親の腫瘍も本患者の腫瘍も、PD-1やPD-L1を発現していなかった。
<症例2>
6歳の男の子が左胸痛を訴えて近くの医療機関を受診した。CTを撮影したところ、左肺門部に6cm大の腫瘤を認め、精査の結果、粘液産生性腺がんと診断された。本患者の母親は、本患者を妊娠しているときに子宮頸部のポリープ様腫瘍を指摘されていた。しかしながら、子宮頸部スメア細胞診では悪性所見なく、無治療経過観察で本病巣は特に変わりなく、妊娠38週で経腟分娩した。産後にあらためて子宮頸部の病巣を生検したところ、腺がんと診断され、大学病院へ紹介され、出産3か月後に広範子宮全摘術+両側付属器切除術を受けた。残念ながら、その2年後に母親はがん死した。こうした経緯があったものの、本患者が6歳になってからのがん発症であったため、母親のがんと本患者のがんは無関係と考えられていた。
本患者の腫瘍は切除困難と判断され、化学療法が行われた。シスプラチン+パクリタキセル併用療法を5コース行った後に、カルボプラチン+パクリタキセル併用療法を3コース行い、さらにパクリタキセル+イリノテカン併用療法を2コース行った。これにより部分奏効が得られ、腫瘍マーカーであるCA19-9は正常域まで低下した。この時点で治療はいったん中断された。その3ヶ月後、左肺に再燃した。再燃後の治療として、ジェムシタビン+ドセタキセル併用療法を5コース行った後にカルボプラチン+パクリタキセル併用療法を1コース行い、引き続いて左肺全摘術を施行した。術後病理所見は粘液産生性腺がんであったが、形態的特徴が通常の原発性肺がんとは異なり、むしろ母親の子宮頸部原発腺がんの病理学的特徴と類似していた。本患者は、術後15ヶ月無再発生存している。
母親の子宮頸部腫瘍と本患者の肺腫瘍を次世代シーケンサーで解析した。予想通り、正常組織は母親と本患者の間で異なる特性を示していたが、母親の腫瘍組織と本患者の腫瘍組織は遺伝子プロファイルが類似しており、母親から本患者へ腫瘍が転移したことが示唆された。どちらの腫瘍もKRASおよびSTK11の遺伝子変異を認め、母親由来であり、母親の正常組織と子宮頸がん組織のどちらにも認められるが本患者の正常組織には見られない38ヶの一塩基多型が、本患者の肺腫瘍組織から検出された。FISH法による解析で、本患者のがん組織には性染色体でいうところのY染色体が欠けていた。全エクソンシーケンスを行ったところ、上記のKRAS変異やSTK11変異のほか14の体細胞変異が見つかり、これは母親と本患者どちらのがん組織にも認められた。本患者に受け継がれなかった母親由来のHLA class I対立遺伝子は、母親と本患者のどちらのがん組織でも欠失していなかった。PCR法でヒトパピローマウイルスの遺伝子検索を行ったところ、母親と本患者のがん組織から16型ヒトパピローマウイルスが検出された。
<考察>
母親の子宮頸部から子供の肺へ転移したと考えられるがんについての2症例を報告した。男児であるにもかかわらずY染色体を欠く腫瘍であったこと、母親のがんと子供のがんが複数の体細胞性変異、ヒトパピローマウイルス遺伝子、一塩基多型を共有していたことが、この事実を示唆していた。どちらの子供でも、がんは気管支周囲に発育しており、出産の際に母親の産道でがん細胞を含む液体を吸い込むことにより、母親から子供へと転移したものと考えられた。母親から子供へと転移したと考えられる他の症例報告では、子供は脳、骨、肝臓、肺、軟部組織といった多系統の臓器転移を呈しており、これは胎盤を介した血行性転移として合致する。一方、今回の2症例においては、病巣は肺のみで、しかも気管支の分布に沿っていた。母親由来のがん細胞は羊水、産道の分泌物、子宮頸部からの出血の中に浮遊しており、経腟分娩のときに子供により吸い込まれるのだろう。今回の2症例は、経腟分娩により母親から子供へと子宮頸がんが転移しうることを示しており、子宮頸がん合併妊娠においては帝王切開が勧められるべきである。
症例1において、母親から子供に受け継がれていなかったHLA class 1対立遺伝子は、母親のがん組織、子供のがん組織、いずれにも認められなかった。こうした現象は、母親から胎児へ白血病細胞が転移した症例においても指摘されている(https://medical.nikkeibp.co.jp/leaf/all/search/cancer/news/200910/512753.html)。HLAタンパクは、同種免疫反応・拒絶反応を引き起こす主要な標的抗原であり、HLA対立遺伝子の欠失は、子供の体内で母親のがん細胞が生存するために役立っていたのかもしれない。症例1では、肺腫瘍が発見されてから1年以内にいくつかの病巣が自然退縮していた。これは、進行した神経内分泌がんでは極めて稀な現象である。加えて、本患者のがん組織がPD-1およびPD-L1のどちらも発現しておらず、さらに本来ほとんどの小児固形がんに免疫チェックポイント阻害薬が無効であるとされているにも関わらず、本患者の残存病変は抗PD-1抗体に反応して縮小した。対照的に、本患者の母親には同じ抗PD-1抗体は無効だった。症例2では、腫瘍の発育速度はとても遅く、本患者が6歳になるまで臨床症状が出現しなかった。こうしたゆっくりした発育は、進行子宮頸部腺がんではとても稀である。それゆえ、子供の体内における同種免疫反応が腫瘍発育速度に影響していたと考えられる。
2021年01月06日
FDAが進展型肺小細胞がんの三次治療以降でのニボルマブ承認を取り消し
2018年08月、米国食品医薬品局は、進展型肺小細胞がんの三次治療以降でニボルマブ単剤療法を承認していた。
http://oitahaiganpractice.junglekouen.com/e940275.html
ところが、2020/12/29付で、本承認を取り消す趣旨の発表がブリストルマイヤーズ社から発出されていたらしい。
Nivolumab Indication in Small Cell Lung Cancer Withdrawn in U.S. Market
By The ASCO Post Staff
Posted: 1/4/2021 10:45:00 AM
Last Updated: 1/5/2021 2:17:22 PM
2018年、ニボルマブは米国食品医薬品局から、プラチナ併用化学療法1レジメンと少なくとももう1レジメンの治療の末に病勢進行に至った肺小細胞がん患者の治療として、迅速承認の対象薬となっていた。本迅速承認は、CheckMate 032試験における、代替エンドポイント(奏効割合と奏効持続期間)での評価で有望な結果が認められたからだった。しかし、CheckMate451試験やCheckMate331試験といった、真のエンドポイントである全生存期間の延長を達成できるかという確認試験では有効性が示されず、本適応でのニボルマブの承認は取り消されることになった。
http://oitahaiganpractice.junglekouen.com/e940275.html
ところが、2020/12/29付で、本承認を取り消す趣旨の発表がブリストルマイヤーズ社から発出されていたらしい。
Nivolumab Indication in Small Cell Lung Cancer Withdrawn in U.S. Market
By The ASCO Post Staff
Posted: 1/4/2021 10:45:00 AM
Last Updated: 1/5/2021 2:17:22 PM
2018年、ニボルマブは米国食品医薬品局から、プラチナ併用化学療法1レジメンと少なくとももう1レジメンの治療の末に病勢進行に至った肺小細胞がん患者の治療として、迅速承認の対象薬となっていた。本迅速承認は、CheckMate 032試験における、代替エンドポイント(奏効割合と奏効持続期間)での評価で有望な結果が認められたからだった。しかし、CheckMate451試験やCheckMate331試験といった、真のエンドポイントである全生存期間の延長を達成できるかという確認試験では有効性が示されず、本適応でのニボルマブの承認は取り消されることになった。
2021年01月06日
学会報告0004:術前診断のついていなかった小細胞肺がん手術例のまとめ
肺小細胞癌の治療の柱は放射線治療と薬物療法とされるが、手術で治療される患者も稀ながら存在する。
術前診断困難な小さな肺がんを切除してみたら、たまたま小細胞癌だったというパターンである。
昨年の学会で、興味深い報告があったので取り上げる。
私は肺がん疑い患者の初診時は、CEA、CYFRA、proGRPを腫瘍マーカーとして測定しているが、この報告には勇気づけられた。
根治的切除を目指した、すなわち比較的早期の肺がん患者において、小細胞肺癌であればその半数で術前proGRPが高値であり、小細胞肺癌でなければ98%はproGRPが正常だったということだ。
また、術中迅速診断と最終診断の一致率がわずか14%だったというのも興味深い。
小細胞癌か非小細胞癌かで、術後薬物療法の方針が大きく異なるため、きちんと最終診断の組織型を確認しなければ足元をすくわれることになる。
<学会報告0004>
出典:2020年 日本肺癌学会支部会 / 日本呼吸器内視鏡学会支部会
・確定診断未決の肺結節に対して手術を行い、病理学的に小細胞がんと診断された患者を後方視的に検討した
・約10年間で、該当する患者は14人に上った
・術前のCTでは、全て充実性結節の所見だった
・肺葉切除7人、部分切除1人、試験開胸6人
・術中迅速診断と最終診断が一致したのは、14人中わずか2人だけだった
・同じ期間内に、根治的切除を目指して手術を行った原発性肺癌患者のうち、術前にproGRPを測定した189人についても検討した
・189人中、非小細胞肺癌は179人、小細胞肺癌は10人だった
・proGRPによる小細胞肺癌の検出精度は、感度(小細胞肺癌患者のうち、proGRP高値だった患者の割合)50.0%、特異度(小細胞肺癌でなかった患者のうち、proGRP正常だった患者の割合)97.8%だった
術前診断困難な小さな肺がんを切除してみたら、たまたま小細胞癌だったというパターンである。
昨年の学会で、興味深い報告があったので取り上げる。
私は肺がん疑い患者の初診時は、CEA、CYFRA、proGRPを腫瘍マーカーとして測定しているが、この報告には勇気づけられた。
根治的切除を目指した、すなわち比較的早期の肺がん患者において、小細胞肺癌であればその半数で術前proGRPが高値であり、小細胞肺癌でなければ98%はproGRPが正常だったということだ。
また、術中迅速診断と最終診断の一致率がわずか14%だったというのも興味深い。
小細胞癌か非小細胞癌かで、術後薬物療法の方針が大きく異なるため、きちんと最終診断の組織型を確認しなければ足元をすくわれることになる。
<学会報告0004>
出典:2020年 日本肺癌学会支部会 / 日本呼吸器内視鏡学会支部会
・確定診断未決の肺結節に対して手術を行い、病理学的に小細胞がんと診断された患者を後方視的に検討した
・約10年間で、該当する患者は14人に上った
・術前のCTでは、全て充実性結節の所見だった
・肺葉切除7人、部分切除1人、試験開胸6人
・術中迅速診断と最終診断が一致したのは、14人中わずか2人だけだった
・同じ期間内に、根治的切除を目指して手術を行った原発性肺癌患者のうち、術前にproGRPを測定した189人についても検討した
・189人中、非小細胞肺癌は179人、小細胞肺癌は10人だった
・proGRPによる小細胞肺癌の検出精度は、感度(小細胞肺癌患者のうち、proGRP高値だった患者の割合)50.0%、特異度(小細胞肺癌でなかった患者のうち、proGRP正常だった患者の割合)97.8%だった
2021年01月06日
アムルビシンと心毒性
正直言って、油断していた。
再燃後の小細胞肺がんに対して、二次治療としてアムルビシン単剤療法をしていた患者。
④コース終了後の効果は病勢安定の範囲内、骨髄抑制はそれなりに出たがどうにかマネジメント可能で、いけるところまで継続しようと考えていた。
⑤コース目に入る直前の診察で患者から、
「最近、ちょっと歩いたり話したりするだけでも息切れを感じることが多くなった」
という訴えがあった。
右肺中葉がほぼ無気肺に陥っていたのでそのせいかと高を括っていたのだが、すこし違和感を感じる。
息切れの症状は確かにあり、会話時の言葉はとぎれとぎれだが、それにしては酸素飽和度がよく、90%台後半を維持している。
それよりも気になるのは、脈拍。
安静時は正常範囲内だが、ちょっと歩いただけで一気に120-130/分まで脈拍が増える。
心電図を調べたところ、もともとは正常所見だったのに、I誘導、V2-6誘導でST-T波の陰転化を認めた。
心エコーでは、左室駆出率は50%未満まで低下、左室収縮は全般にやや低下していた。
虚血性心疾患(狭心症、心筋梗塞)を思わせるような臨床所見は指摘しがたく、アムルビシンによる心筋障害と断定し、アムルビシン投与は見合わせた。
改めて添付文書を見直してみると、アムルビシンによる心毒性の頻度は結構高い。
https://www.kegg.jp/medicus-bin/japic_med?japic_code=00049228
心電図以上の出現率は5%以上、心機能低下や心不全症状出現も0.5-5%程度と無視できない。
添付文書よりも詳しいインタビューフォームも参照してみた。
http://image.packageinsert.jp/pdf.php?mode=1&yjcode=4235406D1020
臨床試験のデータからも、3-4%程度は心不全症状を伴う心毒性が出ると見て良さそうだ。
通常の診察では見つけきれなかった。
患者の訴えと、習慣になっている入院時心電図検査に救われた。
できる限り心機能の是正を図り、三次治療につなげたい。
再燃後の小細胞肺がんに対して、二次治療としてアムルビシン単剤療法をしていた患者。
④コース終了後の効果は病勢安定の範囲内、骨髄抑制はそれなりに出たがどうにかマネジメント可能で、いけるところまで継続しようと考えていた。
⑤コース目に入る直前の診察で患者から、
「最近、ちょっと歩いたり話したりするだけでも息切れを感じることが多くなった」
という訴えがあった。
右肺中葉がほぼ無気肺に陥っていたのでそのせいかと高を括っていたのだが、すこし違和感を感じる。
息切れの症状は確かにあり、会話時の言葉はとぎれとぎれだが、それにしては酸素飽和度がよく、90%台後半を維持している。
それよりも気になるのは、脈拍。
安静時は正常範囲内だが、ちょっと歩いただけで一気に120-130/分まで脈拍が増える。
心電図を調べたところ、もともとは正常所見だったのに、I誘導、V2-6誘導でST-T波の陰転化を認めた。
心エコーでは、左室駆出率は50%未満まで低下、左室収縮は全般にやや低下していた。
虚血性心疾患(狭心症、心筋梗塞)を思わせるような臨床所見は指摘しがたく、アムルビシンによる心筋障害と断定し、アムルビシン投与は見合わせた。
改めて添付文書を見直してみると、アムルビシンによる心毒性の頻度は結構高い。
https://www.kegg.jp/medicus-bin/japic_med?japic_code=00049228
心電図以上の出現率は5%以上、心機能低下や心不全症状出現も0.5-5%程度と無視できない。
添付文書よりも詳しいインタビューフォームも参照してみた。
http://image.packageinsert.jp/pdf.php?mode=1&yjcode=4235406D1020
臨床試験のデータからも、3-4%程度は心不全症状を伴う心毒性が出ると見て良さそうだ。
通常の診察では見つけきれなかった。
患者の訴えと、習慣になっている入院時心電図検査に救われた。
できる限り心機能の是正を図り、三次治療につなげたい。
2021年01月03日
学会報告0003+α:AYA世代のALK陽性原発性肺がん
ぽつりぽつりとではあるが、ALK陽性肺がん、ROS1陽性肺がん、いずれも目にすることが増えてきた。
また、20代、30代の肺がん患者にも時々遭遇する。
今回は若い肺がん患者について取り扱う。
<学会報告0003>
出典:2020年、日本肺癌学会総会
10代女性。
検診の胸部レントゲンで異常を指摘された。
胸部CTで右肺上葉に腫瘤影を認めた。
PET/CTでも、同部位に強いFDGの集積を認めた。
気管支鏡検査で原発性肺腺がんと診断した。
全身検索を行い、cT2aN0M0, stage IBと臨床病期診断した。
手術適応と判断し、胸腔鏡下右肺上葉切除術を施行した。
術後病理所見では、背景に豊富な粘液を伴い、乳頭型・微小乳頭型、腺房型、肺胞上皮置換型の成分が混在した腺がんだった。
免疫染色及びFISHにて、ALK融合遺伝子を検出した。
<+α>
出典:2020年、日本肺癌学会総会
2010年から2019年までに切除術を行った約930人の原発性肺がん患者のうち、40歳以下の患者は5人(0.5%)だった。
男性1人、女性4人。
年齢は26-40歳、中央値は36歳。
腺がん2人、腺扁平上皮がん1人、多型がん1人、粘表皮がん1人。
術後病理病期はIA期3人(腺がん、粘表皮がん)、IIB期1人(多型がん)、IIIA期1人(腺扁平上皮がん)。
腺がんは2人とも女性、30代、ALK陽性だった。
印象:
10代の原発性肺がん患者は正直言って経験がない。
若い女性の肺腺がんを見つけたら、EGFR、ALKをはじめとして、ドライバー遺伝子変異の有無を積極的に調べたい。
血栓形成傾向が強ければROS1も念頭に置くのは言うまでもない。
また、20代、30代の肺がん患者にも時々遭遇する。
今回は若い肺がん患者について取り扱う。
<学会報告0003>
出典:2020年、日本肺癌学会総会
10代女性。
検診の胸部レントゲンで異常を指摘された。
胸部CTで右肺上葉に腫瘤影を認めた。
PET/CTでも、同部位に強いFDGの集積を認めた。
気管支鏡検査で原発性肺腺がんと診断した。
全身検索を行い、cT2aN0M0, stage IBと臨床病期診断した。
手術適応と判断し、胸腔鏡下右肺上葉切除術を施行した。
術後病理所見では、背景に豊富な粘液を伴い、乳頭型・微小乳頭型、腺房型、肺胞上皮置換型の成分が混在した腺がんだった。
免疫染色及びFISHにて、ALK融合遺伝子を検出した。
<+α>
出典:2020年、日本肺癌学会総会
2010年から2019年までに切除術を行った約930人の原発性肺がん患者のうち、40歳以下の患者は5人(0.5%)だった。
男性1人、女性4人。
年齢は26-40歳、中央値は36歳。
腺がん2人、腺扁平上皮がん1人、多型がん1人、粘表皮がん1人。
術後病理病期はIA期3人(腺がん、粘表皮がん)、IIB期1人(多型がん)、IIIA期1人(腺扁平上皮がん)。
腺がんは2人とも女性、30代、ALK陽性だった。
印象:
10代の原発性肺がん患者は正直言って経験がない。
若い女性の肺腺がんを見つけたら、EGFR、ALKをはじめとして、ドライバー遺伝子変異の有無を積極的に調べたい。
血栓形成傾向が強ければROS1も念頭に置くのは言うまでもない。



