2024年12月26日
・Osi-risk TORG-TG2101試験・・・オシメルチニブ投与中止後のEGFR-TKI再投与とその安全性について
今年ももうすぐ終わりですね。
振り返ってみれば、あまり筆が進まない1年でした。
理由は様々です。
・有望だと報告される治療があまりに多すぎて、どれから手を付けていいかわからない
・免疫チェックポイント阻害薬関連では、近年周術期や局所進行期に関する報告が多数を占めていて、進行期の治療については材料が出尽くした感がある
・分子標的薬関連では、希少なドライバー遺伝子変異集団における治療選択肢が増えた、という報告が多かった
・本業が忙しく、ブログ運営に割ける余力が減った
・母に進行肺腺がん皮膚転移による病状悪化を疑わせることがあり、落ち着かなかった
・義父の進行肺腺がんの病状が現在進行形であまり思わしくない
・自分自身も手術を受けなくてはならなくなり、診断結果によってはがんサバイバーの仲間入り
ことに自分自身の病気については想像していたより遥かに影響がありました。
詳しくは別の記事で書きます。
入院して3日目を迎え、明日は手術を受ける予定です。
手術はおろか、入院生活すら人生で初めての経験です。
クリスマス、子供の誕生日、年末年始と、入院患者として病院で過ごすことになりました。
過敏と言ってもいいくらい感染対策が万全の病院で、新型コロナウイルスPCRが陰性であることを確認しないと入院させてもらえませんでした(専用病室で3時間ほど待機しました)し、外出・外泊はもちろんのこと、入院したが最期、退院するまで面会謝絶です。
そんなわけで自由時間がたくさんあるので、周術期で身動きが取れない期間を除いては、病棟内で運動したり、読書をしたり、論文を読んだり、ブログを書くことにしました。
今回取り上げるのは、オシメルチニブ初回治療後に薬剤性肺障害を来した場合、肺障害回復後にEGFR-TKI再投与をしてもよいものか、という後方視的研究です。
薬剤性肺障害を起こした後にEGFR-TKI再投与すること自体、なかなか"challenging"な診療だと思うのですが、実際のところオシメルチニブ再投与で50%、その他のEGFR-TKIにスイッチしても15%程度は薬剤性肺障害の再燃に見舞われるようです。
当たり前と言えば当たり前、オシメルチニブ再投与に至っては50%で済んでまだましだったのでは、という気もします。
とはいえ、せっかく腫瘍縮小効果が得られたのに薬剤性肺障害で治療中止せざるを得なくなった、となると再投与したくなるのは人情です。
考察の項でまとめられていたように、患者さん、ご家族と担当医が再投与のリスクを共有したうえで取り組むのであれば、選択肢としてはアリなのかもしれません。
Real-World Data on Subsequent Therapy for First-Line Osimertinib-Induced Pneumonitis: Safety of EGFR-TKI Rechallenge (Osi-risk Study TORG-TG2101)
Nishioka et al.
Target Oncol. 2024 May;19(3):423-433.
doi: 10.1007/s11523-024-01048-x. Epub 2024 Apr 13.
背景:
オシメルチニブはEGFR遺伝子変異陽性進行肺がんに対する有望な治療選択肢ではあるが、この薬を使用したときの薬剤性肺障害合併割合はとりわけ日本人で高い。さらには、薬剤性肺障害から回復したあと、EGFR-TKI再投与(rechallenge)を含む次治療の安全性と有効性についてはいまだ明らかでない。
目的:
初回治療でオシメルチニブを使用したのちに薬剤性肺障害を来した患者において、EGFR-TKI rechallengeの安全性を検証することを本研究の目的とし、rechallenge後の薬剤性肺障害再発に主眼を置いた。
方法:
2018年08月から2020年09月にかけて、日本国内34施設から後方視的に患者を集積した。EGFR遺伝子変異陽性肺がん患者で、オシメルチニブによる初回治療後に薬剤性肺障害を来した患者を対象とした。
結果:
124人が解析対象となった。そのうち68人(54.8%)はEGFR-TKI rechallengeを受けた。EGFR-TKI rechallenge後の薬剤性肺障害再発割合は、12ヶ月時点で27%(95%信頼区間17-39)だった。薬剤性肺障害再発累積発生数は、その他の(第1/2世代)EGFR-TKI rechallenge集団と比較して、オシメルチニブrechallenge集団で有意に高かった(ハザード比3.1、95%信頼区間1.3-7.5、p=0.013)。多変数解析の結果、rechallengeで使用したEGFR-TKIの種類(オシメルチニブ vs その他のEGFR-TKI)と薬剤性肺障害再発の間に有意な相関が見られ、薬剤性肺障害初発時の重症度や状態とは関連がなかった(ハザード比3.29、95%信頼区間1.12-9.68、p=0.03)。
結論:
初回治療でオシメルチニブを使用し、薬剤性肺障害により中止したのちにオシメルチニブrechallengeを行った場合、その他のEGFR-TKIでrechallengeを行うのと比較して薬剤性肺障害再発割合が高い。
本文より:
・オシメルチニブは第3世代のEGFR-TKIであり、第1世代と比較して無増悪生存期間や全生存期間を延長することが知られている
・一方、FLAURA試験やOsi-fact研究の結果から、日本人にオシメルチニブを使用した場合の薬剤性肺障害発生割合が高いことも知られている(FLAURA試験:12.3%、Osi-fact研究:12.8%)
・画像所見上は薬剤性肺障害と同一だが自覚症状を伴わない、一過性無症候性すりガラス陰影(transient asymptomatic pulmonary opacity, TAPO)が報告されており、薬剤性肺障害とは異なる現象と考えられていて、TAPOを認めてもオシメルチニブ投与を継続することが許容されている
・しかしながら、TAPOの発生機序や診断基準は今のところ明確でない
・今回の研究では、オシメルチニブ使用後に薬剤性肺障害を来したEGFR遺伝子変異陽性非小細胞肺がん患者におけるその後の治療についてのリアルワールドデータを集積することと、EGFR-TKIのrechallenge治療の安全性を評価することを目的とした
・日本国内34施設で、オシメルチニブによる初回治療後に薬剤性肺障害を起こしたEGFR遺伝子変異陽性切除不能非小細胞肺がん患者の臨床情報を後方視的に見直した
・2018年08月から2020年09月の期間に治療を受けた患者を対象とした
・UICC-TNM分類第8版を用いて病期分類した
・データ集積は2021/03/31で打ち切った
・本試験は参加した各施設の倫理委員会で承認され、インフォームド・コンセントは各施設ホームページ上に掲載したオプトアウトの形式を用いて行った
・本試験におけるEGFR-TKI rechallenge治療は、オシメルチニブによる初回治療後に最初の薬剤性肺障害を起こしたのち、二次治療以降の治療でオシメルチニブを含むEGFR-TKIを再投与することと定義した
・TAPOと診断されオシメルチニブを継続投与された患者においては、オシメルチニブによる初回治療期間はオシメルチニブの初回治療を開始してからTAPOと診断されるまでの期間とし、EGFR-TKIのrechallenge治療期間はTAPOと診断されてからオシメルチニブの最終投与日または患者死亡日までとした
・EGFR-TKIによる薬剤性肺障害のCT所見は以下のように分類した
〇器質化肺炎(OP)パターン:末梢優位の多発斑状陰影
〇過敏性肺臓炎(HP)パターン
〇びまん性肺胞障害(DAD)パターン
〇非特異型間質性肺炎(NSIP)パターン
〇分類不能(NE)パターン
・124人の患者が集積された
・大多数の患者がECOG-PS 0-1(85.5%)で、組織型は腺がん(98.4%)だった
・PD-L1≧50%の患者は12.1%だった
・オシメルチニブによる薬剤性肺障害を重症度別に分類すると、grade 1が32.3%、grade 2が33.9%、grade 3が25.8%、grade 4が1.6%、grade 5が6.4%だった
・オシメルチニブの初回投与開始から薬剤性肺障害発症までの期間中央値は60日間(3-434)だった
・全体集団と、EGFR-TKIのrechallenge集団との間に、患者背景の差はなかった
・rechallenge集団は68人、ECOG-PS 0-1(88.3%)、腺がん(97.1%)、PD-L1≧50%(7.4%)、オシメルチニブ開始から薬剤性肺障害発生までの期間中央値56.5日間(5-434)だった
・rechallenge集団には、オシメルチニブによる初回治療でgrade4の薬剤性肺障害を起こした患者はいなかった
・全体集団124人のうち、87人が二次治療を受け、うち46人はEGFR-TKI rechallenge治療を受け、41人は化学療法を受けた
・二次治療のEGFR-TKIで最も多く用いられたのはオシメルチニブ(19人、41.3%)で、二次治療の化学療法で最も多く用いられたのはカルボプラチン+ペメトレキセド併用療法(12人、29.3%)だった
・二次治療で化学療法を受けた患者のうち、22人は二次治療後最終的にEGFR-TKIのrechallenge治療を受けた
・結局、総計68人の患者がEGFR-TKIのrechallenge治療を受けた
・研究期間中、薬剤性肺障害が再発するまでの期間は中央値に達しなかった(範囲は18.8ヶ月-未到達)
・3ヶ月薬剤性肺障害再発割合は21%(95%信頼区間12-32)、6ヶ月薬剤性肺障害再発割合は25%(95%信頼区間15-37)、12ヶ月薬剤性肺障害再発割合は27%(95%信頼区間17-39)だった
・rechallenge集団をオシメルチニブrechallenge集団とその他のEGFR-TKI rechallenge集団に分けたところ、増悪までの期間中央値はオシメルチニブrechallenge集団で9.2ヶ月(2.2-未到達)、その他のEGFR-TKI rechallenge集団で未到達(未到達-未到達)だった
・6ヶ月薬剤性肺障害再発割合はオシメルチニブrechallenge集団で46%(95%信頼区間24-68)、その他のEGFR-TKI rechallenge集団で15%(95%信頼区間6.3-29)だった
・12ヶ月薬剤性肺障害再発割合はオシメルチニブrechallenge集団で50%(95%信頼区間28-72)、その他のEGFR-TKI rechallenge集団で15%(95%信頼区間6.3-29)だった
・薬剤性肺障害の累積発生割合は、その他のEGFR-TKI rechallenge集団と比較して有意にオシメルチニブrechallenge集団で高かった(ハザード比3.1、95%信頼区間1.3-7.5、p=0.013)
・多変数解析を行ったところ、rechallenge治療でオシメルチニブを使うこと(補正ハザード比3.93、95%信頼区間1.58-9.80、p=0.003)、オシメルチニブ初回治療開始から初回の薬剤性肺障害を発症するまでの期間が60日間以内であること(補正ハザード比4.58、95%信頼区間1.57-13.34、p=0.005)の2項目が、EGFR-TKI rechallenge治療後の薬剤性肺障害再発の有意な危険因子だった
・全体集団124人中87人が二次治療を受け、うち19人はオシメルチニブrechallengeを、27人はその他のEGFR-TKI rechallengeを、41人は化学療法を受けていた
・二次治療期間における12ヶ月薬剤性肺障害再発割合は、オシメルチニブrechallenge集団で47.4%(95%信頼区間24.4-71.1)、その他のEGFR-TKI rechallenge集団で15%(95%信頼区間6.3-29)、化学療法集団で7.3%(95%信頼区間1.5-20)だった
・薬剤性肺障害の累積発生割合は、化学療法集団と比較して有意にオシメルチニブrechallenge集団で高かった(ハザード比5.85、95%信頼区間1.88-18.2、p=0.002)
・その他のEGFR-TKI rechallenge集団と化学療法集団の間で、薬剤性肺障害の累積発生割合の有意差は認めなかった(ハザード比1.31、95%信頼区間0.67-2.54、p=0.43)
・オシメルチニブ初回治療後の薬剤性肺障害(124人)についてCT分類別に解析したところ、OPパターンが最多(57人、46.0%)で、HPパターン(25人、20.2%)、DADパターン(24人、19.2%)、NSIPパターン(7人、5.6%)と続いた
・EGFR-TKI rechallenge後の薬剤性肺障害再発(19人)時の解析では、OPパターンが最多(10人、52.6%)で、HPパターン(5人、26.3%)、DADパターン(2人、10.5%)、NSIPパターン(1人、5.3%)と続いた
・EGFR-TKI rechallenge後に薬剤性肺障害を再発した患者集団としなかった患者集団において、初回の薬剤性肺障害のCTCAE grade、ステロイド治療内容、CTパターンの相違は認めなかった
・EGFR-TKI rechallenge後に薬剤性肺障害を再発した患者では、約10%がCTCAE grade 3以上の重症度だった
2021年11月10日
免疫チェックポイント阻害薬と自己免疫疾患発症
先だって、別府市内のひょうたん温泉がテレビ番組で特集されていた。
お客さん、従業員、さまざまな人間模様が紹介されていて、思わず見入ってしまった。
お互い膠原病(自己免疫疾患)の療養目的で入湯に来て知り合い、その後もときどき一緒に来ている、という20代ないし30代の女性二人連れも含まれていた。
どの温泉にも掲示されている「効果・効能表」に、よく「関節リウマチ」と書かれていて眉唾のように感じていたが、当事者からすると実際に効果を実感するらしいので侮れない。
免疫チェックポイント阻害薬を使っていると、甲状腺機能低下ないしは亢進にはしばしば、下垂体機能低下にはまれに遭遇する。
しかし、関節リウマチ、多発性筋炎、皮膚筋炎、強皮症、全身性エリテマトーデス等の膠原病(自己免疫疾患)合併にはとんと遭遇しない。
せいぜい関節炎症状を訴える患者を見たくらいである。
免疫チェックポイントのメカニズムを初めて聞いたとき、膠原病をはじめとした自己免疫疾患の発症機序解明にも役立つかもしれないと短絡的に考えたが、実際のところ膠原病発症にはあまり関与していないのだろうか。
お客さん、従業員、さまざまな人間模様が紹介されていて、思わず見入ってしまった。
お互い膠原病(自己免疫疾患)の療養目的で入湯に来て知り合い、その後もときどき一緒に来ている、という20代ないし30代の女性二人連れも含まれていた。
どの温泉にも掲示されている「効果・効能表」に、よく「関節リウマチ」と書かれていて眉唾のように感じていたが、当事者からすると実際に効果を実感するらしいので侮れない。
免疫チェックポイント阻害薬を使っていると、甲状腺機能低下ないしは亢進にはしばしば、下垂体機能低下にはまれに遭遇する。
しかし、関節リウマチ、多発性筋炎、皮膚筋炎、強皮症、全身性エリテマトーデス等の膠原病(自己免疫疾患)合併にはとんと遭遇しない。
せいぜい関節炎症状を訴える患者を見たくらいである。
免疫チェックポイントのメカニズムを初めて聞いたとき、膠原病をはじめとした自己免疫疾患の発症機序解明にも役立つかもしれないと短絡的に考えたが、実際のところ膠原病発症にはあまり関与していないのだろうか。
2021年11月09日
セルペルカチニブと過敏症
このところ、間もなく薬価収載され、実臨床に導入されると見込まれるセルペルカチニブのウェブセミナーが繰り返し開催されている。
オンコマインDxTTでの検出が必須で、かつ非扁平上皮非小細胞肺がんにおける出現頻度はわずか2%のがんである。
それだけに、なんとか諦めずに見つけてね、見つけたらきちんと使ってね、というメッセージが込められているように感じる。
セミナーを見ていると、「過敏症(hypersensitive reaction)」というカテゴリーの有害事象が繰り返し取り上げられている。
過敏症というと、一般の感覚からすると「アレルギー」「アナフィラキシー」といった状況を連想する。
われわれ臨床医は、抗体医薬をはじめとした薬物を使用したときの即時反応(結局アナフィラキシーとかインフュージョンリアクションのことだが)を思い浮かべる。
しかし、セルペルカチニブにおける過敏症という概念は、これらとはちょっと違うらしい。
演者の言葉を借りれば、
「なかなかこれまでの分子標的薬で、こうした用語は出てこなかった」
「こういうものが全体の5.2-11.7%くらいにでてくるので、注目すべき」
「過敏症関連事象と表現されている一方で、アナフィラキシーなどの重篤な過敏症を除くと但し書きされており、分かりにくい」
「こうした有害事象が起こりうる、ということを頭に入れておかないと診断自体が難しく、治療調整につなげにくい」
とのこと。
いまのところ、本件についてまとめられたネット上の記事が乏しかったので、まとめておく。
治療上のポイントは休薬とステロイド開始だが、ステロイドの使い方に決まったものはないらしい。
これも演者のコメントを借りれば、患者体重1kg当たり0.5mgくらいの開始量で、経過を見ながら5-10mgずつ減量がいいのではないか、と提案されていた。
<セルペルカチニブによる過敏症の特徴>
・原因は不明
・皮膚症状(斑状丘疹)が主体
・関節痛や筋肉痛を伴う発熱から始まることが多い
・肝機能障害、血小板減少を伴う
・これら個別の有害事象が重なってきたときに過敏症と診断できるが、それと気づくまで診断自体が難しい
・ときに口内炎、下痢、末梢神経障害、筋痙攣
・まれに血圧低下・頻脈・血中クレアチニン値増加を伴う
・治療開始から過敏症出現までの期間中央値は1.9週(範囲は0.9-77)
・過敏症が現れたら、まずは回復するまで休薬
・休薬だけで改善しなければステロイド(プレドニゾロン)内服開始
・その他の対症療法
・ステロイドを開始すると48時間程度で速やかに症状改善
・症状がおさまったら、ステロイドを併用しながらセルペルカチニブ40mg/回、1日2回に減量して再開
(通常の用量は160mg/回、1日2回)
・再開後に7日間以上過敏症症状が再発しないときは、80mg/回、120mg/回、160mg/回と1段階ずつ過敏症発現時の用量まで増やせる
・増量完了後に7日以上過敏症症状が再発しないときは、ステロイドを漸減する
・免疫チェックポイント阻害薬による前治療歴があると過敏症が出現しやすい(11.2-18.8% vs 1.8-2.8%)
オンコマインDxTTでの検出が必須で、かつ非扁平上皮非小細胞肺がんにおける出現頻度はわずか2%のがんである。
それだけに、なんとか諦めずに見つけてね、見つけたらきちんと使ってね、というメッセージが込められているように感じる。
セミナーを見ていると、「過敏症(hypersensitive reaction)」というカテゴリーの有害事象が繰り返し取り上げられている。
過敏症というと、一般の感覚からすると「アレルギー」「アナフィラキシー」といった状況を連想する。
われわれ臨床医は、抗体医薬をはじめとした薬物を使用したときの即時反応(結局アナフィラキシーとかインフュージョンリアクションのことだが)を思い浮かべる。
しかし、セルペルカチニブにおける過敏症という概念は、これらとはちょっと違うらしい。
演者の言葉を借りれば、
「なかなかこれまでの分子標的薬で、こうした用語は出てこなかった」
「こういうものが全体の5.2-11.7%くらいにでてくるので、注目すべき」
「過敏症関連事象と表現されている一方で、アナフィラキシーなどの重篤な過敏症を除くと但し書きされており、分かりにくい」
「こうした有害事象が起こりうる、ということを頭に入れておかないと診断自体が難しく、治療調整につなげにくい」
とのこと。
いまのところ、本件についてまとめられたネット上の記事が乏しかったので、まとめておく。
治療上のポイントは休薬とステロイド開始だが、ステロイドの使い方に決まったものはないらしい。
これも演者のコメントを借りれば、患者体重1kg当たり0.5mgくらいの開始量で、経過を見ながら5-10mgずつ減量がいいのではないか、と提案されていた。
<セルペルカチニブによる過敏症の特徴>
・原因は不明
・皮膚症状(斑状丘疹)が主体
・関節痛や筋肉痛を伴う発熱から始まることが多い
・肝機能障害、血小板減少を伴う
・これら個別の有害事象が重なってきたときに過敏症と診断できるが、それと気づくまで診断自体が難しい
・ときに口内炎、下痢、末梢神経障害、筋痙攣
・まれに血圧低下・頻脈・血中クレアチニン値増加を伴う
・治療開始から過敏症出現までの期間中央値は1.9週(範囲は0.9-77)
・過敏症が現れたら、まずは回復するまで休薬
・休薬だけで改善しなければステロイド(プレドニゾロン)内服開始
・その他の対症療法
・ステロイドを開始すると48時間程度で速やかに症状改善
・症状がおさまったら、ステロイドを併用しながらセルペルカチニブ40mg/回、1日2回に減量して再開
(通常の用量は160mg/回、1日2回)
・再開後に7日間以上過敏症症状が再発しないときは、80mg/回、120mg/回、160mg/回と1段階ずつ過敏症発現時の用量まで増やせる
・増量完了後に7日以上過敏症症状が再発しないときは、ステロイドを漸減する
・免疫チェックポイント阻害薬による前治療歴があると過敏症が出現しやすい(11.2-18.8% vs 1.8-2.8%)
2021年11月02日
ラムシルマブ+ドセタキセル併用療法と胸水・腹水貯留
進行非小細胞肺がんに対する治療をしていて、新たに胸水や腹水が出てきたときは、気落ちする。
たいていの場合はがん性胸水、がん性腹水による病勢進行と考えられるから。
とはいえ、進行非小細胞肺がんの治療中に腹水貯留で困ることは、経験上あまりない。
それだけに、消化器がんや婦人科がん、あるいは非代償期肝硬変で腹水がパンパンにたまっている患者を見ると、呼吸器内科医としてはちょっとしたカルチャーショックだ。
ラムシルマブ+ドセタキセル併用療法後、もとの病巣が縮小したまま、胸水・腹水が急速に貯留した患者の症例報告を見かけた。
それぞれ穿刺して調べたところいずれも乳糜様であり、ラムシルマブ+ドセタキセル併用療法を中止したところ増えなくなったとのこと。
薬物療法を完全に中断して4ヶ月経過を見るのは勇気がいるが、本治療中に他の病巣が安定しているにも関わらず胸水・腹水のみが増えるというときには鑑別に挙げる価値がある。
とはいえ、治療変更が必要なのは変わらないが。
Simultaneous chylous ascites and chylothorax during ramucirumab plus docetaxel chemotherapy in a patient with non-small lung cell cancer
Makoto Arai et al., Int Cancer Conf J. 2019 Jul; 8(3): 114–117.
Published online 2019 Feb 25.
doi: 10.1007/s13691-019-00366-6
今回報告する患者は、非小細胞肺がん(腺癌、cT1aN3M1b)と診断された69歳の女性である。過去に手術歴、或いは腹部外傷歴はない。診断確定後、カルボプラチン+パクリタキセル+ベバシズマブ併用療法を4コース、続いて38コースのベバシズマブ維持療法を受けた。その後、病勢進行が確認され、ラムシルマブ+ドセタキセル併用療法を3週間ごとに行った。8コース終了時点で造影CTを撮影したところ部分奏効が確認されたが、同時にGrade 2の蛋白尿が出現した。そのため、治療間隔を3週間から4週間に引き延ばした。それから4週後、腹部膨満感と末梢浮腫が出現し、2か月間で体重が18kg増加した。そのためラムシルマブ+ドセタキセル併用療法は中止した。再度造影CTを撮影したところ、大量の両側胸水と腹水を認めたものの、中心静脈路やリンパ管の閉塞所見は認めなかった。腹水試験穿刺を行ったところ、白色、乳液状の性状を示しており、527mg/dlと高濃度の中性脂肪を含んでいた。加えて、胸水穿刺を行っても同様の白色、乳液状の性状を示した。ラムシルマブ+ドセタキセル併用療法中止後は腹水、胸水ともに増加しなかった。治療中止から4か月後の時点でも、部分奏効の状態を維持しており、腹水、胸水の増加は見られなかった。乳糜腹水、乳糜胸水はラムシルマブ+ドセタキセル併用療法が原因だったのかもしれない。
たいていの場合はがん性胸水、がん性腹水による病勢進行と考えられるから。
とはいえ、進行非小細胞肺がんの治療中に腹水貯留で困ることは、経験上あまりない。
それだけに、消化器がんや婦人科がん、あるいは非代償期肝硬変で腹水がパンパンにたまっている患者を見ると、呼吸器内科医としてはちょっとしたカルチャーショックだ。
ラムシルマブ+ドセタキセル併用療法後、もとの病巣が縮小したまま、胸水・腹水が急速に貯留した患者の症例報告を見かけた。
それぞれ穿刺して調べたところいずれも乳糜様であり、ラムシルマブ+ドセタキセル併用療法を中止したところ増えなくなったとのこと。
薬物療法を完全に中断して4ヶ月経過を見るのは勇気がいるが、本治療中に他の病巣が安定しているにも関わらず胸水・腹水のみが増えるというときには鑑別に挙げる価値がある。
とはいえ、治療変更が必要なのは変わらないが。
Simultaneous chylous ascites and chylothorax during ramucirumab plus docetaxel chemotherapy in a patient with non-small lung cell cancer
Makoto Arai et al., Int Cancer Conf J. 2019 Jul; 8(3): 114–117.
Published online 2019 Feb 25.
doi: 10.1007/s13691-019-00366-6
今回報告する患者は、非小細胞肺がん(腺癌、cT1aN3M1b)と診断された69歳の女性である。過去に手術歴、或いは腹部外傷歴はない。診断確定後、カルボプラチン+パクリタキセル+ベバシズマブ併用療法を4コース、続いて38コースのベバシズマブ維持療法を受けた。その後、病勢進行が確認され、ラムシルマブ+ドセタキセル併用療法を3週間ごとに行った。8コース終了時点で造影CTを撮影したところ部分奏効が確認されたが、同時にGrade 2の蛋白尿が出現した。そのため、治療間隔を3週間から4週間に引き延ばした。それから4週後、腹部膨満感と末梢浮腫が出現し、2か月間で体重が18kg増加した。そのためラムシルマブ+ドセタキセル併用療法は中止した。再度造影CTを撮影したところ、大量の両側胸水と腹水を認めたものの、中心静脈路やリンパ管の閉塞所見は認めなかった。腹水試験穿刺を行ったところ、白色、乳液状の性状を示しており、527mg/dlと高濃度の中性脂肪を含んでいた。加えて、胸水穿刺を行っても同様の白色、乳液状の性状を示した。ラムシルマブ+ドセタキセル併用療法中止後は腹水、胸水ともに増加しなかった。治療中止から4か月後の時点でも、部分奏効の状態を維持しており、腹水、胸水の増加は見られなかった。乳糜腹水、乳糜胸水はラムシルマブ+ドセタキセル併用療法が原因だったのかもしれない。
2021年09月30日
アナモレリンと高血糖
アナモレリンの市販直後調査の結果が報告されていたので眺めてみた。
https://www.ono-oncology.jp/system/files/2021-09/ADM_houkoku_0.pdf
胃腸障害が28件で最多だが、そのうち最も多かったのは悪心で13件、全て非重篤。
続いて一般・全身障害および投与部位の状態が18件、こちらはさまざま。
いずれにせよ、がん自体の症状としても説明可能なもののように思われた。
気になったのは糖尿病ないし高血糖の計14件、うち5件は重篤と判定されている。
ステロイドや免疫チェックポイント阻害薬を使用している患者なら、糖尿病の原因鑑別が難しくなりそうだ。
ステロイドはそう簡単には中止できないし、免疫チェックポイント阻害薬によるI型糖尿病は中止すれば治るというものではないが、アナモレリンについてはいったん中止が第一選択だろう。
https://www.ono-oncology.jp/system/files/2021-09/ADM_houkoku_0.pdf
胃腸障害が28件で最多だが、そのうち最も多かったのは悪心で13件、全て非重篤。
続いて一般・全身障害および投与部位の状態が18件、こちらはさまざま。
いずれにせよ、がん自体の症状としても説明可能なもののように思われた。
気になったのは糖尿病ないし高血糖の計14件、うち5件は重篤と判定されている。
ステロイドや免疫チェックポイント阻害薬を使用している患者なら、糖尿病の原因鑑別が難しくなりそうだ。
ステロイドはそう簡単には中止できないし、免疫チェックポイント阻害薬によるI型糖尿病は中止すれば治るというものではないが、アナモレリンについてはいったん中止が第一選択だろう。
2021年09月22日
HER2遺伝子変異陽性肺がんに対するtrastuzumab deruxtecan
HER2遺伝子変異陽性非小細胞肺がん。
いい思い出がない。
もう6年以上前だが、1人だけ担当したことがある。
もともと他院で診療されていた患者だが、プラチナ併用化学療法と丸山ワクチンを併用したいということで私のもとに来られた。
とにかく、できることは何でもしたい、と本人・ご家族ともに考えておられた。
化学療法も丸山ワクチンも顕著な効果なく、LC-SCRUMに参加したところ、HER2遺伝子変異陽性を指摘された。
当時、確か北大でトラスツズマブの、岡山大でT-DM1の臨床試験が行われていたと記憶しているが、既に参加できるようなPSではなかった。
最終的には、苦し紛れにpan HER inhibitorであるアファチニブを使ったが、全く歯が立たなかった。
今回取り上げる論文冒頭の記載によると、HER2遺伝子変異陽性肺がんは非扁平上皮非小細胞肺がん患者の3%弱に認められ、女性・非喫煙者に多く、予後不良とのこと。
私が担当した患者に見事に特徴が合致する。
・HER2遺伝子変異陽性肺癌
→http://oitahaiganpractice.junglekouen.com/e808769.html
実際のところ、HER2を治療標的とした初期の臨床試験は、まさに死屍累々たる有様だった。
・Studies Explore Targeted Therapies in Lung Cancer
→http://oitahaiganpractice.junglekouen.com/e900760.html
・T-DM1 for HER2 positive NSCLC
→http://oitahaiganpractice.junglekouen.com/e906042.html
そんな中、以下の記事でごくわずかに触れたが、
「抗体-薬物複合体を用いた治療により、HER2遺伝子変異陽性非小細胞肺がん患者では60%以上の奏効割合が、現在進行中の臨床試験で示されている」
という話があり、その結果公表が待っていた。
・あれから20年も、この先10年も
→http://oitahaiganpractice.junglekouen.com/e982143.html
そして、ようやくその時が来た。
trasutuzumab deruxtecanは乳がんや胃がんで既に有効性が証明されていたが、今回のDESTINY-01試験で非小細胞肺がんにおいても一定の有効性が確認された。
参加した患者の95%がプラチナ併用化学療法施行済み、66%がPD-1 / PD-L1抗体使用済み、20%がドセタキセル使用済み、14%が抗HER2チロシンキナーゼ阻害薬使用済みということ。
経過観察期間中央値はまだわずか13ヶ月だが、奏効割合55%、無増悪生存期間中央値8.2ヶ月、全生存期間中央値17.8ヶ月というのは有望な数字である。
Trastuzumab Deruxtecan in HER2-Mutant Non–Small-Cell Lung Cancer
DESTINY-Lung01 Trial
Bob T. Li,Yasushi Goto, M.D., Ph.D., Kazuhiko Nakagawa, M.D., Hibiki Udagawa, M.D. Misako Nagasaka, M.D., Ryota Shiga, B.Sc. et al.
N Engl J Med September 18, 2021, published online
DOI: 10.1056/NEJMoa2112431
背景:
ヒト上皮成長因子受容体2(HER2)を標的とした治療は、これまでのところ非小細胞肺がん領域では承認されていない。HER2遺伝子変異陽性非小細胞肺がんに対し、HER2抗体-薬物複合体であるtrastuzumab deruxtecan(以前はDS-8201のコードネームで呼称されていた)を使用した際の有効性、安全性について、これまでのところ国際的に検証されたことはない。
方法:
標準治療に対し耐性となったHER2遺伝子変異陽性進行非小細胞肺がん患者に対し、trastuzumab deruxtecan(患者体重1kgあたり6.4mg)を投与する国際多施設共同第2相臨床試験を行った。主要評価項目は独立委員会判定による奏効割合とした。副次評価項目には、奏効持続期間、無増悪生存期間、全生存期間、安全性を含めた。バイオマーカーとして、HER2遺伝子変異の多様性についても検討した。
結果:
計91人の患者が登録された。経過観察期間中央値は13.1ヶ月(0.7-29.1)だった。奏効割合は55%(95%信頼区間44-65%)だった。奏効持続期間中央値は9.3ヶ月(95%信頼区間5.7-14.7)だった。無増悪生存期間中央値は8.2ヶ月(95%信頼区間6.0-11.9)、全生存期間中央値は17.8ヶ月(95%信頼区間13.8-22.)だった。安全性プロファイルは、trastuzumab deruxtecanに関連した過去の研究結果で認められたのと同様だった。Grade 3以上の薬剤関連有害事象は患者の46%に認められた。その中でも最も頻度が高かったのは好中球減少症(19%)だった。薬剤性と判定された間質性肺障害は26%の患者に認められ、2人はこれにより死亡した。腫瘍縮小効果はHER2遺伝子変異のどのサブタイプでも同様に認められ、免疫染色によるHER2発現の有無、あるいはHER2増幅の有無と縮小効果の間には関連性は見られなかった。
結論
trasutuzumab deruxtecanは、既治療HER2陽性非小細胞肺がん患者に対して、持続的な抗腫瘍活性を示した。安全性プロファイルの点では、薬剤性肺障害による死亡例が2件発生したが、概ね過去の研究で確認されたのと同様の所見だった。
いい思い出がない。
もう6年以上前だが、1人だけ担当したことがある。
もともと他院で診療されていた患者だが、プラチナ併用化学療法と丸山ワクチンを併用したいということで私のもとに来られた。
とにかく、できることは何でもしたい、と本人・ご家族ともに考えておられた。
化学療法も丸山ワクチンも顕著な効果なく、LC-SCRUMに参加したところ、HER2遺伝子変異陽性を指摘された。
当時、確か北大でトラスツズマブの、岡山大でT-DM1の臨床試験が行われていたと記憶しているが、既に参加できるようなPSではなかった。
最終的には、苦し紛れにpan HER inhibitorであるアファチニブを使ったが、全く歯が立たなかった。
今回取り上げる論文冒頭の記載によると、HER2遺伝子変異陽性肺がんは非扁平上皮非小細胞肺がん患者の3%弱に認められ、女性・非喫煙者に多く、予後不良とのこと。
私が担当した患者に見事に特徴が合致する。
・HER2遺伝子変異陽性肺癌
→http://oitahaiganpractice.junglekouen.com/e808769.html
実際のところ、HER2を治療標的とした初期の臨床試験は、まさに死屍累々たる有様だった。
・Studies Explore Targeted Therapies in Lung Cancer
→http://oitahaiganpractice.junglekouen.com/e900760.html
・T-DM1 for HER2 positive NSCLC
→http://oitahaiganpractice.junglekouen.com/e906042.html
そんな中、以下の記事でごくわずかに触れたが、
「抗体-薬物複合体を用いた治療により、HER2遺伝子変異陽性非小細胞肺がん患者では60%以上の奏効割合が、現在進行中の臨床試験で示されている」
という話があり、その結果公表が待っていた。
・あれから20年も、この先10年も
→http://oitahaiganpractice.junglekouen.com/e982143.html
そして、ようやくその時が来た。
trasutuzumab deruxtecanは乳がんや胃がんで既に有効性が証明されていたが、今回のDESTINY-01試験で非小細胞肺がんにおいても一定の有効性が確認された。
参加した患者の95%がプラチナ併用化学療法施行済み、66%がPD-1 / PD-L1抗体使用済み、20%がドセタキセル使用済み、14%が抗HER2チロシンキナーゼ阻害薬使用済みということ。
経過観察期間中央値はまだわずか13ヶ月だが、奏効割合55%、無増悪生存期間中央値8.2ヶ月、全生存期間中央値17.8ヶ月というのは有望な数字である。
Trastuzumab Deruxtecan in HER2-Mutant Non–Small-Cell Lung Cancer
DESTINY-Lung01 Trial
Bob T. Li,Yasushi Goto, M.D., Ph.D., Kazuhiko Nakagawa, M.D., Hibiki Udagawa, M.D. Misako Nagasaka, M.D., Ryota Shiga, B.Sc. et al.
N Engl J Med September 18, 2021, published online
DOI: 10.1056/NEJMoa2112431
背景:
ヒト上皮成長因子受容体2(HER2)を標的とした治療は、これまでのところ非小細胞肺がん領域では承認されていない。HER2遺伝子変異陽性非小細胞肺がんに対し、HER2抗体-薬物複合体であるtrastuzumab deruxtecan(以前はDS-8201のコードネームで呼称されていた)を使用した際の有効性、安全性について、これまでのところ国際的に検証されたことはない。
方法:
標準治療に対し耐性となったHER2遺伝子変異陽性進行非小細胞肺がん患者に対し、trastuzumab deruxtecan(患者体重1kgあたり6.4mg)を投与する国際多施設共同第2相臨床試験を行った。主要評価項目は独立委員会判定による奏効割合とした。副次評価項目には、奏効持続期間、無増悪生存期間、全生存期間、安全性を含めた。バイオマーカーとして、HER2遺伝子変異の多様性についても検討した。
結果:
計91人の患者が登録された。経過観察期間中央値は13.1ヶ月(0.7-29.1)だった。奏効割合は55%(95%信頼区間44-65%)だった。奏効持続期間中央値は9.3ヶ月(95%信頼区間5.7-14.7)だった。無増悪生存期間中央値は8.2ヶ月(95%信頼区間6.0-11.9)、全生存期間中央値は17.8ヶ月(95%信頼区間13.8-22.)だった。安全性プロファイルは、trastuzumab deruxtecanに関連した過去の研究結果で認められたのと同様だった。Grade 3以上の薬剤関連有害事象は患者の46%に認められた。その中でも最も頻度が高かったのは好中球減少症(19%)だった。薬剤性と判定された間質性肺障害は26%の患者に認められ、2人はこれにより死亡した。腫瘍縮小効果はHER2遺伝子変異のどのサブタイプでも同様に認められ、免疫染色によるHER2発現の有無、あるいはHER2増幅の有無と縮小効果の間には関連性は見られなかった。
結論
trasutuzumab deruxtecanは、既治療HER2陽性非小細胞肺がん患者に対して、持続的な抗腫瘍活性を示した。安全性プロファイルの点では、薬剤性肺障害による死亡例が2件発生したが、概ね過去の研究で確認されたのと同様の所見だった。
2021年09月15日
中国人患者におけるRET阻害薬(Selpercatinib, Pralsetinib)の有効性
中国人を対象としたRET阻害薬のデータが公表されていた。
SelpercatinibもPralsetinibも、奏効割合という点では変わりはなさそう。
Pralsetinibでは骨髄抑制の有害事象が目立つ。
Efficacy and Safety of Selpercatinib in Chinese Patients With RET Fusion-Positive Non-Small Cell Lung Cancer: A Phase 2 Trial
Shun Lu et al., WCLC 2021 Abst.#MA02.01
背景:
Serpercatinibは、rearranged during transfection(RET)キナーゼに対する高い選択性と阻害活性を有する、この分野では初めての薬であり、中枢神経系への活性も有する。RET融合遺伝子陽性非小細胞肺がんやRET変異のある甲状腺がんに対して多数の国々で承認されている。今回は、RET融合遺伝子陽性非小細胞肺がんの中国人患者を対象に、Serpercatinibの効果と安全性を検証した初めての臨床試験であるLIBRETTO-321試験について報告する。
方法:
LIBRETTO-321試験は、オープンラベル、多施設共同の第II相試験であり、RET融合遺伝子陽性非小細胞肺がんを含むRET遺伝子異常陽性進行固形がんの中国人患者を対象とした。Selpercatinib 160mgを1日2回経口投与し、28日間の治療を1サイクルとして、病勢進行、忍容不能の毒性、臨床試験参加への患者同意撤回、患者死亡のいずれかが発生するまで治療を継続した。主要評価項目はRECIST ver.1.1準拠の独立効果判定委員会(IRC)評価による奏効割合とした。副次評価項目の主なものは、奏効持続期間(DoR)、中枢神経病変における奏効割合(CNS-ORR)、中枢神経病変における奏効持続期間(CNS-DoR)、安全性とした。有効性評価はprimary analysis setとresponse evaluable patientsに分けて行った。primary analysis set(PAS)は中央臨床検査部においてRET融合遺伝子陽性非小細胞肺がんと確認された患者集団であり、response evaluable population(REP)は本試験に登録され、測定可能病変を有し、少なくとも1回は効果判定を受けた全ての非小細胞肺がん患者集団である。安全性はプロトコール治療を受けた全ての患者に対して評価した。
結果:
20201年3月25日までに、77人の患者が登録され、この中には47人のRET融合遺伝子陽性非小細胞肺がん患者が含まれており、26人はPASの基準を満たした。PASの患者集団の観察期間中央値は9.7ヶ月で、IRC評価による奏効割合は69.2%(95%信頼区間48.2-85.7)で、治療歴のない患者では87.5%、治療歴のある患者では61.1%だった。奏効持続期間中央値は未到達で、9ヶ月奏効持続割合は93.8%だった。REP集団は総数45人で、観察期間中央値は10.4ヶ月、IRC評価による奏効割合は66.7%(95%信頼区間51.0-80.0)だった。治療開始前に測定可能な中枢神経病変を有していた5人の患者のうち、4人(80%)はIRC評価による中枢神経病変の奏効基準を満たしており、9ヶ月後も効果が持続していた。安全性評価対象となった77人において、Grade 3以上の有害事象で頻度が高かったのは高血圧(19.5%)、AST上昇(15.6%)、ALT上昇(15.6%)だった。ほとんどの有害事象はGrade 1もしくは2だった。有害事象のためSelpercatinibの治療中止に至った割合は5.2%で、用量減量を必要としたのは32.5%だった。Selpercatinibとは無関係と思われる有害事象で1人の患者が死亡した。
結論:
Selpercatinibは中国人のRET融合遺伝子陽性進行非小細胞肺がん患者に対して、強力で持続的な抗腫瘍活性を示し、LIBRETTO-001試験で示された知見と同様だった。

Efficacy and Safety of Pralsetinib in Chinese Patients with Advanced RET Fusion+ Non-Small Cell Lung Cancer
Qing Zhou et al., WCLC 2021 Abst.#MA02.02
背景:
RET融合遺伝子は非小細胞肺がん患者のおよそ1-2%で認められるドライバー遺伝子異常として同定された。PralsetinibはRET遺伝子異常に対する高い選択性および阻害活性を持つRET阻害薬である。ARROW試験は第I / II相、オープンラベルの臨床試験で、非小細胞肺がんをはじめとした種々のRET遺伝子異常陽性進行固形がんに対するPralsetinibの安全性と抗腫瘍活性を評価する初の臨床試験である。前回のWCLC2020において、プラチナ併用化学療法後にPralsetinibを使用したRET融合遺伝子陽性進行非小細胞がんの中国人患者集団における効果と安全性について報告した。今回はその後の最新情報に加え、未治療RET融合遺伝子陽性進行非小細胞肺がんの中国人患者集団におけるPralsetinibの効果と安全性についても報告する。
方法:
未治療、もしくはプラチナ併用化学療法治療歴のあるRET融合遺伝子陽性非小細胞肺がン中国人患者を対象に、Pralsetinib 400mg/日を投与した。主要評価項目は独立効果判定委員会によるRECIST ver.1.1準拠の奏効割合、安全性プロファイルとした。副次評価項目には奏効持続期間(DoR)、病勢コントロール割合(DCR)、無増悪生存期間(PFS)、全生存期間(OS)を含めた。
結果:
2021年4月12日までに、68人のRET融合遺伝子陽性非小細胞肺がん中国人患者(プラチナ併用化学療法治療歴あり:37人、治療歴なし:31人)がPralsetininbの治療を受けた。治療前の段階で、ほとんど(95.6%)の患者がECOG-PS1の状態だった。RET融合遺伝子の融合パートナー(KIF5Bが66.2%、CCDC6が17.6%、その他が16.2%)、脳転移合併割合(33.8%)はこれまで知られているデータとほぼ同様だった。治療効果は図表に示したとおりであり、Pralsetinibは治療歴の有無に関わらず高い奏効割合を示した。少なくとも1回のPralsetinib投与を受けた患者は安全性評価対象とした(n=68)。治療関連有害事象として頻度が高かったのは、AST上昇(80.9%)、好中球減少(79.4%)、貧血(67.6%)、白血球減少(60.3%)、ALT上昇(57.4%)だった。10.3%の患者が有害事象を理由にPralsetinibの使用を中止した。
結論:
PralsetinibはRET融合遺伝子陽性の非小細胞肺がん中国人患者において、治療歴の有無に関わらず、早くかつ深い臨床的活性を有する有望な分子標的薬である。中国人患者におけるPralsetinibの有効性は、国際共同試験におけるデータと同様で、治療歴のない中国人患者でも同様の有効性を示した。安全性プロファイルは管理可能であり、未知の有害事象には見舞われなかった。Pralsetinibは良好な有効性・安全性プロファイルを有し、RET融合遺伝子陽性進行非小細胞肺がんの中国人患者に対して新しい医療を提案している。

SelpercatinibもPralsetinibも、奏効割合という点では変わりはなさそう。
Pralsetinibでは骨髄抑制の有害事象が目立つ。
Efficacy and Safety of Selpercatinib in Chinese Patients With RET Fusion-Positive Non-Small Cell Lung Cancer: A Phase 2 Trial
Shun Lu et al., WCLC 2021 Abst.#MA02.01
背景:
Serpercatinibは、rearranged during transfection(RET)キナーゼに対する高い選択性と阻害活性を有する、この分野では初めての薬であり、中枢神経系への活性も有する。RET融合遺伝子陽性非小細胞肺がんやRET変異のある甲状腺がんに対して多数の国々で承認されている。今回は、RET融合遺伝子陽性非小細胞肺がんの中国人患者を対象に、Serpercatinibの効果と安全性を検証した初めての臨床試験であるLIBRETTO-321試験について報告する。
方法:
LIBRETTO-321試験は、オープンラベル、多施設共同の第II相試験であり、RET融合遺伝子陽性非小細胞肺がんを含むRET遺伝子異常陽性進行固形がんの中国人患者を対象とした。Selpercatinib 160mgを1日2回経口投与し、28日間の治療を1サイクルとして、病勢進行、忍容不能の毒性、臨床試験参加への患者同意撤回、患者死亡のいずれかが発生するまで治療を継続した。主要評価項目はRECIST ver.1.1準拠の独立効果判定委員会(IRC)評価による奏効割合とした。副次評価項目の主なものは、奏効持続期間(DoR)、中枢神経病変における奏効割合(CNS-ORR)、中枢神経病変における奏効持続期間(CNS-DoR)、安全性とした。有効性評価はprimary analysis setとresponse evaluable patientsに分けて行った。primary analysis set(PAS)は中央臨床検査部においてRET融合遺伝子陽性非小細胞肺がんと確認された患者集団であり、response evaluable population(REP)は本試験に登録され、測定可能病変を有し、少なくとも1回は効果判定を受けた全ての非小細胞肺がん患者集団である。安全性はプロトコール治療を受けた全ての患者に対して評価した。
結果:
20201年3月25日までに、77人の患者が登録され、この中には47人のRET融合遺伝子陽性非小細胞肺がん患者が含まれており、26人はPASの基準を満たした。PASの患者集団の観察期間中央値は9.7ヶ月で、IRC評価による奏効割合は69.2%(95%信頼区間48.2-85.7)で、治療歴のない患者では87.5%、治療歴のある患者では61.1%だった。奏効持続期間中央値は未到達で、9ヶ月奏効持続割合は93.8%だった。REP集団は総数45人で、観察期間中央値は10.4ヶ月、IRC評価による奏効割合は66.7%(95%信頼区間51.0-80.0)だった。治療開始前に測定可能な中枢神経病変を有していた5人の患者のうち、4人(80%)はIRC評価による中枢神経病変の奏効基準を満たしており、9ヶ月後も効果が持続していた。安全性評価対象となった77人において、Grade 3以上の有害事象で頻度が高かったのは高血圧(19.5%)、AST上昇(15.6%)、ALT上昇(15.6%)だった。ほとんどの有害事象はGrade 1もしくは2だった。有害事象のためSelpercatinibの治療中止に至った割合は5.2%で、用量減量を必要としたのは32.5%だった。Selpercatinibとは無関係と思われる有害事象で1人の患者が死亡した。
結論:
Selpercatinibは中国人のRET融合遺伝子陽性進行非小細胞肺がん患者に対して、強力で持続的な抗腫瘍活性を示し、LIBRETTO-001試験で示された知見と同様だった。

Efficacy and Safety of Pralsetinib in Chinese Patients with Advanced RET Fusion+ Non-Small Cell Lung Cancer
Qing Zhou et al., WCLC 2021 Abst.#MA02.02
背景:
RET融合遺伝子は非小細胞肺がん患者のおよそ1-2%で認められるドライバー遺伝子異常として同定された。PralsetinibはRET遺伝子異常に対する高い選択性および阻害活性を持つRET阻害薬である。ARROW試験は第I / II相、オープンラベルの臨床試験で、非小細胞肺がんをはじめとした種々のRET遺伝子異常陽性進行固形がんに対するPralsetinibの安全性と抗腫瘍活性を評価する初の臨床試験である。前回のWCLC2020において、プラチナ併用化学療法後にPralsetinibを使用したRET融合遺伝子陽性進行非小細胞がんの中国人患者集団における効果と安全性について報告した。今回はその後の最新情報に加え、未治療RET融合遺伝子陽性進行非小細胞肺がんの中国人患者集団におけるPralsetinibの効果と安全性についても報告する。
方法:
未治療、もしくはプラチナ併用化学療法治療歴のあるRET融合遺伝子陽性非小細胞肺がン中国人患者を対象に、Pralsetinib 400mg/日を投与した。主要評価項目は独立効果判定委員会によるRECIST ver.1.1準拠の奏効割合、安全性プロファイルとした。副次評価項目には奏効持続期間(DoR)、病勢コントロール割合(DCR)、無増悪生存期間(PFS)、全生存期間(OS)を含めた。
結果:
2021年4月12日までに、68人のRET融合遺伝子陽性非小細胞肺がん中国人患者(プラチナ併用化学療法治療歴あり:37人、治療歴なし:31人)がPralsetininbの治療を受けた。治療前の段階で、ほとんど(95.6%)の患者がECOG-PS1の状態だった。RET融合遺伝子の融合パートナー(KIF5Bが66.2%、CCDC6が17.6%、その他が16.2%)、脳転移合併割合(33.8%)はこれまで知られているデータとほぼ同様だった。治療効果は図表に示したとおりであり、Pralsetinibは治療歴の有無に関わらず高い奏効割合を示した。少なくとも1回のPralsetinib投与を受けた患者は安全性評価対象とした(n=68)。治療関連有害事象として頻度が高かったのは、AST上昇(80.9%)、好中球減少(79.4%)、貧血(67.6%)、白血球減少(60.3%)、ALT上昇(57.4%)だった。10.3%の患者が有害事象を理由にPralsetinibの使用を中止した。
結論:
PralsetinibはRET融合遺伝子陽性の非小細胞肺がん中国人患者において、治療歴の有無に関わらず、早くかつ深い臨床的活性を有する有望な分子標的薬である。中国人患者におけるPralsetinibの有効性は、国際共同試験におけるデータと同様で、治療歴のない中国人患者でも同様の有効性を示した。安全性プロファイルは管理可能であり、未知の有害事象には見舞われなかった。Pralsetinibは良好な有効性・安全性プロファイルを有し、RET融合遺伝子陽性進行非小細胞肺がんの中国人患者に対して新しい医療を提案している。

2021年09月08日
限局型肺小細胞がんにおける海馬回避予防的全脳照射
海馬回避全脳照射については、以前触れたことがある。
・全脳照射の時、海馬を避けることに意味はあるのか
→http://oitahaiganpractice.junglekouen.com/e971509.html
一般向けの教養書でも海馬と記憶の関係はしばしば触れられている。
アルツハイマー病においては、海馬の萎縮が画像診断上の一つの目安とされており、最近脳神経内科医に相談した私の入院患者は、実際に海馬の萎縮を以てアルツハイマー病の疑いが強いと指摘されていた。
上記の記事は、転移性脳腫瘍を発症した患者全体が適格患者とされていた。
今回はもっと対象者を絞り込み、予防的全脳照射の適応がある肺小細胞がん患者とされている。
欧州では進展型肺小細胞がん患者も予防的全脳照射の対象とされており、本試験でも約30%が進展型の患者であったようで、我が国における実臨床とは一部隔たりがある。
とはいえ、5年生存割合が35-40%にも及んだ患者集団において、認知機能をより良好に維持したというのは、無視できないデータのように考えられる。
FCSRTという耳慣れない評価尺度が用いられているため、簡単にではあるが参考資料を末尾に付した。
我が国でも、一般に用いられている長谷川式認知機能評価スケールやMMSEを評価項目に加えて検討すると、より実感がわく結果が得られるのではないだろうか。
Randomized Phase III Trial of Prophylactic Cranial Irradiation With or Without Hippocampal Avoidance for Small-Cell Lung Cancer (PREMER): A GICOR-GOECP-SEOR Study
Núria Rodríguez de Dios et al., Published online August 11, 2021.
DOI: 10.1200/JCO.21.00639 Journal of Clinical Oncology
方法:
放射線全脳照射治療中に海馬の神経幹細胞が暴露される放射線量は、認知機能低下と関連があると言われてきた。小細胞肺がん患者に対して海馬回避予防的全脳照射(Hippocampal Acoidance-Prophylactic Cranial Irradiation, HA-PCI)を適用する際の関心事は、放射線暴露を回避した海馬領域における脳転移の発生頻度である。
方法:
今回の第III相臨床試験では、2019年10月までスペイン国内13施設から150人の肺小細胞がん患者(71.3%は限局型)が組み入れられ、標準的な予防的全脳照射(Prophylactic Cranial Irradiation, PCI, 総線量25Gyを10回分割照射)群とHA-PCI群に割り付けた。主要評価項目はFree and Cued Selective Reminding Test(FCSRT)における治療後3ヶ月時点での遅延自由再生(Delayed Free Recall, DFR)とし、治療開始前のベースラインの点数より3点以上低下したら認知機能低下と判定した。副次評価項目は、FCSRTにおける他項目の点数、Quality of Life(QoL)、脳転移の発生割合および発生部位、全生存期間とした。データは治療開始前、治療開始後3ヶ月、6ヶ月、12ヶ月、24ヶ月の時点で評価した。
結果:
PCI群、HA-PCI群にそれぞれ75人ずつが割り付けられた。両群合わせて13人が不適格と判断され、結局PCI群に68人、HA-PCI群に69人が割り付けられた。両治療群間で、患者背景に有意な差は見られなかった。生存患者の経過観察期間中央値は40.4ヶ月だった。治療開始前から治療後3ヶ月時点までのDFRの低下は、PCI群(23.5%)に比してHA-PCI群(5.8%)で有意に軽微だった(オッズ比5, 95%信頼区間1.57-15.86, p=0.003)。FCSRTにおける他項目の検討では、治療開始前から治療後3ヶ月時点までの全再生(Total Recall, TR)の低下はPCI群で20.6%, HA-PCI群で20.6%、治療開始前から治療後6ヶ月時点までのDFRの低下はPCI群で33.3%、HA-PCI群で11.1%、TRの低下はPCI群で38.9%、HA-PCI群で20.3%、全自由再生(Total Free Recall, TFR)の低下はPCI群で14.8%、HA-PCI群で31.5%、治療開始前から治療後24ヶ月時点までのTRの低下はPCI群で47.6%、HA-PCI群で14.2%だった。2年経過時点における、脳転移の累積発生割合はHA-PCI群で22.8%、PCI群で17.7%で統計学的有意差を認めなかった(p=0.430)。脳転移再発した患者のうち、多発脳転移再発はPCI群で70.5%、HA-PCI群で84.6%に認めた。HA-PCI群のうち、1人で海馬歯状回への転移を認めた。海馬回避領域への単発の脳転移再発は認めなかったが、多発脳転移を来した患者において、PCI群で2人、HA-PCI群で12人に海馬回避領域の転移を認めた。60ヶ月経過時点で、HA-PCI群のうち60.0%、PCI群のうち65.3%は死亡していた→5年生存割合はHA-PCI群で40%、PCI群で34.7%だった。生存期間中央値はHA-PCI群で23.4ヶ月、PCI群で24.9ヶ月だった(p=0.556)。QoLには両群間で有意差を認めなかった。
結論:
小細胞肺がん患者に対するPCI中に海馬を照射野から外すことにより、認知機能はよりよく維持された。脳転移再発割合、全生存期間、QoLは標準的なPCIと遜色なかった。
Free and Cued Selective Reminding Test 日本語版作成とその有効性について
田村 至、老年精神医学雑誌,22(8):949-954,2011
(以下、序文より一部抜粋)
軽度認知障害のスクリーニング検査として欧米で使用されているFree and Cued Selective Reminding Test(FCSRT)は、16単語の即時ヒント再生,3回にわたる自由再生およびヒント再生,遅延自由・ヒント再生を行うことで,記憶の3側面である記銘・想起・貯蔵を個別に検査することができる。欧米では,FCSRTがアルツハイマー病とパーキンソン病,脳血管性認知症などとの鑑別診断に有用であると報告されている。
・全脳照射の時、海馬を避けることに意味はあるのか
→http://oitahaiganpractice.junglekouen.com/e971509.html
一般向けの教養書でも海馬と記憶の関係はしばしば触れられている。
アルツハイマー病においては、海馬の萎縮が画像診断上の一つの目安とされており、最近脳神経内科医に相談した私の入院患者は、実際に海馬の萎縮を以てアルツハイマー病の疑いが強いと指摘されていた。
上記の記事は、転移性脳腫瘍を発症した患者全体が適格患者とされていた。
今回はもっと対象者を絞り込み、予防的全脳照射の適応がある肺小細胞がん患者とされている。
欧州では進展型肺小細胞がん患者も予防的全脳照射の対象とされており、本試験でも約30%が進展型の患者であったようで、我が国における実臨床とは一部隔たりがある。
とはいえ、5年生存割合が35-40%にも及んだ患者集団において、認知機能をより良好に維持したというのは、無視できないデータのように考えられる。
FCSRTという耳慣れない評価尺度が用いられているため、簡単にではあるが参考資料を末尾に付した。
我が国でも、一般に用いられている長谷川式認知機能評価スケールやMMSEを評価項目に加えて検討すると、より実感がわく結果が得られるのではないだろうか。
Randomized Phase III Trial of Prophylactic Cranial Irradiation With or Without Hippocampal Avoidance for Small-Cell Lung Cancer (PREMER): A GICOR-GOECP-SEOR Study
Núria Rodríguez de Dios et al., Published online August 11, 2021.
DOI: 10.1200/JCO.21.00639 Journal of Clinical Oncology
方法:
放射線全脳照射治療中に海馬の神経幹細胞が暴露される放射線量は、認知機能低下と関連があると言われてきた。小細胞肺がん患者に対して海馬回避予防的全脳照射(Hippocampal Acoidance-Prophylactic Cranial Irradiation, HA-PCI)を適用する際の関心事は、放射線暴露を回避した海馬領域における脳転移の発生頻度である。
方法:
今回の第III相臨床試験では、2019年10月までスペイン国内13施設から150人の肺小細胞がん患者(71.3%は限局型)が組み入れられ、標準的な予防的全脳照射(Prophylactic Cranial Irradiation, PCI, 総線量25Gyを10回分割照射)群とHA-PCI群に割り付けた。主要評価項目はFree and Cued Selective Reminding Test(FCSRT)における治療後3ヶ月時点での遅延自由再生(Delayed Free Recall, DFR)とし、治療開始前のベースラインの点数より3点以上低下したら認知機能低下と判定した。副次評価項目は、FCSRTにおける他項目の点数、Quality of Life(QoL)、脳転移の発生割合および発生部位、全生存期間とした。データは治療開始前、治療開始後3ヶ月、6ヶ月、12ヶ月、24ヶ月の時点で評価した。
結果:
PCI群、HA-PCI群にそれぞれ75人ずつが割り付けられた。両群合わせて13人が不適格と判断され、結局PCI群に68人、HA-PCI群に69人が割り付けられた。両治療群間で、患者背景に有意な差は見られなかった。生存患者の経過観察期間中央値は40.4ヶ月だった。治療開始前から治療後3ヶ月時点までのDFRの低下は、PCI群(23.5%)に比してHA-PCI群(5.8%)で有意に軽微だった(オッズ比5, 95%信頼区間1.57-15.86, p=0.003)。FCSRTにおける他項目の検討では、治療開始前から治療後3ヶ月時点までの全再生(Total Recall, TR)の低下はPCI群で20.6%, HA-PCI群で20.6%、治療開始前から治療後6ヶ月時点までのDFRの低下はPCI群で33.3%、HA-PCI群で11.1%、TRの低下はPCI群で38.9%、HA-PCI群で20.3%、全自由再生(Total Free Recall, TFR)の低下はPCI群で14.8%、HA-PCI群で31.5%、治療開始前から治療後24ヶ月時点までのTRの低下はPCI群で47.6%、HA-PCI群で14.2%だった。2年経過時点における、脳転移の累積発生割合はHA-PCI群で22.8%、PCI群で17.7%で統計学的有意差を認めなかった(p=0.430)。脳転移再発した患者のうち、多発脳転移再発はPCI群で70.5%、HA-PCI群で84.6%に認めた。HA-PCI群のうち、1人で海馬歯状回への転移を認めた。海馬回避領域への単発の脳転移再発は認めなかったが、多発脳転移を来した患者において、PCI群で2人、HA-PCI群で12人に海馬回避領域の転移を認めた。60ヶ月経過時点で、HA-PCI群のうち60.0%、PCI群のうち65.3%は死亡していた→5年生存割合はHA-PCI群で40%、PCI群で34.7%だった。生存期間中央値はHA-PCI群で23.4ヶ月、PCI群で24.9ヶ月だった(p=0.556)。QoLには両群間で有意差を認めなかった。
結論:
小細胞肺がん患者に対するPCI中に海馬を照射野から外すことにより、認知機能はよりよく維持された。脳転移再発割合、全生存期間、QoLは標準的なPCIと遜色なかった。
Free and Cued Selective Reminding Test 日本語版作成とその有効性について
田村 至、老年精神医学雑誌,22(8):949-954,2011
(以下、序文より一部抜粋)
軽度認知障害のスクリーニング検査として欧米で使用されているFree and Cued Selective Reminding Test(FCSRT)は、16単語の即時ヒント再生,3回にわたる自由再生およびヒント再生,遅延自由・ヒント再生を行うことで,記憶の3側面である記銘・想起・貯蔵を個別に検査することができる。欧米では,FCSRTがアルツハイマー病とパーキンソン病,脳血管性認知症などとの鑑別診断に有用であると報告されている。
2021年09月02日
髄膜癌腫症と姑息的全脳全脊髄放射線照射
ときどき、髄膜癌腫症に対して全脳全脊髄放射線照射という治療が行われることがある。
転移性脳腫瘍に対する全脳照射は一般的な治療だが、肺がん領域で全脳全脊髄照射をする例はあまり見たことがない。
1年くらい前だったか、がんセンターに勤める医師に髄膜癌腫症の治療について意見を求めたところ、全脳全脊髄照射をしてみては、という答えが返ってきた。
どの程度の治療効果が期待できるのか、ちょっと文献の要約をかじってみた。
全脳全脊髄照射にそれほど劇的な効果が期待できるわけではない。
例外的に、61.5ヶ月以上の長期生存が得られている非小細胞肺がん患者がいたが、詳細に書かれていないものの、おそらくはドライバー遺伝子変異を有する患者だろう。
髄膜癌腫症を発症してからの平均的な生命予後は1.5-5ヶ月、予後のよい患者でも7-8ヶ月程度の生命予後である。
今回取り上げた2件の文献は、いずれも全脳全脊髄照射の有効性を統計学的に証明したものではないので、これを以て本治療を積極的に進める根拠にはならない。
正直言って、労多くして益少なし、という印象を受けた。
とはいえ、もし本治療を検討するときには、治療に期待できる効果を患者に指し示すにあたっては参考になるデータだろう。
Craniospinal irradiation(CSI) in patients with leptomeningeal metastases: risk-benefit-profile and development of a prognostic score for decision making in the palliative setting
Michal Devecka et al., BMC Cancer. 2020 Jun 1;20(1):501.
doi: 10.1186/s12885-020-06984-1.
背景:
本研究の目的は、髄膜癌腫症(leptomeningitis, LM)を合併した患者に対して全脊髄照射あるいは全脳全脊髄照射(CranioSpinal irradiation,CSI)を行った際の忍容性、治療効果を調べることと、どんな背景を持つ患者が本治療の恩恵を受けるのか予測可能なスコアリングシステムを提案することである。
方法:
我々の施設でCSIを施行した19人の患者を評価対象とした。患者背景、がん原発巣の状態、CSIによる治療効果と毒性を後方視的に検討した。中枢神経系以外の病状は、CSI施行前に行った病期判定時のCTで評価した。患者のPSや臨床病期に基づいた層別化によりスコアリングシステムを作成し、治療効果予測を行った。
結果:
全生存期間に関する経過観察期間中央値は3.4ヶ月(0.5-61.5)だった。生存期間中央値は、LM合併乳がん患者で4.7ヶ月、LM合併非小細胞肺がん患者で3.3ヶ月だった。非小細胞肺がん患者は5人含まれていて、それぞれの生存期間中央値は1.5ヶ月、1.5ヶ月、3.3ヶ月、4.2ヶ月、61.5ヶ月だった。①KPS<70 or KPS≧70、あるいは②中枢神経系外病変あり or なし、によって層別化したところ、①・②いずれも予後不良因子がない患者の生存期間中央値は7.3ヶ月、①・②どちらか一方の予後不良因子を有する患者の生存期間中央値は3.3ヶ月、①・②いずれの予後不良因子を有するものの生存期間中央値は1.5ヶ月だった。CSIによる非血液毒性は軽微だった。
結論:
CSIにより臨床的に意義のある生存期間が得られ、抗がん薬髄腔内投与による治療効果と遜色なかった。簡単な予後予測スコアリングシステムにより、全脳全脊髄照射の恩恵が得られる患者の選別ができそうだった。
A systematic review of craniospinal irradiation for leptomeningeal disease: past, present, and future
L Maillie et al., Clin Transl Oncol. 2021 Oct;23(10):2109-2119.
doi: 10.1007/s12094-021-02615-8. Epub 2021 Apr 21.
背景:
髄膜癌腫症(leptomeningeal dissemination,LMD)は、中枢神経系の髄膜と脳脊髄液に腫瘍細胞がばらまかれる、稀ではあるが致死的な合併症である。全脳全脊髄照射(CranioSpinal irradiation, CSI)は中枢神経系全てのくも膜下腔を照射野におさめる治療であり、LMDにおける最後の治療手段として時に用いられる。
方法:
今回は、成人の固形癌あるいは血液腫瘍に起因するLMDに対するCSIの役割について記述した文献についてまとめた。2020年9月1日までに論文化された報告をPubMedデータベースで検索した。
結果:
262件の文献がヒットした。LMDに対してCSIが施行された計275人の患者を含む13件の研究を解析対象とした。CSI照射時点での年齢中央値は43歳、ほとんどの患者のKPSは70以上だった。LMDを合併した悪性腫瘍で頻度が高かったのは、急性リンパ性白血病、乳がん、急性骨髄性白血病だった。CSI線量の中央値は30Gyで、全体の18%の患者が陽子線治療を受けていた。52%の患者で、神経学的症候の安定化もしくは改善が認められた。全患者集団における生存期間中央値は5.3ヶ月だった。骨髄回避陽子線治療を受けた患者における生存期間中央値は8ヶ月だった。頻度の高かった有害事象は血液毒性と胃腸毒性だった。
結論:
薬物療法や放射線治療が進歩したにもかかわらず、LMDは依然として様々な悪性腫瘍における破滅的な終末期合併症だった。治療関連有害事象はCSI遂行における障壁となり得る。一部のLMD患者において、骨髄回避陽子線治療はより安全な緩和医療となり得るし、生命予後延長効果もあるかも知れない
転移性脳腫瘍に対する全脳照射は一般的な治療だが、肺がん領域で全脳全脊髄照射をする例はあまり見たことがない。
1年くらい前だったか、がんセンターに勤める医師に髄膜癌腫症の治療について意見を求めたところ、全脳全脊髄照射をしてみては、という答えが返ってきた。
どの程度の治療効果が期待できるのか、ちょっと文献の要約をかじってみた。
全脳全脊髄照射にそれほど劇的な効果が期待できるわけではない。
例外的に、61.5ヶ月以上の長期生存が得られている非小細胞肺がん患者がいたが、詳細に書かれていないものの、おそらくはドライバー遺伝子変異を有する患者だろう。
髄膜癌腫症を発症してからの平均的な生命予後は1.5-5ヶ月、予後のよい患者でも7-8ヶ月程度の生命予後である。
今回取り上げた2件の文献は、いずれも全脳全脊髄照射の有効性を統計学的に証明したものではないので、これを以て本治療を積極的に進める根拠にはならない。
正直言って、労多くして益少なし、という印象を受けた。
とはいえ、もし本治療を検討するときには、治療に期待できる効果を患者に指し示すにあたっては参考になるデータだろう。
Craniospinal irradiation(CSI) in patients with leptomeningeal metastases: risk-benefit-profile and development of a prognostic score for decision making in the palliative setting
Michal Devecka et al., BMC Cancer. 2020 Jun 1;20(1):501.
doi: 10.1186/s12885-020-06984-1.
背景:
本研究の目的は、髄膜癌腫症(leptomeningitis, LM)を合併した患者に対して全脊髄照射あるいは全脳全脊髄照射(CranioSpinal irradiation,CSI)を行った際の忍容性、治療効果を調べることと、どんな背景を持つ患者が本治療の恩恵を受けるのか予測可能なスコアリングシステムを提案することである。
方法:
我々の施設でCSIを施行した19人の患者を評価対象とした。患者背景、がん原発巣の状態、CSIによる治療効果と毒性を後方視的に検討した。中枢神経系以外の病状は、CSI施行前に行った病期判定時のCTで評価した。患者のPSや臨床病期に基づいた層別化によりスコアリングシステムを作成し、治療効果予測を行った。
結果:
全生存期間に関する経過観察期間中央値は3.4ヶ月(0.5-61.5)だった。生存期間中央値は、LM合併乳がん患者で4.7ヶ月、LM合併非小細胞肺がん患者で3.3ヶ月だった。非小細胞肺がん患者は5人含まれていて、それぞれの生存期間中央値は1.5ヶ月、1.5ヶ月、3.3ヶ月、4.2ヶ月、61.5ヶ月だった。①KPS<70 or KPS≧70、あるいは②中枢神経系外病変あり or なし、によって層別化したところ、①・②いずれも予後不良因子がない患者の生存期間中央値は7.3ヶ月、①・②どちらか一方の予後不良因子を有する患者の生存期間中央値は3.3ヶ月、①・②いずれの予後不良因子を有するものの生存期間中央値は1.5ヶ月だった。CSIによる非血液毒性は軽微だった。
結論:
CSIにより臨床的に意義のある生存期間が得られ、抗がん薬髄腔内投与による治療効果と遜色なかった。簡単な予後予測スコアリングシステムにより、全脳全脊髄照射の恩恵が得られる患者の選別ができそうだった。
A systematic review of craniospinal irradiation for leptomeningeal disease: past, present, and future
L Maillie et al., Clin Transl Oncol. 2021 Oct;23(10):2109-2119.
doi: 10.1007/s12094-021-02615-8. Epub 2021 Apr 21.
背景:
髄膜癌腫症(leptomeningeal dissemination,LMD)は、中枢神経系の髄膜と脳脊髄液に腫瘍細胞がばらまかれる、稀ではあるが致死的な合併症である。全脳全脊髄照射(CranioSpinal irradiation, CSI)は中枢神経系全てのくも膜下腔を照射野におさめる治療であり、LMDにおける最後の治療手段として時に用いられる。
方法:
今回は、成人の固形癌あるいは血液腫瘍に起因するLMDに対するCSIの役割について記述した文献についてまとめた。2020年9月1日までに論文化された報告をPubMedデータベースで検索した。
結果:
262件の文献がヒットした。LMDに対してCSIが施行された計275人の患者を含む13件の研究を解析対象とした。CSI照射時点での年齢中央値は43歳、ほとんどの患者のKPSは70以上だった。LMDを合併した悪性腫瘍で頻度が高かったのは、急性リンパ性白血病、乳がん、急性骨髄性白血病だった。CSI線量の中央値は30Gyで、全体の18%の患者が陽子線治療を受けていた。52%の患者で、神経学的症候の安定化もしくは改善が認められた。全患者集団における生存期間中央値は5.3ヶ月だった。骨髄回避陽子線治療を受けた患者における生存期間中央値は8ヶ月だった。頻度の高かった有害事象は血液毒性と胃腸毒性だった。
結論:
薬物療法や放射線治療が進歩したにもかかわらず、LMDは依然として様々な悪性腫瘍における破滅的な終末期合併症だった。治療関連有害事象はCSI遂行における障壁となり得る。一部のLMD患者において、骨髄回避陽子線治療はより安全な緩和医療となり得るし、生命予後延長効果もあるかも知れない
2021年08月31日
免疫チェックポイント阻害薬と抑うつ反応
がん薬物療法による有害事象の中には、多分因果関係が分からない、見過ごされているものも多数ある。
味覚障害や聴覚障害など、その最たるものだろう。
既に亡くなった患者だが、免疫チェックポイント阻害薬をかなり長期間使用したのちに、前触れなく抑うつ反応を起こした患者がいた。
もともとが社交的で朗らかな患者だっただけに、随分と面食らった。
食事をしてくれない。
話もしてくれない。
体を起こしてさえくれない。
病状を考えると進行肺がんによる抑うつに陥っても何ら不思議はない患者だったのだが、それにしてもそうなる前との落差が大きく、戸惑った。
一時期は全く食事を食べなくなり、中心静脈路確保、高カロリー輸液まで必要となる有様だった。
結局ごくありふれた抗うつ薬・抗不安薬であるデパス(エチゾラム)を処方して、少なくとも抑うつは快方に向かった。
しかし、久し振りに考え直してみると、免疫チェックポイント阻害薬の有害事象だったのではないかという気がしてきた。
免疫チェックポイント阻害薬と抑うつ反応の関連性についての報告は調べる限りでは見つけきれなかった。
この患者については、過去のブログ記事で断片的に取り上げていたので、備忘録として残しておく。
・早速PD-L1検査
http://oitahaiganpractice.junglekouen.com/e890120.html
・検体不足
http://oitahaiganpractice.junglekouen.com/e890923.html
・PD-L1評価のため再生検したものの・・・
http://oitahaiganpractice.junglekouen.com/e893894.html
・30%・・・
http://oitahaiganpractice.junglekouen.com/e895217.html
・アテゾリズマブ、使用可能に
http://oitahaiganpractice.junglekouen.com/e931095.html
・ペンブロリズマブ後のアテゾリズマブ、残念ながら無効中止
http://oitahaiganpractice.junglekouen.com/e941860.html
・ステロイド使用中の患者とPD-1/PD-L1阻害薬の効果
http://oitahaiganpractice.junglekouen.com/e942028.html
・「無増悪生存期間は延長しないが、全生存期間は延長する」ということの意味
http://oitahaiganpractice.junglekouen.com/e967731.html
・正月をどこで迎えるかということ
http://oitahaiganpractice.junglekouen.com/e968219.html
味覚障害や聴覚障害など、その最たるものだろう。
既に亡くなった患者だが、免疫チェックポイント阻害薬をかなり長期間使用したのちに、前触れなく抑うつ反応を起こした患者がいた。
もともとが社交的で朗らかな患者だっただけに、随分と面食らった。
食事をしてくれない。
話もしてくれない。
体を起こしてさえくれない。
病状を考えると進行肺がんによる抑うつに陥っても何ら不思議はない患者だったのだが、それにしてもそうなる前との落差が大きく、戸惑った。
一時期は全く食事を食べなくなり、中心静脈路確保、高カロリー輸液まで必要となる有様だった。
結局ごくありふれた抗うつ薬・抗不安薬であるデパス(エチゾラム)を処方して、少なくとも抑うつは快方に向かった。
しかし、久し振りに考え直してみると、免疫チェックポイント阻害薬の有害事象だったのではないかという気がしてきた。
免疫チェックポイント阻害薬と抑うつ反応の関連性についての報告は調べる限りでは見つけきれなかった。
この患者については、過去のブログ記事で断片的に取り上げていたので、備忘録として残しておく。
・早速PD-L1検査
http://oitahaiganpractice.junglekouen.com/e890120.html
・検体不足
http://oitahaiganpractice.junglekouen.com/e890923.html
・PD-L1評価のため再生検したものの・・・
http://oitahaiganpractice.junglekouen.com/e893894.html
・30%・・・
http://oitahaiganpractice.junglekouen.com/e895217.html
・アテゾリズマブ、使用可能に
http://oitahaiganpractice.junglekouen.com/e931095.html
・ペンブロリズマブ後のアテゾリズマブ、残念ながら無効中止
http://oitahaiganpractice.junglekouen.com/e941860.html
・ステロイド使用中の患者とPD-1/PD-L1阻害薬の効果
http://oitahaiganpractice.junglekouen.com/e942028.html
・「無増悪生存期間は延長しないが、全生存期間は延長する」ということの意味
http://oitahaiganpractice.junglekouen.com/e967731.html
・正月をどこで迎えるかということ
http://oitahaiganpractice.junglekouen.com/e968219.html
2021年07月01日
アンサーとセファランチン、放射線治療とリンパ球
セファランチン、最近めっきり使わなくなってしまった薬の1つである。
とても不思議な薬で、効能・効果は、
「放射線による白血球減少」「円形脱毛症・粃糠性脱毛症」
とされている。
かつて、胸部放射線治療を開始した患者さんによく処方していたが、効果があるのかないのかよく分からず、いつからか処方しなくなった。
インタビューフォームを確認しても、有効性については以下のような記載しかない。
「放射線による白血球減少症に対する効果:放射線による白血球減少症 264 例に対する有効率は、「有効」以上で 64.8%(171/264)、「やや
有効」以上で 83.3%(220/264)であった」
一方、アンサー皮下注は、そもそも使ったことがない。
この薬はセファランチンよりももっとトンガっていて、効能・効果は、
「放射線療法による白血球減少症」
と潔いくらいにこの用法に特化した薬である。
1日1回皮下注射、週に2回を放射線治療継続中は継続するとのこと。
こちらは二重盲検比較試験で有効性が検証されており、
「放射線療法に起因する白血球減少症に対するアンサー皮下注 20μgの臨床的有用性を、肺癌患者において感染症併発を指標とし、プラセボ(生理食塩液)を対照とした二重盲検比較試験により検討した。その結果、感染症併発の発生率は、アンサー皮下注 20μg群 6.7%、プラセボ群21.2%でアンサー皮下注 20μg群の方が低値であった。また感染症の累積発生率および疑感染を含む 3 段階の感染症併発の検討では、アンサー皮下注 20μg群で感染症の併発が有意に抑制されていた」
とのこと。
さらに、インタビューフォームを注意深く読んでみると、開発の経緯の項に
「本剤は 1956 年に日本医科大学皮膚科学教室 丸山千里博士により、人型結核菌青山 B 株から製造された結核菌体抽出物質である」
「本剤は基礎的検討で造血機能亢進作用並びに白血球減少回復促進作用が見出され、1986 年から臨床試験を開始し、放射線治療時の白血球減少に対する有用性が確認された」
とある。
・・・早い話が、丸山ワクチンのB液ということですか?
B液だけとはいえ、保険適応の薬として市販されているとは知らなかった。
コロニー刺激因子やIL-3の発現を誘導して、顆粒球や単球を増やすとのこと。
なぜこんなことを書き始めたかというと、III期局所進行非小細胞肺がん放射線治療中のリンパ球が多く保たれる方が、生命予後がよいという話を聞いたからである。
この論文では、放射線治療中のリンパ球最低値が≦500ケ/μLのグループと>500ケ/μLのグループとで比較したところ、後者の方が無増悪生存期間、全生存期間共に統計学的有意に優れていたとのこと。
じゃあリンパ球を増やす薬を併用しながら治療すればいいんじゃない?ということでアンサーとセファランチンを調べてみたのだが、残念ながらリンパ球を増やすような薬ではなかったようだ。
Treatment-duration is related to changes in peripheral lymphocyte counts during definitive radiotherapy for unresectable stage III NSCLC
Luke R G Pike et al., Radiat Oncol. 2019 May 27;14(1):86.
doi: 10.1186/s13014-019-1287-z.
背景:
非小細胞肺がん治療における根治的胸部放射線照射中における分割照射方法が、リンパ球減少症の程度に、さらには患者の生命予後に影響を与えるかどうかを検証した。
方法:
切除不能III期非小細胞肺がん患者で、異なる照射量・分割方法により根治的胸部放射線照射を受けた115人の患者を対象とした。カルテと臨床検査データを見直して、放射線治療中のリンパ球数の変化を評価した。リンパ球数と臨床経過の相関を解析した。
結果:
患者全体におけるリンパ球数減少値の中央値は1,300/μL(四分位区間は950-1510/μL)だった。全体のうち63人(54.8%)は、リンパ球数<500/μLと高度のリンパ球減少症に見舞われており、この状態になるまでの期間の中央値は放射線治療開始から5週目であり、放射線治療終了時や総照射量が最大になった時点ではなかった。高度のリンパ球減少を来すリスクは当初5週間で増加し(オッズ比は3.455、p=0.007)、その後はリスク増加は確認できなかった(オッズ比0.562、p=0.216)。リンパ球数の中央値は、放射線治療を完遂してから2ヶ月経過しても低値のままであり、治療開始前の水準には回復しなかった。高度の好中球減少に至らないことは独立した予後良好因子で、多変数解析で交絡因子を調整したあとでも、有意に無増悪生存期間(ハザード比0.544、p=0.010)、全生存期間(ハザード比0.463、p=0.011)を延長していた。高度のリンパ球減少は、全治療期間4週以内(3Gy/回×20回)の患者集団の方が、全治療期間4週間超(2Gy/回×30回)の患者集団よりも頻度が低かった(32.1% vs 62.1%、オッズ比0.289で71.1%の相対リスク低下、p=0.006)。多変数解析では、全治療期間4週以内であることがリンパ球減少のリスクを低減する独立した因子だった(オッズ比0.322、p=0.032)。
結論:
切除不能III期非小細胞肺がん患者において、3Gy/回×20回の放射線照射法は有意に高度のリンパ球減少リスクを低下させ、生命予後を改善することが示された。
とても不思議な薬で、効能・効果は、
「放射線による白血球減少」「円形脱毛症・粃糠性脱毛症」
とされている。
かつて、胸部放射線治療を開始した患者さんによく処方していたが、効果があるのかないのかよく分からず、いつからか処方しなくなった。
インタビューフォームを確認しても、有効性については以下のような記載しかない。
「放射線による白血球減少症に対する効果:放射線による白血球減少症 264 例に対する有効率は、「有効」以上で 64.8%(171/264)、「やや
有効」以上で 83.3%(220/264)であった」
一方、アンサー皮下注は、そもそも使ったことがない。
この薬はセファランチンよりももっとトンガっていて、効能・効果は、
「放射線療法による白血球減少症」
と潔いくらいにこの用法に特化した薬である。
1日1回皮下注射、週に2回を放射線治療継続中は継続するとのこと。
こちらは二重盲検比較試験で有効性が検証されており、
「放射線療法に起因する白血球減少症に対するアンサー皮下注 20μgの臨床的有用性を、肺癌患者において感染症併発を指標とし、プラセボ(生理食塩液)を対照とした二重盲検比較試験により検討した。その結果、感染症併発の発生率は、アンサー皮下注 20μg群 6.7%、プラセボ群21.2%でアンサー皮下注 20μg群の方が低値であった。また感染症の累積発生率および疑感染を含む 3 段階の感染症併発の検討では、アンサー皮下注 20μg群で感染症の併発が有意に抑制されていた」
とのこと。
さらに、インタビューフォームを注意深く読んでみると、開発の経緯の項に
「本剤は 1956 年に日本医科大学皮膚科学教室 丸山千里博士により、人型結核菌青山 B 株から製造された結核菌体抽出物質である」
「本剤は基礎的検討で造血機能亢進作用並びに白血球減少回復促進作用が見出され、1986 年から臨床試験を開始し、放射線治療時の白血球減少に対する有用性が確認された」
とある。
・・・早い話が、丸山ワクチンのB液ということですか?
B液だけとはいえ、保険適応の薬として市販されているとは知らなかった。
コロニー刺激因子やIL-3の発現を誘導して、顆粒球や単球を増やすとのこと。
なぜこんなことを書き始めたかというと、III期局所進行非小細胞肺がん放射線治療中のリンパ球が多く保たれる方が、生命予後がよいという話を聞いたからである。
この論文では、放射線治療中のリンパ球最低値が≦500ケ/μLのグループと>500ケ/μLのグループとで比較したところ、後者の方が無増悪生存期間、全生存期間共に統計学的有意に優れていたとのこと。
じゃあリンパ球を増やす薬を併用しながら治療すればいいんじゃない?ということでアンサーとセファランチンを調べてみたのだが、残念ながらリンパ球を増やすような薬ではなかったようだ。
Treatment-duration is related to changes in peripheral lymphocyte counts during definitive radiotherapy for unresectable stage III NSCLC
Luke R G Pike et al., Radiat Oncol. 2019 May 27;14(1):86.
doi: 10.1186/s13014-019-1287-z.
背景:
非小細胞肺がん治療における根治的胸部放射線照射中における分割照射方法が、リンパ球減少症の程度に、さらには患者の生命予後に影響を与えるかどうかを検証した。
方法:
切除不能III期非小細胞肺がん患者で、異なる照射量・分割方法により根治的胸部放射線照射を受けた115人の患者を対象とした。カルテと臨床検査データを見直して、放射線治療中のリンパ球数の変化を評価した。リンパ球数と臨床経過の相関を解析した。
結果:
患者全体におけるリンパ球数減少値の中央値は1,300/μL(四分位区間は950-1510/μL)だった。全体のうち63人(54.8%)は、リンパ球数<500/μLと高度のリンパ球減少症に見舞われており、この状態になるまでの期間の中央値は放射線治療開始から5週目であり、放射線治療終了時や総照射量が最大になった時点ではなかった。高度のリンパ球減少を来すリスクは当初5週間で増加し(オッズ比は3.455、p=0.007)、その後はリスク増加は確認できなかった(オッズ比0.562、p=0.216)。リンパ球数の中央値は、放射線治療を完遂してから2ヶ月経過しても低値のままであり、治療開始前の水準には回復しなかった。高度の好中球減少に至らないことは独立した予後良好因子で、多変数解析で交絡因子を調整したあとでも、有意に無増悪生存期間(ハザード比0.544、p=0.010)、全生存期間(ハザード比0.463、p=0.011)を延長していた。高度のリンパ球減少は、全治療期間4週以内(3Gy/回×20回)の患者集団の方が、全治療期間4週間超(2Gy/回×30回)の患者集団よりも頻度が低かった(32.1% vs 62.1%、オッズ比0.289で71.1%の相対リスク低下、p=0.006)。多変数解析では、全治療期間4週以内であることがリンパ球減少のリスクを低減する独立した因子だった(オッズ比0.322、p=0.032)。
結論:
切除不能III期非小細胞肺がん患者において、3Gy/回×20回の放射線照射法は有意に高度のリンパ球減少リスクを低下させ、生命予後を改善することが示された。
2021年06月30日
PD-L1≧50%の進行non-Sq NSCLC患者で、免疫チェックポイント阻害薬単剤療法は必要かつ十分なのか
KEYNOTE-024試験の日本人サブグループ解析の結果、PD-L1≧50%の患者集団における生存期間の95%信頼値は22.9ヶ月以上、5年生存割合は51%と、以下の記事で書いた。
http://oitahaiganpractice.junglekouen.com/e986810.html
限られた患者集団とは言え、条件を満たした進行非小細胞肺がん患者がペンブロリズマブ単剤療法から治療を開始するとその半数が5年生存するというのは、私のような20世紀デビューの医師からすると、衝撃的な事実である。
とはいえ、実臨床でそこまで良いような印象は、正直言ってない。
本当にそうなるのかどうか、今後検証する必要があるだろう。
スイスの先生とイタリアの先生が、以下のような議論を交わしていたようだ。
スイスの先生とイタリアの先生が、アメリカの患者さんたちの実地臨床データベースから抽出した結果をもって欧州で議論しているのは、私から見れば「他人の褌で相撲を取る」に見えてしまう。
両者の結論は対照的で、なんだかpro-con的な議論で結論が見いだせない。
今回の報告を受けて、私ならPD-L1≧50%の進行非扁平上皮非小細胞肺がん患者の治療を考えるとき、
単剤療法:元気がない人・治療毒性リスクが高い人・進行が緩やかな人・PD-L1≧90%の人
併用療法:非喫煙者・治療毒性リスクが低い人・進行が速い、或いは病巣が増大するとPSが悪化しやすそうな人、PD-L1 50-89%
と使い分けるかなあ。
非喫煙者を潜在的な(未知の、あるいは評価困難な)ドライバー遺伝子変異陽性群と捉えると、多分ドライバー遺伝子変異陽性の患者は、併用療法の方がいいんだろう。
分子標的薬が使えなくなったら、次治療では併用療法を行うのがスマートかも知れない。
こうした考え方は、ニボルマブ+イピリムマブを使うとき、どんな人にCM227レジメンを、どんな人にCM9LAレジメンを使うか、といったところにも応用できそうな気がする。
Effectiveness of PD-(L)1 inhibitors alone or in combination with platinum-doublet chemotherapy in first-line (1L) non-squamous non-small cell lung cancer (Nsq-NSCLC) with high PD-L1 expression using real-world data
Solange Peters, MD, PhD
ESMO Virtual Plenary. Presented April 8, 2020.
腫瘍細胞におけるPD-L1高発現、すなわちPD-L1発現割合(TPS)≧50%の進行非扁平上皮非小細胞肺がん患者においては、抗PD-1 / PD-L1抗体の単剤療法と、抗PD-1 / PD-L1抗体+プラチナ併用化学療法のいずれも初回薬物療法の治療選択肢である。こうした患者においてどちらの治療が最適なのか、実際のところはっきりしない。Peters教授のグループは、実社会においてこれらの治療を受けた患者集団の治療経過について調査した。
米国のFlatiron Health電子データベースを用いて、条件に合う患者を抽出した。データベースにない事項は、医療者のカルテ、バイオマーカー評価結果報告書、病理診断結果報告書などから抽出した。非小細胞肺がん患者24,075人から、条件に合う患者520人を抽出した。主な条件は、IV期相当の状態(新規の進行非小細胞肺がん患者もしくは術後再発の治癒不能非小細胞肺がん患者)、非扁平上皮がん、ドライバー遺伝子変異がない、血液生化学検査で正常である、PS 0-2、TPS≧50%、初回薬物療法として抗PD-1 / PD-L1抗体の単剤療法もしくは抗PD-1 / PD-L1抗体+プラチナ併用化学療法を行っている、とした。特定の患者集団では、対象患者数が少ないとか、治療戦略(担当医の治療指針)のバラつきが目立った。そのため、今回の調査ではそうしたサブグループと判断された扁平上皮がんの患者、TPS 1-49%の患者は除外した。
事実上、単剤療法は全てペンブロリズマブ単剤療法であり、併用療法は全てペンブロリズマブ+カルボプラチン+ペメトレキセド併用療法だった。
患者の内訳は単剤療法群351人、併用療法群169人だった。主要評価項目は全生存期間で、副次評価項目は臨床的無増悪生存期間(画像評価上の悪化ではなく、患者の病状悪化を病勢進行と捉える)とした。単剤療法群には、より予後不良な背景(高齢、術後再発)を持つ患者が多かった。傾向スコアマッチング法(propensity score matching methods)を用いて患者背景で調整した上でハザード比を算出した。以下の背景因子について調整した:年齢、性別、人種、喫煙歴、PS、転移様式、脳転移の有無、肝転移の有無、診断から治療開始までの期間。
観察期間中央値は単剤療法群で23.5ヶ月、併用療法群で19.9ヶ月だった。以下に示すように、全生存期間、無増悪生存期間のどちらでも、両群間に有意差はつかなかった。

Peters教授は以下のようにコメントしている。
・全生存期間の生存曲線は、両群間で完全に重なっている
・画像診断上の無増悪生存期間の生存曲線も同様に重なっているように見えるが、治療期間の早い段階においては単剤療法群で病勢進行が目立ち、併用療法の方が優れているように見える
・治療早期に病勢進行に至る患者が多いことは免疫チェックポイント阻害薬単剤療法の臨床試験ではよく知られた現象だが、それがそのまま全生存期間や臨床的無増悪生存期間に反映されるわけではない
全体の患者集団では両治療群間に差は見られなかったわけだが、非喫煙者集団では併用療法群の方が統計学的有意に予後良好だった。この患者集団では、併用療法により死亡リスクが75%(p=0.02)、病勢進行リスクが60%(p=0.04)低減された。
脳転移患者集団、肝転移患者集団においては、両治療群間の治療成績は同等だった。
治療開始から中止までの期間中央値は、単剤療法群で8.5ヶ月、併用療法群で7.3ヶ月だった。後治療は単剤療法群の31%が、併用療法群の33%が受けていた。
Peters教授の発表を受けて、討論に参加したCappuzo教授は以下のようにコメントしている。
・重要で刺激的な発表であり、科学的な見地からは単剤療法と併用療法どちらを選ぶべきかの結論は今回の発表だけでは出せない
・全生存期間に差がない以上、単剤療法と併用療法のどちらがベストなのか、個別の患者ごとに判断しなければいけないということははっきりした
・PD-L1高発現の非小細胞肺がん患者において免疫チェックポイント阻害薬単剤療法が化学療法を凌ぐことは確かだが、一方で第III相臨床試験に参加した患者の30%では、免疫チェックポイント阻害薬単剤療法よりも、化学療法との併用療法の方が、より予後良好だった
・PD-L1高発現の患者を対象としたほとんどの臨床試験において、免疫チェックポイント阻害薬単剤療法での生存期間中央値は2年未満だが、併用療法では2年を上回る
・一方で、併用療法では毒性も強くなる
・grade 3-5の毒性は併用療法では患者の60%に見られるが、単剤療法では20%である
・毒性管理は実臨床においては重要で、治療毒性に耐えうる限り、進行の早い患者には併用療法を使いたいし、一方で進行の緩やかな患者や忍容性の乏しい患者では単剤療法を使いたい
・一般に、非喫煙者における免疫チェックポイント阻害薬の効果は乏しいとされているので、免疫チェックポイント阻害薬に化学療法上乗せが必要かどうかよりも、そもそもこの患者集団全てに免疫チェックポイント阻害薬が必要なのか、化学療法だけではダメなのか、免疫チェックポイント阻害薬が全く役に立たないのはどんな非喫煙者なのか、という視点がほしい
・PD-L1高発現の患者は、一様ではない
・PD-L1≧90%の患者には免疫チェックポイント阻害薬が著効するため、こうした患者には単剤療法が最適な治療かも知れない
・結局のところ、安全性が担保される限りはPD-L1≧50%の全ての患者に併用療法を適用したいが、PD-L1≧90%の患者とか、患者の治療忍容性に懸念があるときは、単剤療法を行いたい
http://oitahaiganpractice.junglekouen.com/e986810.html
限られた患者集団とは言え、条件を満たした進行非小細胞肺がん患者がペンブロリズマブ単剤療法から治療を開始するとその半数が5年生存するというのは、私のような20世紀デビューの医師からすると、衝撃的な事実である。
とはいえ、実臨床でそこまで良いような印象は、正直言ってない。
本当にそうなるのかどうか、今後検証する必要があるだろう。
スイスの先生とイタリアの先生が、以下のような議論を交わしていたようだ。
スイスの先生とイタリアの先生が、アメリカの患者さんたちの実地臨床データベースから抽出した結果をもって欧州で議論しているのは、私から見れば「他人の褌で相撲を取る」に見えてしまう。
両者の結論は対照的で、なんだかpro-con的な議論で結論が見いだせない。
今回の報告を受けて、私ならPD-L1≧50%の進行非扁平上皮非小細胞肺がん患者の治療を考えるとき、
単剤療法:元気がない人・治療毒性リスクが高い人・進行が緩やかな人・PD-L1≧90%の人
併用療法:非喫煙者・治療毒性リスクが低い人・進行が速い、或いは病巣が増大するとPSが悪化しやすそうな人、PD-L1 50-89%
と使い分けるかなあ。
非喫煙者を潜在的な(未知の、あるいは評価困難な)ドライバー遺伝子変異陽性群と捉えると、多分ドライバー遺伝子変異陽性の患者は、併用療法の方がいいんだろう。
分子標的薬が使えなくなったら、次治療では併用療法を行うのがスマートかも知れない。
こうした考え方は、ニボルマブ+イピリムマブを使うとき、どんな人にCM227レジメンを、どんな人にCM9LAレジメンを使うか、といったところにも応用できそうな気がする。
Effectiveness of PD-(L)1 inhibitors alone or in combination with platinum-doublet chemotherapy in first-line (1L) non-squamous non-small cell lung cancer (Nsq-NSCLC) with high PD-L1 expression using real-world data
Solange Peters, MD, PhD
ESMO Virtual Plenary. Presented April 8, 2020.
腫瘍細胞におけるPD-L1高発現、すなわちPD-L1発現割合(TPS)≧50%の進行非扁平上皮非小細胞肺がん患者においては、抗PD-1 / PD-L1抗体の単剤療法と、抗PD-1 / PD-L1抗体+プラチナ併用化学療法のいずれも初回薬物療法の治療選択肢である。こうした患者においてどちらの治療が最適なのか、実際のところはっきりしない。Peters教授のグループは、実社会においてこれらの治療を受けた患者集団の治療経過について調査した。
米国のFlatiron Health電子データベースを用いて、条件に合う患者を抽出した。データベースにない事項は、医療者のカルテ、バイオマーカー評価結果報告書、病理診断結果報告書などから抽出した。非小細胞肺がん患者24,075人から、条件に合う患者520人を抽出した。主な条件は、IV期相当の状態(新規の進行非小細胞肺がん患者もしくは術後再発の治癒不能非小細胞肺がん患者)、非扁平上皮がん、ドライバー遺伝子変異がない、血液生化学検査で正常である、PS 0-2、TPS≧50%、初回薬物療法として抗PD-1 / PD-L1抗体の単剤療法もしくは抗PD-1 / PD-L1抗体+プラチナ併用化学療法を行っている、とした。特定の患者集団では、対象患者数が少ないとか、治療戦略(担当医の治療指針)のバラつきが目立った。そのため、今回の調査ではそうしたサブグループと判断された扁平上皮がんの患者、TPS 1-49%の患者は除外した。
事実上、単剤療法は全てペンブロリズマブ単剤療法であり、併用療法は全てペンブロリズマブ+カルボプラチン+ペメトレキセド併用療法だった。
患者の内訳は単剤療法群351人、併用療法群169人だった。主要評価項目は全生存期間で、副次評価項目は臨床的無増悪生存期間(画像評価上の悪化ではなく、患者の病状悪化を病勢進行と捉える)とした。単剤療法群には、より予後不良な背景(高齢、術後再発)を持つ患者が多かった。傾向スコアマッチング法(propensity score matching methods)を用いて患者背景で調整した上でハザード比を算出した。以下の背景因子について調整した:年齢、性別、人種、喫煙歴、PS、転移様式、脳転移の有無、肝転移の有無、診断から治療開始までの期間。
観察期間中央値は単剤療法群で23.5ヶ月、併用療法群で19.9ヶ月だった。以下に示すように、全生存期間、無増悪生存期間のどちらでも、両群間に有意差はつかなかった。

Peters教授は以下のようにコメントしている。
・全生存期間の生存曲線は、両群間で完全に重なっている
・画像診断上の無増悪生存期間の生存曲線も同様に重なっているように見えるが、治療期間の早い段階においては単剤療法群で病勢進行が目立ち、併用療法の方が優れているように見える
・治療早期に病勢進行に至る患者が多いことは免疫チェックポイント阻害薬単剤療法の臨床試験ではよく知られた現象だが、それがそのまま全生存期間や臨床的無増悪生存期間に反映されるわけではない
全体の患者集団では両治療群間に差は見られなかったわけだが、非喫煙者集団では併用療法群の方が統計学的有意に予後良好だった。この患者集団では、併用療法により死亡リスクが75%(p=0.02)、病勢進行リスクが60%(p=0.04)低減された。
脳転移患者集団、肝転移患者集団においては、両治療群間の治療成績は同等だった。
治療開始から中止までの期間中央値は、単剤療法群で8.5ヶ月、併用療法群で7.3ヶ月だった。後治療は単剤療法群の31%が、併用療法群の33%が受けていた。
Peters教授の発表を受けて、討論に参加したCappuzo教授は以下のようにコメントしている。
・重要で刺激的な発表であり、科学的な見地からは単剤療法と併用療法どちらを選ぶべきかの結論は今回の発表だけでは出せない
・全生存期間に差がない以上、単剤療法と併用療法のどちらがベストなのか、個別の患者ごとに判断しなければいけないということははっきりした
・PD-L1高発現の非小細胞肺がん患者において免疫チェックポイント阻害薬単剤療法が化学療法を凌ぐことは確かだが、一方で第III相臨床試験に参加した患者の30%では、免疫チェックポイント阻害薬単剤療法よりも、化学療法との併用療法の方が、より予後良好だった
・PD-L1高発現の患者を対象としたほとんどの臨床試験において、免疫チェックポイント阻害薬単剤療法での生存期間中央値は2年未満だが、併用療法では2年を上回る
・一方で、併用療法では毒性も強くなる
・grade 3-5の毒性は併用療法では患者の60%に見られるが、単剤療法では20%である
・毒性管理は実臨床においては重要で、治療毒性に耐えうる限り、進行の早い患者には併用療法を使いたいし、一方で進行の緩やかな患者や忍容性の乏しい患者では単剤療法を使いたい
・一般に、非喫煙者における免疫チェックポイント阻害薬の効果は乏しいとされているので、免疫チェックポイント阻害薬に化学療法上乗せが必要かどうかよりも、そもそもこの患者集団全てに免疫チェックポイント阻害薬が必要なのか、化学療法だけではダメなのか、免疫チェックポイント阻害薬が全く役に立たないのはどんな非喫煙者なのか、という視点がほしい
・PD-L1高発現の患者は、一様ではない
・PD-L1≧90%の患者には免疫チェックポイント阻害薬が著効するため、こうした患者には単剤療法が最適な治療かも知れない
・結局のところ、安全性が担保される限りはPD-L1≧50%の全ての患者に併用療法を適用したいが、PD-L1≧90%の患者とか、患者の治療忍容性に懸念があるときは、単剤療法を行いたい
2021年04月22日
がんと新型コロナウイルスワクチン
私の勤め先の市町村でも、患者の手元に新型コロナウイルスワクチンのクーポンが届き始めた。
たくさんの外来患者から、自分は接種してもいいだろうかと相談を受けた。
型のごとく、新型コロナウイルスワクチンは他のワクチンと同様に自由意思が尊重されているので、接種するかしないかは個人の自由だと伝えている。
その上で、もし接種をするのなら、少なくとも2回目を接種した翌日だけは自宅で1日療養できる体制を整えるようにと伝えた。
ワクチンは新型コロナウイルスに対する免疫活性を増強するために接種するわけだが、ワクチン接種により免疫チェックポイント阻害薬による治療を受けているがん患者では、免疫関連有害事象が起こりやすくなるのではないかという仮説が考えられる。
今回の論文はそこに一定の回答を与えるものであり、結論から言うとあまり心配せずに、一般の患者と同様に接種を勧めてよさそうだ。
Short-term safety of the BNT162b2 mRNA COVID-19 vaccine in patients with cancer treated with immune checkpoint inhibitors
Lancet Oncol. 2021 Apr 1
doi: 10.1016/S1470-2045(21)00155-8 [Epub ahead of print]
2020年12月20日、イスラエル保健省は国家的なCOVID-19ワクチン施策に着手した。これは、2021年1月末日までに全てのハイリスク者に迅速にワクチン接種(ビオンテック/ファイザーのBNT162b2ワクチン...商品名コミナティ, 以下COVID-19ワクチンと記載)を行うことを目指していた。本ワクチンは速やかに、かつ無料で提供された。薬物療法を受けているがん患者はとりわけCOVID-19による死亡リスクの高い集団であり、COVID-19ワクチン優先接種群として扱われた。
BNT162b2ワクチンの有効性を立証した臨床試験には健常者、もしくは慢性疾患はあるものの安定している患者のみが参加していたため、当局者にとっての懸念はがん治療を受けた、もしくは受けている患者にワクチン接種をした場合の有効性や安全性のデータがないことだった。インフルエンザワクチン等、日常的に使用されている他のワクチンに関する知見に基づき、当局は全てのがん患者に対してCOVID-19ワクチン接種を推奨した。しかし一部の有識者は、免疫チェックポイント阻害薬による治療を受けている患者の免疫関連有害事象が、ワクチン接種により誘発ないし増幅されるリスクについて懸念を抱いていた。そのため、免疫チェックポイント阻害薬による治療を受けている患者のワクチン接種については、当局は態度を保留し、担当医の判断に委ねることとした。
テルアビブSourasky医療センター(TLVSMC)の腫瘍部門およびBnei-Zion医療センターの腫瘍ユニットの施設方針は、全てのがん治療を受けている患者に対して、治療内容によらずCOVID-19ワクチン接種を許可ないし推奨するというものだった。COVID-19はこうした患者に対してはとりわけ危険なため、病期、PS、期待される予後に関わらずワクチン接種が推奨された。既に新型コロナウイルスに感染した患者、あるいは何らかの急性期合併症に見舞われている患者(活動性の感染症に罹患している、コントロールできていない免疫関連有害事象に見舞われている、など)はCOVID-19ワクチン施策の対象外とされた。COVID-19ワクチンは標準投与量を1日目と21日目に投与された。2回目の投与は、1回目の投与の後に新型コロナウイルスに感染した患者では省略された。
前述の安全性に関する懸念から、免疫チェックポイント阻害薬治療中の患者におけるCOVID19ワクチンの副反応・有害事象は、1回目の接種後、2回目の接種後ともに20日間前後、詳しい電話アンケートの形式で追跡された。今回報告するのは、上記の2医療センターで免疫チェックポイント阻害薬治療を受けている患者におけるCOVID-19ワクチンの安全性に関するデータである。免疫チェックポイント阻害薬による治療を受けている患者とコントロール群の患者におけるCOVID-19ワクチンの有害事象を症例・対照研究として比較した。COVID-19ワクチン施策の開始時点で、病院ボランティアを含むすべてのTLVSMCの医療スタッフが新型コロナウイルスワクチン接種を推奨され、実際にワクチンを接種した2241人が有害事象調査に参加した。2回目の接種まで受け終えたそれぞれのがん患者に対して、TLVMCでワクチン接種を受けた健常者から性別と年齢を適合させた対照者を設定し、比較対照群とした。一人だけ、93歳の患者については対照者が得られなかったため、89歳の患者を充てた。
2021年1月11日から2月25日にかけて、免疫チェックポイント阻害薬による治療を受けている患者170人に対してCOVID-19ワクチン接種とその後の調査が提案された。33人(19%)はCOVID-19ワクチン接種を拒否した。ほとんどはCOVID-19ワクチン接種による有害事象を恐れていることが理由だった。137人(81%)の患者は1回目のワクチン接種を受け、そのうち134人は2回目のワクチン接種を受けた。3人の患者は1回目のワクチン接種後に死亡した。1人はCOVID-19感染により、2人はがんの病勢進行により死亡した。1回目のワクチン接種後に頻度が高かった副反応は、注射部位の痛み(134人中28人、21%)だった。全身性の副反応には、疲労(5人、4%)、頭痛(3人、2%)、筋肉痛(3人、2%)、そして悪寒戦慄(1人、1%)だった。
2回目の投与後の観察期間中に、134人中4人(3%)が病院に入院した。4人中3人はがん関連の有害事象、4人中1人は発熱が原因だった。入院治療後、4人全てが退院した。既に報告されているように、1回目ワクチン投与後よりも2回目のワクチン投与後の方が全身的、局所的副反応がより起こりやすかった。局所的副反応で頻度が高かったのは、注射部位の痛み(134人中85人、63%)、局所の発疹(134人中3人、2%)、局所の腫脹(134人中12人、9%)だった。一方、全身性副反応で頻度が高かったのは、筋肉痛(134人中46人、34%)、疲労(134人中45人、34%)、頭痛(134人中22人、16%)、発熱(134人中14人、10%)、悪寒戦慄(134人中14人、10%)、胃腸症状(134人中14人、10%)、インフルエンザ様症状(134人中3人、2%)だった。これら副反応により、入院や特別な治療を要することはなかった。
134人中、ほとんどの患者(116人、87%)は免疫チェックポイント阻害薬単剤での治療を受けており、残る18人(13%)は免疫チェックポイント阻害薬と化学療法の併用療法を受けていた。両群において、全身性のワクチン副反応が起こる頻度に違いは見られなかった(単剤療法群116人中37人(32%) vs 併用療法群18人中8人(44%)、χ二乗テストでのp=0.29)。
何より重要なことに、新たな免疫関連有害事象の発生や、既に認められていた免疫関連有害事象の増悪は認められなかった。
COVID-19ワクチンによる副反応は、健常者とがん患者においてほぼ同様だったが、筋肉痛だけはがん患者でより高頻度に認められた。しかし、免疫関連筋炎と診断された患者は、健常者、がん患者、いずれにも認められなかった。今回の調査結果は、免疫チェックポイント阻害薬を使用しているがん患者に対するCOVID-19ワクチンの安全性を裏付けている。
COVID-19ワクチン接種前に認められていた免疫関連有害事象とCOVID-19ワクチンによる副反応の関連性についても調べた。134人中72人(54%)の患者は、COVID-19ワクチン接種よりも前に、Grade2もしくはより深刻な免疫関連有害事象を経験していた。免疫関連有害事象を経験している患者でもしていない患者でも、COVID-19ワクチンの2回目を接種した後の全身性の副反応には差がなかった(72人中24人(33%) vs 62人中21人(34%)、p=0.94)。重要なことに、過去に免疫関連有害事象を経験したことがある患者について、COVID-19ワクチン関連の副反応はマイルドで、入院やがん治療の休止を要するようなものではなかった。
たくさんの外来患者から、自分は接種してもいいだろうかと相談を受けた。
型のごとく、新型コロナウイルスワクチンは他のワクチンと同様に自由意思が尊重されているので、接種するかしないかは個人の自由だと伝えている。
その上で、もし接種をするのなら、少なくとも2回目を接種した翌日だけは自宅で1日療養できる体制を整えるようにと伝えた。
ワクチンは新型コロナウイルスに対する免疫活性を増強するために接種するわけだが、ワクチン接種により免疫チェックポイント阻害薬による治療を受けているがん患者では、免疫関連有害事象が起こりやすくなるのではないかという仮説が考えられる。
今回の論文はそこに一定の回答を与えるものであり、結論から言うとあまり心配せずに、一般の患者と同様に接種を勧めてよさそうだ。
Short-term safety of the BNT162b2 mRNA COVID-19 vaccine in patients with cancer treated with immune checkpoint inhibitors
Lancet Oncol. 2021 Apr 1
doi: 10.1016/S1470-2045(21)00155-8 [Epub ahead of print]
2020年12月20日、イスラエル保健省は国家的なCOVID-19ワクチン施策に着手した。これは、2021年1月末日までに全てのハイリスク者に迅速にワクチン接種(ビオンテック/ファイザーのBNT162b2ワクチン...商品名コミナティ, 以下COVID-19ワクチンと記載)を行うことを目指していた。本ワクチンは速やかに、かつ無料で提供された。薬物療法を受けているがん患者はとりわけCOVID-19による死亡リスクの高い集団であり、COVID-19ワクチン優先接種群として扱われた。
BNT162b2ワクチンの有効性を立証した臨床試験には健常者、もしくは慢性疾患はあるものの安定している患者のみが参加していたため、当局者にとっての懸念はがん治療を受けた、もしくは受けている患者にワクチン接種をした場合の有効性や安全性のデータがないことだった。インフルエンザワクチン等、日常的に使用されている他のワクチンに関する知見に基づき、当局は全てのがん患者に対してCOVID-19ワクチン接種を推奨した。しかし一部の有識者は、免疫チェックポイント阻害薬による治療を受けている患者の免疫関連有害事象が、ワクチン接種により誘発ないし増幅されるリスクについて懸念を抱いていた。そのため、免疫チェックポイント阻害薬による治療を受けている患者のワクチン接種については、当局は態度を保留し、担当医の判断に委ねることとした。
テルアビブSourasky医療センター(TLVSMC)の腫瘍部門およびBnei-Zion医療センターの腫瘍ユニットの施設方針は、全てのがん治療を受けている患者に対して、治療内容によらずCOVID-19ワクチン接種を許可ないし推奨するというものだった。COVID-19はこうした患者に対してはとりわけ危険なため、病期、PS、期待される予後に関わらずワクチン接種が推奨された。既に新型コロナウイルスに感染した患者、あるいは何らかの急性期合併症に見舞われている患者(活動性の感染症に罹患している、コントロールできていない免疫関連有害事象に見舞われている、など)はCOVID-19ワクチン施策の対象外とされた。COVID-19ワクチンは標準投与量を1日目と21日目に投与された。2回目の投与は、1回目の投与の後に新型コロナウイルスに感染した患者では省略された。
前述の安全性に関する懸念から、免疫チェックポイント阻害薬治療中の患者におけるCOVID19ワクチンの副反応・有害事象は、1回目の接種後、2回目の接種後ともに20日間前後、詳しい電話アンケートの形式で追跡された。今回報告するのは、上記の2医療センターで免疫チェックポイント阻害薬治療を受けている患者におけるCOVID-19ワクチンの安全性に関するデータである。免疫チェックポイント阻害薬による治療を受けている患者とコントロール群の患者におけるCOVID-19ワクチンの有害事象を症例・対照研究として比較した。COVID-19ワクチン施策の開始時点で、病院ボランティアを含むすべてのTLVSMCの医療スタッフが新型コロナウイルスワクチン接種を推奨され、実際にワクチンを接種した2241人が有害事象調査に参加した。2回目の接種まで受け終えたそれぞれのがん患者に対して、TLVMCでワクチン接種を受けた健常者から性別と年齢を適合させた対照者を設定し、比較対照群とした。一人だけ、93歳の患者については対照者が得られなかったため、89歳の患者を充てた。
2021年1月11日から2月25日にかけて、免疫チェックポイント阻害薬による治療を受けている患者170人に対してCOVID-19ワクチン接種とその後の調査が提案された。33人(19%)はCOVID-19ワクチン接種を拒否した。ほとんどはCOVID-19ワクチン接種による有害事象を恐れていることが理由だった。137人(81%)の患者は1回目のワクチン接種を受け、そのうち134人は2回目のワクチン接種を受けた。3人の患者は1回目のワクチン接種後に死亡した。1人はCOVID-19感染により、2人はがんの病勢進行により死亡した。1回目のワクチン接種後に頻度が高かった副反応は、注射部位の痛み(134人中28人、21%)だった。全身性の副反応には、疲労(5人、4%)、頭痛(3人、2%)、筋肉痛(3人、2%)、そして悪寒戦慄(1人、1%)だった。
2回目の投与後の観察期間中に、134人中4人(3%)が病院に入院した。4人中3人はがん関連の有害事象、4人中1人は発熱が原因だった。入院治療後、4人全てが退院した。既に報告されているように、1回目ワクチン投与後よりも2回目のワクチン投与後の方が全身的、局所的副反応がより起こりやすかった。局所的副反応で頻度が高かったのは、注射部位の痛み(134人中85人、63%)、局所の発疹(134人中3人、2%)、局所の腫脹(134人中12人、9%)だった。一方、全身性副反応で頻度が高かったのは、筋肉痛(134人中46人、34%)、疲労(134人中45人、34%)、頭痛(134人中22人、16%)、発熱(134人中14人、10%)、悪寒戦慄(134人中14人、10%)、胃腸症状(134人中14人、10%)、インフルエンザ様症状(134人中3人、2%)だった。これら副反応により、入院や特別な治療を要することはなかった。
134人中、ほとんどの患者(116人、87%)は免疫チェックポイント阻害薬単剤での治療を受けており、残る18人(13%)は免疫チェックポイント阻害薬と化学療法の併用療法を受けていた。両群において、全身性のワクチン副反応が起こる頻度に違いは見られなかった(単剤療法群116人中37人(32%) vs 併用療法群18人中8人(44%)、χ二乗テストでのp=0.29)。
何より重要なことに、新たな免疫関連有害事象の発生や、既に認められていた免疫関連有害事象の増悪は認められなかった。
COVID-19ワクチンによる副反応は、健常者とがん患者においてほぼ同様だったが、筋肉痛だけはがん患者でより高頻度に認められた。しかし、免疫関連筋炎と診断された患者は、健常者、がん患者、いずれにも認められなかった。今回の調査結果は、免疫チェックポイント阻害薬を使用しているがん患者に対するCOVID-19ワクチンの安全性を裏付けている。
COVID-19ワクチン接種前に認められていた免疫関連有害事象とCOVID-19ワクチンによる副反応の関連性についても調べた。134人中72人(54%)の患者は、COVID-19ワクチン接種よりも前に、Grade2もしくはより深刻な免疫関連有害事象を経験していた。免疫関連有害事象を経験している患者でもしていない患者でも、COVID-19ワクチンの2回目を接種した後の全身性の副反応には差がなかった(72人中24人(33%) vs 62人中21人(34%)、p=0.94)。重要なことに、過去に免疫関連有害事象を経験したことがある患者について、COVID-19ワクチン関連の副反応はマイルドで、入院やがん治療の休止を要するようなものではなかった。
2021年03月24日
CheckMate451試験、進展型肺小細胞癌に対するニボルマブ+イピリムマブ併用維持療法は無効
進展型肺小細胞癌に対するプラチナ併用化学療法初回治療後にニボルマブ+イピリムマブ併用維持療法を行うことの意義を検証するCheckMate451第III相臨床試験の結果が報告されていた。
端的に言って、ニボルマブ+イピリムマブ併用療法もしくはニボルマブ単剤療法によるswitch maintenance therapyは無効だった。
有害事象も治療関連死も明らかに増えており、本治療は勧められない。
TMB≧13/1Mbaseの患者集団であればニボルマブ+イピリムマブ併用療法の意義がありそうだと付記されていたが、この患者集団に特化した第III相試験を新たに行わない限り、more toxicな本治療を行う必然性はないだろう。
Immunotherapy Doublet as Maintenance Therapy for Extensive-Disease Small Cell Lung Cancer
The ASCO Post
Posted: 3/18/2021 2:17:00 PM
Last Updated: 3/21/2021 12:09:41 PM
Nivolumab and Ipilimumab as Maintenance Therapy in Extensive-Disease Small-Cell Lung Cancer: CheckMate 451
Taofeek K. Owonikoko et al., J Clin Oncol 2021
DOI: 10.1200/JCO.20.02212 Journal of Clinical Oncology
背景:
進展型小細胞肺がんの患者において、プラチナ併用初回化学療法による腫瘍縮小には期待できるものの、その効果に持続性はない。CheckMate451試験は二重盲検第III相臨床試験で、進展型小細胞肺がん患者に対する初回化学療法後の維持療法としてニボルマブ+イピリムマブ併用療法、あるいはニボルマブ単剤療法の有用性を検討したものである。
方法:
進展型小細胞肺がんと診断され、ECOG-PS 0 /1、4コース以下の初回化学療法後に病勢進行に至っていない患者を対象とした。患者を1:1:1の割合で無作為に割り付けた。NI群(279人)ではニボルマブ1mg/kg+イピリムマブ3mg/kgを3週間ごとに12週間投与し、引き続いてニボルマブ240mgを2週間ごとに投与した。N群(280人)ではニボルマブ240mgを2週間ごとに投与した。P群(275人)ではプラセボを投与した。病勢進行あるいは忍容不能の毒性が出現するまで継続し、投与期間は最長2年間とした。主要評価項目はNI群とP群の間での全生存期間比較とし、副次評価項目は階層的に解析した。
結果:
2015年10月から2018年1月にかけて、32か国から参加した834人の患者が無作為割り付けの対象となった。最短の経過観察期間は8.9ヶ月、各治療群における観察期間中央値はNI群で8.4ヶ月、N群で9.9ヶ月、P群で9.1ヶ月だった。P群と比較して、NI群の全生存期間に有意な延長は認められなかった(ハザード比0.92(95%信頼区間0.75-1.12)、p=0.37、生存期間中央値はNI群で9.2ヶ月(95%信頼区間8.0-10.2ヶ月)、P群で9.6ヶ月(95%信頼区間8.2‐11.0ヶ月))。P群と比較して、N群の生存期間延長効果も同様に見られなかった(ハザード比0.84(95%信頼区間0.69-1.02)、N群の生存期間中央値は10.4ヶ月(95%信頼区間9.5‐12.1ヶ月))。無増悪生存期間について、P群に対するハザード比はNI群で0.72(95%信頼区間0.60-0.87)、N群で0.67(95%信頼区間は0.56-0.81)だった。無増悪生存期間中央値はNI群で1.7ヶ月、N群で1.9ヶ月、P群で1.4ヶ月だった。奏効割合はNI群で9.1%、N群で11.5%、P群で4.2%だった。奏効持続期間中央値はNI群で10.2ヶ月、n群で11.2ヶ月、P群で8.1ヶ月だった。参加者のうち、580人ではベースラインのTumor mutational burden(TMB)データが得られ、TMBが1Mbaseあたり13以上の患者集団では、P群に対してNI群で全生存期間が延長する傾向が認められた(ハザード比0.61、95%信頼区間0.39-0.94)。Grade 3-4の治療関連有害事象は、NI群の52.2%、N群の11.5%、P群の8.4%認められた。重篤な治療関連有害事象はNI群の37.4%、N群の6.1%、P群の2.9%で認められた。治療関連死はNI群で7人(横紋筋融解症1人、心筋炎1人、肝不全1人、辺縁系脳症1人、重症筋無力症1人、脳炎1人、免疫関連腸炎1人)、N群で1人(脳炎1人)、P群で1人(肺臓炎)認められた。
結論:
ニボルマブ+イピリムマブ併用による維持療法は、進展型小細胞肺がんの初回化学療法後の生存期間延長効果を示さないことが分かった。
端的に言って、ニボルマブ+イピリムマブ併用療法もしくはニボルマブ単剤療法によるswitch maintenance therapyは無効だった。
有害事象も治療関連死も明らかに増えており、本治療は勧められない。
TMB≧13/1Mbaseの患者集団であればニボルマブ+イピリムマブ併用療法の意義がありそうだと付記されていたが、この患者集団に特化した第III相試験を新たに行わない限り、more toxicな本治療を行う必然性はないだろう。
Immunotherapy Doublet as Maintenance Therapy for Extensive-Disease Small Cell Lung Cancer
The ASCO Post
Posted: 3/18/2021 2:17:00 PM
Last Updated: 3/21/2021 12:09:41 PM
Nivolumab and Ipilimumab as Maintenance Therapy in Extensive-Disease Small-Cell Lung Cancer: CheckMate 451
Taofeek K. Owonikoko et al., J Clin Oncol 2021
DOI: 10.1200/JCO.20.02212 Journal of Clinical Oncology
背景:
進展型小細胞肺がんの患者において、プラチナ併用初回化学療法による腫瘍縮小には期待できるものの、その効果に持続性はない。CheckMate451試験は二重盲検第III相臨床試験で、進展型小細胞肺がん患者に対する初回化学療法後の維持療法としてニボルマブ+イピリムマブ併用療法、あるいはニボルマブ単剤療法の有用性を検討したものである。
方法:
進展型小細胞肺がんと診断され、ECOG-PS 0 /1、4コース以下の初回化学療法後に病勢進行に至っていない患者を対象とした。患者を1:1:1の割合で無作為に割り付けた。NI群(279人)ではニボルマブ1mg/kg+イピリムマブ3mg/kgを3週間ごとに12週間投与し、引き続いてニボルマブ240mgを2週間ごとに投与した。N群(280人)ではニボルマブ240mgを2週間ごとに投与した。P群(275人)ではプラセボを投与した。病勢進行あるいは忍容不能の毒性が出現するまで継続し、投与期間は最長2年間とした。主要評価項目はNI群とP群の間での全生存期間比較とし、副次評価項目は階層的に解析した。
結果:
2015年10月から2018年1月にかけて、32か国から参加した834人の患者が無作為割り付けの対象となった。最短の経過観察期間は8.9ヶ月、各治療群における観察期間中央値はNI群で8.4ヶ月、N群で9.9ヶ月、P群で9.1ヶ月だった。P群と比較して、NI群の全生存期間に有意な延長は認められなかった(ハザード比0.92(95%信頼区間0.75-1.12)、p=0.37、生存期間中央値はNI群で9.2ヶ月(95%信頼区間8.0-10.2ヶ月)、P群で9.6ヶ月(95%信頼区間8.2‐11.0ヶ月))。P群と比較して、N群の生存期間延長効果も同様に見られなかった(ハザード比0.84(95%信頼区間0.69-1.02)、N群の生存期間中央値は10.4ヶ月(95%信頼区間9.5‐12.1ヶ月))。無増悪生存期間について、P群に対するハザード比はNI群で0.72(95%信頼区間0.60-0.87)、N群で0.67(95%信頼区間は0.56-0.81)だった。無増悪生存期間中央値はNI群で1.7ヶ月、N群で1.9ヶ月、P群で1.4ヶ月だった。奏効割合はNI群で9.1%、N群で11.5%、P群で4.2%だった。奏効持続期間中央値はNI群で10.2ヶ月、n群で11.2ヶ月、P群で8.1ヶ月だった。参加者のうち、580人ではベースラインのTumor mutational burden(TMB)データが得られ、TMBが1Mbaseあたり13以上の患者集団では、P群に対してNI群で全生存期間が延長する傾向が認められた(ハザード比0.61、95%信頼区間0.39-0.94)。Grade 3-4の治療関連有害事象は、NI群の52.2%、N群の11.5%、P群の8.4%認められた。重篤な治療関連有害事象はNI群の37.4%、N群の6.1%、P群の2.9%で認められた。治療関連死はNI群で7人(横紋筋融解症1人、心筋炎1人、肝不全1人、辺縁系脳症1人、重症筋無力症1人、脳炎1人、免疫関連腸炎1人)、N群で1人(脳炎1人)、P群で1人(肺臓炎)認められた。
結論:
ニボルマブ+イピリムマブ併用による維持療法は、進展型小細胞肺がんの初回化学療法後の生存期間延長効果を示さないことが分かった。
2021年02月02日
RET陽性肺がんのLIBRETTO-001試験、東アジア人患者でのサブグループ解析
2020年世界肺癌会議で、LIBRETTO-001試験における東アジア人患者の解析データが示されていた。
全体集団の解析結果と比べて、腫瘍縮小効果はほぼ同等、有害事象とそれに基づく治療中断は軽微、という有望な結果だった。
全体集団の解析結果は以下を参照。
http://oitahaiganpractice.junglekouen.com/e982216.html
FP14.10 - Efficacy and Safety of Selpercatinib (LOXO-292) in East Asian Patients with RET Fusion-Positive NSCLC
Herbert H Loong et al., WCLC 2020 #FP14.10
背景:
selpercatinibは高い選択性と潜在活性を持つ、中枢神経系病変にも有効な、経口RET阻害薬である。今回は、LIBRETTO-001試験の初期評価対象患者のうち、東アジア人患者集団に関する有効性と安全性について検討した。規制当局の同意のもと、初期評価対象患者は臨床試験開始初期に登録されたプラチナ併用化学療法既治療患者連続105人と定義された。
方法:
RET融合遺伝子陽性非小細胞肺がん患者が国際多施設共同第I / II相LIBRETTO-001試験に登録された。総計16か国からの89施設が参加したが、初期評価対象患者のうち自己申告に基づくアジア人患者は7か国23施設から登録されていた(日本:12人、韓国:11人、シンガポール:5人、香港:5人、米国:5人、オーストラリア:1人、フランス:1人)。用量漸増試験である第I相部分に引き続き、対象患者は第II相部分での推奨用量(160mg経口投与を1日2回、28日を1サイクルとして服用)で治療を受けた。主要評価項目は委員会判定によるRECIST 1.1準拠の奏効割合とした。副次評価項目は、奏効持続期間と安全性とした。今回報告する内容は、2019年12月16日のデータカットオフ時点における、初期評価対象患者のうちの東アジア患者集団に関するデータである。
結果:
40人の東アジア人初期評価対象患者を解析した。60%が女性、年齢中央値は56歳(範囲は35-80歳)、95%の患者はECOG-PS 0-1だった。RET融合遺伝子のパートナーはKIF5Bが57.5%、CCDC6が15.0%、NCOA4が2.5%、その他が25%だった。全ての患者に前治療歴があり、プラチナ併用化学療法は100%、マルチキナーゼ阻害薬は52.5%、抗PD-1 / PD-L1抗体は57.5%だった。前治療のレジメン数中央値は3.0(範囲は1-15)だった。主要評価項目である奏効割合は60.0%(95%信頼区間は43.3-75.1%、n=24/40)だった。奏効持続期間中央値は、追跡期間中央値12ヶ月の段階で未到達だった。東アジア人患者集団全体(n=136)におけるselpercatinibの安全性解析では、患者の15%以上で観察された治療関連有害事象としてALT / AST高値、口渇、高血圧、下痢、血清クレアチニン値上昇、心電図におけるQT延長、血小板減少、末梢性浮腫、発疹が見られた。治療関連有害事象のためselpercatinibを中止した患者は、東アジア人集団136人のうち2人(1.5%)のみだった。
結論:
今回対象となった濃厚な前治療歴を有するRET融合遺伝子陽性非小細胞肺がんの東アジア人患者において、selpercatinibによる治療は顕著かつ持続的な効果を示し、忍容性も良好であることが示され、LIBRETTO-001試験に関する既報と合致していた。新規の毒性所見は認めなかった。
全体集団の解析結果と比べて、腫瘍縮小効果はほぼ同等、有害事象とそれに基づく治療中断は軽微、という有望な結果だった。
全体集団の解析結果は以下を参照。
http://oitahaiganpractice.junglekouen.com/e982216.html
FP14.10 - Efficacy and Safety of Selpercatinib (LOXO-292) in East Asian Patients with RET Fusion-Positive NSCLC
Herbert H Loong et al., WCLC 2020 #FP14.10
背景:
selpercatinibは高い選択性と潜在活性を持つ、中枢神経系病変にも有効な、経口RET阻害薬である。今回は、LIBRETTO-001試験の初期評価対象患者のうち、東アジア人患者集団に関する有効性と安全性について検討した。規制当局の同意のもと、初期評価対象患者は臨床試験開始初期に登録されたプラチナ併用化学療法既治療患者連続105人と定義された。
方法:
RET融合遺伝子陽性非小細胞肺がん患者が国際多施設共同第I / II相LIBRETTO-001試験に登録された。総計16か国からの89施設が参加したが、初期評価対象患者のうち自己申告に基づくアジア人患者は7か国23施設から登録されていた(日本:12人、韓国:11人、シンガポール:5人、香港:5人、米国:5人、オーストラリア:1人、フランス:1人)。用量漸増試験である第I相部分に引き続き、対象患者は第II相部分での推奨用量(160mg経口投与を1日2回、28日を1サイクルとして服用)で治療を受けた。主要評価項目は委員会判定によるRECIST 1.1準拠の奏効割合とした。副次評価項目は、奏効持続期間と安全性とした。今回報告する内容は、2019年12月16日のデータカットオフ時点における、初期評価対象患者のうちの東アジア患者集団に関するデータである。
結果:
40人の東アジア人初期評価対象患者を解析した。60%が女性、年齢中央値は56歳(範囲は35-80歳)、95%の患者はECOG-PS 0-1だった。RET融合遺伝子のパートナーはKIF5Bが57.5%、CCDC6が15.0%、NCOA4が2.5%、その他が25%だった。全ての患者に前治療歴があり、プラチナ併用化学療法は100%、マルチキナーゼ阻害薬は52.5%、抗PD-1 / PD-L1抗体は57.5%だった。前治療のレジメン数中央値は3.0(範囲は1-15)だった。主要評価項目である奏効割合は60.0%(95%信頼区間は43.3-75.1%、n=24/40)だった。奏効持続期間中央値は、追跡期間中央値12ヶ月の段階で未到達だった。東アジア人患者集団全体(n=136)におけるselpercatinibの安全性解析では、患者の15%以上で観察された治療関連有害事象としてALT / AST高値、口渇、高血圧、下痢、血清クレアチニン値上昇、心電図におけるQT延長、血小板減少、末梢性浮腫、発疹が見られた。治療関連有害事象のためselpercatinibを中止した患者は、東アジア人集団136人のうち2人(1.5%)のみだった。
結論:
今回対象となった濃厚な前治療歴を有するRET融合遺伝子陽性非小細胞肺がんの東アジア人患者において、selpercatinibによる治療は顕著かつ持続的な効果を示し、忍容性も良好であることが示され、LIBRETTO-001試験に関する既報と合致していた。新規の毒性所見は認めなかった。
2021年02月01日
Grade 3の発熱性好中球減少症とGrade 4の好中球減少症
以前からずっと気になっていることがある。
末梢血好中球数が500/μL未満になり、発熱もしているとき、どのように評価するべきなのか。
Grade 3の発熱性好中球減少症と記載すべきか。
Grade 4の好中球減少症と記載すべきか。
あるいは、好中球減少症としてGrade 4相当として、「生命を脅かす/緊急処置を要する」Grade 4の発熱性好中球減少症と記載すべきか。
生命を脅かす/緊急処置を要する、とまでは言わないけれど、好中球数は500μL未満の発熱性好中球減少症にはしばしば遭遇する。
発熱性好中球減少症で、末梢血好中球数が500/μL未満なら、Grade 4と規定してくれるとシンプルなんだけど。

末梢血好中球数が500/μL未満になり、発熱もしているとき、どのように評価するべきなのか。
Grade 3の発熱性好中球減少症と記載すべきか。
Grade 4の好中球減少症と記載すべきか。
あるいは、好中球減少症としてGrade 4相当として、「生命を脅かす/緊急処置を要する」Grade 4の発熱性好中球減少症と記載すべきか。
生命を脅かす/緊急処置を要する、とまでは言わないけれど、好中球数は500μL未満の発熱性好中球減少症にはしばしば遭遇する。
発熱性好中球減少症で、末梢血好中球数が500/μL未満なら、Grade 4と規定してくれるとシンプルなんだけど。

2021年01月26日
ニボルマブ+イピリムマブ±プラチナ併用化学療法 オンライン講演会
2021年01月22日、標記のテーマでオンライン講演会があった。
幸い開始時刻に間に合うように帰宅できたので、夕食は後回しにして自宅から視聴した。
とても勉強になったので、少しだけ復習した。
・免疫チェックポイント阻害薬に関わる代表的な有害事象とその症状
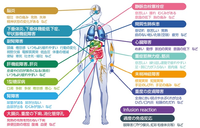
こうしてみると、症状として注意すべきチェック項目が無数にあることがよくわかる。
・肝機能障害時の対策
肝機能障害は、起こり方によっては厄介な病態である。
私は、最初にウルソを投与してお茶を濁すが、ひどくなると結構な高用量のステロイドが必要になることもある。

・皮膚障害時の対策
皮膚トラブルは比較的よく遭遇する有害事象で、なんとなくステロイド外用薬で凌ぐことが多かった。
重症度に応じて、ある程度やるべきことは決められている。

幸い開始時刻に間に合うように帰宅できたので、夕食は後回しにして自宅から視聴した。
とても勉強になったので、少しだけ復習した。
・免疫チェックポイント阻害薬に関わる代表的な有害事象とその症状

こうしてみると、症状として注意すべきチェック項目が無数にあることがよくわかる。
・肝機能障害時の対策
肝機能障害は、起こり方によっては厄介な病態である。
私は、最初にウルソを投与してお茶を濁すが、ひどくなると結構な高用量のステロイドが必要になることもある。

・皮膚障害時の対策
皮膚トラブルは比較的よく遭遇する有害事象で、なんとなくステロイド外用薬で凌ぐことが多かった。
重症度に応じて、ある程度やるべきことは決められている。

2021年01月06日
アムルビシンと心毒性
正直言って、油断していた。
再燃後の小細胞肺がんに対して、二次治療としてアムルビシン単剤療法をしていた患者。
④コース終了後の効果は病勢安定の範囲内、骨髄抑制はそれなりに出たがどうにかマネジメント可能で、いけるところまで継続しようと考えていた。
⑤コース目に入る直前の診察で患者から、
「最近、ちょっと歩いたり話したりするだけでも息切れを感じることが多くなった」
という訴えがあった。
右肺中葉がほぼ無気肺に陥っていたのでそのせいかと高を括っていたのだが、すこし違和感を感じる。
息切れの症状は確かにあり、会話時の言葉はとぎれとぎれだが、それにしては酸素飽和度がよく、90%台後半を維持している。
それよりも気になるのは、脈拍。
安静時は正常範囲内だが、ちょっと歩いただけで一気に120-130/分まで脈拍が増える。
心電図を調べたところ、もともとは正常所見だったのに、I誘導、V2-6誘導でST-T波の陰転化を認めた。
心エコーでは、左室駆出率は50%未満まで低下、左室収縮は全般にやや低下していた。
虚血性心疾患(狭心症、心筋梗塞)を思わせるような臨床所見は指摘しがたく、アムルビシンによる心筋障害と断定し、アムルビシン投与は見合わせた。
改めて添付文書を見直してみると、アムルビシンによる心毒性の頻度は結構高い。
https://www.kegg.jp/medicus-bin/japic_med?japic_code=00049228
心電図以上の出現率は5%以上、心機能低下や心不全症状出現も0.5-5%程度と無視できない。
添付文書よりも詳しいインタビューフォームも参照してみた。
http://image.packageinsert.jp/pdf.php?mode=1&yjcode=4235406D1020
臨床試験のデータからも、3-4%程度は心不全症状を伴う心毒性が出ると見て良さそうだ。
通常の診察では見つけきれなかった。
患者の訴えと、習慣になっている入院時心電図検査に救われた。
できる限り心機能の是正を図り、三次治療につなげたい。
再燃後の小細胞肺がんに対して、二次治療としてアムルビシン単剤療法をしていた患者。
④コース終了後の効果は病勢安定の範囲内、骨髄抑制はそれなりに出たがどうにかマネジメント可能で、いけるところまで継続しようと考えていた。
⑤コース目に入る直前の診察で患者から、
「最近、ちょっと歩いたり話したりするだけでも息切れを感じることが多くなった」
という訴えがあった。
右肺中葉がほぼ無気肺に陥っていたのでそのせいかと高を括っていたのだが、すこし違和感を感じる。
息切れの症状は確かにあり、会話時の言葉はとぎれとぎれだが、それにしては酸素飽和度がよく、90%台後半を維持している。
それよりも気になるのは、脈拍。
安静時は正常範囲内だが、ちょっと歩いただけで一気に120-130/分まで脈拍が増える。
心電図を調べたところ、もともとは正常所見だったのに、I誘導、V2-6誘導でST-T波の陰転化を認めた。
心エコーでは、左室駆出率は50%未満まで低下、左室収縮は全般にやや低下していた。
虚血性心疾患(狭心症、心筋梗塞)を思わせるような臨床所見は指摘しがたく、アムルビシンによる心筋障害と断定し、アムルビシン投与は見合わせた。
改めて添付文書を見直してみると、アムルビシンによる心毒性の頻度は結構高い。
https://www.kegg.jp/medicus-bin/japic_med?japic_code=00049228
心電図以上の出現率は5%以上、心機能低下や心不全症状出現も0.5-5%程度と無視できない。
添付文書よりも詳しいインタビューフォームも参照してみた。
http://image.packageinsert.jp/pdf.php?mode=1&yjcode=4235406D1020
臨床試験のデータからも、3-4%程度は心不全症状を伴う心毒性が出ると見て良さそうだ。
通常の診察では見つけきれなかった。
患者の訴えと、習慣になっている入院時心電図検査に救われた。
できる限り心機能の是正を図り、三次治療につなげたい。
2020年12月06日
ニボルマブ+イピリムマブ±プラチナ併用化学療法 適応追加
2020/11/27はいろいろな薬事承認が成された日だった様子。
非小細胞肺がん治療の領域にも、「免疫チェックポイント阻害薬2剤併用」という新たな地平が開かれた。
また、抗CTLA-4抗体が非小細胞肺がん領域で薬事承認されたという意味でも新しい。
CheckMate277試験とCheckMate9LA試験の結果を根拠として、ニボルマブ+イピリムマブ±化学療法が未治療進行非小細胞肺がんに適用可能となった。
CheckMate-277試験とCheckMate9LA試験については過去にも触れているので、以下のリンクを参照のこと。
http://oitahaiganpractice.junglekouen.com/e968110.html
http://oitahaiganpractice.junglekouen.com/e976407.html
効果・安全性の両面から、イピリムマブを実地臨床で追加すべきかどうかは判断が難しい。
製薬メーカーのパンフレットを用いて見ておきたい。
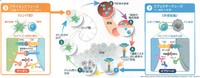
こちらは、「腫瘍免疫サイクル」としてよく知られた図表である。
① がん細胞に特徴的ながん特異抗原が放出される
② がん特異抗原が抗原提示細胞に捕捉される
③ リンパ節において、抗原提示細胞ががん特異抗原の情報をT細胞に受け渡す。
このとき、抗原提示細胞上のB7タンパクとT細胞上のCD28タンパクがくっつくと、T細胞の働きが活性化される。
一方で、抗原提示細胞上のB7タンパクとT細胞上のCTLA-4タンパクがくっつくと、T細胞の働きが抑制される。
④ がん特異抗原を認識できるようになったT細胞が、リンパ節から血管内へと移動する。
⑤ がん病巣を発見したT細胞は、血管からがん病巣への沁みだす。
⑥ T細胞ががん細胞を発見し、がん細胞表面にあるがん特異抗原・MHCタンパク複合体を、T細胞受容体を介して認識する。
このとき、T細胞表面にあるPD-1タンパクとがん細胞表面にあるPD-L1タンパクがくっつくと、T細胞の働きが抑制される
⑦ T細胞ががん細胞を攻撃する
③の過程で、CTLA-4にくっついてB7とCTLA-4がくっつけないようにし、T細胞を活性化する薬がイピリムマブ(ヤーボイ®)。
⑥の過程で、PD-1にくっついてPD-1とPD-L1がくっつけないようにし、T細胞を活性化する薬がニボルマブ(オプジーボ®)。

ニボルマブは、治療スケジュールが複数あり、それに応じて治療必要量も変わる。
具体的にいえば、2週間ごとに240mg、あるいは3週間ごとに360mgの投与量。
1コース3週間のリズムに慣れている医療従事者にとっては、3週間ごとに360mgの方が馴染みやすいだろう。
イピリムマブは単独では使用できず、ニボルマブとの併用が前提となっており、6週間ごとに反復投与する。

投与スケジュールと投与量を図示するとこのようになる。
オプジーボは2週間ごとなら2週間ごと、3週間ごとなら3週間ごとと原則を決めてどの患者にも適用した方が、間違いがないだろう。

CheckMate-227試験の概要。
何度見てもわかりにくい。
敢えてまとめるなら、全体集団ではイピリムマブ+ニボルマブ併用療法(NI群)とプラチナ併用化学療法(C群)の2群比較をベースに、PD-L1≧1%の患者集団ではニボルマブ単剤療法(N群)を、PD-L1<1%の患者ではニボルマブ+プラチナ併用化学療法(NC群)をさらに治療集団として加えている。

CheckMate-227試験におけるPD-L1≧1%の患者集団でのNI群とC群の生存期間比較。
なぜかこの図表にはN群に関する生存曲線の記述がない。
NI群とN群の間に有意差がついていない(参照:http://img01.junglekouen.com/usr/o/i/t/oitahaiganpractice/CheckMate229sOS.jpg)ので、NI群とC群の差に目を向けさせるため、恣意的にパンフレットの図表からは除かれているのではないだろうか。
最初の6か月間だけで見るならば、C群の方がよい。
それ以降で見るならば、NI群の方がよい。
最終的には統計学的有意にNI群の方がよかった。

CheckMate-227試験におけるPD-L1<1%の患者集団でのNI群、NC群、C群の生存期間比較。
まず、生存曲線の末尾の方を見る限り、NI群が圧倒的に優れているように見える。
PD-L1発現の有無にかかわらず、3年経過以降は長期生存が期待できるというのはNI群の大きなメリットではないだろうか。
試験デザイン上、ここに上がっている治療群間には統計学的な有意差はついていないのだが、そんなことよりはこの生存曲線の語る事実を素直に受け止めるべきだろう。

CheckMate-227試験における無増悪生存期間比較。
はっきり言えることは、化学療法が入っていなければ、最初の6か月間の成績が悪いということである。
治療内容に化学療法を含んでいないNI療法は、再現性を以て最初の6か月間の治療成績が劣っている。

奏効割合のデータからは、一定の傾向を見出すのは難しい。
PD-L1<1%だったら、C群よりNC群の方が腫瘍縮小効果が高い、ということくらいしか言えない。

毒性については、皮膚・内分泌系の重篤な毒性がNI群で目立つ。

NI群においては、胃腸・肝・肺毒性が、治療中止に至る毒性として多いようである。

今度はCheckMate-9LA試験。
解析計画の記述は長すぎて読む気にならないが、試験デザインはシンプルで好感が持てる。
初期治療効果の劣るNI群の弱点を補うために、試験治療群(NI-Chemo群)では治療初期の1ヶ月半から2ヶ月の間は化学療法を併用する。
対照群はシンプルに標準化学療法(Chemo群)である。
したがって、本試験ではChemo群に対してNI-Chemo群が優れているかどうかだけが明らかになる。
NI群に対してNI-Chemo群が優れるかどうかとか、PD-L1≧50%の患者集団で、抗PD-1抗体単剤療法に対してNI-Chemo群が優れるかどうかとかはわからない。

CheckMate-9LA試験における全患者集団の生存曲線。
追跡期間が短くてこれからどうなるのかまだわからないが、少なくとも統計学的有意差はついたとのこと。
少なくとも、NI-Chemo群において、治療初期に化学療法を併用した効果は出ているようで、治療開始初期からNI-Chemo群の生存曲線が上を行っている。
CheckMate-227試験におけるNI群の生存曲線とは様相が異なる。
一方で、2本の生存曲線が末広がりでなく先すぼまりになっているのは、今後どのように展開するのか気になるところである。
長期経過を追ったら成績が変わらなくなった、とか、逆転した、となれば、異なる解釈が必要になる。

CheckMate-9LA試験における、PD-L1≧50%の患者集団の生存曲線。
基本的な傾向は、全患者集団のそれと変わらない。

CheckMate-9LA試験における、PD-L1=0-49%の患者集団の生存曲線。
これも基本的な傾向は変わらない。

CheckMate-9LA試験における、PD-L1≧1%の患者集団の生存曲線。
これも変わらず。

CheckMate-9LA試験における、PD-L1<1%の患者集団の生存曲線。
これまた変わらず。
結局、PD-L1発現状態によらず、同じような傾向に落ち着く様子。
イピリムマブを併用することによって、PD-L1発現状態が効果予測因子となるニボルマブの特性が弱められるのかもしれない。

CheckMate-9LA試験における、無増悪生存曲線。
治療初期は似たり寄ったり。
治療開始から4-17ヶ月あたりは、NI-Chemo群の方が良さそう。
それ以降はまた似たり寄ったり。

CheckMate-9LA試験における奏効割合。
これは有意差を以てNI-Chemo群の方が優れる。

CheckMate-9LA試験における有害事象。
皮膚・内分泌・肝胆道系のGrade 3以上の有害事象がNI-Chemo群で気になる。

CheckMate-9LA試験における有害事象。
治療中止に至る有害事象として診るならば、皮膚や内分泌はそれほど大きな問題ではなく、胃腸・肝・肺・腎・過敏症症状が治療中止に至る有害事象として無視できないようだ。
ここからは私の妄想。
CheckMate-227試験におけるNI群の生存期間中央値は概ね17ヶ月、対するCheckMate-9LA試験におけるNI-Chemo群の生存期間中央値は概ね14ヶ月で、3ヶ月の開きがある。
14ヶ月と言えば、CheckMate-227試験におけるC群の成績に近い。
異なる臨床試験の結果だから直接比較は難しい、とはいいながら、両臨床試験のシェーマを見る限り、患者背景はほぼ同じ、CheckMate-227試験におけるC群とCheckMate-9LA試験におけるChemo群の治療内容もほぼ同じである。
CheckMate-9LA試験結果から、化学療法単独に対するニボルマブ+イピリムマブの効果が4ヶ月の生存期間上乗せと見積もると、もしCheckMate-227試験でNI-Chemo群を走らせていたら、C群の生存期間14ヶ月に4ヶ月を上乗せして、多分生存期間中央値は18ヶ月くらいで落ち着いたのではないだろうか。
非小細胞肺がん治療の領域にも、「免疫チェックポイント阻害薬2剤併用」という新たな地平が開かれた。
また、抗CTLA-4抗体が非小細胞肺がん領域で薬事承認されたという意味でも新しい。
CheckMate277試験とCheckMate9LA試験の結果を根拠として、ニボルマブ+イピリムマブ±化学療法が未治療進行非小細胞肺がんに適用可能となった。
CheckMate-277試験とCheckMate9LA試験については過去にも触れているので、以下のリンクを参照のこと。
http://oitahaiganpractice.junglekouen.com/e968110.html
http://oitahaiganpractice.junglekouen.com/e976407.html
効果・安全性の両面から、イピリムマブを実地臨床で追加すべきかどうかは判断が難しい。
製薬メーカーのパンフレットを用いて見ておきたい。

こちらは、「腫瘍免疫サイクル」としてよく知られた図表である。
① がん細胞に特徴的ながん特異抗原が放出される
② がん特異抗原が抗原提示細胞に捕捉される
③ リンパ節において、抗原提示細胞ががん特異抗原の情報をT細胞に受け渡す。
このとき、抗原提示細胞上のB7タンパクとT細胞上のCD28タンパクがくっつくと、T細胞の働きが活性化される。
一方で、抗原提示細胞上のB7タンパクとT細胞上のCTLA-4タンパクがくっつくと、T細胞の働きが抑制される。
④ がん特異抗原を認識できるようになったT細胞が、リンパ節から血管内へと移動する。
⑤ がん病巣を発見したT細胞は、血管からがん病巣への沁みだす。
⑥ T細胞ががん細胞を発見し、がん細胞表面にあるがん特異抗原・MHCタンパク複合体を、T細胞受容体を介して認識する。
このとき、T細胞表面にあるPD-1タンパクとがん細胞表面にあるPD-L1タンパクがくっつくと、T細胞の働きが抑制される
⑦ T細胞ががん細胞を攻撃する
③の過程で、CTLA-4にくっついてB7とCTLA-4がくっつけないようにし、T細胞を活性化する薬がイピリムマブ(ヤーボイ®)。
⑥の過程で、PD-1にくっついてPD-1とPD-L1がくっつけないようにし、T細胞を活性化する薬がニボルマブ(オプジーボ®)。

ニボルマブは、治療スケジュールが複数あり、それに応じて治療必要量も変わる。
具体的にいえば、2週間ごとに240mg、あるいは3週間ごとに360mgの投与量。
1コース3週間のリズムに慣れている医療従事者にとっては、3週間ごとに360mgの方が馴染みやすいだろう。
イピリムマブは単独では使用できず、ニボルマブとの併用が前提となっており、6週間ごとに反復投与する。

投与スケジュールと投与量を図示するとこのようになる。
オプジーボは2週間ごとなら2週間ごと、3週間ごとなら3週間ごとと原則を決めてどの患者にも適用した方が、間違いがないだろう。

CheckMate-227試験の概要。
何度見てもわかりにくい。
敢えてまとめるなら、全体集団ではイピリムマブ+ニボルマブ併用療法(NI群)とプラチナ併用化学療法(C群)の2群比較をベースに、PD-L1≧1%の患者集団ではニボルマブ単剤療法(N群)を、PD-L1<1%の患者ではニボルマブ+プラチナ併用化学療法(NC群)をさらに治療集団として加えている。

CheckMate-227試験におけるPD-L1≧1%の患者集団でのNI群とC群の生存期間比較。
なぜかこの図表にはN群に関する生存曲線の記述がない。
NI群とN群の間に有意差がついていない(参照:http://img01.junglekouen.com/usr/o/i/t/oitahaiganpractice/CheckMate229sOS.jpg)ので、NI群とC群の差に目を向けさせるため、恣意的にパンフレットの図表からは除かれているのではないだろうか。
最初の6か月間だけで見るならば、C群の方がよい。
それ以降で見るならば、NI群の方がよい。
最終的には統計学的有意にNI群の方がよかった。

CheckMate-227試験におけるPD-L1<1%の患者集団でのNI群、NC群、C群の生存期間比較。
まず、生存曲線の末尾の方を見る限り、NI群が圧倒的に優れているように見える。
PD-L1発現の有無にかかわらず、3年経過以降は長期生存が期待できるというのはNI群の大きなメリットではないだろうか。
試験デザイン上、ここに上がっている治療群間には統計学的な有意差はついていないのだが、そんなことよりはこの生存曲線の語る事実を素直に受け止めるべきだろう。

CheckMate-227試験における無増悪生存期間比較。
はっきり言えることは、化学療法が入っていなければ、最初の6か月間の成績が悪いということである。
治療内容に化学療法を含んでいないNI療法は、再現性を以て最初の6か月間の治療成績が劣っている。

奏効割合のデータからは、一定の傾向を見出すのは難しい。
PD-L1<1%だったら、C群よりNC群の方が腫瘍縮小効果が高い、ということくらいしか言えない。

毒性については、皮膚・内分泌系の重篤な毒性がNI群で目立つ。

NI群においては、胃腸・肝・肺毒性が、治療中止に至る毒性として多いようである。

今度はCheckMate-9LA試験。
解析計画の記述は長すぎて読む気にならないが、試験デザインはシンプルで好感が持てる。
初期治療効果の劣るNI群の弱点を補うために、試験治療群(NI-Chemo群)では治療初期の1ヶ月半から2ヶ月の間は化学療法を併用する。
対照群はシンプルに標準化学療法(Chemo群)である。
したがって、本試験ではChemo群に対してNI-Chemo群が優れているかどうかだけが明らかになる。
NI群に対してNI-Chemo群が優れるかどうかとか、PD-L1≧50%の患者集団で、抗PD-1抗体単剤療法に対してNI-Chemo群が優れるかどうかとかはわからない。

CheckMate-9LA試験における全患者集団の生存曲線。
追跡期間が短くてこれからどうなるのかまだわからないが、少なくとも統計学的有意差はついたとのこと。
少なくとも、NI-Chemo群において、治療初期に化学療法を併用した効果は出ているようで、治療開始初期からNI-Chemo群の生存曲線が上を行っている。
CheckMate-227試験におけるNI群の生存曲線とは様相が異なる。
一方で、2本の生存曲線が末広がりでなく先すぼまりになっているのは、今後どのように展開するのか気になるところである。
長期経過を追ったら成績が変わらなくなった、とか、逆転した、となれば、異なる解釈が必要になる。

CheckMate-9LA試験における、PD-L1≧50%の患者集団の生存曲線。
基本的な傾向は、全患者集団のそれと変わらない。

CheckMate-9LA試験における、PD-L1=0-49%の患者集団の生存曲線。
これも基本的な傾向は変わらない。

CheckMate-9LA試験における、PD-L1≧1%の患者集団の生存曲線。
これも変わらず。

CheckMate-9LA試験における、PD-L1<1%の患者集団の生存曲線。
これまた変わらず。
結局、PD-L1発現状態によらず、同じような傾向に落ち着く様子。
イピリムマブを併用することによって、PD-L1発現状態が効果予測因子となるニボルマブの特性が弱められるのかもしれない。

CheckMate-9LA試験における、無増悪生存曲線。
治療初期は似たり寄ったり。
治療開始から4-17ヶ月あたりは、NI-Chemo群の方が良さそう。
それ以降はまた似たり寄ったり。

CheckMate-9LA試験における奏効割合。
これは有意差を以てNI-Chemo群の方が優れる。

CheckMate-9LA試験における有害事象。
皮膚・内分泌・肝胆道系のGrade 3以上の有害事象がNI-Chemo群で気になる。

CheckMate-9LA試験における有害事象。
治療中止に至る有害事象として診るならば、皮膚や内分泌はそれほど大きな問題ではなく、胃腸・肝・肺・腎・過敏症症状が治療中止に至る有害事象として無視できないようだ。
ここからは私の妄想。
CheckMate-227試験におけるNI群の生存期間中央値は概ね17ヶ月、対するCheckMate-9LA試験におけるNI-Chemo群の生存期間中央値は概ね14ヶ月で、3ヶ月の開きがある。
14ヶ月と言えば、CheckMate-227試験におけるC群の成績に近い。
異なる臨床試験の結果だから直接比較は難しい、とはいいながら、両臨床試験のシェーマを見る限り、患者背景はほぼ同じ、CheckMate-227試験におけるC群とCheckMate-9LA試験におけるChemo群の治療内容もほぼ同じである。
CheckMate-9LA試験結果から、化学療法単独に対するニボルマブ+イピリムマブの効果が4ヶ月の生存期間上乗せと見積もると、もしCheckMate-227試験でNI-Chemo群を走らせていたら、C群の生存期間14ヶ月に4ヶ月を上乗せして、多分生存期間中央値は18ヶ月くらいで落ち着いたのではないだろうか。
2020年11月29日
METエクソン14スキップ変異陽性アジア人非小細胞肺がん患者に対するテポチニブの効果
METエクソン14スキップ変異陽性アジア人非小細胞肺がん患者に対するテポチニブの効果。
患者背景を説明する修飾語は、年々長くなる一方だ。
テポチニブが薬事承認されてすでに半年以上経過するが、まだこの遺伝子変異が見いだされ、テポチニブを使用している患者を見たことはない。
METエクソン14スキップ変異の認知と検査実施が、足元ではあまり進んでいないように思われる。
383MO - Tepotinib in Asian patients (pts) with advanced NSCLC with MET exon 14 (METex14) skipping
James Chih-Hsin Yang et al., ESMO Asia 2020
背景:
METエクソン14スキップ変異を有する進行非小細胞肺がんに対して持続的な効果を示した、1日1回服用で高い選択性と潜在能力wo
有するMET阻害薬であるテポチニブは、日本で薬事承認(2020/03/25)された。
→https://www.merckgroup.com/jp-ja/press/mbj/2020/200325_News_Release_Tepotinib-Japan-Approval_JP.pdf
第II相VISION試験では、奏効割合は独立効果判定委員会評価で44.5-47.4%、担当医評価では54.7-58.3%だった。ほとんどの患者で、腫瘍縮小効果は治療開始から6週間以内に観察された。今回は、アジア人患者集団における治療効果について報告する。
方法:
組織生検もしくはリキッドバイオプシーでEGFR遺伝子変異陰性、ALK融合遺伝子陰性、METエクソン14スキップ変異陽性と診断された進行非小細胞肺がん患者を対象とし、テポチニブ500mgを経口投与した。病勢進行、忍容不能の毒性、本人意思による治療の中止のいずれかに至るまでは治療を継続した。主要評価項目は独立効果判定委員会評価による奏効割合(初回の奏効確認から4週間以上空けて再度奏効が確認された場合を奏効確定例とする)とした。副次評価項目は担当医評価による奏効割合、奏効持続期間、無増悪生存期間、安全性とした。Pts evaluable for ORR had ≥2 post-baseline assessments or discontinuation for any reason.
結果:
2020年1月1日のデータカットオフ時点で、効果判定可能だったアジア人患者は38人だった。年齢中央値は70歳(52-85歳)、32%が女性で、39%が非喫煙者、32%は過去に治療歴がない患者だった。国別の内訳は、日本が50%、韓国が26%、台湾が13%、スペインが3%、米国が8%だった。アジア人患者に対するテポチニブの有効性は全体集団と同様で、独立効果判定員会評価による奏効割合は47.4%(95%信頼区間は31.0-64.2%)だった。担当医評価による奏効割合は60.5%(95%信頼区間は43.4%-76.0%)だった。独立効果判定員会評価による奏効持続期間は未到達、担当医評価による奏効持続期間は10.9ヶ月(95%信頼区間は9.7ヶ月-未到達)だった。病勢コントロール割合(完全奏効、部分奏効もしくは病勢安定の状態が12週間以上持続した患者の割合)は独立効果判定員会評価で68.4%(95%信頼区間は51.3-82.5%)、担当医評価で81.6%(95%信頼区間は65.7-92.3%)だった。いまだデータは不十分だが、無増悪生存期間中央値は11.0ヶ月(95%信頼区間は4.9ヶ月-未到達)だった。まだ効果判定時期に至っていない患者も含めると、全体で50人のアジア人が少なくとも1回のテポチニブ内服投与を受けていた。主な有害事象は末梢浮腫、血清クレアチニン上昇、下痢だった。Grade 3以上の治療関連有害事象は患者の26%に認められた。治療関連有害事象のうち、投与量減量が必要だったのは28%、一時的な治療中断が必要だったのは36%、治療中止に至ったのは10%だった。
結論:
テポチニブはMETエクソン14スキップ変異陽性のアジア人非小細胞がん患者に対して、確たる持続的な臨床効果を示した。有害事象はおしなべてマイルドかつ管理可能で、治療中止に至る割合はわずかだった。VISION試験は最終的に、アジア人を55人組み入れる予定となっている。
患者背景を説明する修飾語は、年々長くなる一方だ。
テポチニブが薬事承認されてすでに半年以上経過するが、まだこの遺伝子変異が見いだされ、テポチニブを使用している患者を見たことはない。
METエクソン14スキップ変異の認知と検査実施が、足元ではあまり進んでいないように思われる。
383MO - Tepotinib in Asian patients (pts) with advanced NSCLC with MET exon 14 (METex14) skipping
James Chih-Hsin Yang et al., ESMO Asia 2020
背景:
METエクソン14スキップ変異を有する進行非小細胞肺がんに対して持続的な効果を示した、1日1回服用で高い選択性と潜在能力wo
有するMET阻害薬であるテポチニブは、日本で薬事承認(2020/03/25)された。
→https://www.merckgroup.com/jp-ja/press/mbj/2020/200325_News_Release_Tepotinib-Japan-Approval_JP.pdf
第II相VISION試験では、奏効割合は独立効果判定委員会評価で44.5-47.4%、担当医評価では54.7-58.3%だった。ほとんどの患者で、腫瘍縮小効果は治療開始から6週間以内に観察された。今回は、アジア人患者集団における治療効果について報告する。
方法:
組織生検もしくはリキッドバイオプシーでEGFR遺伝子変異陰性、ALK融合遺伝子陰性、METエクソン14スキップ変異陽性と診断された進行非小細胞肺がん患者を対象とし、テポチニブ500mgを経口投与した。病勢進行、忍容不能の毒性、本人意思による治療の中止のいずれかに至るまでは治療を継続した。主要評価項目は独立効果判定委員会評価による奏効割合(初回の奏効確認から4週間以上空けて再度奏効が確認された場合を奏効確定例とする)とした。副次評価項目は担当医評価による奏効割合、奏効持続期間、無増悪生存期間、安全性とした。Pts evaluable for ORR had ≥2 post-baseline assessments or discontinuation for any reason.
結果:
2020年1月1日のデータカットオフ時点で、効果判定可能だったアジア人患者は38人だった。年齢中央値は70歳(52-85歳)、32%が女性で、39%が非喫煙者、32%は過去に治療歴がない患者だった。国別の内訳は、日本が50%、韓国が26%、台湾が13%、スペインが3%、米国が8%だった。アジア人患者に対するテポチニブの有効性は全体集団と同様で、独立効果判定員会評価による奏効割合は47.4%(95%信頼区間は31.0-64.2%)だった。担当医評価による奏効割合は60.5%(95%信頼区間は43.4%-76.0%)だった。独立効果判定員会評価による奏効持続期間は未到達、担当医評価による奏効持続期間は10.9ヶ月(95%信頼区間は9.7ヶ月-未到達)だった。病勢コントロール割合(完全奏効、部分奏効もしくは病勢安定の状態が12週間以上持続した患者の割合)は独立効果判定員会評価で68.4%(95%信頼区間は51.3-82.5%)、担当医評価で81.6%(95%信頼区間は65.7-92.3%)だった。いまだデータは不十分だが、無増悪生存期間中央値は11.0ヶ月(95%信頼区間は4.9ヶ月-未到達)だった。まだ効果判定時期に至っていない患者も含めると、全体で50人のアジア人が少なくとも1回のテポチニブ内服投与を受けていた。主な有害事象は末梢浮腫、血清クレアチニン上昇、下痢だった。Grade 3以上の治療関連有害事象は患者の26%に認められた。治療関連有害事象のうち、投与量減量が必要だったのは28%、一時的な治療中断が必要だったのは36%、治療中止に至ったのは10%だった。
結論:
テポチニブはMETエクソン14スキップ変異陽性のアジア人非小細胞がん患者に対して、確たる持続的な臨床効果を示した。有害事象はおしなべてマイルドかつ管理可能で、治療中止に至る割合はわずかだった。VISION試験は最終的に、アジア人を55人組み入れる予定となっている。




