2020年12月31日
学会報告0002:IgG4関連肺疾患と合併した肺がん
自己免疫性膵炎との関連で広く知られるようになったIgG4関連疾患群。
私も過去に数人の患者を経験しており、年齢層は60-80代で、今回の症例報告と合致する。
組織型にこれといった傾向はないが、ドライバー遺伝子変異合併例はこれまで経験がない。
<学会報告0002>
出典:2020年、日本呼吸器学会・日本結核非結核性抗酸菌症病学会支部会
70代男性。
IgG4関連肺疾患に対してプレドニゾロンを処方されていた。
経過観察目的で胸部CTを撮影したところ、右肺の腫瘤陰影新出、既存のすりガラス状陰影の拡大、肺門・縦隔リンパ節の腫大を指摘された。
IgG4関連肺疾患の悪化、原発性肺がんの合併が疑われ、精査のため入院した。
入院後に急速な呼吸状態の悪化を来し、治療の甲斐なく入院後約1週間で死亡した。
家族の同意を得て病理解剖を行ったところ、原発性肺腺がん、腫瘍塞栓、多発遠隔転移(両肺、縦隔、肝臓、腹部リンパ節)を認め、がん性リンパ管症や気管支肺炎、肺出血の所見も伴っていた。これら全てによる急性呼吸不全が死因と考えられた。
IgG4関連疾患患者の約10%で肺病変を認めるが、肺がんとの関連性については未だ報告が少ない。
印象:
IgG4関連肺疾患の定期経過観察中とのことなので、一般の人よりは頻繁に肺がん合併の有無をCTでチェックされていたと考えていいだろう。
それでも発見時には既に進行期だったという方は少なくないし、今回の患者のように急速な経過をたどって手も足も出ないということもしばしば経験する。
経過が早いので、何らかのドライバー遺伝子変異が関わっていた可能性はあるかも知れない。
しかし、たとえそうだったとしても、生検をして、病理所見を確認して、その後に発注した遺伝子変異が判明し、治療を開始できるようになるまでには相応の時間(最低でも1-2週間程度)を要するはずで、この患者の運命は変わらなかっただろう。
私も過去に数人の患者を経験しており、年齢層は60-80代で、今回の症例報告と合致する。
組織型にこれといった傾向はないが、ドライバー遺伝子変異合併例はこれまで経験がない。
<学会報告0002>
出典:2020年、日本呼吸器学会・日本結核非結核性抗酸菌症病学会支部会
70代男性。
IgG4関連肺疾患に対してプレドニゾロンを処方されていた。
経過観察目的で胸部CTを撮影したところ、右肺の腫瘤陰影新出、既存のすりガラス状陰影の拡大、肺門・縦隔リンパ節の腫大を指摘された。
IgG4関連肺疾患の悪化、原発性肺がんの合併が疑われ、精査のため入院した。
入院後に急速な呼吸状態の悪化を来し、治療の甲斐なく入院後約1週間で死亡した。
家族の同意を得て病理解剖を行ったところ、原発性肺腺がん、腫瘍塞栓、多発遠隔転移(両肺、縦隔、肝臓、腹部リンパ節)を認め、がん性リンパ管症や気管支肺炎、肺出血の所見も伴っていた。これら全てによる急性呼吸不全が死因と考えられた。
IgG4関連疾患患者の約10%で肺病変を認めるが、肺がんとの関連性については未だ報告が少ない。
印象:
IgG4関連肺疾患の定期経過観察中とのことなので、一般の人よりは頻繁に肺がん合併の有無をCTでチェックされていたと考えていいだろう。
それでも発見時には既に進行期だったという方は少なくないし、今回の患者のように急速な経過をたどって手も足も出ないということもしばしば経験する。
経過が早いので、何らかのドライバー遺伝子変異が関わっていた可能性はあるかも知れない。
しかし、たとえそうだったとしても、生検をして、病理所見を確認して、その後に発注した遺伝子変異が判明し、治療を開始できるようになるまでには相応の時間(最低でも1-2週間程度)を要するはずで、この患者の運命は変わらなかっただろう。
2020年12月30日
学会報告0001:免疫チェックポイント阻害薬を3種類使用し長期生存が得られた術後再発肺腺癌の一例
このところ、「症例報告」の重要性を感じるようになった。
大規模臨床試験の結果は、主要な国際学会や医学雑誌を見ていると手に入るが、一人ひとりの患者がどんな局面でどんな治療選択をし、その結果どんな経過を辿ったかというきめ細かな情報はなかなか手に入れにくい。
ふと思い立って、過去の国内学会の抄録を紐解いて、興味深いものを要約して残すことにした。
一部記載されていない所見は、診療経過を踏まえて推測で追加した。
今回の患者は、術後補助化学療法まで含めると8レジメンものがん薬物療法を経験していて、しかも8レジメン目(免疫チェックポイント阻害薬だけで言えば3レジメン目)がそれなりに効果を示している。
この診療経過は他の患者の励みになり、気付きをもたらしてくれるのではないだろうか。
<学会報告0001>
出典:2020年、日本呼吸器学会総会
60代男性。
左原発性肺腺がんに対して根治的切除術施行。
術後病理所見はpT2aN2M0, stage IIIA。
術後補助化学療法として、シスプラチン+ドセタキセル併用療法を行った。
術後再発を来し、治療を再検討した。
再発病変の生検を行ったところ、PD-L1発現は陰性だった。
EGFRをはじめとして、各種のドライバー遺伝子変異は検索した限りでは陰性。
再発時点での病巣が根治的放射線照射の範囲内にとどまっていたため、再発後の一次治療はシスプラチン+ビノレルビン+同時併用根治的胸部放射線照射療法を行った。
病勢進行を来したため、二次治療としてペメトレキセド単剤療法を行った。
病勢進行を来したため、三次治療としてニボルマブ単剤療法を行った。
ニボルマブ6コース後に病勢進行を来したため、四次治療としてドセタキセル+ベバシズマブ併用療法を行った。
病勢進行を来したため、五次治療としてジェムシタビン単剤療法を行った。
病勢進行を来したため、六次治療としてアテゾリズマブ単剤療法を行った。
いったんは部分奏効に至ったが、8コース後に病勢進行を来した。
腋窩リンパ節再発病巣より再生検を行ったところ、PD-L1発現は100%だった。
七次治療としてペンブロリズマブ単剤療法を行った。
腋窩リンパ節は縮小したものの、学会発表時点での治療効果は病勢安定に留まっていた。
印象:
術前評価時の病期がどの程度だったのかはわからないが、stage IIIAの患者に対して、手術を行うのか、化学放射線療法を行うのかは、外科医と内科医の間でいつも論争になる。化学放射線療法後の維持療法としてデュルバルマブが使用できるようになった現在でも、この構図は変わらない。
術後補助化学療法としてシスプラチン+ドセタキセル併用療法はあまり一般的ではなく、術後病理病期IIIA期なら、シスプラチン+ビノレルビン併用療法が標準だろう。
再発後に敢えて化学放射線療法を選択して治癒を目指すところに、担当医の心意気が感じられる。
興味深いのは、生検のタイミング及び部位によって、PD-L1発現状態が異なることである。
再発直後の検査ではPD-L1陰性、ニボルマブ、アテゾリズマブを投与して病勢進行に至ったのちに敢えてもう一度再生検、PD-L1発現状態の確認を行ったのは、ペンブロリズマブが使用できるかどうかを判断するためだったと考えられる。
手術標本、術後再発発覚時の再生検標本、ペンブロリズマブ使用前の再々生検、それぞれの病理所見とPD-L1発現状態を比べてみたいものだ。
PD-L1発現100%のインパクトは大きい。
経験的にも、PD-L1発現80%以上の患者では、かなり効果が期待できる印象がある。
ペンブロリズマブの長期効果がどうなのかが最も知りたいところだが、少なくとも生検部位は縮小、その他の部位も病勢安定に留められているとのことで、このまま進行を抑えて長期維持、という可能性もあるだろう。
Never give up!
大規模臨床試験の結果は、主要な国際学会や医学雑誌を見ていると手に入るが、一人ひとりの患者がどんな局面でどんな治療選択をし、その結果どんな経過を辿ったかというきめ細かな情報はなかなか手に入れにくい。
ふと思い立って、過去の国内学会の抄録を紐解いて、興味深いものを要約して残すことにした。
一部記載されていない所見は、診療経過を踏まえて推測で追加した。
今回の患者は、術後補助化学療法まで含めると8レジメンものがん薬物療法を経験していて、しかも8レジメン目(免疫チェックポイント阻害薬だけで言えば3レジメン目)がそれなりに効果を示している。
この診療経過は他の患者の励みになり、気付きをもたらしてくれるのではないだろうか。
<学会報告0001>
出典:2020年、日本呼吸器学会総会
60代男性。
左原発性肺腺がんに対して根治的切除術施行。
術後病理所見はpT2aN2M0, stage IIIA。
術後補助化学療法として、シスプラチン+ドセタキセル併用療法を行った。
術後再発を来し、治療を再検討した。
再発病変の生検を行ったところ、PD-L1発現は陰性だった。
EGFRをはじめとして、各種のドライバー遺伝子変異は検索した限りでは陰性。
再発時点での病巣が根治的放射線照射の範囲内にとどまっていたため、再発後の一次治療はシスプラチン+ビノレルビン+同時併用根治的胸部放射線照射療法を行った。
病勢進行を来したため、二次治療としてペメトレキセド単剤療法を行った。
病勢進行を来したため、三次治療としてニボルマブ単剤療法を行った。
ニボルマブ6コース後に病勢進行を来したため、四次治療としてドセタキセル+ベバシズマブ併用療法を行った。
病勢進行を来したため、五次治療としてジェムシタビン単剤療法を行った。
病勢進行を来したため、六次治療としてアテゾリズマブ単剤療法を行った。
いったんは部分奏効に至ったが、8コース後に病勢進行を来した。
腋窩リンパ節再発病巣より再生検を行ったところ、PD-L1発現は100%だった。
七次治療としてペンブロリズマブ単剤療法を行った。
腋窩リンパ節は縮小したものの、学会発表時点での治療効果は病勢安定に留まっていた。
印象:
術前評価時の病期がどの程度だったのかはわからないが、stage IIIAの患者に対して、手術を行うのか、化学放射線療法を行うのかは、外科医と内科医の間でいつも論争になる。化学放射線療法後の維持療法としてデュルバルマブが使用できるようになった現在でも、この構図は変わらない。
術後補助化学療法としてシスプラチン+ドセタキセル併用療法はあまり一般的ではなく、術後病理病期IIIA期なら、シスプラチン+ビノレルビン併用療法が標準だろう。
再発後に敢えて化学放射線療法を選択して治癒を目指すところに、担当医の心意気が感じられる。
興味深いのは、生検のタイミング及び部位によって、PD-L1発現状態が異なることである。
再発直後の検査ではPD-L1陰性、ニボルマブ、アテゾリズマブを投与して病勢進行に至ったのちに敢えてもう一度再生検、PD-L1発現状態の確認を行ったのは、ペンブロリズマブが使用できるかどうかを判断するためだったと考えられる。
手術標本、術後再発発覚時の再生検標本、ペンブロリズマブ使用前の再々生検、それぞれの病理所見とPD-L1発現状態を比べてみたいものだ。
PD-L1発現100%のインパクトは大きい。
経験的にも、PD-L1発現80%以上の患者では、かなり効果が期待できる印象がある。
ペンブロリズマブの長期効果がどうなのかが最も知りたいところだが、少なくとも生検部位は縮小、その他の部位も病勢安定に留められているとのことで、このまま進行を抑えて長期維持、という可能性もあるだろう。
Never give up!
2020年12月18日
胸水貯留と免疫チェックポイント阻害薬
悪性胸水を合併していると、免疫チェックポイントの効果はあまり期待できないという報告。
実感としてそんな感じがする。
治療に対する生理的バリアという概念は納得できる。
中枢神経系への転移だけでなく、悪性胸水や腹水を伴う病状では、それなりの工夫が必要な気がする。
ドライバー遺伝子変異がなく、かつ中枢神経系や悪性胸水・腹水がある患者においては、血管増殖因子阻害薬を積極的に使用してみてはどうだろうか。
ESMO Immuno-Oncology 2020: Does Pleural Effusion Affect Survival in Patients Treated With Immunotherapy for NSCLC?
ASCO post
Pleural effusion is a negative prognostic factor for immunotherapy in non small cell lung cancer (NSCLC): The PLUIE study
Nicolas Epaillard et al., ESMO Immuno-Oncology Virtual Congress 2020 Abst.#42P
胸水貯留を伴う非小細胞肺がん患者、とりわけ胸水ドレナージを要するような患者においては、免疫チェックポイント阻害薬を使用しても予後不良なことがしばしば経験される。EpaillardらはESMO Immuno-Oncology Virtual Congress 2020でそうした趣旨の研究報告を行った。
胸膜は非小細胞肺がん患者における遠隔転移先として頻度の高い部位であり、免疫チェックポイント阻害薬の浸透および効果発現を制限する生理的なバリアーとしても機能する。こうした背景から、今回報告されたPLUIE試験では、免疫チェックポイント阻害薬による治療を受けた胸水貯留合併非小細胞肺がん患者の臨床的アウトカムについて調査された。
本試験は国際的多施設共同後方視的研究である。2012年11月kら2019年11月にかけて、免疫チェックポイント阻害薬による治療を受けた538人の非小細胞肺がん患者を対象とした。免疫チェックポイント阻害薬導入前の段階で、胸水貯留を伴う群(胸水貯留群、196人)と胸水貯留を伴わない群(非胸水貯留群、342人)を同定した。
主要評価項目は、全生存期間と早期死亡割合とし、副次評価項目は無増悪生存期間、病勢コントロール割合とした。これら臨床的アウトカムと胸水貯留の相関はロジスティック回帰モデルで解析し、全生存期間や無増悪生存期間の解析は単変数解析と、コックスモデルを用いた多変数解析で行った。
全体集団の年齢中央値は62.9歳、女性の割合は34.6%、非喫煙者の割合は9.5%、非扁平上皮非小細胞肺がんの割合は75.7%だった。胸水貯留群でも全体と同様の傾向であり、年齢中央値は64.4歳、女性の割合は31.6%、非喫煙者の割合は12.4%、非扁平上皮非小細胞肺がんの割合は77.6%だった。一次治療もしくは二次治療で免疫チェックポイント阻害薬が使用皿た患者の割合は66%、免疫チェックポイント阻害薬を単剤治療として受けた患者の割合は94%だった。
胸水貯留群では、遠隔転移の部位が多い傾向が見られた。すなわち、胸水貯留群での遠隔転移部位数中央値は3.5ヶ所、非胸水貯留群での遠隔転移部位数中央値は2.7ヶ所だった。胸水貯留群ではPS不良の傾向も強く、胸水貯留群の90.8%、非胸水貯留群の80.5%は、PSが2-4だった。
全体集団における生存期間中央値は9.7ヶ月(95%信頼区間は8.1-11.8ヶ月)だった。各群別にみると、胸水貯留群では6.3ヶ月(95%信頼区間は4.0-8.6ヶ月)、非胸水貯留群では11.4ヶ月(95%信頼区間は9.7-13.8ヶ月)で、胸水貯留群で有意に予後不良だった(p=0.002)。早期死亡割合は全体集団で31.4%、胸水貯留群で38.3%、非胸水貯留群で27.5%で、これも胸水貯留群で有意に予後不良だった(オッズ比1.63、95%信頼区間1.13-2.37、p=0.01)。
無増悪生存期間は胸水貯留群で1.8ヶ月(95%信頼区間は1.7-2.5ヶ月)、非胸水貯留群で2.3ヶ月(95%信頼区間は2.0-3.6ヶ月)で、これも胸水貯留群で有意に予後不良だった(p=0.04)。
PS、遠隔転移巣(肝、頭蓋内、骨)、免疫チェックポイント阻害薬を導入した治療ライン次、末梢血好中球/リンパ球比率といった因子について調整した多変数解析を行ってもなお、胸水貯留は全生存期間(ハザード比1.38、95%信頼区間1.09-1.74、p=0.007)および無増悪生存期間(ハザード比1.35、95%信頼区間1.09-1.68、p=0.006)についての有意な予後不良因子だった。病勢コントロール割合は胸水貯留群で49.9%、非胸水貯留群で52.3%であり、これも胸水貯留群で有意に悪かった(オッズ比1.64、95%信頼区間1.14-2.40、p=0.01)。
胸水貯留群196人中、胸腔ドレナージが必要だった患者は73人(37.2%)で、こうした患者はドレナージが不要だった患者と比較して早期死亡割合が高かった(52% vs 30.5%、p=0.003)。
以上から、胸水貯留を伴う非小細胞肺がん患者では免疫チェックポイントの効果は悪く、予後不良であると結論された。
実感としてそんな感じがする。
治療に対する生理的バリアという概念は納得できる。
中枢神経系への転移だけでなく、悪性胸水や腹水を伴う病状では、それなりの工夫が必要な気がする。
ドライバー遺伝子変異がなく、かつ中枢神経系や悪性胸水・腹水がある患者においては、血管増殖因子阻害薬を積極的に使用してみてはどうだろうか。
ESMO Immuno-Oncology 2020: Does Pleural Effusion Affect Survival in Patients Treated With Immunotherapy for NSCLC?
ASCO post
Pleural effusion is a negative prognostic factor for immunotherapy in non small cell lung cancer (NSCLC): The PLUIE study
Nicolas Epaillard et al., ESMO Immuno-Oncology Virtual Congress 2020 Abst.#42P
胸水貯留を伴う非小細胞肺がん患者、とりわけ胸水ドレナージを要するような患者においては、免疫チェックポイント阻害薬を使用しても予後不良なことがしばしば経験される。EpaillardらはESMO Immuno-Oncology Virtual Congress 2020でそうした趣旨の研究報告を行った。
胸膜は非小細胞肺がん患者における遠隔転移先として頻度の高い部位であり、免疫チェックポイント阻害薬の浸透および効果発現を制限する生理的なバリアーとしても機能する。こうした背景から、今回報告されたPLUIE試験では、免疫チェックポイント阻害薬による治療を受けた胸水貯留合併非小細胞肺がん患者の臨床的アウトカムについて調査された。
本試験は国際的多施設共同後方視的研究である。2012年11月kら2019年11月にかけて、免疫チェックポイント阻害薬による治療を受けた538人の非小細胞肺がん患者を対象とした。免疫チェックポイント阻害薬導入前の段階で、胸水貯留を伴う群(胸水貯留群、196人)と胸水貯留を伴わない群(非胸水貯留群、342人)を同定した。
主要評価項目は、全生存期間と早期死亡割合とし、副次評価項目は無増悪生存期間、病勢コントロール割合とした。これら臨床的アウトカムと胸水貯留の相関はロジスティック回帰モデルで解析し、全生存期間や無増悪生存期間の解析は単変数解析と、コックスモデルを用いた多変数解析で行った。
全体集団の年齢中央値は62.9歳、女性の割合は34.6%、非喫煙者の割合は9.5%、非扁平上皮非小細胞肺がんの割合は75.7%だった。胸水貯留群でも全体と同様の傾向であり、年齢中央値は64.4歳、女性の割合は31.6%、非喫煙者の割合は12.4%、非扁平上皮非小細胞肺がんの割合は77.6%だった。一次治療もしくは二次治療で免疫チェックポイント阻害薬が使用皿た患者の割合は66%、免疫チェックポイント阻害薬を単剤治療として受けた患者の割合は94%だった。
胸水貯留群では、遠隔転移の部位が多い傾向が見られた。すなわち、胸水貯留群での遠隔転移部位数中央値は3.5ヶ所、非胸水貯留群での遠隔転移部位数中央値は2.7ヶ所だった。胸水貯留群ではPS不良の傾向も強く、胸水貯留群の90.8%、非胸水貯留群の80.5%は、PSが2-4だった。
全体集団における生存期間中央値は9.7ヶ月(95%信頼区間は8.1-11.8ヶ月)だった。各群別にみると、胸水貯留群では6.3ヶ月(95%信頼区間は4.0-8.6ヶ月)、非胸水貯留群では11.4ヶ月(95%信頼区間は9.7-13.8ヶ月)で、胸水貯留群で有意に予後不良だった(p=0.002)。早期死亡割合は全体集団で31.4%、胸水貯留群で38.3%、非胸水貯留群で27.5%で、これも胸水貯留群で有意に予後不良だった(オッズ比1.63、95%信頼区間1.13-2.37、p=0.01)。
無増悪生存期間は胸水貯留群で1.8ヶ月(95%信頼区間は1.7-2.5ヶ月)、非胸水貯留群で2.3ヶ月(95%信頼区間は2.0-3.6ヶ月)で、これも胸水貯留群で有意に予後不良だった(p=0.04)。
PS、遠隔転移巣(肝、頭蓋内、骨)、免疫チェックポイント阻害薬を導入した治療ライン次、末梢血好中球/リンパ球比率といった因子について調整した多変数解析を行ってもなお、胸水貯留は全生存期間(ハザード比1.38、95%信頼区間1.09-1.74、p=0.007)および無増悪生存期間(ハザード比1.35、95%信頼区間1.09-1.68、p=0.006)についての有意な予後不良因子だった。病勢コントロール割合は胸水貯留群で49.9%、非胸水貯留群で52.3%であり、これも胸水貯留群で有意に悪かった(オッズ比1.64、95%信頼区間1.14-2.40、p=0.01)。
胸水貯留群196人中、胸腔ドレナージが必要だった患者は73人(37.2%)で、こうした患者はドレナージが不要だった患者と比較して早期死亡割合が高かった(52% vs 30.5%、p=0.003)。
以上から、胸水貯留を伴う非小細胞肺がん患者では免疫チェックポイントの効果は悪く、予後不良であると結論された。
2020年12月17日
抗PD-1抗体とベザフィブラート
抗PD-L1抗体の抗腫瘍効果を、脂質代謝異常改善薬のベザフィブラートが活性化するかも、という話。
基礎研究の世界の話題に過ぎないが、源流はPD-1 / PD-L1系の発見者である本庶佑先生の研究室であり、信頼性はある。
Mitochondrial activation chemicals synergize with surface receptor PD-1 blockade for T cell-dependent antitumor activity
Kenji Chamoto, Partha S. Chowdhury, Alok Kumar, Kazuhiro Sonomura, Fumihiko Matsuda, Sidonia Fagarasan, and Tasuku Honjo
PNAS first published January 17, 2017
https://doi.org/10.1073/pnas.1620433114
この論文の内容については、以下にまとめられているのでリンクを記し、ここでは詳しく触れない。
https://oncolo.jp/news/170125k01
ごく簡単にまとめるなら、ベザフィブラートが細胞障害性T細胞内のミトコンドリアを活性化し、エネルギー代謝効率を上げ、T細胞を元気にする、ということらしい。
上記の論文では大腸がんの細胞株を用いて研究されたようだが、似たようなことを肺がんの細胞株で行ったのが以下の論文で、中国は武漢からの報告である。
相変わらず基礎研究の話ではあるが、中性脂肪優位の脂質異常症を合併している患者さんは、ベザフィブラートを服用しながらニボルマブやペンブロリズマブを使用してみてもいいのではないだろうか。
PGC-1α activator-induced fatty acid oxidation in tumor-infiltrating CTLs enhances effects of PD-1 blockade therapy in lung cancer
Huan Wan et al., Tumori. 2020 Feb;106(1):55-63.
doi: 10.1177/0300891619868287.
Epub 2019 Aug 27.
背景:
ペルオキシソーム増殖因子活性化受容体-ガンマ(PPARγ)共役因子1α(PGC-1α)アゴニストを抗PD-1抗体に添加することにより、治療反応性の乏しい肺癌細胞株の実験動物モデルで有効性と治療メカニズムを検証することを目的とし、PGC-1αアゴニストとしてベザフィブラートを用いた。
方法:
ルイス肺癌細胞株マウスモデルを確立し、抗PD-1抗体単独、あるいは抗PD-1抗体+ベザフィブラート併用で処理をした。腫瘍組織と末梢血を回収し、フローサイトメトリーとリアルタイムPCRを用いて抗腫瘍細胞障害性T細胞(CTL)の質、量、機能、エネルギー代謝について検証した。
結果:
ベザフィブラートと抗PD-1抗体の併用により、相乗的な抗腫瘍活性が認められた。こうした効果は、ベザフィブラート単剤では認められなかった。ベザフィブラートは、腫瘍浸潤CTL上のケモカイン受容体CXCR3と同様に、腫瘍内のケモカインであるCXCL9およびCXCL10の発現を増強することにより、CD8陽性T細胞の腫瘍組織への浸潤を促進した。腫瘍組織内の活性化CTL数はベザフィブラートにより有意に増加した。さらに、ベザフィブラートにより腫瘍浸潤CTLの生存期間や機能が維持された。また、腫瘍浸潤CTL内の活性酸素や、脂肪酸酸化関連遺伝子(PGC-1α,Cpt1a,LCAD)の腫瘍内部での発現が、ベザフィブラート投与後に有意に増加した。
結論:
ベザフィブラートは、腫瘍内微小環境における抗腫瘍CTLの活性を増強させることにより、治療抵抗性肺がんに対するPD-1阻害薬の腫瘍制御に相乗効果をもたらす。こうした潜在的なメカニズムは、腫瘍浸潤CTLの脂肪酸酸化をベザフィブラートが制御する能力に関連している。
基礎研究の世界の話題に過ぎないが、源流はPD-1 / PD-L1系の発見者である本庶佑先生の研究室であり、信頼性はある。
Mitochondrial activation chemicals synergize with surface receptor PD-1 blockade for T cell-dependent antitumor activity
Kenji Chamoto, Partha S. Chowdhury, Alok Kumar, Kazuhiro Sonomura, Fumihiko Matsuda, Sidonia Fagarasan, and Tasuku Honjo
PNAS first published January 17, 2017
https://doi.org/10.1073/pnas.1620433114
この論文の内容については、以下にまとめられているのでリンクを記し、ここでは詳しく触れない。
https://oncolo.jp/news/170125k01
ごく簡単にまとめるなら、ベザフィブラートが細胞障害性T細胞内のミトコンドリアを活性化し、エネルギー代謝効率を上げ、T細胞を元気にする、ということらしい。
上記の論文では大腸がんの細胞株を用いて研究されたようだが、似たようなことを肺がんの細胞株で行ったのが以下の論文で、中国は武漢からの報告である。
相変わらず基礎研究の話ではあるが、中性脂肪優位の脂質異常症を合併している患者さんは、ベザフィブラートを服用しながらニボルマブやペンブロリズマブを使用してみてもいいのではないだろうか。
PGC-1α activator-induced fatty acid oxidation in tumor-infiltrating CTLs enhances effects of PD-1 blockade therapy in lung cancer
Huan Wan et al., Tumori. 2020 Feb;106(1):55-63.
doi: 10.1177/0300891619868287.
Epub 2019 Aug 27.
背景:
ペルオキシソーム増殖因子活性化受容体-ガンマ(PPARγ)共役因子1α(PGC-1α)アゴニストを抗PD-1抗体に添加することにより、治療反応性の乏しい肺癌細胞株の実験動物モデルで有効性と治療メカニズムを検証することを目的とし、PGC-1αアゴニストとしてベザフィブラートを用いた。
方法:
ルイス肺癌細胞株マウスモデルを確立し、抗PD-1抗体単独、あるいは抗PD-1抗体+ベザフィブラート併用で処理をした。腫瘍組織と末梢血を回収し、フローサイトメトリーとリアルタイムPCRを用いて抗腫瘍細胞障害性T細胞(CTL)の質、量、機能、エネルギー代謝について検証した。
結果:
ベザフィブラートと抗PD-1抗体の併用により、相乗的な抗腫瘍活性が認められた。こうした効果は、ベザフィブラート単剤では認められなかった。ベザフィブラートは、腫瘍浸潤CTL上のケモカイン受容体CXCR3と同様に、腫瘍内のケモカインであるCXCL9およびCXCL10の発現を増強することにより、CD8陽性T細胞の腫瘍組織への浸潤を促進した。腫瘍組織内の活性化CTL数はベザフィブラートにより有意に増加した。さらに、ベザフィブラートにより腫瘍浸潤CTLの生存期間や機能が維持された。また、腫瘍浸潤CTL内の活性酸素や、脂肪酸酸化関連遺伝子(PGC-1α,Cpt1a,LCAD)の腫瘍内部での発現が、ベザフィブラート投与後に有意に増加した。
結論:
ベザフィブラートは、腫瘍内微小環境における抗腫瘍CTLの活性を増強させることにより、治療抵抗性肺がんに対するPD-1阻害薬の腫瘍制御に相乗効果をもたらす。こうした潜在的なメカニズムは、腫瘍浸潤CTLの脂肪酸酸化をベザフィブラートが制御する能力に関連している。
2020年12月13日
ドライバー遺伝子変異と免疫チェックポイント阻害薬の無増悪生存期間延長効果
ドライバー遺伝子変異を有する患者に免疫チェックポイント阻害薬を使ったときの無増悪生存期間延長効果について。
KRAS遺伝子変異とBRAF遺伝子変異があると、EGFR遺伝子変異やALK融合遺伝子がある患者よりも無増悪生存期間が有意に伸びるのだとか。
ただ、KRAS遺伝子変異やBRAF遺伝子変異を有する患者では、EGFR遺伝子変異やALK融合遺伝子を有する患者よりも喫煙歴が目立つそう。
結局、遺伝子変異の有無よりも喫煙歴の方が効果予測に役立つのでは?
OA05.04
Real-World Progression-Free Survival in Oncogenic Driver-Mutated Non-Small Cell Lung Cancer (NSCLC) Treated With Single-Agent Immunotherapy
Joseph Bodor et al., IASLC 2020 North America Conference on Lung Cancer
背景:
免疫チェックポイント阻害薬は進行非小細胞肺がんの治療体系を劇的に変えたが、持続的な腫瘍制御効果が得られる患者は限られている。免疫チェックポイント阻害薬関連の臨床試験におけるサブグループ解析のデータから、ドライバー遺伝子変異陽性のがんはPD-1 / PD-L1阻害薬への耐性が増しているように思われるが、ドライバー遺伝子変異陽性患者でのPD-1 / PD-L1阻害薬の効果や、PD-L1発現状態もしくは喫煙歴が免疫チェックポイント阻害薬使用時の効果予測因子として有効かを実地臨床で検証した研究はほとんどない。
方法:
今回の後方視的検討では、ドライバー遺伝子変異陽性の進行非小細胞肺がん患者における実地臨床での無増悪生存期間(rwPFS)を検証し、ドライバー遺伝子変異とPD-L1発現状態や喫煙歴がどのように関わるかも検証した。米国全土のFlatiron Health Electronic Health Recordに由来する、個人識別情報を秘匿したデータベースを用いて、なんらかのドライバー遺伝子変異を有し、免疫チェックポイント阻害薬単剤(ペンブロリズマブ、ニボルマブ、アテゾリズマブ)で治療を受けた患者について分析した。ドライバー遺伝子変異の種類(EGFR、ALK、BRAF、KRAS)ごとのrwPFS中央値(月)が算出され、どのようにPD-L1発現状態や喫煙歴が関連しているかを見た。全患者集団と各ドライバー遺伝子変異集団ごとのカプランマイヤー生存曲線を作成し、log-rank testで検定した。
結果:
1746人の患者が集積され、EGFR遺伝子変異(458人)、ALK融合遺伝子(65人)、BRAF遺伝子変異(146人)、KRAS遺伝子変異(1077人)それぞれの患者集団が、2014年4月23日から2019年2月28日までに免疫チェックポイント阻害薬単剤治療を受けていた。年齢中央値は69歳、58%は女性で、19%は喫煙経験がなかった。rwPFS中央値は遺伝子変異サブタイプ別で有意に異なっており(p<0.001)、KRAS遺伝子変異陽性(rwPFS中央値 3.3ヶ月、95%信頼区間は3.0-3.6ヶ月)およびBRAF遺伝子変異陽性(rwPFS中央値 3.6ヶ月、95%信頼区間は2.6-4.7ヶ月)ではEGFR遺伝子変異陽性(rwPFS中央値2.5ヶ月、95%信頼区間は2.3-2.6ヶ月)およびALK融合遺伝子陽性(rwPFS中央値 2.3ヶ月、95%信頼区間は1.6-3.1ヶ月)よりも有意にrwPFSが長かった。12ヶ月無増悪生存割合はKRAS遺伝子変異陽性患者で21%、BRAF遺伝子変異陽性患者で21%、EGFR遺伝子変異陽性患者で8%、ALK融合遺伝子陽性患者で11%だった。全体のうち795人の患者ではPD-L1発現状態のデータが利用可能だった。KRAS遺伝子変異陽性患者においてのみ、PD-L1発現状態によってrwPFSが変化していた。PD-L1発現陽性(>%)の患者の方がPD-L1発現陰性の患者よりrwPFSが延長していた(4.2ヶ月 vs 3.0ヶ月、p<0.001)。EGFR遺伝子変異陽性、ALK融合遺伝子陽性、BRAF遺伝子変異陽性の患者では、PD-L1発現状態は効果予測因子として役に立たなかった。しかし、喫煙歴があるとEGFR遺伝子変異陽性患者(rwPFS中央値 2.6ヶ月 vs 2.3ヶ月、p<0.05)とALK融合遺伝子陽性患者(rwPFS中央値 3.0ヶ月 vs 2.1ヶ月、p<0.05)ではrwPFSが有意に延長していた。
KRAS遺伝子変異とBRAF遺伝子変異があると、EGFR遺伝子変異やALK融合遺伝子がある患者よりも無増悪生存期間が有意に伸びるのだとか。
ただ、KRAS遺伝子変異やBRAF遺伝子変異を有する患者では、EGFR遺伝子変異やALK融合遺伝子を有する患者よりも喫煙歴が目立つそう。
結局、遺伝子変異の有無よりも喫煙歴の方が効果予測に役立つのでは?
OA05.04
Real-World Progression-Free Survival in Oncogenic Driver-Mutated Non-Small Cell Lung Cancer (NSCLC) Treated With Single-Agent Immunotherapy
Joseph Bodor et al., IASLC 2020 North America Conference on Lung Cancer
背景:
免疫チェックポイント阻害薬は進行非小細胞肺がんの治療体系を劇的に変えたが、持続的な腫瘍制御効果が得られる患者は限られている。免疫チェックポイント阻害薬関連の臨床試験におけるサブグループ解析のデータから、ドライバー遺伝子変異陽性のがんはPD-1 / PD-L1阻害薬への耐性が増しているように思われるが、ドライバー遺伝子変異陽性患者でのPD-1 / PD-L1阻害薬の効果や、PD-L1発現状態もしくは喫煙歴が免疫チェックポイント阻害薬使用時の効果予測因子として有効かを実地臨床で検証した研究はほとんどない。
方法:
今回の後方視的検討では、ドライバー遺伝子変異陽性の進行非小細胞肺がん患者における実地臨床での無増悪生存期間(rwPFS)を検証し、ドライバー遺伝子変異とPD-L1発現状態や喫煙歴がどのように関わるかも検証した。米国全土のFlatiron Health Electronic Health Recordに由来する、個人識別情報を秘匿したデータベースを用いて、なんらかのドライバー遺伝子変異を有し、免疫チェックポイント阻害薬単剤(ペンブロリズマブ、ニボルマブ、アテゾリズマブ)で治療を受けた患者について分析した。ドライバー遺伝子変異の種類(EGFR、ALK、BRAF、KRAS)ごとのrwPFS中央値(月)が算出され、どのようにPD-L1発現状態や喫煙歴が関連しているかを見た。全患者集団と各ドライバー遺伝子変異集団ごとのカプランマイヤー生存曲線を作成し、log-rank testで検定した。
結果:
1746人の患者が集積され、EGFR遺伝子変異(458人)、ALK融合遺伝子(65人)、BRAF遺伝子変異(146人)、KRAS遺伝子変異(1077人)それぞれの患者集団が、2014年4月23日から2019年2月28日までに免疫チェックポイント阻害薬単剤治療を受けていた。年齢中央値は69歳、58%は女性で、19%は喫煙経験がなかった。rwPFS中央値は遺伝子変異サブタイプ別で有意に異なっており(p<0.001)、KRAS遺伝子変異陽性(rwPFS中央値 3.3ヶ月、95%信頼区間は3.0-3.6ヶ月)およびBRAF遺伝子変異陽性(rwPFS中央値 3.6ヶ月、95%信頼区間は2.6-4.7ヶ月)ではEGFR遺伝子変異陽性(rwPFS中央値2.5ヶ月、95%信頼区間は2.3-2.6ヶ月)およびALK融合遺伝子陽性(rwPFS中央値 2.3ヶ月、95%信頼区間は1.6-3.1ヶ月)よりも有意にrwPFSが長かった。12ヶ月無増悪生存割合はKRAS遺伝子変異陽性患者で21%、BRAF遺伝子変異陽性患者で21%、EGFR遺伝子変異陽性患者で8%、ALK融合遺伝子陽性患者で11%だった。全体のうち795人の患者ではPD-L1発現状態のデータが利用可能だった。KRAS遺伝子変異陽性患者においてのみ、PD-L1発現状態によってrwPFSが変化していた。PD-L1発現陽性(>%)の患者の方がPD-L1発現陰性の患者よりrwPFSが延長していた(4.2ヶ月 vs 3.0ヶ月、p<0.001)。EGFR遺伝子変異陽性、ALK融合遺伝子陽性、BRAF遺伝子変異陽性の患者では、PD-L1発現状態は効果予測因子として役に立たなかった。しかし、喫煙歴があるとEGFR遺伝子変異陽性患者(rwPFS中央値 2.6ヶ月 vs 2.3ヶ月、p<0.05)とALK融合遺伝子陽性患者(rwPFS中央値 3.0ヶ月 vs 2.1ヶ月、p<0.05)ではrwPFSが有意に延長していた。
2020年12月09日
緩和ケア病棟の閉鎖
先日、近隣の医療機関からこんな文書連絡があった。
「当院の緩和ケア病棟を閉鎖します」
ここは準公的医療機関であり、この地域では唯一、緩和ケア専門病棟を有していた。
旧知の医師が病棟責任者を務めていて、彼の前職のころから、私は何度も助けていただいた。
なぜ閉鎖に至ったかというと、紛れもなく新型コロナウイルス感染症の流行が直接の原因である。
この医療機関は大分県がん診療連携協力病院であるとともに、第二種感染症指定医療機関でもある。
新型コロナウイルス感染症患者が地域で発生したときには、真っ先に受け入れなければならない立場にある。
感染確定患者もくれば、疑い患者も来る。
確定患者は専用病棟に隔離できるのだが、疑い患者はそうはいかない。
疑い患者は診断が確定するまでの間、どこの病棟に入院させればよいか、ということになり、結局受け入れ先が緩和ケア病棟になったようなのだ。
4月以降そうした形で緩和ケア病棟が新型コロナウイルス感染疑い患者病棟として運用されることになった。
当然のことながら、緩和ケア病棟スタッフの業務は縮小される。
収束の見通しが立っていれば、一時的な経過措置として我慢もできる。
ただ、少なくとも我が国政府・社会は、国民経済を守るためという理由で、徹底的な封じ込めは行っていない。
国家予算を組んで、旅行や会食、ショッピングを推奨して、結果として最悪の時期に今年最高の流行を招くことになった。
本日大分県では過去最高の1日21人の新規患者が報告され、流行は収束するどころか拡大の一途をたどっている。
緩和ケア病棟の業務を再開する見通しは全く立たず、病棟責任者の医師は退職を決意したようだ。
その医師に電話をして心境を聞いてみた。
「残念ながら、再開の見通しは立ちません」
「私は緩和ケア診療をするためにここに赴任したので、この状況ではここにいる意味はありません」
「退職後は旧知の医師を頼って、在宅緩和医療のお手伝いを始めてみます」
とのことだった。
また一つ、大分での肺がん診療に新型コロナウイルスの爪痕が残された。
「当院の緩和ケア病棟を閉鎖します」
ここは準公的医療機関であり、この地域では唯一、緩和ケア専門病棟を有していた。
旧知の医師が病棟責任者を務めていて、彼の前職のころから、私は何度も助けていただいた。
なぜ閉鎖に至ったかというと、紛れもなく新型コロナウイルス感染症の流行が直接の原因である。
この医療機関は大分県がん診療連携協力病院であるとともに、第二種感染症指定医療機関でもある。
新型コロナウイルス感染症患者が地域で発生したときには、真っ先に受け入れなければならない立場にある。
感染確定患者もくれば、疑い患者も来る。
確定患者は専用病棟に隔離できるのだが、疑い患者はそうはいかない。
疑い患者は診断が確定するまでの間、どこの病棟に入院させればよいか、ということになり、結局受け入れ先が緩和ケア病棟になったようなのだ。
4月以降そうした形で緩和ケア病棟が新型コロナウイルス感染疑い患者病棟として運用されることになった。
当然のことながら、緩和ケア病棟スタッフの業務は縮小される。
収束の見通しが立っていれば、一時的な経過措置として我慢もできる。
ただ、少なくとも我が国政府・社会は、国民経済を守るためという理由で、徹底的な封じ込めは行っていない。
国家予算を組んで、旅行や会食、ショッピングを推奨して、結果として最悪の時期に今年最高の流行を招くことになった。
本日大分県では過去最高の1日21人の新規患者が報告され、流行は収束するどころか拡大の一途をたどっている。
緩和ケア病棟の業務を再開する見通しは全く立たず、病棟責任者の医師は退職を決意したようだ。
その医師に電話をして心境を聞いてみた。
「残念ながら、再開の見通しは立ちません」
「私は緩和ケア診療をするためにここに赴任したので、この状況ではここにいる意味はありません」
「退職後は旧知の医師を頼って、在宅緩和医療のお手伝いを始めてみます」
とのことだった。
また一つ、大分での肺がん診療に新型コロナウイルスの爪痕が残された。
2020年12月06日
ニボルマブ+イピリムマブ±プラチナ併用化学療法 適応追加
2020/11/27はいろいろな薬事承認が成された日だった様子。
非小細胞肺がん治療の領域にも、「免疫チェックポイント阻害薬2剤併用」という新たな地平が開かれた。
また、抗CTLA-4抗体が非小細胞肺がん領域で薬事承認されたという意味でも新しい。
CheckMate277試験とCheckMate9LA試験の結果を根拠として、ニボルマブ+イピリムマブ±化学療法が未治療進行非小細胞肺がんに適用可能となった。
CheckMate-277試験とCheckMate9LA試験については過去にも触れているので、以下のリンクを参照のこと。
http://oitahaiganpractice.junglekouen.com/e968110.html
http://oitahaiganpractice.junglekouen.com/e976407.html
効果・安全性の両面から、イピリムマブを実地臨床で追加すべきかどうかは判断が難しい。
製薬メーカーのパンフレットを用いて見ておきたい。
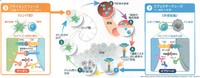
こちらは、「腫瘍免疫サイクル」としてよく知られた図表である。
① がん細胞に特徴的ながん特異抗原が放出される
② がん特異抗原が抗原提示細胞に捕捉される
③ リンパ節において、抗原提示細胞ががん特異抗原の情報をT細胞に受け渡す。
このとき、抗原提示細胞上のB7タンパクとT細胞上のCD28タンパクがくっつくと、T細胞の働きが活性化される。
一方で、抗原提示細胞上のB7タンパクとT細胞上のCTLA-4タンパクがくっつくと、T細胞の働きが抑制される。
④ がん特異抗原を認識できるようになったT細胞が、リンパ節から血管内へと移動する。
⑤ がん病巣を発見したT細胞は、血管からがん病巣への沁みだす。
⑥ T細胞ががん細胞を発見し、がん細胞表面にあるがん特異抗原・MHCタンパク複合体を、T細胞受容体を介して認識する。
このとき、T細胞表面にあるPD-1タンパクとがん細胞表面にあるPD-L1タンパクがくっつくと、T細胞の働きが抑制される
⑦ T細胞ががん細胞を攻撃する
③の過程で、CTLA-4にくっついてB7とCTLA-4がくっつけないようにし、T細胞を活性化する薬がイピリムマブ(ヤーボイ®)。
⑥の過程で、PD-1にくっついてPD-1とPD-L1がくっつけないようにし、T細胞を活性化する薬がニボルマブ(オプジーボ®)。

ニボルマブは、治療スケジュールが複数あり、それに応じて治療必要量も変わる。
具体的にいえば、2週間ごとに240mg、あるいは3週間ごとに360mgの投与量。
1コース3週間のリズムに慣れている医療従事者にとっては、3週間ごとに360mgの方が馴染みやすいだろう。
イピリムマブは単独では使用できず、ニボルマブとの併用が前提となっており、6週間ごとに反復投与する。

投与スケジュールと投与量を図示するとこのようになる。
オプジーボは2週間ごとなら2週間ごと、3週間ごとなら3週間ごとと原則を決めてどの患者にも適用した方が、間違いがないだろう。

CheckMate-227試験の概要。
何度見てもわかりにくい。
敢えてまとめるなら、全体集団ではイピリムマブ+ニボルマブ併用療法(NI群)とプラチナ併用化学療法(C群)の2群比較をベースに、PD-L1≧1%の患者集団ではニボルマブ単剤療法(N群)を、PD-L1<1%の患者ではニボルマブ+プラチナ併用化学療法(NC群)をさらに治療集団として加えている。

CheckMate-227試験におけるPD-L1≧1%の患者集団でのNI群とC群の生存期間比較。
なぜかこの図表にはN群に関する生存曲線の記述がない。
NI群とN群の間に有意差がついていない(参照:http://img01.junglekouen.com/usr/o/i/t/oitahaiganpractice/CheckMate229sOS.jpg)ので、NI群とC群の差に目を向けさせるため、恣意的にパンフレットの図表からは除かれているのではないだろうか。
最初の6か月間だけで見るならば、C群の方がよい。
それ以降で見るならば、NI群の方がよい。
最終的には統計学的有意にNI群の方がよかった。

CheckMate-227試験におけるPD-L1<1%の患者集団でのNI群、NC群、C群の生存期間比較。
まず、生存曲線の末尾の方を見る限り、NI群が圧倒的に優れているように見える。
PD-L1発現の有無にかかわらず、3年経過以降は長期生存が期待できるというのはNI群の大きなメリットではないだろうか。
試験デザイン上、ここに上がっている治療群間には統計学的な有意差はついていないのだが、そんなことよりはこの生存曲線の語る事実を素直に受け止めるべきだろう。

CheckMate-227試験における無増悪生存期間比較。
はっきり言えることは、化学療法が入っていなければ、最初の6か月間の成績が悪いということである。
治療内容に化学療法を含んでいないNI療法は、再現性を以て最初の6か月間の治療成績が劣っている。

奏効割合のデータからは、一定の傾向を見出すのは難しい。
PD-L1<1%だったら、C群よりNC群の方が腫瘍縮小効果が高い、ということくらいしか言えない。

毒性については、皮膚・内分泌系の重篤な毒性がNI群で目立つ。

NI群においては、胃腸・肝・肺毒性が、治療中止に至る毒性として多いようである。

今度はCheckMate-9LA試験。
解析計画の記述は長すぎて読む気にならないが、試験デザインはシンプルで好感が持てる。
初期治療効果の劣るNI群の弱点を補うために、試験治療群(NI-Chemo群)では治療初期の1ヶ月半から2ヶ月の間は化学療法を併用する。
対照群はシンプルに標準化学療法(Chemo群)である。
したがって、本試験ではChemo群に対してNI-Chemo群が優れているかどうかだけが明らかになる。
NI群に対してNI-Chemo群が優れるかどうかとか、PD-L1≧50%の患者集団で、抗PD-1抗体単剤療法に対してNI-Chemo群が優れるかどうかとかはわからない。

CheckMate-9LA試験における全患者集団の生存曲線。
追跡期間が短くてこれからどうなるのかまだわからないが、少なくとも統計学的有意差はついたとのこと。
少なくとも、NI-Chemo群において、治療初期に化学療法を併用した効果は出ているようで、治療開始初期からNI-Chemo群の生存曲線が上を行っている。
CheckMate-227試験におけるNI群の生存曲線とは様相が異なる。
一方で、2本の生存曲線が末広がりでなく先すぼまりになっているのは、今後どのように展開するのか気になるところである。
長期経過を追ったら成績が変わらなくなった、とか、逆転した、となれば、異なる解釈が必要になる。

CheckMate-9LA試験における、PD-L1≧50%の患者集団の生存曲線。
基本的な傾向は、全患者集団のそれと変わらない。

CheckMate-9LA試験における、PD-L1=0-49%の患者集団の生存曲線。
これも基本的な傾向は変わらない。

CheckMate-9LA試験における、PD-L1≧1%の患者集団の生存曲線。
これも変わらず。

CheckMate-9LA試験における、PD-L1<1%の患者集団の生存曲線。
これまた変わらず。
結局、PD-L1発現状態によらず、同じような傾向に落ち着く様子。
イピリムマブを併用することによって、PD-L1発現状態が効果予測因子となるニボルマブの特性が弱められるのかもしれない。

CheckMate-9LA試験における、無増悪生存曲線。
治療初期は似たり寄ったり。
治療開始から4-17ヶ月あたりは、NI-Chemo群の方が良さそう。
それ以降はまた似たり寄ったり。

CheckMate-9LA試験における奏効割合。
これは有意差を以てNI-Chemo群の方が優れる。

CheckMate-9LA試験における有害事象。
皮膚・内分泌・肝胆道系のGrade 3以上の有害事象がNI-Chemo群で気になる。

CheckMate-9LA試験における有害事象。
治療中止に至る有害事象として診るならば、皮膚や内分泌はそれほど大きな問題ではなく、胃腸・肝・肺・腎・過敏症症状が治療中止に至る有害事象として無視できないようだ。
ここからは私の妄想。
CheckMate-227試験におけるNI群の生存期間中央値は概ね17ヶ月、対するCheckMate-9LA試験におけるNI-Chemo群の生存期間中央値は概ね14ヶ月で、3ヶ月の開きがある。
14ヶ月と言えば、CheckMate-227試験におけるC群の成績に近い。
異なる臨床試験の結果だから直接比較は難しい、とはいいながら、両臨床試験のシェーマを見る限り、患者背景はほぼ同じ、CheckMate-227試験におけるC群とCheckMate-9LA試験におけるChemo群の治療内容もほぼ同じである。
CheckMate-9LA試験結果から、化学療法単独に対するニボルマブ+イピリムマブの効果が4ヶ月の生存期間上乗せと見積もると、もしCheckMate-227試験でNI-Chemo群を走らせていたら、C群の生存期間14ヶ月に4ヶ月を上乗せして、多分生存期間中央値は18ヶ月くらいで落ち着いたのではないだろうか。
非小細胞肺がん治療の領域にも、「免疫チェックポイント阻害薬2剤併用」という新たな地平が開かれた。
また、抗CTLA-4抗体が非小細胞肺がん領域で薬事承認されたという意味でも新しい。
CheckMate277試験とCheckMate9LA試験の結果を根拠として、ニボルマブ+イピリムマブ±化学療法が未治療進行非小細胞肺がんに適用可能となった。
CheckMate-277試験とCheckMate9LA試験については過去にも触れているので、以下のリンクを参照のこと。
http://oitahaiganpractice.junglekouen.com/e968110.html
http://oitahaiganpractice.junglekouen.com/e976407.html
効果・安全性の両面から、イピリムマブを実地臨床で追加すべきかどうかは判断が難しい。
製薬メーカーのパンフレットを用いて見ておきたい。

こちらは、「腫瘍免疫サイクル」としてよく知られた図表である。
① がん細胞に特徴的ながん特異抗原が放出される
② がん特異抗原が抗原提示細胞に捕捉される
③ リンパ節において、抗原提示細胞ががん特異抗原の情報をT細胞に受け渡す。
このとき、抗原提示細胞上のB7タンパクとT細胞上のCD28タンパクがくっつくと、T細胞の働きが活性化される。
一方で、抗原提示細胞上のB7タンパクとT細胞上のCTLA-4タンパクがくっつくと、T細胞の働きが抑制される。
④ がん特異抗原を認識できるようになったT細胞が、リンパ節から血管内へと移動する。
⑤ がん病巣を発見したT細胞は、血管からがん病巣への沁みだす。
⑥ T細胞ががん細胞を発見し、がん細胞表面にあるがん特異抗原・MHCタンパク複合体を、T細胞受容体を介して認識する。
このとき、T細胞表面にあるPD-1タンパクとがん細胞表面にあるPD-L1タンパクがくっつくと、T細胞の働きが抑制される
⑦ T細胞ががん細胞を攻撃する
③の過程で、CTLA-4にくっついてB7とCTLA-4がくっつけないようにし、T細胞を活性化する薬がイピリムマブ(ヤーボイ®)。
⑥の過程で、PD-1にくっついてPD-1とPD-L1がくっつけないようにし、T細胞を活性化する薬がニボルマブ(オプジーボ®)。

ニボルマブは、治療スケジュールが複数あり、それに応じて治療必要量も変わる。
具体的にいえば、2週間ごとに240mg、あるいは3週間ごとに360mgの投与量。
1コース3週間のリズムに慣れている医療従事者にとっては、3週間ごとに360mgの方が馴染みやすいだろう。
イピリムマブは単独では使用できず、ニボルマブとの併用が前提となっており、6週間ごとに反復投与する。

投与スケジュールと投与量を図示するとこのようになる。
オプジーボは2週間ごとなら2週間ごと、3週間ごとなら3週間ごとと原則を決めてどの患者にも適用した方が、間違いがないだろう。

CheckMate-227試験の概要。
何度見てもわかりにくい。
敢えてまとめるなら、全体集団ではイピリムマブ+ニボルマブ併用療法(NI群)とプラチナ併用化学療法(C群)の2群比較をベースに、PD-L1≧1%の患者集団ではニボルマブ単剤療法(N群)を、PD-L1<1%の患者ではニボルマブ+プラチナ併用化学療法(NC群)をさらに治療集団として加えている。

CheckMate-227試験におけるPD-L1≧1%の患者集団でのNI群とC群の生存期間比較。
なぜかこの図表にはN群に関する生存曲線の記述がない。
NI群とN群の間に有意差がついていない(参照:http://img01.junglekouen.com/usr/o/i/t/oitahaiganpractice/CheckMate229sOS.jpg)ので、NI群とC群の差に目を向けさせるため、恣意的にパンフレットの図表からは除かれているのではないだろうか。
最初の6か月間だけで見るならば、C群の方がよい。
それ以降で見るならば、NI群の方がよい。
最終的には統計学的有意にNI群の方がよかった。

CheckMate-227試験におけるPD-L1<1%の患者集団でのNI群、NC群、C群の生存期間比較。
まず、生存曲線の末尾の方を見る限り、NI群が圧倒的に優れているように見える。
PD-L1発現の有無にかかわらず、3年経過以降は長期生存が期待できるというのはNI群の大きなメリットではないだろうか。
試験デザイン上、ここに上がっている治療群間には統計学的な有意差はついていないのだが、そんなことよりはこの生存曲線の語る事実を素直に受け止めるべきだろう。

CheckMate-227試験における無増悪生存期間比較。
はっきり言えることは、化学療法が入っていなければ、最初の6か月間の成績が悪いということである。
治療内容に化学療法を含んでいないNI療法は、再現性を以て最初の6か月間の治療成績が劣っている。

奏効割合のデータからは、一定の傾向を見出すのは難しい。
PD-L1<1%だったら、C群よりNC群の方が腫瘍縮小効果が高い、ということくらいしか言えない。

毒性については、皮膚・内分泌系の重篤な毒性がNI群で目立つ。

NI群においては、胃腸・肝・肺毒性が、治療中止に至る毒性として多いようである。

今度はCheckMate-9LA試験。
解析計画の記述は長すぎて読む気にならないが、試験デザインはシンプルで好感が持てる。
初期治療効果の劣るNI群の弱点を補うために、試験治療群(NI-Chemo群)では治療初期の1ヶ月半から2ヶ月の間は化学療法を併用する。
対照群はシンプルに標準化学療法(Chemo群)である。
したがって、本試験ではChemo群に対してNI-Chemo群が優れているかどうかだけが明らかになる。
NI群に対してNI-Chemo群が優れるかどうかとか、PD-L1≧50%の患者集団で、抗PD-1抗体単剤療法に対してNI-Chemo群が優れるかどうかとかはわからない。

CheckMate-9LA試験における全患者集団の生存曲線。
追跡期間が短くてこれからどうなるのかまだわからないが、少なくとも統計学的有意差はついたとのこと。
少なくとも、NI-Chemo群において、治療初期に化学療法を併用した効果は出ているようで、治療開始初期からNI-Chemo群の生存曲線が上を行っている。
CheckMate-227試験におけるNI群の生存曲線とは様相が異なる。
一方で、2本の生存曲線が末広がりでなく先すぼまりになっているのは、今後どのように展開するのか気になるところである。
長期経過を追ったら成績が変わらなくなった、とか、逆転した、となれば、異なる解釈が必要になる。

CheckMate-9LA試験における、PD-L1≧50%の患者集団の生存曲線。
基本的な傾向は、全患者集団のそれと変わらない。

CheckMate-9LA試験における、PD-L1=0-49%の患者集団の生存曲線。
これも基本的な傾向は変わらない。

CheckMate-9LA試験における、PD-L1≧1%の患者集団の生存曲線。
これも変わらず。

CheckMate-9LA試験における、PD-L1<1%の患者集団の生存曲線。
これまた変わらず。
結局、PD-L1発現状態によらず、同じような傾向に落ち着く様子。
イピリムマブを併用することによって、PD-L1発現状態が効果予測因子となるニボルマブの特性が弱められるのかもしれない。

CheckMate-9LA試験における、無増悪生存曲線。
治療初期は似たり寄ったり。
治療開始から4-17ヶ月あたりは、NI-Chemo群の方が良さそう。
それ以降はまた似たり寄ったり。

CheckMate-9LA試験における奏効割合。
これは有意差を以てNI-Chemo群の方が優れる。

CheckMate-9LA試験における有害事象。
皮膚・内分泌・肝胆道系のGrade 3以上の有害事象がNI-Chemo群で気になる。

CheckMate-9LA試験における有害事象。
治療中止に至る有害事象として診るならば、皮膚や内分泌はそれほど大きな問題ではなく、胃腸・肝・肺・腎・過敏症症状が治療中止に至る有害事象として無視できないようだ。
ここからは私の妄想。
CheckMate-227試験におけるNI群の生存期間中央値は概ね17ヶ月、対するCheckMate-9LA試験におけるNI-Chemo群の生存期間中央値は概ね14ヶ月で、3ヶ月の開きがある。
14ヶ月と言えば、CheckMate-227試験におけるC群の成績に近い。
異なる臨床試験の結果だから直接比較は難しい、とはいいながら、両臨床試験のシェーマを見る限り、患者背景はほぼ同じ、CheckMate-227試験におけるC群とCheckMate-9LA試験におけるChemo群の治療内容もほぼ同じである。
CheckMate-9LA試験結果から、化学療法単独に対するニボルマブ+イピリムマブの効果が4ヶ月の生存期間上乗せと見積もると、もしCheckMate-227試験でNI-Chemo群を走らせていたら、C群の生存期間14ヶ月に4ヶ月を上乗せして、多分生存期間中央値は18ヶ月くらいで落ち着いたのではないだろうか。



