2017年06月29日
EGFR T790M変異 ctDNA検索 保険収載間近
2017年6月28日、T790M血漿検査(コバスv2.0)の保険適用に関する中医協が開催され、保険収載日が7月1日(土)になったとのこと。
「組織を検体とした検査が実施困難である医学的な理由を診療録及び診療報酬明細書の摘要欄に記載すること」
との条件が付されているが、検査が乱発されそうなのは容易に想像できる。
医師の良識と、診断担当医と治療担当医の間での円滑な連携が試されている。
先日、当院入院中の患者で1人測定したが、もともと腫瘍細胞で確認されていた感受性EGFR遺伝子変異、T790M変異いずれも陰性だった。
これまでにも同じような結果の人は何人かいたが、病勢進行は認めるものの局所進行に留まっている人が多い気がする。
気がするだけでなく、きっとそういうことなのだろう。
ctDNA検索は、耐性変異を捕まえるのが現状の主目的であるのは言うまでもないが、腫瘍DNAが末梢血中に漏出しているかどうかで病勢の悪化を見極める、という点では、腫瘍マーカー検索とか末梢血中腫瘍細胞評価と同様の意義を持っているようだ。
ここからは憶測に過ぎないが、生検によるT790M変異検索とctDNAによるT790M変異検索の結果が一致しなかったとき(保険請求の条件上、通常の診療ではこんなことは起こらないかもしれないが)、仮に生検による変異検索結果に基づいてOsimertinibの投与を開始した場合には、生検部位以外の病巣が悪化していないかどうか注意深く見守る必要があるだろう。
生検検体でT790M変異検索を行うにあたっては、まずは生検しやすいところから採取するべきだし、複数の生検可能病巣がある場合には、進行するとより致死的になるとか、よりQoLを阻害するとか、そうしたところを選んで採取したい。
http://www.roche-diagnostics.jp/news/17/06/30.html
販売名: コバスEGFR変異検出キット v2.0
保険適用希望企業: ロシュ・ダイアグノスティックス株式会社
測定項目: EGFR遺伝子検査(血漿)
測定方法: アレル特異的リアルタイムPCR法
保険点数: 2,100点
準用保険点数: D006-2 造血器腫瘍遺伝子検査
留意事項案:
1. 本検査は、肺癌の再発や増悪により、EGFR遺伝子変異の2次的遺伝子変異が疑われ、再度治療法を選択する必要があり、血漿を用いてリアルタイムPCR法で測定した場合に、患者1人につき1回に限り算定できる。
ただし、本検査の実施は、医学的な理由により、肺癌の組織を検体として、区分番号「D004-2」悪性腫瘍組織検査の「1」悪性腫瘍遺伝子検査の「イ」EGFR遺伝子検査(リアルタイムPCR法)又は
「ロ」EGFR遺伝子検査(リアルタイムPCR法以外)を行うことが困難な場合に限る。本検査の実施にあたっては、関連学会が定める実施指針を遵守すること。
2. 本検査を実施した場合は、肺癌の組織を検体とした検査が実施困難である医学的な理由を診療録及び診療報酬明細書の摘要欄に記載すること。
3. 本検査、区分番号「D004-2」悪性腫瘍組織検査の「1」悪性腫瘍遺伝子検査、区分番号「D006-2」造血器腫瘍遺伝子検査又は区分番号「D006-6」免疫関連遺伝子再構成のうちいずれかを同一月中に併せて行った場合には、主たるもののみ算定する。
「組織を検体とした検査が実施困難である医学的な理由を診療録及び診療報酬明細書の摘要欄に記載すること」
との条件が付されているが、検査が乱発されそうなのは容易に想像できる。
医師の良識と、診断担当医と治療担当医の間での円滑な連携が試されている。
先日、当院入院中の患者で1人測定したが、もともと腫瘍細胞で確認されていた感受性EGFR遺伝子変異、T790M変異いずれも陰性だった。
これまでにも同じような結果の人は何人かいたが、病勢進行は認めるものの局所進行に留まっている人が多い気がする。
気がするだけでなく、きっとそういうことなのだろう。
ctDNA検索は、耐性変異を捕まえるのが現状の主目的であるのは言うまでもないが、腫瘍DNAが末梢血中に漏出しているかどうかで病勢の悪化を見極める、という点では、腫瘍マーカー検索とか末梢血中腫瘍細胞評価と同様の意義を持っているようだ。
ここからは憶測に過ぎないが、生検によるT790M変異検索とctDNAによるT790M変異検索の結果が一致しなかったとき(保険請求の条件上、通常の診療ではこんなことは起こらないかもしれないが)、仮に生検による変異検索結果に基づいてOsimertinibの投与を開始した場合には、生検部位以外の病巣が悪化していないかどうか注意深く見守る必要があるだろう。
生検検体でT790M変異検索を行うにあたっては、まずは生検しやすいところから採取するべきだし、複数の生検可能病巣がある場合には、進行するとより致死的になるとか、よりQoLを阻害するとか、そうしたところを選んで採取したい。
http://www.roche-diagnostics.jp/news/17/06/30.html
販売名: コバスEGFR変異検出キット v2.0
保険適用希望企業: ロシュ・ダイアグノスティックス株式会社
測定項目: EGFR遺伝子検査(血漿)
測定方法: アレル特異的リアルタイムPCR法
保険点数: 2,100点
準用保険点数: D006-2 造血器腫瘍遺伝子検査
留意事項案:
1. 本検査は、肺癌の再発や増悪により、EGFR遺伝子変異の2次的遺伝子変異が疑われ、再度治療法を選択する必要があり、血漿を用いてリアルタイムPCR法で測定した場合に、患者1人につき1回に限り算定できる。
ただし、本検査の実施は、医学的な理由により、肺癌の組織を検体として、区分番号「D004-2」悪性腫瘍組織検査の「1」悪性腫瘍遺伝子検査の「イ」EGFR遺伝子検査(リアルタイムPCR法)又は
「ロ」EGFR遺伝子検査(リアルタイムPCR法以外)を行うことが困難な場合に限る。本検査の実施にあたっては、関連学会が定める実施指針を遵守すること。
2. 本検査を実施した場合は、肺癌の組織を検体とした検査が実施困難である医学的な理由を診療録及び診療報酬明細書の摘要欄に記載すること。
3. 本検査、区分番号「D004-2」悪性腫瘍組織検査の「1」悪性腫瘍遺伝子検査、区分番号「D006-2」造血器腫瘍遺伝子検査又は区分番号「D006-6」免疫関連遺伝子再構成のうちいずれかを同一月中に併せて行った場合には、主たるもののみ算定する。
2017年06月28日
Alectinib関連の備忘録
2017年度日本呼吸器内視鏡学会総会第1日 2017年6月9日(金)
ランチョンセミナー3
<ALK陽性非小細胞肺癌の治療戦略とその実際>
・進行非小細胞肺癌の診断がついたら、次にするべきはEGFR、ALK、ROS1、PD-L1の確認
→全て陰性なら、Bevacizumabが使えるかどうかを判断するため、扁平上皮癌か非扁平上皮癌の鑑別をする
・2007年にALK融合遺伝子が発見された
EML4-ALKはリガンド非依存的に二量体を形成する
検索する手段は免疫染色、FISH、PCR
・ALK検査の手引き
ALK陽性の頻度が高い組織像ならば、免疫染色陰性でもFISHをしておきたい
・Park et al., PLoS ONE 2016
https://www.ncbi.nlm.nih.gov/pubmed/27518729
Lymphadenopathy, extranodal invasionがALK陽性肺癌で高頻度
・Yoshida et al., J Clin Oncol 2016
https://www.ncbi.nlm.nih.gov/pubmed/27354483
Crizotinibの効果とALK variantの関係
・Gainor et al., Clin Cancer Res, 4585-4593, 2016
https://www.ncbi.nlm.nih.gov/pubmed/27225694
EGFRやALKが陽性の場合、抗PD-1抗体が効きにくいが、その理由に言及
・EGFR遺伝子変異陽性ならCD73が高発現、そのため抗PD-1抗体の効果が出にくい
ASCO 2017 abst.#11505
http://abstracts.asco.org/199/AbstView_199_194449.html
・J-ALEX study, Hida et al., Lancet 2017
1レジメンまでの化学療法歴は可とした
ALK検索の手法として、IHC、FISH、PCRいずれも可とした
PSは0-2
1st line / 2nd lineでのサブグループ解析→Alectinib優位
IIIB, IV期 / 術後再発でのサブグループ解析→Alectinib優位
・Alectinibのcompoundとしての初回報告
Sakamoto et al., Cancer cell 679-690, 2011
https://www.ncbi.nlm.nih.gov/pubmed/21575866
・ALEX study, Peters et al., N Engl J Med 2017, Shaw et al., ASCO 2017 abst #LBA9008
Grobal study
未治療ALK陽性進行肺癌患者のみが対象
PSは0-2
層別化因子は人種、脳転移の有無、ALK検出法
無増悪生存期間中央値はAlectinibで未到達、Crizotinibで11.1ヶ月
ハザード比0.47(95%信頼区間は0.34-0.65)
P<0.0001
ASCO 2017における筆頭演者のコメントは、
“The large magnitude of benefit suggest that first line alectinib may be superior to sequential treatment with crizotinib and alectinib ( crizotinib followed by alectinib).”
“First line alectinib for ALK+ advanced NSCLC is ESTABLISHED.”
→「(J-ALEX studyの結果が明らかになってからというもの、Alectinibを1st lineで使用することと、Crizotinibを1st lineで使用したのちにAlectinibを使用することと、どちらがより全体としての治療成績を改善するのかという議論があるが)今回のALEX studyにおける、1st line Alectinibの優れた治療効果を目の当たりにすると、仮に逐次療法との比較を考えたとしても、1st line Alectinibが優れているだろうと考えざるを得ない」
「1st line Alectinibはもはや"確立された"治療といってよい」
・Tamura et al., J Clin Oncol 2017
AF-001JP試験の3年追跡結果
3年無増悪生存割合:62%(95%信頼区間は45-75%)
3年生存割合:78%(95%信頼区間は63-88%)
奏効割合:93.5%
奏効までの期間:0.7ヶ月(95%信頼区間は0.6-7.1ヶ月)
・Kodama et al., Cancer Chemother Pharmacol 1023-1025 2014
Alectinibは脳内への移行性良好
・Gadgeel et al., J Clin Oncol 2016
Pooled analysis of CNS response to alectinib
・PS不良患者に対するAlectinib:Iwama et al., J Thorac Oncol 2017
奏効割合 72.2%
PS改善割合 83.3%
無増悪生存期間中央値 10.1ヶ月
・ALK阻害薬耐性の機序は多彩
Gainor et al., Cancer Discov 1118-1133, 2016
・Ou et al., ASCO 2017 abst.#9010
Foundation Core Databaseを利用してALK陽性肺癌患者634人を解析
Variant 1とVariant 3の患者が多かった
Variant 3では二次変異が多発し、有効な治療薬が乏しいG1202R変異を生じやすい
・肺癌診療ガイドライン2016ではAlectinib Grade A, Crizotinib Grade B, 化学療法 Grade C1
ランチョンセミナー3
<ALK陽性非小細胞肺癌の治療戦略とその実際>
・進行非小細胞肺癌の診断がついたら、次にするべきはEGFR、ALK、ROS1、PD-L1の確認
→全て陰性なら、Bevacizumabが使えるかどうかを判断するため、扁平上皮癌か非扁平上皮癌の鑑別をする
・2007年にALK融合遺伝子が発見された
EML4-ALKはリガンド非依存的に二量体を形成する
検索する手段は免疫染色、FISH、PCR
・ALK検査の手引き
ALK陽性の頻度が高い組織像ならば、免疫染色陰性でもFISHをしておきたい
・Park et al., PLoS ONE 2016
https://www.ncbi.nlm.nih.gov/pubmed/27518729
Lymphadenopathy, extranodal invasionがALK陽性肺癌で高頻度
・Yoshida et al., J Clin Oncol 2016
https://www.ncbi.nlm.nih.gov/pubmed/27354483
Crizotinibの効果とALK variantの関係
・Gainor et al., Clin Cancer Res, 4585-4593, 2016
https://www.ncbi.nlm.nih.gov/pubmed/27225694
EGFRやALKが陽性の場合、抗PD-1抗体が効きにくいが、その理由に言及
・EGFR遺伝子変異陽性ならCD73が高発現、そのため抗PD-1抗体の効果が出にくい
ASCO 2017 abst.#11505
http://abstracts.asco.org/199/AbstView_199_194449.html
・J-ALEX study, Hida et al., Lancet 2017
1レジメンまでの化学療法歴は可とした
ALK検索の手法として、IHC、FISH、PCRいずれも可とした
PSは0-2
1st line / 2nd lineでのサブグループ解析→Alectinib優位
IIIB, IV期 / 術後再発でのサブグループ解析→Alectinib優位
・Alectinibのcompoundとしての初回報告
Sakamoto et al., Cancer cell 679-690, 2011
https://www.ncbi.nlm.nih.gov/pubmed/21575866
・ALEX study, Peters et al., N Engl J Med 2017, Shaw et al., ASCO 2017 abst #LBA9008
Grobal study
未治療ALK陽性進行肺癌患者のみが対象
PSは0-2
層別化因子は人種、脳転移の有無、ALK検出法
無増悪生存期間中央値はAlectinibで未到達、Crizotinibで11.1ヶ月
ハザード比0.47(95%信頼区間は0.34-0.65)
P<0.0001
ASCO 2017における筆頭演者のコメントは、
“The large magnitude of benefit suggest that first line alectinib may be superior to sequential treatment with crizotinib and alectinib ( crizotinib followed by alectinib).”
“First line alectinib for ALK+ advanced NSCLC is ESTABLISHED.”
→「(J-ALEX studyの結果が明らかになってからというもの、Alectinibを1st lineで使用することと、Crizotinibを1st lineで使用したのちにAlectinibを使用することと、どちらがより全体としての治療成績を改善するのかという議論があるが)今回のALEX studyにおける、1st line Alectinibの優れた治療効果を目の当たりにすると、仮に逐次療法との比較を考えたとしても、1st line Alectinibが優れているだろうと考えざるを得ない」
「1st line Alectinibはもはや"確立された"治療といってよい」
・Tamura et al., J Clin Oncol 2017
AF-001JP試験の3年追跡結果
3年無増悪生存割合:62%(95%信頼区間は45-75%)
3年生存割合:78%(95%信頼区間は63-88%)
奏効割合:93.5%
奏効までの期間:0.7ヶ月(95%信頼区間は0.6-7.1ヶ月)
・Kodama et al., Cancer Chemother Pharmacol 1023-1025 2014
Alectinibは脳内への移行性良好
・Gadgeel et al., J Clin Oncol 2016
Pooled analysis of CNS response to alectinib
・PS不良患者に対するAlectinib:Iwama et al., J Thorac Oncol 2017
奏効割合 72.2%
PS改善割合 83.3%
無増悪生存期間中央値 10.1ヶ月
・ALK阻害薬耐性の機序は多彩
Gainor et al., Cancer Discov 1118-1133, 2016
・Ou et al., ASCO 2017 abst.#9010
Foundation Core Databaseを利用してALK陽性肺癌患者634人を解析
Variant 1とVariant 3の患者が多かった
Variant 3では二次変異が多発し、有効な治療薬が乏しいG1202R変異を生じやすい
・肺癌診療ガイドライン2016ではAlectinib Grade A, Crizotinib Grade B, 化学療法 Grade C1
2017年06月27日
量子コンピューターと人工知能
この数年というもの、人工知能の話題が尽きない。
チェス、将棋、囲碁の世界で、人間が人工知能にかなわないのは、もはや当たり前になった。
人工知能の社会進出によって様々な職種で人間が淘汰されると予測されているが、医師を含めた医療職もその中に含まれている。
人工知能という言葉自体はそんなに目新しいものではない。
スピルバーグ監督が映画を作るもっと前から、おぼろげな記憶では1980年代から、当時小学生だった私の耳にも届いていた言葉だ。
しかし、当時と今では、人工知能という同じ言葉が指し示す概念は、かなり違ったものに見える。
基盤となる理論や進歩が大きく変わってきたためなのだろうか。
理論面では、深層学習という概念が良く取り沙汰される。
コンピューター性能の向上と深層学習が相俟って、今日の人工知能の隆盛を築いているのだろう。
調べ物をしていたら、たまたま興味深い記事に行き当たったので、取り上げておくことにした。
https://www3.nhk.or.jp/news/web_tokushu/2017_0627.html?utm_int=news_contents_news-closeup_001
耳慣れない「量子コンピューター」なるものが6年前から登場しており、スーパーコンピューターを遥かに凌ぐ性能が期待されているらしい。
記事を読むと分かるが、その構造から性能まで、なんだかSF小説を読んでいるような感覚になる。
しかし、「無数の化合物から最も薬効の高いものを選び出して、新薬開発につなげる」といった作業を得意とする、などと記載されると、より効果が高く、より副作用の少ない薬の開発に大きく寄与するのではないかと、期待してしまう。
放射線治療の分野でも、「量子メス」なる次世代重粒子線治療開発プロジェクトが、産官合同で進んでいると聞く。
これからのがん治療開発では、「量子」が新たなキーワードになるかもしれない。
チェス、将棋、囲碁の世界で、人間が人工知能にかなわないのは、もはや当たり前になった。
人工知能の社会進出によって様々な職種で人間が淘汰されると予測されているが、医師を含めた医療職もその中に含まれている。
人工知能という言葉自体はそんなに目新しいものではない。
スピルバーグ監督が映画を作るもっと前から、おぼろげな記憶では1980年代から、当時小学生だった私の耳にも届いていた言葉だ。
しかし、当時と今では、人工知能という同じ言葉が指し示す概念は、かなり違ったものに見える。
基盤となる理論や進歩が大きく変わってきたためなのだろうか。
理論面では、深層学習という概念が良く取り沙汰される。
コンピューター性能の向上と深層学習が相俟って、今日の人工知能の隆盛を築いているのだろう。
調べ物をしていたら、たまたま興味深い記事に行き当たったので、取り上げておくことにした。
https://www3.nhk.or.jp/news/web_tokushu/2017_0627.html?utm_int=news_contents_news-closeup_001
耳慣れない「量子コンピューター」なるものが6年前から登場しており、スーパーコンピューターを遥かに凌ぐ性能が期待されているらしい。
記事を読むと分かるが、その構造から性能まで、なんだかSF小説を読んでいるような感覚になる。
しかし、「無数の化合物から最も薬効の高いものを選び出して、新薬開発につなげる」といった作業を得意とする、などと記載されると、より効果が高く、より副作用の少ない薬の開発に大きく寄与するのではないかと、期待してしまう。
放射線治療の分野でも、「量子メス」なる次世代重粒子線治療開発プロジェクトが、産官合同で進んでいると聞く。
これからのがん治療開発では、「量子」が新たなキーワードになるかもしれない。
2017年06月27日
いよいよ次世代シーケンサーが実地臨床導入へ
2017年6月22日、BRAF V600E陽性肺癌に対するdabrafenib+trametinib併用療法がFDAによって承認された。
https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm564331.htm
今回の承認は、BRF113928試験に基づいている。dabrafenib+trametinib併用療法を行った患者群93人(未治療36人、既治療57人)を解析したところ、既治療群での奏効割合は63%(95%信頼区間は49%から76%)、奏効持続期間中央値は12.6ヶ月だった。一方、未治療群での奏効割合は61%(95%信頼区間は44%から77%)、奏効持続期間中央値は解析時点で未到達だったが、59%の患者では6ヶ月以上の奏効持続が確認された。
本治療がFDA承認されたこと自体がもちろんニュースなのだが、特筆すべきは、コンパニオン診断として次世代シーケンサースクリーニングであるOncomine Dx Target Testが併せて承認されたことである。少なくともBRAF、ROS1、EGFR遺伝子異常検索は本検査で検索可能と記載されている。本検査でROS1、EGFRの異常が見つかった際に、それらに対応した治療をしてよいかどうかまでは述べられていないものの、次世代シーケンサーによるクリニカルシーケンスが実地臨床に導入されることになったという点で、dabrafenib+trametinib併用療法が承認されたことよりも遙かに画期的な出来事のように思われる。
https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm564331.htm
今回の承認は、BRF113928試験に基づいている。dabrafenib+trametinib併用療法を行った患者群93人(未治療36人、既治療57人)を解析したところ、既治療群での奏効割合は63%(95%信頼区間は49%から76%)、奏効持続期間中央値は12.6ヶ月だった。一方、未治療群での奏効割合は61%(95%信頼区間は44%から77%)、奏効持続期間中央値は解析時点で未到達だったが、59%の患者では6ヶ月以上の奏効持続が確認された。
本治療がFDA承認されたこと自体がもちろんニュースなのだが、特筆すべきは、コンパニオン診断として次世代シーケンサースクリーニングであるOncomine Dx Target Testが併せて承認されたことである。少なくともBRAF、ROS1、EGFR遺伝子異常検索は本検査で検索可能と記載されている。本検査でROS1、EGFRの異常が見つかった際に、それらに対応した治療をしてよいかどうかまでは述べられていないものの、次世代シーケンサーによるクリニカルシーケンスが実地臨床に導入されることになったという点で、dabrafenib+trametinib併用療法が承認されたことよりも遙かに画期的な出来事のように思われる。
2017年06月22日
クライオプローブお見積り
たまたま医療機器卸の営業の方とお目にかかることがあり、クライオプローブ一式の見積書を見せていただいた。
しめて8,000,000円前後・・・。
これで診療報酬には全く反映されないとなると、普通の経営感覚では予算はつけられないだろう・・・。
しめて8,000,000円前後・・・。
これで診療報酬には全く反映されないとなると、普通の経営感覚では予算はつけられないだろう・・・。
2017年06月20日
ROS1検査受託開始
新たにCrizotinibの治療対象となったROS1肺癌を見出すための検査ができるようになった。
6月16日から受付を開始したとのこと。




先週経気管支肺生検を行って診断がついた患者で、早速提出することにした。
院内に凍結保存していたブラシ細胞診洗浄液をEGFR、ROS1用として提出することにした。
こうすることで、計算上は全てのマーカーを調べるために21枚の未染プレパラートが必要なところを、11枚まで節約することができる。
関連した内容を、5月に開催した講演会のスライドから転載する。

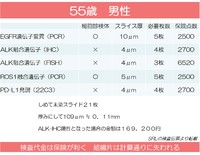



今回の患者は分化が特定しがたい病理像だったらしい。
TTF-1やNapsin-A、p40など、計7種類の追加免疫染色をしてよいかどうかという問い合わせがあったため、そのためにALKやPD-L1の評価ができなくなってはたまらないと回答し、ALK、PD-L1用のプレパラート確保を優先してもらうことにした。
その為の免疫染色と、ALK、PD-L1用の検体を確保すると、パラフィンブロックをほぼ使い切ってしまい、EGFRやROS1に回せる分は残らなかった。
ブラシ細胞診洗浄液を保管しておいて正解だった。
診断実務上、こうしておいた方がいいだろうという流れを書き残す。
診断過程において、密接に病理部門と連絡を取り合うことが何より肝要だ。
・経気管支肺生検時に、組織生検は通常鉗子でなるべく多く(10個が目標)、ブラシ細胞診をしてブラシ洗浄液を一部院内に保存し(最低でも2ml×2本)、できれば責任気管支での気管支洗浄液も採取しておく
・ブラシ洗浄液は、遠心分離して、ペレットを凍結保存する必要がある
→ブラシ洗浄液をそのまま凍結しておいて提出したら、「RNAが壊れてうまくPCRにかからない可能性があるから、次回からはペレットにして提出してください」とコメントされた
→実際には、ブラシ洗浄液からペレットを作成しても、ほとんど残らないかも。
・経気管支肺生検が終わった段階で、患者・家族に以下のように説明しておく。
「肺癌の診断がついた場合には治療法を選ぶために詳しい検査を行いますが、その際には保険点数として169,200円の検査を行う予定です。そのため、外来結果説明時の窓口請求が、検査代だけで1割負担なら16,920円、3割負担で50,760円と高額になります。予めご了承ください。なお、検査結果説明後にこれら検査をするか否かを話し合ってもよいですが、その場合には治療開始が1-4週間程度遅れる可能性があります」
・洗浄液中に腫瘍細胞が確認されたら、そちらからEGFR, ROS1検索を提出する
・組織診断がついた場合、扁平上皮癌であればPD-L1用の未染標本を作製してもらう
・組織診断がついた場合、非扁平上皮癌であればALK、PD-L1用の未染標本を作製してもらい、洗浄液中に腫瘍細胞が確認されなかった場合にはEGFR、ROS1用の未染標本も追加で作成してもらう
・組織診断がついた場合、非小細胞肺癌、分化不明であれば、ALK、PD-L1、さらに洗浄液中に腫瘍細胞が確認されなかった場合にはEGFR、ROS1用の未染標本を優先的に作製してもらい、その後余地があれば組織型を調べるための免疫染色をしてもらう
・検体不足で全ての予測因子を検索できない場合、頻度の高いものから調べる
・EGFRは優先されるべきだが、ALK、ROS1、PD-L1のどれを優先するかは年齢・性別・喫煙歴・病理像・臨床経過などの患者背景因子で判断する
初回診断時の効果予測因子検索のために、実費として169,200円の高額をかけるのがどうかという議論もあるかも知れないが、陽性となったときの治療選択に与えるインパクトや、その後の治療費節約、患者の生命予後の改善を考えると、かえって初期投資を手厚くした方が効率がいいように感じる。
少なくとも、効果予測因子検索もせずに年間10,000,000円単位のお金を使うよりは、よほど理に適っている。
6月16日から受付を開始したとのこと。




先週経気管支肺生検を行って診断がついた患者で、早速提出することにした。
院内に凍結保存していたブラシ細胞診洗浄液をEGFR、ROS1用として提出することにした。
こうすることで、計算上は全てのマーカーを調べるために21枚の未染プレパラートが必要なところを、11枚まで節約することができる。
関連した内容を、5月に開催した講演会のスライドから転載する。





今回の患者は分化が特定しがたい病理像だったらしい。
TTF-1やNapsin-A、p40など、計7種類の追加免疫染色をしてよいかどうかという問い合わせがあったため、そのためにALKやPD-L1の評価ができなくなってはたまらないと回答し、ALK、PD-L1用のプレパラート確保を優先してもらうことにした。
その為の免疫染色と、ALK、PD-L1用の検体を確保すると、パラフィンブロックをほぼ使い切ってしまい、EGFRやROS1に回せる分は残らなかった。
ブラシ細胞診洗浄液を保管しておいて正解だった。
診断実務上、こうしておいた方がいいだろうという流れを書き残す。
診断過程において、密接に病理部門と連絡を取り合うことが何より肝要だ。
・経気管支肺生検時に、組織生検は通常鉗子でなるべく多く(10個が目標)、ブラシ細胞診をしてブラシ洗浄液を一部院内に保存し(最低でも2ml×2本)、できれば責任気管支での気管支洗浄液も採取しておく
・ブラシ洗浄液は、遠心分離して、ペレットを凍結保存する必要がある
→ブラシ洗浄液をそのまま凍結しておいて提出したら、「RNAが壊れてうまくPCRにかからない可能性があるから、次回からはペレットにして提出してください」とコメントされた
→実際には、ブラシ洗浄液からペレットを作成しても、ほとんど残らないかも。
・経気管支肺生検が終わった段階で、患者・家族に以下のように説明しておく。
「肺癌の診断がついた場合には治療法を選ぶために詳しい検査を行いますが、その際には保険点数として169,200円の検査を行う予定です。そのため、外来結果説明時の窓口請求が、検査代だけで1割負担なら16,920円、3割負担で50,760円と高額になります。予めご了承ください。なお、検査結果説明後にこれら検査をするか否かを話し合ってもよいですが、その場合には治療開始が1-4週間程度遅れる可能性があります」
・洗浄液中に腫瘍細胞が確認されたら、そちらからEGFR, ROS1検索を提出する
・組織診断がついた場合、扁平上皮癌であればPD-L1用の未染標本を作製してもらう
・組織診断がついた場合、非扁平上皮癌であればALK、PD-L1用の未染標本を作製してもらい、洗浄液中に腫瘍細胞が確認されなかった場合にはEGFR、ROS1用の未染標本も追加で作成してもらう
・組織診断がついた場合、非小細胞肺癌、分化不明であれば、ALK、PD-L1、さらに洗浄液中に腫瘍細胞が確認されなかった場合にはEGFR、ROS1用の未染標本を優先的に作製してもらい、その後余地があれば組織型を調べるための免疫染色をしてもらう
・検体不足で全ての予測因子を検索できない場合、頻度の高いものから調べる
・EGFRは優先されるべきだが、ALK、ROS1、PD-L1のどれを優先するかは年齢・性別・喫煙歴・病理像・臨床経過などの患者背景因子で判断する
初回診断時の効果予測因子検索のために、実費として169,200円の高額をかけるのがどうかという議論もあるかも知れないが、陽性となったときの治療選択に与えるインパクトや、その後の治療費節約、患者の生命予後の改善を考えると、かえって初期投資を手厚くした方が効率がいいように感じる。
少なくとも、効果予測因子検索もせずに年間10,000,000円単位のお金を使うよりは、よほど理に適っている。
2017年06月15日
gefitinib術後補助療法 ADJUVANT / CTONG1104 study
肺癌完全切除後の再発率を下げるための術後補助化学療法。
これまでにも何度か取り扱った。
http://oitahaiganpractice.junglekouen.com/e359226.html
http://oitahaiganpractice.junglekouen.com/e601159.html
http://oitahaiganpractice.junglekouen.com/e599868.html
http://oitahaiganpractice.junglekouen.com/e854713.html
http://oitahaiganpractice.junglekouen.com/e820228.html
ASCO 2017において、中国から術後gefitinib補助療法に関する発表があった。
関連する過去の記事を以下に記載する。
http://oitahaiganpractice.junglekouen.com/d2016-01-05.html
http://oitahaiganpractice.junglekouen.com/d2014-07-07.html
有望な結果だと思っていたのだが、識者から寄せられたコストに関するコメントを見てちょっと驚いた。
413倍のコスト・・・。
確かに、全生存期間がどの程度延長されるのかを確認してからでないと、実臨床には持ち込めない。
コスト、コスト、コスト、だ。
こうなると、社会的な見地からすれば、この治療による社会へのコスト増と、この治療で長期延命した患者さんがどの程度社会へベネフィットを供せるのかを比較検討するのも必要だろう。
そして、我が国では同様のコンセプトでWJOG6410L-IMPACT studyが患者追跡期間中である。
私が個人的に尊敬する先生の肝煎りの試験でもあるし、日本人として、本試験の結果を待って実地臨床に活かしたい。
Adjuvant Gefitinib May Extend DFS in NSCLC With EGFR-Activating Mutations
June 5, 2017
EGFRチロシンキナーゼ阻害薬であるgefitinibは、EGFR遺伝子変異を有する非小細胞肺がん患者への術後補助療法として、シスプラチン+ビノレルビン併用療法と比較して無病生存期間を延長することが、無作為化第III相臨床試験であるADJUVANT trial(CTONG 1104)の結果としてASCO 2017, abst.# 8500で報告された。
本試験では、完全切除されたII期からIIIA期(N1-N2)のEGFR遺伝子変異陽性非小細胞肺がん患者を対象に、無作為にgefitinib群(111人)とシスプラチン+ビノレルビン併用群(111人)に無作為割付した。
intent-to-treat解析において、無病生存期間はgefitinib群で有意に延長していた(無病生存期間中央値はgefitinib群で28.7ヶ月、シスプラチン+ビノレルビン群で18.0ヶ月、ハザード比は0.60、95%信頼区間は0.42-0.87、p=0.005)。3年無病生存割合はそれぞれ34%と27%だった。性別、喫煙状態、EGFR遺伝子変異型、リンパ節転移範囲、組織型といったサブグループ解析を行っても、全体の傾向と同様にgefitinib群で優れる傾向だった。
全生存期間のデータは未確定だが、複数のエキスパートは全生存期間こそが重要なエンドポイントだと主張している。
「無病生存期間の生存曲線は、3年経過後は曲線が重なり始めたように見えており、生存期間の後半でどんなことが起こっているのか明らかにするのが重要だ」
とのことだ。
もうひとつ議論の的になる点は、シスプラチン+ビノレルビン併用療法群において治療を拒否する患者が多かったことだ。シスプラチン+ビノレルビン群で23人(21%)がプロトコール治療を拒否したが、gefitinib群では5人(5%)程度だった。シスプラチン+ビノレルビン群に割り付けられ、プロトコール治療を拒否した患者もintent-to-treat解析には含まれており、結果に影響している可能性がある。実治療群間の解析は今回報告されなかった。
gefitinib群はシスプラチン+ビノレルビン群に比べて有害事象も軽微だった。好中球減少、貧血、白血球減少、骨髄抑制、嘔気、嘔吐、食欲不振の点において、gefitinib群の方が頻度が少なかった。一方で、gefitinib群の方が皮疹、肝機能障害、下痢の頻度が高く、ごく一部に重症の患者もいた。Grade 3以上の有害事象はgefitinib群の12%に、シスプラチン+ビノレルビン群の48%に認めた。gefitinib群では、シスプラチン+ビノレルビン群と比較して健康関連QoLが有意に改善していた。
今回の発表者は、sEGFRm陽性の術後非小細胞肺癌患者に対する術後gefitinib補助療法は術後再発の時期を遅らせ、N1領域もしくはN2領域にリンパ節転移のあった完全切除後sEGFRm陽性非小細胞肺癌患者に対して優先されてよい治療だ、と結論している。




識者からは、以下のようなコメントが寄せられた。
・比較的進行度の高い完全切除後非小細胞肺癌患者に対して、術後補助化学療法はいまもって標準治療だが、その生存期間延長効果はそこそこでしかない
・そのうえ、術後補助化学療法の恩恵が期待できる患者を実地臨床で選択するために有効なバイオマーカーは(ERCC1等の報告はあるものの)、いまのところ見つかっていない
・そうした点を踏まえると、今回の結果はとても興味深い
・同様の検討としては、BR19試験やRADIANT試験が既に報告されているが、術後補助療法としてのEGFR-TKI療法には限られた効果しかなかった。
・RADIANT試験では、sEGFRm陽性患者を対象としたサブセット解析で、erlotinibはプラセボに対して有意に優れていた
・術後補助療法としてのコストを考えたとき、シスプラチン+ビノレルビン併用療法では447ドル、gefitinib療法では184,879ドルかかる
・実治療群間毎の生存期間延長効果とコストを総合的に見て、術後gefitinib補助療法が本当に意義のある治療なのか考えねばならない
これまでにも何度か取り扱った。
http://oitahaiganpractice.junglekouen.com/e359226.html
http://oitahaiganpractice.junglekouen.com/e601159.html
http://oitahaiganpractice.junglekouen.com/e599868.html
http://oitahaiganpractice.junglekouen.com/e854713.html
http://oitahaiganpractice.junglekouen.com/e820228.html
ASCO 2017において、中国から術後gefitinib補助療法に関する発表があった。
関連する過去の記事を以下に記載する。
http://oitahaiganpractice.junglekouen.com/d2016-01-05.html
http://oitahaiganpractice.junglekouen.com/d2014-07-07.html
有望な結果だと思っていたのだが、識者から寄せられたコストに関するコメントを見てちょっと驚いた。
413倍のコスト・・・。
確かに、全生存期間がどの程度延長されるのかを確認してからでないと、実臨床には持ち込めない。
コスト、コスト、コスト、だ。
こうなると、社会的な見地からすれば、この治療による社会へのコスト増と、この治療で長期延命した患者さんがどの程度社会へベネフィットを供せるのかを比較検討するのも必要だろう。
そして、我が国では同様のコンセプトでWJOG6410L-IMPACT studyが患者追跡期間中である。
私が個人的に尊敬する先生の肝煎りの試験でもあるし、日本人として、本試験の結果を待って実地臨床に活かしたい。
Adjuvant Gefitinib May Extend DFS in NSCLC With EGFR-Activating Mutations
June 5, 2017
EGFRチロシンキナーゼ阻害薬であるgefitinibは、EGFR遺伝子変異を有する非小細胞肺がん患者への術後補助療法として、シスプラチン+ビノレルビン併用療法と比較して無病生存期間を延長することが、無作為化第III相臨床試験であるADJUVANT trial(CTONG 1104)の結果としてASCO 2017, abst.# 8500で報告された。
本試験では、完全切除されたII期からIIIA期(N1-N2)のEGFR遺伝子変異陽性非小細胞肺がん患者を対象に、無作為にgefitinib群(111人)とシスプラチン+ビノレルビン併用群(111人)に無作為割付した。
intent-to-treat解析において、無病生存期間はgefitinib群で有意に延長していた(無病生存期間中央値はgefitinib群で28.7ヶ月、シスプラチン+ビノレルビン群で18.0ヶ月、ハザード比は0.60、95%信頼区間は0.42-0.87、p=0.005)。3年無病生存割合はそれぞれ34%と27%だった。性別、喫煙状態、EGFR遺伝子変異型、リンパ節転移範囲、組織型といったサブグループ解析を行っても、全体の傾向と同様にgefitinib群で優れる傾向だった。
全生存期間のデータは未確定だが、複数のエキスパートは全生存期間こそが重要なエンドポイントだと主張している。
「無病生存期間の生存曲線は、3年経過後は曲線が重なり始めたように見えており、生存期間の後半でどんなことが起こっているのか明らかにするのが重要だ」
とのことだ。
もうひとつ議論の的になる点は、シスプラチン+ビノレルビン併用療法群において治療を拒否する患者が多かったことだ。シスプラチン+ビノレルビン群で23人(21%)がプロトコール治療を拒否したが、gefitinib群では5人(5%)程度だった。シスプラチン+ビノレルビン群に割り付けられ、プロトコール治療を拒否した患者もintent-to-treat解析には含まれており、結果に影響している可能性がある。実治療群間の解析は今回報告されなかった。
gefitinib群はシスプラチン+ビノレルビン群に比べて有害事象も軽微だった。好中球減少、貧血、白血球減少、骨髄抑制、嘔気、嘔吐、食欲不振の点において、gefitinib群の方が頻度が少なかった。一方で、gefitinib群の方が皮疹、肝機能障害、下痢の頻度が高く、ごく一部に重症の患者もいた。Grade 3以上の有害事象はgefitinib群の12%に、シスプラチン+ビノレルビン群の48%に認めた。gefitinib群では、シスプラチン+ビノレルビン群と比較して健康関連QoLが有意に改善していた。
今回の発表者は、sEGFRm陽性の術後非小細胞肺癌患者に対する術後gefitinib補助療法は術後再発の時期を遅らせ、N1領域もしくはN2領域にリンパ節転移のあった完全切除後sEGFRm陽性非小細胞肺癌患者に対して優先されてよい治療だ、と結論している。




識者からは、以下のようなコメントが寄せられた。
・比較的進行度の高い完全切除後非小細胞肺癌患者に対して、術後補助化学療法はいまもって標準治療だが、その生存期間延長効果はそこそこでしかない
・そのうえ、術後補助化学療法の恩恵が期待できる患者を実地臨床で選択するために有効なバイオマーカーは(ERCC1等の報告はあるものの)、いまのところ見つかっていない
・そうした点を踏まえると、今回の結果はとても興味深い
・同様の検討としては、BR19試験やRADIANT試験が既に報告されているが、術後補助療法としてのEGFR-TKI療法には限られた効果しかなかった。
・RADIANT試験では、sEGFRm陽性患者を対象としたサブセット解析で、erlotinibはプラセボに対して有意に優れていた
・術後補助療法としてのコストを考えたとき、シスプラチン+ビノレルビン併用療法では447ドル、gefitinib療法では184,879ドルかかる
・実治療群間毎の生存期間延長効果とコストを総合的に見て、術後gefitinib補助療法が本当に意義のある治療なのか考えねばならない
2017年06月13日
ご家族の思い
肺がん診療をしていても、自分の患者さんが亡くなった場合、そのご家族と後々までお付き合いする機会はあまりない。
本ブログの読者の方から、以下のようなコメントを頂いた。
内容を拝見して、涙腺が緩んだ。
奥さまを亡くし、残されたこのご主人は、おそらく私と同じ世代の方だろう。
「子供に手を取られて随分と遅くなった」
「まだ何と無く肺癌の記事を読んでしまう」
「ウチはもう患者家族から卒業した」
というところは、淡々と書かれてはいるものの、つらいお気持ちは察するに余りある。
本ブログは、患者さんやご家族のみならず、肺がんにかかわる様々な職種の方がときどき眺めてくださっているようで、このところいろんな形で、いろんな人から声をかけていただいている。
内容には「私自身の興味」というバイアスが大きくかかっているので万人にはお勧めできないのだが、今回いただいたコメントは、是非読者の方々と共有したい。
そして、稀なケース、エビデンスでは太刀打ちできないケースに向き合ったとき、本人やご家族、医療者がいかにもがき苦しんで、エビデンスのないところで奮闘しているのか、診療経過から感じてほしい。
ご一読を。
http://oitahaiganpractice.junglekouen.com/e896441.html
2月の肺癌学会アンケートの際にコメントさせて頂いた者です。その節は暖かいコメントを本当に本当にありがとうございました。
子供に手を取られて随分と遅くなったのですが本記事に少し関わる情報かと思うので素人考えですがご知見の一つにと思いコメントさせて頂きます。まだ何と無く肺癌の記事を読んでしまいます。
ウチの妻が、非小細胞肺腺癌から小細胞に変異したのか元から居たのか分かりませんが、大きな影響を受けた様です。レアケースなのでしょうか?
これから耐性と戦って行くと色んな変異が起こり、色んな可能性を想定してマルチラインに対応して頂かないといけないのかもしれません。
以下に経緯を書かせて頂きます。コメントなどは不要です。臨床の一例として先生の一情報となれば幸いです。
ウチはもう患者家族から卒業しましたが患者さんが少しでも減り、良い治療を受けられます様に祈念しております。影ながら応援しております。
・42歳女性 健診胸部X線で胸水まで見える。
この3ヶ月ぐらい前から幹部側の胸の表皮に極軽い皮疹。ピリピリした痛みを少し感じる程度。皮膚科でも帯状疱疹では?とか言われる程度でした。
・生検でEGFR変異 L858変異と診断。胸椎、骨板等転移でSTAGE Ⅳの診断。
・イレッサ後に肝機能悪化。ここで転居、転院。
その後タルセバへ。
・全体SDもその後胸椎転移の溶骨で圧迫骨折寸前でカルパクイレッサと放射線治療。
・タルセバに戻すもその後PD
・シス+アリムタ+アバスチン。
・ドセ 。脳転移あり、ガンマ。
・ジェムザール、カルセド 。
・PD後 癌性髄膜炎状態に。歩行困難。ガンマも追加出来ずタルセバ。
・タグリッソ個人輸入で手配。3ヶ月弱服用で劇的回復。その後無償供与にも参加。(事前検査でT790M検査済)
ただしこの段階で脊椎に増骨性転移も。
・PD。肝転移が拡大。
●ここで鎖骨のリンパ節が腫脹。
小細胞では首周りのリンパ節が良く腫れるそうですが主治医の判断でマーカーを取るとNSEが異常値との事でカルボ+イリノテカンでまた大幅縮小。ただし肝臓はあまり縮小せず。
※少なくともこの時点では小細胞要素が多分にあり、イリノテカンが効いたのではないかと推測。NSEも一気に改善。
・しばらくSDも肝転移が憎悪、ニボルマブ切替を検討するも貧血、血小板減少が加速。
輸血しながら肝塞栓療法を検討するも血小板が増えず。緩和に。
・最終 DICにて死去。
年齢も有るのか多様な要素が入り混じった感が主治医には有った様です。
治療(OS?)45ヶ月でした。
以上
本ブログの読者の方から、以下のようなコメントを頂いた。
内容を拝見して、涙腺が緩んだ。
奥さまを亡くし、残されたこのご主人は、おそらく私と同じ世代の方だろう。
「子供に手を取られて随分と遅くなった」
「まだ何と無く肺癌の記事を読んでしまう」
「ウチはもう患者家族から卒業した」
というところは、淡々と書かれてはいるものの、つらいお気持ちは察するに余りある。
本ブログは、患者さんやご家族のみならず、肺がんにかかわる様々な職種の方がときどき眺めてくださっているようで、このところいろんな形で、いろんな人から声をかけていただいている。
内容には「私自身の興味」というバイアスが大きくかかっているので万人にはお勧めできないのだが、今回いただいたコメントは、是非読者の方々と共有したい。
そして、稀なケース、エビデンスでは太刀打ちできないケースに向き合ったとき、本人やご家族、医療者がいかにもがき苦しんで、エビデンスのないところで奮闘しているのか、診療経過から感じてほしい。
ご一読を。
http://oitahaiganpractice.junglekouen.com/e896441.html
2月の肺癌学会アンケートの際にコメントさせて頂いた者です。その節は暖かいコメントを本当に本当にありがとうございました。
子供に手を取られて随分と遅くなったのですが本記事に少し関わる情報かと思うので素人考えですがご知見の一つにと思いコメントさせて頂きます。まだ何と無く肺癌の記事を読んでしまいます。
ウチの妻が、非小細胞肺腺癌から小細胞に変異したのか元から居たのか分かりませんが、大きな影響を受けた様です。レアケースなのでしょうか?
これから耐性と戦って行くと色んな変異が起こり、色んな可能性を想定してマルチラインに対応して頂かないといけないのかもしれません。
以下に経緯を書かせて頂きます。コメントなどは不要です。臨床の一例として先生の一情報となれば幸いです。
ウチはもう患者家族から卒業しましたが患者さんが少しでも減り、良い治療を受けられます様に祈念しております。影ながら応援しております。
・42歳女性 健診胸部X線で胸水まで見える。
この3ヶ月ぐらい前から幹部側の胸の表皮に極軽い皮疹。ピリピリした痛みを少し感じる程度。皮膚科でも帯状疱疹では?とか言われる程度でした。
・生検でEGFR変異 L858変異と診断。胸椎、骨板等転移でSTAGE Ⅳの診断。
・イレッサ後に肝機能悪化。ここで転居、転院。
その後タルセバへ。
・全体SDもその後胸椎転移の溶骨で圧迫骨折寸前でカルパクイレッサと放射線治療。
・タルセバに戻すもその後PD
・シス+アリムタ+アバスチン。
・ドセ 。脳転移あり、ガンマ。
・ジェムザール、カルセド 。
・PD後 癌性髄膜炎状態に。歩行困難。ガンマも追加出来ずタルセバ。
・タグリッソ個人輸入で手配。3ヶ月弱服用で劇的回復。その後無償供与にも参加。(事前検査でT790M検査済)
ただしこの段階で脊椎に増骨性転移も。
・PD。肝転移が拡大。
●ここで鎖骨のリンパ節が腫脹。
小細胞では首周りのリンパ節が良く腫れるそうですが主治医の判断でマーカーを取るとNSEが異常値との事でカルボ+イリノテカンでまた大幅縮小。ただし肝臓はあまり縮小せず。
※少なくともこの時点では小細胞要素が多分にあり、イリノテカンが効いたのではないかと推測。NSEも一気に改善。
・しばらくSDも肝転移が憎悪、ニボルマブ切替を検討するも貧血、血小板減少が加速。
輸血しながら肝塞栓療法を検討するも血小板が増えず。緩和に。
・最終 DICにて死去。
年齢も有るのか多様な要素が入り混じった感が主治医には有った様です。
治療(OS?)45ヶ月でした。
以上
2017年06月13日
クライオプローブ、発売まで秒読み段階
先日長崎市で開催された日本呼吸器内視鏡学会総会で、3年ぶりにクライオプローブが企業展示ブースに並べられていた。
いよいよこの8月に発売となるらしい。
一式の想定価格は800万円程度とのこと。
大きな組織が取れる、きれいな病理所見が得られる、など、病理診断・免疫染色、遺伝子診断の面ではメリットが多い。
一方、クライオプローブを使ったからといって、通常生検と全く異なる検査所見が得られるわけではないので、追加の診療報酬は出ないだろう。
この点は、ラジアル型EBUSプローブと同じで、診断精度は上がるものの、それにかかるコストは患者ではなく病院が負担することになる。
したがって、クライオプローブも、ごく限られた医療機関にしか普及しない可能性が高い。
だからこそ大学病院などでは積極的に採用すべきだろう。
国立がん研究センター東病院では、クライオプローブ生検の安全性を検証する臨床試験が現在も続けられている。
登録予定症例数は200人、これまでのところ67人まで終了したとのこと。
少なくとも数字の上では合併症のリスクは同等で、より良質な大きな検体が取れる一方で、生検個数が少ない、手技に熟練を要する、最終的に評価可能な標本を作製できる割合がやや落ちるといった問題も出てきている様子。
そして、今回の学会発表において、座長からは、
「診断技術に関わるこうした検討で、主要評価項目が”安全性”というのはあまり類を見ない」
「よく倫理審査委員会が許可したものだ」
「万が一、主要評価項目の安全性が担保できなかったなら、クライオプローブ自体の商品化・市販の道が閉ざされかねない」
「安全性が担保できたとして、従来の鉗子生検に比べて、患者にはどのようなメリットがあるのか」
といった、「座長の質問としてはあまり類を見ない」厳しい内容の質問が矢継ぎ早に飛んでいた。
私の主観から言わせてもらえれば、採取される検体の質という点では、鉗子生検とクライオプローブ生検では比較にならない。
比較対象となるならば、外科生検とクライオプローブ生検だろう。
全身麻酔下外科生検とクライオプローブ生検、どちらが患者の満足度が高いかを検証する比較試験をするとよい。
さりとて、現行の肺癌診療では、通常生検で必要十分な結果が得られることが多いのも事実である。
実際に、当院のような普通の私立病院でも、通常生検でLC-SCRUM用の検体採取に事足りている。
クライオプローブは綺麗な・豊富な検体が採取できるという点ではいい検査だが、鉗子生検と比較してどんなメリットが患者にあるのかという命題に答えるのはなかなか難しい。
間質性肺炎の外科生検の代替手段としては、かなり有望だと思われるのだが。








いよいよこの8月に発売となるらしい。
一式の想定価格は800万円程度とのこと。
大きな組織が取れる、きれいな病理所見が得られる、など、病理診断・免疫染色、遺伝子診断の面ではメリットが多い。
一方、クライオプローブを使ったからといって、通常生検と全く異なる検査所見が得られるわけではないので、追加の診療報酬は出ないだろう。
この点は、ラジアル型EBUSプローブと同じで、診断精度は上がるものの、それにかかるコストは患者ではなく病院が負担することになる。
したがって、クライオプローブも、ごく限られた医療機関にしか普及しない可能性が高い。
だからこそ大学病院などでは積極的に採用すべきだろう。
国立がん研究センター東病院では、クライオプローブ生検の安全性を検証する臨床試験が現在も続けられている。
登録予定症例数は200人、これまでのところ67人まで終了したとのこと。
少なくとも数字の上では合併症のリスクは同等で、より良質な大きな検体が取れる一方で、生検個数が少ない、手技に熟練を要する、最終的に評価可能な標本を作製できる割合がやや落ちるといった問題も出てきている様子。
そして、今回の学会発表において、座長からは、
「診断技術に関わるこうした検討で、主要評価項目が”安全性”というのはあまり類を見ない」
「よく倫理審査委員会が許可したものだ」
「万が一、主要評価項目の安全性が担保できなかったなら、クライオプローブ自体の商品化・市販の道が閉ざされかねない」
「安全性が担保できたとして、従来の鉗子生検に比べて、患者にはどのようなメリットがあるのか」
といった、「座長の質問としてはあまり類を見ない」厳しい内容の質問が矢継ぎ早に飛んでいた。
私の主観から言わせてもらえれば、採取される検体の質という点では、鉗子生検とクライオプローブ生検では比較にならない。
比較対象となるならば、外科生検とクライオプローブ生検だろう。
全身麻酔下外科生検とクライオプローブ生検、どちらが患者の満足度が高いかを検証する比較試験をするとよい。
さりとて、現行の肺癌診療では、通常生検で必要十分な結果が得られることが多いのも事実である。
実際に、当院のような普通の私立病院でも、通常生検でLC-SCRUM用の検体採取に事足りている。
クライオプローブは綺麗な・豊富な検体が採取できるという点ではいい検査だが、鉗子生検と比較してどんなメリットが患者にあるのかという命題に答えるのはなかなか難しい。
間質性肺炎の外科生検の代替手段としては、かなり有望だと思われるのだが。








2017年06月10日
Studies Explore Targeted Therapies in Lung Cancer
HER2関連肺癌とMET exon 14 skipping mutationの話題。
自分の患者でもそうだったが、HER2陽性肺癌の治療はまだまだ難しいようだ。
HER2関連肺癌に対しては、抗体医薬でなく小分子化合物が開発されるまではあまり期待できないかもしれない。
MET exon 14 skipping mutationに対しては、他のDriver oncogene陽性肺癌と同様、よりupfrontに分子標的薬を、抗体医薬は最後の方で、というのがよさそうだ。
HER2はともかく、MET exon 14 skipping mutationははやく実地臨床で利用できるようになってほしい。
Studies Explore Targeted Therapies in Lung Cancer
June 6, 2017
6月4日に開催されたASCO2017のClinical Science Symposium "Old Targets, New Drugs: HER2 and MET” で、進行非小細胞肺癌を含む肺がん患者に対する新しいコンセプトの分子標的療法について4つの発表があった。比較的稀な遺伝子異常を対象にした研究であり、共同研究を継続することが重要だと強調されていた。
・HER2を過剰発現した非小細胞肺癌に対するT-DM1療法(ASCO 2017 abst.#8509)
HER2の免疫染色で2+ / 3+と過剰発現が認められた化学療法既治療の進行非小細胞肺癌患者に対するT-DM1療法の有効性を検証する第II相試験の結果が報告された。
HER2過剰発現、HER2遺伝子増幅、HER遺伝子変異といったHER2の異常は、非小細胞肺癌患者の一部で認められる。乳癌とは対照的に、非小細胞肺癌におけるHER2遺伝子増幅はいつもHER2過剰発現と相関しているとは限らない。しかしながら、HER2過剰発現は非小細胞肺癌の予後不良因子である。一般に、HER2遺伝子増幅とHER2遺伝子変異は非小細胞肺癌においては相互排他的な現象で、並存することはない。
非小細胞肺癌におけるHER2異常の頻度は検査手法や判定基準によってさまざまだが、免疫染色で3+と評価される程度の過剰発現や、遺伝子増幅あるいは遺伝子変異は、最高でも6%程度といわれている。
本研究では393人の患者をHER2免疫染色でスクリーニングして、40人がHER2過剰発現陽性だった。その内訳は、20人がHER2 2+, 20人がHER2 3+だった。それぞれのコホートに対し、T-DM1を3.6mg/kgの投与量で3週間ごとに治療した。
追跡期間中央値が16ヶ月の段階で評価したところ、奏効割合はHER2 2+のコホートでは0%、HER2 3+のコホートでは20%だった。腫瘍が縮小した患者では、そのほとんどで治療開始後速やかに治療効果が得られた。治療継続期間中央値はそれぞれ1.4ヶ月、2.1ヶ月だった。全体の無増悪生存期間中央値は2.6ヶ月、生存期間中央値は12.2ヶ月だった。想定外の有害事象は認めなかった。
探索的バイオマーカー研究を行ったところ、HER2 3+で、かつ次世代シーケンサーでHER2遺伝子増幅が確認された患者では治療効果が期待できそうだった。こうした基準を満たした5人の患者のうち、2人でT-DM1が奏効していた。
・HER2遺伝子変異を伴う肺癌に対するT-DM1療法(ASCO 2017 abst.#8510)
HER2遺伝子増幅あるいは遺伝子変異を伴う進行固形癌患者に対するT-DM1療法の有効性を検証する臓器横断的な第II相basket trialの結果の一部が報告された。このなかにはHER2遺伝子変異を伴う肺癌患者も含まれており、別個に検証された。
今回の研究はHER2遺伝子変異を有する患者に限定して行われた。対象となった18人の患者の前治療中央値は2レジメンだった。72%の患者は女性で、39%は非喫煙者だった。この患者群において、T-DM1を標準的な方法で投与したところ、奏効割合は44%、無増悪生存期間中央値は4ヶ月だった。奏効持続期間中央値は5ヶ月だった。奏効した患者の中には、奏効の基準を満たすまでに3-4ヶ月かかった患者もいた。
T-DM1療法が奏効した患者のうち50%は過去にHER2に対する分子標的治療を受けていたが、既往の抗HER2療法とT-DM1療法に対する反応性の間に相関は見られなかった。infusion reactionが想定より多かったことを除いては、安全性のデータはほぼ予想通りだった。
付随研究を行ったところ、HER2過剰発現は治療反応性に関係していなかった。
・MET遺伝子変異を有する非小細胞肺がん患者に対するMET阻害薬療法(ASCO 2017 abst.#8511)
MET exon 14遺伝子変異陽性非小細胞肺癌患者に対するMET阻害薬の効果に関するレトロスペクティブ研究の結果が報告された。MET exon 14遺伝子変異は非小細胞肺癌の3%に認められる。こうした患者に対するMET阻害薬の治療効果について、小規模な症例報告はこれまでにされていた。Crizotinibが既に一般臨床に広く浸透していること、試験プロトコールにクロスオーバーや病勢進行後の治療が盛り込まれるのが一般的であるがために、MET exon 14遺伝子変異陽性患者を対象としたランダム化試験で生存期間延長効果を証明するのは難しいだろうと目されている。
この患者群に対するMETチロシンキナーゼ阻害薬の効果を検証するために、MET exon 14遺伝子変異陽性の進行非小細胞肺癌患者61人(34人はMETチロシンキナーゼ阻害薬治療歴なし、27人は治療歴あり)を対象に、レトロスペクティブ研究を行った。使用されたMETチロシンキナーゼ阻害薬は、crizotinib(20人は保険外診療で、4人は臨床試験で使用)、glesatinib(4人)、capmatinib(3人)だった。数人の患者は、複数のチロシンキナーゼ阻害薬を使用していた。患者の57%は女性で、39人は非喫煙者、30%は診断時に既にIV期と診断されていた。
METチロシンキナーゼ阻害薬を使用した患者の生存期間中央値は24.6ヶ月、使用しなかった患者では8.1ヶ月だった。crizotinibを使用した患者に限って言えば、生存期間中央値は20.5ヶ月、無増悪生存期間中央値は7.4ヶ月だった。
METチロシンキナーゼ阻害薬を使用した患者では、使用しなかった患者に対して、他の薬物療法を受けた患者が有意に多かった(p<0.001)。また、PD-1阻害薬の投与を受けた患者も、METチロシンキナーゼ阻害薬を使用した患者で有意に多かった(37% vs 9%, p=0.01)。
・MET遺伝子変異陽性非小細胞肺癌患者に対する免疫チェックポイント阻害薬の有効性(ASCO 2017 abst.#8512)
MET exon 14遺伝子変異陽性非小細胞肺癌患者81人を対象に、PD-L1発現状態と免疫チェックポイント阻害薬の効果を検証した。
81人の解析において、免疫染色でPD-L1の発現を見た患者は54人(67%)だった。その約半数(46%)で、PD-L1を発現しているがん細胞がが50%以上と高発現の状態だった。PD-L1発現細胞が1-49%の患者は19%、PD-L1発現陰性(発現細胞1%未満)の患者は35%だった。PD-L1発現状態とその他の背景因子に相関は見られなかった。
78人のMET exon 14遺伝子変異陽性非小細胞肺がん患者と、1,769人の非小細胞肺がん患者コホートとの間でTumor Mutational Burden(TMB)を比較したところ、前者では有意にTMBが低かった(3.8変異/megabase vs 5.7変異/megabase, p=0.0006)。PD-L1発現とTMBの間に有意な相関はなかった。
MET exon 14遺伝子変異陽性患者で免疫チェックポイント阻害薬の治療を受け、効果判定が出来た患者は15人だった。14人は抗PD-1抗体もしくは抗PD-L1抗体の単剤療法を受け、1人だけは抗PD-1抗体と抗CTLA-4抗体併用療法を受けていた。6人は、過去に治療歴のない患者だった。
この患者群において、免疫チェックポイント阻害薬の治療効果は不良(奏効割合は6.7%)で、PD-L1発現は効果予測因子としては役に立たなかった。PD-L1高発現の6人の患者でも、奏効は得られなかった。TMBですら効果予測因子とならず、TMB高値の患者でも奏効は得られなかった。
自分の患者でもそうだったが、HER2陽性肺癌の治療はまだまだ難しいようだ。
HER2関連肺癌に対しては、抗体医薬でなく小分子化合物が開発されるまではあまり期待できないかもしれない。
MET exon 14 skipping mutationに対しては、他のDriver oncogene陽性肺癌と同様、よりupfrontに分子標的薬を、抗体医薬は最後の方で、というのがよさそうだ。
HER2はともかく、MET exon 14 skipping mutationははやく実地臨床で利用できるようになってほしい。
Studies Explore Targeted Therapies in Lung Cancer
June 6, 2017
6月4日に開催されたASCO2017のClinical Science Symposium "Old Targets, New Drugs: HER2 and MET” で、進行非小細胞肺癌を含む肺がん患者に対する新しいコンセプトの分子標的療法について4つの発表があった。比較的稀な遺伝子異常を対象にした研究であり、共同研究を継続することが重要だと強調されていた。
・HER2を過剰発現した非小細胞肺癌に対するT-DM1療法(ASCO 2017 abst.#8509)
HER2の免疫染色で2+ / 3+と過剰発現が認められた化学療法既治療の進行非小細胞肺癌患者に対するT-DM1療法の有効性を検証する第II相試験の結果が報告された。
HER2過剰発現、HER2遺伝子増幅、HER遺伝子変異といったHER2の異常は、非小細胞肺癌患者の一部で認められる。乳癌とは対照的に、非小細胞肺癌におけるHER2遺伝子増幅はいつもHER2過剰発現と相関しているとは限らない。しかしながら、HER2過剰発現は非小細胞肺癌の予後不良因子である。一般に、HER2遺伝子増幅とHER2遺伝子変異は非小細胞肺癌においては相互排他的な現象で、並存することはない。
非小細胞肺癌におけるHER2異常の頻度は検査手法や判定基準によってさまざまだが、免疫染色で3+と評価される程度の過剰発現や、遺伝子増幅あるいは遺伝子変異は、最高でも6%程度といわれている。
本研究では393人の患者をHER2免疫染色でスクリーニングして、40人がHER2過剰発現陽性だった。その内訳は、20人がHER2 2+, 20人がHER2 3+だった。それぞれのコホートに対し、T-DM1を3.6mg/kgの投与量で3週間ごとに治療した。
追跡期間中央値が16ヶ月の段階で評価したところ、奏効割合はHER2 2+のコホートでは0%、HER2 3+のコホートでは20%だった。腫瘍が縮小した患者では、そのほとんどで治療開始後速やかに治療効果が得られた。治療継続期間中央値はそれぞれ1.4ヶ月、2.1ヶ月だった。全体の無増悪生存期間中央値は2.6ヶ月、生存期間中央値は12.2ヶ月だった。想定外の有害事象は認めなかった。
探索的バイオマーカー研究を行ったところ、HER2 3+で、かつ次世代シーケンサーでHER2遺伝子増幅が確認された患者では治療効果が期待できそうだった。こうした基準を満たした5人の患者のうち、2人でT-DM1が奏効していた。
・HER2遺伝子変異を伴う肺癌に対するT-DM1療法(ASCO 2017 abst.#8510)
HER2遺伝子増幅あるいは遺伝子変異を伴う進行固形癌患者に対するT-DM1療法の有効性を検証する臓器横断的な第II相basket trialの結果の一部が報告された。このなかにはHER2遺伝子変異を伴う肺癌患者も含まれており、別個に検証された。
今回の研究はHER2遺伝子変異を有する患者に限定して行われた。対象となった18人の患者の前治療中央値は2レジメンだった。72%の患者は女性で、39%は非喫煙者だった。この患者群において、T-DM1を標準的な方法で投与したところ、奏効割合は44%、無増悪生存期間中央値は4ヶ月だった。奏効持続期間中央値は5ヶ月だった。奏効した患者の中には、奏効の基準を満たすまでに3-4ヶ月かかった患者もいた。
T-DM1療法が奏効した患者のうち50%は過去にHER2に対する分子標的治療を受けていたが、既往の抗HER2療法とT-DM1療法に対する反応性の間に相関は見られなかった。infusion reactionが想定より多かったことを除いては、安全性のデータはほぼ予想通りだった。
付随研究を行ったところ、HER2過剰発現は治療反応性に関係していなかった。
・MET遺伝子変異を有する非小細胞肺がん患者に対するMET阻害薬療法(ASCO 2017 abst.#8511)
MET exon 14遺伝子変異陽性非小細胞肺癌患者に対するMET阻害薬の効果に関するレトロスペクティブ研究の結果が報告された。MET exon 14遺伝子変異は非小細胞肺癌の3%に認められる。こうした患者に対するMET阻害薬の治療効果について、小規模な症例報告はこれまでにされていた。Crizotinibが既に一般臨床に広く浸透していること、試験プロトコールにクロスオーバーや病勢進行後の治療が盛り込まれるのが一般的であるがために、MET exon 14遺伝子変異陽性患者を対象としたランダム化試験で生存期間延長効果を証明するのは難しいだろうと目されている。
この患者群に対するMETチロシンキナーゼ阻害薬の効果を検証するために、MET exon 14遺伝子変異陽性の進行非小細胞肺癌患者61人(34人はMETチロシンキナーゼ阻害薬治療歴なし、27人は治療歴あり)を対象に、レトロスペクティブ研究を行った。使用されたMETチロシンキナーゼ阻害薬は、crizotinib(20人は保険外診療で、4人は臨床試験で使用)、glesatinib(4人)、capmatinib(3人)だった。数人の患者は、複数のチロシンキナーゼ阻害薬を使用していた。患者の57%は女性で、39人は非喫煙者、30%は診断時に既にIV期と診断されていた。
METチロシンキナーゼ阻害薬を使用した患者の生存期間中央値は24.6ヶ月、使用しなかった患者では8.1ヶ月だった。crizotinibを使用した患者に限って言えば、生存期間中央値は20.5ヶ月、無増悪生存期間中央値は7.4ヶ月だった。
METチロシンキナーゼ阻害薬を使用した患者では、使用しなかった患者に対して、他の薬物療法を受けた患者が有意に多かった(p<0.001)。また、PD-1阻害薬の投与を受けた患者も、METチロシンキナーゼ阻害薬を使用した患者で有意に多かった(37% vs 9%, p=0.01)。
・MET遺伝子変異陽性非小細胞肺癌患者に対する免疫チェックポイント阻害薬の有効性(ASCO 2017 abst.#8512)
MET exon 14遺伝子変異陽性非小細胞肺癌患者81人を対象に、PD-L1発現状態と免疫チェックポイント阻害薬の効果を検証した。
81人の解析において、免疫染色でPD-L1の発現を見た患者は54人(67%)だった。その約半数(46%)で、PD-L1を発現しているがん細胞がが50%以上と高発現の状態だった。PD-L1発現細胞が1-49%の患者は19%、PD-L1発現陰性(発現細胞1%未満)の患者は35%だった。PD-L1発現状態とその他の背景因子に相関は見られなかった。
78人のMET exon 14遺伝子変異陽性非小細胞肺がん患者と、1,769人の非小細胞肺がん患者コホートとの間でTumor Mutational Burden(TMB)を比較したところ、前者では有意にTMBが低かった(3.8変異/megabase vs 5.7変異/megabase, p=0.0006)。PD-L1発現とTMBの間に有意な相関はなかった。
MET exon 14遺伝子変異陽性患者で免疫チェックポイント阻害薬の治療を受け、効果判定が出来た患者は15人だった。14人は抗PD-1抗体もしくは抗PD-L1抗体の単剤療法を受け、1人だけは抗PD-1抗体と抗CTLA-4抗体併用療法を受けていた。6人は、過去に治療歴のない患者だった。
この患者群において、免疫チェックポイント阻害薬の治療効果は不良(奏効割合は6.7%)で、PD-L1発現は効果予測因子としては役に立たなかった。PD-L1高発現の6人の患者でも、奏効は得られなかった。TMBですら効果予測因子とならず、TMB高値の患者でも奏効は得られなかった。
2017年06月10日
悪性胸膜中皮腫と免疫チェックポイント阻害薬
そろそろ、悪性胸膜中皮腫の領域でも免疫チェックポイント阻害薬に関する知見がまとまり始めた。
肺癌に比べると患者数が少ないだけに、第II相試験の結果とて無視できない。
2レジメン以上の治療歴がある患者が対象となると、尚更である。
追跡期間が短いので、治療成績が今後どのように展開するかを見守る必要がある。
また、有害事象に関しても気になるところである。
全体の30%は2コースまでで治療を終えざるを得なかったこと、そんな中で約80-90%の患者が何らかの有害事象を経験していること、併用療法群の約5%(61人中3人)が治療関連死に至っていることを考えると、演者が語るほど「軽微な」「十分対応可能な」有害事象ではないように思う。
今回は、まとめるのを忘れていたPembrolizumabに関する記事についても併せて触れておく。
ASCO 2017: Early Research Suggests First Immunotherapy for Mesothelioma on the Horizon
By The ASCO Post
Posted: 6/6/2017 10:51:20 AM
Last Updated: 6/6/2017 10:51:20 AM
悪性胸膜中皮腫は稀な悪性腫瘍だが、その発生頻度は年々増加している。本疾患は通常アスベスト暴露に関連して発生するとされ、診断後の生存期間中央値は13から15ヶ月程度とされる。初回化学療法の後、例外なく病勢進行に至り、治療対象者のうち半数以上が6ヶ月以内に治療を中断せざるを得なくなる。現在のところ、悪性胸膜中皮腫に対して効果的な他の治療法はない。
フランスで遂行されている第II相臨床試験、MAPS-2試験の中間解析結果によると、術後再発患者に対する免疫チェックポイント阻害薬は腫瘍細胞の増殖速度を遅らせた。治療開始から12週間の段階で、Nivolumabを投与された患者の44%で、Nivolumab+Ipilimumabを投与された患者の50%で増悪を認めなかった(ASCO 2017, #LBA8507)。
本多施設共同試験は、最大2レジメンまでの前治療歴(シスプラチン+ペメトレキセド併用化学療法を含む)のある進行悪性胸膜中皮腫患者125人を登録した。患者の大多数(80%)は男性で、年齢中央値は72歳だった。患者はNivolumab単剤療法群(63人)かNivolumab+Ipilimumab療法群(62人、うち実際にプロトコール治療を受けたのは61人)のいずれかに無作為割付され、病勢悪化まで継続された。70%の患者が少なくとも3コースの治療を受けた。
今回の報告では、当初登録・治療された108人に関するものだった。過去に検証された化学療法における12週病勢コントロール割合は30%未満だったが、今回の試験における12週病勢コントロール割合はNivolumab単剤療法群で44.4%(18.5%はPR、25.9%はSD)、Nivolumab+Ipilimumab療法群の50%(25.9%はPR、24.1%はSD)だった。Intent to Treatによる最終解析では
それぞれ39.7%、51.6%だった。
125人を平均10.4ヶ月追跡した段階で、無増悪生存期間中央値はNivolumab単剤療法群で4ヶ月、Nivolumab+Ipilimumab併用療法群で5.6ヶ月だった。生存期間中央値はそれぞれ10.4ヶ月、未到達だった。
Nivolumab単剤療法群では、77.8%の患者でなんらかの有害事象を認めた。9人(9.5%)ではGrade 3/4の重篤な有害事象を合併した。Nivolumab+Ipilimumab併用療法群では86.9%の患者でなんらかの有害事象を認め、Grade 3/4の重篤な有害事象は11人(18.0%)にのぼった。併用療法群では3人の治療関連死が発生し、劇症肝炎1人、脳炎1人、急性腎不全1人という内訳だった。下痢(19.7% vs 6.3%、p=0.035)と皮膚掻痒症(11.5% vs 1.6%, p=0.04)はいずれも併用療法群で有意に高頻度だった。
これまでのところ、MAPS-2試験は悪性胸膜中皮腫に対する臨床試験としては最大規模のものだが、他にもNivolumabと他の免疫チェックポイント阻害薬の併用療法を二次治療もしくは三次治療として適用する臨床試験が進行中である。加えて、初回治療として免疫チェックポイント阻害薬を用いる、より大規模な臨床試験もすでにいくつか進行中である。
Pembrolizumab in PD-L1–Positive Malignant Pleural Mesothelioma
By Matthew Stenger
Posted: 3/30/2017 9:15:08 AM
Last Updated: 3/30/2017 9:15:08 AM
Lancet Oncology誌に掲載された第Ib相のKEYNOTE-028試験の中間解析結果によると、悪性胸膜中皮腫患者に対するPembrolizumab単剤療法により長期的な腫瘍制御効果が認められているようだ。
KEYNOTE-028試験は既治療のPD-L1陽性(免疫染色により、腫瘍細胞の1%以上がPD-L1陽性)悪性腫瘍患者を対象に、Pembrolizumab 10mg/kgを2週間ごとに、病勢進行もしくは忍容不能の毒性で治療継続ができなくなるまで、最長2年間にわたり投与し続けるという臨床試験である。今回はその中で、悪性胸膜中皮腫の患者25人のコホートを対象として解析した。
年齢中央値は65歳、68%は男性、84%は白人、ECOG-PSは全員が0もしくは1で、病理組織学的には上皮方が72%で、32%は2レジメン以上の前治療歴があり、88%はプラチナ製剤の前治療歴を、84%でペメトレキセドの前治療歴を含んでいた。
奏効割合は20%(95%信頼区間は6.8%-40.7%)で、病勢コントロール割合は52%だった。奏効持続期間中央値は12.0ヶ月(95%信頼区間は3.7ヶ月-未到達)で、2016年6月のデータカットオフ時点でも2人の患者が治療継続中だった。
肺癌に比べると患者数が少ないだけに、第II相試験の結果とて無視できない。
2レジメン以上の治療歴がある患者が対象となると、尚更である。
追跡期間が短いので、治療成績が今後どのように展開するかを見守る必要がある。
また、有害事象に関しても気になるところである。
全体の30%は2コースまでで治療を終えざるを得なかったこと、そんな中で約80-90%の患者が何らかの有害事象を経験していること、併用療法群の約5%(61人中3人)が治療関連死に至っていることを考えると、演者が語るほど「軽微な」「十分対応可能な」有害事象ではないように思う。
今回は、まとめるのを忘れていたPembrolizumabに関する記事についても併せて触れておく。
ASCO 2017: Early Research Suggests First Immunotherapy for Mesothelioma on the Horizon
By The ASCO Post
Posted: 6/6/2017 10:51:20 AM
Last Updated: 6/6/2017 10:51:20 AM
悪性胸膜中皮腫は稀な悪性腫瘍だが、その発生頻度は年々増加している。本疾患は通常アスベスト暴露に関連して発生するとされ、診断後の生存期間中央値は13から15ヶ月程度とされる。初回化学療法の後、例外なく病勢進行に至り、治療対象者のうち半数以上が6ヶ月以内に治療を中断せざるを得なくなる。現在のところ、悪性胸膜中皮腫に対して効果的な他の治療法はない。
フランスで遂行されている第II相臨床試験、MAPS-2試験の中間解析結果によると、術後再発患者に対する免疫チェックポイント阻害薬は腫瘍細胞の増殖速度を遅らせた。治療開始から12週間の段階で、Nivolumabを投与された患者の44%で、Nivolumab+Ipilimumabを投与された患者の50%で増悪を認めなかった(ASCO 2017, #LBA8507)。
本多施設共同試験は、最大2レジメンまでの前治療歴(シスプラチン+ペメトレキセド併用化学療法を含む)のある進行悪性胸膜中皮腫患者125人を登録した。患者の大多数(80%)は男性で、年齢中央値は72歳だった。患者はNivolumab単剤療法群(63人)かNivolumab+Ipilimumab療法群(62人、うち実際にプロトコール治療を受けたのは61人)のいずれかに無作為割付され、病勢悪化まで継続された。70%の患者が少なくとも3コースの治療を受けた。
今回の報告では、当初登録・治療された108人に関するものだった。過去に検証された化学療法における12週病勢コントロール割合は30%未満だったが、今回の試験における12週病勢コントロール割合はNivolumab単剤療法群で44.4%(18.5%はPR、25.9%はSD)、Nivolumab+Ipilimumab療法群の50%(25.9%はPR、24.1%はSD)だった。Intent to Treatによる最終解析では
それぞれ39.7%、51.6%だった。
125人を平均10.4ヶ月追跡した段階で、無増悪生存期間中央値はNivolumab単剤療法群で4ヶ月、Nivolumab+Ipilimumab併用療法群で5.6ヶ月だった。生存期間中央値はそれぞれ10.4ヶ月、未到達だった。
Nivolumab単剤療法群では、77.8%の患者でなんらかの有害事象を認めた。9人(9.5%)ではGrade 3/4の重篤な有害事象を合併した。Nivolumab+Ipilimumab併用療法群では86.9%の患者でなんらかの有害事象を認め、Grade 3/4の重篤な有害事象は11人(18.0%)にのぼった。併用療法群では3人の治療関連死が発生し、劇症肝炎1人、脳炎1人、急性腎不全1人という内訳だった。下痢(19.7% vs 6.3%、p=0.035)と皮膚掻痒症(11.5% vs 1.6%, p=0.04)はいずれも併用療法群で有意に高頻度だった。
これまでのところ、MAPS-2試験は悪性胸膜中皮腫に対する臨床試験としては最大規模のものだが、他にもNivolumabと他の免疫チェックポイント阻害薬の併用療法を二次治療もしくは三次治療として適用する臨床試験が進行中である。加えて、初回治療として免疫チェックポイント阻害薬を用いる、より大規模な臨床試験もすでにいくつか進行中である。
Pembrolizumab in PD-L1–Positive Malignant Pleural Mesothelioma
By Matthew Stenger
Posted: 3/30/2017 9:15:08 AM
Last Updated: 3/30/2017 9:15:08 AM
Lancet Oncology誌に掲載された第Ib相のKEYNOTE-028試験の中間解析結果によると、悪性胸膜中皮腫患者に対するPembrolizumab単剤療法により長期的な腫瘍制御効果が認められているようだ。
KEYNOTE-028試験は既治療のPD-L1陽性(免疫染色により、腫瘍細胞の1%以上がPD-L1陽性)悪性腫瘍患者を対象に、Pembrolizumab 10mg/kgを2週間ごとに、病勢進行もしくは忍容不能の毒性で治療継続ができなくなるまで、最長2年間にわたり投与し続けるという臨床試験である。今回はその中で、悪性胸膜中皮腫の患者25人のコホートを対象として解析した。
年齢中央値は65歳、68%は男性、84%は白人、ECOG-PSは全員が0もしくは1で、病理組織学的には上皮方が72%で、32%は2レジメン以上の前治療歴があり、88%はプラチナ製剤の前治療歴を、84%でペメトレキセドの前治療歴を含んでいた。
奏効割合は20%(95%信頼区間は6.8%-40.7%)で、病勢コントロール割合は52%だった。奏効持続期間中央値は12.0ヶ月(95%信頼区間は3.7ヶ月-未到達)で、2016年6月のデータカットオフ時点でも2人の患者が治療継続中だった。
2017年06月09日
放射線治療歴のある非小細胞肺がん患者さんへのPembrolizumab
非小細胞肺癌に免疫チェックポイント阻害薬が使えるようになる少し前から、
「放射線治療後の患者では、血中にがん特異抗原がばらまかれていて、免疫チェックポイント阻害薬の治療効果が高まるらしい」
という、いわゆるabscopal effectの存在が囁かれていた。
いま、他院から紹介を受けて入院診療しているがん患者がいる。
右上縦隔原発、上大静脈症候群合併、両側癌性胸膜炎合併、がん性心膜炎合併の状態。
外科的縦隔生検の結果、胸腺癌あるいは原発性肺扁平上皮癌の診断(個人的には、おいおい、という感じの病理診断だが)。
上大静脈症候群に対しては、姑息的胸部放射線終了後。
前医で転院前日に右胸膜癒着術が行われ、胸腔ドレーンを抜去した当日に転院。
転院目的はリハビリだった。
結局、胸水も心嚢液も全くコントロールできておらず、それぞれドレナージと癒着術をして、最近になってようやく落ち着いた。
縦隔生検の検体を取り寄せてドライバー遺伝子変異、PD-L1の検索をすると、遺伝子変異はなかったが、PD-L1は50%陽性。
・・・さて、どうするか。
原発性肺癌と考えれば、言うまでもないがPembrolizumab初回治療の対象だ。
しかし、姑息的とはいえ胸部放射線照射が終わったのが4月の話。
規定では、胸部放射線照射終了から半年間はPembrolizumabが使用できないらしい。
結構効果は期待できそうなのだが、制限時間との戦いになっている今日この頃。
秋まで落ち着いていてくれるといいのだが。
こんなんだったら、免疫チェックポイント阻害薬を使用する患者では、何らかの形で頭部以外の腫瘍に放射線治療を行えば、治療成績が向上するのでは?
こうしたコンセプトの臨床試験をやってみると面白いような気がするのだが。
免疫チェックポイント阻害薬は、放射線治療の役割すら変えてしまうのかもしれない。
Effect of Previous Radiotherapy on Outcome With Pembrolizumab in NSCLC
By Matthew Stenger
Posted: 6/6/2017 10:57:05 AM
Last Updated: 6/6/2017 10:57:05 AM
ShaverdianらがLancet Oncologyに単施設の後方視的解析結果として報告したところによれば、進行非小細胞肺がん患者に対すPembrolizumab第I相試験であるKEYNOTE-001試験において、過去に放射線治療歴のある患者では治療成績がよかったとのことだ。
今回の検討では、UCLAからKEYNOTE-001試験に参加した97人の患者が対象となった。このうち、42人(43%)がPembrolizumab初回投与前に何らかの放射線治療を受けていた。38人は頭部以外の部位に放射線治療を受けていて、24人は胸部への照射を受けていた。経過観察期間の中央値は32.5ヶ月だった。
無増悪生存期間中央値は、何らかの放射線治療を受けたことのある患者では4.4ヶ月、ない患者では2.1ヶ月(ハザード比0.56、p=0.019)、頭部以外への照射歴がある患者では6.3ヶ月、ない患者では2.0ヶ月だった(ハザード比0.50、p=0.084)。生存期間中央値は、何らかの放射線治療を受けたことのある患者では10.7ヶ月、ない患者では5.3ヶ月(ハザード比0.58、p=0.026)、頭部以外への照射歴がある患者では11.6ヶ月、ない患者では5.3ヶ月だった(ハザード比0.59、p=0.034)。
肺毒性は、胸部放射線照射歴のある患者では24人中15人(63%)で、ない患者では73人中29人(40%)で、治療に関連すると判断された肺毒性はそれぞれ13% vs 1%だった。
「放射線治療後の患者では、血中にがん特異抗原がばらまかれていて、免疫チェックポイント阻害薬の治療効果が高まるらしい」
という、いわゆるabscopal effectの存在が囁かれていた。
いま、他院から紹介を受けて入院診療しているがん患者がいる。
右上縦隔原発、上大静脈症候群合併、両側癌性胸膜炎合併、がん性心膜炎合併の状態。
外科的縦隔生検の結果、胸腺癌あるいは原発性肺扁平上皮癌の診断(個人的には、おいおい、という感じの病理診断だが)。
上大静脈症候群に対しては、姑息的胸部放射線終了後。
前医で転院前日に右胸膜癒着術が行われ、胸腔ドレーンを抜去した当日に転院。
転院目的はリハビリだった。
結局、胸水も心嚢液も全くコントロールできておらず、それぞれドレナージと癒着術をして、最近になってようやく落ち着いた。
縦隔生検の検体を取り寄せてドライバー遺伝子変異、PD-L1の検索をすると、遺伝子変異はなかったが、PD-L1は50%陽性。
・・・さて、どうするか。
原発性肺癌と考えれば、言うまでもないがPembrolizumab初回治療の対象だ。
しかし、姑息的とはいえ胸部放射線照射が終わったのが4月の話。
規定では、胸部放射線照射終了から半年間はPembrolizumabが使用できないらしい。
結構効果は期待できそうなのだが、制限時間との戦いになっている今日この頃。
秋まで落ち着いていてくれるといいのだが。
こんなんだったら、免疫チェックポイント阻害薬を使用する患者では、何らかの形で頭部以外の腫瘍に放射線治療を行えば、治療成績が向上するのでは?
こうしたコンセプトの臨床試験をやってみると面白いような気がするのだが。
免疫チェックポイント阻害薬は、放射線治療の役割すら変えてしまうのかもしれない。
Effect of Previous Radiotherapy on Outcome With Pembrolizumab in NSCLC
By Matthew Stenger
Posted: 6/6/2017 10:57:05 AM
Last Updated: 6/6/2017 10:57:05 AM
ShaverdianらがLancet Oncologyに単施設の後方視的解析結果として報告したところによれば、進行非小細胞肺がん患者に対すPembrolizumab第I相試験であるKEYNOTE-001試験において、過去に放射線治療歴のある患者では治療成績がよかったとのことだ。
今回の検討では、UCLAからKEYNOTE-001試験に参加した97人の患者が対象となった。このうち、42人(43%)がPembrolizumab初回投与前に何らかの放射線治療を受けていた。38人は頭部以外の部位に放射線治療を受けていて、24人は胸部への照射を受けていた。経過観察期間の中央値は32.5ヶ月だった。
無増悪生存期間中央値は、何らかの放射線治療を受けたことのある患者では4.4ヶ月、ない患者では2.1ヶ月(ハザード比0.56、p=0.019)、頭部以外への照射歴がある患者では6.3ヶ月、ない患者では2.0ヶ月だった(ハザード比0.50、p=0.084)。生存期間中央値は、何らかの放射線治療を受けたことのある患者では10.7ヶ月、ない患者では5.3ヶ月(ハザード比0.58、p=0.026)、頭部以外への照射歴がある患者では11.6ヶ月、ない患者では5.3ヶ月だった(ハザード比0.59、p=0.034)。
肺毒性は、胸部放射線照射歴のある患者では24人中15人(63%)で、ない患者では73人中29人(40%)で、治療に関連すると判断された肺毒性はそれぞれ13% vs 1%だった。
2017年06月04日
シスメックス・京大 Nivolumab効果予測の臨床試験を計画
今朝の日経新聞を読んでいたら、表紙に標題の記事が載っていた。
シスメックスという会社、顕微鏡で細菌や細胞を見る際の染色液を扱うメーカーで、以前からお世話になっている。
記事を見る限り、血液検体でNivolumabの効果予測を試みているようで、診療上のメリットは大きい。
ちなみに、記事中に「測定する医師の力量で判定が左右される」というくだりがあるが、それは誤解だと思う。
免疫染色の評価というのは、そもそも個人差があって当たり前だ。
「オプジーボ 効果予測 シスメックス・京大 年内に臨床研究 医療費を抑制」
血液検査機器世界最大手シスメックスは「オプジーボ」など免疫の働きを高めるタイプのがん治療役が効くかどうか、事前に血液検査で予測する技術の臨床研究を近く始める方針だ。京都大学と共同で、3-4年内の実用化を目指す。オプジーボは高額なうえ効果が出る人が末期患者の2-3割に限られる。実用化されれば不必要な投与を避けられ、医療費抑制につながる可能性がある。
小野薬品工業とブリストル・マイヤーズ・スクイブ(BMS)が開発したオプジーボは免疫細胞の働きを抑えるたんぱく質が機能しないように働きかけ、がん細胞への攻撃を促す仕組み。シスメックスと京大の本庶佑名誉教授らのグループはがん患者の血液に溶け込んでいる物質の種類や量を解析すれば薬の効果がどの程度表れるか予測できることを突き止めた。京大から提供された患者の血液検体を使い、シスメックスが解析を担う。2017年中にも実際の患者を対象とした臨床研究を始める方針。オプジーボ以外の薬でも実用化を目指す。
従来は体の中からがん細胞を取りさす「生検」で分析していたが、患者の負担が重い上測定する医師の力量で判定が左右される問題もあった。新技術は客観的な数値で判断できるため、的確に予測できると見込む。オプジーボは末期がん患者に劇的な治療効果が見込めるとし手急速に普及が進んでいる。ただ、薬価が高く、医療財政を圧迫するとの声は多い。2月に本来の改定時期を待たずに薬価が半分に引き下げられたが、体重60kgの患者が仮に1年間使い続けた場合、約1750万円かかるとされる。効果が出ないまま投与を続けるケースもあり、投与効果の予測や、投与をやめる時期を見極める手法の確率が求められている。
シスメックスという会社、顕微鏡で細菌や細胞を見る際の染色液を扱うメーカーで、以前からお世話になっている。
記事を見る限り、血液検体でNivolumabの効果予測を試みているようで、診療上のメリットは大きい。
ちなみに、記事中に「測定する医師の力量で判定が左右される」というくだりがあるが、それは誤解だと思う。
免疫染色の評価というのは、そもそも個人差があって当たり前だ。
「オプジーボ 効果予測 シスメックス・京大 年内に臨床研究 医療費を抑制」
血液検査機器世界最大手シスメックスは「オプジーボ」など免疫の働きを高めるタイプのがん治療役が効くかどうか、事前に血液検査で予測する技術の臨床研究を近く始める方針だ。京都大学と共同で、3-4年内の実用化を目指す。オプジーボは高額なうえ効果が出る人が末期患者の2-3割に限られる。実用化されれば不必要な投与を避けられ、医療費抑制につながる可能性がある。
小野薬品工業とブリストル・マイヤーズ・スクイブ(BMS)が開発したオプジーボは免疫細胞の働きを抑えるたんぱく質が機能しないように働きかけ、がん細胞への攻撃を促す仕組み。シスメックスと京大の本庶佑名誉教授らのグループはがん患者の血液に溶け込んでいる物質の種類や量を解析すれば薬の効果がどの程度表れるか予測できることを突き止めた。京大から提供された患者の血液検体を使い、シスメックスが解析を担う。2017年中にも実際の患者を対象とした臨床研究を始める方針。オプジーボ以外の薬でも実用化を目指す。
従来は体の中からがん細胞を取りさす「生検」で分析していたが、患者の負担が重い上測定する医師の力量で判定が左右される問題もあった。新技術は客観的な数値で判断できるため、的確に予測できると見込む。オプジーボは末期がん患者に劇的な治療効果が見込めるとし手急速に普及が進んでいる。ただ、薬価が高く、医療財政を圧迫するとの声は多い。2月に本来の改定時期を待たずに薬価が半分に引き下げられたが、体重60kgの患者が仮に1年間使い続けた場合、約1750万円かかるとされる。効果が出ないまま投与を続けるケースもあり、投与効果の予測や、投与をやめる時期を見極める手法の確率が求められている。
2017年06月03日
腫瘍微小環境における炎症細胞プロファイルと免疫チェックポイント阻害薬の効果
興味深い話だけれど、3桁くらいの患者を対象にして再検討してほしい。
ELCC 2017: Specific Immune Cell Profiles Potentially Identify Patients With Lung Cancer Responsive to Anti–PD-1 Immunotherapy
By The ASCO Post
Posted: 5/9/2017 1:24:23 PM
Last Updated: 5/9/2017 1:24:23 PM
肺腺癌や肺扁平上皮癌患者の腫瘍組織微小環境内の免疫細胞サブタイプの解析により、一部のサブグループでは患者の生存期間が延長しており、Nivolumab療法の効果予測因子になりうることが報告された(ELCC 2017 abst. #2O)。
外科的に採取された非小細胞肺がん組織について、解析を行った。無治療コホートとして、51人の腺癌患者、69人の扁平上皮癌患者、Nivolumab治療コホートとして8人の腺癌患者、10人の扁平上皮癌患者を対象とした。
免疫ペルオキシダーゼ染色(H-score)と免疫蛍光染色を用いて、28-8抗体、22C3抗体、SP142抗体によるPD-L1発現レベルを評価した。1平方ミリメートルあたりの陽性細胞数、腫瘍内・腫瘍周囲・浸潤部辺縁の腫瘍浸潤リンパ球の局在と、そのリンパ球の亜型について解析した。
免疫組織化学的データと診療記録を用いたカプランマイヤー解析では、腺癌ではCD3陽性細胞が扁平上皮癌の2倍多く、逆に扁平上皮癌ではCD4陽性細胞が腺癌の1.8倍多かった。腫瘍組織内に炎症細胞浸潤が多い腺癌患者群では、そうでない患者群より生存期間が10ヶ月程度延長していることがわかった。
EGFR遺伝子変異陽性患者では、腫瘍細胞内の炎症細胞浸潤が乏しい傾向があった。
PD-L1発現状態と炎症細胞浸潤状態によって、患者を4群に分類した。第I群(PD-L1高発現、炎症細胞浸潤高度)は少数で、全体の14.6%に過ぎなかった。第II群(PD-L1低発現、炎症細胞浸潤軽度)は非小細胞肺癌検体の1/3以上を占め、免疫応答の枯渇を思わせた。第III群(PD-L1高発現、炎症細胞浸潤軽度:ナチュラルキラー細胞およびグランザイムB陽性細胞増加を伴う)と第IV群(PD-L1低発現、炎症細胞浸潤高度:制御性T細胞増加を伴う)は同程度に認められた
第III群では生存期間の延長が認められた。第III群の生存期間中央値は36.5ヶ月、無増悪生存期間中央値は27.6ヶ月だったが、第II群の生存期間中央値は25.7ヶ月、無増悪生存期間中央値は16.1ヶ月だった。PD-1低発現、CD8/CD3比高値の患者では、PD-1高発現、CD8/CD3比低値の患者と比して、生存期間が11ヶ月延長していた(p<0.01)。PD-L1高発現、PD-1低発現の患者群では免疫チェックポイント阻害薬に対する反応性が良好で、86%でNivolumab療法が奏効していた。
ELCC 2017: Specific Immune Cell Profiles Potentially Identify Patients With Lung Cancer Responsive to Anti–PD-1 Immunotherapy
By The ASCO Post
Posted: 5/9/2017 1:24:23 PM
Last Updated: 5/9/2017 1:24:23 PM
肺腺癌や肺扁平上皮癌患者の腫瘍組織微小環境内の免疫細胞サブタイプの解析により、一部のサブグループでは患者の生存期間が延長しており、Nivolumab療法の効果予測因子になりうることが報告された(ELCC 2017 abst. #2O)。
外科的に採取された非小細胞肺がん組織について、解析を行った。無治療コホートとして、51人の腺癌患者、69人の扁平上皮癌患者、Nivolumab治療コホートとして8人の腺癌患者、10人の扁平上皮癌患者を対象とした。
免疫ペルオキシダーゼ染色(H-score)と免疫蛍光染色を用いて、28-8抗体、22C3抗体、SP142抗体によるPD-L1発現レベルを評価した。1平方ミリメートルあたりの陽性細胞数、腫瘍内・腫瘍周囲・浸潤部辺縁の腫瘍浸潤リンパ球の局在と、そのリンパ球の亜型について解析した。
免疫組織化学的データと診療記録を用いたカプランマイヤー解析では、腺癌ではCD3陽性細胞が扁平上皮癌の2倍多く、逆に扁平上皮癌ではCD4陽性細胞が腺癌の1.8倍多かった。腫瘍組織内に炎症細胞浸潤が多い腺癌患者群では、そうでない患者群より生存期間が10ヶ月程度延長していることがわかった。
EGFR遺伝子変異陽性患者では、腫瘍細胞内の炎症細胞浸潤が乏しい傾向があった。
PD-L1発現状態と炎症細胞浸潤状態によって、患者を4群に分類した。第I群(PD-L1高発現、炎症細胞浸潤高度)は少数で、全体の14.6%に過ぎなかった。第II群(PD-L1低発現、炎症細胞浸潤軽度)は非小細胞肺癌検体の1/3以上を占め、免疫応答の枯渇を思わせた。第III群(PD-L1高発現、炎症細胞浸潤軽度:ナチュラルキラー細胞およびグランザイムB陽性細胞増加を伴う)と第IV群(PD-L1低発現、炎症細胞浸潤高度:制御性T細胞増加を伴う)は同程度に認められた
第III群では生存期間の延長が認められた。第III群の生存期間中央値は36.5ヶ月、無増悪生存期間中央値は27.6ヶ月だったが、第II群の生存期間中央値は25.7ヶ月、無増悪生存期間中央値は16.1ヶ月だった。PD-1低発現、CD8/CD3比高値の患者では、PD-1高発現、CD8/CD3比低値の患者と比して、生存期間が11ヶ月延長していた(p<0.01)。PD-L1高発現、PD-1低発現の患者群では免疫チェックポイント阻害薬に対する反応性が良好で、86%でNivolumab療法が奏効していた。
2017年06月03日
Selumetinib+DOC 第III相試験 for KRASm陽性肺癌
KRAS遺伝子変異陽性肺癌に対するSelumetinib+ドセタキセル併用化学療法については先行研究があり、4年前に以下のリンクで触れている。
http://oitahaiganpractice.junglekouen.com/e646669.html
かなり期待していたのだが、最近論文報告された第III相試験では、Selumetinib+ドセタキセル療法の優位性は証明されず、大変残念な結果に終わってしまった。
図らずも、第II相試験の結果がどんなによくても第III相試験で検証するまでは結論が出せない、ということが改めて示された。
EGFR遺伝子変異陽性肺癌に対するErlotinib+Bevacizumab併用療法がこのような顛末にならないことを祈る。
Selumetinib plus Docetaxel compared with Docetaxel alone and progression-free survival in patients with KRAS-mutant advanced Non-small cell lung cancer
Pasi A Janne et al, JAMA 317(18); 1844-1853, 2017
・KRAS遺伝子変異陽性非小細胞肺癌患者の二次治療において、ドセタキセル単剤化学療法にMEK阻害薬のSelumetinibを追加しても無増悪生存期間を延長しないことが、第III相試験のSELECT-Iで明らかになった
・KRAS遺伝子変異は、MEKキナーゼやERKキナーゼなどで構成されるMAPK系を含むシグナル伝達系を介して、腫瘍化に関わっている
・今回の二重盲検試験では、25ヶ国、202施設から患者を募集した
・2013年10月から、2016年1月にかけて患者を集積し、無作為割付した
・3,323人が試験参加同意書もしくはKRASスクリーニング同意書に署名した
・652人がKRAS遺伝子変異陽性と判定された
・510人がSelumetinib群(254人)かプラセボ群(256人)に割り付けられた
・Selumetinib群では、Selumetinibを75mg/回を1日2回連日内服し、さらにドセタキセルを75mg/回で3週間に1コースの頻度で点滴投与した。
・プラセボ群では、プラセボとドセタキセルを同様に投与した
・主要評価項目は無増悪生存期間とした
・2016年6月に最終解析を行った
・参加者の年齢中央値は62歳、全体の41%が女性、95%が白人、22%が現喫煙者、70%が既喫煙者、95%が遠隔転移を有し、94%がKRAS codon 12もしくは13の変異を有し、91%が腺癌だった
・510人中385人(75%)でPD-L1(28-8抗体)発現解析を行い、224人(58%)で5%未満、161人(42%)で5%以上陽性だった
・PD-L1発現状態と治療効果に相関はなかった
・データ解析時点で、無増悪生存期間中央値はSelumetinib群で3.9ヶ月、プラセボ群で2.8ヶ月、ハザード比0.93、p=0.44と、両群間に有意差を認めなかった
・生存期間中央値はSelumetinib群で8.7ヶ月、プラセボ群で7.9ヶ月、ハザード比1.05、p=0.64と、両群間で有意差を認めなかった
・奏効割合はSelumetinib群で20.1%、プラセボ群で13.7%、オッズ比1.61、p=0.05だった
・奏効持続期間はSelumetinib群で2.9ヶ月、プラセボ群で4.5ヶ月だった
・発生頻度の高かった有害事象は、Selumetinib群では下痢(61%)、嘔気(38%)、発疹(34%)、四肢浮腫(30%)、プラセボ群では下痢(35%)、疲労(31%)だった
・Grade 3以上の有害事象はSelumetinib群の67%、プラセボ群の45%で認められた
・発熱性好中球減少はSelumetinib群の2%、プラセボ群の1%で認められた
(ただし、プロトコール規定で全ての患者にG-CSF製剤の予防投与が課されていた)
・Selumetinib+ドセタキセル療法が有望と目された第II相試験の結果と比べると、プラセボ群の治療成績がよく(奏効割合は本試験で14%、第II相試験で0%、無増悪生存期間中央値は本試験で2.8ヶ月、第II相試験で2.1ヶ月)、反対にSelumetinib群の治療成績は悪かった(奏効割合は本試験で20%、第II相試験で37%、無増悪生存期間中央値は本試験で3.9ヶ月、第II相試験で5.3ヶ月)
http://oitahaiganpractice.junglekouen.com/e646669.html
かなり期待していたのだが、最近論文報告された第III相試験では、Selumetinib+ドセタキセル療法の優位性は証明されず、大変残念な結果に終わってしまった。
図らずも、第II相試験の結果がどんなによくても第III相試験で検証するまでは結論が出せない、ということが改めて示された。
EGFR遺伝子変異陽性肺癌に対するErlotinib+Bevacizumab併用療法がこのような顛末にならないことを祈る。
Selumetinib plus Docetaxel compared with Docetaxel alone and progression-free survival in patients with KRAS-mutant advanced Non-small cell lung cancer
Pasi A Janne et al, JAMA 317(18); 1844-1853, 2017
・KRAS遺伝子変異陽性非小細胞肺癌患者の二次治療において、ドセタキセル単剤化学療法にMEK阻害薬のSelumetinibを追加しても無増悪生存期間を延長しないことが、第III相試験のSELECT-Iで明らかになった
・KRAS遺伝子変異は、MEKキナーゼやERKキナーゼなどで構成されるMAPK系を含むシグナル伝達系を介して、腫瘍化に関わっている
・今回の二重盲検試験では、25ヶ国、202施設から患者を募集した
・2013年10月から、2016年1月にかけて患者を集積し、無作為割付した
・3,323人が試験参加同意書もしくはKRASスクリーニング同意書に署名した
・652人がKRAS遺伝子変異陽性と判定された
・510人がSelumetinib群(254人)かプラセボ群(256人)に割り付けられた
・Selumetinib群では、Selumetinibを75mg/回を1日2回連日内服し、さらにドセタキセルを75mg/回で3週間に1コースの頻度で点滴投与した。
・プラセボ群では、プラセボとドセタキセルを同様に投与した
・主要評価項目は無増悪生存期間とした
・2016年6月に最終解析を行った
・参加者の年齢中央値は62歳、全体の41%が女性、95%が白人、22%が現喫煙者、70%が既喫煙者、95%が遠隔転移を有し、94%がKRAS codon 12もしくは13の変異を有し、91%が腺癌だった
・510人中385人(75%)でPD-L1(28-8抗体)発現解析を行い、224人(58%)で5%未満、161人(42%)で5%以上陽性だった
・PD-L1発現状態と治療効果に相関はなかった
・データ解析時点で、無増悪生存期間中央値はSelumetinib群で3.9ヶ月、プラセボ群で2.8ヶ月、ハザード比0.93、p=0.44と、両群間に有意差を認めなかった
・生存期間中央値はSelumetinib群で8.7ヶ月、プラセボ群で7.9ヶ月、ハザード比1.05、p=0.64と、両群間で有意差を認めなかった
・奏効割合はSelumetinib群で20.1%、プラセボ群で13.7%、オッズ比1.61、p=0.05だった
・奏効持続期間はSelumetinib群で2.9ヶ月、プラセボ群で4.5ヶ月だった
・発生頻度の高かった有害事象は、Selumetinib群では下痢(61%)、嘔気(38%)、発疹(34%)、四肢浮腫(30%)、プラセボ群では下痢(35%)、疲労(31%)だった
・Grade 3以上の有害事象はSelumetinib群の67%、プラセボ群の45%で認められた
・発熱性好中球減少はSelumetinib群の2%、プラセボ群の1%で認められた
(ただし、プロトコール規定で全ての患者にG-CSF製剤の予防投与が課されていた)
・Selumetinib+ドセタキセル療法が有望と目された第II相試験の結果と比べると、プラセボ群の治療成績がよく(奏効割合は本試験で14%、第II相試験で0%、無増悪生存期間中央値は本試験で2.8ヶ月、第II相試験で2.1ヶ月)、反対にSelumetinib群の治療成績は悪かった(奏効割合は本試験で20%、第II相試験で37%、無増悪生存期間中央値は本試験で3.9ヶ月、第II相試験で5.3ヶ月)



