2021年11月03日
根治切除術直後の非小細胞肺がん患者に、バイオマーカー解析をするべきか
患者のことを考えれば、根治切除後できるだけ早い段階でバイオマーカー検索を行っておくのが望ましい。
肺がん領域のみならず、バイオマーカー解析の話題はにぎにぎしい。
対象となるバイオマーカーが増えて、それぞれに異なる検査手法があり、その中にはコンパニオン診断として認められたものとそうでないものがある。
最近では、ひとつの検査で複数のバイオマーカーを調べられるものも出てきている。
加えて、技術的にはどちらの検査でも調べられるバイオマーカーでありながらも、検査Aはコンパニオン診断として認められており、検査Bは認められていない、といったことが発生している。
さらには、各検査手法により必要な検体も異なれば、期待される精度も異なる。
もっと言えば、各検査にかかるお金が高額なうえ、がんゲノムプロファイリング検査ともなれば限られた施設でしかできないため、実施にあたってのハードルが高くなっている。
結果として、一部のマニアックな研究者、臨床家を除いて、バイオマーカー検索は極めて扱いにくい診療となっており、稀なバイオマーカーほどより一層発見されにくい土壌になっている気がする。
たいていの内科臨床医はEGFR遺伝子変異検索とALK免疫染色で満足して、生検組織が大きければOncomine DxTTまで、加えて22C3抗体でPD-L1検索も、といった感じでバイオマーカー検索を行っているのではないだろうか。
これだけでも、相当量の生検検体が必要だろう。
そうした状況であればこそ、せめて外科的切除ができた患者だけでも、切除した病巣が経年劣化しないうちに、早めに網羅的なバイオマーカー解析をしておいた方がいいのではないか、というのが私の考えである。
不幸にして術後再発した際、病巣が生検可能な部位になく、切除病巣は経年劣化のためバイオマーカー検索に不適で、頼みの綱は液性検体での検索のみ、というのはどうにもいただけない。
一歩進んで、バイオマーカー検索目的の外科的肺生検、という考え方もあっていいのではないか。
ADAURA試験やIMpower010試験の結果を受けて、少なくともEGFR遺伝子変異やPD-L1発現状態は切除した病巣を用いてルーチンで調べることになるだろう。
PD-L1発現状態を確認するにあたり使用する免疫染色用モノクローナル抗体のクローンも、内科では使用頻度の多いペンブロリズマブを想定して22C3抗体を、外科では術後補助療法にアテゾリズマブを使用することを想定してSP263抗体を好んで指定する、ということになるかもしれない。
肺がん領域のみならず、バイオマーカー解析の話題はにぎにぎしい。
対象となるバイオマーカーが増えて、それぞれに異なる検査手法があり、その中にはコンパニオン診断として認められたものとそうでないものがある。
最近では、ひとつの検査で複数のバイオマーカーを調べられるものも出てきている。
加えて、技術的にはどちらの検査でも調べられるバイオマーカーでありながらも、検査Aはコンパニオン診断として認められており、検査Bは認められていない、といったことが発生している。
さらには、各検査手法により必要な検体も異なれば、期待される精度も異なる。
もっと言えば、各検査にかかるお金が高額なうえ、がんゲノムプロファイリング検査ともなれば限られた施設でしかできないため、実施にあたってのハードルが高くなっている。
結果として、一部のマニアックな研究者、臨床家を除いて、バイオマーカー検索は極めて扱いにくい診療となっており、稀なバイオマーカーほどより一層発見されにくい土壌になっている気がする。
たいていの内科臨床医はEGFR遺伝子変異検索とALK免疫染色で満足して、生検組織が大きければOncomine DxTTまで、加えて22C3抗体でPD-L1検索も、といった感じでバイオマーカー検索を行っているのではないだろうか。
これだけでも、相当量の生検検体が必要だろう。
そうした状況であればこそ、せめて外科的切除ができた患者だけでも、切除した病巣が経年劣化しないうちに、早めに網羅的なバイオマーカー解析をしておいた方がいいのではないか、というのが私の考えである。
不幸にして術後再発した際、病巣が生検可能な部位になく、切除病巣は経年劣化のためバイオマーカー検索に不適で、頼みの綱は液性検体での検索のみ、というのはどうにもいただけない。
一歩進んで、バイオマーカー検索目的の外科的肺生検、という考え方もあっていいのではないか。
ADAURA試験やIMpower010試験の結果を受けて、少なくともEGFR遺伝子変異やPD-L1発現状態は切除した病巣を用いてルーチンで調べることになるだろう。
PD-L1発現状態を確認するにあたり使用する免疫染色用モノクローナル抗体のクローンも、内科では使用頻度の多いペンブロリズマブを想定して22C3抗体を、外科では術後補助療法にアテゾリズマブを使用することを想定してSP263抗体を好んで指定する、ということになるかもしれない。
2021年09月14日
オシメルチニブによる術前療法・・・NeoADAURAの前哨戦
昨年来、オシメルチニブによる術後補助療法のADAURA試験が大きな話題となっており、既に我が国でも適応拡大申請が成されている。
→https://prtimes.jp/main/html/rd/p/000000336.000024308.html
臨床研究の焦点は、既に術前治療のステップに移っている。
今年の世界肺癌会議では、オシメルチニブによる術前療法の報告が2報あった。
1報は中国から、オシメルチニブによる術前療法の効果と安全性に関する後方視的な検討について。
1報は米国から、オシメルチニブによる術前療法の効果と安全性に関する第II相試験の中間解析結果について。
なんとなく、診療や研究に対する哲学やアプローチの違いが表れているような感じがして興味深い。
そして、出てくる結論が似たり寄ったりであることも、また興味深いところである。
他の類似薬がそうであるように、オシメルチニブも単剤では病理学的効果はさほど高くないようだ。
オシメルチニブが効きにくい背景となりそうなRBM10という遺伝子変異が見つかったのは、今後に役立つのかもしれない。
P03.02 - Osimertinib as Neoadjuvant Therapy for Resectable EGFR Mutant Non-small Cell Lung Cancer: A Real-World Multicenter Retrospective Study
Xue-Feng Leng et al., WCLC2021 Abst.#P03.02
背景:
第3世代のEGFRチロシンキナーゼ阻害薬であるオシメルチニブは、優れた安全性プロファイルを有し、IB-IIIA期のEGFR遺伝子変異陽性完全切除後非小細胞肺がん患者の無病生存期間(Disease Free Survival, DFS)を延長する。しかし、術前治療としてのオシメルチニブのデータは限られている。今回の多施設共同後方視的研究は、IA-IIIB期のEGFR遺伝子変異陽性切除可能非小細胞肺がん患者におけるオシメルチニブの術前治療に関し、効果と安全性を検証するために企画した。
方法:
オシメルチニブの術前治療(80mg/日を経口投与)を1-3ヶ月行った後に手術を行ったIA-IIIB期の切除可能EGFR遺伝子変異陽性非小細胞肺がん患者13人の臨床データを後方視的に収集した。
結果:
術前オシメルチニブ投与の平均期間は59.8日間だった。オシメルチニブによる術前治療後、2人の患者は完全奏効、9人は部分奏効、2人は病勢安定の状態にあり、奏効割合は84.6%、病勢コントロール割合は100%だった。切除後の病理所見において、残存腫瘍細胞が病巣の10%未満と定義されるmajor Pathologic Response(mPR)の状態にある患者が4人認められた。mPR割合は75%だった。残存腫瘍細胞が皆無と定義される病理学的完全奏効(pathological Complete Response, pCR)は認められなかった。術前の臨床病期診断が術後病理病期診断で改善する(downstaging)現象は5人で認められた。オシメルチニブ投与に伴う深刻な有害事象や手術合併症は認めなかった。
結論:
今回の後方視的検討において、EGFR遺伝子変異陽性切除可能IA-IIIB期非小細胞肺がん患者におけるオシメルチニブ術前療法は忍容性良好で良好な病理学的治療効果につながっていた。
P26.02 - A Phase II Trial of Neoadjuvant Osimertinib for Surgically Resectable EGFR-Mutant Non-Small Cell Lung Cancer: Updated Results
Collin M. Blakely et al., WCLC2021 Abst.#P26.02
背景:
第3世代のEGFRチロシンキナーゼ阻害薬であるオシメルチニブは、EGFR遺伝子変異陽性進行非小細胞肺がんに対する一次治療として良好な安全性プロファイルと効果を併せ持っている。IB-IIIA期の外科切除後EGFR遺伝子変異陽性非小細胞肺がん患者に対し、オシメルチニブによる術後補助療法は有意に再発リスクを低下させる。一方、外科切除可能なEGFR遺伝子変異陽性非小細胞肺がんに対するオシメルチニブ術前療法の利点はまだわかっていない。ドライバー遺伝子変異陽性非小細胞肺がんに対する術前分子標的治療は、術前化学療法に比べて病理学的奏効割合や安全性の面でより有利かもしれない。こうした取り組みは、最適ながん遺伝子標的治療に対する腫瘍細胞の耐性メカニズムを同定することにも役立つ。
方法:
本試験はオシメルチニブ術前療法に関する進行中の多施設共同第II相試験であり、EGFR遺伝子変異陽性(Exon 19欠失変異あるいはExon 21 L858R点突然変異)の外科的切除可能な病期(AJCC第7版準拠でのI-IIIA期)にある非小細胞肺がん患者27人の集積を目指している。適格患者は、オシメルチニブ80mg/日内服を28日間サイクルで1サイクルあるいは2サイクルにわたって継続し、その後に外科的切除を受ける。主要評価項目は切除標本における残存腫瘍細胞が10%未満だった患者の割合を示すmajor Pathological Response(mPR)とした。副次評価項目は安全性、想定外の手術日程遅延、術後合併症割合、病理学的奏効割合(残存腫瘍細胞が0-49%の場合を奏効と定義)、病理学的完全奏効(pathological Complete Response, pCR)割合、奏効割合、リンパ節転移病巣のdownstagingの状態、無病生存期間(Disease Free Survival, DFS)、全生存期間(Overall Survival, OS)とした。
結果:
2021年4月までに、13人の早期(IA/B期6人、IIA/B期2人、IIIA期5人)EGFR遺伝子変異陽性(Exon 19欠失変異7人、Exon 21 L858R点突然変異6人)非小細胞肺がん患者が登録され、平均59日間のオシメルチニブによる術前治療の後に手術を受けた。mPR割合は15%(2 / 13)だった。病理学的奏効割合は69%(9 / 13)だった。病理学的完全奏効は認められなかった。画像診断上の奏効割合は46%(6 / 13)で、病勢安定の患者は7人、病勢コントロール割合は100%だった。治療開始前にリンパ節転移があった5人の患者のうち、リンパ節転移病巣のdownstagingは4人の患者で認められた(80%)。DFSやOSのデータはまだ評価できる段階にない。治療の安全性は良好で重篤な有害事象は確認されておらず、全ての患者が手術日程遅延や想定外の術後合併症に見舞われずに手術を受けられた。1人だけ、Grade 2相当の肺臓炎を合併したが、ステロイド治療を行うことなく改善した。7人の患者について、プロトコール治療開始前の腫瘍生検検体を用いて最大500か所に及ぶがん関連遺伝子解析を行った。オシメルチニブによる病理学的有効性が認められなかった4人のうち3人(75%)で、RBM10の機能失活を来す遺伝子変異が認められた。
結論:
今回の第II相試験の中間解析で、オシメルチニブによる術前治療は忍容性良好で、想定外の手術日程遅延を来すことなく、かつ病理学的奏効やリンパ節転移巣のdownstagingが得られることが分かった。一方、mPRに至る患者はまれであり、pCRを達成する患者は皆無だった。オシメルチニブによる病理学的奏効が得られなかった患者の大多数でRBM10変異が観察された。EGFR遺伝子変異陽性肺がんにおいて、臨床的に意義のあるmPR割合を達成するためには、NeoADAURA試験で検証されているようなオシメルチニブ+化学療法による術前療法のようなアプローチが必要なのかもしれない。
NeoADAURA試験(ClinicalTrials.gov ID: NCT04351555)
EGFR遺伝子変異陽性完全切除可能非小細胞肺がん患者を対象に、プラチナ製剤+ペメトレキセド併用術前療法と比較して、プラチナ製剤+ペメトレキセド+オシメルチニブ併用術前療法、オシメルチニブ単剤術前療法の効果と安全性を検証する無作為化第III相試験。
→https://prtimes.jp/main/html/rd/p/000000336.000024308.html
臨床研究の焦点は、既に術前治療のステップに移っている。
今年の世界肺癌会議では、オシメルチニブによる術前療法の報告が2報あった。
1報は中国から、オシメルチニブによる術前療法の効果と安全性に関する後方視的な検討について。
1報は米国から、オシメルチニブによる術前療法の効果と安全性に関する第II相試験の中間解析結果について。
なんとなく、診療や研究に対する哲学やアプローチの違いが表れているような感じがして興味深い。
そして、出てくる結論が似たり寄ったりであることも、また興味深いところである。
他の類似薬がそうであるように、オシメルチニブも単剤では病理学的効果はさほど高くないようだ。
オシメルチニブが効きにくい背景となりそうなRBM10という遺伝子変異が見つかったのは、今後に役立つのかもしれない。
P03.02 - Osimertinib as Neoadjuvant Therapy for Resectable EGFR Mutant Non-small Cell Lung Cancer: A Real-World Multicenter Retrospective Study
Xue-Feng Leng et al., WCLC2021 Abst.#P03.02
背景:
第3世代のEGFRチロシンキナーゼ阻害薬であるオシメルチニブは、優れた安全性プロファイルを有し、IB-IIIA期のEGFR遺伝子変異陽性完全切除後非小細胞肺がん患者の無病生存期間(Disease Free Survival, DFS)を延長する。しかし、術前治療としてのオシメルチニブのデータは限られている。今回の多施設共同後方視的研究は、IA-IIIB期のEGFR遺伝子変異陽性切除可能非小細胞肺がん患者におけるオシメルチニブの術前治療に関し、効果と安全性を検証するために企画した。
方法:
オシメルチニブの術前治療(80mg/日を経口投与)を1-3ヶ月行った後に手術を行ったIA-IIIB期の切除可能EGFR遺伝子変異陽性非小細胞肺がん患者13人の臨床データを後方視的に収集した。
結果:
術前オシメルチニブ投与の平均期間は59.8日間だった。オシメルチニブによる術前治療後、2人の患者は完全奏効、9人は部分奏効、2人は病勢安定の状態にあり、奏効割合は84.6%、病勢コントロール割合は100%だった。切除後の病理所見において、残存腫瘍細胞が病巣の10%未満と定義されるmajor Pathologic Response(mPR)の状態にある患者が4人認められた。mPR割合は75%だった。残存腫瘍細胞が皆無と定義される病理学的完全奏効(pathological Complete Response, pCR)は認められなかった。術前の臨床病期診断が術後病理病期診断で改善する(downstaging)現象は5人で認められた。オシメルチニブ投与に伴う深刻な有害事象や手術合併症は認めなかった。
結論:
今回の後方視的検討において、EGFR遺伝子変異陽性切除可能IA-IIIB期非小細胞肺がん患者におけるオシメルチニブ術前療法は忍容性良好で良好な病理学的治療効果につながっていた。
P26.02 - A Phase II Trial of Neoadjuvant Osimertinib for Surgically Resectable EGFR-Mutant Non-Small Cell Lung Cancer: Updated Results
Collin M. Blakely et al., WCLC2021 Abst.#P26.02
背景:
第3世代のEGFRチロシンキナーゼ阻害薬であるオシメルチニブは、EGFR遺伝子変異陽性進行非小細胞肺がんに対する一次治療として良好な安全性プロファイルと効果を併せ持っている。IB-IIIA期の外科切除後EGFR遺伝子変異陽性非小細胞肺がん患者に対し、オシメルチニブによる術後補助療法は有意に再発リスクを低下させる。一方、外科切除可能なEGFR遺伝子変異陽性非小細胞肺がんに対するオシメルチニブ術前療法の利点はまだわかっていない。ドライバー遺伝子変異陽性非小細胞肺がんに対する術前分子標的治療は、術前化学療法に比べて病理学的奏効割合や安全性の面でより有利かもしれない。こうした取り組みは、最適ながん遺伝子標的治療に対する腫瘍細胞の耐性メカニズムを同定することにも役立つ。
方法:
本試験はオシメルチニブ術前療法に関する進行中の多施設共同第II相試験であり、EGFR遺伝子変異陽性(Exon 19欠失変異あるいはExon 21 L858R点突然変異)の外科的切除可能な病期(AJCC第7版準拠でのI-IIIA期)にある非小細胞肺がん患者27人の集積を目指している。適格患者は、オシメルチニブ80mg/日内服を28日間サイクルで1サイクルあるいは2サイクルにわたって継続し、その後に外科的切除を受ける。主要評価項目は切除標本における残存腫瘍細胞が10%未満だった患者の割合を示すmajor Pathological Response(mPR)とした。副次評価項目は安全性、想定外の手術日程遅延、術後合併症割合、病理学的奏効割合(残存腫瘍細胞が0-49%の場合を奏効と定義)、病理学的完全奏効(pathological Complete Response, pCR)割合、奏効割合、リンパ節転移病巣のdownstagingの状態、無病生存期間(Disease Free Survival, DFS)、全生存期間(Overall Survival, OS)とした。
結果:
2021年4月までに、13人の早期(IA/B期6人、IIA/B期2人、IIIA期5人)EGFR遺伝子変異陽性(Exon 19欠失変異7人、Exon 21 L858R点突然変異6人)非小細胞肺がん患者が登録され、平均59日間のオシメルチニブによる術前治療の後に手術を受けた。mPR割合は15%(2 / 13)だった。病理学的奏効割合は69%(9 / 13)だった。病理学的完全奏効は認められなかった。画像診断上の奏効割合は46%(6 / 13)で、病勢安定の患者は7人、病勢コントロール割合は100%だった。治療開始前にリンパ節転移があった5人の患者のうち、リンパ節転移病巣のdownstagingは4人の患者で認められた(80%)。DFSやOSのデータはまだ評価できる段階にない。治療の安全性は良好で重篤な有害事象は確認されておらず、全ての患者が手術日程遅延や想定外の術後合併症に見舞われずに手術を受けられた。1人だけ、Grade 2相当の肺臓炎を合併したが、ステロイド治療を行うことなく改善した。7人の患者について、プロトコール治療開始前の腫瘍生検検体を用いて最大500か所に及ぶがん関連遺伝子解析を行った。オシメルチニブによる病理学的有効性が認められなかった4人のうち3人(75%)で、RBM10の機能失活を来す遺伝子変異が認められた。
結論:
今回の第II相試験の中間解析で、オシメルチニブによる術前治療は忍容性良好で、想定外の手術日程遅延を来すことなく、かつ病理学的奏効やリンパ節転移巣のdownstagingが得られることが分かった。一方、mPRに至る患者はまれであり、pCRを達成する患者は皆無だった。オシメルチニブによる病理学的奏効が得られなかった患者の大多数でRBM10変異が観察された。EGFR遺伝子変異陽性肺がんにおいて、臨床的に意義のあるmPR割合を達成するためには、NeoADAURA試験で検証されているようなオシメルチニブ+化学療法による術前療法のようなアプローチが必要なのかもしれない。
NeoADAURA試験(ClinicalTrials.gov ID: NCT04351555)
EGFR遺伝子変異陽性完全切除可能非小細胞肺がん患者を対象に、プラチナ製剤+ペメトレキセド併用術前療法と比較して、プラチナ製剤+ペメトレキセド+オシメルチニブ併用術前療法、オシメルチニブ単剤術前療法の効果と安全性を検証する無作為化第III相試験。
2021年09月04日
非小細胞肺がんの周術期治療をどのように考えるか
先日から、訳あって留学生の入院担当医をしている。
向こうもnon-native、こちらもnon-nativeで、ちょっとだけ日本語、ほとんど英語でのやり取りを余儀なくされている。
頑張ってしゃべっているつもりだが、なかなかうまくいかない。
今日は便秘に関するやり取りをするのにずいぶん苦労した。
排便、便秘に関する英語の勉強をして、それから英語のwebinerで少しだけ肺がんの勉強をした。
米国の識者が非小細胞肺がんの周術期治療をどのように考えるかの話をしていた。
今年の主要学会で発表された以下の臨床試験を踏まえてのことだろう。
・IMpower010試験・・・術後補助化学療法におけるアテゾリズマブ
→http://oitahaiganpractice.junglekouen.com/e989861.html
・第III相CheckMate816試験・・・ニボルマブ併用術前化学療法により病理学的完全奏効割合が改善
→http://oitahaiganpractice.junglekouen.com/e987857.html
症例検討の概要は以下の通り。
・65歳男性
・虚血性心疾患の既往あり
・脂質異常症あり
・喫煙歴:55 pack-year=1日20本を55年間=Brinkman Index 1100
・腎結石の精査中に、たまたま右肺下葉の腫瘤を指摘された
・CTでは、右肺下葉に45mm大の腫瘍があり、右肺門リンパ節の腫大も疑われた。
・PET-CTでは縦郭リンパ節や遠隔転移の所見はなかった
・頭部造影MRIでは明らかな中枢神経病変は見つけられなかった
・縦郭リンパ節生検では診断つかず
・外科切除の結果、原発巣は4.5㎝、右肺門リンパ節に2ヶ所転移を認めた
この時点で、術後の治療戦略を考えるにあたり、どんなバイオマーカーを調べるかというのが最初の議論になっていた。
ADAURA試験、IMpower010試験の結果を踏まえて、EGFR遺伝子変異とPD-L1発現は見ておきたい、というのが一致した見解だった。
この点は、術後再発時に生検不可能な部位に再発すると生検できずバイオマーカー検索できない可能性があること、手術時のがん組織は固定や経年変化により適切なバイオマーカー検体として適さなくなる可能性があることから、手術後にできるだけのバイオマーカーを検索しておきたい私の見解とは異なる。
実際に今回の患者のEGFR遺伝子変異、PD-L1発現を調べてみたところ、
・EGFR遺伝子変異:(-)
・PD-L1発現:25%
となっていたそうだ。
EGFR遺伝子変異やPD-L1発現状態の如何に拠らず、適応のある患者にはプラチナ併用術後補助化学療法を行うのが大前提である。
その上で、EGFR遺伝子変異陽性患者であれば、ADAURA試験の結果から、術後補助化学療法に引き続いてオシメルチニブを使用することにより、少なくとも無増悪生存期間の延長が期待できる。
・術後補助化学療法にもオシメルチニブ・・・ADAURA試験、「顕著な有効性」を示す
→http://oitahaiganpractice.junglekouen.com/e973395.html
・ADAURA試験
→http://oitahaiganpractice.junglekouen.com/e975874.html
・T.M.先生、ADAURA試験について語る
→http://oitahaiganpractice.junglekouen.com/e980042.html
・ADAURA試験サブグループ解析・・・術後補助化学療法の有無、病期別の解析結果
→http://oitahaiganpractice.junglekouen.com/e987128.html
現時点では米国でも術後補助化学療法としてのアテゾリズマブは承認されていないが、IMpower010試験もプラチナ併用術後補助化学療法を行うことが前提なので、結局バイオマーカーに拠らず、実地臨床で行うべきことは変わらない。
次のステップとして、EGFRチロシンキナーゼ阻害薬や免疫チェックポイント阻害薬が周術期治療として有効ならば、今度はプラチナ併用術後補助化学療法を省略できるかどうか、という検証が必要かもしれない。
ただし、試験デザインとしては非劣性試験が必要な上、製薬会社には何らメリットのない検証なので、実現はそう簡単ではないだろう。
向こうもnon-native、こちらもnon-nativeで、ちょっとだけ日本語、ほとんど英語でのやり取りを余儀なくされている。
頑張ってしゃべっているつもりだが、なかなかうまくいかない。
今日は便秘に関するやり取りをするのにずいぶん苦労した。
排便、便秘に関する英語の勉強をして、それから英語のwebinerで少しだけ肺がんの勉強をした。
米国の識者が非小細胞肺がんの周術期治療をどのように考えるかの話をしていた。
今年の主要学会で発表された以下の臨床試験を踏まえてのことだろう。
・IMpower010試験・・・術後補助化学療法におけるアテゾリズマブ
→http://oitahaiganpractice.junglekouen.com/e989861.html
・第III相CheckMate816試験・・・ニボルマブ併用術前化学療法により病理学的完全奏効割合が改善
→http://oitahaiganpractice.junglekouen.com/e987857.html
症例検討の概要は以下の通り。
・65歳男性
・虚血性心疾患の既往あり
・脂質異常症あり
・喫煙歴:55 pack-year=1日20本を55年間=Brinkman Index 1100
・腎結石の精査中に、たまたま右肺下葉の腫瘤を指摘された
・CTでは、右肺下葉に45mm大の腫瘍があり、右肺門リンパ節の腫大も疑われた。
・PET-CTでは縦郭リンパ節や遠隔転移の所見はなかった
・頭部造影MRIでは明らかな中枢神経病変は見つけられなかった
・縦郭リンパ節生検では診断つかず
・外科切除の結果、原発巣は4.5㎝、右肺門リンパ節に2ヶ所転移を認めた
この時点で、術後の治療戦略を考えるにあたり、どんなバイオマーカーを調べるかというのが最初の議論になっていた。
ADAURA試験、IMpower010試験の結果を踏まえて、EGFR遺伝子変異とPD-L1発現は見ておきたい、というのが一致した見解だった。
この点は、術後再発時に生検不可能な部位に再発すると生検できずバイオマーカー検索できない可能性があること、手術時のがん組織は固定や経年変化により適切なバイオマーカー検体として適さなくなる可能性があることから、手術後にできるだけのバイオマーカーを検索しておきたい私の見解とは異なる。
実際に今回の患者のEGFR遺伝子変異、PD-L1発現を調べてみたところ、
・EGFR遺伝子変異:(-)
・PD-L1発現:25%
となっていたそうだ。
EGFR遺伝子変異やPD-L1発現状態の如何に拠らず、適応のある患者にはプラチナ併用術後補助化学療法を行うのが大前提である。
その上で、EGFR遺伝子変異陽性患者であれば、ADAURA試験の結果から、術後補助化学療法に引き続いてオシメルチニブを使用することにより、少なくとも無増悪生存期間の延長が期待できる。
・術後補助化学療法にもオシメルチニブ・・・ADAURA試験、「顕著な有効性」を示す
→http://oitahaiganpractice.junglekouen.com/e973395.html
・ADAURA試験
→http://oitahaiganpractice.junglekouen.com/e975874.html
・T.M.先生、ADAURA試験について語る
→http://oitahaiganpractice.junglekouen.com/e980042.html
・ADAURA試験サブグループ解析・・・術後補助化学療法の有無、病期別の解析結果
→http://oitahaiganpractice.junglekouen.com/e987128.html
現時点では米国でも術後補助化学療法としてのアテゾリズマブは承認されていないが、IMpower010試験もプラチナ併用術後補助化学療法を行うことが前提なので、結局バイオマーカーに拠らず、実地臨床で行うべきことは変わらない。
次のステップとして、EGFRチロシンキナーゼ阻害薬や免疫チェックポイント阻害薬が周術期治療として有効ならば、今度はプラチナ併用術後補助化学療法を省略できるかどうか、という検証が必要かもしれない。
ただし、試験デザインとしては非劣性試験が必要な上、製薬会社には何らメリットのない検証なので、実現はそう簡単ではないだろう。
2021年08月27日
尿路上皮がんと術後補助ニボルマブ療法
6月に紹介した腎盂がんの患者さんの手術がまだ実現していない。
いろいろな要素が絡み、やむを得ず約3ヶ月の待機期間が発生したのだが、それにしても長い。
約1か月前からがん性疼痛が悪化し、外来で麻薬による疼痛コントロールをして凌いできたが、いよいよPSが悪化してきたため入院させた。
大変がっかりしたことに、きちんと内服が出来ておらず、入院時持参薬には大量の麻薬が含まれていた。
こちらが指示した薬を、患者がきちんと服用しているとは限らない。
それが分かっただけでも、入院してもらってよかった。
PS低下のために手術適応がなくなった、と言われてはあまりにも切ないので、泌尿器科担当医にお願いし、何とか術前早期に引き継いでもらえることになった。
泌尿器系のがんは、早期だろうが進行期だろうが、腫瘍量減量の観点から外科切除が前提である。
・・・とはいいながら、最近では腎細胞癌では手術をしない方がよいという話が出てきたが、尿路上皮がんではまだそんな話は聞かない。
今回の患者さんも、首尾よく手術が受けられて、以下のような治療の機会に恵まれるとなおよいのだが・・・、流石に薬事承認が間に合わないだろうな。
CheckMate 274試験
術後再発リスクの高い膀胱、もしくは上位尿路(腎盂・尿管)の尿路上皮がんに対して拡大切除術を行った後120日間以内の患者を対象とした、無作為化・二重盲検・プラセボ対照比較試験である。対象患者は、2週間ごとにニボルマブ240mgを使用する群(N群)とプラセボ群(P群)に1:1の割合で割り付けられ、再発が確認されるか、忍容不能な毒性に見舞われるまで、最長1年間にわたりプロトコール治療を継続した。
主要評価項目は担当医判定によるIntent-to-treat集団(ITT集団)およびPD-L1発現割合≧1%の患者集団(TPS≧1%集団)における無再発生存期間とした。無再発生存期間は、無作為割付から最初の術後再発に見舞われるか、患者が死亡するかまでの期間とした。
事前に規定されていた中間解析の段階で、N群において統計学的に有意な無再発生存期間延長効果が、ITT集団およびTPS≧1%集団の双方で確認された。ITT集団の解析では、無再発生存期間はN群で20.8ヶ月(95%信頼区間16.5-27.6)、P群で10.8ヶ月(95%信頼区間8.3-13.9)で、ハザード比は0.70(95%信頼区間0.57-0.86)、p=0.0008だった。TPS≧1%集団では、無再発生存期間はN群で未到達(95%信頼区間21.2ヶ月-未到達)、P群で8.4ヶ月(95%信頼区間5.6-21.2)で、ハザード比は0.55(95%信頼区間0.39-0.77、p=0.0005)だった。
PD-L1陰性の患者集団(全体の58%)を対象とした探索的解析では、P群に対するN群の無再発生存期間延長効果に関するハザード比は0.83(95%信頼区間0.64-1.08)で有意差に至らなかった。全生存期間に関するデータ集積は、死亡イベントが全体の33%しか発生していないためまだ解析には不十分だった。上位尿路患者を対象としたサブグループ解析では、37人の死亡イベントが発生していた(N群20人、P群17人)。
N群において20%以上の患者に認められた高頻度の有害事象は、発疹、倦怠感、下痢、掻痒、筋肉痛、尿路感染症だった。
なお、尿路上皮がんに対する術後補助療法としてのニボルマブの推奨投与法は、240mgを2週間ごとか、もしくは480mgを4週間ごととされた。
いろいろな要素が絡み、やむを得ず約3ヶ月の待機期間が発生したのだが、それにしても長い。
約1か月前からがん性疼痛が悪化し、外来で麻薬による疼痛コントロールをして凌いできたが、いよいよPSが悪化してきたため入院させた。
大変がっかりしたことに、きちんと内服が出来ておらず、入院時持参薬には大量の麻薬が含まれていた。
こちらが指示した薬を、患者がきちんと服用しているとは限らない。
それが分かっただけでも、入院してもらってよかった。
PS低下のために手術適応がなくなった、と言われてはあまりにも切ないので、泌尿器科担当医にお願いし、何とか術前早期に引き継いでもらえることになった。
泌尿器系のがんは、早期だろうが進行期だろうが、腫瘍量減量の観点から外科切除が前提である。
・・・とはいいながら、最近では腎細胞癌では手術をしない方がよいという話が出てきたが、尿路上皮がんではまだそんな話は聞かない。
今回の患者さんも、首尾よく手術が受けられて、以下のような治療の機会に恵まれるとなおよいのだが・・・、流石に薬事承認が間に合わないだろうな。
CheckMate 274試験
術後再発リスクの高い膀胱、もしくは上位尿路(腎盂・尿管)の尿路上皮がんに対して拡大切除術を行った後120日間以内の患者を対象とした、無作為化・二重盲検・プラセボ対照比較試験である。対象患者は、2週間ごとにニボルマブ240mgを使用する群(N群)とプラセボ群(P群)に1:1の割合で割り付けられ、再発が確認されるか、忍容不能な毒性に見舞われるまで、最長1年間にわたりプロトコール治療を継続した。
主要評価項目は担当医判定によるIntent-to-treat集団(ITT集団)およびPD-L1発現割合≧1%の患者集団(TPS≧1%集団)における無再発生存期間とした。無再発生存期間は、無作為割付から最初の術後再発に見舞われるか、患者が死亡するかまでの期間とした。
事前に規定されていた中間解析の段階で、N群において統計学的に有意な無再発生存期間延長効果が、ITT集団およびTPS≧1%集団の双方で確認された。ITT集団の解析では、無再発生存期間はN群で20.8ヶ月(95%信頼区間16.5-27.6)、P群で10.8ヶ月(95%信頼区間8.3-13.9)で、ハザード比は0.70(95%信頼区間0.57-0.86)、p=0.0008だった。TPS≧1%集団では、無再発生存期間はN群で未到達(95%信頼区間21.2ヶ月-未到達)、P群で8.4ヶ月(95%信頼区間5.6-21.2)で、ハザード比は0.55(95%信頼区間0.39-0.77、p=0.0005)だった。
PD-L1陰性の患者集団(全体の58%)を対象とした探索的解析では、P群に対するN群の無再発生存期間延長効果に関するハザード比は0.83(95%信頼区間0.64-1.08)で有意差に至らなかった。全生存期間に関するデータ集積は、死亡イベントが全体の33%しか発生していないためまだ解析には不十分だった。上位尿路患者を対象としたサブグループ解析では、37人の死亡イベントが発生していた(N群20人、P群17人)。
N群において20%以上の患者に認められた高頻度の有害事象は、発疹、倦怠感、下痢、掻痒、筋肉痛、尿路感染症だった。
なお、尿路上皮がんに対する術後補助療法としてのニボルマブの推奨投与法は、240mgを2週間ごとか、もしくは480mgを4週間ごととされた。
2021年06月13日
IMpower010試験・・・術後補助化学療法におけるアテゾリズマブ
II-IIIA期の完全切除後非小細胞肺がんに対し、プラチナ併用術後補助化学療法の後にアテゾリズマブを約1年間投与することで、無病生存期間が有意に改善するとのこと。
全生存期間に反映されるかどうかはまだわからない(少なくとも、本試験で全生存期間の統計学的延長が示されても試験デザイン上は参考データでしかない)が、無病生存期間が7ヶ月延長するというのは、意味のある結果と考えていいだろう。
IB期ならUFT、II-III期ならシスプラチン+ビノレルビン(非扁平上皮がんならペメトレキセドもありか?)併用術後補助化学療法と、それに引き続くアテゾリズマブ1年間投与が我が国における今後の標準治療となるのだろうか。
理由はわからないが、相変わらずアテゾリズマブ関連の臨床試験の統計学的処理はトリッキーである。
ある程度治療対象や評価項目を絞り込んででも、なんとか薬事承認のバックグラウンドになるようなpositive dataを捻出しよう、という製薬会社及び規制当局の意図の表れなのだろう。
IMpower010: Primary results of a phase III global study of atezolizumab versus best supportive care after adjuvant chemotherapy in resected stage IB-IIIA non-small cell lung cancer (NSCLC).
Heather A. Wakelee et al., 2021 ASCO Annual Meeting abst.#8500
背景:
再発リスクの高い早期非小細胞肺がん完全切除後のプラチナ併用術後補助化学療法は、そこそこの5年生存割合延長効果しかもたらさない。今回は、完全切除後の早期非小細胞肺がんに対して術後補助化学療法を行った後、引き続いてアテゾリズマブを投与するか経過観察とするかを比較するオープンラベル第III相臨床試験であるIMpower010試験について、あらかじめ規定されていた中間解析における無病生存期間の結果について報告する。
方法:
AJCC/UICC第7版基準における病理病期IB期(腫瘍長径≧4cm)-IIIA期の(臨床試験登録前4-12週間の間に)完全切除された非小細胞肺がんで、ECOG-PS 0-1の患者を登録対象とした。対象患者にはEGFR遺伝子変異陽性患者も含んでいた。1,280人の患者が登録され、1,269人が最大4コース、21日間隔のプラチナ併用術後補助化学療法(併用薬はペメトレキセド、ドセタキセル、ジェムシタビン、ビノレルビンのいずれか)を受けた。この1,269人のうち、1,005人が無作為割付の対象となった。Atezo群(アテゾリズマブ1,200mgを3週ごとに16コース)とBSC群(無治療経過観察)に1:1の割合で割り付けられた。主要評価項目である治療担当者評価による無病生存期間(DFS)、副次評価項目である全生存期間は以下の順序に従って階層的に検証された(有意差が認められなければ以後の階層の評価項目は無効とした):①SP263抗体を用いた評価による腫瘍細胞のPD-L1発現割合≧1%かつ病理病期II-IIIA期の患者サブグループにおけるDFS、②全ての病理病期II-IIIA期の患者サブグループにおけるDFS、③全対象患者のITT解析によるDFS、④全対象患者のITT解析によるOS。有効性の評価は無作為割付された患者全員を対象とし、安全性の評価は、Atezo群ではアテゾリズマブの投与を1コース以上受けた患者とし、BSC群では無作為割付後1度以上安全性評価を受けた患者とした。
結果:
2,021年1月21日のデータカットオフ時点で、ITT集団の追跡期間中央値は32.2ヶ月だった。患者背景は両治療群間で差を認めなかった。年齢中央値は62歳(26-84)、非扁平上皮癌が65.6%、IB期が12.2%、腫瘍細胞のPD-L1発現≧1%が54.6%であり、EGFR変異陽性患者が11.6%含まれていた。Atezo群では、①および②の患者集団で有意にDFSを延長していた。
①PD-L1陽性腫瘍細胞≧1%かつ病理病期II期-IIIA期の患者において、Atezo群(248人)のDFS中央値は未到達(95%信頼区間36.1ヶ月-未到達)、BSC群(228人)のDFS中央値は35.3カ月(95%信頼区間29.0ヶ月-未到達)で、ハザード比0.66(95%信頼区間0.50-0.88、p=0.004)、p=0.004だった。このサブグループにおける24ヶ月DFS割合はAtezo群が74.6%、BSC群が61.0%、36ヶ月DFS割合はAtezo群が60.0%、BSC群が48.2%だった。
②全ての病理病期II-IIIA期の患者において、Atezo群(442人)のDFS中央値は42.3ヶ月(95%信頼区間36.0ヶ月-未到達)、BSC群(440人)のDFS中央値は35.3ヶ月(95%信頼区間30.4-46.4)で、ハザード比0.79(95%信頼区間0.64-0.96、p=0.02)で有意にAtezo群で延長していた。このサブグループにおける24ヶ月DFS割合はAtezo群で70.2%、BSC群で61.6%、36ヶ月DFS割合はAtezo群で55.7%、BSC群で49.4%だった。PD-L1発現状態別にみると、PD-L1発現が50%以上のハザード比は0.43、1%以上が0.66、1%未満は0.97だった。EGFR変異陽性患者のハザード比は0.99で両群間に有意差を認めなかった。
③全対象患者のITT解析では、Atezo群(507人)のDFS中央値は未到達(95%信頼区間:36.1ヶ月-未到達)、BSC群(498人)のDFS中央値は37.2ヶ月(95%信頼区間31.6ヶ月-未到達)で、ハザード比0.81(95%信頼区間:0.67-0.99、p=0.04)で、事前に規定した有意水準を満たさなかった。24ヶ月DFS割合はAtezo群で71.4%、BSC群で63.6%、36ヶ月DFS割合はAtezo群で57.9%、BSC群で52.6%だった。
④全対象患者のITT解析では、全生存期間解析に十分なイベントはまだ発生していなかった。探索的な解析を行ったところ、腫瘍細胞のPD-L1発現≧1%で病理病期II期-IIIA期の患者では、ハザード比0.77(95%信頼区間:0.51-1.17)とAtezo群で良い傾向があった。]
Atezo群において、アテゾリズマブの投与コース中央値は16コース(1-16)だった。全グレードの有害事象は、Atezo群の92.7%、BSC群の70.7%に認められた。Atezo群でGrade3/4の有害事象を認めたのは21.8%、治療関連のグレード5は0.8%だった。BSC群でGrade3/4の有害事象を認めたのは11.5%だった。有害事象のためにアテゾリズマブ投与中止となったのは18.2%だった。
結論:
IMpower010試験は主要評価項目を満たし、病理病期II-IIIA期の完全切除後非小細胞肺がん患者のプラチナ併用術後補助化学療法後のアテゾリズマブ投与により無病生存期間が延長することが示された。
全生存期間に反映されるかどうかはまだわからない(少なくとも、本試験で全生存期間の統計学的延長が示されても試験デザイン上は参考データでしかない)が、無病生存期間が7ヶ月延長するというのは、意味のある結果と考えていいだろう。
IB期ならUFT、II-III期ならシスプラチン+ビノレルビン(非扁平上皮がんならペメトレキセドもありか?)併用術後補助化学療法と、それに引き続くアテゾリズマブ1年間投与が我が国における今後の標準治療となるのだろうか。
理由はわからないが、相変わらずアテゾリズマブ関連の臨床試験の統計学的処理はトリッキーである。
ある程度治療対象や評価項目を絞り込んででも、なんとか薬事承認のバックグラウンドになるようなpositive dataを捻出しよう、という製薬会社及び規制当局の意図の表れなのだろう。
IMpower010: Primary results of a phase III global study of atezolizumab versus best supportive care after adjuvant chemotherapy in resected stage IB-IIIA non-small cell lung cancer (NSCLC).
Heather A. Wakelee et al., 2021 ASCO Annual Meeting abst.#8500
背景:
再発リスクの高い早期非小細胞肺がん完全切除後のプラチナ併用術後補助化学療法は、そこそこの5年生存割合延長効果しかもたらさない。今回は、完全切除後の早期非小細胞肺がんに対して術後補助化学療法を行った後、引き続いてアテゾリズマブを投与するか経過観察とするかを比較するオープンラベル第III相臨床試験であるIMpower010試験について、あらかじめ規定されていた中間解析における無病生存期間の結果について報告する。
方法:
AJCC/UICC第7版基準における病理病期IB期(腫瘍長径≧4cm)-IIIA期の(臨床試験登録前4-12週間の間に)完全切除された非小細胞肺がんで、ECOG-PS 0-1の患者を登録対象とした。対象患者にはEGFR遺伝子変異陽性患者も含んでいた。1,280人の患者が登録され、1,269人が最大4コース、21日間隔のプラチナ併用術後補助化学療法(併用薬はペメトレキセド、ドセタキセル、ジェムシタビン、ビノレルビンのいずれか)を受けた。この1,269人のうち、1,005人が無作為割付の対象となった。Atezo群(アテゾリズマブ1,200mgを3週ごとに16コース)とBSC群(無治療経過観察)に1:1の割合で割り付けられた。主要評価項目である治療担当者評価による無病生存期間(DFS)、副次評価項目である全生存期間は以下の順序に従って階層的に検証された(有意差が認められなければ以後の階層の評価項目は無効とした):①SP263抗体を用いた評価による腫瘍細胞のPD-L1発現割合≧1%かつ病理病期II-IIIA期の患者サブグループにおけるDFS、②全ての病理病期II-IIIA期の患者サブグループにおけるDFS、③全対象患者のITT解析によるDFS、④全対象患者のITT解析によるOS。有効性の評価は無作為割付された患者全員を対象とし、安全性の評価は、Atezo群ではアテゾリズマブの投与を1コース以上受けた患者とし、BSC群では無作為割付後1度以上安全性評価を受けた患者とした。
結果:
2,021年1月21日のデータカットオフ時点で、ITT集団の追跡期間中央値は32.2ヶ月だった。患者背景は両治療群間で差を認めなかった。年齢中央値は62歳(26-84)、非扁平上皮癌が65.6%、IB期が12.2%、腫瘍細胞のPD-L1発現≧1%が54.6%であり、EGFR変異陽性患者が11.6%含まれていた。Atezo群では、①および②の患者集団で有意にDFSを延長していた。
①PD-L1陽性腫瘍細胞≧1%かつ病理病期II期-IIIA期の患者において、Atezo群(248人)のDFS中央値は未到達(95%信頼区間36.1ヶ月-未到達)、BSC群(228人)のDFS中央値は35.3カ月(95%信頼区間29.0ヶ月-未到達)で、ハザード比0.66(95%信頼区間0.50-0.88、p=0.004)、p=0.004だった。このサブグループにおける24ヶ月DFS割合はAtezo群が74.6%、BSC群が61.0%、36ヶ月DFS割合はAtezo群が60.0%、BSC群が48.2%だった。
②全ての病理病期II-IIIA期の患者において、Atezo群(442人)のDFS中央値は42.3ヶ月(95%信頼区間36.0ヶ月-未到達)、BSC群(440人)のDFS中央値は35.3ヶ月(95%信頼区間30.4-46.4)で、ハザード比0.79(95%信頼区間0.64-0.96、p=0.02)で有意にAtezo群で延長していた。このサブグループにおける24ヶ月DFS割合はAtezo群で70.2%、BSC群で61.6%、36ヶ月DFS割合はAtezo群で55.7%、BSC群で49.4%だった。PD-L1発現状態別にみると、PD-L1発現が50%以上のハザード比は0.43、1%以上が0.66、1%未満は0.97だった。EGFR変異陽性患者のハザード比は0.99で両群間に有意差を認めなかった。
③全対象患者のITT解析では、Atezo群(507人)のDFS中央値は未到達(95%信頼区間:36.1ヶ月-未到達)、BSC群(498人)のDFS中央値は37.2ヶ月(95%信頼区間31.6ヶ月-未到達)で、ハザード比0.81(95%信頼区間:0.67-0.99、p=0.04)で、事前に規定した有意水準を満たさなかった。24ヶ月DFS割合はAtezo群で71.4%、BSC群で63.6%、36ヶ月DFS割合はAtezo群で57.9%、BSC群で52.6%だった。
④全対象患者のITT解析では、全生存期間解析に十分なイベントはまだ発生していなかった。探索的な解析を行ったところ、腫瘍細胞のPD-L1発現≧1%で病理病期II期-IIIA期の患者では、ハザード比0.77(95%信頼区間:0.51-1.17)とAtezo群で良い傾向があった。]
Atezo群において、アテゾリズマブの投与コース中央値は16コース(1-16)だった。全グレードの有害事象は、Atezo群の92.7%、BSC群の70.7%に認められた。Atezo群でGrade3/4の有害事象を認めたのは21.8%、治療関連のグレード5は0.8%だった。BSC群でGrade3/4の有害事象を認めたのは11.5%だった。有害事象のためにアテゾリズマブ投与中止となったのは18.2%だった。
結論:
IMpower010試験は主要評価項目を満たし、病理病期II-IIIA期の完全切除後非小細胞肺がん患者のプラチナ併用術後補助化学療法後のアテゾリズマブ投与により無病生存期間が延長することが示された。
2021年06月12日
IMPACT / WJOG6410L試験・・・我が国発の術後補助ゲフィチニブ療法第III相試験
(2021/11/10 一部加筆修正)
EGFR遺伝子変異陽性、病理病期II-III期の完全切除後非小細胞肺がん患者を対象に、ゲフィチニブ術後補助療法の有効性を検証した第III相IMPACT / WJOG6410L試験。
以前も記事にしたが、中国初のADJUVANT / CTONG1104試験はあくまで参考とし、このIMPACT試験の結果を以て実地臨床における自分の考え方を決めようと思っていた。
ADJUVANT / CTONG1104試験
http://oitahaiganpractice.junglekouen.com/e974737.html
http://oitahaiganpractice.junglekouen.com/e919586.html
http://oitahaiganpractice.junglekouen.com/e900761.html
ADJUVANT / CTONG1104試験では、ゲフィチニブは無病生存期間を延長するが、全生存期間は延長しない、ただし生存期間中央値は少なくとも75ヶ月以上と有意義な結果を残していた。
しかし、昨年の話題をさらったADAURA試験から、本患者集団ではオシメルチニブの方がさらによい結果が予感され、EGFR遺伝子変異陽性の全ての患者集団におけるゲフィチニブ時代の終焉を思わせた。
ADAURA試験
http://oitahaiganpractice.junglekouen.com/e987128.html
http://oitahaiganpractice.junglekouen.com/e980042.html
http://oitahaiganpractice.junglekouen.com/e975874.html
それから1年経過しての、IMPACT / WJOG6410L試験の結果報告。
第III相臨床試験としての輝きは、既に失われてしまった。
数の暴力、時の流れというのは残酷極まりない。
とはいえ、我が国で行われた臨床試験において、この患者集団の術後生命予後がきちんとしたデータで示され、71ヶ月という長期追跡期間にもかかわらず全患者集団の生存期間中央値が未到達というのは、これから治療に臨む患者に勇気を与える結果だと思う。
Adjuvant gefitinib versus cisplatin/vinorelbine in Japanese patients with completely resected, EGFR-mutated, stage II-III non-small cell lung cancer (IMPACT, WJOG6410L): A randomized phase 3 trial.
Hirohito Tada, et al., ASCO 2021 abst.#8501
Randomized Phase III Study of Gefitinib Versus Cisplatin Plus Vinorelbine for Patients With Resected Stage II-IIIA Non–Small-Cell Lung Cancer With EGFR Mutation (IMPACT)
Hirohito Tada et al., J Clin Oncol 2021
DOI: 10.1200/JCO.21.01729 Journal of Clinical Oncology
背景:
上皮成長因子受容体(EGFR)チロシンキナーゼ阻害薬単剤療法はEGFR遺伝子変異陽性未治療進行非小細胞肺がんの標準治療のひとつである。しかし、EGFR遺伝子変異陽性の完全切除後非小細胞肺がん患者における術後補助療法としてのゲフィチニブの有効性と安全性はシスプラチンベースの術後化学療法と比べてどうなのか、本試験が開始された2,011年当時はまだわかっていなかった。
方法:
2,011年09月から2,015年12月にかけて、EGFR遺伝子変異(エクソン19欠失変異もしくはエクソン21L858R点突然変異)陽性、病理病期II-III期の完全切除後非小細胞肺がん患者234人を対象に、G群(ゲフィチニブ250mgを1日1回2年間内服)とVP群(シスプラチン80mg/㎡を1日目、ビノレルビン25mg/㎡を1日目、8日目に点滴投与、3週間ごと4コース)に無作為に割り付けた。主要評価項目は独立判定委員会評価によるintent-to-treat解析での無病生存期間(DFS)とした。副次評価項目は全生存期間(OS)、安全性、再発時の再発パターンとした。
結果:
G群のうち2人が臨床試験参加を撤回したため、intent-to-treat解析から除外した。G群(116人)とVP群(116人)の患者背景に差はなかった。両群とも女性が6割を占め、年齢中央値は64歳、喫煙歴がなかった人はG群で58.6%、VP群で63.8%、病理病期はIIA期がG群で31.0%、VP群で32.8%、IIIA期はG群で61.2%、VP群で62.9%だった。プロトコール治療を完遂したのはG群61.2%、VP群77.6%だった。G群では治療関連死がなかったが、VP群では3人の治療関連死(脳出血、自殺、肺炎)が発生した。追跡期間中央値は70ヶ月だった。数値上、DFSはG群で長く、G群35.9ヶ月(95%信頼区間30.0-47.7)、VP群25.2ヶ月(95%信頼区間17.7-41.8)だった。しかし、カプランマイヤー曲線は術後約4年後から交差し、統計学的な有意差を認めず、ハザード比0.92(95%信頼区間0.67-1.28、p=0.63)だった。2年DFS割合はG群63.7%、VP群52.3%、5年DFS割合はG群31.8%、VP群34.1%だった。OSも有意差がつかず、解析時点では両群ともに中央値に至っておらず、5年生存割合はG群で78.0%、VP群で74.6%、ハザード比1.03(95%信頼区間0.65-1.65、p=0.89)だった。70歳以上の患者を対象に探索的解析を行ったところ、G群(19人)の方がVP群(27人)よりもOSが延長していた(ハザード比0.31、95%信頼区間0.10-0.98、p=0.046)。再発パターンは、局所再発については両群で差はなかったが、遠隔転移再発については、脳がG群で26件、VP群が14件とG群で多かった。術後再発した患者のうち、G群で76人、VP群で71人が後治療を受けていた。そのうち薬物療法を受けたのはG群66人、VP群64人、EGFRチロシンキナーゼ阻害薬を投与されたのはG群43人、VP群59人、化学療法を受けたのはG群23人、VP群4人だった。プロトコール治療中、Grade 4以上の有害事象に見舞われたのはG群で4%、VP群で62%(1人を除いて、全て好中球減少症をはじめとする造血障害)だった。
結論:
EGFR遺伝子変異(エクソン19欠失変異もしくはエクソン21L858R点突然変異)陽性、病理病期II-III期の完全切除後非小細胞肺がん患者において、ゲフィチニブによる術後補助療法はDFS、OSともに統計学的有意な延長効果を示せなかった。
EGFR遺伝子変異陽性、病理病期II-III期の完全切除後非小細胞肺がん患者を対象に、ゲフィチニブ術後補助療法の有効性を検証した第III相IMPACT / WJOG6410L試験。
以前も記事にしたが、中国初のADJUVANT / CTONG1104試験はあくまで参考とし、このIMPACT試験の結果を以て実地臨床における自分の考え方を決めようと思っていた。
ADJUVANT / CTONG1104試験
http://oitahaiganpractice.junglekouen.com/e974737.html
http://oitahaiganpractice.junglekouen.com/e919586.html
http://oitahaiganpractice.junglekouen.com/e900761.html
ADJUVANT / CTONG1104試験では、ゲフィチニブは無病生存期間を延長するが、全生存期間は延長しない、ただし生存期間中央値は少なくとも75ヶ月以上と有意義な結果を残していた。
しかし、昨年の話題をさらったADAURA試験から、本患者集団ではオシメルチニブの方がさらによい結果が予感され、EGFR遺伝子変異陽性の全ての患者集団におけるゲフィチニブ時代の終焉を思わせた。
ADAURA試験
http://oitahaiganpractice.junglekouen.com/e987128.html
http://oitahaiganpractice.junglekouen.com/e980042.html
http://oitahaiganpractice.junglekouen.com/e975874.html
それから1年経過しての、IMPACT / WJOG6410L試験の結果報告。
第III相臨床試験としての輝きは、既に失われてしまった。
数の暴力、時の流れというのは残酷極まりない。
とはいえ、我が国で行われた臨床試験において、この患者集団の術後生命予後がきちんとしたデータで示され、71ヶ月という長期追跡期間にもかかわらず全患者集団の生存期間中央値が未到達というのは、これから治療に臨む患者に勇気を与える結果だと思う。
Adjuvant gefitinib versus cisplatin/vinorelbine in Japanese patients with completely resected, EGFR-mutated, stage II-III non-small cell lung cancer (IMPACT, WJOG6410L): A randomized phase 3 trial.
Hirohito Tada, et al., ASCO 2021 abst.#8501
Randomized Phase III Study of Gefitinib Versus Cisplatin Plus Vinorelbine for Patients With Resected Stage II-IIIA Non–Small-Cell Lung Cancer With EGFR Mutation (IMPACT)
Hirohito Tada et al., J Clin Oncol 2021
DOI: 10.1200/JCO.21.01729 Journal of Clinical Oncology
背景:
上皮成長因子受容体(EGFR)チロシンキナーゼ阻害薬単剤療法はEGFR遺伝子変異陽性未治療進行非小細胞肺がんの標準治療のひとつである。しかし、EGFR遺伝子変異陽性の完全切除後非小細胞肺がん患者における術後補助療法としてのゲフィチニブの有効性と安全性はシスプラチンベースの術後化学療法と比べてどうなのか、本試験が開始された2,011年当時はまだわかっていなかった。
方法:
2,011年09月から2,015年12月にかけて、EGFR遺伝子変異(エクソン19欠失変異もしくはエクソン21L858R点突然変異)陽性、病理病期II-III期の完全切除後非小細胞肺がん患者234人を対象に、G群(ゲフィチニブ250mgを1日1回2年間内服)とVP群(シスプラチン80mg/㎡を1日目、ビノレルビン25mg/㎡を1日目、8日目に点滴投与、3週間ごと4コース)に無作為に割り付けた。主要評価項目は独立判定委員会評価によるintent-to-treat解析での無病生存期間(DFS)とした。副次評価項目は全生存期間(OS)、安全性、再発時の再発パターンとした。
結果:
G群のうち2人が臨床試験参加を撤回したため、intent-to-treat解析から除外した。G群(116人)とVP群(116人)の患者背景に差はなかった。両群とも女性が6割を占め、年齢中央値は64歳、喫煙歴がなかった人はG群で58.6%、VP群で63.8%、病理病期はIIA期がG群で31.0%、VP群で32.8%、IIIA期はG群で61.2%、VP群で62.9%だった。プロトコール治療を完遂したのはG群61.2%、VP群77.6%だった。G群では治療関連死がなかったが、VP群では3人の治療関連死(脳出血、自殺、肺炎)が発生した。追跡期間中央値は70ヶ月だった。数値上、DFSはG群で長く、G群35.9ヶ月(95%信頼区間30.0-47.7)、VP群25.2ヶ月(95%信頼区間17.7-41.8)だった。しかし、カプランマイヤー曲線は術後約4年後から交差し、統計学的な有意差を認めず、ハザード比0.92(95%信頼区間0.67-1.28、p=0.63)だった。2年DFS割合はG群63.7%、VP群52.3%、5年DFS割合はG群31.8%、VP群34.1%だった。OSも有意差がつかず、解析時点では両群ともに中央値に至っておらず、5年生存割合はG群で78.0%、VP群で74.6%、ハザード比1.03(95%信頼区間0.65-1.65、p=0.89)だった。70歳以上の患者を対象に探索的解析を行ったところ、G群(19人)の方がVP群(27人)よりもOSが延長していた(ハザード比0.31、95%信頼区間0.10-0.98、p=0.046)。再発パターンは、局所再発については両群で差はなかったが、遠隔転移再発については、脳がG群で26件、VP群が14件とG群で多かった。術後再発した患者のうち、G群で76人、VP群で71人が後治療を受けていた。そのうち薬物療法を受けたのはG群66人、VP群64人、EGFRチロシンキナーゼ阻害薬を投与されたのはG群43人、VP群59人、化学療法を受けたのはG群23人、VP群4人だった。プロトコール治療中、Grade 4以上の有害事象に見舞われたのはG群で4%、VP群で62%(1人を除いて、全て好中球減少症をはじめとする造血障害)だった。
結論:
EGFR遺伝子変異(エクソン19欠失変異もしくはエクソン21L858R点突然変異)陽性、病理病期II-III期の完全切除後非小細胞肺がん患者において、ゲフィチニブによる術後補助療法はDFS、OSともに統計学的有意な延長効果を示せなかった。
2021年04月14日
実際に術前免疫チェックポイント阻害薬を受けた患者さんのコメント
このところLCMC3、CheckMate816、NEOSTARと立て続けに術前免疫チェックポイント阻害薬投与からの肺がん切除術に関する記事を書いた、
なぜ書いたかというと、今回の記事を書く前提にしたかったからである。
今回掲載するのは、本ブログのコメント欄にたびたび投稿くださった患者さんの記載内容をまとめたもので、ご許可を頂いたので書き残す。
当初は切除不能IIIB期原発性肺腺がんと診断された方だが、結果的に術前ペンブロリズマブ単剤療法の後に完全切除を施行され、病理学的完全寛解が確認され、現在も元気でお過ごしとのことである。
学会報告や論文からはうかがい知ることのできない、患者さん本人の本音がにじみ出ている。
進行期肺がんの領域で進んでいる免疫チェックポイント阻害薬+化学療法併用の波はもう周術期治療の分野にも打ち寄せてきているが、こうした患者さんの声を我々は知っておくべきだろう。
肺癌治療中の50代女子です。X年5月に非小細胞肺腺癌(T3、N3、M0、ステージⅢb)と診断されました。ドライバー遺伝子変異は無く、PD-L1発現率は95%、主治医の勧めで初回からキイトルーダで治療しました。6回投与の後、謎の筋肉痛と関節痛がひどくなり、消去法でリウマチでもヘルニアでもないから副作用かなーと判定され、腫瘍がどんどん小さくなって経過も良好だからと2ヶ月間休薬、痛みが軽減したので11月より再開しました。休薬により状態が悪くなっていないかとCTを撮ったところ、もっともっと小さくなっちゃってて。 そこで、主治医が「完治を目指して手術で切除することを検討したい」とおっしゃったのです。「完治は望めないから」とキイトルーダなわけだし、自覚症状はなく、副作用も上記のようなものであるため、私自身は告知以前と全く同じ生活(朝晩は犬と1時間ずつ早歩き、週に6日はスポーツジムでトレーニング、月に何度か2時間立ちっぱなしで仕事)ができていました。切除して肺機能になにか障害が出たらやだなー、とは思いました。そして、少なくともかかりつけの病院においては「免疫チェックポイント阻害薬で小さくなったから切除して完治」というケースはまだひとつもないと聞いており、完治したら嬉しいけど不安もあるな、と思っていました。
様々なことを考え合わせた上、素人ながら「切除手術は実験的なもの」という感触を持ちました。
告知からしばらくの間は受け止めようがなくてオロオロしましたが、その後「がんはそこにいてもいい。悪さをしなければ、そこにあってもいい」という考え方に到達したことで、「そのためのキイトルーダなのだ」と深く納得し、悪さをしなければ普通に暮らせるのだからと気が楽になり、よく食べよく飲みよく笑い、運動する、という生活に戻ることができました。キイトルーダの副作用や「耐性ができてしまったら困るな」ということは心配ではあるけれど非常に安定している、治療も生活もうまくいっていて不満がない、という状況だったのにこの提案。うーむ・・。
結局、キイトルーダ11回投与の後、X+1年3月に肺葉切除手術を受けました。切ってみたら癌細胞がなくなっていたそうです。その後、肺活量も元通り、生活にもトレーニングなどの趣味にもなんら困るところなく暮らしています。
ここまでの治療を振り返って、いくつか考えたことがあります。
1)患者自身にとっては、放射線治療も免疫チェックポイント阻害薬も未知なるもの。特に免疫チェックポイント阻害薬については診断当時知っている人が少なくて、どの治療をするか選べと言われておおいに困ってしまいました。結果的にキイトルーダを選択して吉と出ましたが、放射線治療を選択していたらどうなっていたんだろう。そこは素人が決めるとこじゃない、という気がしました。「最後は自分で決めて」のスタンスが、患者初心者にとっては非常に辛かった、という思い出です。
2)免疫チェックポイント阻害薬の効き目についてもっともっといろいろなことがわかってくれば、私のようなケースは「切らないで完治」ということになるのではないか。「切ってみたら癌細胞がなかった」というのは、嬉しさと残念さが半々でした。肺は取られちゃったあとだし。なお、投与5回めから出始めた筋肉痛は投与終了から1年4ヶ月経っても残っていて、ステロイド剤と鎮痛剤の服用を長期にわたり続けました。その後、胃をやられてしまいました。ロキソニンをはじめ、複数の痛み止めを使っていたら胃が荒れました。やむなく鎮痛剤の種類を替え、さらに分量を減らし、プレドニゾロンについてもすこしずつ減量を試みたところ、不思議なことにある時期からふと「あれ?一段階楽になったかも」と思えるようになり、揺り戻しもありつつ、最近ではあきらかに「前よりマシ」になっています。それって、キイトルーダの効力が切れるということ?そしたら再発しちゃうってこと?素人としては、そんな不安もありますけれど・・・・痛みが減るのは何にせよめでたいことと思うようにしております。
なぜ書いたかというと、今回の記事を書く前提にしたかったからである。
今回掲載するのは、本ブログのコメント欄にたびたび投稿くださった患者さんの記載内容をまとめたもので、ご許可を頂いたので書き残す。
当初は切除不能IIIB期原発性肺腺がんと診断された方だが、結果的に術前ペンブロリズマブ単剤療法の後に完全切除を施行され、病理学的完全寛解が確認され、現在も元気でお過ごしとのことである。
学会報告や論文からはうかがい知ることのできない、患者さん本人の本音がにじみ出ている。
進行期肺がんの領域で進んでいる免疫チェックポイント阻害薬+化学療法併用の波はもう周術期治療の分野にも打ち寄せてきているが、こうした患者さんの声を我々は知っておくべきだろう。
肺癌治療中の50代女子です。X年5月に非小細胞肺腺癌(T3、N3、M0、ステージⅢb)と診断されました。ドライバー遺伝子変異は無く、PD-L1発現率は95%、主治医の勧めで初回からキイトルーダで治療しました。6回投与の後、謎の筋肉痛と関節痛がひどくなり、消去法でリウマチでもヘルニアでもないから副作用かなーと判定され、腫瘍がどんどん小さくなって経過も良好だからと2ヶ月間休薬、痛みが軽減したので11月より再開しました。休薬により状態が悪くなっていないかとCTを撮ったところ、もっともっと小さくなっちゃってて。 そこで、主治医が「完治を目指して手術で切除することを検討したい」とおっしゃったのです。「完治は望めないから」とキイトルーダなわけだし、自覚症状はなく、副作用も上記のようなものであるため、私自身は告知以前と全く同じ生活(朝晩は犬と1時間ずつ早歩き、週に6日はスポーツジムでトレーニング、月に何度か2時間立ちっぱなしで仕事)ができていました。切除して肺機能になにか障害が出たらやだなー、とは思いました。そして、少なくともかかりつけの病院においては「免疫チェックポイント阻害薬で小さくなったから切除して完治」というケースはまだひとつもないと聞いており、完治したら嬉しいけど不安もあるな、と思っていました。
様々なことを考え合わせた上、素人ながら「切除手術は実験的なもの」という感触を持ちました。
告知からしばらくの間は受け止めようがなくてオロオロしましたが、その後「がんはそこにいてもいい。悪さをしなければ、そこにあってもいい」という考え方に到達したことで、「そのためのキイトルーダなのだ」と深く納得し、悪さをしなければ普通に暮らせるのだからと気が楽になり、よく食べよく飲みよく笑い、運動する、という生活に戻ることができました。キイトルーダの副作用や「耐性ができてしまったら困るな」ということは心配ではあるけれど非常に安定している、治療も生活もうまくいっていて不満がない、という状況だったのにこの提案。うーむ・・。
結局、キイトルーダ11回投与の後、X+1年3月に肺葉切除手術を受けました。切ってみたら癌細胞がなくなっていたそうです。その後、肺活量も元通り、生活にもトレーニングなどの趣味にもなんら困るところなく暮らしています。
ここまでの治療を振り返って、いくつか考えたことがあります。
1)患者自身にとっては、放射線治療も免疫チェックポイント阻害薬も未知なるもの。特に免疫チェックポイント阻害薬については診断当時知っている人が少なくて、どの治療をするか選べと言われておおいに困ってしまいました。結果的にキイトルーダを選択して吉と出ましたが、放射線治療を選択していたらどうなっていたんだろう。そこは素人が決めるとこじゃない、という気がしました。「最後は自分で決めて」のスタンスが、患者初心者にとっては非常に辛かった、という思い出です。
2)免疫チェックポイント阻害薬の効き目についてもっともっといろいろなことがわかってくれば、私のようなケースは「切らないで完治」ということになるのではないか。「切ってみたら癌細胞がなかった」というのは、嬉しさと残念さが半々でした。肺は取られちゃったあとだし。なお、投与5回めから出始めた筋肉痛は投与終了から1年4ヶ月経っても残っていて、ステロイド剤と鎮痛剤の服用を長期にわたり続けました。その後、胃をやられてしまいました。ロキソニンをはじめ、複数の痛み止めを使っていたら胃が荒れました。やむなく鎮痛剤の種類を替え、さらに分量を減らし、プレドニゾロンについてもすこしずつ減量を試みたところ、不思議なことにある時期からふと「あれ?一段階楽になったかも」と思えるようになり、揺り戻しもありつつ、最近ではあきらかに「前よりマシ」になっています。それって、キイトルーダの効力が切れるということ?そしたら再発しちゃうってこと?素人としては、そんな不安もありますけれど・・・・痛みが減るのは何にせよめでたいことと思うようにしております。
2021年04月14日
第II相NEOSTAR試験・・・術前ニボルマブ+イピリムマブ併用療法
最後にNEOSTAR試験。
こちらは術前にニボルマブ+イピリムマブ併用療法を行うというもの。
第II相臨床試験ではあるが、果たしてCheckMate816レジメンとどう住み分けることになるのか。
少なくともニボルマブに関する限り、単剤での術前療法を開発する方向には向かっていないようだ。
Neoadjuvant nivolumab or nivolumab plus ipilimumab in operable non-small cell lung cancer: the phase 2 randomized NEOSTAR trial.
Tina Cascone et al.,Nature medicine. 2021 03;27(3);504-514.
doi: 10.1038/s41591-020-01224-2.
イピリムマブは、ニボルマブと併用することによって進行非小細胞肺がんの予後を改善することが示されているが、切除可能な非小細胞肺がん病巣の免疫学的微小環境にどのように影響するのかは未知数である。今回我々は、切除可能な非小細胞肺がん患者44人を対象として、術前ニボルマブ単剤療法(N群)と術前ニボルマブ+イピリムマブ併用療法(NI群)とそれに引き続く手術の効果を、major pathological response(MPR)を主要評価項目として検証するランダム化第II相NEOSTAR試験の結果について報告する。MPR割合は、術前化学療法によって得られるそれをhistolical controlとして統計解析にかけた。NI群においては、21人の患者のうち6人でMPRが達成されることを有効性の閾値としたが、今回は21人中8人(38%)でMPRが得られたため、有効と判定した。一方N群においては、23人中5人(22%)でMPRが得られた。プロトコール治療中に計37人の患者が手術を受け、N群におけるMPR割合は24%(5/21)、NI群におけるMPR割合は50%(8/16)だった。病理学的完全奏効割合(N群 10% vs NI群 38%)、生存腫瘍細胞割合中央値(N群 50% vs NI群 9%)、腫瘍病巣内に残存するT細胞数のいずれもNI群で優れていた。腸管内におけるRuminococcusとAkkermansia属の増加がNI群のMPR割合と相関していた。
こちらは術前にニボルマブ+イピリムマブ併用療法を行うというもの。
第II相臨床試験ではあるが、果たしてCheckMate816レジメンとどう住み分けることになるのか。
少なくともニボルマブに関する限り、単剤での術前療法を開発する方向には向かっていないようだ。
Neoadjuvant nivolumab or nivolumab plus ipilimumab in operable non-small cell lung cancer: the phase 2 randomized NEOSTAR trial.
Tina Cascone et al.,Nature medicine. 2021 03;27(3);504-514.
doi: 10.1038/s41591-020-01224-2.
イピリムマブは、ニボルマブと併用することによって進行非小細胞肺がんの予後を改善することが示されているが、切除可能な非小細胞肺がん病巣の免疫学的微小環境にどのように影響するのかは未知数である。今回我々は、切除可能な非小細胞肺がん患者44人を対象として、術前ニボルマブ単剤療法(N群)と術前ニボルマブ+イピリムマブ併用療法(NI群)とそれに引き続く手術の効果を、major pathological response(MPR)を主要評価項目として検証するランダム化第II相NEOSTAR試験の結果について報告する。MPR割合は、術前化学療法によって得られるそれをhistolical controlとして統計解析にかけた。NI群においては、21人の患者のうち6人でMPRが達成されることを有効性の閾値としたが、今回は21人中8人(38%)でMPRが得られたため、有効と判定した。一方N群においては、23人中5人(22%)でMPRが得られた。プロトコール治療中に計37人の患者が手術を受け、N群におけるMPR割合は24%(5/21)、NI群におけるMPR割合は50%(8/16)だった。病理学的完全奏効割合(N群 10% vs NI群 38%)、生存腫瘍細胞割合中央値(N群 50% vs NI群 9%)、腫瘍病巣内に残存するT細胞数のいずれもNI群で優れていた。腸管内におけるRuminococcusとAkkermansia属の増加がNI群のMPR割合と相関していた。
2021年04月14日
第III相CheckMate816試験・・・ニボルマブ併用術前化学療法により病理学的完全奏効割合が改善
こちらは、ニボルマブ+プラチナ併用化学療法を術前に行うことにより、病理学的完全奏効割合が有意に改善したとする第III相臨床試験。
術前治療による病理学的完全奏効は術後再発割合を下げ、生存期間延長に寄与するとされている。
しかしながら、本治療の真価は生存期間解析の結果を以て確認すべきである。
術前治療の有用性が第III相臨床試験で示されることはほとんどなく、非常に貴重な報告である。
このテーマに関する過去の記事を検索してみたが、わずかに1本しか見つからなかった。
http://oitahaiganpractice.junglekouen.com/e507188.html
CT003 - Nivolumab (NIVO) + platinum-doublet chemotherapy (chemo) vs chemo as neoadjuvant treatment (tx) for resectable (IB-IIIA) non-small cell lung cancer (NSCLC) in the phase 3 CheckMate 816 trial
Patrick M. Forde et al., AACR 2021
背景:
遠隔転移のない非小細胞肺がん患者において、手術療法は治癒が期待できる治療だが、手術を受けた患者のうち30-80%で術後再発する。再発リスクの高い患者では術前もしくは術後化学療法が推奨されるものの、その治療効果はさほど高くなく、術前化学療法により病理学的完全奏効が得られることは少ない。PD-1経路を治療標的とした免疫チェックポイント阻害薬は進行非小細胞肺がん患者の生命予後を改善したが、完全切除可能な患者における免疫チェックポイント阻害薬の有効性について、第III相臨床試験の結果はまだ報告されていない。近年、ニボルマブ単剤、あるいはニボルマブと化学療法の併用に関する第II相単アーム臨床試験において、有望な病理学的完全奏効割合が示された。今回は、完全切除可能な非小細胞肺がん患者を対象に、術前療法としてのニボルマブ併用化学療法群と化学療法単独群を比較するランダム化第III相オープンラベルCheckMate816試験について、主要評価項目の1つである病理学的完全奏効の最終解析結果について報告する。
方法:
臨床病期IB(原発巣の最大径が4cm以上)からIIIA期(AJCC第7版準拠)の完全切除可能非小細胞肺がん患者で、ECOG-PS 0-1、EGFR遺伝子変異もしくはALK融合遺伝子のないものを対象とし、ニボルマブ+プラチナ併用化学療法群(NC群:ニボルマブ360mg+プラチナ併用化学療法を3週ごとに3コース施行)とプラチナ併用化学療法単独群(C群:プラチナ併用化学療法を3週ごとに3コース施行)に無作為に割り付けて、その後に手術を行った。割付調整因子は臨床病期(IB / II期 vs IIIA期)、PD-L1発現状態(≧1% vs <1%)、性別とした。主要評価項目は、独立委員会評価による病理学的完全奏効割合と無再発生存期間とした。病理学的完全奏効は切除した肺とリンパ節に生存腫瘍細胞が全く認められない(0%)ことと定義した。手術が行われなかった患者は、術前治療の効果が得られなかったものとみなした。副次評価項目は全生存期間、major pathological response(MPR:切除した肺とリンパ節に認められる生存腫瘍細胞が全体の10%以下)、試験参加から死亡もしくは遠隔転移発覚までの期間、とした。探索的評価項目は奏効割合、治療効果予測因子としてPD-L1発現状態とtumor mutational burden(TMB)とした。
結果:
NC群、C群ともに患者数は179人で、患者背景に差はなかった。intent-to-treat解析において、NC群で有意に病理学的完全奏効割合が改善した(NC群で24.0%、C群で2.2%、オッズ比は13.94(99%信頼区間は3.49-55.75、p<0.0001)。この所見は、どのサブグループ解析においても同様に認められた;IB / II期(26.2% vs 4.8%)、IIIA期以上(23.0% vs 0.9%)、PD-L1<1%(16.7% vs 2.6%)、PD-L1≧1%(32.6% vs 2.2%)、TMB低値(22.4% vs 1.9%)、TMB高値(30.8% vs 2.7%)。MPR割合(36.9% vs 8.9%)、奏効割合(53.6% vs 37.4%)、画像診断上の病期改善割合(30.7% vs 23.5%)もNC群で良好だった。定型的な手術はNC群の83.2%、C群の75.4%で実施された。毒性により手術不能となった患者は各群2人ずつと少数で、病勢進行により手術不能となった患者はNC群で12人、C群で17人だった。Grade 3-4の薬物療法関連有害事象はNC群の33.5%、C群の36.9%で、Grade 3-4の手術関連有害事象はNC群の11.4%、C群の14.8%で認められた。
結論:
CheckMate816試験は、主要評価項目の1つである完全奏効割合をNC群が統計学的有意に改善することを示した。ニボルマブ+プラチナ併用化学療法による毒性として新規なものは認められず、本治療を行うことにより手術実施に支障をきたすことはなかった。
術前治療による病理学的完全奏効は術後再発割合を下げ、生存期間延長に寄与するとされている。
しかしながら、本治療の真価は生存期間解析の結果を以て確認すべきである。
術前治療の有用性が第III相臨床試験で示されることはほとんどなく、非常に貴重な報告である。
このテーマに関する過去の記事を検索してみたが、わずかに1本しか見つからなかった。
http://oitahaiganpractice.junglekouen.com/e507188.html
CT003 - Nivolumab (NIVO) + platinum-doublet chemotherapy (chemo) vs chemo as neoadjuvant treatment (tx) for resectable (IB-IIIA) non-small cell lung cancer (NSCLC) in the phase 3 CheckMate 816 trial
Patrick M. Forde et al., AACR 2021
背景:
遠隔転移のない非小細胞肺がん患者において、手術療法は治癒が期待できる治療だが、手術を受けた患者のうち30-80%で術後再発する。再発リスクの高い患者では術前もしくは術後化学療法が推奨されるものの、その治療効果はさほど高くなく、術前化学療法により病理学的完全奏効が得られることは少ない。PD-1経路を治療標的とした免疫チェックポイント阻害薬は進行非小細胞肺がん患者の生命予後を改善したが、完全切除可能な患者における免疫チェックポイント阻害薬の有効性について、第III相臨床試験の結果はまだ報告されていない。近年、ニボルマブ単剤、あるいはニボルマブと化学療法の併用に関する第II相単アーム臨床試験において、有望な病理学的完全奏効割合が示された。今回は、完全切除可能な非小細胞肺がん患者を対象に、術前療法としてのニボルマブ併用化学療法群と化学療法単独群を比較するランダム化第III相オープンラベルCheckMate816試験について、主要評価項目の1つである病理学的完全奏効の最終解析結果について報告する。
方法:
臨床病期IB(原発巣の最大径が4cm以上)からIIIA期(AJCC第7版準拠)の完全切除可能非小細胞肺がん患者で、ECOG-PS 0-1、EGFR遺伝子変異もしくはALK融合遺伝子のないものを対象とし、ニボルマブ+プラチナ併用化学療法群(NC群:ニボルマブ360mg+プラチナ併用化学療法を3週ごとに3コース施行)とプラチナ併用化学療法単独群(C群:プラチナ併用化学療法を3週ごとに3コース施行)に無作為に割り付けて、その後に手術を行った。割付調整因子は臨床病期(IB / II期 vs IIIA期)、PD-L1発現状態(≧1% vs <1%)、性別とした。主要評価項目は、独立委員会評価による病理学的完全奏効割合と無再発生存期間とした。病理学的完全奏効は切除した肺とリンパ節に生存腫瘍細胞が全く認められない(0%)ことと定義した。手術が行われなかった患者は、術前治療の効果が得られなかったものとみなした。副次評価項目は全生存期間、major pathological response(MPR:切除した肺とリンパ節に認められる生存腫瘍細胞が全体の10%以下)、試験参加から死亡もしくは遠隔転移発覚までの期間、とした。探索的評価項目は奏効割合、治療効果予測因子としてPD-L1発現状態とtumor mutational burden(TMB)とした。
結果:
NC群、C群ともに患者数は179人で、患者背景に差はなかった。intent-to-treat解析において、NC群で有意に病理学的完全奏効割合が改善した(NC群で24.0%、C群で2.2%、オッズ比は13.94(99%信頼区間は3.49-55.75、p<0.0001)。この所見は、どのサブグループ解析においても同様に認められた;IB / II期(26.2% vs 4.8%)、IIIA期以上(23.0% vs 0.9%)、PD-L1<1%(16.7% vs 2.6%)、PD-L1≧1%(32.6% vs 2.2%)、TMB低値(22.4% vs 1.9%)、TMB高値(30.8% vs 2.7%)。MPR割合(36.9% vs 8.9%)、奏効割合(53.6% vs 37.4%)、画像診断上の病期改善割合(30.7% vs 23.5%)もNC群で良好だった。定型的な手術はNC群の83.2%、C群の75.4%で実施された。毒性により手術不能となった患者は各群2人ずつと少数で、病勢進行により手術不能となった患者はNC群で12人、C群で17人だった。Grade 3-4の薬物療法関連有害事象はNC群の33.5%、C群の36.9%で、Grade 3-4の手術関連有害事象はNC群の11.4%、C群の14.8%で認められた。
結論:
CheckMate816試験は、主要評価項目の1つである完全奏効割合をNC群が統計学的有意に改善することを示した。ニボルマブ+プラチナ併用化学療法による毒性として新規なものは認められず、本治療を行うことにより手術実施に支障をきたすことはなかった。
2021年04月14日
LCMC3・・・アテゾリズマブ単剤による術前治療の効果
何件か、術前免疫チェックポイント阻害薬療法について取り扱う。
まずはLCMC3試験の初期評価報告について。
今年1月に開催された世界肺癌会議で取り扱われていた。
化学療法薬の開発の経緯を振り返ると、周術期治療に関する臨床試験は抗悪性腫瘍薬開発における最終段階と考えていいだろう。
LCMC3試験において、アテゾリズマブは主要評価項目を達成しており、今後の第III相試験が期待される。
しかし、他の記事で取り扱うが、この分野ではニボルマブが開発の一歩先を行っているようだ。
LCMC3 Findings Indicate Neoadjuvant Atezolizumab Safe, Efficacious in Resectable Stage IB-IIIB NSCLC
Kara Nyberg, PhD, et al., PRESIDENTIAL SYMPOSIUM WCLC 2020 ARCHIVE Abst.#PS01.05
JAN 28, 2021
第II相Lung Cancer Mutation Consortium(LCMC)3臨床試験の解析データ第一陣から、アテゾリズマブによる術前治療が根治切除可能なIB-IIIB期の非小細胞肺がん患者の一部において検討する価値のある治療選択肢であることが示唆された。EGFR遺伝子変異もしくはALK融合遺伝子を伴わない患者の21%で、切除時点でmajor pathologic response(MPR)‐残存腫瘍細胞が腫瘍全体の10%未満‐に至っており、本試験の主要評価項目を達成した。一方、病理学的完全奏効‐残存腫瘍細胞が全くない‐はこの患者群の7%に留まった。病理学的な評価が可能だった155人のうち43%でアテゾリズマブによる術前治療で病期が改善し、一方19%では病期が進行した。
術前化学療法と異なり、アテゾリズマブによる術前治療では周術期の合併症や手術関連死を抑えつつ、術前治療終了後すぐに手術を行うことができ、完全切除割合も高かった。本試験は比較的多数の患者を対象に行われたため、術前治療の有効性に関する今後の臨床試験のベンチマークとなり得る結果を残した。
LCMC3試験はオープンラベル、単アームの試験デザインが特徴である。計181人の根治切除可能なIB-IIIA期、もしくは慎重に手術適応を判断されたIIIB期の非小細胞肺がん患者が参加した。全ての患者は最大2コースの術前アテゾリズマブ療法(1200mg/日、3週ごと)を受け、最後にアテゾリズマブが投与されてから8-28日目(試験治療開始から30日目から50日目)に根治切除を予定することとした。
181人が本試験に参加し、159人(88%)が術前アテゾリズマブ療法ののちに根治切除に進み、アテゾリズマブの最終投与日から手術を行うまでの期間中央値は22日(11-74日)だった。159人中140人は、試験治療開始から30-50日間の範囲内で根治切除術を受けていた。アテゾリズマブの最終投与から既定の日程以内に手術を受けられなかった19人においても、9人では物流の問題、6人では他の合併症の問題、4人では治療に直接関係のない問題が原因だった。
手術そのものについては、低侵襲な手術法で臨んだ101人のうち、15人で開胸術への移行を要した。すなわち、ロボット支援手術や胸腔鏡か切除が54%、開胸術が46%を占めたということである。R0切除ができたのは92%で、術前化学療法の臨床試験のhistolical controlと比較して良好だった。
なお、生存期間解析については追跡期間が2.1年と短いものの、1年無病生存割合はI / II期、III期の患者でいずれも85%、1.5年無病生存割合はI / II期で79%、III期で77%だった。同様に、1年生存割合はI / II期の患者で92%、III期の患者で95%、1.5年生存割合はI / II期の患者で91%、III期の患者で87%だった。
まずはLCMC3試験の初期評価報告について。
今年1月に開催された世界肺癌会議で取り扱われていた。
化学療法薬の開発の経緯を振り返ると、周術期治療に関する臨床試験は抗悪性腫瘍薬開発における最終段階と考えていいだろう。
LCMC3試験において、アテゾリズマブは主要評価項目を達成しており、今後の第III相試験が期待される。
しかし、他の記事で取り扱うが、この分野ではニボルマブが開発の一歩先を行っているようだ。
LCMC3 Findings Indicate Neoadjuvant Atezolizumab Safe, Efficacious in Resectable Stage IB-IIIB NSCLC
Kara Nyberg, PhD, et al., PRESIDENTIAL SYMPOSIUM WCLC 2020 ARCHIVE Abst.#PS01.05
JAN 28, 2021
第II相Lung Cancer Mutation Consortium(LCMC)3臨床試験の解析データ第一陣から、アテゾリズマブによる術前治療が根治切除可能なIB-IIIB期の非小細胞肺がん患者の一部において検討する価値のある治療選択肢であることが示唆された。EGFR遺伝子変異もしくはALK融合遺伝子を伴わない患者の21%で、切除時点でmajor pathologic response(MPR)‐残存腫瘍細胞が腫瘍全体の10%未満‐に至っており、本試験の主要評価項目を達成した。一方、病理学的完全奏効‐残存腫瘍細胞が全くない‐はこの患者群の7%に留まった。病理学的な評価が可能だった155人のうち43%でアテゾリズマブによる術前治療で病期が改善し、一方19%では病期が進行した。
術前化学療法と異なり、アテゾリズマブによる術前治療では周術期の合併症や手術関連死を抑えつつ、術前治療終了後すぐに手術を行うことができ、完全切除割合も高かった。本試験は比較的多数の患者を対象に行われたため、術前治療の有効性に関する今後の臨床試験のベンチマークとなり得る結果を残した。
LCMC3試験はオープンラベル、単アームの試験デザインが特徴である。計181人の根治切除可能なIB-IIIA期、もしくは慎重に手術適応を判断されたIIIB期の非小細胞肺がん患者が参加した。全ての患者は最大2コースの術前アテゾリズマブ療法(1200mg/日、3週ごと)を受け、最後にアテゾリズマブが投与されてから8-28日目(試験治療開始から30日目から50日目)に根治切除を予定することとした。
181人が本試験に参加し、159人(88%)が術前アテゾリズマブ療法ののちに根治切除に進み、アテゾリズマブの最終投与日から手術を行うまでの期間中央値は22日(11-74日)だった。159人中140人は、試験治療開始から30-50日間の範囲内で根治切除術を受けていた。アテゾリズマブの最終投与から既定の日程以内に手術を受けられなかった19人においても、9人では物流の問題、6人では他の合併症の問題、4人では治療に直接関係のない問題が原因だった。
手術そのものについては、低侵襲な手術法で臨んだ101人のうち、15人で開胸術への移行を要した。すなわち、ロボット支援手術や胸腔鏡か切除が54%、開胸術が46%を占めたということである。R0切除ができたのは92%で、術前化学療法の臨床試験のhistolical controlと比較して良好だった。
なお、生存期間解析については追跡期間が2.1年と短いものの、1年無病生存割合はI / II期、III期の患者でいずれも85%、1.5年無病生存割合はI / II期で79%、III期で77%だった。同様に、1年生存割合はI / II期の患者で92%、III期の患者で95%、1.5年生存割合はI / II期の患者で91%、III期の患者で87%だった。
2021年03月24日
ADAURA試験サブグループ解析・・・術後補助化学療法の有無、病期別の解析結果
CoVID-19に翻弄され続けた2020年度だったが、ワクチンの登場によりまだ時間はかかるだろうが出口は見えてきた感がある。
あと1年間経過すれば、随分と世界は変わっていることだろう。
CoVID-19にめげず、肺がん領域ではいろいろと新しい知見が今年度も提供されたが、やはり白眉はADAURA試験ではないか。
完全切除後のEGFR遺伝子変異陽性肺がん患者において、圧倒的な差異を以て無病生存期間を延長した。
標準的な術後補助化学療法を行うことが前提で(行うかどうかの最終的な判断は担当医と患者に委ねられていたが)、やるべき治療をやった後にオシメルチニブを上乗せするかどうかという臨床試験だった。
オシメルチニブ以外の、もっとサイフに優しいEGFR阻害薬ではどうなのか、という疑問は残るものの、これだけ圧倒的な無病生存期間延長効果を見せつけられると、少なくとも治療選択肢を患者に提供しないわけにはいかない。
New England Journal of Medicine誌に掲載された論文の要約を掲載するとともに、術後補助化学商法施行の有無、各病期別の無病生存期間解析データが2020年世界肺癌会議や2021年日本臨床腫瘍学会で報告されていた。
stage IBの患者集団に関しては、我が国ではUFT内服による術後補助化学療法が標準治療とされているために、どうオシメルチニブを適用するかの議論が必要だと思われるが、少なくともII-IIIA期の患者では我が国でもオシメルチニブ投与を考えるべきだろう。
Osimertinib in Resected EGFR-Mutated Non–Small-Cell Lung Cancer
Yi-long Wu, Masahiro Tsuboi et al., N Engl J Med 2020; 383:1711-1723
DOI: 10.1056/NEJMoa2027071
背景:
オシメルチニブはEGFR遺伝子変異陽性未治療進行非小細胞肺がんの標準治療である。術後補助療法としてのオシメルチニブの有効性と安全性は明らかでない。
方法:
今回の二重盲検第III相臨床試験では、完全切除後のEGFR遺伝子変異陽性非小細胞肺がん患者を、オシメルチニブ群(80mgを1日1回服用)とプラセボ群に1:1の割合で無作為に割り付け、最長3年間治療を継続した。主要評価項目は担当医評価によるII期およびIIIA期の患者の無病生存期間とした。副次評価項目には全患者集団(IB期からIIIA期まで)の無病生存期間、全生存期間、安全性とした。
結果:
682人の患者に対して無作為割り付けを行った(オシメルチニブ群339人、プラセボ群343人)。24ヶ月時点で、II期およびIIIA期の患者のうち、オシメルチニブ群の90%(95%信頼区間84%-93%)とプラセボ群の44%(95%信頼区間37%-51%)が無病生存していた(ハザード比0.17、99.06%信頼区間0.11-0.26、p<0.001)。全体集団では、オシメルチニブ群の89%(95%信頼区間85%-92%)、プラセボ群の52%(95%信頼区間46-58%)が無病生存していた(ハザード比0.20、99.12%信頼区間0.14-0.30、p<0.001)。24ヶ月時点で、オシメルチニブ群の98%(95%信頼区間95-99%)、プラセボ群の85%(95%信頼区間80-89%)は中枢神経系への転移なく生存していた(頭蓋内無病生存期間に関するハザード比は0.18、95%信頼区間0.10-0.33)。全生存期間イベントは29件(オシメルチニブ群9件、プラセボ群20件)と少なく、解析段階になかった。新規の有害事象は認めなかった。
結論:
IB期からIIIA期のEGFR遺伝子変異陽性非小細胞肺がんにおいて、オシメルチニブ群ではプラセボ群と比較して有意に無病生存期間が延長した。
Postoperative Chemotherapy Use and Outcomes from ADAURA: Osimertinib as Adjuvant Therapy for Resected EGFR Mutated NSCLC
Yi-long Wu et al., WCLC2020, Abst.#OA06.04
Postoperative chemotherapy patterns and outcomes from ADAURA: osimertinib as adjuvant therapy for resected EGFRm NSCLC
Kato et al., JSMO2021, Abst.#MO29-7
背景:
非小細胞肺がん患者のうち約30%は切除可能な状態で発見される。術後病理病期II期、IIIA期、あるいは一部のIB期患者に対しては、術後補助化学療法が推奨される。しかしながら、術後再発率は高い。今回の第III相、二重盲検、ランダム化ADAURA試験では、オシメルチニブ(第3世代、非可逆性、中枢神経系への活性を有するEGFR阻害薬)は完全切除、適応のある患者ではさらに術後補助化学療法追加後のIB-IIIA期EGFR遺伝子変異陽性非小細胞肺がん患者に対し、統計学的有意に、臨床的にも意味のある無病生存期間延長効果(ハザード比0.20、99.12%信頼区間0.14-0.30、p<0.001)を示した。今回は、術後補助化学療法施行有無とアウトカムに関する探索的検討を行った。
方法:
完全切除後のIB-IIIA期(AJCC-TNM分類第7版、病理病期)EGFR遺伝子変異陽性非小細胞肺がん患者を対象に、オシメルチニブ群(80mgを1日1回服用)とプラセボ群に1:1の割合で割り付けて、治療開始から3年間経過するか再発するかまで治療を継続した。ランダム化前の標準術後補助化学療法は、担当医および患者の判断で、してもしなくてもよいことになっていた。術後補助化学療法を施行したか否かに関する統計解析は探索的なものと位置付けられていた。術後補助化学療法施行のあり・なし別の全患者集団の無病生存期間解析は、予め定められたサブグループ解析で、コックス比例ハザードモデルを用いて解析された。データカットオフは2020年1月17日時点とした。
結果:
ADAURA試験では、無作為割り付けされた患者全体のうち60%(682人中410人)が術後補助化学療法を受けており、治療コース数の中央値は4コースで、各治療群間に均等に割り付けられていた。410人中、409人がプラチナ併用化学療法を、残る1人は単剤化学療法を適用されており、ほとんどはII期もしくはIIIA期の患者だった(II期の患者全体のうち71%(231人中165人)、IIIA期の患者全体のうち80%(235人中187人)、IB期の患者全体のうち26%(216人中57人))。全体として、70歳未満の患者のうち66%(509人中338人)、70歳以上の患者のうち42%(173人中72人)、75歳以上の患者のうち27%(78人中21人)が術後補助化学療法を受けていた。WHO分類におけるPSは、術後補助化学療法施行の有無と相関はなかった(術後補助化学療法を受けたのはPS 0の患者の60%、PS 1の患者の60%)。アジア人患者414人のうち65%、非アジア人患者268人のうち53%が術後補助化学療法を受けていた。術後補助化学療法の有無、各病期別の無病生存期間解析結果は図表のとおりである。
結論:
ADAURA試験における術後補助化学療法施行状況は、過去の臨床試験結果や実地臨床に即していた。予想されたように、若い患者やより進行した患者では術後補助化学療法が積極的に行われており、一方でPSの良し悪しとは関連がなかった。病理病期に拠らず、術後補助化化学療法施行の有無によらず、オシメルチニブによる術後治療は無病生存期間の延長に寄与していた。

あと1年間経過すれば、随分と世界は変わっていることだろう。
CoVID-19にめげず、肺がん領域ではいろいろと新しい知見が今年度も提供されたが、やはり白眉はADAURA試験ではないか。
完全切除後のEGFR遺伝子変異陽性肺がん患者において、圧倒的な差異を以て無病生存期間を延長した。
標準的な術後補助化学療法を行うことが前提で(行うかどうかの最終的な判断は担当医と患者に委ねられていたが)、やるべき治療をやった後にオシメルチニブを上乗せするかどうかという臨床試験だった。
オシメルチニブ以外の、もっとサイフに優しいEGFR阻害薬ではどうなのか、という疑問は残るものの、これだけ圧倒的な無病生存期間延長効果を見せつけられると、少なくとも治療選択肢を患者に提供しないわけにはいかない。
New England Journal of Medicine誌に掲載された論文の要約を掲載するとともに、術後補助化学商法施行の有無、各病期別の無病生存期間解析データが2020年世界肺癌会議や2021年日本臨床腫瘍学会で報告されていた。
stage IBの患者集団に関しては、我が国ではUFT内服による術後補助化学療法が標準治療とされているために、どうオシメルチニブを適用するかの議論が必要だと思われるが、少なくともII-IIIA期の患者では我が国でもオシメルチニブ投与を考えるべきだろう。
Osimertinib in Resected EGFR-Mutated Non–Small-Cell Lung Cancer
Yi-long Wu, Masahiro Tsuboi et al., N Engl J Med 2020; 383:1711-1723
DOI: 10.1056/NEJMoa2027071
背景:
オシメルチニブはEGFR遺伝子変異陽性未治療進行非小細胞肺がんの標準治療である。術後補助療法としてのオシメルチニブの有効性と安全性は明らかでない。
方法:
今回の二重盲検第III相臨床試験では、完全切除後のEGFR遺伝子変異陽性非小細胞肺がん患者を、オシメルチニブ群(80mgを1日1回服用)とプラセボ群に1:1の割合で無作為に割り付け、最長3年間治療を継続した。主要評価項目は担当医評価によるII期およびIIIA期の患者の無病生存期間とした。副次評価項目には全患者集団(IB期からIIIA期まで)の無病生存期間、全生存期間、安全性とした。
結果:
682人の患者に対して無作為割り付けを行った(オシメルチニブ群339人、プラセボ群343人)。24ヶ月時点で、II期およびIIIA期の患者のうち、オシメルチニブ群の90%(95%信頼区間84%-93%)とプラセボ群の44%(95%信頼区間37%-51%)が無病生存していた(ハザード比0.17、99.06%信頼区間0.11-0.26、p<0.001)。全体集団では、オシメルチニブ群の89%(95%信頼区間85%-92%)、プラセボ群の52%(95%信頼区間46-58%)が無病生存していた(ハザード比0.20、99.12%信頼区間0.14-0.30、p<0.001)。24ヶ月時点で、オシメルチニブ群の98%(95%信頼区間95-99%)、プラセボ群の85%(95%信頼区間80-89%)は中枢神経系への転移なく生存していた(頭蓋内無病生存期間に関するハザード比は0.18、95%信頼区間0.10-0.33)。全生存期間イベントは29件(オシメルチニブ群9件、プラセボ群20件)と少なく、解析段階になかった。新規の有害事象は認めなかった。
結論:
IB期からIIIA期のEGFR遺伝子変異陽性非小細胞肺がんにおいて、オシメルチニブ群ではプラセボ群と比較して有意に無病生存期間が延長した。
Postoperative Chemotherapy Use and Outcomes from ADAURA: Osimertinib as Adjuvant Therapy for Resected EGFR Mutated NSCLC
Yi-long Wu et al., WCLC2020, Abst.#OA06.04
Postoperative chemotherapy patterns and outcomes from ADAURA: osimertinib as adjuvant therapy for resected EGFRm NSCLC
Kato et al., JSMO2021, Abst.#MO29-7
背景:
非小細胞肺がん患者のうち約30%は切除可能な状態で発見される。術後病理病期II期、IIIA期、あるいは一部のIB期患者に対しては、術後補助化学療法が推奨される。しかしながら、術後再発率は高い。今回の第III相、二重盲検、ランダム化ADAURA試験では、オシメルチニブ(第3世代、非可逆性、中枢神経系への活性を有するEGFR阻害薬)は完全切除、適応のある患者ではさらに術後補助化学療法追加後のIB-IIIA期EGFR遺伝子変異陽性非小細胞肺がん患者に対し、統計学的有意に、臨床的にも意味のある無病生存期間延長効果(ハザード比0.20、99.12%信頼区間0.14-0.30、p<0.001)を示した。今回は、術後補助化学療法施行有無とアウトカムに関する探索的検討を行った。
方法:
完全切除後のIB-IIIA期(AJCC-TNM分類第7版、病理病期)EGFR遺伝子変異陽性非小細胞肺がん患者を対象に、オシメルチニブ群(80mgを1日1回服用)とプラセボ群に1:1の割合で割り付けて、治療開始から3年間経過するか再発するかまで治療を継続した。ランダム化前の標準術後補助化学療法は、担当医および患者の判断で、してもしなくてもよいことになっていた。術後補助化学療法を施行したか否かに関する統計解析は探索的なものと位置付けられていた。術後補助化学療法施行のあり・なし別の全患者集団の無病生存期間解析は、予め定められたサブグループ解析で、コックス比例ハザードモデルを用いて解析された。データカットオフは2020年1月17日時点とした。
結果:
ADAURA試験では、無作為割り付けされた患者全体のうち60%(682人中410人)が術後補助化学療法を受けており、治療コース数の中央値は4コースで、各治療群間に均等に割り付けられていた。410人中、409人がプラチナ併用化学療法を、残る1人は単剤化学療法を適用されており、ほとんどはII期もしくはIIIA期の患者だった(II期の患者全体のうち71%(231人中165人)、IIIA期の患者全体のうち80%(235人中187人)、IB期の患者全体のうち26%(216人中57人))。全体として、70歳未満の患者のうち66%(509人中338人)、70歳以上の患者のうち42%(173人中72人)、75歳以上の患者のうち27%(78人中21人)が術後補助化学療法を受けていた。WHO分類におけるPSは、術後補助化学療法施行の有無と相関はなかった(術後補助化学療法を受けたのはPS 0の患者の60%、PS 1の患者の60%)。アジア人患者414人のうち65%、非アジア人患者268人のうち53%が術後補助化学療法を受けていた。術後補助化学療法の有無、各病期別の無病生存期間解析結果は図表のとおりである。
結論:
ADAURA試験における術後補助化学療法施行状況は、過去の臨床試験結果や実地臨床に即していた。予想されたように、若い患者やより進行した患者では術後補助化学療法が積極的に行われており、一方でPSの良し悪しとは関連がなかった。病理病期に拠らず、術後補助化化学療法施行の有無によらず、オシメルチニブによる術後治療は無病生存期間の延長に寄与していた。

2021年01月10日
母親の子宮頸がんから転移した、子供の転移性肺がん
先日、NHKニュースや地方紙を含めた新聞報道で取り上げられていた話題。
https://www.ncc.go.jp/jp/information/pr_release/2020/20210107/index.html
母親の子宮頸がん由来のがん細胞が、経腟分娩の際に子供の肺へと吸い込まれてそこに生着し、転移性肺がんを発症したという極めて稀な症例報告が、New England Journal of Medicineに掲載された。
次世代シーケンサー解析やFISHといったおなじみのテクノロジーを用いて、子供から検出したがん組織が母親由来であったことが示されている。
学術的に見れば、
・ものすごく稀な症例をまとめて2例報告した
・がんの進行抑制に、同種免疫反応が一役かっている
・同種免疫反応が、免疫チェックポイント阻害薬の有効性にも関わっている
・(疑い例を含む)子宮頸がん合併妊娠では、帝王切開が第一選択である
というメッセージが込められているようだが、計算上は5億件に1件という極めて稀なケースのため、日常臨床に役立つかどうかはわからない。
しかし、ファンタジーとして見るならば、とても興味深い。
報道を見ているだけではわからない細部にこそ、この報告の大切な部分が記されているように感じたので、ほぼ全文を日本語訳して書き残す。
医師免許を持った小説家が好んで取り上げそうな話題ではないだろうか。
2症例ともに母親は既に亡くなった後だが、子供の病に直面し、残された父親や両家の祖父母の戸惑い、心労、治療がうまくいったときの安堵、そして、テクノロジーを駆使して調べた末に、病気が母親由来だったことが判明したときの葛藤など、様々想いを馳せるととても切なくなる。
2症例とも、最後の治療が終わってからまだ2年にも満たないようだが、母親の魂に護られてすくすくと育ってほしいと願うばかりである。
Vaginal Transmission of Cancer from Mothers with Cervical Cancer to Infants
Ayumu Arakawa et al., N Engl J Med 2021; 384:42-50
DOI: 10.1056/NEJMoa2030391
母親から子へのがんの転移は極めてまれとされており、がんに罹患した母親50万人に対して1人の割合で起こるとされている。一方、母親1000人に対して1件の割合で出産時の母親にがんの合併が認められるとされている(ため、一般の出産5億件に対して1件の割合で母親から子へのがんの転移が発生すると見積もられる)。過去に18件、こうした症例が文献報告されている。こうした報告では、母親由来の血液腫瘍(6件)、悪性黒色腫(8件)、肺がん(小細胞がん2件、腺がん1件)、子宮頸がん(神経内分泌がん2件、腺がん1件)はおそらく循環系(経胎盤的)を介して母親から胎児へと移行し、ときに母親由来の腫瘍細胞が子の多臓器(脳、骨、肝、軟部組織)へ播種性に広がっている。文献報告されている症例では、全て子が2歳未満の時点で診断されていた。いくつかの症例では、罹患した子のがん病巣の自然退縮が認められた。経胎盤的な胎児への転移は、胎盤のバリア機能や子の同種免疫反応のために、稀であろうと考えられる。
経胎盤的経路以外にも、出産時の経産道的な子への転移もまた、理論的には起こりうる。もし母親が子宮頸がんに罹患していたとすると、子は産道を通過してくるときに産道内の液体に含まれたがん細胞に暴露され、子の肺内へ母親のがん細胞が吸引されうる。したがって、子宮頸がんに罹患した女性が子を経腟分娩することは、母親から子へのがんの転移の危険因子となりうる。しかしながら、こうしたケースはまれであるがゆえに、裏付けデータが不足している。
今回我々は2件の症例について報告する。母親の子宮頸がんが子へ転移し、小児肺がんを発症したと考えられる症例である。いずれも、国立がん研究センター中央病院で行っていた臨床試験であるTOP-GEAR(Trial of Onco-Panel for Gene-profiling to Estimate both Adverse Events and Response during cancer treatment)に参加した患者の、腫瘍サンプルおよび対を成す正常組織サンプルの、次世代シーケンサー解析の結果解析からたまたま明らかになった。
<症例1>
生後23か月の男児が、痰を伴う咳が2週間続くということで近くの医療機関を受診した。CTを撮影したところ、両肺の気管支分岐に沿うような分布で、多数の腫瘤性病変を認めた。外科的肺生検を行ったところ、部分的に腺組織への分化を示す神経内分泌がんの存在が明らかとなった。
本患者が生まれる7か月前、患者の母親は子宮スメア細胞診を受けており、結果は陰性だった。本患者は妊娠39週で経腟分娩で生まれた。出産当時母親は35歳で、ヒトパピローマウイルスワクチンの接種はしていなかったが、本患者を出産してから3か月後に子宮頸部の扁平上皮がんと確定診断された。確定診断後、母親は広範子宮全摘術及び骨盤内リンパ節郭清を受け、術後補助化学療法を4コース施行された。本患者の外科的肺生検で得られた病理組織像と、母親の子宮頸がんの病理組織像が異なっていたため、この時点では母親から子へのがんの転移は想定していなかった。
両親の希望で、本患者はまめに経過観察された一方で、特段の追加治療は受けてこなかった。外科的肺生検から1年後、残存病巣が増大した。この時点で、3歳となった本患者の追加治療について検討するために、国立がん研究センター中央病院を紹介受診した。驚くべきことに、いくつかの病巣は自然退縮傾向にあった。胸部レントゲン写真で観察された円形の陰影は、両肺に未だ多数の腫瘍病変が残っていることを示唆していた。CTを撮影したところ、気管支分岐に沿って腫瘍病変が広がっていることが確認できた。本患者は、シスプラチン+イリノテカン併用療法を5コース行い、その後にカルボプラチン+エトポシド併用療法を2コース行った。いくつかの病巣は縮小し、その他の病巣は増大した。
母親の方は、術後3年の経過観察期間中に肺、肝、骨転移が明らかとなった。左肺の肺転移巣に対して外科的肺生検を行ったところ、神経内分泌分化を伴う低分化がんと病理診断された。子宮全摘術を行った際の切除標本を詳しく再検討したところ、低分化型扁平上皮がんの組織像の中に、巣状の神経内分泌分化成分を認め、腺がんの組織像を示す部分も一部混じっていた。この部分の病理組織所見は、母親の外科的肺生検標本の病理組織所見、本患者の外科的肺生検標本の病理組織所見と同様だった。
本患者の外科的肺生検がん組織、正常組織、母親の子宮頚がん組織、正常組織を用いて、次世代シーケンサーで遺伝情報を解析した。本患者、母親、どちらのがん組織からも、KRAS G13D変異、TP53 E285K変異が発見された。また、母親由来であり、母親の正常組織と子宮頸がん組織のどちらにも認められるが本患者の正常組織には見られない47ヶの一塩基多型が、本患者の外科的肺生検がん組織から検出された。このことから、本患者のがん組織は母親由来であることがわかった。また、FISH法による解析で、本患者のがん組織には性染色体でいうところのY染色体が欠けていた。全エクソンシーケンスを行ったところ、上記のKRAS変異やTP53変異のほかに20の体細胞変異が見つかり、これは母親と本患者どちらのがん組織にも認められた。本患者に受け継がれなかった母親由来のHLA class I対立遺伝子は、母親と本患者のどちらのがん組織でも欠失していた。PCR法でヒトパピローマウイルスの遺伝子検索を行ったところ、母親と本患者のがん組織から18型ヒトパピローマウイルスが検出された。
2レジメンの化学療法を施行したにもかかわらず病勢進行したため、本患者はニボルマブ療法の臨床試験に参加した。ニボルマブ単剤療法(ニボルマブ3mg/kgを2週間ごとに投与)を④コース行った後、CTで全ての病巣の縮小を認めた。また、腫瘍マーカーのpro-GRPは、治療開始前の1649pg/mlから152pg/mlまで低下した。本患者は計14コースのニボルマブ単剤療法を受けた。治療効果は、新規病変の出現なく7か月間持続した。この時点で、残存病変を切除するために肺葉切除術を施行した。切除標本中にはリンパ組織新生や石灰化を伴う一方で、残存腫瘍細胞の見られない線維化結節を認め、病理学的完全奏効を示唆する所見だった。フローサイトメトリーで解析したところ、免疫細胞が占める割合は腫瘍病巣内で88%と、非腫瘍部の33%と比較して高かった。また、腫瘍病巣内では、CD4陽性T細胞やCD8陽性T細胞と同様に、B細胞も44%と多く含まれていた。これらの所見は、抗PD-1抗体療法の治療反応として合致するものだった。本患者は、肺葉切除後12ヶ月間、無再発状態を維持している。
本患者の母親は、多発転移再発発覚後、ニボルマブ240mgを2週間ごとに使用する第II相臨床試験に参加した。しかしながら、母親の腫瘍は4コースの治療に関わらず進行し、その5か月後に母親は死亡した。免疫組織化学染色による評価では、母親の腫瘍も本患者の腫瘍も、PD-1やPD-L1を発現していなかった。
<症例2>
6歳の男の子が左胸痛を訴えて近くの医療機関を受診した。CTを撮影したところ、左肺門部に6cm大の腫瘤を認め、精査の結果、粘液産生性腺がんと診断された。本患者の母親は、本患者を妊娠しているときに子宮頸部のポリープ様腫瘍を指摘されていた。しかしながら、子宮頸部スメア細胞診では悪性所見なく、無治療経過観察で本病巣は特に変わりなく、妊娠38週で経腟分娩した。産後にあらためて子宮頸部の病巣を生検したところ、腺がんと診断され、大学病院へ紹介され、出産3か月後に広範子宮全摘術+両側付属器切除術を受けた。残念ながら、その2年後に母親はがん死した。こうした経緯があったものの、本患者が6歳になってからのがん発症であったため、母親のがんと本患者のがんは無関係と考えられていた。
本患者の腫瘍は切除困難と判断され、化学療法が行われた。シスプラチン+パクリタキセル併用療法を5コース行った後に、カルボプラチン+パクリタキセル併用療法を3コース行い、さらにパクリタキセル+イリノテカン併用療法を2コース行った。これにより部分奏効が得られ、腫瘍マーカーであるCA19-9は正常域まで低下した。この時点で治療はいったん中断された。その3ヶ月後、左肺に再燃した。再燃後の治療として、ジェムシタビン+ドセタキセル併用療法を5コース行った後にカルボプラチン+パクリタキセル併用療法を1コース行い、引き続いて左肺全摘術を施行した。術後病理所見は粘液産生性腺がんであったが、形態的特徴が通常の原発性肺がんとは異なり、むしろ母親の子宮頸部原発腺がんの病理学的特徴と類似していた。本患者は、術後15ヶ月無再発生存している。
母親の子宮頸部腫瘍と本患者の肺腫瘍を次世代シーケンサーで解析した。予想通り、正常組織は母親と本患者の間で異なる特性を示していたが、母親の腫瘍組織と本患者の腫瘍組織は遺伝子プロファイルが類似しており、母親から本患者へ腫瘍が転移したことが示唆された。どちらの腫瘍もKRASおよびSTK11の遺伝子変異を認め、母親由来であり、母親の正常組織と子宮頸がん組織のどちらにも認められるが本患者の正常組織には見られない38ヶの一塩基多型が、本患者の肺腫瘍組織から検出された。FISH法による解析で、本患者のがん組織には性染色体でいうところのY染色体が欠けていた。全エクソンシーケンスを行ったところ、上記のKRAS変異やSTK11変異のほか14の体細胞変異が見つかり、これは母親と本患者どちらのがん組織にも認められた。本患者に受け継がれなかった母親由来のHLA class I対立遺伝子は、母親と本患者のどちらのがん組織でも欠失していなかった。PCR法でヒトパピローマウイルスの遺伝子検索を行ったところ、母親と本患者のがん組織から16型ヒトパピローマウイルスが検出された。
<考察>
母親の子宮頸部から子供の肺へ転移したと考えられるがんについての2症例を報告した。男児であるにもかかわらずY染色体を欠く腫瘍であったこと、母親のがんと子供のがんが複数の体細胞性変異、ヒトパピローマウイルス遺伝子、一塩基多型を共有していたことが、この事実を示唆していた。どちらの子供でも、がんは気管支周囲に発育しており、出産の際に母親の産道でがん細胞を含む液体を吸い込むことにより、母親から子供へと転移したものと考えられた。母親から子供へと転移したと考えられる他の症例報告では、子供は脳、骨、肝臓、肺、軟部組織といった多系統の臓器転移を呈しており、これは胎盤を介した血行性転移として合致する。一方、今回の2症例においては、病巣は肺のみで、しかも気管支の分布に沿っていた。母親由来のがん細胞は羊水、産道の分泌物、子宮頸部からの出血の中に浮遊しており、経腟分娩のときに子供により吸い込まれるのだろう。今回の2症例は、経腟分娩により母親から子供へと子宮頸がんが転移しうることを示しており、子宮頸がん合併妊娠においては帝王切開が勧められるべきである。
症例1において、母親から子供に受け継がれていなかったHLA class 1対立遺伝子は、母親のがん組織、子供のがん組織、いずれにも認められなかった。こうした現象は、母親から胎児へ白血病細胞が転移した症例においても指摘されている(https://medical.nikkeibp.co.jp/leaf/all/search/cancer/news/200910/512753.html)。HLAタンパクは、同種免疫反応・拒絶反応を引き起こす主要な標的抗原であり、HLA対立遺伝子の欠失は、子供の体内で母親のがん細胞が生存するために役立っていたのかもしれない。症例1では、肺腫瘍が発見されてから1年以内にいくつかの病巣が自然退縮していた。これは、進行した神経内分泌がんでは極めて稀な現象である。加えて、本患者のがん組織がPD-1およびPD-L1のどちらも発現しておらず、さらに本来ほとんどの小児固形がんに免疫チェックポイント阻害薬が無効であるとされているにも関わらず、本患者の残存病変は抗PD-1抗体に反応して縮小した。対照的に、本患者の母親には同じ抗PD-1抗体は無効だった。症例2では、腫瘍の発育速度はとても遅く、本患者が6歳になるまで臨床症状が出現しなかった。こうしたゆっくりした発育は、進行子宮頸部腺がんではとても稀である。それゆえ、子供の体内における同種免疫反応が腫瘍発育速度に影響していたと考えられる。
https://www.ncc.go.jp/jp/information/pr_release/2020/20210107/index.html
母親の子宮頸がん由来のがん細胞が、経腟分娩の際に子供の肺へと吸い込まれてそこに生着し、転移性肺がんを発症したという極めて稀な症例報告が、New England Journal of Medicineに掲載された。
次世代シーケンサー解析やFISHといったおなじみのテクノロジーを用いて、子供から検出したがん組織が母親由来であったことが示されている。
学術的に見れば、
・ものすごく稀な症例をまとめて2例報告した
・がんの進行抑制に、同種免疫反応が一役かっている
・同種免疫反応が、免疫チェックポイント阻害薬の有効性にも関わっている
・(疑い例を含む)子宮頸がん合併妊娠では、帝王切開が第一選択である
というメッセージが込められているようだが、計算上は5億件に1件という極めて稀なケースのため、日常臨床に役立つかどうかはわからない。
しかし、ファンタジーとして見るならば、とても興味深い。
報道を見ているだけではわからない細部にこそ、この報告の大切な部分が記されているように感じたので、ほぼ全文を日本語訳して書き残す。
医師免許を持った小説家が好んで取り上げそうな話題ではないだろうか。
2症例ともに母親は既に亡くなった後だが、子供の病に直面し、残された父親や両家の祖父母の戸惑い、心労、治療がうまくいったときの安堵、そして、テクノロジーを駆使して調べた末に、病気が母親由来だったことが判明したときの葛藤など、様々想いを馳せるととても切なくなる。
2症例とも、最後の治療が終わってからまだ2年にも満たないようだが、母親の魂に護られてすくすくと育ってほしいと願うばかりである。
Vaginal Transmission of Cancer from Mothers with Cervical Cancer to Infants
Ayumu Arakawa et al., N Engl J Med 2021; 384:42-50
DOI: 10.1056/NEJMoa2030391
母親から子へのがんの転移は極めてまれとされており、がんに罹患した母親50万人に対して1人の割合で起こるとされている。一方、母親1000人に対して1件の割合で出産時の母親にがんの合併が認められるとされている(ため、一般の出産5億件に対して1件の割合で母親から子へのがんの転移が発生すると見積もられる)。過去に18件、こうした症例が文献報告されている。こうした報告では、母親由来の血液腫瘍(6件)、悪性黒色腫(8件)、肺がん(小細胞がん2件、腺がん1件)、子宮頸がん(神経内分泌がん2件、腺がん1件)はおそらく循環系(経胎盤的)を介して母親から胎児へと移行し、ときに母親由来の腫瘍細胞が子の多臓器(脳、骨、肝、軟部組織)へ播種性に広がっている。文献報告されている症例では、全て子が2歳未満の時点で診断されていた。いくつかの症例では、罹患した子のがん病巣の自然退縮が認められた。経胎盤的な胎児への転移は、胎盤のバリア機能や子の同種免疫反応のために、稀であろうと考えられる。
経胎盤的経路以外にも、出産時の経産道的な子への転移もまた、理論的には起こりうる。もし母親が子宮頸がんに罹患していたとすると、子は産道を通過してくるときに産道内の液体に含まれたがん細胞に暴露され、子の肺内へ母親のがん細胞が吸引されうる。したがって、子宮頸がんに罹患した女性が子を経腟分娩することは、母親から子へのがんの転移の危険因子となりうる。しかしながら、こうしたケースはまれであるがゆえに、裏付けデータが不足している。
今回我々は2件の症例について報告する。母親の子宮頸がんが子へ転移し、小児肺がんを発症したと考えられる症例である。いずれも、国立がん研究センター中央病院で行っていた臨床試験であるTOP-GEAR(Trial of Onco-Panel for Gene-profiling to Estimate both Adverse Events and Response during cancer treatment)に参加した患者の、腫瘍サンプルおよび対を成す正常組織サンプルの、次世代シーケンサー解析の結果解析からたまたま明らかになった。
<症例1>
生後23か月の男児が、痰を伴う咳が2週間続くということで近くの医療機関を受診した。CTを撮影したところ、両肺の気管支分岐に沿うような分布で、多数の腫瘤性病変を認めた。外科的肺生検を行ったところ、部分的に腺組織への分化を示す神経内分泌がんの存在が明らかとなった。
本患者が生まれる7か月前、患者の母親は子宮スメア細胞診を受けており、結果は陰性だった。本患者は妊娠39週で経腟分娩で生まれた。出産当時母親は35歳で、ヒトパピローマウイルスワクチンの接種はしていなかったが、本患者を出産してから3か月後に子宮頸部の扁平上皮がんと確定診断された。確定診断後、母親は広範子宮全摘術及び骨盤内リンパ節郭清を受け、術後補助化学療法を4コース施行された。本患者の外科的肺生検で得られた病理組織像と、母親の子宮頸がんの病理組織像が異なっていたため、この時点では母親から子へのがんの転移は想定していなかった。
両親の希望で、本患者はまめに経過観察された一方で、特段の追加治療は受けてこなかった。外科的肺生検から1年後、残存病巣が増大した。この時点で、3歳となった本患者の追加治療について検討するために、国立がん研究センター中央病院を紹介受診した。驚くべきことに、いくつかの病巣は自然退縮傾向にあった。胸部レントゲン写真で観察された円形の陰影は、両肺に未だ多数の腫瘍病変が残っていることを示唆していた。CTを撮影したところ、気管支分岐に沿って腫瘍病変が広がっていることが確認できた。本患者は、シスプラチン+イリノテカン併用療法を5コース行い、その後にカルボプラチン+エトポシド併用療法を2コース行った。いくつかの病巣は縮小し、その他の病巣は増大した。
母親の方は、術後3年の経過観察期間中に肺、肝、骨転移が明らかとなった。左肺の肺転移巣に対して外科的肺生検を行ったところ、神経内分泌分化を伴う低分化がんと病理診断された。子宮全摘術を行った際の切除標本を詳しく再検討したところ、低分化型扁平上皮がんの組織像の中に、巣状の神経内分泌分化成分を認め、腺がんの組織像を示す部分も一部混じっていた。この部分の病理組織所見は、母親の外科的肺生検標本の病理組織所見、本患者の外科的肺生検標本の病理組織所見と同様だった。
本患者の外科的肺生検がん組織、正常組織、母親の子宮頚がん組織、正常組織を用いて、次世代シーケンサーで遺伝情報を解析した。本患者、母親、どちらのがん組織からも、KRAS G13D変異、TP53 E285K変異が発見された。また、母親由来であり、母親の正常組織と子宮頸がん組織のどちらにも認められるが本患者の正常組織には見られない47ヶの一塩基多型が、本患者の外科的肺生検がん組織から検出された。このことから、本患者のがん組織は母親由来であることがわかった。また、FISH法による解析で、本患者のがん組織には性染色体でいうところのY染色体が欠けていた。全エクソンシーケンスを行ったところ、上記のKRAS変異やTP53変異のほかに20の体細胞変異が見つかり、これは母親と本患者どちらのがん組織にも認められた。本患者に受け継がれなかった母親由来のHLA class I対立遺伝子は、母親と本患者のどちらのがん組織でも欠失していた。PCR法でヒトパピローマウイルスの遺伝子検索を行ったところ、母親と本患者のがん組織から18型ヒトパピローマウイルスが検出された。
2レジメンの化学療法を施行したにもかかわらず病勢進行したため、本患者はニボルマブ療法の臨床試験に参加した。ニボルマブ単剤療法(ニボルマブ3mg/kgを2週間ごとに投与)を④コース行った後、CTで全ての病巣の縮小を認めた。また、腫瘍マーカーのpro-GRPは、治療開始前の1649pg/mlから152pg/mlまで低下した。本患者は計14コースのニボルマブ単剤療法を受けた。治療効果は、新規病変の出現なく7か月間持続した。この時点で、残存病変を切除するために肺葉切除術を施行した。切除標本中にはリンパ組織新生や石灰化を伴う一方で、残存腫瘍細胞の見られない線維化結節を認め、病理学的完全奏効を示唆する所見だった。フローサイトメトリーで解析したところ、免疫細胞が占める割合は腫瘍病巣内で88%と、非腫瘍部の33%と比較して高かった。また、腫瘍病巣内では、CD4陽性T細胞やCD8陽性T細胞と同様に、B細胞も44%と多く含まれていた。これらの所見は、抗PD-1抗体療法の治療反応として合致するものだった。本患者は、肺葉切除後12ヶ月間、無再発状態を維持している。
本患者の母親は、多発転移再発発覚後、ニボルマブ240mgを2週間ごとに使用する第II相臨床試験に参加した。しかしながら、母親の腫瘍は4コースの治療に関わらず進行し、その5か月後に母親は死亡した。免疫組織化学染色による評価では、母親の腫瘍も本患者の腫瘍も、PD-1やPD-L1を発現していなかった。
<症例2>
6歳の男の子が左胸痛を訴えて近くの医療機関を受診した。CTを撮影したところ、左肺門部に6cm大の腫瘤を認め、精査の結果、粘液産生性腺がんと診断された。本患者の母親は、本患者を妊娠しているときに子宮頸部のポリープ様腫瘍を指摘されていた。しかしながら、子宮頸部スメア細胞診では悪性所見なく、無治療経過観察で本病巣は特に変わりなく、妊娠38週で経腟分娩した。産後にあらためて子宮頸部の病巣を生検したところ、腺がんと診断され、大学病院へ紹介され、出産3か月後に広範子宮全摘術+両側付属器切除術を受けた。残念ながら、その2年後に母親はがん死した。こうした経緯があったものの、本患者が6歳になってからのがん発症であったため、母親のがんと本患者のがんは無関係と考えられていた。
本患者の腫瘍は切除困難と判断され、化学療法が行われた。シスプラチン+パクリタキセル併用療法を5コース行った後に、カルボプラチン+パクリタキセル併用療法を3コース行い、さらにパクリタキセル+イリノテカン併用療法を2コース行った。これにより部分奏効が得られ、腫瘍マーカーであるCA19-9は正常域まで低下した。この時点で治療はいったん中断された。その3ヶ月後、左肺に再燃した。再燃後の治療として、ジェムシタビン+ドセタキセル併用療法を5コース行った後にカルボプラチン+パクリタキセル併用療法を1コース行い、引き続いて左肺全摘術を施行した。術後病理所見は粘液産生性腺がんであったが、形態的特徴が通常の原発性肺がんとは異なり、むしろ母親の子宮頸部原発腺がんの病理学的特徴と類似していた。本患者は、術後15ヶ月無再発生存している。
母親の子宮頸部腫瘍と本患者の肺腫瘍を次世代シーケンサーで解析した。予想通り、正常組織は母親と本患者の間で異なる特性を示していたが、母親の腫瘍組織と本患者の腫瘍組織は遺伝子プロファイルが類似しており、母親から本患者へ腫瘍が転移したことが示唆された。どちらの腫瘍もKRASおよびSTK11の遺伝子変異を認め、母親由来であり、母親の正常組織と子宮頸がん組織のどちらにも認められるが本患者の正常組織には見られない38ヶの一塩基多型が、本患者の肺腫瘍組織から検出された。FISH法による解析で、本患者のがん組織には性染色体でいうところのY染色体が欠けていた。全エクソンシーケンスを行ったところ、上記のKRAS変異やSTK11変異のほか14の体細胞変異が見つかり、これは母親と本患者どちらのがん組織にも認められた。本患者に受け継がれなかった母親由来のHLA class I対立遺伝子は、母親と本患者のどちらのがん組織でも欠失していなかった。PCR法でヒトパピローマウイルスの遺伝子検索を行ったところ、母親と本患者のがん組織から16型ヒトパピローマウイルスが検出された。
<考察>
母親の子宮頸部から子供の肺へ転移したと考えられるがんについての2症例を報告した。男児であるにもかかわらずY染色体を欠く腫瘍であったこと、母親のがんと子供のがんが複数の体細胞性変異、ヒトパピローマウイルス遺伝子、一塩基多型を共有していたことが、この事実を示唆していた。どちらの子供でも、がんは気管支周囲に発育しており、出産の際に母親の産道でがん細胞を含む液体を吸い込むことにより、母親から子供へと転移したものと考えられた。母親から子供へと転移したと考えられる他の症例報告では、子供は脳、骨、肝臓、肺、軟部組織といった多系統の臓器転移を呈しており、これは胎盤を介した血行性転移として合致する。一方、今回の2症例においては、病巣は肺のみで、しかも気管支の分布に沿っていた。母親由来のがん細胞は羊水、産道の分泌物、子宮頸部からの出血の中に浮遊しており、経腟分娩のときに子供により吸い込まれるのだろう。今回の2症例は、経腟分娩により母親から子供へと子宮頸がんが転移しうることを示しており、子宮頸がん合併妊娠においては帝王切開が勧められるべきである。
症例1において、母親から子供に受け継がれていなかったHLA class 1対立遺伝子は、母親のがん組織、子供のがん組織、いずれにも認められなかった。こうした現象は、母親から胎児へ白血病細胞が転移した症例においても指摘されている(https://medical.nikkeibp.co.jp/leaf/all/search/cancer/news/200910/512753.html)。HLAタンパクは、同種免疫反応・拒絶反応を引き起こす主要な標的抗原であり、HLA対立遺伝子の欠失は、子供の体内で母親のがん細胞が生存するために役立っていたのかもしれない。症例1では、肺腫瘍が発見されてから1年以内にいくつかの病巣が自然退縮していた。これは、進行した神経内分泌がんでは極めて稀な現象である。加えて、本患者のがん組織がPD-1およびPD-L1のどちらも発現しておらず、さらに本来ほとんどの小児固形がんに免疫チェックポイント阻害薬が無効であるとされているにも関わらず、本患者の残存病変は抗PD-1抗体に反応して縮小した。対照的に、本患者の母親には同じ抗PD-1抗体は無効だった。症例2では、腫瘍の発育速度はとても遅く、本患者が6歳になるまで臨床症状が出現しなかった。こうしたゆっくりした発育は、進行子宮頸部腺がんではとても稀である。それゆえ、子供の体内における同種免疫反応が腫瘍発育速度に影響していたと考えられる。
2021年01月06日
学会報告0004:術前診断のついていなかった小細胞肺がん手術例のまとめ
肺小細胞癌の治療の柱は放射線治療と薬物療法とされるが、手術で治療される患者も稀ながら存在する。
術前診断困難な小さな肺がんを切除してみたら、たまたま小細胞癌だったというパターンである。
昨年の学会で、興味深い報告があったので取り上げる。
私は肺がん疑い患者の初診時は、CEA、CYFRA、proGRPを腫瘍マーカーとして測定しているが、この報告には勇気づけられた。
根治的切除を目指した、すなわち比較的早期の肺がん患者において、小細胞肺癌であればその半数で術前proGRPが高値であり、小細胞肺癌でなければ98%はproGRPが正常だったということだ。
また、術中迅速診断と最終診断の一致率がわずか14%だったというのも興味深い。
小細胞癌か非小細胞癌かで、術後薬物療法の方針が大きく異なるため、きちんと最終診断の組織型を確認しなければ足元をすくわれることになる。
<学会報告0004>
出典:2020年 日本肺癌学会支部会 / 日本呼吸器内視鏡学会支部会
・確定診断未決の肺結節に対して手術を行い、病理学的に小細胞がんと診断された患者を後方視的に検討した
・約10年間で、該当する患者は14人に上った
・術前のCTでは、全て充実性結節の所見だった
・肺葉切除7人、部分切除1人、試験開胸6人
・術中迅速診断と最終診断が一致したのは、14人中わずか2人だけだった
・同じ期間内に、根治的切除を目指して手術を行った原発性肺癌患者のうち、術前にproGRPを測定した189人についても検討した
・189人中、非小細胞肺癌は179人、小細胞肺癌は10人だった
・proGRPによる小細胞肺癌の検出精度は、感度(小細胞肺癌患者のうち、proGRP高値だった患者の割合)50.0%、特異度(小細胞肺癌でなかった患者のうち、proGRP正常だった患者の割合)97.8%だった
術前診断困難な小さな肺がんを切除してみたら、たまたま小細胞癌だったというパターンである。
昨年の学会で、興味深い報告があったので取り上げる。
私は肺がん疑い患者の初診時は、CEA、CYFRA、proGRPを腫瘍マーカーとして測定しているが、この報告には勇気づけられた。
根治的切除を目指した、すなわち比較的早期の肺がん患者において、小細胞肺癌であればその半数で術前proGRPが高値であり、小細胞肺癌でなければ98%はproGRPが正常だったということだ。
また、術中迅速診断と最終診断の一致率がわずか14%だったというのも興味深い。
小細胞癌か非小細胞癌かで、術後薬物療法の方針が大きく異なるため、きちんと最終診断の組織型を確認しなければ足元をすくわれることになる。
<学会報告0004>
出典:2020年 日本肺癌学会支部会 / 日本呼吸器内視鏡学会支部会
・確定診断未決の肺結節に対して手術を行い、病理学的に小細胞がんと診断された患者を後方視的に検討した
・約10年間で、該当する患者は14人に上った
・術前のCTでは、全て充実性結節の所見だった
・肺葉切除7人、部分切除1人、試験開胸6人
・術中迅速診断と最終診断が一致したのは、14人中わずか2人だけだった
・同じ期間内に、根治的切除を目指して手術を行った原発性肺癌患者のうち、術前にproGRPを測定した189人についても検討した
・189人中、非小細胞肺癌は179人、小細胞肺癌は10人だった
・proGRPによる小細胞肺癌の検出精度は、感度(小細胞肺癌患者のうち、proGRP高値だった患者の割合)50.0%、特異度(小細胞肺癌でなかった患者のうち、proGRP正常だった患者の割合)97.8%だった
2020年11月17日
あれから20年も、この先10年も
ネット上に、米国の抗腫瘍薬開発のオピニオンリーダーから以下のようなコメントが寄せられていたので引用してみた。
かなり意訳してしまった。
この20年は、私の社会人としてのキャリアとぴったり重なるので、とても感慨深い。
Lung Cancer: Precision Therapies at the Forefront
By Suresh S. Ramalingam, MD, FACP, FASCO
November 10, 2020
この20年間で、なんと大きな変化が起こったことだろうか。
ECOG1594試験の結果は、2000年の米国臨床腫瘍学会年次総会のプレナリーセッションで報告された。進行非小細胞肺がん患者に対する初回治療として、4種のプラチナ併用化学療法はどれも同等の効果を示すとされた。各治療の奏効割合はおしなべて20%程度で、生存期間中央値はたった8ヶ月だった。その1年前、進行非小細胞肺がん患者のサルベージ療法(二次化学療法)としてドセタキセル単剤療法が薬事承認されたが、これは10%未満の奏効割合と8ヶ月程度の生存期間中央値という結果に基づいたものだった。
当時は、進行非小細胞肺がんの患者に対して、そもそも薬物療法を提案するべきか否かという論争があった。肺がん患者に対して長期生存もしくは治癒の可能性があるとするなら、それは早期の段階で外科切除を行い、それにより確定診断がついたときだった。しかし、有効なスクリーニング手段がないため、早期に診断される肺がん患者は少なかった。
もっとも楽観的な見通しを持っていた胸部腫瘍医でさえ、個別改良により進行がんの患者が長期生存できるようになるモデルケースの役割を肺がんが担うようになると予測するのは難しかっただろう。肺がんによる死亡率は2013年以降というもの、年率3-6%ずつ減少しており、1991年以降の米国でがん死亡率が29%減少-この30年間でがん関連死亡者数が300万人減少-したことの主たる要因と考えられている。
2020年だけでも、米国食品医薬品局は肺がんに対して9種の新規治療を承認した。そのうち4種(selpercatinib, pralsetinib, lurbinectedin, capmatinib)は初めて医薬品として承認された化学物質である。また3種は、既存の免疫チェックポイント阻害薬の新たな適応拡大だった。非小細胞肺がんの治療はここ数年で様変わりした。ほとんどの進行非小細胞肺がんの患者において、QoLを悪化させずに長期生存を目指すことは、現実的な治療目標になった。次世代シーケンサーによる分子標的の検索により、治療標的となり得る少なくとも7種の「分子ドライバー」の検出が可能になった。こうした分子標的薬を用いることにより、奏効割合は50-85%、無増悪生存期間中央値は10-25ヶ月は見積もられるようになった。
個別化医療への第一歩は、上皮成長因子受容体(EGFR)チロシンキナーゼ阻害薬の開発と、治療感受性が活性化遺伝子変異と相関していることの発見だった。続いて、より高い有効性と、耐性化変異の克服のために、新世代のEGFR阻害薬が開発された。異常蛋白への特異性を増すことにより、EGFR阻害薬の安全性プロファイルが改善した。また、脳転移に対する効果が改善したこともまた、新世代のEGFR阻害薬開発の成功のためのキーポイントだった。
2007年に、肺がん患者の一部でALK遺伝子再構成がドライバー遺伝子変異として働いていることが発見されたことは、もう一つの重要な節目だった。この発見からほとんど時を置かず、劇的な治療効果を示すALK阻害薬の評価がなされた。この患者集団において、6種の異なるALK阻害薬が強力な抗腫瘍活性を示し、生存期間中央値は5年を超える。
最近では、KRAS G12Cがん遺伝子を直接の標的とした治療が有望な結果を残している。かつてKRAS遺伝子変異は治療標的期とはなりがたいと考えられていたが、新規の薬剤を用いると奏効割合は約32%に達することが分かった。また、抗体-薬物複合体を用いた治療により、HER2遺伝子変異陽性非小細胞肺がん患者では60%以上の奏効割合が、現在進行中の臨床試験で示されている。
こうした諸々の治療により、プレシジョン・メディシンを達成するための標的分子の数は近い将来2ケタに達すると考えられ、我々が長い間渇望していた個別化医療に前進をもたらすだろう。
また一方で、免疫チェックポイント阻害薬の開発もまた、肺がん治療の進歩のもう一つの節目と言える。現在、日々の実地臨床において5種の免疫チェックポイント阻害薬が使用されている。
進行非小細胞肺がんの患者のうち約30%を占めるPD-L1高発現の患者に対して、ペンブロリズマブ単剤療法を行った際の5年生存割合は32%である。ここでもまた、バイオマーカーに基づいた治療選択が、免疫チェックポイント阻害薬単剤療法、もしくは免疫チェックポイント阻害薬と化学療法の併用療法による便益を最大化するのに役立っており、この治療戦略はPD-L1発現状態に依拠している。イピリムマブとニボルマブの併用療法は、免疫チェックポイント阻害薬同士の併用療法として、初めて化学療法を含まない形での併用療法として米国食品医薬品局に認可された。治療耐性化を克服するために、また免疫チェックポイント阻害薬療法による便益をさらに拡大するために、こうしたコンセプトの併用療法はこれから先も多く実地臨床に導入されることが望まれる。
免疫チェックポイント阻害薬はまた、切除不能のIII期非小細胞肺がん患者への治療にもうまく組み込まれている。この患者集団においては、この20年で最初の大きな成果といってよく、化学放射線療法後のデュルバルマブ維持療法により、4年生存割合は約47%に達した。また、根治切除後の術後補助療法として免疫チェックポイント阻害薬の意義を検証する臨床試験が行われているが、結果の公表が強く待ち望まれている。
こうした治療上の進歩を我々は祝福するべきだが、一方で我々は、ルーチンワークの負担増大、研究予算の縮小、(治療費の高騰により患者負担が大きくなってしまったがために)治療方針選択の主導権が規制当局や生命保険会社へのシフトといった逆境にも関わらず、この分野への関与を続ける研究者および医療チームのたゆまぬ努力と献身を決して忘れてはならない。同様に、こうした治療開発の成功は、肺がんに対する悲観的なマインドセットを変化させるために努力してきた患者やコミュニティーの代表者に負うところもまた大きい。
これから10年間、我々の課題ははっきりしている。
1、効果的な喫煙規制政策を推し進めることにより肺癌罹患のリスクを低下させること、とりわけ、ティーンエイジャーへの電子たばこ利用増加に対して警鐘を鳴らすこと
2、肺がんの早期発見を促すため、ハイリスク集団に対するCT検診の適用を拡大すること、現在はこうした集団の5%以下にしか適用できていない
3、分子標的薬や免疫チェックポイント阻害薬に対する耐性化克服のための新たな治療開発を推し進めること
4、微小転移や残存病変を検出するためのリキッドバイオプシー体制を実用化すること
5、人種等に起因する肺がん治療格差を理解して、その解消に取り組むこと
6、臨床試験への参加を促し、有望な発見を実地臨床へ持ち込む過程を加速すること
かなり意訳してしまった。
この20年は、私の社会人としてのキャリアとぴったり重なるので、とても感慨深い。
Lung Cancer: Precision Therapies at the Forefront
By Suresh S. Ramalingam, MD, FACP, FASCO
November 10, 2020
この20年間で、なんと大きな変化が起こったことだろうか。
ECOG1594試験の結果は、2000年の米国臨床腫瘍学会年次総会のプレナリーセッションで報告された。進行非小細胞肺がん患者に対する初回治療として、4種のプラチナ併用化学療法はどれも同等の効果を示すとされた。各治療の奏効割合はおしなべて20%程度で、生存期間中央値はたった8ヶ月だった。その1年前、進行非小細胞肺がん患者のサルベージ療法(二次化学療法)としてドセタキセル単剤療法が薬事承認されたが、これは10%未満の奏効割合と8ヶ月程度の生存期間中央値という結果に基づいたものだった。
当時は、進行非小細胞肺がんの患者に対して、そもそも薬物療法を提案するべきか否かという論争があった。肺がん患者に対して長期生存もしくは治癒の可能性があるとするなら、それは早期の段階で外科切除を行い、それにより確定診断がついたときだった。しかし、有効なスクリーニング手段がないため、早期に診断される肺がん患者は少なかった。
もっとも楽観的な見通しを持っていた胸部腫瘍医でさえ、個別改良により進行がんの患者が長期生存できるようになるモデルケースの役割を肺がんが担うようになると予測するのは難しかっただろう。肺がんによる死亡率は2013年以降というもの、年率3-6%ずつ減少しており、1991年以降の米国でがん死亡率が29%減少-この30年間でがん関連死亡者数が300万人減少-したことの主たる要因と考えられている。
2020年だけでも、米国食品医薬品局は肺がんに対して9種の新規治療を承認した。そのうち4種(selpercatinib, pralsetinib, lurbinectedin, capmatinib)は初めて医薬品として承認された化学物質である。また3種は、既存の免疫チェックポイント阻害薬の新たな適応拡大だった。非小細胞肺がんの治療はここ数年で様変わりした。ほとんどの進行非小細胞肺がんの患者において、QoLを悪化させずに長期生存を目指すことは、現実的な治療目標になった。次世代シーケンサーによる分子標的の検索により、治療標的となり得る少なくとも7種の「分子ドライバー」の検出が可能になった。こうした分子標的薬を用いることにより、奏効割合は50-85%、無増悪生存期間中央値は10-25ヶ月は見積もられるようになった。
個別化医療への第一歩は、上皮成長因子受容体(EGFR)チロシンキナーゼ阻害薬の開発と、治療感受性が活性化遺伝子変異と相関していることの発見だった。続いて、より高い有効性と、耐性化変異の克服のために、新世代のEGFR阻害薬が開発された。異常蛋白への特異性を増すことにより、EGFR阻害薬の安全性プロファイルが改善した。また、脳転移に対する効果が改善したこともまた、新世代のEGFR阻害薬開発の成功のためのキーポイントだった。
2007年に、肺がん患者の一部でALK遺伝子再構成がドライバー遺伝子変異として働いていることが発見されたことは、もう一つの重要な節目だった。この発見からほとんど時を置かず、劇的な治療効果を示すALK阻害薬の評価がなされた。この患者集団において、6種の異なるALK阻害薬が強力な抗腫瘍活性を示し、生存期間中央値は5年を超える。
最近では、KRAS G12Cがん遺伝子を直接の標的とした治療が有望な結果を残している。かつてKRAS遺伝子変異は治療標的期とはなりがたいと考えられていたが、新規の薬剤を用いると奏効割合は約32%に達することが分かった。また、抗体-薬物複合体を用いた治療により、HER2遺伝子変異陽性非小細胞肺がん患者では60%以上の奏効割合が、現在進行中の臨床試験で示されている。
こうした諸々の治療により、プレシジョン・メディシンを達成するための標的分子の数は近い将来2ケタに達すると考えられ、我々が長い間渇望していた個別化医療に前進をもたらすだろう。
また一方で、免疫チェックポイント阻害薬の開発もまた、肺がん治療の進歩のもう一つの節目と言える。現在、日々の実地臨床において5種の免疫チェックポイント阻害薬が使用されている。
進行非小細胞肺がんの患者のうち約30%を占めるPD-L1高発現の患者に対して、ペンブロリズマブ単剤療法を行った際の5年生存割合は32%である。ここでもまた、バイオマーカーに基づいた治療選択が、免疫チェックポイント阻害薬単剤療法、もしくは免疫チェックポイント阻害薬と化学療法の併用療法による便益を最大化するのに役立っており、この治療戦略はPD-L1発現状態に依拠している。イピリムマブとニボルマブの併用療法は、免疫チェックポイント阻害薬同士の併用療法として、初めて化学療法を含まない形での併用療法として米国食品医薬品局に認可された。治療耐性化を克服するために、また免疫チェックポイント阻害薬療法による便益をさらに拡大するために、こうしたコンセプトの併用療法はこれから先も多く実地臨床に導入されることが望まれる。
免疫チェックポイント阻害薬はまた、切除不能のIII期非小細胞肺がん患者への治療にもうまく組み込まれている。この患者集団においては、この20年で最初の大きな成果といってよく、化学放射線療法後のデュルバルマブ維持療法により、4年生存割合は約47%に達した。また、根治切除後の術後補助療法として免疫チェックポイント阻害薬の意義を検証する臨床試験が行われているが、結果の公表が強く待ち望まれている。
こうした治療上の進歩を我々は祝福するべきだが、一方で我々は、ルーチンワークの負担増大、研究予算の縮小、(治療費の高騰により患者負担が大きくなってしまったがために)治療方針選択の主導権が規制当局や生命保険会社へのシフトといった逆境にも関わらず、この分野への関与を続ける研究者および医療チームのたゆまぬ努力と献身を決して忘れてはならない。同様に、こうした治療開発の成功は、肺がんに対する悲観的なマインドセットを変化させるために努力してきた患者やコミュニティーの代表者に負うところもまた大きい。
これから10年間、我々の課題ははっきりしている。
1、効果的な喫煙規制政策を推し進めることにより肺癌罹患のリスクを低下させること、とりわけ、ティーンエイジャーへの電子たばこ利用増加に対して警鐘を鳴らすこと
2、肺がんの早期発見を促すため、ハイリスク集団に対するCT検診の適用を拡大すること、現在はこうした集団の5%以下にしか適用できていない
3、分子標的薬や免疫チェックポイント阻害薬に対する耐性化克服のための新たな治療開発を推し進めること
4、微小転移や残存病変を検出するためのリキッドバイオプシー体制を実用化すること
5、人種等に起因する肺がん治療格差を理解して、その解消に取り組むこと
6、臨床試験への参加を促し、有望な発見を実地臨床へ持ち込む過程を加速すること
2020年10月15日
CheckMate816試験・・・まだまだこれから
2020/10/08付で、小野薬品工業が以下のプレスリリースを発出した。
オプジーボと化学療法の併用療法が、切除可能な非小細胞肺がんの術前補助療法での第Ⅲ相 CheckMate -816 試験において統計学的に有意な病理学的完全奏効の改善を示す
https://www.ono.co.jp/jpnw/PDF/n20_1008.pdf
ポイントを抜粋すると、
・Checkmate -816 試験は、切除可能な非小細胞肺がん患者の術前補助療法として、オプジーボと化学療法の併用療法を化学療法と比較評価した多施設共同無作為化非盲検第Ⅲ相試験です
・一次解析には、患者約 358 例が登録され、オプジーボ 360 mg と組織型に基づくプラチナ製剤を含む化学療法 2 剤との併用療法を 3 週間間隔で最大 3 回投与する群、またはプラチナ製剤を含む化学療法 2 剤を 3 週間間隔で最大 3 回投与する群のいずれかに無作為に割り付けられ、その後、手術が施行されました
・本試験の主要評価項目は、病理学的完全奏効(pCR)=切除組織にがん細胞を認めないこと、および無イベント生存期間です
・主要な副次評価項目は、全生存期間(OS)、Major Pathological Response(MPR)および死亡または遠隔転移までの期間です
・本試験において、術前にオプジーボ(一般名:ニボルマブ)と化学療法の併用療法を受けた患者群では、化学療法を受けた患者群と比較し
て、切除組織にがん細胞を認めない患者数が有意に多かったことを示しました
・CheckMate -816試験は、非進行 NSCLC の術前補助療法で、免疫チェックポイント阻害薬と化学療法の併用療法がベネフィットを示した初めてで唯一の第Ⅲ相試験です
古典的な考え方をすれば、肺がん治療における唯一絶対の評価項目は、全生存期間である。
早い話が、長生きが目的ですよということ。
しかし、全生存期間の評価には、時間もかかれば手間もかかる。
そのため、全生存期間に代わる代替エンドポイントとして、無再発もしくは無増悪生存期間が主要評価項目として用いられることが近年著しく多くなった。
本試験ではさらに一歩進んで、切除された病巣を顕微鏡で確認し、どの程度の腫瘍細胞が死滅せずに残っているか、という調査を行った。
今のところはニボルマブ+化学療法の組み合わせでpCR率が上がるかどうかのデータしかなく、これだけで何かの結論を出すのは拙速と言わざるをえない。
無イベント生存期間と全生存期間のデータが明らかにされて、初めて本試験の意義が示されるだろう。
pCR率の向上、果たして長生きにつながるのか。
オプジーボと化学療法の併用療法が、切除可能な非小細胞肺がんの術前補助療法での第Ⅲ相 CheckMate -816 試験において統計学的に有意な病理学的完全奏効の改善を示す
https://www.ono.co.jp/jpnw/PDF/n20_1008.pdf
ポイントを抜粋すると、
・Checkmate -816 試験は、切除可能な非小細胞肺がん患者の術前補助療法として、オプジーボと化学療法の併用療法を化学療法と比較評価した多施設共同無作為化非盲検第Ⅲ相試験です
・一次解析には、患者約 358 例が登録され、オプジーボ 360 mg と組織型に基づくプラチナ製剤を含む化学療法 2 剤との併用療法を 3 週間間隔で最大 3 回投与する群、またはプラチナ製剤を含む化学療法 2 剤を 3 週間間隔で最大 3 回投与する群のいずれかに無作為に割り付けられ、その後、手術が施行されました
・本試験の主要評価項目は、病理学的完全奏効(pCR)=切除組織にがん細胞を認めないこと、および無イベント生存期間です
・主要な副次評価項目は、全生存期間(OS)、Major Pathological Response(MPR)および死亡または遠隔転移までの期間です
・本試験において、術前にオプジーボ(一般名:ニボルマブ)と化学療法の併用療法を受けた患者群では、化学療法を受けた患者群と比較し
て、切除組織にがん細胞を認めない患者数が有意に多かったことを示しました
・CheckMate -816試験は、非進行 NSCLC の術前補助療法で、免疫チェックポイント阻害薬と化学療法の併用療法がベネフィットを示した初めてで唯一の第Ⅲ相試験です
古典的な考え方をすれば、肺がん治療における唯一絶対の評価項目は、全生存期間である。
早い話が、長生きが目的ですよということ。
しかし、全生存期間の評価には、時間もかかれば手間もかかる。
そのため、全生存期間に代わる代替エンドポイントとして、無再発もしくは無増悪生存期間が主要評価項目として用いられることが近年著しく多くなった。
本試験ではさらに一歩進んで、切除された病巣を顕微鏡で確認し、どの程度の腫瘍細胞が死滅せずに残っているか、という調査を行った。
今のところはニボルマブ+化学療法の組み合わせでpCR率が上がるかどうかのデータしかなく、これだけで何かの結論を出すのは拙速と言わざるをえない。
無イベント生存期間と全生存期間のデータが明らかにされて、初めて本試験の意義が示されるだろう。
pCR率の向上、果たして長生きにつながるのか。
2020年09月24日
T.M.先生、ADAURA試験について語る
そろそろ欧州臨床腫瘍学会の話題を仕入れようとネットサーフィンをしていたら、国立がん研究センター東病院のT.M.先生が英語でプレゼンテーションをなさっている動画を見つけてしまい、びっくりたまげて椅子から滑り落ちてしまった。
https://ascopost.com/videos/esmo-virtual-congress-2020/masahiro-tsuboi-on-adjuvant-osimertinib-in-egfr-mutated-nsclc/
ときどきこのウェブサイトを覗いているのだが、日本国内で診療しておられる日本人の先生が肺がん分野で登場するのは、あまり記憶にない。
T.M.先生のプレゼンテーションから、頭に残ったことを書き残す。
Osimertinib adjuvant therapy in patients (pts) with resected EGFR mutated (EGFRm) NSCLC (ADAURA): Central nervous system (CNS) disease recurrence
ESMO 2020, Abst. #LBA1
背景:
非小細胞肺がんにおける中枢神経系への転移再発はよくあることで、予後不良因子である。外科切除後のEGFR遺伝子変異陽性非小細胞肺がんにおいて、中枢神経系を含む再発病巣への治療有効性は、治療戦略を考えるうえでのカギとなる。オシメルチニブは第三世代のEGFRチロシンキナーゼ阻害薬で、非小細胞肺がんにおける中枢神経系転移に対して有効であることが証明されている。ADAURA試験では、外科切除後の病理病期IB-IIIA期EGFR遺伝子変異陽性(Exon 19 変異もしくはExon 21変異)非小細胞肺がんに対する術後補助化学療法として、オシメルチニブがプラセボ(偽薬)と比較して有意かつ臨床的に意義のある無病生存期間延長を達成した(ハザード比0.20、99.12%信頼区間は0.14-0.30、p<0.001)。今回は、ADAURA試験における再発様式に関しての探索的検討について報告する。
方法:
術後補助化学療法施行の有無を問わず、外科切除後病理病期IB-IIIA期、EGFR遺伝子変異陽性の非小細胞肺がん患者を、オシメルチニブ80mg1日1回投与をする群(O群)とプラセボを投与する群(P群)に1:1の比率で無作為割付し、病勢進行・治療継続不能・治療開始から3年間経過のどれかを満たすまで継続治療した。再発様式と中枢神経系に特化した無病生存期間(中枢神経系への転移再発を確認されるか、患者が死亡するかをイベントと判定する)を探索的評価項目とした。術前、もしくは臨床試験参加登録前の段階での頭部MRIもしくはCTでの脳転移巣検索を臨床試験参加条件として義務付けたが、臨床症状がなければこれら検査は免除した。再発様式は、局所再発と遠隔転移再発に分類され、再発部位が記録された。2020年1月17日にデータカットオフを行った。
結果:
全体で682人の患者が無作為割付され、O群に339人、P群に343人が割り振られた。O群ではP群に比べて再発イベントが少なかった。観察期間中央値22ヶ月間の時点で全体の45人(O群6人、P群39人)が中枢神経系再発イベントを起こした。12ヶ月時点における暫定的な中枢神経系再発割合は、O群で1%未満、P群で7%だった。中枢神経系無病生存期間中央値はO群では未到達(95%信頼区間は39.0ヶ月以上)、P群では48.2ヶ月(95%信頼区間算出困難)だった。中枢神経系無病生存期間のハザード比は0.18(95%信頼区間は0.10-0.33)で、p<0.0001だった。
Table: LBA1
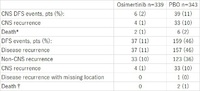
*Death in absence of CNS disease recurrence, or death within two visits of baseline where the patient has no evaluable assessments or no baseline data. †Death in the absence of disease recurrence (any site), or death within two visits of baseline where the patient has no evaluable assessments or no baseline data.
結論:
オシメルチニブによる臨床的に意義のある中枢神経系無病生存期間の改善効果が確認された。プラセボと比較して、再発もしくは死亡のリスクを82%逓減した。今回の結果により、EGFR遺伝子変異陽性の根治的切除後非小細胞肺がん患者においては、オシメルチニブが中枢神経系への転移再発を抑制する効果が明らかとなった。
Dr.T.M.のコメント
・ADAURA試験は術後病理病期IB-IIIA期、EGFR遺伝子変異陽性の患者を対象に、オシメルチニブとプラセボの効果比較を行う臨床試験である
・対象となる患者682人を、1:1の比率でオシメルチニブ群とプラセボ群に無作為に割り付けた
・主要評価項目はII-IIIA期の患者における無病生存期間
・副次評価項目はIB-IIIA期の全ての患者における無病生存期間
・主要評価項目はハザード比0.17、この時点では再発・死亡に関する83%のリスク逓減効果があった
・副次評価項目はハザード比0.20、同じく再発・死亡に関する80%のリスク逓減効果があった
・中枢神経系無病生存期間はハザード比0.18で、中枢神経系転移もしくは死亡に関する82%のリスク逓減効果があった
https://ascopost.com/videos/esmo-virtual-congress-2020/masahiro-tsuboi-on-adjuvant-osimertinib-in-egfr-mutated-nsclc/
ときどきこのウェブサイトを覗いているのだが、日本国内で診療しておられる日本人の先生が肺がん分野で登場するのは、あまり記憶にない。
T.M.先生のプレゼンテーションから、頭に残ったことを書き残す。
Osimertinib adjuvant therapy in patients (pts) with resected EGFR mutated (EGFRm) NSCLC (ADAURA): Central nervous system (CNS) disease recurrence
ESMO 2020, Abst. #LBA1
背景:
非小細胞肺がんにおける中枢神経系への転移再発はよくあることで、予後不良因子である。外科切除後のEGFR遺伝子変異陽性非小細胞肺がんにおいて、中枢神経系を含む再発病巣への治療有効性は、治療戦略を考えるうえでのカギとなる。オシメルチニブは第三世代のEGFRチロシンキナーゼ阻害薬で、非小細胞肺がんにおける中枢神経系転移に対して有効であることが証明されている。ADAURA試験では、外科切除後の病理病期IB-IIIA期EGFR遺伝子変異陽性(Exon 19 変異もしくはExon 21変異)非小細胞肺がんに対する術後補助化学療法として、オシメルチニブがプラセボ(偽薬)と比較して有意かつ臨床的に意義のある無病生存期間延長を達成した(ハザード比0.20、99.12%信頼区間は0.14-0.30、p<0.001)。今回は、ADAURA試験における再発様式に関しての探索的検討について報告する。
方法:
術後補助化学療法施行の有無を問わず、外科切除後病理病期IB-IIIA期、EGFR遺伝子変異陽性の非小細胞肺がん患者を、オシメルチニブ80mg1日1回投与をする群(O群)とプラセボを投与する群(P群)に1:1の比率で無作為割付し、病勢進行・治療継続不能・治療開始から3年間経過のどれかを満たすまで継続治療した。再発様式と中枢神経系に特化した無病生存期間(中枢神経系への転移再発を確認されるか、患者が死亡するかをイベントと判定する)を探索的評価項目とした。術前、もしくは臨床試験参加登録前の段階での頭部MRIもしくはCTでの脳転移巣検索を臨床試験参加条件として義務付けたが、臨床症状がなければこれら検査は免除した。再発様式は、局所再発と遠隔転移再発に分類され、再発部位が記録された。2020年1月17日にデータカットオフを行った。
結果:
全体で682人の患者が無作為割付され、O群に339人、P群に343人が割り振られた。O群ではP群に比べて再発イベントが少なかった。観察期間中央値22ヶ月間の時点で全体の45人(O群6人、P群39人)が中枢神経系再発イベントを起こした。12ヶ月時点における暫定的な中枢神経系再発割合は、O群で1%未満、P群で7%だった。中枢神経系無病生存期間中央値はO群では未到達(95%信頼区間は39.0ヶ月以上)、P群では48.2ヶ月(95%信頼区間算出困難)だった。中枢神経系無病生存期間のハザード比は0.18(95%信頼区間は0.10-0.33)で、p<0.0001だった。
Table: LBA1

*Death in absence of CNS disease recurrence, or death within two visits of baseline where the patient has no evaluable assessments or no baseline data. †Death in the absence of disease recurrence (any site), or death within two visits of baseline where the patient has no evaluable assessments or no baseline data.
結論:
オシメルチニブによる臨床的に意義のある中枢神経系無病生存期間の改善効果が確認された。プラセボと比較して、再発もしくは死亡のリスクを82%逓減した。今回の結果により、EGFR遺伝子変異陽性の根治的切除後非小細胞肺がん患者においては、オシメルチニブが中枢神経系への転移再発を抑制する効果が明らかとなった。
Dr.T.M.のコメント
・ADAURA試験は術後病理病期IB-IIIA期、EGFR遺伝子変異陽性の患者を対象に、オシメルチニブとプラセボの効果比較を行う臨床試験である
・対象となる患者682人を、1:1の比率でオシメルチニブ群とプラセボ群に無作為に割り付けた
・主要評価項目はII-IIIA期の患者における無病生存期間
・副次評価項目はIB-IIIA期の全ての患者における無病生存期間
・主要評価項目はハザード比0.17、この時点では再発・死亡に関する83%のリスク逓減効果があった
・副次評価項目はハザード比0.20、同じく再発・死亡に関する80%のリスク逓減効果があった
・中枢神経系無病生存期間はハザード比0.18で、中枢神経系転移もしくは死亡に関する82%のリスク逓減効果があった
2020年06月17日
ADAURA試験
ADAURA試験については、以前取り上げた。
http://oitahaiganpractice.junglekouen.com/e973395.html
無病生存期間の生存曲線を見ると、目を瞠る。
ハザード比0.17・・・。
そうそうお目にかかれない数字である。
本試験は、術後補助化学療法の標準治療であるプラチナ併用化学療法とオシメルチニブを比較したものではない。
EGFR遺伝子変異陽性の完全切除後非扁平上皮非小細胞肺がん患者を対象とし、適応のある患者には標準治療である術後補助化学療法を行い(詳しい治療レジメンの記載はないが)、その後にオシメルチニブを上乗せする意義があるかどうかを、プラセボ対照で検証した試験である。
実地臨床において、術後補助化学療法の適応はあるものの、年齢、背景疾患、患者の希望等々の理由で術後補助化学療法がおこなわれない患者は相当数いるため、こうした試験デザインでも一定の意義がある。
治療的にも医療経済的にも"toxic new"な治療だったわけだが、少なくともプラチナ併用術後補助化学療法の対象となるII期、IIIA期の患者に対しては、圧倒的な無病生存期間の延長効果を示している。
それも、「予定していなかった中間解析の結果を受けて、独立データモニタリング委員会が早期の非盲検化を勧告した」というほどの出来事であり、余程のことである。
多分、EGFRチロシンキナーゼ阻害薬関連試験の常で、全生存期間の延長は達成できないだろう。
それも、おそらくはオシメルチニブを術後補助療法として加えることにより再発を先延ばしにする効果が得られているだけで、オシメルチニブ群のプラセボ群の累積再発患者数は、おそらく有意差は出ないだろう。
そして、治癒を目指すべき患者を対象とした臨床試験で、全生存期間の延長が得られないときに、その治療に臨床的な意義があるのか、という議論が沸き起こるだろう。
しかし、再発なく過ごせる期間が圧倒的に長くなる、というのは、当然大きなアドバンテージだ。
また、本試験は、IB期とII / III期への対応を、明確に区別すべき世界的なきっかけになるかも知れない。
所属リンパ節転移を伴わないIB期と、伴う(ということは、既にリンパ路にのった腫瘍細胞が広い範囲に広がっている)II / III期では、おのずと異なる対応が必要となるだろう。
IB期に対する我が国の標準術後補助化学療法はUFT内服2年間だが、果たしてオシメルチニブは、この成績を凌駕できるだろうか。
http://oitahaiganpractice.junglekouen.com/e968113.html
また、II-IIIA期の患者で、術後補助化学療法が行われた患者と行われなかった患者で、無病生存期間や全生存期間に差が出るかどうかも見てみたいところである。
Osimertinib as adjuvant therapy in patients with stage IB-IIIA EGFR mutation positive NSCLC after complete tumor resection
Roy Herbst et al.
ASCO 2020 abst. #LBA5
背景:
オシメルチニブは第3世代の、中枢神経病変への活性を有するEGFRチロシンキナーゼ阻害薬で、EGFR遺伝子変異陽性の未治療進行非小細胞肺がんに対する治療において、ゲフィチニブやエルロチニブよりも効果が高いことが示されている。非小細胞肺がん患者の約30%はI-IIIA期の早期段階で診断され、この場合は外科手術が第一選択の治療である。II-III期、およびIB期の一部の患者では、切除後に術後補助化学療法を行うことが標準治療とされているが、いまだ術後再発率は高く、他の治療の必要性が叫ばれてきた。ADAURA試験は、完全切除後で、必要に応じて術後補助化学療法がおこなわれたIB-IIIA期のEGFR遺伝子変異陽性非小細胞肺がん患者を対象として、プラセボに対するオシメルチニブの有効性と安全性を評価することを目的とした第III相二重盲検ランダム化比較試験である。独立したデータモニタリング委員会の勧告に従い、本試験は有効性データをもとに早期の非盲検化を行うこととなった。そのため、今回は予定していなかった中間解析結果について報告する。
方法:
適格患者の条件は以下の通り。
・18歳以上(日本と台湾では20歳以上)
・WHO PS 0もしくは1
・IB, II, IIIA期の原発性非扁平上皮非小細胞肺がん
・EGFR遺伝子変異(エクソン19欠失変異 / エクソン21L858R点突然変異)が確認されている
・原発性非小細胞肺がん完全切除後で、術後状態から回復している
術後(補助)化学療法は許容された。対象患者はオシメルチニブ群(オシメルチニブ80mg/回を1日1回服用)とプラセボ群に1:1の割合で無作為に割り付けられ、3年間を上限としてプロトコール治療を受けた。病期(IB期 / II期 / IIIA期)、EGFR遺伝子変異のタイプ(エクソン19 / エクソン21)、人種(アジア人 / 非アジア人)を割り付け調整因子とした。主要評価項目はII-IIIA期の患者の無病生存期間とし、副次評価項目は全生存期間と安全性とした。データカットオフは2020年1月17日に設定された。
結果:
全体で、682人の患者が無作為割り付けされた。オシメルチニブ群は339人、プラセボ群は343人だった。背景因子は両群でバランスが取れていた。IB期患者はそれぞれ31%、II / IIIA期患者はそれぞれ69%、女性は68% / 72%、エクソン19変異は55% / 56%、エクソン21変異は45% / 44%だった。II-IIIA期の患者の無病生存期間に関するハザード比は0.17(95%信頼区間は0.12-0.23)で、p<0.0001(156 / 470イベント)と、オシメルチニブ群で有意に延長した。2年無病生存割合はオシメルチニブ群で90%、プラセボ群で44%だった。対象となった患者全体では、無病生存期間に関するハザード比は0.21(95%信頼区間は0.16-0.28)で、p<0.0001(196 / 682イベント)と、こちらもオシメルチニブ群で有意に延長した。2年無病生存割合はオシメルチニブ群で89%、プラセボ群で53%だった。データカットオフ時点での全生存期間データは未だ不十分で(データ確定は4%程度)、682人中29人が死亡していた(オシメルチニブ群で9人、プラセボ群で20人)。安全性については、オシメルチニブについて既に知られている内容と変わりはなかった。
結論:
オシメルチニブによる術後補助療法は、今回の対象集団に対して統計学的有意に、かつ臨床的にも意義のある無病生存期間の延長効果を示した。
・本試験のシェーマ

・患者背景

・試験結果概要

・無病生存期間生存曲線
II-IIIA期のみ(主要評価項目)

IB-IIIA期の全て
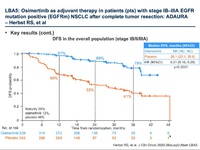
・各病期ごとの無病生存期間生存曲線

・サブグループ解析のフォレスト・プロット

・II期、IIIA期患者の全生存期間生存曲線

http://oitahaiganpractice.junglekouen.com/e973395.html
無病生存期間の生存曲線を見ると、目を瞠る。
ハザード比0.17・・・。
そうそうお目にかかれない数字である。
本試験は、術後補助化学療法の標準治療であるプラチナ併用化学療法とオシメルチニブを比較したものではない。
EGFR遺伝子変異陽性の完全切除後非扁平上皮非小細胞肺がん患者を対象とし、適応のある患者には標準治療である術後補助化学療法を行い(詳しい治療レジメンの記載はないが)、その後にオシメルチニブを上乗せする意義があるかどうかを、プラセボ対照で検証した試験である。
実地臨床において、術後補助化学療法の適応はあるものの、年齢、背景疾患、患者の希望等々の理由で術後補助化学療法がおこなわれない患者は相当数いるため、こうした試験デザインでも一定の意義がある。
治療的にも医療経済的にも"toxic new"な治療だったわけだが、少なくともプラチナ併用術後補助化学療法の対象となるII期、IIIA期の患者に対しては、圧倒的な無病生存期間の延長効果を示している。
それも、「予定していなかった中間解析の結果を受けて、独立データモニタリング委員会が早期の非盲検化を勧告した」というほどの出来事であり、余程のことである。
多分、EGFRチロシンキナーゼ阻害薬関連試験の常で、全生存期間の延長は達成できないだろう。
それも、おそらくはオシメルチニブを術後補助療法として加えることにより再発を先延ばしにする効果が得られているだけで、オシメルチニブ群のプラセボ群の累積再発患者数は、おそらく有意差は出ないだろう。
そして、治癒を目指すべき患者を対象とした臨床試験で、全生存期間の延長が得られないときに、その治療に臨床的な意義があるのか、という議論が沸き起こるだろう。
しかし、再発なく過ごせる期間が圧倒的に長くなる、というのは、当然大きなアドバンテージだ。
また、本試験は、IB期とII / III期への対応を、明確に区別すべき世界的なきっかけになるかも知れない。
所属リンパ節転移を伴わないIB期と、伴う(ということは、既にリンパ路にのった腫瘍細胞が広い範囲に広がっている)II / III期では、おのずと異なる対応が必要となるだろう。
IB期に対する我が国の標準術後補助化学療法はUFT内服2年間だが、果たしてオシメルチニブは、この成績を凌駕できるだろうか。
http://oitahaiganpractice.junglekouen.com/e968113.html
また、II-IIIA期の患者で、術後補助化学療法が行われた患者と行われなかった患者で、無病生存期間や全生存期間に差が出るかどうかも見てみたいところである。
Osimertinib as adjuvant therapy in patients with stage IB-IIIA EGFR mutation positive NSCLC after complete tumor resection
Roy Herbst et al.
ASCO 2020 abst. #LBA5
背景:
オシメルチニブは第3世代の、中枢神経病変への活性を有するEGFRチロシンキナーゼ阻害薬で、EGFR遺伝子変異陽性の未治療進行非小細胞肺がんに対する治療において、ゲフィチニブやエルロチニブよりも効果が高いことが示されている。非小細胞肺がん患者の約30%はI-IIIA期の早期段階で診断され、この場合は外科手術が第一選択の治療である。II-III期、およびIB期の一部の患者では、切除後に術後補助化学療法を行うことが標準治療とされているが、いまだ術後再発率は高く、他の治療の必要性が叫ばれてきた。ADAURA試験は、完全切除後で、必要に応じて術後補助化学療法がおこなわれたIB-IIIA期のEGFR遺伝子変異陽性非小細胞肺がん患者を対象として、プラセボに対するオシメルチニブの有効性と安全性を評価することを目的とした第III相二重盲検ランダム化比較試験である。独立したデータモニタリング委員会の勧告に従い、本試験は有効性データをもとに早期の非盲検化を行うこととなった。そのため、今回は予定していなかった中間解析結果について報告する。
方法:
適格患者の条件は以下の通り。
・18歳以上(日本と台湾では20歳以上)
・WHO PS 0もしくは1
・IB, II, IIIA期の原発性非扁平上皮非小細胞肺がん
・EGFR遺伝子変異(エクソン19欠失変異 / エクソン21L858R点突然変異)が確認されている
・原発性非小細胞肺がん完全切除後で、術後状態から回復している
術後(補助)化学療法は許容された。対象患者はオシメルチニブ群(オシメルチニブ80mg/回を1日1回服用)とプラセボ群に1:1の割合で無作為に割り付けられ、3年間を上限としてプロトコール治療を受けた。病期(IB期 / II期 / IIIA期)、EGFR遺伝子変異のタイプ(エクソン19 / エクソン21)、人種(アジア人 / 非アジア人)を割り付け調整因子とした。主要評価項目はII-IIIA期の患者の無病生存期間とし、副次評価項目は全生存期間と安全性とした。データカットオフは2020年1月17日に設定された。
結果:
全体で、682人の患者が無作為割り付けされた。オシメルチニブ群は339人、プラセボ群は343人だった。背景因子は両群でバランスが取れていた。IB期患者はそれぞれ31%、II / IIIA期患者はそれぞれ69%、女性は68% / 72%、エクソン19変異は55% / 56%、エクソン21変異は45% / 44%だった。II-IIIA期の患者の無病生存期間に関するハザード比は0.17(95%信頼区間は0.12-0.23)で、p<0.0001(156 / 470イベント)と、オシメルチニブ群で有意に延長した。2年無病生存割合はオシメルチニブ群で90%、プラセボ群で44%だった。対象となった患者全体では、無病生存期間に関するハザード比は0.21(95%信頼区間は0.16-0.28)で、p<0.0001(196 / 682イベント)と、こちらもオシメルチニブ群で有意に延長した。2年無病生存割合はオシメルチニブ群で89%、プラセボ群で53%だった。データカットオフ時点での全生存期間データは未だ不十分で(データ確定は4%程度)、682人中29人が死亡していた(オシメルチニブ群で9人、プラセボ群で20人)。安全性については、オシメルチニブについて既に知られている内容と変わりはなかった。
結論:
オシメルチニブによる術後補助療法は、今回の対象集団に対して統計学的有意に、かつ臨床的にも意義のある無病生存期間の延長効果を示した。
・本試験のシェーマ

・患者背景
・試験結果概要

・無病生存期間生存曲線
II-IIIA期のみ(主要評価項目)
IB-IIIA期の全て
・各病期ごとの無病生存期間生存曲線
・サブグループ解析のフォレスト・プロット
・II期、IIIA期患者の全生存期間生存曲線
2020年05月20日
ゲフィチニブの術後補助化学療法は全生存期間を延長しないが・・・ADJUVANT-CTONG1104
ADJUVANT-CTONG1104は、過去に何度か扱った。
http://oitahaiganpractice.junglekouen.com/e919586.html
今回は、全生存期間に関する最終解析結果。
こうした試験デザインで、全生存期間が延長しないという現象は、もはや当たり前になってしまった。
しかし、わずか15人のサブグループ解析の結果ではあるが、術後補助治療でゲフィチニブを使って、再発後にも何らかのEGFRチロシンキナーゼ阻害薬を使うと、病理病期II-IIIA期の患者の術後全生存期間中央値が6年を超える、というのは、やはり意義のある結果ではないだろうか。
日常臨床の経験から、そう実感する。
CTONG1104: Adjuvant gefitinib versus chemotherapy for resected N1-N2 NSCLC with EGFR mutation—Final overall survival analysis of the randomized phase III trial 1 analysis of the randomized phase III trial.
Yi-Long Wu,et al.
2020 ASCO Virtual Scientific Program
abst.#9005
背景:
ADJUVANT-CTONG1104試験は、EGFR遺伝子変異陽性、病理病期II-IIIA(N1-N2)期の完全切除後非小細胞肺がん患者における術後補助療法として、標準的な併用化学療法に対するゲフィチニブ内服療法が無病生存期間を有意に改善することを示した。N1-N2患者における5年生存割合は、IASLC病期診断システムでは38-50%とされている。今回、本試験における全生存期間の最終解析結果を報告する。
方法:
2011年9月から2014年4月の期間に、222人の患者を集積した。年齢は18歳から75歳、27施設から適格患者を集積した。患者を1:1の比率で各治療群間に割り付けた。G群(111人)ではゲフィチニブ250mg/日を24ヶ月にわたって投与した。VP群(111人)では、ビノレルビン(25㎎/㎡、1日目、8日目)+シスプラチン(75mg/㎡、1日目)併用療法を3週間ごとに4コース投与した。主要評価項目は無病生存期間、ITT解析に基づくものとした。副次評価項目には全生存期間、3年無病生存割合、5年無病生存割合、5年生存割合を含めた。VP群がゲフィチニブを使用する、G群がゲフィチニブを再使用するなど、再発後の後治療についてもデータを収集した。今回の解析におけるデータカットオフは2020年1月13日とした。
結果:
追跡期間中央値は76.9ヶ月だった。ITT解析対象となった患者集団全体における再発/死亡イベントは95件(42.8%)だった。生存期間中央値はG群で75.5ヶ月、VP群で79.2ヶ月、ハザード比は0.96、95%信頼区間は0.64-1.43、p=0.823だった。3年生存割合、5年生存割合は、G群でそれぞれ68.6%、53.8%で、VP群では67.5%、52.4%だった。3年無病生存割合、5年無病生存割合は、G群で40.3%、23.4%で、VP群では33.2%、23.7%だった(3年無病生存割合に関するp値は0.395、5年無病生存割合におけるp値は0.891)。年齢、性別、リンパ節転移の状況、EGFR遺伝子変異タイプ別のサブグループ解析では、有意差がつくものはなかった。後治療においては、分子標的薬を用いた治療が生存期間延長に寄与していた(ハザード比0.46、95%信頼区間は0.26-0.83)。後治療で分子標的薬を使用した患者(35人)の生存期間中央値は75.5ヶ月で、その他の治療を受けた患者(33人)の生存期間中央値は36.4ヶ月だった(p<0.001)。G群で後治療に分子標的薬を使用した患者(15人)の生存期間中央値は75.5ヶ月で、その他の治療を受けた患者(18人)の生存期間中央値は36.4ヶ月だった(p<0.001)。VP群で後治療に分子標的薬を使用した患者(20人)の生存期間中央値は62.8ヶ月で、その他の治療を受けた患者(15人)の生存期間中央値は46.8ヶ月だった(p=0.251)。G群で後治療に分子標的薬を使用した患者(15人)における奏効割合は26.7%、病勢コントロール割合は66.7%、無増悪生存期間中央値は14.1ヶ月、全生存期間中央値は19.6ヶ月だった。追跡期間中に、想定外の重篤な有害事象は認められなかった。
結論:
ADJUVANT試験では、無病生存期間の延長がそのまま全生存期間の延長に反映されることはなかった(無病生存期間は延長したが、全生存期間は延長しなかった)。N1-N2期の完全切除後非小細胞肺がん患者の生存期間中央値が75.5ヶ月に及ぶというのは過去のデータと比較して有望であり、術後補助化学療法、再発後治療のいずれでも分子標的薬を使用することで生存期間延長が期待できる。
・CTONG1104試験概要

・全生存期間の生存曲線

・無病生存期間の生存曲線

http://oitahaiganpractice.junglekouen.com/e919586.html
今回は、全生存期間に関する最終解析結果。
こうした試験デザインで、全生存期間が延長しないという現象は、もはや当たり前になってしまった。
しかし、わずか15人のサブグループ解析の結果ではあるが、術後補助治療でゲフィチニブを使って、再発後にも何らかのEGFRチロシンキナーゼ阻害薬を使うと、病理病期II-IIIA期の患者の術後全生存期間中央値が6年を超える、というのは、やはり意義のある結果ではないだろうか。
日常臨床の経験から、そう実感する。
CTONG1104: Adjuvant gefitinib versus chemotherapy for resected N1-N2 NSCLC with EGFR mutation—Final overall survival analysis of the randomized phase III trial 1 analysis of the randomized phase III trial.
Yi-Long Wu,et al.
2020 ASCO Virtual Scientific Program
abst.#9005
背景:
ADJUVANT-CTONG1104試験は、EGFR遺伝子変異陽性、病理病期II-IIIA(N1-N2)期の完全切除後非小細胞肺がん患者における術後補助療法として、標準的な併用化学療法に対するゲフィチニブ内服療法が無病生存期間を有意に改善することを示した。N1-N2患者における5年生存割合は、IASLC病期診断システムでは38-50%とされている。今回、本試験における全生存期間の最終解析結果を報告する。
方法:
2011年9月から2014年4月の期間に、222人の患者を集積した。年齢は18歳から75歳、27施設から適格患者を集積した。患者を1:1の比率で各治療群間に割り付けた。G群(111人)ではゲフィチニブ250mg/日を24ヶ月にわたって投与した。VP群(111人)では、ビノレルビン(25㎎/㎡、1日目、8日目)+シスプラチン(75mg/㎡、1日目)併用療法を3週間ごとに4コース投与した。主要評価項目は無病生存期間、ITT解析に基づくものとした。副次評価項目には全生存期間、3年無病生存割合、5年無病生存割合、5年生存割合を含めた。VP群がゲフィチニブを使用する、G群がゲフィチニブを再使用するなど、再発後の後治療についてもデータを収集した。今回の解析におけるデータカットオフは2020年1月13日とした。
結果:
追跡期間中央値は76.9ヶ月だった。ITT解析対象となった患者集団全体における再発/死亡イベントは95件(42.8%)だった。生存期間中央値はG群で75.5ヶ月、VP群で79.2ヶ月、ハザード比は0.96、95%信頼区間は0.64-1.43、p=0.823だった。3年生存割合、5年生存割合は、G群でそれぞれ68.6%、53.8%で、VP群では67.5%、52.4%だった。3年無病生存割合、5年無病生存割合は、G群で40.3%、23.4%で、VP群では33.2%、23.7%だった(3年無病生存割合に関するp値は0.395、5年無病生存割合におけるp値は0.891)。年齢、性別、リンパ節転移の状況、EGFR遺伝子変異タイプ別のサブグループ解析では、有意差がつくものはなかった。後治療においては、分子標的薬を用いた治療が生存期間延長に寄与していた(ハザード比0.46、95%信頼区間は0.26-0.83)。後治療で分子標的薬を使用した患者(35人)の生存期間中央値は75.5ヶ月で、その他の治療を受けた患者(33人)の生存期間中央値は36.4ヶ月だった(p<0.001)。G群で後治療に分子標的薬を使用した患者(15人)の生存期間中央値は75.5ヶ月で、その他の治療を受けた患者(18人)の生存期間中央値は36.4ヶ月だった(p<0.001)。VP群で後治療に分子標的薬を使用した患者(20人)の生存期間中央値は62.8ヶ月で、その他の治療を受けた患者(15人)の生存期間中央値は46.8ヶ月だった(p=0.251)。G群で後治療に分子標的薬を使用した患者(15人)における奏効割合は26.7%、病勢コントロール割合は66.7%、無増悪生存期間中央値は14.1ヶ月、全生存期間中央値は19.6ヶ月だった。追跡期間中に、想定外の重篤な有害事象は認められなかった。
結論:
ADJUVANT試験では、無病生存期間の延長がそのまま全生存期間の延長に反映されることはなかった(無病生存期間は延長したが、全生存期間は延長しなかった)。N1-N2期の完全切除後非小細胞肺がん患者の生存期間中央値が75.5ヶ月に及ぶというのは過去のデータと比較して有望であり、術後補助化学療法、再発後治療のいずれでも分子標的薬を使用することで生存期間延長が期待できる。
・CTONG1104試験概要

・全生存期間の生存曲線

・無病生存期間の生存曲線

2020年05月20日
JCOG1205/1206・・・斜陽のイリノテカン
初期のパイロットスタディー立案に関わった立場としては寂しい限りだ。
小細胞肺がん、大細胞神経内分泌がんの術後補助化学療法として、シスプラチン+イリノテカン併用療法の有効性を検証した本試験。
残念ながら、シスプラチン+エトポシド併用療法に対する優越性を示すことはできなかった。
時代の流れというべきではないか。
イリノテカンという薬は、下痢の対処、UGT1A1遺伝子多型を評価する必要、毎週イリノテカン分割投与、という手間がある。
進展型小細胞肺がんに対するイリノテカンの有効性は、我が国の第III相臨床試験で示されているものの、その位置づけは年々低下している印象がある。
プラチナ製剤+エトポシド併用療法が世界的な標準と位置付けられ、免疫チェックポイント阻害薬が治療に組み込まれるようになって、いよいよ存在感が低下している。
これも時代の要請だろう。
治療の効果もさることながら、これだけ外来化学療法が普及してくると、治療の利便性、という臨床試験には表れない評価基準は、避けて通れない。
少なくとも肺がん領域では、イリノテカンは実臨床における自然淘汰にさらされているのだ。
本試験では、主要評価項目が全生存期間から3年無再発生存割合に変更されている。
折に触れて記しているが、第III相臨床試験において、主要評価項目を変更するのは、私個人としては禁じ手だと思っている。
臨床試験そのものの信頼性に関わる問題である。
だがしかし、今回の変更、中間解析時点での無効中止の判断は、時代の流れを汲み取り、早期に結論を出すための苦渋の決断だったのではないかと想像する。
さようなら、イリノテカン。
こんにちは、免疫チェックポイント阻害薬。
きっと次のステップでは、同じ患者集団を対象に、シスプラチン+エトポシド併用療法に免疫チェックポイント阻害薬を加えるかどうか、というコンセプトを考えるのではないだろうか。
私なら、そのために本試験を早期中止する。
だけど。
重喫煙者が多数を占めるこの患者集団に、医療費の高騰を招く上記のような臨床試験コンセプトは、受け入れがたい。
喫煙習慣撲滅以上に効果が期待できる臨床試験、この患者集団に立案できるだろうか。
たばこ業界と製薬業界には悪いが、喫煙者を触媒にして利益を得るのは、もういい加減やめてほしい。
消費者には自己を守る意識を、医療者には納税者への責任を肝に銘じてほしい。
Randomized phase III study of irinotecan/cisplatin (IP) versus etoposide/cisplatin (EP) for completely resected high-grade neuroendocrine carcinoma (HGNEC) of the lung: JCOG1205/1206.
Hirotsugu Kenmotsu. et al.
2020 ASCO Virtual Scientific Program
abst.#9006
背景:
肺がんWHO分類では、小細胞肺がんと大細胞神経内分泌がんは肺原発の高悪性度神経内分泌がんと捉えられている。完全切除後の肺原発高悪性度神経内分泌がんの術後補助化学療法について検討した無作為化比較試験は皆無だが、シスプラチン+エトポシド併用化学療法が標準治療と位置付けられている。一方、進展型小細胞肺がんに対しては、第III相比較試験(JCOG9511試験)で、シスプラチン+エトポシド併用療法に対するシスプラチン+イリノテカン併用療法の優位性が示されている。
方法:
完全切除後の高悪性度神経内分泌がんの患者を対象とし、EP群:エトポシド(100mg/㎡、1-3日目)+シスプラチン(80mg/㎡、1日目)とIP群:イリノテカン(60mg/㎡、1日目、8日目、15日目)+シスプラチン(60mg/㎡、1日目)に1:1の割合で無作為割付を行った。性別、病理病期、組織型、参加施設を割付調整因子とし、最小化法を用いて無作為化した。主要評価項目は当初全生存期間だったが、試験期間中に無再発生存期間に改めた。3年無再発生存割合をEP群で59%、IP群で72%、ハザード比を0.623とする仮説を立てた。80%の検出率、αエラーは片側検定で、有意水準5%と設定した。予定集積患者数は220人、患者集積期間を6年間、追跡期間を3年間とした。
結果:
2013年4月から2018年10月の期間に、221人の患者を集積した。年齢中央値は66歳、病理病期I期の患者が54%と半数以上を占め、小細胞がんの患者が53%とやはり半数以上を占めた。111人をEP群に、110人をIP群に割り付けた。2回目の中間解析において、主要評価項目の解析を行う時点でIP群がEP群を上回る確率が15.9%だったため、本試験は早期終了すべし、との結論に至った。追跡期間中央値24.1ヶ月の時点で、3年無増悪生存割合はEP群で65.4%、IP群で69.0%、ハザード比1.076(95%信頼区間は0.666-1.738、p=0.619)だった。組織型別のサブグループ解析で、小細胞がんにおける3年無再発生存割合はEP群で65.2%、IP群で66.5%、ハザード比1.029(95%信頼区間は0.544-1.944)、大細胞神経内分泌がんにおける3年無再発生存割合はEP群で66.5%、IP群で72.0%、ハザード比1.072(95%信頼区間は0.517-2.222)だった。3年全生存割合はEP群で84.1%、IP群で79.0%、ハザード比は1.539(95%信頼区間は0.760-3.117)だった。治療完遂割合はEP群で87.4%、IP群で72.7%だった。EP群、IP群におけるGrade 3 / 4の有害事象発生割合は、発熱性好中球減少症が20.2%、3.7%、好中球減少症が97.2%、35.8%で、これらはEP群でより高頻度だった。一方、Grade 3 / 4の下痢は0.9%、8.3%、食欲不振は6.4%、11.1%で、これら消化器症状はIP群で高頻度だった。IP群の中で1人だけ、気管内出血による治療関連死を認めた。
結論:
本試験では、完全切除後高悪性度神経内分泌がんの患者の術後補助化学療法において、EP群に対するIP群の優越性を証明できなかった。シスプラチン+エトポシド併用療法は、引き続き本患者群の標準治療と位置付けられる。
小細胞肺がん、大細胞神経内分泌がんの術後補助化学療法として、シスプラチン+イリノテカン併用療法の有効性を検証した本試験。
残念ながら、シスプラチン+エトポシド併用療法に対する優越性を示すことはできなかった。
時代の流れというべきではないか。
イリノテカンという薬は、下痢の対処、UGT1A1遺伝子多型を評価する必要、毎週イリノテカン分割投与、という手間がある。
進展型小細胞肺がんに対するイリノテカンの有効性は、我が国の第III相臨床試験で示されているものの、その位置づけは年々低下している印象がある。
プラチナ製剤+エトポシド併用療法が世界的な標準と位置付けられ、免疫チェックポイント阻害薬が治療に組み込まれるようになって、いよいよ存在感が低下している。
これも時代の要請だろう。
治療の効果もさることながら、これだけ外来化学療法が普及してくると、治療の利便性、という臨床試験には表れない評価基準は、避けて通れない。
少なくとも肺がん領域では、イリノテカンは実臨床における自然淘汰にさらされているのだ。
本試験では、主要評価項目が全生存期間から3年無再発生存割合に変更されている。
折に触れて記しているが、第III相臨床試験において、主要評価項目を変更するのは、私個人としては禁じ手だと思っている。
臨床試験そのものの信頼性に関わる問題である。
だがしかし、今回の変更、中間解析時点での無効中止の判断は、時代の流れを汲み取り、早期に結論を出すための苦渋の決断だったのではないかと想像する。
さようなら、イリノテカン。
こんにちは、免疫チェックポイント阻害薬。
きっと次のステップでは、同じ患者集団を対象に、シスプラチン+エトポシド併用療法に免疫チェックポイント阻害薬を加えるかどうか、というコンセプトを考えるのではないだろうか。
私なら、そのために本試験を早期中止する。
だけど。
重喫煙者が多数を占めるこの患者集団に、医療費の高騰を招く上記のような臨床試験コンセプトは、受け入れがたい。
喫煙習慣撲滅以上に効果が期待できる臨床試験、この患者集団に立案できるだろうか。
たばこ業界と製薬業界には悪いが、喫煙者を触媒にして利益を得るのは、もういい加減やめてほしい。
消費者には自己を守る意識を、医療者には納税者への責任を肝に銘じてほしい。
Randomized phase III study of irinotecan/cisplatin (IP) versus etoposide/cisplatin (EP) for completely resected high-grade neuroendocrine carcinoma (HGNEC) of the lung: JCOG1205/1206.
Hirotsugu Kenmotsu. et al.
2020 ASCO Virtual Scientific Program
abst.#9006
背景:
肺がんWHO分類では、小細胞肺がんと大細胞神経内分泌がんは肺原発の高悪性度神経内分泌がんと捉えられている。完全切除後の肺原発高悪性度神経内分泌がんの術後補助化学療法について検討した無作為化比較試験は皆無だが、シスプラチン+エトポシド併用化学療法が標準治療と位置付けられている。一方、進展型小細胞肺がんに対しては、第III相比較試験(JCOG9511試験)で、シスプラチン+エトポシド併用療法に対するシスプラチン+イリノテカン併用療法の優位性が示されている。
方法:
完全切除後の高悪性度神経内分泌がんの患者を対象とし、EP群:エトポシド(100mg/㎡、1-3日目)+シスプラチン(80mg/㎡、1日目)とIP群:イリノテカン(60mg/㎡、1日目、8日目、15日目)+シスプラチン(60mg/㎡、1日目)に1:1の割合で無作為割付を行った。性別、病理病期、組織型、参加施設を割付調整因子とし、最小化法を用いて無作為化した。主要評価項目は当初全生存期間だったが、試験期間中に無再発生存期間に改めた。3年無再発生存割合をEP群で59%、IP群で72%、ハザード比を0.623とする仮説を立てた。80%の検出率、αエラーは片側検定で、有意水準5%と設定した。予定集積患者数は220人、患者集積期間を6年間、追跡期間を3年間とした。
結果:
2013年4月から2018年10月の期間に、221人の患者を集積した。年齢中央値は66歳、病理病期I期の患者が54%と半数以上を占め、小細胞がんの患者が53%とやはり半数以上を占めた。111人をEP群に、110人をIP群に割り付けた。2回目の中間解析において、主要評価項目の解析を行う時点でIP群がEP群を上回る確率が15.9%だったため、本試験は早期終了すべし、との結論に至った。追跡期間中央値24.1ヶ月の時点で、3年無増悪生存割合はEP群で65.4%、IP群で69.0%、ハザード比1.076(95%信頼区間は0.666-1.738、p=0.619)だった。組織型別のサブグループ解析で、小細胞がんにおける3年無再発生存割合はEP群で65.2%、IP群で66.5%、ハザード比1.029(95%信頼区間は0.544-1.944)、大細胞神経内分泌がんにおける3年無再発生存割合はEP群で66.5%、IP群で72.0%、ハザード比1.072(95%信頼区間は0.517-2.222)だった。3年全生存割合はEP群で84.1%、IP群で79.0%、ハザード比は1.539(95%信頼区間は0.760-3.117)だった。治療完遂割合はEP群で87.4%、IP群で72.7%だった。EP群、IP群におけるGrade 3 / 4の有害事象発生割合は、発熱性好中球減少症が20.2%、3.7%、好中球減少症が97.2%、35.8%で、これらはEP群でより高頻度だった。一方、Grade 3 / 4の下痢は0.9%、8.3%、食欲不振は6.4%、11.1%で、これら消化器症状はIP群で高頻度だった。IP群の中で1人だけ、気管内出血による治療関連死を認めた。
結論:
本試験では、完全切除後高悪性度神経内分泌がんの患者の術後補助化学療法において、EP群に対するIP群の優越性を証明できなかった。シスプラチン+エトポシド併用療法は、引き続き本患者群の標準治療と位置付けられる。
2020年04月26日
免疫チェックポイント阻害薬による術前免疫療法
ときどき思い立って、データベースを使って肺がん患者さんの過去を遡り、気づきを探すことにしている。
やはり、5年間以上の長期生存を達成した患者さんの臨床経過は参考になる。
こうした作業は、学会発表で経過をまとめる医師がときどき行う程度で、実際にはあまり為されていないのではないだろうか。
前向き臨床試験がすべてであり、標準治療以外の治療は行う価値はなく、実地臨床で診療する患者の過去なんて振り返らない、という医師には、おそらく永遠に見えてこない景色がある。
私は、臨床試験から得られる知見と、実地臨床から得られる経験(と振り返り)、そして社会人・家庭人としての常識、これらがうまくかみ合って、初めて最良の診療ができると信じている。
長生きしている患者さんの診療を振り返ってその都度感じるのは、その時々の患者の状況に応じて、知恵を絞って、諦めずに泥臭く悪戦苦闘すると、ときになんらかの光明が見えるということである。
ドライバー遺伝子変異陽性の患者でも、分子標的薬が効いていた期間よりも殺細胞性抗腫瘍薬が効いていた期間の方が長くなることもある。
脳転移再発した完全切除後の患者でも、脳転移の治療をした後に5年以上長生きすることもある。
免疫チェックポイント阻害薬が実地臨床に浸透して、どの程度長生きする患者が増えるのか、楽しみだ。
進行期の患者だけでなく、術後補助療法としても臨床試験が行われているが、なんとなく参加者は長生きしているような印象を受ける。
また、術前療法としても臨床試験が進行しているようで、以下の記事を見ると期待が持てる。
What’s the Current Status of Neoadjuvant Immunotherapy?
The ASCO Post
April 25, 2020
<肺がんに対する術前免疫療法>
免疫療法は、進行期肺がんに対する薬物療法として、そして完全切除後の肺がんに対する術後療法として進化してきた。術前療法としての意義も検討されつつある。免疫療法を行うことで、治療前には手術ができなかった患者に対して、手術ができるようになるかもしれない。また、免疫療法の効果が極めて良好な患者では、手術そのものが不要になるかもしれない。
こうした術前免疫療法の可能性については、すでに50以上の臨床試験が非小細胞肺がん患者を対象に広く行われており、その多くは第III相臨床試験である。
こうした臨床試験の初期のものは既に結果が報告されている。非小細胞肺がん患者20人を対象とした臨床試験(Forde PM, Chaft JE, Smith KN, et al: Neoadjuvant PD-1 blockade in resectable lung cancer. N Engl J Med 378:1976-1986, 2018., http://oitahaiganpractice.junglekouen.com/e932057.html)では、完全奏効はほとんど観察されなかった一方で、Major pathologic response rate(病理学的に、病巣内の腫瘍細胞のうち90%は死滅していた患者の割合)は45%(9人)で、3年間の間に術後再発を来した患者はわずか1人で、その患者も適切に再治療できている。長期経過観察において、寛解状態を維持している患者の血中を循環する腫瘍DNAは認められておらず、免疫療法がよく効いた患者では、腫瘍特異的T細胞クローン数が有意に高く保たれており、潜在的に抗腫瘍活性を惹起している。
非小細胞肺がんの術前免疫療法臨床試験における病理学的完全寛解割合は24%であり、これは術前化学療法におけるそれの20%よりも高い。さらには、術前免疫療法の方が毒性が軽い。特筆すべきことに、NADIM II試験(ClinicalTrials.gov identifier NCT03838159)において術前化学療法にニボルマブを上乗せしたところ、Major pathologic response rateは74%に上った。
術前免疫療法は、化学療法と併用される・されないに関わらず、忍容可能で病理学的寛解状態へ導きうるということで、こうした所見は複数の第III相臨床試験で検証中である。術前化学免疫療法と術前化学療法を比較する現在進行中の臨床試験には、CheckMate 816試験(ニボルマブ)、KEYNOTE-671試験(ペンブロリズマブ)、IMpassion030試験(アテゾリズマブ)が含まれる。AEGEAN試験は、抗PD-L1抗体であるデュルバルマブとプラセボを比較するコンセプトである。そのほかに、新規薬物を用いた臨床試験も進行中である。
2010年から2020年にかけては、進行期肺がん患者に対する分子標的薬や免疫チェックポイント阻害薬が勃興した時代だった。2020年から2030年は、こうした治療が早期肺がんの治療に応用し、再発の回避を目指すことになるだろう。
やはり、5年間以上の長期生存を達成した患者さんの臨床経過は参考になる。
こうした作業は、学会発表で経過をまとめる医師がときどき行う程度で、実際にはあまり為されていないのではないだろうか。
前向き臨床試験がすべてであり、標準治療以外の治療は行う価値はなく、実地臨床で診療する患者の過去なんて振り返らない、という医師には、おそらく永遠に見えてこない景色がある。
私は、臨床試験から得られる知見と、実地臨床から得られる経験(と振り返り)、そして社会人・家庭人としての常識、これらがうまくかみ合って、初めて最良の診療ができると信じている。
長生きしている患者さんの診療を振り返ってその都度感じるのは、その時々の患者の状況に応じて、知恵を絞って、諦めずに泥臭く悪戦苦闘すると、ときになんらかの光明が見えるということである。
ドライバー遺伝子変異陽性の患者でも、分子標的薬が効いていた期間よりも殺細胞性抗腫瘍薬が効いていた期間の方が長くなることもある。
脳転移再発した完全切除後の患者でも、脳転移の治療をした後に5年以上長生きすることもある。
免疫チェックポイント阻害薬が実地臨床に浸透して、どの程度長生きする患者が増えるのか、楽しみだ。
進行期の患者だけでなく、術後補助療法としても臨床試験が行われているが、なんとなく参加者は長生きしているような印象を受ける。
また、術前療法としても臨床試験が進行しているようで、以下の記事を見ると期待が持てる。
What’s the Current Status of Neoadjuvant Immunotherapy?
The ASCO Post
April 25, 2020
<肺がんに対する術前免疫療法>
免疫療法は、進行期肺がんに対する薬物療法として、そして完全切除後の肺がんに対する術後療法として進化してきた。術前療法としての意義も検討されつつある。免疫療法を行うことで、治療前には手術ができなかった患者に対して、手術ができるようになるかもしれない。また、免疫療法の効果が極めて良好な患者では、手術そのものが不要になるかもしれない。
こうした術前免疫療法の可能性については、すでに50以上の臨床試験が非小細胞肺がん患者を対象に広く行われており、その多くは第III相臨床試験である。
こうした臨床試験の初期のものは既に結果が報告されている。非小細胞肺がん患者20人を対象とした臨床試験(Forde PM, Chaft JE, Smith KN, et al: Neoadjuvant PD-1 blockade in resectable lung cancer. N Engl J Med 378:1976-1986, 2018., http://oitahaiganpractice.junglekouen.com/e932057.html)では、完全奏効はほとんど観察されなかった一方で、Major pathologic response rate(病理学的に、病巣内の腫瘍細胞のうち90%は死滅していた患者の割合)は45%(9人)で、3年間の間に術後再発を来した患者はわずか1人で、その患者も適切に再治療できている。長期経過観察において、寛解状態を維持している患者の血中を循環する腫瘍DNAは認められておらず、免疫療法がよく効いた患者では、腫瘍特異的T細胞クローン数が有意に高く保たれており、潜在的に抗腫瘍活性を惹起している。
非小細胞肺がんの術前免疫療法臨床試験における病理学的完全寛解割合は24%であり、これは術前化学療法におけるそれの20%よりも高い。さらには、術前免疫療法の方が毒性が軽い。特筆すべきことに、NADIM II試験(ClinicalTrials.gov identifier NCT03838159)において術前化学療法にニボルマブを上乗せしたところ、Major pathologic response rateは74%に上った。
術前免疫療法は、化学療法と併用される・されないに関わらず、忍容可能で病理学的寛解状態へ導きうるということで、こうした所見は複数の第III相臨床試験で検証中である。術前化学免疫療法と術前化学療法を比較する現在進行中の臨床試験には、CheckMate 816試験(ニボルマブ)、KEYNOTE-671試験(ペンブロリズマブ)、IMpassion030試験(アテゾリズマブ)が含まれる。AEGEAN試験は、抗PD-L1抗体であるデュルバルマブとプラセボを比較するコンセプトである。そのほかに、新規薬物を用いた臨床試験も進行中である。
2010年から2020年にかけては、進行期肺がん患者に対する分子標的薬や免疫チェックポイント阻害薬が勃興した時代だった。2020年から2030年は、こうした治療が早期肺がんの治療に応用し、再発の回避を目指すことになるだろう。




