2015年12月31日
Lorlatinib後のCrizotinib
今年最後の仕事も、もうすぐ終わろうとしています。
大晦日の日直でしたが、わりあい落ち着いていて、久し振りにゆっくりブログ記事作成ができました。
そろそろ帰り支度、という頃合いになって、以下の論文がNew England Journal of Medicineに載っていたので、ちょっとだけ触れて帰ります。
Resensitization to Crizotinib by the Lorlatinib ALK Resistance Mutation L1198F
Alice T. Shaw, M.D., Ph.D., Luc Friboulet, Ph.D., Ignaty Leshchiner, Ph.D., Justin F. Gainor, M.D., Simon Bergqvist, Ph.D., Alexei Brooun, Ph.D., Benjamin J. Burke, Ph.D., Ya-Li Deng, B.S., Wei Liu, M.A., Leila Dardaei, Ph.D., Rosa L. Frias, B.A., Kate R. Schultz, M.A., Jennifer Logan, M.S.N., Leonard P. James, M.D., Ph.D., Tod Smeal, Ph.D., Sergei Timofeevski, Ph.D., Ryohei Katayama, Ph.D., A. John Iafrate, M.D., Ph.D., Long Le, M.D., Michele McTigue, Ph.D., Gad Getz, Ph.D., Ted W. Johnson, Ph.D., and Jeffrey A. Engelman, M.D., Ph.D.
New England Journal of Medicine, December 23, 2015DOI: 10.1056/NEJMoa1508887
ALK遺伝子再構成を伴う52歳の女性患者が、ALKのリン酸化部位の二次的変異によりクリゾチニブ耐性となった。この二次的変異はC1156Yのアミノ酸置換をもたらすものと予測された。耐性後、第2世代ALK阻害薬であるCeritinibを使用したが多発肝転移によりわずか5週間後に無効中止となり、ヒートショック蛋白90(HSP-90)阻害薬も無効だった。続いてカルボプラチン+ペメトレキセド併用療法を行ったところ6か月間は無増悪期間が得られたが、その後病勢進行に至り、クリゾチニブ再投与を試みたが無効だった。続いて、第3世代ALK阻害薬であるLorlatinib(PF-06463922)の第I相試験に参加したところ、5週間後には41%の腫瘍縮小効果が得られたが、8か月後には肝転移が増悪した。肝転移巣の再生検を行い遺伝子シーケンスを調べたところ、C1156Yの二次変異に加えて、L1198Fの三次変異を認めた。この変異はLorlatinibの結合部位に構造変化をもたらし、結合を阻害するものだった。しかしながら、L1198Fは不思議なことにクリゾチニブの結合作用を増強する効果も併せ持っていることがわかり、これによってC1156Yのクリゾチニブ阻害効果が無効化されていた。患者は遺伝子シーケンスの最中もLorlatinibの投与を受けていたが肝機能障害の進行により中止せざるを得なくなっていた。しかし、クリゾチニブの再々投与により臨床症状と肝機能障害は改善した。
・・・あきらめるな、ということですね。
実地臨床ではこんなに何回も遺伝子シーケンシングはできませんが、将来の治療戦略に期待が持てる報告です。
肺癌ではEGFRの世界でも同じようなことが起きていて、既に臨床応用されようとしていますし、おそらく、特定の遺伝子異常が分子標的薬の効果予測因子になる場合には、どの分子でも認められる現象なのでしょうね。
これで今年のブログは書き納め。
みなさん、よいお年を。
特に肺がんと闘っている患者さんとご家族は、この大切な年末年始を、有意義に過ごしてください。
大晦日の日直でしたが、わりあい落ち着いていて、久し振りにゆっくりブログ記事作成ができました。
そろそろ帰り支度、という頃合いになって、以下の論文がNew England Journal of Medicineに載っていたので、ちょっとだけ触れて帰ります。
Resensitization to Crizotinib by the Lorlatinib ALK Resistance Mutation L1198F
Alice T. Shaw, M.D., Ph.D., Luc Friboulet, Ph.D., Ignaty Leshchiner, Ph.D., Justin F. Gainor, M.D., Simon Bergqvist, Ph.D., Alexei Brooun, Ph.D., Benjamin J. Burke, Ph.D., Ya-Li Deng, B.S., Wei Liu, M.A., Leila Dardaei, Ph.D., Rosa L. Frias, B.A., Kate R. Schultz, M.A., Jennifer Logan, M.S.N., Leonard P. James, M.D., Ph.D., Tod Smeal, Ph.D., Sergei Timofeevski, Ph.D., Ryohei Katayama, Ph.D., A. John Iafrate, M.D., Ph.D., Long Le, M.D., Michele McTigue, Ph.D., Gad Getz, Ph.D., Ted W. Johnson, Ph.D., and Jeffrey A. Engelman, M.D., Ph.D.
New England Journal of Medicine, December 23, 2015DOI: 10.1056/NEJMoa1508887
ALK遺伝子再構成を伴う52歳の女性患者が、ALKのリン酸化部位の二次的変異によりクリゾチニブ耐性となった。この二次的変異はC1156Yのアミノ酸置換をもたらすものと予測された。耐性後、第2世代ALK阻害薬であるCeritinibを使用したが多発肝転移によりわずか5週間後に無効中止となり、ヒートショック蛋白90(HSP-90)阻害薬も無効だった。続いてカルボプラチン+ペメトレキセド併用療法を行ったところ6か月間は無増悪期間が得られたが、その後病勢進行に至り、クリゾチニブ再投与を試みたが無効だった。続いて、第3世代ALK阻害薬であるLorlatinib(PF-06463922)の第I相試験に参加したところ、5週間後には41%の腫瘍縮小効果が得られたが、8か月後には肝転移が増悪した。肝転移巣の再生検を行い遺伝子シーケンスを調べたところ、C1156Yの二次変異に加えて、L1198Fの三次変異を認めた。この変異はLorlatinibの結合部位に構造変化をもたらし、結合を阻害するものだった。しかしながら、L1198Fは不思議なことにクリゾチニブの結合作用を増強する効果も併せ持っていることがわかり、これによってC1156Yのクリゾチニブ阻害効果が無効化されていた。患者は遺伝子シーケンスの最中もLorlatinibの投与を受けていたが肝機能障害の進行により中止せざるを得なくなっていた。しかし、クリゾチニブの再々投与により臨床症状と肝機能障害は改善した。
・・・あきらめるな、ということですね。
実地臨床ではこんなに何回も遺伝子シーケンシングはできませんが、将来の治療戦略に期待が持てる報告です。
肺癌ではEGFRの世界でも同じようなことが起きていて、既に臨床応用されようとしていますし、おそらく、特定の遺伝子異常が分子標的薬の効果予測因子になる場合には、どの分子でも認められる現象なのでしょうね。
これで今年のブログは書き納め。
みなさん、よいお年を。
特に肺がんと闘っている患者さんとご家族は、この大切な年末年始を、有意義に過ごしてください。
2015年12月31日
afatinib vs gefitinib(LUX-Lung 7)
2015年12月18日から21日にかけて、シンガポールで開催された欧州臨床腫瘍学会 in Asia(ESMO Asia 2015)で、afatinib(ジオトリフ)とgefitinib(イレッサ)の比較試験(LUX-Lung 7)の結果が報告されました。
対象となった患者さんは
・IIIB期 / IV期の原発性肺腺癌
・EGFR遺伝子変異(Ex.19 / Ex.21のいずれか、あるいは両方)を有する
・過去に進行肺癌に対する治療歴がない
・Performance Status 0 / 1
で、Ex.19とEx.21のいずれか、脳転移があるかないかの2点を割付調整因子としてafatinib群とgefitinib群に等しく割り付けられました。
主要評価項目は3点、無増悪生存期間(PFS)と治療成功期間:無作為化から増悪、治療毒性および死亡を含む全ての原因による治療中止までの時間(TTF)、全生存期間(OS)でした。病勢増悪後も、担当医判断で治療を継続してもよいとされ、効果判定は4週目、8週目、それ以後は64週までは8週間ごと、それ以後は12週ごとと規定されました。
統計学的な設定は、gefitinib群に対するafatinib群の主要評価項目に関するハザード比に関して行われました。
目標患者数は、PFSに関するハザード比の95%信頼区間を目安に設定されました。
すなわち、250イベントを認めた段階で、ログスケールにおける95%信頼区間が0.75-1.25の範囲までに収まれば有意としました。
全ての統計量は両側検定でα=0.05を有意水準とし、多重性の調整は行いませんでした。
主要評価項目については、全てCox比例ハザードモデルとログランク検定で解析しました。
・・・ここまで見ても、結局本試験が目指すものは何なのか、よく分かりませんでした。
患者数設定の部分を見ると、「gefitinib群に対する、afatinib群の非劣性を証明する」のが目標のように見えます。
それにしては、それぞれ160人規模となると、ちょっとパワー不足のように感じます。
また、本臨床試験は「phase IIb」試験と位置づけられていますが、これもよく分かりません。
ネットで調べてみると・・・Spilker, Bert. Guide to Clinical Trials, Raven Press, 1984. Page XXii-Xxiii.
「phase IIb試験:治療・診断・予防を必要とする疾患もしくは状態の患者を対象に、効果(と安全性)を評価することを目的とした臨床試験。一般にこれらの臨床試験は、薬効評価としては最も厳密なものである。pivotal trialと称されることもある」
とのことですが・・・、要は「第II相試験の中でも、薬効そのものの評価としては最終段階のものであり、ときにはこの結果を以て第III相試験の結果に替える」くらいのニュアンスなんでしょうね。
ランダム化第II相試験の結果を以て第III相試験と同等に考える、といったことがしばしばまかり通りますが、今回のLUX-Lung 7試験はランダム化第IIb相試験であり、一般の第II相試験に比べるとより第III相試験を意識した、裏を返せば本試験の結果を第III相試験結果と同等に扱い、後には同様の第III相試験は計画しない、という意図があるのだと思います。
参加したのはカナダ、フランス、ドイツ、アイルランド、ノルウェー、スペイン、スウェーデン、イギリス、オーストラリア、中国、韓国、台湾、シンガポールの13か国、64施設で治療を受けた患者さんです。
2011年12月から2013年8月まで患者登録が行われ、PFSの観察期間中央値は27.3ヶ月でした。
患者背景は次図の通りです。

非アジア人が半数程度、Ex.19欠失変異が全体の60%程度を占めています。
主要評価項目のひとつであるPFSのデータです。

生存曲線が示せないのでニュアンスを伝えにくいのですが、ランダム化から1年まではほぼ生存曲線は重なっており、それ以後に末広がりで差が開いていきます。
したがって、生存期間中央値にはわずか3日間の差しかありませんが、18ヶ月、24か月と追跡するごとに差が開きます。
統計学的には、PFSについては明らかに有意差を以てafatinibが優れています。
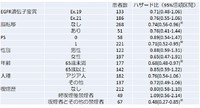
PFSに関するサブグループ解析の結果です。
おしなべてAfatinib群で良好な傾向にありますが、※のついた「脳転移がない」「PS1」「65歳未満」「喫煙者とその他の禁煙者」ではAfatinib群で有意にPFSがよかったようです。
続いて、TTFのデータです。

これも有意にAfatinibが優れており、生存曲線は一貫してAfatinib群が上を行っていました。

こちらはEx.19、Ex.21別のPFSおよび奏効割合の解析です。
有意差はついていないものの、こちらも生存曲線は12ヶ月以降で末広がりとなる傾向にあったようです。
奏効割合はafatinibの方が優れています。

続いて、有害事象に関するまとめです。
投与量減量を要した有害事象はAfatinib群で多かったようですが、その他はあまり違いはないようです。
重篤な有害事象については、薬剤性肺障害はAfatinibでは皆無、Gefitinibでは件数は不明ですが確認されているようです。
また、Gefitinib群では、肝不全での死亡例が1件あるようです。

薬剤関連有害事象のうち、10%以上で認められたもののまとめです。
脱毛や肝障害を除いては、おしなべてAfatinib群の方が高率に認められるようです。
・・・といった感じなのですが、PFSについてはこの規模の臨床試験で有意差が確認された以上、GefitinibよりもAfatinibが勝ると考えて間違いなさそうです。
とりわけ、サブグループ解析結果ではあるものの、「脳転移がない」「PS1」「65歳未満」「喫煙者とその他の禁煙者」でAfatinib群が有意にPFSで優れていた事実は、患者選択をする上でEx.19変異の有無以外に有益な情報のように思えます。
問題は、その差が治療開始後1年を超えてから見え始めることで、いかに有害事象をコントロールしながら内服を継続するか、というのが実地臨床上のテーマのように思います。
さらには、全体の30-50%程度を占めると予想されるT790M二次耐性の患者に対する第3世代EGFR阻害薬の治療までセットで考えると、あるいはもっと先を見越して、第3世代EGFR阻害薬が1st lineで使えるようになると、自ずと治療戦略が変わってきそうです。
対象となった患者さんは
・IIIB期 / IV期の原発性肺腺癌
・EGFR遺伝子変異(Ex.19 / Ex.21のいずれか、あるいは両方)を有する
・過去に進行肺癌に対する治療歴がない
・Performance Status 0 / 1
で、Ex.19とEx.21のいずれか、脳転移があるかないかの2点を割付調整因子としてafatinib群とgefitinib群に等しく割り付けられました。
主要評価項目は3点、無増悪生存期間(PFS)と治療成功期間:無作為化から増悪、治療毒性および死亡を含む全ての原因による治療中止までの時間(TTF)、全生存期間(OS)でした。病勢増悪後も、担当医判断で治療を継続してもよいとされ、効果判定は4週目、8週目、それ以後は64週までは8週間ごと、それ以後は12週ごとと規定されました。
統計学的な設定は、gefitinib群に対するafatinib群の主要評価項目に関するハザード比に関して行われました。
目標患者数は、PFSに関するハザード比の95%信頼区間を目安に設定されました。
すなわち、250イベントを認めた段階で、ログスケールにおける95%信頼区間が0.75-1.25の範囲までに収まれば有意としました。
全ての統計量は両側検定でα=0.05を有意水準とし、多重性の調整は行いませんでした。
主要評価項目については、全てCox比例ハザードモデルとログランク検定で解析しました。
・・・ここまで見ても、結局本試験が目指すものは何なのか、よく分かりませんでした。
患者数設定の部分を見ると、「gefitinib群に対する、afatinib群の非劣性を証明する」のが目標のように見えます。
それにしては、それぞれ160人規模となると、ちょっとパワー不足のように感じます。
また、本臨床試験は「phase IIb」試験と位置づけられていますが、これもよく分かりません。
ネットで調べてみると・・・Spilker, Bert. Guide to Clinical Trials, Raven Press, 1984. Page XXii-Xxiii.
「phase IIb試験:治療・診断・予防を必要とする疾患もしくは状態の患者を対象に、効果(と安全性)を評価することを目的とした臨床試験。一般にこれらの臨床試験は、薬効評価としては最も厳密なものである。pivotal trialと称されることもある」
とのことですが・・・、要は「第II相試験の中でも、薬効そのものの評価としては最終段階のものであり、ときにはこの結果を以て第III相試験の結果に替える」くらいのニュアンスなんでしょうね。
ランダム化第II相試験の結果を以て第III相試験と同等に考える、といったことがしばしばまかり通りますが、今回のLUX-Lung 7試験はランダム化第IIb相試験であり、一般の第II相試験に比べるとより第III相試験を意識した、裏を返せば本試験の結果を第III相試験結果と同等に扱い、後には同様の第III相試験は計画しない、という意図があるのだと思います。
参加したのはカナダ、フランス、ドイツ、アイルランド、ノルウェー、スペイン、スウェーデン、イギリス、オーストラリア、中国、韓国、台湾、シンガポールの13か国、64施設で治療を受けた患者さんです。
2011年12月から2013年8月まで患者登録が行われ、PFSの観察期間中央値は27.3ヶ月でした。
患者背景は次図の通りです。

非アジア人が半数程度、Ex.19欠失変異が全体の60%程度を占めています。
主要評価項目のひとつであるPFSのデータです。

生存曲線が示せないのでニュアンスを伝えにくいのですが、ランダム化から1年まではほぼ生存曲線は重なっており、それ以後に末広がりで差が開いていきます。
したがって、生存期間中央値にはわずか3日間の差しかありませんが、18ヶ月、24か月と追跡するごとに差が開きます。
統計学的には、PFSについては明らかに有意差を以てafatinibが優れています。

PFSに関するサブグループ解析の結果です。
おしなべてAfatinib群で良好な傾向にありますが、※のついた「脳転移がない」「PS1」「65歳未満」「喫煙者とその他の禁煙者」ではAfatinib群で有意にPFSがよかったようです。
続いて、TTFのデータです。

これも有意にAfatinibが優れており、生存曲線は一貫してAfatinib群が上を行っていました。

こちらはEx.19、Ex.21別のPFSおよび奏効割合の解析です。
有意差はついていないものの、こちらも生存曲線は12ヶ月以降で末広がりとなる傾向にあったようです。
奏効割合はafatinibの方が優れています。

続いて、有害事象に関するまとめです。
投与量減量を要した有害事象はAfatinib群で多かったようですが、その他はあまり違いはないようです。
重篤な有害事象については、薬剤性肺障害はAfatinibでは皆無、Gefitinibでは件数は不明ですが確認されているようです。
また、Gefitinib群では、肝不全での死亡例が1件あるようです。

薬剤関連有害事象のうち、10%以上で認められたもののまとめです。
脱毛や肝障害を除いては、おしなべてAfatinib群の方が高率に認められるようです。
・・・といった感じなのですが、PFSについてはこの規模の臨床試験で有意差が確認された以上、GefitinibよりもAfatinibが勝ると考えて間違いなさそうです。
とりわけ、サブグループ解析結果ではあるものの、「脳転移がない」「PS1」「65歳未満」「喫煙者とその他の禁煙者」でAfatinib群が有意にPFSで優れていた事実は、患者選択をする上でEx.19変異の有無以外に有益な情報のように思えます。
問題は、その差が治療開始後1年を超えてから見え始めることで、いかに有害事象をコントロールしながら内服を継続するか、というのが実地臨床上のテーマのように思います。
さらには、全体の30-50%程度を占めると予想されるT790M二次耐性の患者に対する第3世代EGFR阻害薬の治療までセットで考えると、あるいはもっと先を見越して、第3世代EGFR阻害薬が1st lineで使えるようになると、自ずと治療戦略が変わってきそうです。
2015年12月30日
再生検に関するweb講演会
去る2015年12月22日、インターネット上で非小細胞肺癌の再生検に関するweb講演会が行われました。
自分の復習を兼ねて、流れを見ていきます。

EGFR遺伝子変異陽性の非小細胞肺癌では、EGFR阻害薬が無増悪生存期間を有意に延長することは周知の事実で、主たる変異形式であるEx.19, Ex.21のいずれにおいても同じように効果が認められています。

一方、EGFR阻害薬治療開始後、ほぼ例外なく全ての患者さんが病勢進行に至りますが、その際に認められる耐性機序はさまざまで、中でもEx.20 T790Mが半数程度を占めるとされています。これらをいかにして検出し、次の治療につなげるかが課題です。

T790M変異をターゲットにした第3世代EGFR阻害薬が2016年前半に上市される見通しですが、遺伝子変異検出のための検査キットは様々あり、コンパニオン診断キットとして認可されているものとそうでないものがあります。EGFR遺伝子変異検査が日本で保険適応となった際には検査と治療薬の関係は切り離して考えられていましたが、最近は特定のコンパニオン診断キットを用いなければ治療薬が使えない、といった問題が生じています。第3世代EGFR阻害薬においては、Cobas法Ver.2がコンパニオン診断キットとして同時承認されると目されていますが、Cobas法においては細胞診検体は適応外であり、本来は薬の恩恵が期待できる患者さんに薬が使えないのではないかとの不安が現場の医師の間で持ち上がっています。

市立岸和田市民病院では、第3世代EGFR阻害薬の治験開始、ALK検査、PD-L1免疫染色の必要性とともに、再生検施行数が増加しました。

対象とした期間中に51件の再生検があり、うち31件はEGFR遺伝子変異陽性肺癌に対する再生検でした。全例において組織診断可能と判断され、27件で気管支鏡検査が行われました。全体のうち6例で組織診が陰性で、この方々では第3世代EGFR阻害薬使用の道は閉ざされた、ということになります。

患者背景をみると、ほとんどがPS 0-1の患者さんで、前例が腺癌、半数以上が三次治療以降のタイミングで再生検されており、再生検の対象となった部位はほとんど(94%)が肺病巣だったようです。

大部分(25人、80.6%)がラジアル型超音波プローブ/ガイドシース併用の経気管支肺生検(EBUS-GS)で再生検されています。
そのうち、組織採取までこぎ着けたのが19人ですから、EBUS-GSを施行した中で組織採取できたのは76%です。
全体を見ると、気管支鏡検査とCTガイド下針生検でほとんどをカバーしています。

再生検による肺癌組織診断率は88.9%、遺伝子変異検査可能率は83.3%、T790M陽性率は33.3%とのこと。
一次治療後に比べると二次治療後、三次治療後の方がT790M陽性率が高いように見えますが、患者数が少ないので何とも言えません。
再生検時には出血リスクが高い、など取り沙汰されることがありますが、安全性の面では問題なかったようです。

再生検部位の選択について、PETの有用性。
このスライドでは右肺中葉と左肺舌区に大きな病巣を認めますが、PETで集積が目立つのは右肺中葉の病巣のみです。
こうした場合は、PETの集積が強い=病勢が強い病巣を選択して生検するべきだとのことでした。

続いては、静岡県立静岡がんセンターから。
今回調査対象となったのは、2014年1月以降に静岡がんセンターでEGFR阻害薬投与後に病勢進行を認めたEGFR遺伝子変異陽性の非小細胞肺癌患者さん120人です。

再生検を行ったのが65人、再生検を行わなかったのが55人で、それぞれの背景に有意な差はありません。
Ex.19変異の割合が前者では61.5%、後者では58.1%と、いずれもEx.19変異患者さんがやや多いようです。

病勢進行を認めてから、遺伝子変異再検査に至るまでのフローチャートです。
再生検を行った65人のうち、病理学的に悪性所見が確認されたのが62人(95.4%)というのは素晴らしい検査成績です。
一方、遺伝子変異再検査までこぎつけたのは53人(81.5%)であり、病理診断ができた数との間に無視できないギャップがあります。

再生検ができなかった理由として目立つのが、PS不良と脳転移巣、担当医判断です。
PS不良は、臨床試験参加が前提で再生検が行われたことを考慮するとやむを得ませんが、実地臨床で第3世代EGFR阻害薬が使えるようになったときには、どの程度のPSの患者さんまで再生検を行うか、的確な判断が要求されるでしょうね。
担当医判断は詳細不明なためコメントしません。
脳転移巣単独の再発は厄介な問題です。
EGFR阻害薬での治療時には、脳転移単独による病勢進行はしばしば経験しますし、だからといって脳転移病巣の生検や外科的摘出は、定位脳放射線照射治療(ガンマナイフ、サイバーナイフ)が一般的になった現在では、ほとんど行われることがありません。


私自身も、何らかの形で再生検が行われた患者さんを調査しました。
約65%は気管支鏡検査、胸水穿刺など呼吸器内科医自身が行うべき手技でした。
一方で、脳転移に対して生検もしくは手術で病理学的診断を行ったのはわずか1人でした。
流石に、T790Mの発現状態を確認するだけのために脳転移巣の生検や外科手術を行うのは、患者さんの身体的負担が大きすぎるように思います。

こちらのスライドを見ると、静岡がんセンターでも72%は胸水穿刺もしくは気管支鏡検査で対応されているようです。

再生検によって、EGFR遺伝子変異検査ができた中では、37.7%においてT790M変異が確認されたようです。
全国調査や岸和田市民病院の報告と合わせると、もともとEGFR遺伝子変異があった患者さんにおいて、再生検でT790Mが認められる割合は、概ね35-50%の範囲内と見てよさそうですね。

このスライドを見るとつくづく立派だなあ、と思うのですが、静岡がんセンターにおける肺癌気管支鏡診断率は、これを見る限り、安定して90%近いようです。
自分の復習を兼ねて、流れを見ていきます。

EGFR遺伝子変異陽性の非小細胞肺癌では、EGFR阻害薬が無増悪生存期間を有意に延長することは周知の事実で、主たる変異形式であるEx.19, Ex.21のいずれにおいても同じように効果が認められています。

一方、EGFR阻害薬治療開始後、ほぼ例外なく全ての患者さんが病勢進行に至りますが、その際に認められる耐性機序はさまざまで、中でもEx.20 T790Mが半数程度を占めるとされています。これらをいかにして検出し、次の治療につなげるかが課題です。

T790M変異をターゲットにした第3世代EGFR阻害薬が2016年前半に上市される見通しですが、遺伝子変異検出のための検査キットは様々あり、コンパニオン診断キットとして認可されているものとそうでないものがあります。EGFR遺伝子変異検査が日本で保険適応となった際には検査と治療薬の関係は切り離して考えられていましたが、最近は特定のコンパニオン診断キットを用いなければ治療薬が使えない、といった問題が生じています。第3世代EGFR阻害薬においては、Cobas法Ver.2がコンパニオン診断キットとして同時承認されると目されていますが、Cobas法においては細胞診検体は適応外であり、本来は薬の恩恵が期待できる患者さんに薬が使えないのではないかとの不安が現場の医師の間で持ち上がっています。

市立岸和田市民病院では、第3世代EGFR阻害薬の治験開始、ALK検査、PD-L1免疫染色の必要性とともに、再生検施行数が増加しました。

対象とした期間中に51件の再生検があり、うち31件はEGFR遺伝子変異陽性肺癌に対する再生検でした。全例において組織診断可能と判断され、27件で気管支鏡検査が行われました。全体のうち6例で組織診が陰性で、この方々では第3世代EGFR阻害薬使用の道は閉ざされた、ということになります。

患者背景をみると、ほとんどがPS 0-1の患者さんで、前例が腺癌、半数以上が三次治療以降のタイミングで再生検されており、再生検の対象となった部位はほとんど(94%)が肺病巣だったようです。

大部分(25人、80.6%)がラジアル型超音波プローブ/ガイドシース併用の経気管支肺生検(EBUS-GS)で再生検されています。
そのうち、組織採取までこぎ着けたのが19人ですから、EBUS-GSを施行した中で組織採取できたのは76%です。
全体を見ると、気管支鏡検査とCTガイド下針生検でほとんどをカバーしています。

再生検による肺癌組織診断率は88.9%、遺伝子変異検査可能率は83.3%、T790M陽性率は33.3%とのこと。
一次治療後に比べると二次治療後、三次治療後の方がT790M陽性率が高いように見えますが、患者数が少ないので何とも言えません。
再生検時には出血リスクが高い、など取り沙汰されることがありますが、安全性の面では問題なかったようです。

再生検部位の選択について、PETの有用性。
このスライドでは右肺中葉と左肺舌区に大きな病巣を認めますが、PETで集積が目立つのは右肺中葉の病巣のみです。
こうした場合は、PETの集積が強い=病勢が強い病巣を選択して生検するべきだとのことでした。

続いては、静岡県立静岡がんセンターから。
今回調査対象となったのは、2014年1月以降に静岡がんセンターでEGFR阻害薬投与後に病勢進行を認めたEGFR遺伝子変異陽性の非小細胞肺癌患者さん120人です。

再生検を行ったのが65人、再生検を行わなかったのが55人で、それぞれの背景に有意な差はありません。
Ex.19変異の割合が前者では61.5%、後者では58.1%と、いずれもEx.19変異患者さんがやや多いようです。

病勢進行を認めてから、遺伝子変異再検査に至るまでのフローチャートです。
再生検を行った65人のうち、病理学的に悪性所見が確認されたのが62人(95.4%)というのは素晴らしい検査成績です。
一方、遺伝子変異再検査までこぎつけたのは53人(81.5%)であり、病理診断ができた数との間に無視できないギャップがあります。

再生検ができなかった理由として目立つのが、PS不良と脳転移巣、担当医判断です。
PS不良は、臨床試験参加が前提で再生検が行われたことを考慮するとやむを得ませんが、実地臨床で第3世代EGFR阻害薬が使えるようになったときには、どの程度のPSの患者さんまで再生検を行うか、的確な判断が要求されるでしょうね。
担当医判断は詳細不明なためコメントしません。
脳転移巣単独の再発は厄介な問題です。
EGFR阻害薬での治療時には、脳転移単独による病勢進行はしばしば経験しますし、だからといって脳転移病巣の生検や外科的摘出は、定位脳放射線照射治療(ガンマナイフ、サイバーナイフ)が一般的になった現在では、ほとんど行われることがありません。


私自身も、何らかの形で再生検が行われた患者さんを調査しました。
約65%は気管支鏡検査、胸水穿刺など呼吸器内科医自身が行うべき手技でした。
一方で、脳転移に対して生検もしくは手術で病理学的診断を行ったのはわずか1人でした。
流石に、T790Mの発現状態を確認するだけのために脳転移巣の生検や外科手術を行うのは、患者さんの身体的負担が大きすぎるように思います。

こちらのスライドを見ると、静岡がんセンターでも72%は胸水穿刺もしくは気管支鏡検査で対応されているようです。

再生検によって、EGFR遺伝子変異検査ができた中では、37.7%においてT790M変異が確認されたようです。
全国調査や岸和田市民病院の報告と合わせると、もともとEGFR遺伝子変異があった患者さんにおいて、再生検でT790Mが認められる割合は、概ね35-50%の範囲内と見てよさそうですね。

このスライドを見るとつくづく立派だなあ、と思うのですが、静岡がんセンターにおける肺癌気管支鏡診断率は、これを見る限り、安定して90%近いようです。
2015年12月30日
ニボルマブ(オプジーボ)と患者さん用スターターキット



ニボルマブが非小細胞肺癌に適応拡大されて少し経ちましたが、日本国内では実地臨床としてすでに30数件で投与が開始されたそうです。
病院で使用するにあたり、いろいろな準備が科されています。
製薬会社と病院の契約に始まり、ホームページ上での登録作業等々、全体の手続きを終えるのに1ヶ月弱かかるということで、年明け早々にどんどん使用患者さんが増える、ということにはならなさそうです。
医師用に分厚いパンフレットや適正使用ガイドが作成され、患者さん用には上記写真のようなスターターキットが準備され、ニボルマブによる治療の概要、免疫療法のイロハ、治療中に注意すべき症状、さらには高額療養費制度の利用手続きについてまで取り扱われています。
2015年12月18日
再生検全国調査
2015年日本肺癌学会総会のトピックスのひとつに、このテーマがありました。
全国30施設で行われたEGFR遺伝子二次変異検索目的の再生検に関するレトロスペクティブ観察研究です。
レトロスペクティブとはいいながら、これだけの規模で再生検に関して検討されたのは、国内では前例がないと思います。
ポスター発表で、見落とした参加者もいるかもしれませんので、個人的な見解も追加してまとめておきます。
<非小細胞肺癌患者に対するRe-Biopsyの実態調査>
目的:2013年時点ですでにre-biopsy(再生検)の経験のある医療機関における、進行非小細胞肺癌患者を対象としたre-biopsyの実施実態を調査することを目的とし、多施設共同のレトロスペクティブ調査を実施した。
方法:
・国内多施設共同、レトロスペクティブ観察研究
・調査対象
- 20歳以上の患者、上限なし
- 組織診または細胞診により、EGFR遺伝子変異陽性の非小細胞肺癌と診断された患者
- EGFRチロシンキナーゼ阻害薬により治療歴があり、病勢進行が確認された患者
- 2013年以降に再生検を実施された患者(ただし、胸水を用いた再生検を行った症例は除く)
・主要評価項目
再生検の成功率(がん細胞が採取できた症例数 / 再生検実施症例数)
・副次的評価項目
初回生検実施時と再生検実施時の各種比較検討
結果:
・主要評価項目
-対象となった症例は401例
-除外症例6例
-初回再生検成功例314例
-初回再生検非成功例81例
-2回目再生検非施行例49例
-2回目再生検施行例32例
-2回目再生検成功例25例
-3回目再生検非施行例4例
-3回目再生検施行例3例
-3回目再生検成功例3例
→主要評価項目である再生検の成功率は79.5%(314/395例)だった
・患者背景

扁平上皮癌の1%強にEGFR遺伝子変異が見られること、Gefitinibが初回投与されている方が多いことは納得いきますが、Del.19がL858Rよりも多いのは実感とは異なります。
・初回生検実施時の生検部位の内訳

初回生検実施時の生検部位は原発巣からが70%を超えます。
リンパ節が7%程度というのは、EBUS-TBNAが普及した現況ではもっと多いかも知れません。
小細胞癌が含まれるようになると、EBUS-TBNAの比率がさらに増えるでしょうね。
・再生検実施時の生検部位の内訳

再生検実施時には、原発巣からの生検が50%強まで減少し、その分転移巣、リンパ節からの生検が増えます。
いったん縮小した原発巣からの再生検は難しいのかも知れません。
また、その他が多くなっています。
個人的な見解ですが、今回の検討は「再生検時に胸水を利用した症例は除く」とされているので、初回生検時には少なからず胸水から診断がついた患者がいるのではないかと想像しています。
・初回(確定)診断時に認められた転移巣の内訳

学生講義をするときには、
「肺癌の転移好発部位は、脳・肝・骨・副腎・肺内他部位だよ」
と教えていますが、概ねその通りになっています。
胸膜を転移巣に含めるかどうかは難しいところですが、これをみても初回診断時に胸水が利用されている可能性が高そうです。
・再生検実施時に認められた転移巣の内訳

この結果を見て驚くのは、「肺内転移」が実に半数を占めることです。
肺内他部位への転移、実感としては遺伝子変異陰性の患者さんではここまで多くないような気がします。
また、胸膜病変が約20%ですから、これら両者で70%を占めます。
「再生検の際には様々な診療科との連携により、どの臓器転移からでも診断がつけられる体制を敷かなければならない」
とは最近よく言われることですが、実際には呼吸器内科医・外科医が診断すべき患者さんが70%を占めるということです。
一方、脳の単発転移、という患者さんが実際にはもっと多いような気がします。
これも、脳単発転移の患者さんは、そもそも本検討には含まれていない(主治医が登録しない)と考えるべきでしょうね。
このところ、脳転移の患者さんに対して外科的切除を行ったケースはほとんど記憶にありません。
この7年間で2例くらい記憶にありますが、いずれも未確診の状態で脳外科手術が行われ、小細胞癌が認められたために呼吸器内科に紹介されたケースでした。
余談になりますが、AZD9291=Osimertinibは脳転移抑制効果が高いかも知れない、という話を聞きました。
ある臨床試験では、Osimertinib投与後に脳転移再燃で病勢進行と判定された患者さんが、全体の1%強しかいなかったとのことです。
・生検時検体採取方法の内訳

これは明らかに海外の報告と異なるデータです。
海外(米国)の論文を見てみると、少なくとも再生検時には、気管支鏡で診断したなんてことは一言も書いていません。
ほとんどが穿刺生検や外科的生検、液性検体です。
・生検時合併症の内訳

再生検時には合併症のリスクが高まるようです。
気胸と出血性合併症が多いようですね。
・初回生検実施時と再生検時のEGFR遺伝子変異検査結果の詳細


Del.19だろうが、L858Rだろうが、概ね半数くらいはT790M陽性となるとみていいようです。
・その他の遺伝子変異検索状況

個人的に注目したいのは、ALK陽性が併せて見つかるケースがあることです。
検索した67人中2人、たかだか3%ですが、これは腺癌全体を対象にした場合のALK陽性割合と遜色ありません。
同様の結果を、2015年の日本呼吸器内視鏡学会総会で、国立がんセンター中央病院の桐田先生が報告されています(4%)。
→http://oitahaiganpractice.junglekouen.com/e803659.html
一方、LC-SCRUM Japanでは、より高精度に希少なドライバー遺伝子変異を検出するため、EGFR遺伝子変異陰性が確認された非小細胞・非扁平上皮肺癌患者さんに対してRET,ROS1,ALKのスクリーニングが行われていますが、その場合にもALKの陽性割合は2%程度です。
よく「driver mutationは相互排他的である=併存することはない」と言われますが、ことEGFRとALKに関する限りは、EGFR遺伝子変異の有無はALK再構成の有無には直接関係しないのではないかと思います。
・EGFRチロシンキナーゼ阻害薬治療歴別のEGFR遺伝子変異結果

T790M陽性肺癌が比較的進行が緩やかで、第3世代EGFR-TKIの効果が期待できること、第3世代EGFR-TKI体制となった場合にも、C797S三次変異が認められた場合には第1世代EGFR-TKIの再投与効果が期待できることから、「いかにしてT790M遺伝子変異を初回治療後に誘導するか」なんて治療戦略も語られ始めています。
ここに示されている結果はそういった意味では興味深く、他のEGFR-TKIに比べるとgefitnib治療後にT790M変異が出現する確率が高そうなことがわかります。
別に特定の製薬会社の肩を持つわけではありませんが、gefitinibとosimertinibを交互に使う、もしくは最初から合剤で使うといった治療戦略も今後検討されることでしょうね。
・先行する治療別のEGFR遺伝子変異結果

これも、現在進行中の臨床試験を踏まえると、少し考えたくなる結果です。
T790Mの陽性割合を見ると、EGFR-TKI単独治療>化学療法>EGFR-TKIと化学療法の併用、の順になっています。
EGFR-TKIと化学療法を同時併用すると、病勢進行した後の治療として、第3世代EGFR-TKIの効果が薄まるかも知れない、ということです。
・・・という感じで、レトロスペクティブな検討で、今回はポスター発表だったのですが、今後の治療戦略を考える上でとても重要な報告だったと思います。
全国30施設で行われたEGFR遺伝子二次変異検索目的の再生検に関するレトロスペクティブ観察研究です。
レトロスペクティブとはいいながら、これだけの規模で再生検に関して検討されたのは、国内では前例がないと思います。
ポスター発表で、見落とした参加者もいるかもしれませんので、個人的な見解も追加してまとめておきます。
<非小細胞肺癌患者に対するRe-Biopsyの実態調査>
目的:2013年時点ですでにre-biopsy(再生検)の経験のある医療機関における、進行非小細胞肺癌患者を対象としたre-biopsyの実施実態を調査することを目的とし、多施設共同のレトロスペクティブ調査を実施した。
方法:
・国内多施設共同、レトロスペクティブ観察研究
・調査対象
- 20歳以上の患者、上限なし
- 組織診または細胞診により、EGFR遺伝子変異陽性の非小細胞肺癌と診断された患者
- EGFRチロシンキナーゼ阻害薬により治療歴があり、病勢進行が確認された患者
- 2013年以降に再生検を実施された患者(ただし、胸水を用いた再生検を行った症例は除く)
・主要評価項目
再生検の成功率(がん細胞が採取できた症例数 / 再生検実施症例数)
・副次的評価項目
初回生検実施時と再生検実施時の各種比較検討
結果:
・主要評価項目
-対象となった症例は401例
-除外症例6例
-初回再生検成功例314例
-初回再生検非成功例81例
-2回目再生検非施行例49例
-2回目再生検施行例32例
-2回目再生検成功例25例
-3回目再生検非施行例4例
-3回目再生検施行例3例
-3回目再生検成功例3例
→主要評価項目である再生検の成功率は79.5%(314/395例)だった
・患者背景

扁平上皮癌の1%強にEGFR遺伝子変異が見られること、Gefitinibが初回投与されている方が多いことは納得いきますが、Del.19がL858Rよりも多いのは実感とは異なります。
・初回生検実施時の生検部位の内訳

初回生検実施時の生検部位は原発巣からが70%を超えます。
リンパ節が7%程度というのは、EBUS-TBNAが普及した現況ではもっと多いかも知れません。
小細胞癌が含まれるようになると、EBUS-TBNAの比率がさらに増えるでしょうね。
・再生検実施時の生検部位の内訳

再生検実施時には、原発巣からの生検が50%強まで減少し、その分転移巣、リンパ節からの生検が増えます。
いったん縮小した原発巣からの再生検は難しいのかも知れません。
また、その他が多くなっています。
個人的な見解ですが、今回の検討は「再生検時に胸水を利用した症例は除く」とされているので、初回生検時には少なからず胸水から診断がついた患者がいるのではないかと想像しています。
・初回(確定)診断時に認められた転移巣の内訳

学生講義をするときには、
「肺癌の転移好発部位は、脳・肝・骨・副腎・肺内他部位だよ」
と教えていますが、概ねその通りになっています。
胸膜を転移巣に含めるかどうかは難しいところですが、これをみても初回診断時に胸水が利用されている可能性が高そうです。
・再生検実施時に認められた転移巣の内訳

この結果を見て驚くのは、「肺内転移」が実に半数を占めることです。
肺内他部位への転移、実感としては遺伝子変異陰性の患者さんではここまで多くないような気がします。
また、胸膜病変が約20%ですから、これら両者で70%を占めます。
「再生検の際には様々な診療科との連携により、どの臓器転移からでも診断がつけられる体制を敷かなければならない」
とは最近よく言われることですが、実際には呼吸器内科医・外科医が診断すべき患者さんが70%を占めるということです。
一方、脳の単発転移、という患者さんが実際にはもっと多いような気がします。
これも、脳単発転移の患者さんは、そもそも本検討には含まれていない(主治医が登録しない)と考えるべきでしょうね。
このところ、脳転移の患者さんに対して外科的切除を行ったケースはほとんど記憶にありません。
この7年間で2例くらい記憶にありますが、いずれも未確診の状態で脳外科手術が行われ、小細胞癌が認められたために呼吸器内科に紹介されたケースでした。
余談になりますが、AZD9291=Osimertinibは脳転移抑制効果が高いかも知れない、という話を聞きました。
ある臨床試験では、Osimertinib投与後に脳転移再燃で病勢進行と判定された患者さんが、全体の1%強しかいなかったとのことです。
・生検時検体採取方法の内訳

これは明らかに海外の報告と異なるデータです。
海外(米国)の論文を見てみると、少なくとも再生検時には、気管支鏡で診断したなんてことは一言も書いていません。
ほとんどが穿刺生検や外科的生検、液性検体です。
・生検時合併症の内訳

再生検時には合併症のリスクが高まるようです。
気胸と出血性合併症が多いようですね。
・初回生検実施時と再生検時のEGFR遺伝子変異検査結果の詳細


Del.19だろうが、L858Rだろうが、概ね半数くらいはT790M陽性となるとみていいようです。
・その他の遺伝子変異検索状況

個人的に注目したいのは、ALK陽性が併せて見つかるケースがあることです。
検索した67人中2人、たかだか3%ですが、これは腺癌全体を対象にした場合のALK陽性割合と遜色ありません。
同様の結果を、2015年の日本呼吸器内視鏡学会総会で、国立がんセンター中央病院の桐田先生が報告されています(4%)。
→http://oitahaiganpractice.junglekouen.com/e803659.html
一方、LC-SCRUM Japanでは、より高精度に希少なドライバー遺伝子変異を検出するため、EGFR遺伝子変異陰性が確認された非小細胞・非扁平上皮肺癌患者さんに対してRET,ROS1,ALKのスクリーニングが行われていますが、その場合にもALKの陽性割合は2%程度です。
よく「driver mutationは相互排他的である=併存することはない」と言われますが、ことEGFRとALKに関する限りは、EGFR遺伝子変異の有無はALK再構成の有無には直接関係しないのではないかと思います。
・EGFRチロシンキナーゼ阻害薬治療歴別のEGFR遺伝子変異結果

T790M陽性肺癌が比較的進行が緩やかで、第3世代EGFR-TKIの効果が期待できること、第3世代EGFR-TKI体制となった場合にも、C797S三次変異が認められた場合には第1世代EGFR-TKIの再投与効果が期待できることから、「いかにしてT790M遺伝子変異を初回治療後に誘導するか」なんて治療戦略も語られ始めています。
ここに示されている結果はそういった意味では興味深く、他のEGFR-TKIに比べるとgefitnib治療後にT790M変異が出現する確率が高そうなことがわかります。
別に特定の製薬会社の肩を持つわけではありませんが、gefitinibとosimertinibを交互に使う、もしくは最初から合剤で使うといった治療戦略も今後検討されることでしょうね。
・先行する治療別のEGFR遺伝子変異結果

これも、現在進行中の臨床試験を踏まえると、少し考えたくなる結果です。
T790Mの陽性割合を見ると、EGFR-TKI単独治療>化学療法>EGFR-TKIと化学療法の併用、の順になっています。
EGFR-TKIと化学療法を同時併用すると、病勢進行した後の治療として、第3世代EGFR-TKIの効果が薄まるかも知れない、ということです。
・・・という感じで、レトロスペクティブな検討で、今回はポスター発表だったのですが、今後の治療戦略を考える上でとても重要な報告だったと思います。
2015年12月18日
ニボルマブ、適応追加!
2015年12月17日午後3時、いよいよニボルマブの非小細胞肺癌適応追加が承認されました。
これで大っぴらに投与可能になります。
まずは副作用対策に、様々な診療科の医師が関わることになりそうです。
個人的に危惧しているのは、悪性腫瘍の治療に携わらなくなった医師が、果たして有害事象管理の依頼を受けたときに適切に対応できるかということです。
うまく機能しますように。
これで大っぴらに投与可能になります。
まずは副作用対策に、様々な診療科の医師が関わることになりそうです。
個人的に危惧しているのは、悪性腫瘍の治療に携わらなくなった医師が、果たして有害事象管理の依頼を受けたときに適切に対応できるかということです。
うまく機能しますように。
2015年12月15日
ニボルマブ、あと少し・・・。
今年の欧州臨床腫瘍学会で、扁平上皮癌と非小細胞・非扁平上皮癌に対するニボルマブの国内第II相臨床試験の結果が報告されており、その概要が伝わってきました。
ざっと印象に残ったことを書き残すと・・・
・臨床試験のデザインは単アームの第II相試験で、主要評価項目は奏効割合
・対象となる患者は20歳以上、自己免疫疾患を合併していない、プラチナ併用化学療法の治療歴ありが必須、TKI使用歴は問わない
・3mg/kgの投与量で、2週間ごとに点滴投与
・明らかな病勢進行となるまでは使用継続可能
・患者の希望があれば、明らかな病勢進行後も担当医判断で継続を考慮
・主要評価項目の奏効割合は約20%程度
・観察期間内の病勢進行割合は50%強
・無増悪生存期間中央値は扁平上皮癌で約4ヶ月、非小細胞・非扁平上皮癌で約3ヶ月
・1年生存割合は扁平上皮癌で60%強、非小細胞・非扁平上皮癌で80%強
・Grade 3/4の有害事象の発現割合は扁平上皮癌で5%程度、非小細胞・非扁平上皮癌で20%程度
・間質性肺炎による死亡が1例あったが、ニボルマブ使用中止後にドセタキセルを使用してから間質性肺炎を発症している
・いわゆる「一過性の病勢進行後の奏効」に至った患者は、非小細胞・非扁平上皮癌の患者で1人認めたのみ
・効果が見られた患者は、その効果が長く続いている
といったところでしょうか。
無増悪生存期間がそれほど長くない割に、50%以上の参加者が1年生存を達成していることなど、やはり従来の殺細胞性抗腫瘍薬とは違った特徴を示しています。
また、今回勉強になったのは、少なくとも肺癌の領域では、国内外の臨床試験において「一過性の病勢進行後の奏効」に至る方がほんのわずかであったことです。
いわゆるRECIST-PDとなり、他に治療選択肢がある患者さんでは、速やかに他に切り替えた方がいいのかも知れません。
ただ、新規転移巣が出現しても、主病巣が縮小しているならば、投与を継続した方がいいだろうとのことでした。
あとはどのくらいまで治療可能施設の裾野を広げるか、ということですが、一旦重篤な有害事象が発生した場合には、甲状腺機能低下症、重症筋無力症、高度の炎症性腸疾患類似病変、間質性肺炎、I型糖尿病、ギランバレー症候群、急性腎不全、急性肝炎等々、多岐にわたる内科疾患への対応が必要となります。
そして、今更繰り返すまでもなく、非常に高価なお薬です。
2002年、イレッサが発売されて、不用意にあちこちで処方されて、多数の間質性肺炎患者さんが発生して訴訟や適応取り消しになった悲劇を繰り返さないためにも、適応追加から一定期間は使用可能施設や医師を制限した方が望ましいように感じました。
ざっと印象に残ったことを書き残すと・・・
・臨床試験のデザインは単アームの第II相試験で、主要評価項目は奏効割合
・対象となる患者は20歳以上、自己免疫疾患を合併していない、プラチナ併用化学療法の治療歴ありが必須、TKI使用歴は問わない
・3mg/kgの投与量で、2週間ごとに点滴投与
・明らかな病勢進行となるまでは使用継続可能
・患者の希望があれば、明らかな病勢進行後も担当医判断で継続を考慮
・主要評価項目の奏効割合は約20%程度
・観察期間内の病勢進行割合は50%強
・無増悪生存期間中央値は扁平上皮癌で約4ヶ月、非小細胞・非扁平上皮癌で約3ヶ月
・1年生存割合は扁平上皮癌で60%強、非小細胞・非扁平上皮癌で80%強
・Grade 3/4の有害事象の発現割合は扁平上皮癌で5%程度、非小細胞・非扁平上皮癌で20%程度
・間質性肺炎による死亡が1例あったが、ニボルマブ使用中止後にドセタキセルを使用してから間質性肺炎を発症している
・いわゆる「一過性の病勢進行後の奏効」に至った患者は、非小細胞・非扁平上皮癌の患者で1人認めたのみ
・効果が見られた患者は、その効果が長く続いている
といったところでしょうか。
無増悪生存期間がそれほど長くない割に、50%以上の参加者が1年生存を達成していることなど、やはり従来の殺細胞性抗腫瘍薬とは違った特徴を示しています。
また、今回勉強になったのは、少なくとも肺癌の領域では、国内外の臨床試験において「一過性の病勢進行後の奏効」に至る方がほんのわずかであったことです。
いわゆるRECIST-PDとなり、他に治療選択肢がある患者さんでは、速やかに他に切り替えた方がいいのかも知れません。
ただ、新規転移巣が出現しても、主病巣が縮小しているならば、投与を継続した方がいいだろうとのことでした。
あとはどのくらいまで治療可能施設の裾野を広げるか、ということですが、一旦重篤な有害事象が発生した場合には、甲状腺機能低下症、重症筋無力症、高度の炎症性腸疾患類似病変、間質性肺炎、I型糖尿病、ギランバレー症候群、急性腎不全、急性肝炎等々、多岐にわたる内科疾患への対応が必要となります。
そして、今更繰り返すまでもなく、非常に高価なお薬です。
2002年、イレッサが発売されて、不用意にあちこちで処方されて、多数の間質性肺炎患者さんが発生して訴訟や適応取り消しになった悲劇を繰り返さないためにも、適応追加から一定期間は使用可能施設や医師を制限した方が望ましいように感じました。
2015年12月01日
国内でも来ました!ニボルマブ!!
以下のリンクにあるように、いよいよニボルマブが、非小細胞肺癌でも使えるようになりました。
効果はお墨付きなのですが、単純に喜んでいいものか、国民医療費への負担を考えると、非常に複雑な心境です。
http://オンコロジー.com/news/151130k03
効果はお墨付きなのですが、単純に喜んでいいものか、国民医療費への負担を考えると、非常に複雑な心境です。
http://オンコロジー.com/news/151130k03
2015年12月01日
新しい肺癌のTNM病期分類(第8版)
肺癌の診療に用いられる分類にはいろいろなものがあります。
その中で代表的なものとして、TNM分類が挙がります。
一般には、「ステージ分類」「病期分類」と記した方がイメージしやすいでしょう。
T:腫瘍原発巣の部位と位置、N:所属リンパ節腫大の範囲、M:遠隔転移の三要素によって、癌の広がりを表現しようというものです。
ありとあらゆる悪性腫瘍で設定されていますが、卵巣腫瘍などのように一部例外もあります。
また、TNM分類が世界的に認知されているにもかかわらず、日本国内では独自の病期分類が用いられている腫瘍もあります。
そんな中、日本肺癌学会はほぼTNM分類に準拠して肺癌取り扱い規約を作成しています。
2017年1月1日より、このTNM分類が現行の第7版から第8版に改訂される予定です。
今回の学会では、特別企画として改訂メンバーの先生が可能な範囲で解説してくださいました。
概ね、以下のようなことを発言されていました。
・TNM分類の作成にはいろんな組織が関わっている。
・UICC-TNM分類とAJCC-TNM分類がよく知られていて、それぞれ別の出版物を作っているが、基本的に内容は同じものである。
・前回改訂は2010年だった。
・UICCはスイスに本部を置く世界的な組織だが、組織自体はこじんまりとしていて、臨床データはあまり持っていない
・AJCCはアメリカに本拠を置く組織で、TNM分類の決定権は持たないものの、各臓器別にタスク・フォースを抱えている。
・AJCCはタスクフォース内でTNM分類の素案を作成し、それをもとにUICCと協議する。
・AJCCのタスクフォースでは、IASLCから肺癌患者のデータ供与を受け、それを解析してTNM分類素案の根拠とする
・IASLCはデータベースも出すが、お金も拠出する
・日本肺癌学会は、IASLCに対してデータベースを拠出するとともに、staging comittee memberも送り込んでいる(=淺村先生ほか)
・IASLCが今回提出したデータベースには94708人の患者データが含まれるが、その内訳は北米:4660件、アジア:41705件、欧州:46560件、豪州:1593件となっており、アジアと欧州からのデータ拠出が多い。
・これでは、世界中の患者データが満遍なく組み込まれているとはいいがたく、特定地域のデータに偏っていると言わざるを得ない。
・日本肺癌学会は毎年UICCに100万円を拠出している。
・UICCとAJCCには、TNM分類に対する基本的な考え方の違いがある。
・UICCは解剖学的な病巣の分布に基づいてステージ分類を行おうとする。
・AJCCは生命予後に準じてステージ分類を行おうとする。
・N因子については我が国のデータと海外データにかなりの食い違いがあり、正直言って他国のリンパ節郭清がどのくらいしっかりされているのか、疑問である。
・米国では、N1とN2の間に予後の違いが出ない
・欧州においては、なぜかN0症例の予後が他の国より悪い
・次回改訂から、T因子は腫瘍長径1cmから5cmまで1cm刻み、5cmから7cmまではひとくくり、7cm以上はT3と扱われる。
・遠隔転移の取り扱いに関しては、M1aが現行通り、M1bは単一臓器への単発転移、M1cは単一臓器多発 / 多臓器多発と定義される予定。
その中で代表的なものとして、TNM分類が挙がります。
一般には、「ステージ分類」「病期分類」と記した方がイメージしやすいでしょう。
T:腫瘍原発巣の部位と位置、N:所属リンパ節腫大の範囲、M:遠隔転移の三要素によって、癌の広がりを表現しようというものです。
ありとあらゆる悪性腫瘍で設定されていますが、卵巣腫瘍などのように一部例外もあります。
また、TNM分類が世界的に認知されているにもかかわらず、日本国内では独自の病期分類が用いられている腫瘍もあります。
そんな中、日本肺癌学会はほぼTNM分類に準拠して肺癌取り扱い規約を作成しています。
2017年1月1日より、このTNM分類が現行の第7版から第8版に改訂される予定です。
今回の学会では、特別企画として改訂メンバーの先生が可能な範囲で解説してくださいました。
概ね、以下のようなことを発言されていました。
・TNM分類の作成にはいろんな組織が関わっている。
・UICC-TNM分類とAJCC-TNM分類がよく知られていて、それぞれ別の出版物を作っているが、基本的に内容は同じものである。
・前回改訂は2010年だった。
・UICCはスイスに本部を置く世界的な組織だが、組織自体はこじんまりとしていて、臨床データはあまり持っていない
・AJCCはアメリカに本拠を置く組織で、TNM分類の決定権は持たないものの、各臓器別にタスク・フォースを抱えている。
・AJCCはタスクフォース内でTNM分類の素案を作成し、それをもとにUICCと協議する。
・AJCCのタスクフォースでは、IASLCから肺癌患者のデータ供与を受け、それを解析してTNM分類素案の根拠とする
・IASLCはデータベースも出すが、お金も拠出する
・日本肺癌学会は、IASLCに対してデータベースを拠出するとともに、staging comittee memberも送り込んでいる(=淺村先生ほか)
・IASLCが今回提出したデータベースには94708人の患者データが含まれるが、その内訳は北米:4660件、アジア:41705件、欧州:46560件、豪州:1593件となっており、アジアと欧州からのデータ拠出が多い。
・これでは、世界中の患者データが満遍なく組み込まれているとはいいがたく、特定地域のデータに偏っていると言わざるを得ない。
・日本肺癌学会は毎年UICCに100万円を拠出している。
・UICCとAJCCには、TNM分類に対する基本的な考え方の違いがある。
・UICCは解剖学的な病巣の分布に基づいてステージ分類を行おうとする。
・AJCCは生命予後に準じてステージ分類を行おうとする。
・N因子については我が国のデータと海外データにかなりの食い違いがあり、正直言って他国のリンパ節郭清がどのくらいしっかりされているのか、疑問である。
・米国では、N1とN2の間に予後の違いが出ない
・欧州においては、なぜかN0症例の予後が他の国より悪い
・次回改訂から、T因子は腫瘍長径1cmから5cmまで1cm刻み、5cmから7cmまではひとくくり、7cm以上はT3と扱われる。
・遠隔転移の取り扱いに関しては、M1aが現行通り、M1bは単一臓器への単発転移、M1cは単一臓器多発 / 多臓器多発と定義される予定。



