2021年06月30日
今更ながら第III相AVAPERL試験のおさらい
今をときめく?IMpower150試験により有効性が確認されたABCP併用療法→AB併用維持療法。
ABCP、すなわちアテゾリズマブ+ベバシズマブ+カルボプラチン+パクリタキセル併用療法→アテゾリズマブ+ベバシズマブ併用維持療法。
http://oitahaiganpractice.junglekouen.com/e935130.html
http://oitahaiganpractice.junglekouen.com/e968054.html
ベースとなっているのはECOG4599レジメン、すなわちベバシズマブ+カルボプラチン+パクリタキセル併用療法→ベバシズマブ維持療法で、ABCP療法はそこにさらにアテゾリズマブを上乗せして、ベバシズマブ維持療法にもアテゾリズマブも上乗せしたら、もっと治療成績が良くなるんやなかろうかという発想だろう。
一方、シスプラチン+ペメトレキセド併用療法→ペメトレキセド維持療法の成功を踏まえて、ベバシズマブ+シスプラチン+ペメトレキセド併用療法→ベバシズマブ+ペメトレキセド併用維持療法の有効性と安全性を検証したAVAPERL試験。
ペメトレキセド維持療法の有効性が示されたのと同じ2011年に最初の報告が行われ、この年は肺がん診療の領域に(今となっては当たり前となった)維持療法という新しい治療概念が持ち込まれた、パラダイムシフトが起きた年だった。
改めて振り返ってみると、全生存期間は延長できなかったものの、ベバシズマブとペメトレキセドの両方を維持療法として使用するという時代をかなり先取りしたコンセプトだったように思う。
きちんと記事としてまとめておらず、検索に苦労したので、今回取り上げることにした。
・・・アテゾリズマブ+ベバシズマブ+カルボプラチン+ペメトレキセド併用療法後のアテゾリズマブ+ベバシズマブ+ペメトレキセド維持療法をやったらどうなるんだろう・・・。
・・・コストが高すぎて言い出せない・・・。
Maintenance bevacizumab-pemetrexed after first-line cisplatin-pemetrexed-bevacizumab for advanced nonsquamous nonsmall-cell lung cancer: updated survival analysis of the AVAPERL (MO22089) randomized phase III trial
F Barlesi et al., Ann Oncol. 2014 May;25(5):1044-52.
doi: 10.1093/annonc/mdu098. Epub 2014 Feb 27.
背景:
無作為化第III相AVAPERL試験は、非扁平上皮非小細胞肺がん患者におけるベバシズマブ+ペメトレキセド(BP)併用維持療法の安全性と有効性を検証するための試験である。無増悪生存期間はBP併用維持療法で有意に延長したが、全生存期間解析についてはデータが未成熟のままとなっていた。今回は本試験の生存解析に関する最新データを取り扱う。
対象患者と方法:
進行非扁平上皮非小細胞肺がん患者に対し、初回治療としてベバシズマブ(7.5mg/kg)、シスプラチン(75mg/㎡)、ペメトレキセド(500mg/㎡)の併用療法を3週間隔で4コース施行した。病勢進行に至らなかった患者のみを対象として、ベバシズマブ(7.5mg/kg)単剤維持療法群(B群)と、ベバシズマブ(7.5mg/kg)+ペメトレキセド(500mg/㎡)併用維持療法群(BP群)に無作為割付し、病勢進行もしくは患者の治療中断希望に至るまで3週間隔で治療を継続した。主要評価項目は無増悪生存期間だった。今回の全生存期間解析では、当初のデータ解析時点で生存していた患者のデータを、臨床試験参加施設に個別に問い合わせて追跡調査した。
結果:
376人の患者が導入療法(ベバシズマブ+シスプラチン+ペメトレキセド併用療法)を受けた。病勢コントロール割合は71.9%で、病勢進行に至らなかった患者のうち253人をB群(125人)とBP群(128人)に無作為に割り付けた。追跡期間中央値は14.8ヶ月間で、無増悪生存期間はBP群が有意に延長した(中央値はBP群7.4ヶ月、B群3.7ヶ月、ハザード比0.57、95%信頼区間0.44-0.75、p<0.0001)。解析対象となった253人のうち、58%は今回の解析時点で死亡していた。全生存期間中央値はBP群の方が長かったが、統計学的有意差には至らなかった(中央値はBP群17.1ヶ月、B群13.2ヶ月、ハザード比0.87、95%信頼区間0.63-1.21、p=0.29)。二次治療はB群の77%、BP群の70%で施行されていた。
結論:
ベバシズマブ+シスプラチン+ペメトレキセド併用療法施行後に病勢進行しなかった進行非扁平上皮非小細胞肺がん患者では、ベバシズマブ+ペメトレキセド併用維持療法はベバシズマブ単剤維持療法と比較して、統計学的有意ではないものの全生存期間を延長した。
なお、今回取り上げたのは第二報であり、第一報は以下。
題名とreferenceだけ書き残す。
Randomized phase III trial of maintenance bevacizumab with or without pemetrexed after first-line induction with bevacizumab, cisplatin, and pemetrexed in advanced nonsquamous non-small-cell lung cancer: AVAPERL (MO22089)
Fabrice Barlesi et al., J Clin Oncol. 2013 Aug 20;31(24):3004-11.
doi: 10.1200/JCO.2012.42.3749.
ABCP、すなわちアテゾリズマブ+ベバシズマブ+カルボプラチン+パクリタキセル併用療法→アテゾリズマブ+ベバシズマブ併用維持療法。
http://oitahaiganpractice.junglekouen.com/e935130.html
http://oitahaiganpractice.junglekouen.com/e968054.html
ベースとなっているのはECOG4599レジメン、すなわちベバシズマブ+カルボプラチン+パクリタキセル併用療法→ベバシズマブ維持療法で、ABCP療法はそこにさらにアテゾリズマブを上乗せして、ベバシズマブ維持療法にもアテゾリズマブも上乗せしたら、もっと治療成績が良くなるんやなかろうかという発想だろう。
一方、シスプラチン+ペメトレキセド併用療法→ペメトレキセド維持療法の成功を踏まえて、ベバシズマブ+シスプラチン+ペメトレキセド併用療法→ベバシズマブ+ペメトレキセド併用維持療法の有効性と安全性を検証したAVAPERL試験。
ペメトレキセド維持療法の有効性が示されたのと同じ2011年に最初の報告が行われ、この年は肺がん診療の領域に(今となっては当たり前となった)維持療法という新しい治療概念が持ち込まれた、パラダイムシフトが起きた年だった。
改めて振り返ってみると、全生存期間は延長できなかったものの、ベバシズマブとペメトレキセドの両方を維持療法として使用するという時代をかなり先取りしたコンセプトだったように思う。
きちんと記事としてまとめておらず、検索に苦労したので、今回取り上げることにした。
・・・アテゾリズマブ+ベバシズマブ+カルボプラチン+ペメトレキセド併用療法後のアテゾリズマブ+ベバシズマブ+ペメトレキセド維持療法をやったらどうなるんだろう・・・。
・・・コストが高すぎて言い出せない・・・。
Maintenance bevacizumab-pemetrexed after first-line cisplatin-pemetrexed-bevacizumab for advanced nonsquamous nonsmall-cell lung cancer: updated survival analysis of the AVAPERL (MO22089) randomized phase III trial
F Barlesi et al., Ann Oncol. 2014 May;25(5):1044-52.
doi: 10.1093/annonc/mdu098. Epub 2014 Feb 27.
背景:
無作為化第III相AVAPERL試験は、非扁平上皮非小細胞肺がん患者におけるベバシズマブ+ペメトレキセド(BP)併用維持療法の安全性と有効性を検証するための試験である。無増悪生存期間はBP併用維持療法で有意に延長したが、全生存期間解析についてはデータが未成熟のままとなっていた。今回は本試験の生存解析に関する最新データを取り扱う。
対象患者と方法:
進行非扁平上皮非小細胞肺がん患者に対し、初回治療としてベバシズマブ(7.5mg/kg)、シスプラチン(75mg/㎡)、ペメトレキセド(500mg/㎡)の併用療法を3週間隔で4コース施行した。病勢進行に至らなかった患者のみを対象として、ベバシズマブ(7.5mg/kg)単剤維持療法群(B群)と、ベバシズマブ(7.5mg/kg)+ペメトレキセド(500mg/㎡)併用維持療法群(BP群)に無作為割付し、病勢進行もしくは患者の治療中断希望に至るまで3週間隔で治療を継続した。主要評価項目は無増悪生存期間だった。今回の全生存期間解析では、当初のデータ解析時点で生存していた患者のデータを、臨床試験参加施設に個別に問い合わせて追跡調査した。
結果:
376人の患者が導入療法(ベバシズマブ+シスプラチン+ペメトレキセド併用療法)を受けた。病勢コントロール割合は71.9%で、病勢進行に至らなかった患者のうち253人をB群(125人)とBP群(128人)に無作為に割り付けた。追跡期間中央値は14.8ヶ月間で、無増悪生存期間はBP群が有意に延長した(中央値はBP群7.4ヶ月、B群3.7ヶ月、ハザード比0.57、95%信頼区間0.44-0.75、p<0.0001)。解析対象となった253人のうち、58%は今回の解析時点で死亡していた。全生存期間中央値はBP群の方が長かったが、統計学的有意差には至らなかった(中央値はBP群17.1ヶ月、B群13.2ヶ月、ハザード比0.87、95%信頼区間0.63-1.21、p=0.29)。二次治療はB群の77%、BP群の70%で施行されていた。
結論:
ベバシズマブ+シスプラチン+ペメトレキセド併用療法施行後に病勢進行しなかった進行非扁平上皮非小細胞肺がん患者では、ベバシズマブ+ペメトレキセド併用維持療法はベバシズマブ単剤維持療法と比較して、統計学的有意ではないものの全生存期間を延長した。
なお、今回取り上げたのは第二報であり、第一報は以下。
題名とreferenceだけ書き残す。
Randomized phase III trial of maintenance bevacizumab with or without pemetrexed after first-line induction with bevacizumab, cisplatin, and pemetrexed in advanced nonsquamous non-small-cell lung cancer: AVAPERL (MO22089)
Fabrice Barlesi et al., J Clin Oncol. 2013 Aug 20;31(24):3004-11.
doi: 10.1200/JCO.2012.42.3749.
2021年06月30日
PD-L1≧50%の進行non-Sq NSCLC患者で、免疫チェックポイント阻害薬単剤療法は必要かつ十分なのか
KEYNOTE-024試験の日本人サブグループ解析の結果、PD-L1≧50%の患者集団における生存期間の95%信頼値は22.9ヶ月以上、5年生存割合は51%と、以下の記事で書いた。
http://oitahaiganpractice.junglekouen.com/e986810.html
限られた患者集団とは言え、条件を満たした進行非小細胞肺がん患者がペンブロリズマブ単剤療法から治療を開始するとその半数が5年生存するというのは、私のような20世紀デビューの医師からすると、衝撃的な事実である。
とはいえ、実臨床でそこまで良いような印象は、正直言ってない。
本当にそうなるのかどうか、今後検証する必要があるだろう。
スイスの先生とイタリアの先生が、以下のような議論を交わしていたようだ。
スイスの先生とイタリアの先生が、アメリカの患者さんたちの実地臨床データベースから抽出した結果をもって欧州で議論しているのは、私から見れば「他人の褌で相撲を取る」に見えてしまう。
両者の結論は対照的で、なんだかpro-con的な議論で結論が見いだせない。
今回の報告を受けて、私ならPD-L1≧50%の進行非扁平上皮非小細胞肺がん患者の治療を考えるとき、
単剤療法:元気がない人・治療毒性リスクが高い人・進行が緩やかな人・PD-L1≧90%の人
併用療法:非喫煙者・治療毒性リスクが低い人・進行が速い、或いは病巣が増大するとPSが悪化しやすそうな人、PD-L1 50-89%
と使い分けるかなあ。
非喫煙者を潜在的な(未知の、あるいは評価困難な)ドライバー遺伝子変異陽性群と捉えると、多分ドライバー遺伝子変異陽性の患者は、併用療法の方がいいんだろう。
分子標的薬が使えなくなったら、次治療では併用療法を行うのがスマートかも知れない。
こうした考え方は、ニボルマブ+イピリムマブを使うとき、どんな人にCM227レジメンを、どんな人にCM9LAレジメンを使うか、といったところにも応用できそうな気がする。
Effectiveness of PD-(L)1 inhibitors alone or in combination with platinum-doublet chemotherapy in first-line (1L) non-squamous non-small cell lung cancer (Nsq-NSCLC) with high PD-L1 expression using real-world data
Solange Peters, MD, PhD
ESMO Virtual Plenary. Presented April 8, 2020.
腫瘍細胞におけるPD-L1高発現、すなわちPD-L1発現割合(TPS)≧50%の進行非扁平上皮非小細胞肺がん患者においては、抗PD-1 / PD-L1抗体の単剤療法と、抗PD-1 / PD-L1抗体+プラチナ併用化学療法のいずれも初回薬物療法の治療選択肢である。こうした患者においてどちらの治療が最適なのか、実際のところはっきりしない。Peters教授のグループは、実社会においてこれらの治療を受けた患者集団の治療経過について調査した。
米国のFlatiron Health電子データベースを用いて、条件に合う患者を抽出した。データベースにない事項は、医療者のカルテ、バイオマーカー評価結果報告書、病理診断結果報告書などから抽出した。非小細胞肺がん患者24,075人から、条件に合う患者520人を抽出した。主な条件は、IV期相当の状態(新規の進行非小細胞肺がん患者もしくは術後再発の治癒不能非小細胞肺がん患者)、非扁平上皮がん、ドライバー遺伝子変異がない、血液生化学検査で正常である、PS 0-2、TPS≧50%、初回薬物療法として抗PD-1 / PD-L1抗体の単剤療法もしくは抗PD-1 / PD-L1抗体+プラチナ併用化学療法を行っている、とした。特定の患者集団では、対象患者数が少ないとか、治療戦略(担当医の治療指針)のバラつきが目立った。そのため、今回の調査ではそうしたサブグループと判断された扁平上皮がんの患者、TPS 1-49%の患者は除外した。
事実上、単剤療法は全てペンブロリズマブ単剤療法であり、併用療法は全てペンブロリズマブ+カルボプラチン+ペメトレキセド併用療法だった。
患者の内訳は単剤療法群351人、併用療法群169人だった。主要評価項目は全生存期間で、副次評価項目は臨床的無増悪生存期間(画像評価上の悪化ではなく、患者の病状悪化を病勢進行と捉える)とした。単剤療法群には、より予後不良な背景(高齢、術後再発)を持つ患者が多かった。傾向スコアマッチング法(propensity score matching methods)を用いて患者背景で調整した上でハザード比を算出した。以下の背景因子について調整した:年齢、性別、人種、喫煙歴、PS、転移様式、脳転移の有無、肝転移の有無、診断から治療開始までの期間。
観察期間中央値は単剤療法群で23.5ヶ月、併用療法群で19.9ヶ月だった。以下に示すように、全生存期間、無増悪生存期間のどちらでも、両群間に有意差はつかなかった。

Peters教授は以下のようにコメントしている。
・全生存期間の生存曲線は、両群間で完全に重なっている
・画像診断上の無増悪生存期間の生存曲線も同様に重なっているように見えるが、治療期間の早い段階においては単剤療法群で病勢進行が目立ち、併用療法の方が優れているように見える
・治療早期に病勢進行に至る患者が多いことは免疫チェックポイント阻害薬単剤療法の臨床試験ではよく知られた現象だが、それがそのまま全生存期間や臨床的無増悪生存期間に反映されるわけではない
全体の患者集団では両治療群間に差は見られなかったわけだが、非喫煙者集団では併用療法群の方が統計学的有意に予後良好だった。この患者集団では、併用療法により死亡リスクが75%(p=0.02)、病勢進行リスクが60%(p=0.04)低減された。
脳転移患者集団、肝転移患者集団においては、両治療群間の治療成績は同等だった。
治療開始から中止までの期間中央値は、単剤療法群で8.5ヶ月、併用療法群で7.3ヶ月だった。後治療は単剤療法群の31%が、併用療法群の33%が受けていた。
Peters教授の発表を受けて、討論に参加したCappuzo教授は以下のようにコメントしている。
・重要で刺激的な発表であり、科学的な見地からは単剤療法と併用療法どちらを選ぶべきかの結論は今回の発表だけでは出せない
・全生存期間に差がない以上、単剤療法と併用療法のどちらがベストなのか、個別の患者ごとに判断しなければいけないということははっきりした
・PD-L1高発現の非小細胞肺がん患者において免疫チェックポイント阻害薬単剤療法が化学療法を凌ぐことは確かだが、一方で第III相臨床試験に参加した患者の30%では、免疫チェックポイント阻害薬単剤療法よりも、化学療法との併用療法の方が、より予後良好だった
・PD-L1高発現の患者を対象としたほとんどの臨床試験において、免疫チェックポイント阻害薬単剤療法での生存期間中央値は2年未満だが、併用療法では2年を上回る
・一方で、併用療法では毒性も強くなる
・grade 3-5の毒性は併用療法では患者の60%に見られるが、単剤療法では20%である
・毒性管理は実臨床においては重要で、治療毒性に耐えうる限り、進行の早い患者には併用療法を使いたいし、一方で進行の緩やかな患者や忍容性の乏しい患者では単剤療法を使いたい
・一般に、非喫煙者における免疫チェックポイント阻害薬の効果は乏しいとされているので、免疫チェックポイント阻害薬に化学療法上乗せが必要かどうかよりも、そもそもこの患者集団全てに免疫チェックポイント阻害薬が必要なのか、化学療法だけではダメなのか、免疫チェックポイント阻害薬が全く役に立たないのはどんな非喫煙者なのか、という視点がほしい
・PD-L1高発現の患者は、一様ではない
・PD-L1≧90%の患者には免疫チェックポイント阻害薬が著効するため、こうした患者には単剤療法が最適な治療かも知れない
・結局のところ、安全性が担保される限りはPD-L1≧50%の全ての患者に併用療法を適用したいが、PD-L1≧90%の患者とか、患者の治療忍容性に懸念があるときは、単剤療法を行いたい
http://oitahaiganpractice.junglekouen.com/e986810.html
限られた患者集団とは言え、条件を満たした進行非小細胞肺がん患者がペンブロリズマブ単剤療法から治療を開始するとその半数が5年生存するというのは、私のような20世紀デビューの医師からすると、衝撃的な事実である。
とはいえ、実臨床でそこまで良いような印象は、正直言ってない。
本当にそうなるのかどうか、今後検証する必要があるだろう。
スイスの先生とイタリアの先生が、以下のような議論を交わしていたようだ。
スイスの先生とイタリアの先生が、アメリカの患者さんたちの実地臨床データベースから抽出した結果をもって欧州で議論しているのは、私から見れば「他人の褌で相撲を取る」に見えてしまう。
両者の結論は対照的で、なんだかpro-con的な議論で結論が見いだせない。
今回の報告を受けて、私ならPD-L1≧50%の進行非扁平上皮非小細胞肺がん患者の治療を考えるとき、
単剤療法:元気がない人・治療毒性リスクが高い人・進行が緩やかな人・PD-L1≧90%の人
併用療法:非喫煙者・治療毒性リスクが低い人・進行が速い、或いは病巣が増大するとPSが悪化しやすそうな人、PD-L1 50-89%
と使い分けるかなあ。
非喫煙者を潜在的な(未知の、あるいは評価困難な)ドライバー遺伝子変異陽性群と捉えると、多分ドライバー遺伝子変異陽性の患者は、併用療法の方がいいんだろう。
分子標的薬が使えなくなったら、次治療では併用療法を行うのがスマートかも知れない。
こうした考え方は、ニボルマブ+イピリムマブを使うとき、どんな人にCM227レジメンを、どんな人にCM9LAレジメンを使うか、といったところにも応用できそうな気がする。
Effectiveness of PD-(L)1 inhibitors alone or in combination with platinum-doublet chemotherapy in first-line (1L) non-squamous non-small cell lung cancer (Nsq-NSCLC) with high PD-L1 expression using real-world data
Solange Peters, MD, PhD
ESMO Virtual Plenary. Presented April 8, 2020.
腫瘍細胞におけるPD-L1高発現、すなわちPD-L1発現割合(TPS)≧50%の進行非扁平上皮非小細胞肺がん患者においては、抗PD-1 / PD-L1抗体の単剤療法と、抗PD-1 / PD-L1抗体+プラチナ併用化学療法のいずれも初回薬物療法の治療選択肢である。こうした患者においてどちらの治療が最適なのか、実際のところはっきりしない。Peters教授のグループは、実社会においてこれらの治療を受けた患者集団の治療経過について調査した。
米国のFlatiron Health電子データベースを用いて、条件に合う患者を抽出した。データベースにない事項は、医療者のカルテ、バイオマーカー評価結果報告書、病理診断結果報告書などから抽出した。非小細胞肺がん患者24,075人から、条件に合う患者520人を抽出した。主な条件は、IV期相当の状態(新規の進行非小細胞肺がん患者もしくは術後再発の治癒不能非小細胞肺がん患者)、非扁平上皮がん、ドライバー遺伝子変異がない、血液生化学検査で正常である、PS 0-2、TPS≧50%、初回薬物療法として抗PD-1 / PD-L1抗体の単剤療法もしくは抗PD-1 / PD-L1抗体+プラチナ併用化学療法を行っている、とした。特定の患者集団では、対象患者数が少ないとか、治療戦略(担当医の治療指針)のバラつきが目立った。そのため、今回の調査ではそうしたサブグループと判断された扁平上皮がんの患者、TPS 1-49%の患者は除外した。
事実上、単剤療法は全てペンブロリズマブ単剤療法であり、併用療法は全てペンブロリズマブ+カルボプラチン+ペメトレキセド併用療法だった。
患者の内訳は単剤療法群351人、併用療法群169人だった。主要評価項目は全生存期間で、副次評価項目は臨床的無増悪生存期間(画像評価上の悪化ではなく、患者の病状悪化を病勢進行と捉える)とした。単剤療法群には、より予後不良な背景(高齢、術後再発)を持つ患者が多かった。傾向スコアマッチング法(propensity score matching methods)を用いて患者背景で調整した上でハザード比を算出した。以下の背景因子について調整した:年齢、性別、人種、喫煙歴、PS、転移様式、脳転移の有無、肝転移の有無、診断から治療開始までの期間。
観察期間中央値は単剤療法群で23.5ヶ月、併用療法群で19.9ヶ月だった。以下に示すように、全生存期間、無増悪生存期間のどちらでも、両群間に有意差はつかなかった。

Peters教授は以下のようにコメントしている。
・全生存期間の生存曲線は、両群間で完全に重なっている
・画像診断上の無増悪生存期間の生存曲線も同様に重なっているように見えるが、治療期間の早い段階においては単剤療法群で病勢進行が目立ち、併用療法の方が優れているように見える
・治療早期に病勢進行に至る患者が多いことは免疫チェックポイント阻害薬単剤療法の臨床試験ではよく知られた現象だが、それがそのまま全生存期間や臨床的無増悪生存期間に反映されるわけではない
全体の患者集団では両治療群間に差は見られなかったわけだが、非喫煙者集団では併用療法群の方が統計学的有意に予後良好だった。この患者集団では、併用療法により死亡リスクが75%(p=0.02)、病勢進行リスクが60%(p=0.04)低減された。
脳転移患者集団、肝転移患者集団においては、両治療群間の治療成績は同等だった。
治療開始から中止までの期間中央値は、単剤療法群で8.5ヶ月、併用療法群で7.3ヶ月だった。後治療は単剤療法群の31%が、併用療法群の33%が受けていた。
Peters教授の発表を受けて、討論に参加したCappuzo教授は以下のようにコメントしている。
・重要で刺激的な発表であり、科学的な見地からは単剤療法と併用療法どちらを選ぶべきかの結論は今回の発表だけでは出せない
・全生存期間に差がない以上、単剤療法と併用療法のどちらがベストなのか、個別の患者ごとに判断しなければいけないということははっきりした
・PD-L1高発現の非小細胞肺がん患者において免疫チェックポイント阻害薬単剤療法が化学療法を凌ぐことは確かだが、一方で第III相臨床試験に参加した患者の30%では、免疫チェックポイント阻害薬単剤療法よりも、化学療法との併用療法の方が、より予後良好だった
・PD-L1高発現の患者を対象としたほとんどの臨床試験において、免疫チェックポイント阻害薬単剤療法での生存期間中央値は2年未満だが、併用療法では2年を上回る
・一方で、併用療法では毒性も強くなる
・grade 3-5の毒性は併用療法では患者の60%に見られるが、単剤療法では20%である
・毒性管理は実臨床においては重要で、治療毒性に耐えうる限り、進行の早い患者には併用療法を使いたいし、一方で進行の緩やかな患者や忍容性の乏しい患者では単剤療法を使いたい
・一般に、非喫煙者における免疫チェックポイント阻害薬の効果は乏しいとされているので、免疫チェックポイント阻害薬に化学療法上乗せが必要かどうかよりも、そもそもこの患者集団全てに免疫チェックポイント阻害薬が必要なのか、化学療法だけではダメなのか、免疫チェックポイント阻害薬が全く役に立たないのはどんな非喫煙者なのか、という視点がほしい
・PD-L1高発現の患者は、一様ではない
・PD-L1≧90%の患者には免疫チェックポイント阻害薬が著効するため、こうした患者には単剤療法が最適な治療かも知れない
・結局のところ、安全性が担保される限りはPD-L1≧50%の全ての患者に併用療法を適用したいが、PD-L1≧90%の患者とか、患者の治療忍容性に懸念があるときは、単剤療法を行いたい
2021年06月28日
末梢病変穿刺用キット・・・Periview Flex
肺野末梢結節影で、どうしても病変に到達できないけど、どう考えてもこの気管支粘膜のすぐ向こう側に病変がある、ということがある。
そんなときに末梢肺を穿刺する手法があるけれど、手元に道具がなくてできなかった。
先日開催された日本呼吸器内視鏡学会にweb参加したところ、Periview Flexなる末梢肺穿刺用キットが既に上市されているとのことだった。
ガイドシースとも併用できるようで、未導入の施設ではぜひ検討するべきデバイスではないだろうか。
https://www.olympusprofed.com/pulm/peripheral/1140/
なお、ガイドシースキットもバージョンアップされている。
不覚にも知らなかった。
末梢病変に対するEBUSアプローチのイメージは、こちらの動画を見ると掴みやすいのではないだろうか。
https://www.youtube.com/watch?v=f8TNGjmQBtk
そんなときに末梢肺を穿刺する手法があるけれど、手元に道具がなくてできなかった。
先日開催された日本呼吸器内視鏡学会にweb参加したところ、Periview Flexなる末梢肺穿刺用キットが既に上市されているとのことだった。
ガイドシースとも併用できるようで、未導入の施設ではぜひ検討するべきデバイスではないだろうか。
https://www.olympusprofed.com/pulm/peripheral/1140/
なお、ガイドシースキットもバージョンアップされている。
不覚にも知らなかった。
末梢病変に対するEBUSアプローチのイメージは、こちらの動画を見ると掴みやすいのではないだろうか。
https://www.youtube.com/watch?v=f8TNGjmQBtk
2021年06月24日
G-CSF以外の骨髄抑制制御薬・・・trilaciclib
進展型小細胞肺がん治療時の骨髄抑制制御薬であるtrilaciclibのお話。
化学療法に先立って投与することで、白血球/好中球減少のみならず、貧血も抑えてくれるということ。
エリスロポイエチン誘導体を使って貧血を抑える試みは過去いくつかの臨床試験が行われ、結局生存期間を短縮してしまうということで開発が止まっている。
それを受けて、G-CSF製剤も実は生存期間を短縮するのではないかという都市伝説が、一部で聞こえてきたりする。
trilaciclibはエリスロポイエチン誘導体、G-CSF製剤の両方の役割をある程度担ってくれる薬のようだが、有害事象に関する記載が不自然なくらいに強調されていた。
果たして、全生存期間に対してはどんな作用を及ぼしているのだろう。
そして、peg-G-CSF製剤に続くこの領域の支持療法薬として、我が国にも導入される日が来るのだろうか?
Trilaciclib to Reduce Chemotherapy-Induced Bone Marrow Suppression in Extensive-Stage Small Cell Lung Cancer
The ASCO Post
By Matthew Stenger
Posted: 6/16/2021 12:53:00 PM
Last Updated: 6/16/2021 1:52:46 PM
2021年2月21日、進展型小細胞肺がん患者に対するプラチナ製剤およびエトポシドを含む化学療法か、あるいはトポテカンを含む化学療法施行時の骨髄抑制を低減する適用条件で、サイクリン依存型キナーゼ4/6(CDK4/6)阻害薬のtrilaciclibが米国食品医薬品局に承認された。
本承認は3件の二重盲検プラセボ対照臨床試験(G1T28-05試験、G1T28-02試験およびG1T28-03試験)結果に基づいている。これら3件の臨床試験では、化学療法①コース目における顆粒球コロニー刺激因子(G-CSF)の予防投与や赤血球造血刺激薬の使用は禁じられていた。②コース目以降は適応があればこれら治療は施行可能とされ、治療目的のG-CSF投与、赤血球輸血、血小板輸血も適応があれば臨床試験期間中いつでも施行可能とされた。
GIT28-05試験では、治療歴のない進展型小細胞肺がん患者107人を対象に、trilaciclib群(54人)あるいはプラセボ群(53人)に割り付けた。全ての患者でエトポシド+カルボプラチン+アテゾリズマブ併用療法を21日間隔で最大④コース施行し、trilaciclib群では化学療法に先立ってtrilaciclib 240mg/㎡を1-3日目に、プラセボ群では同様にプラセボを1-3日目に経静脈投与した。主要評価項目の解析において、trilaciclib群は治療①コース目における重篤な好中球減少症の平均持続期間を短縮し(0日間 vs 4日間、p<0.0001)、重篤な好中球減少症を来す患者の割合も減少させた(2% vs 49%、p<0.0001)。化学療法薬の減量を必要とする有害事象全体に占める好中球減少症の割合は、triraciclib群で0.021、プラセボ群で0.085だった。治療開始から5週間以上経過した段階で、赤血球輸血を必要とした患者の割合はtrilaciclib群で13.0%、プラセボ群で20.8%であり、同様にG-CSF投与を必要とした割合はtrilaciclib群で29.6%、プラセボ群で47.2%だった。
GIT28-02試験では、治療歴のない進展型小細胞肺がん患者77人を対象に、trilaciclib群(39人)あるいはプラセボ群(38人)に割り付けた。全ての患者はエトポシド+カルボプラチン併用療法を21日間隔で病勢進行もしくは忍容不能の有害事象発現まで継続し、trilaciclib群では化学療法に先立ってtrilaciclib 240mg/㎡を1-3日目に、プラセボ群では同様にプラセボを1-3日目に経静脈投与した。治療①コース目における重篤な好中球減少症の平均持続期間はtrilaciclib群0.5日間、プラセボ群3日間で、重篤な好中球減少症を来す患者の割合はtrilaciclib群5.1%、プラセボ群42.1%だった。化学療法薬の減量を必要とする有害事象全体に占める好中球減少症の割合は、triraciclib群で0.0022、プラセボ群で0.084だった。治療開始から5週間以上経過した段階で、赤血球輸血を必要とした患者の割合はtrilaciclib群で5.1%、プラセボ群で23.7%であり、同様にG-CSF投与を必要とした割合はtrilaciclib群で10.3%、プラセボ群で63.2%だった。
GIT28-03試験では、既治療の進展型小細胞肺がん患者61人を対象に、trilaciclib群(32人)あるいはプラセボ群(29人)に割り付けた。全ての患者はトポテカン単剤療法を21日間隔で病勢進行もしくは忍容不能の有害事象発現まで継続し、trilaciclib群では化学療法に先立ってtrilaciclib 240mg/㎡を1-5日目に、プラセボ群では同様にプラセボを1-5日目に経静脈投与した。治療①コース目における重篤な好中球減少症の平均持続期間はtrilaciclib群2日間、プラセボ群7日間で、重篤な好中球減少症を来す患者の割合はtrilaciclib群40.6%、プラセボ群75.9%だった。化学療法薬の減量を必要とする有害事象全体に占める好中球減少症の割合は、triraciclib群で0.051、プラセボ群で0.116だった。
trilaciclibは一過性のCDK4/6阻害薬である。骨髄中の造血幹細胞ないし造血前駆細胞は、準間欠中の好中球、赤血球、血小板を増加させる。造血幹細胞及び造血前駆細胞の増殖は、CDK4/6活性に依存している。
trilaciclibの推奨容量は1回240mg/㎡であり、化学療法薬投与に先立つこと4時間以内に、30分かけて点滴投与することとされている。trilaciclibを中止する場合には、trilaciclib最終投与から96時間経過するまでは化学療法を再開するべきではないとされている。
G1T28-05試験、G1T28-02試験およびG1T28-03試験を統合解析し、trilaciclib群122人、プラセボ群118人から安全性に関するデータを抽出した。trilaciclib群の71%、プラセボ群の78%が少なくとも④コースの治療を完遂した。各群の治療コース中央値はいずれも④コースだった。
trilaciclib群の患者の10%以上で発生し、かつプラセボ群よりも2%以上発現割合が高かった全グレードの有害事象は、倦怠感(34% vs 27%)、低カルシウム血症(24% vs 21%)、低カリウム血症(22% vs 18%)、低リン酸血症(21% vs 16%)、AST上昇(17% vs 14%)、頭痛(13% vs 9%)、肺炎(10% vs 8%)だった。頻度の高かったGrade 3-4の有害事象は、肺炎(7% vs 7%)、低リン酸血症(7% vs 2%)、低カリウム血症(6% vs 3%)だった。Grade 3-4の骨髄抑制は、好中球減少(32% vs 69%)、発熱性好中球減少(3% vs 9%)、貧血(16% vs 34%)、血小板減少(18% vs 33%)、白血球減少(4% vs 17%)、リンパ球減少(<1% vs <1%)だった。
深刻な有害事象はtrilaciclib群の患者の30%で認められ、これらのうち3%以上を呼吸不全、出血、血栓塞栓症が占めていた。有害事象により点滴を中断した事例は4%発生した。trilaciclib群の9%では有害事象によりプロトコール治療の中断を余儀なくされたが、原因は肺炎(2%)、無力症、注射部位の局所反応、血小板減少症、心血管イベント、脳梗塞、インフュージョンリアクション、呼吸不全、筋炎(それぞれ1%未満)だった。5%の患者は致死的な有害事象を来しており、原因は肺炎(2%)、呼吸不全(2%)、急性呼吸不全(<1%)、喀血(<1%)、脳血管イベント(<1%)だった。
化学療法に先立って投与することで、白血球/好中球減少のみならず、貧血も抑えてくれるということ。
エリスロポイエチン誘導体を使って貧血を抑える試みは過去いくつかの臨床試験が行われ、結局生存期間を短縮してしまうということで開発が止まっている。
それを受けて、G-CSF製剤も実は生存期間を短縮するのではないかという都市伝説が、一部で聞こえてきたりする。
trilaciclibはエリスロポイエチン誘導体、G-CSF製剤の両方の役割をある程度担ってくれる薬のようだが、有害事象に関する記載が不自然なくらいに強調されていた。
果たして、全生存期間に対してはどんな作用を及ぼしているのだろう。
そして、peg-G-CSF製剤に続くこの領域の支持療法薬として、我が国にも導入される日が来るのだろうか?
Trilaciclib to Reduce Chemotherapy-Induced Bone Marrow Suppression in Extensive-Stage Small Cell Lung Cancer
The ASCO Post
By Matthew Stenger
Posted: 6/16/2021 12:53:00 PM
Last Updated: 6/16/2021 1:52:46 PM
2021年2月21日、進展型小細胞肺がん患者に対するプラチナ製剤およびエトポシドを含む化学療法か、あるいはトポテカンを含む化学療法施行時の骨髄抑制を低減する適用条件で、サイクリン依存型キナーゼ4/6(CDK4/6)阻害薬のtrilaciclibが米国食品医薬品局に承認された。
本承認は3件の二重盲検プラセボ対照臨床試験(G1T28-05試験、G1T28-02試験およびG1T28-03試験)結果に基づいている。これら3件の臨床試験では、化学療法①コース目における顆粒球コロニー刺激因子(G-CSF)の予防投与や赤血球造血刺激薬の使用は禁じられていた。②コース目以降は適応があればこれら治療は施行可能とされ、治療目的のG-CSF投与、赤血球輸血、血小板輸血も適応があれば臨床試験期間中いつでも施行可能とされた。
GIT28-05試験では、治療歴のない進展型小細胞肺がん患者107人を対象に、trilaciclib群(54人)あるいはプラセボ群(53人)に割り付けた。全ての患者でエトポシド+カルボプラチン+アテゾリズマブ併用療法を21日間隔で最大④コース施行し、trilaciclib群では化学療法に先立ってtrilaciclib 240mg/㎡を1-3日目に、プラセボ群では同様にプラセボを1-3日目に経静脈投与した。主要評価項目の解析において、trilaciclib群は治療①コース目における重篤な好中球減少症の平均持続期間を短縮し(0日間 vs 4日間、p<0.0001)、重篤な好中球減少症を来す患者の割合も減少させた(2% vs 49%、p<0.0001)。化学療法薬の減量を必要とする有害事象全体に占める好中球減少症の割合は、triraciclib群で0.021、プラセボ群で0.085だった。治療開始から5週間以上経過した段階で、赤血球輸血を必要とした患者の割合はtrilaciclib群で13.0%、プラセボ群で20.8%であり、同様にG-CSF投与を必要とした割合はtrilaciclib群で29.6%、プラセボ群で47.2%だった。
GIT28-02試験では、治療歴のない進展型小細胞肺がん患者77人を対象に、trilaciclib群(39人)あるいはプラセボ群(38人)に割り付けた。全ての患者はエトポシド+カルボプラチン併用療法を21日間隔で病勢進行もしくは忍容不能の有害事象発現まで継続し、trilaciclib群では化学療法に先立ってtrilaciclib 240mg/㎡を1-3日目に、プラセボ群では同様にプラセボを1-3日目に経静脈投与した。治療①コース目における重篤な好中球減少症の平均持続期間はtrilaciclib群0.5日間、プラセボ群3日間で、重篤な好中球減少症を来す患者の割合はtrilaciclib群5.1%、プラセボ群42.1%だった。化学療法薬の減量を必要とする有害事象全体に占める好中球減少症の割合は、triraciclib群で0.0022、プラセボ群で0.084だった。治療開始から5週間以上経過した段階で、赤血球輸血を必要とした患者の割合はtrilaciclib群で5.1%、プラセボ群で23.7%であり、同様にG-CSF投与を必要とした割合はtrilaciclib群で10.3%、プラセボ群で63.2%だった。
GIT28-03試験では、既治療の進展型小細胞肺がん患者61人を対象に、trilaciclib群(32人)あるいはプラセボ群(29人)に割り付けた。全ての患者はトポテカン単剤療法を21日間隔で病勢進行もしくは忍容不能の有害事象発現まで継続し、trilaciclib群では化学療法に先立ってtrilaciclib 240mg/㎡を1-5日目に、プラセボ群では同様にプラセボを1-5日目に経静脈投与した。治療①コース目における重篤な好中球減少症の平均持続期間はtrilaciclib群2日間、プラセボ群7日間で、重篤な好中球減少症を来す患者の割合はtrilaciclib群40.6%、プラセボ群75.9%だった。化学療法薬の減量を必要とする有害事象全体に占める好中球減少症の割合は、triraciclib群で0.051、プラセボ群で0.116だった。
trilaciclibは一過性のCDK4/6阻害薬である。骨髄中の造血幹細胞ないし造血前駆細胞は、準間欠中の好中球、赤血球、血小板を増加させる。造血幹細胞及び造血前駆細胞の増殖は、CDK4/6活性に依存している。
trilaciclibの推奨容量は1回240mg/㎡であり、化学療法薬投与に先立つこと4時間以内に、30分かけて点滴投与することとされている。trilaciclibを中止する場合には、trilaciclib最終投与から96時間経過するまでは化学療法を再開するべきではないとされている。
G1T28-05試験、G1T28-02試験およびG1T28-03試験を統合解析し、trilaciclib群122人、プラセボ群118人から安全性に関するデータを抽出した。trilaciclib群の71%、プラセボ群の78%が少なくとも④コースの治療を完遂した。各群の治療コース中央値はいずれも④コースだった。
trilaciclib群の患者の10%以上で発生し、かつプラセボ群よりも2%以上発現割合が高かった全グレードの有害事象は、倦怠感(34% vs 27%)、低カルシウム血症(24% vs 21%)、低カリウム血症(22% vs 18%)、低リン酸血症(21% vs 16%)、AST上昇(17% vs 14%)、頭痛(13% vs 9%)、肺炎(10% vs 8%)だった。頻度の高かったGrade 3-4の有害事象は、肺炎(7% vs 7%)、低リン酸血症(7% vs 2%)、低カリウム血症(6% vs 3%)だった。Grade 3-4の骨髄抑制は、好中球減少(32% vs 69%)、発熱性好中球減少(3% vs 9%)、貧血(16% vs 34%)、血小板減少(18% vs 33%)、白血球減少(4% vs 17%)、リンパ球減少(<1% vs <1%)だった。
深刻な有害事象はtrilaciclib群の患者の30%で認められ、これらのうち3%以上を呼吸不全、出血、血栓塞栓症が占めていた。有害事象により点滴を中断した事例は4%発生した。trilaciclib群の9%では有害事象によりプロトコール治療の中断を余儀なくされたが、原因は肺炎(2%)、無力症、注射部位の局所反応、血小板減少症、心血管イベント、脳梗塞、インフュージョンリアクション、呼吸不全、筋炎(それぞれ1%未満)だった。5%の患者は致死的な有害事象を来しており、原因は肺炎(2%)、呼吸不全(2%)、急性呼吸不全(<1%)、喀血(<1%)、脳血管イベント(<1%)だった。
2021年06月23日
順序
今日はちょっと新型コロナウイルスがらみの私見を書き残す。
思いのほか速いペースでワクチン接種が進んでいる。
医療従事者はともかくとして、75歳以上の優先接種対象者のワクチン接種が始まった当初は、混乱の極みだった。
丸一日電話をかけ続けてもつながらないコールセンター、かかりつけ医療機関の接種枠とのミスマッチ。
私の勤め先の自治体では不思議なルールがあった。
かかりつけに限らず、どなたでも希望される方は接種を受け入れますよ、と標榜した医療機関では、予約はコールセンターに一任せざるを得ず、予約できなかったかかりつけの患者さんを尻目に、一見さんの方が悠々と接種して帰っていく、という有様だった。
一方、かかりつけの患者さんには接種しますが、一見さんはお断りですよ、と標榜した医療機関では、予約はその医療機関の窓口で個別にできるようになっており、相応の数量のワクチンが振り分けられているようだった。
・・・ちょっと不公平ではないですか?
挙句の果てに、そうした一見さんお断りの医療機関でさばき切れないワクチンが、あらかじめ確保されていた7000人余り分のワクチンのうち、1000人余り分もあるとのことだった。
現在もこの仕組みは維持されているようで、なんだか医師会の闇を感じるのだが、最近は集団接種会場が円滑に運営されるようになった。
自治体の事前説明会に参加して話を聞いたところ、かなり綿密に計画されていて、担当者の皆さんの使命感と熱意、そして努力を感じた。
今では医療機関に予約して接種するよりも早く接種できるようで、私のかかりつけ外来患者さんもかなりの方々が集団接種会場で接種されている。
知人の一人が、早く接種してもらえそうだからと集団接種会場で1回目の接種を受け、解熱鎮痛薬を処方してもらいにかかりつけ医を受診したところ、「なぜ私のところで接種しないんですか!?」とやたらと怒鳴られたようだ。
これまた闇を感じる話である。
大分県では随分と新規患者数が減っているが、ずっと0というわけでもない。
先日5人くらいのクラスターが発生していたが、20代の方々のカラオケクラスターだった。
・・・わけがわからない。
ほんの1-2か月前、大分県で大規模なカラオケクラスターが発生し、最終的には高々この程度の人口規模の件で100人/日を超える新規患者が発生する羽目になったのは当然ご存じですよね。
ちょっと新規患者が減ったからって、よくワクチンも打ってないのにカラオケに行く気になりますね。
その行動が学校、職場、保健福祉行政、医療機関、二次感染してしまった方々にどれだけの迷惑をかけるか理解していますか?
ワクチン接種とカラオケに繰り出すのと、順序があべこべでしょう。
ワクチン接種が先で、カラオケに行くのはその後です。
新型コロナウイルス感染患者の対応に追われ、一時的とはいえ機能不全に陥った呼吸器内科は少なくない。
クラスターが発生した医療機関や老人ホームでは、クラスターが収束した後もいつからどの程度感染制御の手を緩めてよいのか判断が難しいと聞く。
施設入居している私の外来患者さんは、37℃台中盤の熱を出すたびに隔離され、個人防護具に包まれた職員としか接することができなくなり、新型コロナウイルスPCRの結果が陰性と確認されるまで解放されなかった。
こうした出来事が2週間続けて起こると、流石にもうそんな厳しく対応しなくていいんじゃないの?という気になる。
その一方で、新型コロナウイルス感染症の急性期を乗り越えてリハビリ目的で入院している90代の方々を見ると、暗澹とした気持ちになり、こりゃ一般の発熱患者の対応はまだ厳しくせざるを得ないなという気になってしまう。
肺炎治療後の肺線維化がほぼ全肺野に及んでおり、顕著な肺容積縮小を認める。
ステロイドを投与すれば線維化が改善し、肺容積が拡張するのか、はっきり言って見通せない。
酸素は外せないし、リハビリは進まないし、食欲は出ないし、施設には帰れないし、本当に先が見通せない。
こうした経験をしてしまうと、新型コロナウイルス対応の出口戦略をどうするか、本当に悩んでしまう。
はっきり言えることは、ワクチンを2回接種したら発症をほぼ90%以上予防することができ、インド(デルタ)株にも有効だということである。
そんなわけで、施設利用者も施設職員もはやくワクチン接種を受けて、気兼ねなくいつもの生活ができるようになろう。
ごくごく稀ながら、ワクチン接種により健康被害が起きているのもまた事実。
それを受けて、ワクチンを接種しない選択をするのは個人の自由。
だけど、自由には責任が伴うことも理解してほしい。
ワクチン接種をしない自由を選択をした人にとっては、パンデミックが収束するまで緊急事態宣言下相応の行動制限をする責任が伴うことを。
思いのほか速いペースでワクチン接種が進んでいる。
医療従事者はともかくとして、75歳以上の優先接種対象者のワクチン接種が始まった当初は、混乱の極みだった。
丸一日電話をかけ続けてもつながらないコールセンター、かかりつけ医療機関の接種枠とのミスマッチ。
私の勤め先の自治体では不思議なルールがあった。
かかりつけに限らず、どなたでも希望される方は接種を受け入れますよ、と標榜した医療機関では、予約はコールセンターに一任せざるを得ず、予約できなかったかかりつけの患者さんを尻目に、一見さんの方が悠々と接種して帰っていく、という有様だった。
一方、かかりつけの患者さんには接種しますが、一見さんはお断りですよ、と標榜した医療機関では、予約はその医療機関の窓口で個別にできるようになっており、相応の数量のワクチンが振り分けられているようだった。
・・・ちょっと不公平ではないですか?
挙句の果てに、そうした一見さんお断りの医療機関でさばき切れないワクチンが、あらかじめ確保されていた7000人余り分のワクチンのうち、1000人余り分もあるとのことだった。
現在もこの仕組みは維持されているようで、なんだか医師会の闇を感じるのだが、最近は集団接種会場が円滑に運営されるようになった。
自治体の事前説明会に参加して話を聞いたところ、かなり綿密に計画されていて、担当者の皆さんの使命感と熱意、そして努力を感じた。
今では医療機関に予約して接種するよりも早く接種できるようで、私のかかりつけ外来患者さんもかなりの方々が集団接種会場で接種されている。
知人の一人が、早く接種してもらえそうだからと集団接種会場で1回目の接種を受け、解熱鎮痛薬を処方してもらいにかかりつけ医を受診したところ、「なぜ私のところで接種しないんですか!?」とやたらと怒鳴られたようだ。
これまた闇を感じる話である。
大分県では随分と新規患者数が減っているが、ずっと0というわけでもない。
先日5人くらいのクラスターが発生していたが、20代の方々のカラオケクラスターだった。
・・・わけがわからない。
ほんの1-2か月前、大分県で大規模なカラオケクラスターが発生し、最終的には高々この程度の人口規模の件で100人/日を超える新規患者が発生する羽目になったのは当然ご存じですよね。
ちょっと新規患者が減ったからって、よくワクチンも打ってないのにカラオケに行く気になりますね。
その行動が学校、職場、保健福祉行政、医療機関、二次感染してしまった方々にどれだけの迷惑をかけるか理解していますか?
ワクチン接種とカラオケに繰り出すのと、順序があべこべでしょう。
ワクチン接種が先で、カラオケに行くのはその後です。
新型コロナウイルス感染患者の対応に追われ、一時的とはいえ機能不全に陥った呼吸器内科は少なくない。
クラスターが発生した医療機関や老人ホームでは、クラスターが収束した後もいつからどの程度感染制御の手を緩めてよいのか判断が難しいと聞く。
施設入居している私の外来患者さんは、37℃台中盤の熱を出すたびに隔離され、個人防護具に包まれた職員としか接することができなくなり、新型コロナウイルスPCRの結果が陰性と確認されるまで解放されなかった。
こうした出来事が2週間続けて起こると、流石にもうそんな厳しく対応しなくていいんじゃないの?という気になる。
その一方で、新型コロナウイルス感染症の急性期を乗り越えてリハビリ目的で入院している90代の方々を見ると、暗澹とした気持ちになり、こりゃ一般の発熱患者の対応はまだ厳しくせざるを得ないなという気になってしまう。
肺炎治療後の肺線維化がほぼ全肺野に及んでおり、顕著な肺容積縮小を認める。
ステロイドを投与すれば線維化が改善し、肺容積が拡張するのか、はっきり言って見通せない。
酸素は外せないし、リハビリは進まないし、食欲は出ないし、施設には帰れないし、本当に先が見通せない。
こうした経験をしてしまうと、新型コロナウイルス対応の出口戦略をどうするか、本当に悩んでしまう。
はっきり言えることは、ワクチンを2回接種したら発症をほぼ90%以上予防することができ、インド(デルタ)株にも有効だということである。
そんなわけで、施設利用者も施設職員もはやくワクチン接種を受けて、気兼ねなくいつもの生活ができるようになろう。
ごくごく稀ながら、ワクチン接種により健康被害が起きているのもまた事実。
それを受けて、ワクチンを接種しない選択をするのは個人の自由。
だけど、自由には責任が伴うことも理解してほしい。
ワクチン接種をしない自由を選択をした人にとっては、パンデミックが収束するまで緊急事態宣言下相応の行動制限をする責任が伴うことを。
2021年06月22日
アナモレリンの効果について
振り返ってみると、アナモレリンの開発にはそれなりに時間がかかっている。
2015年に一度、アナモレリンに関する記載を残していた。
→http://oitahaiganpractice.junglekouen.com/e828753.html
これを読んだだけでも、開発に難航していたことがよく分かる。
結局のところ、アナモレリンを使用すると体重減少と食欲不振、血中プレアルブミン濃度は改善するものの、運動機能の改善には至らないとのこと。
比較的運動機能の保たれた、悪液質を伴う進行非小細胞肺がん患者がよい適応ということなのだろうか。
繰り返しになるが、使い始めるタイミングが意外と難しい薬である。
Anamorelin (ONO-7643) for the treatment of patients with non-small cell lung cancer and cachexia: Results from a randomized, double-blind, placebo-controlled, multicenter study of Japanese patients (ONO-7643-04)
Nobuyuki Katakami et al., Cancer. 2018 Feb 1;124(3):606-616.
doi: 10.1002/cncr.31128. Epub 2017 Dec 4.
背景:
体重(主として除脂肪体重(lean body mass, LBM))の減少や食欲不振といったがん悪液質の症状は、進行がんの患者ではよく見られるものである。今回の試験では、がん悪液質を伴う日本人がん患者において、新規の選択的グレリン受容体作動薬であるアナモレリン(ONO-7643)の有効性と安全性を検証することを目的とした。
方法:
今回の二重盲検臨床試験(ONO-7643-04)では、がん悪液質を伴う切除不能III / IV期非小細胞肺がん患者174人を対象とした。患者はアナモレリン群(アナモレリンを連日100mg内服)とプラセボ群に割り付けられ、12週間のプロトコール治療を受けた。主要評価項目は12週間経過時点での、ベースラインの除脂肪体重からの変化量とした。除脂肪体重は、二重エネルギーX線吸収測定法を用いて測定した。
→※二重エネルギーX線吸収測定法:https://www.jstage.jst.go.jp/article/jssmn/53/4/53_119/_pdf/-char/ja
副次評価項目は、食欲・体重・QoL・握力・6分間歩行負荷試験結果の変化量とした。
結果:
ベースラインから12週間後の除脂肪体重の最小二乗平均(±標準誤差)は、アナモレリン群で1.38±0.18、プラセボ群で-0.17±0.17で、アナモレリン群で有意に増加していた(p<0.0001)。ベースラインからの変化量は、除脂肪体重、体重、食欲不振症状のいずれにおいても、全ての評価時点においてアナモレリン群とプラセボ群で有意差を認めた。アナモレリン群では治療開始3週間時点、9週間時点で血中プレアルブミンが増加していた。握力や6分間歩行負荷試験の測定値は両群で差がなかった。アナモレリンによる12週間の治療は、非小細胞肺がん患者においては安全で忍容性良好だった。
結論:
日本人進行非小細胞肺がん患者において、アナモレリンは有意に除脂肪体重を増加させ、食欲不振の兆候や栄養状態を改善したが、運動機能は改善しなかった。がん悪液質に対する有効な治療法はこれまでなかったため、アナモレリンは有益な治療選択肢になりうる。
2015年に一度、アナモレリンに関する記載を残していた。
→http://oitahaiganpractice.junglekouen.com/e828753.html
これを読んだだけでも、開発に難航していたことがよく分かる。
結局のところ、アナモレリンを使用すると体重減少と食欲不振、血中プレアルブミン濃度は改善するものの、運動機能の改善には至らないとのこと。
比較的運動機能の保たれた、悪液質を伴う進行非小細胞肺がん患者がよい適応ということなのだろうか。
繰り返しになるが、使い始めるタイミングが意外と難しい薬である。
Anamorelin (ONO-7643) for the treatment of patients with non-small cell lung cancer and cachexia: Results from a randomized, double-blind, placebo-controlled, multicenter study of Japanese patients (ONO-7643-04)
Nobuyuki Katakami et al., Cancer. 2018 Feb 1;124(3):606-616.
doi: 10.1002/cncr.31128. Epub 2017 Dec 4.
背景:
体重(主として除脂肪体重(lean body mass, LBM))の減少や食欲不振といったがん悪液質の症状は、進行がんの患者ではよく見られるものである。今回の試験では、がん悪液質を伴う日本人がん患者において、新規の選択的グレリン受容体作動薬であるアナモレリン(ONO-7643)の有効性と安全性を検証することを目的とした。
方法:
今回の二重盲検臨床試験(ONO-7643-04)では、がん悪液質を伴う切除不能III / IV期非小細胞肺がん患者174人を対象とした。患者はアナモレリン群(アナモレリンを連日100mg内服)とプラセボ群に割り付けられ、12週間のプロトコール治療を受けた。主要評価項目は12週間経過時点での、ベースラインの除脂肪体重からの変化量とした。除脂肪体重は、二重エネルギーX線吸収測定法を用いて測定した。
→※二重エネルギーX線吸収測定法:https://www.jstage.jst.go.jp/article/jssmn/53/4/53_119/_pdf/-char/ja
副次評価項目は、食欲・体重・QoL・握力・6分間歩行負荷試験結果の変化量とした。
結果:
ベースラインから12週間後の除脂肪体重の最小二乗平均(±標準誤差)は、アナモレリン群で1.38±0.18、プラセボ群で-0.17±0.17で、アナモレリン群で有意に増加していた(p<0.0001)。ベースラインからの変化量は、除脂肪体重、体重、食欲不振症状のいずれにおいても、全ての評価時点においてアナモレリン群とプラセボ群で有意差を認めた。アナモレリン群では治療開始3週間時点、9週間時点で血中プレアルブミンが増加していた。握力や6分間歩行負荷試験の測定値は両群で差がなかった。アナモレリンによる12週間の治療は、非小細胞肺がん患者においては安全で忍容性良好だった。
結論:
日本人進行非小細胞肺がん患者において、アナモレリンは有意に除脂肪体重を増加させ、食欲不振の兆候や栄養状態を改善したが、運動機能は改善しなかった。がん悪液質に対する有効な治療法はこれまでなかったため、アナモレリンは有益な治療選択肢になりうる。
2021年06月22日
アナモレリン、意外と使いどころが難しい・・・
がん悪液質に対するアナモレリン、今度こそきちんと使おうと準備していたのだが・・・。
またコケてしまった。
肺がん領域では、適応患者は「下記の悪性腫瘍によるがん悪液質:非小細胞肺癌、胃癌、膵癌、大腸癌」・・・。
なんと、肺小細胞癌は適応外ではないですか。
三次治療までやりつくして進退窮まった肺小細胞癌の患者さんに使おうとしたのだが、考えが甘かった。
気をつけないと。
またコケてしまった。
肺がん領域では、適応患者は「下記の悪性腫瘍によるがん悪液質:非小細胞肺癌、胃癌、膵癌、大腸癌」・・・。
なんと、肺小細胞癌は適応外ではないですか。
三次治療までやりつくして進退窮まった肺小細胞癌の患者さんに使おうとしたのだが、考えが甘かった。
気をつけないと。
2021年06月20日
PACIFIC試験における5年生存割合は42.9%
いよいよPACIFIC試験の5年生存割合データが出てきた。
デュルバルマブを使用していない患者の5年生存割合33.4%も十分立派な数字だと思うが、デュルバルマブを使用するとこれが42.9%にまで跳ね上がる。
ここまでくると、もはやIII期の患者に手術をする、という選択はしにくくなる。
術前治療や術後治療で42.9%よりも高い5年生存割合をたたき出さないと、手術の意義は乏しいと言わざるを得ない。
Five-year survival outcomes with durvalumab after chemoradiotherapy in unresectable stage III NSCLC: An update from the PACIFIC trial.
David R. Spigel et al., 2021 ASCO Annual Meeting, abst.#8511
背景:
プラチナ併用化学療法+同時併用根治的胸部放射線療法後に病勢進行を認めなかった切除不能III期非小細胞肺がん患者を対象としたプラセボ対照第III相PACIFIC試験において、デュルバルマブは全生存期間(OS、層別化ハザード比0.68、95%信頼区間0.53-0.87、p=0.0025、データカットオフは2018年03月22日)および無増悪生存期間(PFS、層別化ハザード比0.52、95%信頼区間0.42-0.65、p<0.0001、データカットオフ2017年02月13日)ともに改善し、その後のデータ更新でも同様の有用性が維持されていた。デュルバルマブによる有害事象は管理可能であり、患者本人申告によるQoL調査でも、プラセボに対して有害な影響は見られなかった。こうした発見により、化学放射線療法後のデュルバルマブ地固め療法(PACIFICレジメン)は本試験参加者のような患者集団にとっての標準治療となった。今回は、最後の参加者が登録されてから約5年間経過したため、OSとPFSについて探索的な解析を行った。
方法:
WHO-PS 0/1(PD-L1発現状態は問わない)で、同時併用化学放射線療法(少なくとも2コース以上は併用)の後に病勢進行に至らなかった適格患者を対象として、2:1の割合でデュルバルマブ(D)群とプラセボ(P)群に割り付けた。同時併用化学放射線療法(根治的胸部放射線照射として、典型的には計60-66Gyを30-33回で分割投与)終了後1-42日の間に、D群ではデュルバルマブを10mg/kgで2週間ごとに12ヶ月間投与し、P群ではプラセボを同様に投与した。層別化因子は年齢(65歳未満 vs 65歳以上)、性別、喫煙歴(喫煙経験者 vs 非喫煙経験者)とした。主要評価項目はIntent-to-treat(ITT)解析による全生存期間及び無増悪生存期間(RECIST vsr.1.1準拠で、独立判定委員会による)とした。ハザード比と95%信頼区間はITT集団における層別化ログランク検定により算出した。60ヶ月経過時点での全生存期間および無増悪生存期間の中央値は、カプランマイヤー法で算出した。
結果:
全体で713人の患者が無作為割付を受け、そのうち709人がプロトコール治療を受けた。D群に割り付けられたのが476人、うちプロトコール治療を受けたのが473人、P群に割り付けられたのが237人、うちプロトコール治療を受けたのが236人だった。参加した患者のうち最後の1人がプロトコール治療を完遂したのが2017年05月だった。2021年1月11日までの段階で(全患者の追跡期間中央値は34.2ヶ月で、範囲は0.2-74.7ヶ月)、t全生存期間(中央値はD群47.5ヶ月、P群29.1ヶ月、ハザード比0.72、95%信頼区間0.59-0.89)、無増悪生存期間(中央値はD群16.9ヶ月、P群5.6ヶ月、95%信頼区間0.45-0.68、ハザード比0.55)と、当初の解析時点と同様にD群がOS、PFSを有意に延長するという傾向を維持していた。5年生存割合はD群42.9%、P群33.4%、5年無再発生存割合はD群33.1%、P群19.0%だった。
結論:
PACIFIC試験の5年間追跡調査結果から、今回の生存期間解析の最新データはPACIFICレジメンの全生存期間、無増悪生存期間延長効果を実証した。D群の42.9%が5年後も生きていると見積もられており、5年経過後も約1/3の患者は病勢進行なく生存している。
デュルバルマブを使用していない患者の5年生存割合33.4%も十分立派な数字だと思うが、デュルバルマブを使用するとこれが42.9%にまで跳ね上がる。
ここまでくると、もはやIII期の患者に手術をする、という選択はしにくくなる。
術前治療や術後治療で42.9%よりも高い5年生存割合をたたき出さないと、手術の意義は乏しいと言わざるを得ない。
Five-year survival outcomes with durvalumab after chemoradiotherapy in unresectable stage III NSCLC: An update from the PACIFIC trial.
David R. Spigel et al., 2021 ASCO Annual Meeting, abst.#8511
背景:
プラチナ併用化学療法+同時併用根治的胸部放射線療法後に病勢進行を認めなかった切除不能III期非小細胞肺がん患者を対象としたプラセボ対照第III相PACIFIC試験において、デュルバルマブは全生存期間(OS、層別化ハザード比0.68、95%信頼区間0.53-0.87、p=0.0025、データカットオフは2018年03月22日)および無増悪生存期間(PFS、層別化ハザード比0.52、95%信頼区間0.42-0.65、p<0.0001、データカットオフ2017年02月13日)ともに改善し、その後のデータ更新でも同様の有用性が維持されていた。デュルバルマブによる有害事象は管理可能であり、患者本人申告によるQoL調査でも、プラセボに対して有害な影響は見られなかった。こうした発見により、化学放射線療法後のデュルバルマブ地固め療法(PACIFICレジメン)は本試験参加者のような患者集団にとっての標準治療となった。今回は、最後の参加者が登録されてから約5年間経過したため、OSとPFSについて探索的な解析を行った。
方法:
WHO-PS 0/1(PD-L1発現状態は問わない)で、同時併用化学放射線療法(少なくとも2コース以上は併用)の後に病勢進行に至らなかった適格患者を対象として、2:1の割合でデュルバルマブ(D)群とプラセボ(P)群に割り付けた。同時併用化学放射線療法(根治的胸部放射線照射として、典型的には計60-66Gyを30-33回で分割投与)終了後1-42日の間に、D群ではデュルバルマブを10mg/kgで2週間ごとに12ヶ月間投与し、P群ではプラセボを同様に投与した。層別化因子は年齢(65歳未満 vs 65歳以上)、性別、喫煙歴(喫煙経験者 vs 非喫煙経験者)とした。主要評価項目はIntent-to-treat(ITT)解析による全生存期間及び無増悪生存期間(RECIST vsr.1.1準拠で、独立判定委員会による)とした。ハザード比と95%信頼区間はITT集団における層別化ログランク検定により算出した。60ヶ月経過時点での全生存期間および無増悪生存期間の中央値は、カプランマイヤー法で算出した。
結果:
全体で713人の患者が無作為割付を受け、そのうち709人がプロトコール治療を受けた。D群に割り付けられたのが476人、うちプロトコール治療を受けたのが473人、P群に割り付けられたのが237人、うちプロトコール治療を受けたのが236人だった。参加した患者のうち最後の1人がプロトコール治療を完遂したのが2017年05月だった。2021年1月11日までの段階で(全患者の追跡期間中央値は34.2ヶ月で、範囲は0.2-74.7ヶ月)、t全生存期間(中央値はD群47.5ヶ月、P群29.1ヶ月、ハザード比0.72、95%信頼区間0.59-0.89)、無増悪生存期間(中央値はD群16.9ヶ月、P群5.6ヶ月、95%信頼区間0.45-0.68、ハザード比0.55)と、当初の解析時点と同様にD群がOS、PFSを有意に延長するという傾向を維持していた。5年生存割合はD群42.9%、P群33.4%、5年無再発生存割合はD群33.1%、P群19.0%だった。
結論:
PACIFIC試験の5年間追跡調査結果から、今回の生存期間解析の最新データはPACIFICレジメンの全生存期間、無増悪生存期間延長効果を実証した。D群の42.9%が5年後も生きていると見積もられており、5年経過後も約1/3の患者は病勢進行なく生存している。
2021年06月19日
ラムシルマブの胸水制御効果・・・ベバシズマブよりは劣るか
ベバシズマブに胸水制御効果があるのなら、果たしてラムシルマブではどうか、というのがこの後方視的研究の一つの注目点だろう。
既治療進行非小細胞肺がんに対してドセタキセル+ラムシルマブ併用療法を施行された患者を集積して調べたところ、胸水に関する奏効割合は7.7%、病勢コントロール割合は53.8%で、本治療で胸水が減少に転じる患者は少なかった様子。胸水コントロール割合が91.3%だったカルボプラチン+パクリタキセル+ベバシズマブ併用療法に比べると見劣りしてしまう。
Impact of docetaxel plus ramucirumab on metastatic site in previously treated patients with non-small cell lung cancer: a multicenter retrospective study
Kinnosuke Matsumoto et al., Transl Lung Cancer Res. 2021 Apr;10(4):1642-1652.
doi: 10.21037/tlcr-20-1263.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8107751/
背景:
ドセタキセル(DTX)+ラムシルマブ(RAM)併用療法は、既治療非小細胞肺がんに対する最適な治療の1つとして推奨されている。しかし、実地臨床におけるDTX+RAM併用療法の報告はほとんどなく、ECOG-PS改善効果や遠隔転移巣制御効果については未だよく分かっていない。
方法:
2016年06月から2020年3月にかけて、日本国内4施設からDTX+RAM併用療法を施行された非小細胞肺がん患者を集積した。後方視的に奏効割合(ORR)、病勢コントロール割合(DCR)、無増悪生存期間(PFS)を調査し、PFSについて単変数ないし多変数解析を行い、独立した予後因子を抽出した。がん性胸水に関する効果は、胸水穿刺を行わずとも明らかに胸水が減少したときは部分奏効(PR)、DTX+RAM併用療法開始から6週間経過しても明らかな胸水増加がなければ病勢安定(SD)とした。対象とした患者は、2020年06月30日まで追跡調査した。
結果:
計237人の患者を集積した。年齢中央値は66歳(範囲は33‐82歳)、75歳以上が30人(12.7%)、女性が87人(36.7%)、腺がんが180人(75.9%)、扁平上皮がんが38人(16.0%)、ECOG-PS 0/1/2はそれぞれ28人(11.8%)/161人(67.9%)/40人(16.9%)、EGFR遺伝子変異陽性は66人(29.5%)、がん性胸水貯留を伴う患者は71人(30.1%)、肺内転移を伴う患者は100人(42.2%)、肝転移を伴う患者は38人(16.0%)、脳転移を有する患者は60人(25.4%)だった。全患者集団におけるORRは25.2%、DCRは63.9%、PFSは4.5ヶ月、生存期間中央値(OS)は13.4ヶ月だった。がん性胸水貯留を伴う患者でのORRは7.7%、DCRは53.8%、肺内転移を有する患者でのORRは30.3%、DCRは77.5%、肝転移を有する患者でのORRは48.6%、DCRは71.4%だった。多変数解析を行ったところ、がん性胸水貯留、肺内転移、肝転移はPFSの予後不良因子とはならなかった。しかしながら、ECOG-PS≧2(ハザード比1.66、95%信頼区間1.14-2.40、p=0.008)、脳転移(ハザード比1.71、95%信頼区間1.23-2.37、p=0.001)はPFS短縮に関連する有意な独立予後不良因子だった。
結論:
DTX+RAM併用療法はがん性胸水、肺転移、肝転移を有する既治療非小細胞肺がん患者の最適な治療の1つとなり得るが、ECOG-PS≧2や脳転移を有する患者ではより慎重に適応判断するべきと考えられた。
既治療進行非小細胞肺がんに対してドセタキセル+ラムシルマブ併用療法を施行された患者を集積して調べたところ、胸水に関する奏効割合は7.7%、病勢コントロール割合は53.8%で、本治療で胸水が減少に転じる患者は少なかった様子。胸水コントロール割合が91.3%だったカルボプラチン+パクリタキセル+ベバシズマブ併用療法に比べると見劣りしてしまう。
Impact of docetaxel plus ramucirumab on metastatic site in previously treated patients with non-small cell lung cancer: a multicenter retrospective study
Kinnosuke Matsumoto et al., Transl Lung Cancer Res. 2021 Apr;10(4):1642-1652.
doi: 10.21037/tlcr-20-1263.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8107751/
背景:
ドセタキセル(DTX)+ラムシルマブ(RAM)併用療法は、既治療非小細胞肺がんに対する最適な治療の1つとして推奨されている。しかし、実地臨床におけるDTX+RAM併用療法の報告はほとんどなく、ECOG-PS改善効果や遠隔転移巣制御効果については未だよく分かっていない。
方法:
2016年06月から2020年3月にかけて、日本国内4施設からDTX+RAM併用療法を施行された非小細胞肺がん患者を集積した。後方視的に奏効割合(ORR)、病勢コントロール割合(DCR)、無増悪生存期間(PFS)を調査し、PFSについて単変数ないし多変数解析を行い、独立した予後因子を抽出した。がん性胸水に関する効果は、胸水穿刺を行わずとも明らかに胸水が減少したときは部分奏効(PR)、DTX+RAM併用療法開始から6週間経過しても明らかな胸水増加がなければ病勢安定(SD)とした。対象とした患者は、2020年06月30日まで追跡調査した。
結果:
計237人の患者を集積した。年齢中央値は66歳(範囲は33‐82歳)、75歳以上が30人(12.7%)、女性が87人(36.7%)、腺がんが180人(75.9%)、扁平上皮がんが38人(16.0%)、ECOG-PS 0/1/2はそれぞれ28人(11.8%)/161人(67.9%)/40人(16.9%)、EGFR遺伝子変異陽性は66人(29.5%)、がん性胸水貯留を伴う患者は71人(30.1%)、肺内転移を伴う患者は100人(42.2%)、肝転移を伴う患者は38人(16.0%)、脳転移を有する患者は60人(25.4%)だった。全患者集団におけるORRは25.2%、DCRは63.9%、PFSは4.5ヶ月、生存期間中央値(OS)は13.4ヶ月だった。がん性胸水貯留を伴う患者でのORRは7.7%、DCRは53.8%、肺内転移を有する患者でのORRは30.3%、DCRは77.5%、肝転移を有する患者でのORRは48.6%、DCRは71.4%だった。多変数解析を行ったところ、がん性胸水貯留、肺内転移、肝転移はPFSの予後不良因子とはならなかった。しかしながら、ECOG-PS≧2(ハザード比1.66、95%信頼区間1.14-2.40、p=0.008)、脳転移(ハザード比1.71、95%信頼区間1.23-2.37、p=0.001)はPFS短縮に関連する有意な独立予後不良因子だった。
結論:
DTX+RAM併用療法はがん性胸水、肺転移、肝転移を有する既治療非小細胞肺がん患者の最適な治療の1つとなり得るが、ECOG-PS≧2や脳転移を有する患者ではより慎重に適応判断するべきと考えられた。
2021年06月19日
がん性胸膜炎、悪性胸水貯留と血管増殖因子阻害薬(ベバシズマブ、ラムシルマブ)
無増悪生存期間延長効果に優れるものの、全生存期間延長効果はそれほどでもない血管増殖因子阻害薬(ベバシズマブ、ラムシルマブ)。
ある先生は製薬企業主催のランチョンセミナーで「このカテゴリーの薬は、ふりかけと思って使ってもらったらいい」と秀逸なコメントをされていた。
もっとオシャンティーに言えば、トッピングというところだろうか。
個人的には、腫瘍縮小を急ぎたいとき、悪性胸水や腹水を伴う時に考えるべきトッピングだと思っている。
以前そんな記事を書いたのだが、探すのにかなり手間取ってしまった。
今後の検索を容易にするために、2013年12月当時の記事を一部修正して、7年半ぶりに移植する。
2008年に修行先から大分へ帰ってきてからずっとお付き合いしていた患者が、当時がん性腹水貯留で苦しんでいた。
2007年末に局所進行原発性肺腺癌と診断されたが、放射線治療不能でシスプラチン+ジェムシタビン併用療法を施行し、有害事象(副作用)で継続困難となった。
この段階で若手医師から診療を引き継いだ。
この時点で自己免疫性肝炎を併発し、通常の化学療法は困難な状況だった。
確定診断した病院から資料を取り寄せて詳しく調べたところ、EGFR遺伝子変異陽性であることが判明し、直ちにゲフィチニブを開始、良好な腫瘍縮小効果が得られ、放射線科医と再協議の末、一旦ゲフィチニブを中止の上で根治的胸部放射線療法を行った。
結局、後に肝転移、骨転移で再燃し、その後はペメトレキセド単剤療法、エルロチニブ単剤療法と治療内容を変更してきた。
後にエルロチニブの皮膚障害に耐え切れずに一旦中止、その後急速にがん性腹水貯留が進行した。
エルロチニブを減量して再開し、間欠的に腹水を除去しながら経過を見た。
当時はアファチニブの薬事承認、薬価収載を間近に控えていたころで、少しずつでも腹水がたまる速度が低下してくれれば、アファチニブに期待をかけられるだろうと我慢の治療を強いられていた。
今ならばT790M耐性変異をチェックし、陽性であればオシメルチニブを使用していたことだろう。
結局この患者は、病状悪化のため次の治療には移行できずに亡くなった。
もうひとつ、可能性があるなら試しておきたい治療があった。
血管上皮成長因子抗体であるベバシズマブは、胸水貯留を伴う肺癌患者に対して胸水コントロール効果が高いことが知られていた。
2013年の夏に開催された日本臨床腫瘍学会総会において、胸水貯留患者に対するカルボプラチン+パクリタキセル+ベバシズマブの効果を検証する第II相試験の結果が報告された。参加した患者23人を検証したところ、奏効割合は60.8%、病勢コントロール割合は87%、無増悪生存期間中央値は7.1ヶ月、全生存期間中央値は11.7ヶ月、胸水コントロール割合は91.3%とのことだった。EGFR遺伝子変異陽性患者は4人、EML4-ALK陽性患者は1人含まれていた。
Phase2 study of bevacizumab with carboplatin-paclitaxel for non-small cell lung cancer with malignant pleural effusion.
Tamiya M, Tamiya A, Yamadori T, Nakao K, Asami K, Yasue T, Otsuka T, Shiroyama T, Morishita N, Suzuki H, Okamoto N, Okishio K, Kawaguchi T, Atagi S, Kawase I, Hirashima T.
Med Oncol. 2013;30(3):676.
また、二次治療としてのエルロチニブ+ベバシズマブ併用療法の意義を検討した大規模第III相試験として、BeTa traialが知られていた。636人の患者がエルロチニブ+ベバシズマブ併用療法とエルロチニブ単独療法のいずれかに振り分けられたが、それぞれの無増悪生存期間中央値は3.4ヶ月と1.7ヶ月、全生存期間中央値は9.3ヶ月と9.2ヶ月で、無増悪生存期間は併用療法群が有意に良好だったけれど、主たる評価項目である全生存期間ではベバシズマブの上乗せ効果は認められなかった。併用療法の意義はないと結論されたが、本試験の参加者で、EGFR遺伝子変異の状態が判明していた患者は355人(55.8%)、そのうちEGFR遺伝子変異陽性患者は30人(355人中の8.5%)しか含まれていなかった。数が少なくて参考程度にしかならないが、EGFR遺伝子変異陽性患者だけで解析すると併用療法群の生存期間中央値は未到達(95%信頼区間は22.6ヶ月-未到達)、エルロチニブ単独療法群では中央値は20.2ヶ月(95%信頼区間は16.4ヶ月-31.1ヶ月)であり、そのハザード比は0.44(0.11-1.67)だった。論文投稿時点において、すなわち主たる評価項目について十分な結論が出ている段階で、生存期間中央値が計測できない、すなわち少なくとも半数以上のEGFR遺伝子変異陽性の併用療法群の患者はこの時点で生存していた、というのはとても希望が持てる事実だと感じた。
Efficacy of bevacizumab plus erlotinib versus erlotinib alone in advanced non-small-cell lung cancer after failure of standard first-line chemotherapy (BeTa): a double-blind, placebo-controlled, phase 3 trial.
Herbst RS, Ansari R, Bustin F, Flynn P, Hart L, Otterson GA, Vlahovic G, Soh CH, O'Connor P, Hainsworth J.
Lancet. 2011 May 28;377(9780):1846-54
本来は、「胸水/腹水貯留を伴うEGFR遺伝子変異陽性の非小細胞・非扁平上皮肺癌患者を対象としたエルロチニブ+ベバシズマブ併用療法の臨床試験」を組んで、改めて検証するべきだろう。
ある先生は製薬企業主催のランチョンセミナーで「このカテゴリーの薬は、ふりかけと思って使ってもらったらいい」と秀逸なコメントをされていた。
もっとオシャンティーに言えば、トッピングというところだろうか。
個人的には、腫瘍縮小を急ぎたいとき、悪性胸水や腹水を伴う時に考えるべきトッピングだと思っている。
以前そんな記事を書いたのだが、探すのにかなり手間取ってしまった。
今後の検索を容易にするために、2013年12月当時の記事を一部修正して、7年半ぶりに移植する。
2008年に修行先から大分へ帰ってきてからずっとお付き合いしていた患者が、当時がん性腹水貯留で苦しんでいた。
2007年末に局所進行原発性肺腺癌と診断されたが、放射線治療不能でシスプラチン+ジェムシタビン併用療法を施行し、有害事象(副作用)で継続困難となった。
この段階で若手医師から診療を引き継いだ。
この時点で自己免疫性肝炎を併発し、通常の化学療法は困難な状況だった。
確定診断した病院から資料を取り寄せて詳しく調べたところ、EGFR遺伝子変異陽性であることが判明し、直ちにゲフィチニブを開始、良好な腫瘍縮小効果が得られ、放射線科医と再協議の末、一旦ゲフィチニブを中止の上で根治的胸部放射線療法を行った。
結局、後に肝転移、骨転移で再燃し、その後はペメトレキセド単剤療法、エルロチニブ単剤療法と治療内容を変更してきた。
後にエルロチニブの皮膚障害に耐え切れずに一旦中止、その後急速にがん性腹水貯留が進行した。
エルロチニブを減量して再開し、間欠的に腹水を除去しながら経過を見た。
当時はアファチニブの薬事承認、薬価収載を間近に控えていたころで、少しずつでも腹水がたまる速度が低下してくれれば、アファチニブに期待をかけられるだろうと我慢の治療を強いられていた。
今ならばT790M耐性変異をチェックし、陽性であればオシメルチニブを使用していたことだろう。
結局この患者は、病状悪化のため次の治療には移行できずに亡くなった。
もうひとつ、可能性があるなら試しておきたい治療があった。
血管上皮成長因子抗体であるベバシズマブは、胸水貯留を伴う肺癌患者に対して胸水コントロール効果が高いことが知られていた。
2013年の夏に開催された日本臨床腫瘍学会総会において、胸水貯留患者に対するカルボプラチン+パクリタキセル+ベバシズマブの効果を検証する第II相試験の結果が報告された。参加した患者23人を検証したところ、奏効割合は60.8%、病勢コントロール割合は87%、無増悪生存期間中央値は7.1ヶ月、全生存期間中央値は11.7ヶ月、胸水コントロール割合は91.3%とのことだった。EGFR遺伝子変異陽性患者は4人、EML4-ALK陽性患者は1人含まれていた。
Phase2 study of bevacizumab with carboplatin-paclitaxel for non-small cell lung cancer with malignant pleural effusion.
Tamiya M, Tamiya A, Yamadori T, Nakao K, Asami K, Yasue T, Otsuka T, Shiroyama T, Morishita N, Suzuki H, Okamoto N, Okishio K, Kawaguchi T, Atagi S, Kawase I, Hirashima T.
Med Oncol. 2013;30(3):676.
また、二次治療としてのエルロチニブ+ベバシズマブ併用療法の意義を検討した大規模第III相試験として、BeTa traialが知られていた。636人の患者がエルロチニブ+ベバシズマブ併用療法とエルロチニブ単独療法のいずれかに振り分けられたが、それぞれの無増悪生存期間中央値は3.4ヶ月と1.7ヶ月、全生存期間中央値は9.3ヶ月と9.2ヶ月で、無増悪生存期間は併用療法群が有意に良好だったけれど、主たる評価項目である全生存期間ではベバシズマブの上乗せ効果は認められなかった。併用療法の意義はないと結論されたが、本試験の参加者で、EGFR遺伝子変異の状態が判明していた患者は355人(55.8%)、そのうちEGFR遺伝子変異陽性患者は30人(355人中の8.5%)しか含まれていなかった。数が少なくて参考程度にしかならないが、EGFR遺伝子変異陽性患者だけで解析すると併用療法群の生存期間中央値は未到達(95%信頼区間は22.6ヶ月-未到達)、エルロチニブ単独療法群では中央値は20.2ヶ月(95%信頼区間は16.4ヶ月-31.1ヶ月)であり、そのハザード比は0.44(0.11-1.67)だった。論文投稿時点において、すなわち主たる評価項目について十分な結論が出ている段階で、生存期間中央値が計測できない、すなわち少なくとも半数以上のEGFR遺伝子変異陽性の併用療法群の患者はこの時点で生存していた、というのはとても希望が持てる事実だと感じた。
Efficacy of bevacizumab plus erlotinib versus erlotinib alone in advanced non-small-cell lung cancer after failure of standard first-line chemotherapy (BeTa): a double-blind, placebo-controlled, phase 3 trial.
Herbst RS, Ansari R, Bustin F, Flynn P, Hart L, Otterson GA, Vlahovic G, Soh CH, O'Connor P, Hainsworth J.
Lancet. 2011 May 28;377(9780):1846-54
本来は、「胸水/腹水貯留を伴うEGFR遺伝子変異陽性の非小細胞・非扁平上皮肺癌患者を対象としたエルロチニブ+ベバシズマブ併用療法の臨床試験」を組んで、改めて検証するべきだろう。
2021年06月16日
第III相CAPITAL試験:70歳以上の高齢者進行肺扁平上皮癌で、CBDCA+nabPTXが新たな標準治療へ
今年のASCOでは、本邦発の、実臨床に活かせる発表が多い。
その最たるものがこのCAPITAL試験ではないだろうか。
これだけ明らかな差がつくと、この患者集団にCBDCA+nabPTX併用療法を使用しないのは、倫理的に問題があると言っていいくらいだろう。
あとは、免疫チェックポイント阻害薬とどう使い分けるか、あるいはどう併用するかという問題だろう。
A randomized phase III study comparing carboplatin with nab-paclitaxel versus docetaxel for elderly patients with squamous-cell lung cancer: Capital study.
Yoichiro Hamamoto et al., 2021 ASCO Annual Meeting abst.#9031
背景:
細胞障害性抗腫瘍薬単剤療法は高齢の進行非小細胞肺がん患者に対する標準治療のひとつである。進行肺扁平上皮癌の患者に対するカルボプラチン+ナブパクリタキセル(CBDCA+nabPTX)併用療法は、カルボプラチン+パクリタキセル(CBDCA+PTX)併用療法と比較して有意に奏効割合が高く、70歳以上の患者サブグループでは全生存期間の延長も見込まれた。今回、高齢の進行肺扁平上皮癌の患者を対象に、CBDCA+nabPTX併用療法とドセタキセル(DTX)単剤療法を比較した。
方法:
CAPITAL試験は多施設共同、オープンラベル、第III相ランダム化比較試験であり、日本国内の92施設が参加した。適格条件は以下の通りとした:未治療進行肺扁平上皮癌患者、70歳以上、ECOG-PS 0-1。対象患者はDTX群(DTX 60mg/㎡を3週ごと)もしくはCnP群(CBDCA 6AUCを3週ごと、nabPTX 100mg/㎡を毎週)に1:1の割合で割り付けられた。層別化因子は年齢(75歳未満と75歳以上)、性別、ECOG-PS、治療施設、臨床病期(III期とIV期)、測定可能病変の有無だった。主要評価項目は全生存期間とした。副次評価項目は奏効割合、無増悪生存期間、安全性とした。
結果:
2015年12月から2020年08月にかけて、196人の患者が無作為割り付けを受けた(D群98人、CnP群98人)。追跡期間中央値は11.5ヶ月だった。患者年齢の中央値は76歳(70-88歳)だった。全体の87%は男性だった。各群における患者背景は、年齢中央値がDTX群77歳(70-88)、CnP群76歳(70-87)、男性がDTX群87.6%、CnP群86.3%、PS 0はDTX群32.0%、CnP群34.7%、IV期はDTX群70.1%、CnP群71.6%、免疫チェックポイント阻害薬の投与歴があったのはDTX群9.3%、CnP群9.5%だった。あらかじめ規定されていた2020年08月の中間解析の時点で、独立モニタリング委員会が主要評価項目である全生存期間の改善を確認(p値が中間解析時点での有意水準である0.01058を下回った)したため、今回の報告が最終結果報告となる。CnP群はDTX群に対して有意な生存期間延長効果を示した(生存期間中央値はCnP群16.9ヶ月(95%信頼区間12.6-25.4)、DTX群10.9ヶ月(95%信頼区間8.5-12.4)、ハザード比0.52(95%信頼区間0.38-0.70)、p=0.0003)。無増悪生存期間においても、CnP群はDTX群と比較して有意に良好だった(無増悪生存期間中央値はCnP群5.8ヶ月(95%信頼区間4.5-7.0)、DTX群4.0ヶ月(95%信頼区間3.0-4.4)、ハザード比0.42(95%信頼区間0.38-0.58)、p<0.0001)。全生存期間、無増悪生存期間ともに75歳未満、75歳以上、男性、女性、PS 0、PS 1、IIIB期、IV期、術後再発のいずれのサブグループでもCnP群が優位だった。同様に奏効割合でもCnP群はDTXと比較して有意に良好だった(66.3%(95%信頼区間55.7-75.8) vs 28.0%(95%信頼区間19.1-38.2)、p<0.001)。CnP群2人(2.2%)に完全奏効(CR)を認めた。後治療を受けたのは、CnP群が51人(53.7%)、DTX群が60人(61.9%)だった。後治療で化学療法を受けたのは、CnP群が14人(14.7%)、DTX群が17人(17.5%)だった。後治療で免疫チェックポイント阻害薬を投与されたのは、CnP群が43人(45.3%)、DTX群が44人(45.4%)だった。Grade 3/4の主な有害事象はCnP群では白血球減少(46.3%)、好中球減少(63.2%)、貧血(38.9%)で、DTX群では白血球減少(56.7%)、好中球減少(77.3%)、発熱性好中球減少(17.5%)だった。特記すべき他の有害事象として、Grade2以上の末梢神経障害がCnP群のうち15人(15.8%)、DTX群の1人(1.0%)で認められた。さらには、重篤な治療関連有害事象がCnP群の14人(14.7%)、DTX群の12人(12.4%)に認められ、治療関連死はCnP群で2人、DTX群で1人発生した。
結論:
高齢者の進行肺扁平上皮がん患者において、カルボプラチン+ナブパクリタキセル併用療法はドセタキセル単剤療法に対して有意に生存期間を改善した。カルボプラチン+ナブパクリタキセル併用療法は本患者群における新たな標準治療である。
その最たるものがこのCAPITAL試験ではないだろうか。
これだけ明らかな差がつくと、この患者集団にCBDCA+nabPTX併用療法を使用しないのは、倫理的に問題があると言っていいくらいだろう。
あとは、免疫チェックポイント阻害薬とどう使い分けるか、あるいはどう併用するかという問題だろう。
A randomized phase III study comparing carboplatin with nab-paclitaxel versus docetaxel for elderly patients with squamous-cell lung cancer: Capital study.
Yoichiro Hamamoto et al., 2021 ASCO Annual Meeting abst.#9031
背景:
細胞障害性抗腫瘍薬単剤療法は高齢の進行非小細胞肺がん患者に対する標準治療のひとつである。進行肺扁平上皮癌の患者に対するカルボプラチン+ナブパクリタキセル(CBDCA+nabPTX)併用療法は、カルボプラチン+パクリタキセル(CBDCA+PTX)併用療法と比較して有意に奏効割合が高く、70歳以上の患者サブグループでは全生存期間の延長も見込まれた。今回、高齢の進行肺扁平上皮癌の患者を対象に、CBDCA+nabPTX併用療法とドセタキセル(DTX)単剤療法を比較した。
方法:
CAPITAL試験は多施設共同、オープンラベル、第III相ランダム化比較試験であり、日本国内の92施設が参加した。適格条件は以下の通りとした:未治療進行肺扁平上皮癌患者、70歳以上、ECOG-PS 0-1。対象患者はDTX群(DTX 60mg/㎡を3週ごと)もしくはCnP群(CBDCA 6AUCを3週ごと、nabPTX 100mg/㎡を毎週)に1:1の割合で割り付けられた。層別化因子は年齢(75歳未満と75歳以上)、性別、ECOG-PS、治療施設、臨床病期(III期とIV期)、測定可能病変の有無だった。主要評価項目は全生存期間とした。副次評価項目は奏効割合、無増悪生存期間、安全性とした。
結果:
2015年12月から2020年08月にかけて、196人の患者が無作為割り付けを受けた(D群98人、CnP群98人)。追跡期間中央値は11.5ヶ月だった。患者年齢の中央値は76歳(70-88歳)だった。全体の87%は男性だった。各群における患者背景は、年齢中央値がDTX群77歳(70-88)、CnP群76歳(70-87)、男性がDTX群87.6%、CnP群86.3%、PS 0はDTX群32.0%、CnP群34.7%、IV期はDTX群70.1%、CnP群71.6%、免疫チェックポイント阻害薬の投与歴があったのはDTX群9.3%、CnP群9.5%だった。あらかじめ規定されていた2020年08月の中間解析の時点で、独立モニタリング委員会が主要評価項目である全生存期間の改善を確認(p値が中間解析時点での有意水準である0.01058を下回った)したため、今回の報告が最終結果報告となる。CnP群はDTX群に対して有意な生存期間延長効果を示した(生存期間中央値はCnP群16.9ヶ月(95%信頼区間12.6-25.4)、DTX群10.9ヶ月(95%信頼区間8.5-12.4)、ハザード比0.52(95%信頼区間0.38-0.70)、p=0.0003)。無増悪生存期間においても、CnP群はDTX群と比較して有意に良好だった(無増悪生存期間中央値はCnP群5.8ヶ月(95%信頼区間4.5-7.0)、DTX群4.0ヶ月(95%信頼区間3.0-4.4)、ハザード比0.42(95%信頼区間0.38-0.58)、p<0.0001)。全生存期間、無増悪生存期間ともに75歳未満、75歳以上、男性、女性、PS 0、PS 1、IIIB期、IV期、術後再発のいずれのサブグループでもCnP群が優位だった。同様に奏効割合でもCnP群はDTXと比較して有意に良好だった(66.3%(95%信頼区間55.7-75.8) vs 28.0%(95%信頼区間19.1-38.2)、p<0.001)。CnP群2人(2.2%)に完全奏効(CR)を認めた。後治療を受けたのは、CnP群が51人(53.7%)、DTX群が60人(61.9%)だった。後治療で化学療法を受けたのは、CnP群が14人(14.7%)、DTX群が17人(17.5%)だった。後治療で免疫チェックポイント阻害薬を投与されたのは、CnP群が43人(45.3%)、DTX群が44人(45.4%)だった。Grade 3/4の主な有害事象はCnP群では白血球減少(46.3%)、好中球減少(63.2%)、貧血(38.9%)で、DTX群では白血球減少(56.7%)、好中球減少(77.3%)、発熱性好中球減少(17.5%)だった。特記すべき他の有害事象として、Grade2以上の末梢神経障害がCnP群のうち15人(15.8%)、DTX群の1人(1.0%)で認められた。さらには、重篤な治療関連有害事象がCnP群の14人(14.7%)、DTX群の12人(12.4%)に認められ、治療関連死はCnP群で2人、DTX群で1人発生した。
結論:
高齢者の進行肺扁平上皮がん患者において、カルボプラチン+ナブパクリタキセル併用療法はドセタキセル単剤療法に対して有意に生存期間を改善した。カルボプラチン+ナブパクリタキセル併用療法は本患者群における新たな標準治療である。
2021年06月16日
第III相J-AXEL試験・・・既治療進行非小細胞肺がんに対するnab-PTXの効果
少し昔の話になるが、
「既治療進行・再発非小細胞肺がんに対するドセタキセルとnab-PTXのランダム化比較第III相試験(J-AXEL試験)」
の結果が2020年の第61回日本肺癌学会総会で公表されていたので、概要を振り返る。
ネーミング的に、日本人ALK融合遺伝子陽性患者に対するアレクチニブの有効性を検証したJ-ALEX試験と紛らわしい。
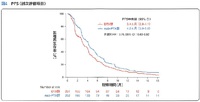
全生存期間はnab-PTXで16.2ヶ月(DTXで13.6ヶ月)、無増悪生存期間はnab-PTXで4.2ヶ月(DTXで3.4ヶ月)、奏効割合はnab-PTXで29.9%(DTXで15.4%)、Grade 3以上の発熱性好中球減少はnab-PTXで0.7%(DTXで18.1%)で、どの要素をとってもnab-PTXが優れていると言ってよい。
不利な点は、延々と毎週点滴に通わなければならないという点、PTXほどでないとはいえ、末梢神経障害がほぼ半数と高率に認められる、ということである。
病院へのアクセスが悪い患者(郊外から都市部の病院に通う患者、体が不自由な患者など)にとっては毎週点滴通いは負担だろう。
背景:
既治療進行非小細胞肺がん患者に対する新たな標準治療確立を目的とし、ドセタキセル(DTX)単剤療法に対するnab-PTX単剤療法の有効性、安全性を検証するランダム化比較第III相試験を実施した。

方法:
前治療2レジメン以内の既治療進行非小細胞肺がん、20歳以上、PS 0-1の患者をnab-PTX群(3週間おきに1日目、8日目、15日目に100mg/m2を投与)もしくはDTX群(3週おきに60mg/m2を投与)に1:1の割合で無作為に割り付けた。EGFR遺伝子変異陽性/ALK融合遺伝子陽性患者については、TKI治療が終了していることを参加の条件とした(EGFR-TKI、ALK-TKI、免疫チェックポイント阻害薬の使用はレジメン数に加えないと規定した)。層別化因子は、性別、PS、臨床病期、組織型、EGFR遺伝子変異の有無、前治療レジメン数、免疫チェックポイント阻害薬治療歴だった。主要評価項目は全生存期間とし、nab-PTXのDTXに対する非劣勢を検証することにした。非劣勢マージンの上限はハザード比1.25とし、非劣勢が証明された場合には優越性を検証することとした。副次評価項目として、無増悪生存期間、奏効割合、有害事象発生割合、QoLを副次評価項目とした。
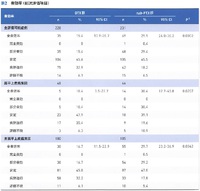
結果:
2015年05月から2018年03月の期間に、82施設から503人が登録された。男性が348人(69.2%)、非扁平上皮がんが403人(80.1%)、EGFR遺伝子変異陽性が115人(22.9%)、免疫チェックポイント阻害薬での前治療歴ありが68人(13.5%)だった。DTX群に251人(投与を受けたのは249人)、nab-PTX群に252人(投与を受けたのは245人)が割り付けられ、両群間の患者背景に差はなかった。最終カットオフ時点は2020年3月だった。OS中央値はDTX群が13.6ヶ月(95%信頼区間10.9-16.5)、nab-PTX群が16.2ヶ月(95%信頼区間14.4-19.0)、2年OS割合はDTX群が30.5%(95%信頼区間24.9-36.2)、nab-PTX群が34.3%(95%信頼区間28.5-40.2)でハザード比0.85(95.2%信頼区間0.68-1.07)だった。ハザード比の上限1.07が非劣勢マージン上限1.25を下回ったことから、非劣性が証明された。しかし、p=0.163で優越性は証明されなかった。生存曲線は、全体的にnab-PTX群が優位だった。
PFS中央値は、DTX群が3.4ヶ月(95%信頼区間2.9-4.1)、nab-PTX群が4.2ヶ月(95%信頼区間3.9-5.0)、1年PFS割合はDTX群が8.4%(95%信頼区間5.2-12.6)、nab-PTX群が12.2%(95%信頼区間8.3-16.9)でハザード比0.76(95%信頼区間0.63-0.92)、p=0.0042で有意にnab-PTX群で延長していた。nab-PTX群のPFS延長効果はどの組織型でも維持されていた。OSのハザード比0.85はドセタキセル+ラムシルマブによるREVEL試験の0.86、PFSのハザード比0.76はREVEL試験の0.76と同等だった。
奏効割合は、DTX群が15.4%(95%信頼区間10.9-20.7)、nab-PTX群が29.9%(95%信頼区間24.0-36.2)で有意にnab-PTX群が高かった(p=0.0002)。組織型別でも同様だった。 有害事象は、Grade 3以上の発熱性好中球減少症は有意にDTX群で多く(18.1% vs 0.7%)、末梢神経障害は有意にnab-PTX群で多かった(47.3% vs 15.5%)。






「既治療進行・再発非小細胞肺がんに対するドセタキセルとnab-PTXのランダム化比較第III相試験(J-AXEL試験)」
の結果が2020年の第61回日本肺癌学会総会で公表されていたので、概要を振り返る。
ネーミング的に、日本人ALK融合遺伝子陽性患者に対するアレクチニブの有効性を検証したJ-ALEX試験と紛らわしい。
全生存期間はnab-PTXで16.2ヶ月(DTXで13.6ヶ月)、無増悪生存期間はnab-PTXで4.2ヶ月(DTXで3.4ヶ月)、奏効割合はnab-PTXで29.9%(DTXで15.4%)、Grade 3以上の発熱性好中球減少はnab-PTXで0.7%(DTXで18.1%)で、どの要素をとってもnab-PTXが優れていると言ってよい。
不利な点は、延々と毎週点滴に通わなければならないという点、PTXほどでないとはいえ、末梢神経障害がほぼ半数と高率に認められる、ということである。
病院へのアクセスが悪い患者(郊外から都市部の病院に通う患者、体が不自由な患者など)にとっては毎週点滴通いは負担だろう。
背景:
既治療進行非小細胞肺がん患者に対する新たな標準治療確立を目的とし、ドセタキセル(DTX)単剤療法に対するnab-PTX単剤療法の有効性、安全性を検証するランダム化比較第III相試験を実施した。

方法:
前治療2レジメン以内の既治療進行非小細胞肺がん、20歳以上、PS 0-1の患者をnab-PTX群(3週間おきに1日目、8日目、15日目に100mg/m2を投与)もしくはDTX群(3週おきに60mg/m2を投与)に1:1の割合で無作為に割り付けた。EGFR遺伝子変異陽性/ALK融合遺伝子陽性患者については、TKI治療が終了していることを参加の条件とした(EGFR-TKI、ALK-TKI、免疫チェックポイント阻害薬の使用はレジメン数に加えないと規定した)。層別化因子は、性別、PS、臨床病期、組織型、EGFR遺伝子変異の有無、前治療レジメン数、免疫チェックポイント阻害薬治療歴だった。主要評価項目は全生存期間とし、nab-PTXのDTXに対する非劣勢を検証することにした。非劣勢マージンの上限はハザード比1.25とし、非劣勢が証明された場合には優越性を検証することとした。副次評価項目として、無増悪生存期間、奏効割合、有害事象発生割合、QoLを副次評価項目とした。
結果:
2015年05月から2018年03月の期間に、82施設から503人が登録された。男性が348人(69.2%)、非扁平上皮がんが403人(80.1%)、EGFR遺伝子変異陽性が115人(22.9%)、免疫チェックポイント阻害薬での前治療歴ありが68人(13.5%)だった。DTX群に251人(投与を受けたのは249人)、nab-PTX群に252人(投与を受けたのは245人)が割り付けられ、両群間の患者背景に差はなかった。最終カットオフ時点は2020年3月だった。OS中央値はDTX群が13.6ヶ月(95%信頼区間10.9-16.5)、nab-PTX群が16.2ヶ月(95%信頼区間14.4-19.0)、2年OS割合はDTX群が30.5%(95%信頼区間24.9-36.2)、nab-PTX群が34.3%(95%信頼区間28.5-40.2)でハザード比0.85(95.2%信頼区間0.68-1.07)だった。ハザード比の上限1.07が非劣勢マージン上限1.25を下回ったことから、非劣性が証明された。しかし、p=0.163で優越性は証明されなかった。生存曲線は、全体的にnab-PTX群が優位だった。
PFS中央値は、DTX群が3.4ヶ月(95%信頼区間2.9-4.1)、nab-PTX群が4.2ヶ月(95%信頼区間3.9-5.0)、1年PFS割合はDTX群が8.4%(95%信頼区間5.2-12.6)、nab-PTX群が12.2%(95%信頼区間8.3-16.9)でハザード比0.76(95%信頼区間0.63-0.92)、p=0.0042で有意にnab-PTX群で延長していた。nab-PTX群のPFS延長効果はどの組織型でも維持されていた。OSのハザード比0.85はドセタキセル+ラムシルマブによるREVEL試験の0.86、PFSのハザード比0.76はREVEL試験の0.76と同等だった。
奏効割合は、DTX群が15.4%(95%信頼区間10.9-20.7)、nab-PTX群が29.9%(95%信頼区間24.0-36.2)で有意にnab-PTX群が高かった(p=0.0002)。組織型別でも同様だった。 有害事象は、Grade 3以上の発熱性好中球減少症は有意にDTX群で多く(18.1% vs 0.7%)、末梢神経障害は有意にnab-PTX群で多かった(47.3% vs 15.5%)。








2021年06月15日
WJOG8515L・・・EGFR-TKIを使いつくした後に、ニボルマブは使えるのか?
EGFR遺伝子変異陽性患者でも、免疫チェックポイント阻害薬が効く人には効く。
とは言え、全生存期間は同等、無増悪生存期間はおしなべて短縮される、となると、なかなか使い方が難しい。
簡単にコンセプトをまとめると、EGFR遺伝子変異陽性進行非小細胞肺がんに対して、オシメルチニブを含めたEGFRチロシンキナーゼ阻害薬がこれ以上使えない、となったとき、次治療として免疫チェックポイント阻害薬がいいのか、プラチナ併用化学療法がいいのかを見る試験。
この患者集団では、一般に免疫チェックポイント阻害薬の効果は期待しがたい上、免疫チェックポイント阻害薬使用後にEGFRチロシンキナーゼ阻害薬を使用すると高率に薬剤性肺障害に見舞われると考えられてきた。
全生存期間は同等で、一部の患者ではニボルマブの長期にわたる有効性が認められたということで、免疫チェックポイント阻害薬を使う選択肢も残しておくべきだ、というのが学ぶべき点なのだろう。
A randomized phase II study comparing nivolumab (NIVO) with carboplatin-pemetrexed (CbPEM) for patients (pts) with EGFR mutation-positive non-small cell lung cancer (NSCLC) who acquire resistance to tyrosine kinase inhibitors (TKIs) not due to a secondary T790M mutation (WJOG8515L).
Hidetoshi Hayashi et al., 2021 ASCO Annual Meeting abst.#9037
背景:
EGFR遺伝子変異陽性非小細胞肺癌に対する抗PD-1抗体の有効性についてはあまり言及されていないが、こうした患者に対するEGFRチロシンキナーゼ阻害薬使用後に、T790M耐性変異以外のメカニズムで病勢進行に至った場合には、ニボルマブの効果が得られるかもしれない。こうした患者を対象として、ニボルマブ単剤療法とカルボプラチン+ペメトレキセド併用療法を比較したランダム化第II相試験を行ったので報告する。
方法:
EGFR遺伝子変異陽性進行非小細胞肺がん患者で、EGFRチロシンキナーゼ阻害薬使用後に病勢進行に至った者を対象として、ニボルマブ単剤療法(N)群とカルボプラチン+ペメトレキセド併用療法(CP)群に1:1の割合で無作為に割り付けた。患者適格性の条件として、EGFRチロシンキナーゼ阻害薬による治療歴を考慮した。すなわち、コホートA:第1世代もしくは第2世代EGFRチロシンキナーゼ阻害薬使用後に病勢進行に至り、T790M耐性変異を認めなかったもの、コホートB:T790M耐性変異陽性が確認されたのちに二次治療として第3世代EGFRチロシンキナーゼ阻害薬を使用し、その後に病勢進行に至ったもの、コホートC:初回治療として第3世代EGFRチロシンキナーゼ阻害薬を使用したもの、とした。(早い話が、もうEGFRチロシンキナーゼ阻害薬を使うチャンスがない患者ということ)。主要評価項目は無増悪生存期間(PFS)で、副次評価項目は全生存期間(OS)、奏効割合、奏効持続期間、PD-L1発現割合別のOSとPFS、安全性だった。探索的解析にはバイオマーカーの解析も加えた。
結果:
計102人の患者を無作為割り付け(N群52人、CP群50人)した。PFS中央値はN群1.7ヶ月(95%信頼区間1.3-2.3)、CP群5.6ヶ月(95%信頼区間3.2-6.8)で、ハザード比1.92(95%信頼区間:1.27-2.90)、p=0.008でN群が有意に短かった。 OS中央値はN群20.7ヶ月(95%信頼区間15.2-28.0)、CP群19.9ヶ月(95%信頼区間12.2-22.6)で、ハザード比0.88、p=0.517で有意差はつかなかった。N群における奏効割合は9.6%、奏効持続期間中央値は5.3ヶ月(95%信頼区間4.6ヶ月-未到達)で、CP群における奏効割合は36.0%、奏効持続期間中央値は5.5ヶ月(95%信頼区間2.9-8.0)だった。腫瘍細胞のPD-L1発現解析は77人に対して(TPS 0%は46人、1-49%は20人、50%以上は11人)行われ、tumor mutation burden(TMB)は50人に対して行われた(TMB中央値は6.2mt/mb)。N群で遺伝子発現解析を行ったところ、ニボルマブが効果を示した患者で細胞障害性T細胞(CTL)関連遺伝子の発現上昇が認められ、ニボルマブが効果を示さなかった患者で血管新生とEGFRに関連した遺伝子の発現上昇があった。また、ニボルマブ投与で6ヶ月超のPFSが得られた患者では、CD8陽性T細胞を遊走させるケモカインと細胞溶解性遺伝子の発現上昇が認められた。PD-L1発現≧50%の患者(8人)とコホートAの患者(29人)では、CP群よりもN群の方が治療効果良好だった。TMBとニボルマブによる治療効果の間には有意な相関は見られなかった。N群のうち1人(1.0%)に肺臓炎が発生した。
結論:
今回対象となった患者集団において、ニボルマブ単剤療法は無増悪生存期間を延長しなかった。全生存期間はニボルマブ単剤療法とカルボプラチン+ペメトレキセド併用療法で同等だった。PD-L1発現状態と遺伝子発現状態がニボルマブ単剤療法の効果予測因子となる可能性が示唆された。
とは言え、全生存期間は同等、無増悪生存期間はおしなべて短縮される、となると、なかなか使い方が難しい。
簡単にコンセプトをまとめると、EGFR遺伝子変異陽性進行非小細胞肺がんに対して、オシメルチニブを含めたEGFRチロシンキナーゼ阻害薬がこれ以上使えない、となったとき、次治療として免疫チェックポイント阻害薬がいいのか、プラチナ併用化学療法がいいのかを見る試験。
この患者集団では、一般に免疫チェックポイント阻害薬の効果は期待しがたい上、免疫チェックポイント阻害薬使用後にEGFRチロシンキナーゼ阻害薬を使用すると高率に薬剤性肺障害に見舞われると考えられてきた。
全生存期間は同等で、一部の患者ではニボルマブの長期にわたる有効性が認められたということで、免疫チェックポイント阻害薬を使う選択肢も残しておくべきだ、というのが学ぶべき点なのだろう。
A randomized phase II study comparing nivolumab (NIVO) with carboplatin-pemetrexed (CbPEM) for patients (pts) with EGFR mutation-positive non-small cell lung cancer (NSCLC) who acquire resistance to tyrosine kinase inhibitors (TKIs) not due to a secondary T790M mutation (WJOG8515L).
Hidetoshi Hayashi et al., 2021 ASCO Annual Meeting abst.#9037
背景:
EGFR遺伝子変異陽性非小細胞肺癌に対する抗PD-1抗体の有効性についてはあまり言及されていないが、こうした患者に対するEGFRチロシンキナーゼ阻害薬使用後に、T790M耐性変異以外のメカニズムで病勢進行に至った場合には、ニボルマブの効果が得られるかもしれない。こうした患者を対象として、ニボルマブ単剤療法とカルボプラチン+ペメトレキセド併用療法を比較したランダム化第II相試験を行ったので報告する。
方法:
EGFR遺伝子変異陽性進行非小細胞肺がん患者で、EGFRチロシンキナーゼ阻害薬使用後に病勢進行に至った者を対象として、ニボルマブ単剤療法(N)群とカルボプラチン+ペメトレキセド併用療法(CP)群に1:1の割合で無作為に割り付けた。患者適格性の条件として、EGFRチロシンキナーゼ阻害薬による治療歴を考慮した。すなわち、コホートA:第1世代もしくは第2世代EGFRチロシンキナーゼ阻害薬使用後に病勢進行に至り、T790M耐性変異を認めなかったもの、コホートB:T790M耐性変異陽性が確認されたのちに二次治療として第3世代EGFRチロシンキナーゼ阻害薬を使用し、その後に病勢進行に至ったもの、コホートC:初回治療として第3世代EGFRチロシンキナーゼ阻害薬を使用したもの、とした。(早い話が、もうEGFRチロシンキナーゼ阻害薬を使うチャンスがない患者ということ)。主要評価項目は無増悪生存期間(PFS)で、副次評価項目は全生存期間(OS)、奏効割合、奏効持続期間、PD-L1発現割合別のOSとPFS、安全性だった。探索的解析にはバイオマーカーの解析も加えた。
結果:
計102人の患者を無作為割り付け(N群52人、CP群50人)した。PFS中央値はN群1.7ヶ月(95%信頼区間1.3-2.3)、CP群5.6ヶ月(95%信頼区間3.2-6.8)で、ハザード比1.92(95%信頼区間:1.27-2.90)、p=0.008でN群が有意に短かった。 OS中央値はN群20.7ヶ月(95%信頼区間15.2-28.0)、CP群19.9ヶ月(95%信頼区間12.2-22.6)で、ハザード比0.88、p=0.517で有意差はつかなかった。N群における奏効割合は9.6%、奏効持続期間中央値は5.3ヶ月(95%信頼区間4.6ヶ月-未到達)で、CP群における奏効割合は36.0%、奏効持続期間中央値は5.5ヶ月(95%信頼区間2.9-8.0)だった。腫瘍細胞のPD-L1発現解析は77人に対して(TPS 0%は46人、1-49%は20人、50%以上は11人)行われ、tumor mutation burden(TMB)は50人に対して行われた(TMB中央値は6.2mt/mb)。N群で遺伝子発現解析を行ったところ、ニボルマブが効果を示した患者で細胞障害性T細胞(CTL)関連遺伝子の発現上昇が認められ、ニボルマブが効果を示さなかった患者で血管新生とEGFRに関連した遺伝子の発現上昇があった。また、ニボルマブ投与で6ヶ月超のPFSが得られた患者では、CD8陽性T細胞を遊走させるケモカインと細胞溶解性遺伝子の発現上昇が認められた。PD-L1発現≧50%の患者(8人)とコホートAの患者(29人)では、CP群よりもN群の方が治療効果良好だった。TMBとニボルマブによる治療効果の間には有意な相関は見られなかった。N群のうち1人(1.0%)に肺臓炎が発生した。
結論:
今回対象となった患者集団において、ニボルマブ単剤療法は無増悪生存期間を延長しなかった。全生存期間はニボルマブ単剤療法とカルボプラチン+ペメトレキセド併用療法で同等だった。PD-L1発現状態と遺伝子発現状態がニボルマブ単剤療法の効果予測因子となる可能性が示唆された。
2021年06月14日
J-ALEX試験最終解析・・・ありがちな結論だけどやっぱりすごい。
ALK融合遺伝子陽性の進行非小細胞肺がんを見たら、何はともあれアレクチニブ。
それさえ守れば、5年生存割合は60%を超える。
分子標的薬に関連した臨床試験でクロスオーバーを許容すると、全生存期間に差が出なくなるという典型的な成り行き。
何はともあれ、はっきりわかったのはアレクチニブが無増悪生存期間を延長すること、クリゾチニブ後の病勢進行時にアレクチニブを使っても、全生存期間を同等に持っていくだけのポテンシャルがあることだろう。
全生存期間が同等なら、治療開始からの無増悪生存期間が長い分だけQoLが良いはずで、アレクチニブの優位性に変わりはない。
Final OS analysis from the phase III j-alex study of alectinib (ALC) versus crizotinib (CRZ) in Japanese ALK-inhibitor naïve ALK-positive non-small cell lung cancer (ALK+ NSCLC).
Hiroshige Yoshioka et al., 2021 ASCO Annual Meeting abst.#9022
背景:
日本人ALK融合遺伝子陽性非小細胞肺がんに対するALK阻害薬の有効性を検証したJ-ALEX試験の主解析において、アレクチニブはクリゾチニブに対して無増悪生存期間を延長した(ハザード比0.34、99.7%信頼区間0.17-0.71、層別化ログランク解析でp<0.0001)(Hida et al., Lancet 2017)。無増悪生存期間の最終解析結果と、全生存期間の第二次中間解析結果も報告されている(Nakagawa et al., Lung Cancer 2020)。今回は、全生存期間解析の最終結果を報告する。
方法:
ALK融合遺伝子陽性(免疫染色、FISH、RT-PCRのいずれかの手法で確認)非小細胞肺がん患者をA群(アレクチニブ300mg/日、103人)とC群(クリゾチニブ250mg/日、104人)に1:1の割合で無作為割り付けした。層別化因子はECOG-PS、治療ライン数、臨床病期とした。主要評価項目は委員会判定による無増悪生存期間とした。副次評価項目は全生存期間、奏効割合、安全性とした。
結果:
追跡期間中央値はA群で68.6ヶ月、C群で68.0ヶ月だった。患者の死亡イベントはA群の40.8%、C群の39.4%で発生した。5年生存割合はA群で60.85%、C群で64.11%だった。全生存期間に関するハザード比は1.03(95%信頼区間0.67-1.58)で、生存期間は両群ともに中央値に達していなかった。特筆すべき点として、C群の方がA群よりも早期に治療変更される傾向にあった(治療変更までの期間の中央値はA群で未到達(95%信頼区間42.8ヶ月-未到達)、C群で12.3ヶ月(95%信頼区間8.7-14.6))。C群の患者の大多数(78.8%)はクリゾチニブ中止後の次治療としてアレクチニブを使用しており、その一方でA群の患者ではわずか10.7%がアレクチニブ中止後の次治療としてクリゾチニブを使用していたに過ぎなかった。次治療の開始からの全生存期間中央値は、A群が24.3ヶ月(95%信頼区間15.4-45.6)、C群が未到達(95%信頼区間49.8ヶ月-未到達)だった。
結論:
J-ALEX試験最終解析の結果、C群に対するA群の全生存期間延長は認められなかった。しかしながら、C群の患者のうち78.8%もの患者がクリゾチニブの次治療でアレクチニブを使用していることが交絡要素になっているのかもしれない。
それさえ守れば、5年生存割合は60%を超える。
分子標的薬に関連した臨床試験でクロスオーバーを許容すると、全生存期間に差が出なくなるという典型的な成り行き。
何はともあれ、はっきりわかったのはアレクチニブが無増悪生存期間を延長すること、クリゾチニブ後の病勢進行時にアレクチニブを使っても、全生存期間を同等に持っていくだけのポテンシャルがあることだろう。
全生存期間が同等なら、治療開始からの無増悪生存期間が長い分だけQoLが良いはずで、アレクチニブの優位性に変わりはない。
Final OS analysis from the phase III j-alex study of alectinib (ALC) versus crizotinib (CRZ) in Japanese ALK-inhibitor naïve ALK-positive non-small cell lung cancer (ALK+ NSCLC).
Hiroshige Yoshioka et al., 2021 ASCO Annual Meeting abst.#9022
背景:
日本人ALK融合遺伝子陽性非小細胞肺がんに対するALK阻害薬の有効性を検証したJ-ALEX試験の主解析において、アレクチニブはクリゾチニブに対して無増悪生存期間を延長した(ハザード比0.34、99.7%信頼区間0.17-0.71、層別化ログランク解析でp<0.0001)(Hida et al., Lancet 2017)。無増悪生存期間の最終解析結果と、全生存期間の第二次中間解析結果も報告されている(Nakagawa et al., Lung Cancer 2020)。今回は、全生存期間解析の最終結果を報告する。
方法:
ALK融合遺伝子陽性(免疫染色、FISH、RT-PCRのいずれかの手法で確認)非小細胞肺がん患者をA群(アレクチニブ300mg/日、103人)とC群(クリゾチニブ250mg/日、104人)に1:1の割合で無作為割り付けした。層別化因子はECOG-PS、治療ライン数、臨床病期とした。主要評価項目は委員会判定による無増悪生存期間とした。副次評価項目は全生存期間、奏効割合、安全性とした。
結果:
追跡期間中央値はA群で68.6ヶ月、C群で68.0ヶ月だった。患者の死亡イベントはA群の40.8%、C群の39.4%で発生した。5年生存割合はA群で60.85%、C群で64.11%だった。全生存期間に関するハザード比は1.03(95%信頼区間0.67-1.58)で、生存期間は両群ともに中央値に達していなかった。特筆すべき点として、C群の方がA群よりも早期に治療変更される傾向にあった(治療変更までの期間の中央値はA群で未到達(95%信頼区間42.8ヶ月-未到達)、C群で12.3ヶ月(95%信頼区間8.7-14.6))。C群の患者の大多数(78.8%)はクリゾチニブ中止後の次治療としてアレクチニブを使用しており、その一方でA群の患者ではわずか10.7%がアレクチニブ中止後の次治療としてクリゾチニブを使用していたに過ぎなかった。次治療の開始からの全生存期間中央値は、A群が24.3ヶ月(95%信頼区間15.4-45.6)、C群が未到達(95%信頼区間49.8ヶ月-未到達)だった。
結論:
J-ALEX試験最終解析の結果、C群に対するA群の全生存期間延長は認められなかった。しかしながら、C群の患者のうち78.8%もの患者がクリゾチニブの次治療でアレクチニブを使用していることが交絡要素になっているのかもしれない。
2021年06月13日
IMpower010試験・・・術後補助化学療法におけるアテゾリズマブ
II-IIIA期の完全切除後非小細胞肺がんに対し、プラチナ併用術後補助化学療法の後にアテゾリズマブを約1年間投与することで、無病生存期間が有意に改善するとのこと。
全生存期間に反映されるかどうかはまだわからない(少なくとも、本試験で全生存期間の統計学的延長が示されても試験デザイン上は参考データでしかない)が、無病生存期間が7ヶ月延長するというのは、意味のある結果と考えていいだろう。
IB期ならUFT、II-III期ならシスプラチン+ビノレルビン(非扁平上皮がんならペメトレキセドもありか?)併用術後補助化学療法と、それに引き続くアテゾリズマブ1年間投与が我が国における今後の標準治療となるのだろうか。
理由はわからないが、相変わらずアテゾリズマブ関連の臨床試験の統計学的処理はトリッキーである。
ある程度治療対象や評価項目を絞り込んででも、なんとか薬事承認のバックグラウンドになるようなpositive dataを捻出しよう、という製薬会社及び規制当局の意図の表れなのだろう。
IMpower010: Primary results of a phase III global study of atezolizumab versus best supportive care after adjuvant chemotherapy in resected stage IB-IIIA non-small cell lung cancer (NSCLC).
Heather A. Wakelee et al., 2021 ASCO Annual Meeting abst.#8500
背景:
再発リスクの高い早期非小細胞肺がん完全切除後のプラチナ併用術後補助化学療法は、そこそこの5年生存割合延長効果しかもたらさない。今回は、完全切除後の早期非小細胞肺がんに対して術後補助化学療法を行った後、引き続いてアテゾリズマブを投与するか経過観察とするかを比較するオープンラベル第III相臨床試験であるIMpower010試験について、あらかじめ規定されていた中間解析における無病生存期間の結果について報告する。
方法:
AJCC/UICC第7版基準における病理病期IB期(腫瘍長径≧4cm)-IIIA期の(臨床試験登録前4-12週間の間に)完全切除された非小細胞肺がんで、ECOG-PS 0-1の患者を登録対象とした。対象患者にはEGFR遺伝子変異陽性患者も含んでいた。1,280人の患者が登録され、1,269人が最大4コース、21日間隔のプラチナ併用術後補助化学療法(併用薬はペメトレキセド、ドセタキセル、ジェムシタビン、ビノレルビンのいずれか)を受けた。この1,269人のうち、1,005人が無作為割付の対象となった。Atezo群(アテゾリズマブ1,200mgを3週ごとに16コース)とBSC群(無治療経過観察)に1:1の割合で割り付けられた。主要評価項目である治療担当者評価による無病生存期間(DFS)、副次評価項目である全生存期間は以下の順序に従って階層的に検証された(有意差が認められなければ以後の階層の評価項目は無効とした):①SP263抗体を用いた評価による腫瘍細胞のPD-L1発現割合≧1%かつ病理病期II-IIIA期の患者サブグループにおけるDFS、②全ての病理病期II-IIIA期の患者サブグループにおけるDFS、③全対象患者のITT解析によるDFS、④全対象患者のITT解析によるOS。有効性の評価は無作為割付された患者全員を対象とし、安全性の評価は、Atezo群ではアテゾリズマブの投与を1コース以上受けた患者とし、BSC群では無作為割付後1度以上安全性評価を受けた患者とした。
結果:
2,021年1月21日のデータカットオフ時点で、ITT集団の追跡期間中央値は32.2ヶ月だった。患者背景は両治療群間で差を認めなかった。年齢中央値は62歳(26-84)、非扁平上皮癌が65.6%、IB期が12.2%、腫瘍細胞のPD-L1発現≧1%が54.6%であり、EGFR変異陽性患者が11.6%含まれていた。Atezo群では、①および②の患者集団で有意にDFSを延長していた。
①PD-L1陽性腫瘍細胞≧1%かつ病理病期II期-IIIA期の患者において、Atezo群(248人)のDFS中央値は未到達(95%信頼区間36.1ヶ月-未到達)、BSC群(228人)のDFS中央値は35.3カ月(95%信頼区間29.0ヶ月-未到達)で、ハザード比0.66(95%信頼区間0.50-0.88、p=0.004)、p=0.004だった。このサブグループにおける24ヶ月DFS割合はAtezo群が74.6%、BSC群が61.0%、36ヶ月DFS割合はAtezo群が60.0%、BSC群が48.2%だった。
②全ての病理病期II-IIIA期の患者において、Atezo群(442人)のDFS中央値は42.3ヶ月(95%信頼区間36.0ヶ月-未到達)、BSC群(440人)のDFS中央値は35.3ヶ月(95%信頼区間30.4-46.4)で、ハザード比0.79(95%信頼区間0.64-0.96、p=0.02)で有意にAtezo群で延長していた。このサブグループにおける24ヶ月DFS割合はAtezo群で70.2%、BSC群で61.6%、36ヶ月DFS割合はAtezo群で55.7%、BSC群で49.4%だった。PD-L1発現状態別にみると、PD-L1発現が50%以上のハザード比は0.43、1%以上が0.66、1%未満は0.97だった。EGFR変異陽性患者のハザード比は0.99で両群間に有意差を認めなかった。
③全対象患者のITT解析では、Atezo群(507人)のDFS中央値は未到達(95%信頼区間:36.1ヶ月-未到達)、BSC群(498人)のDFS中央値は37.2ヶ月(95%信頼区間31.6ヶ月-未到達)で、ハザード比0.81(95%信頼区間:0.67-0.99、p=0.04)で、事前に規定した有意水準を満たさなかった。24ヶ月DFS割合はAtezo群で71.4%、BSC群で63.6%、36ヶ月DFS割合はAtezo群で57.9%、BSC群で52.6%だった。
④全対象患者のITT解析では、全生存期間解析に十分なイベントはまだ発生していなかった。探索的な解析を行ったところ、腫瘍細胞のPD-L1発現≧1%で病理病期II期-IIIA期の患者では、ハザード比0.77(95%信頼区間:0.51-1.17)とAtezo群で良い傾向があった。]
Atezo群において、アテゾリズマブの投与コース中央値は16コース(1-16)だった。全グレードの有害事象は、Atezo群の92.7%、BSC群の70.7%に認められた。Atezo群でGrade3/4の有害事象を認めたのは21.8%、治療関連のグレード5は0.8%だった。BSC群でGrade3/4の有害事象を認めたのは11.5%だった。有害事象のためにアテゾリズマブ投与中止となったのは18.2%だった。
結論:
IMpower010試験は主要評価項目を満たし、病理病期II-IIIA期の完全切除後非小細胞肺がん患者のプラチナ併用術後補助化学療法後のアテゾリズマブ投与により無病生存期間が延長することが示された。
全生存期間に反映されるかどうかはまだわからない(少なくとも、本試験で全生存期間の統計学的延長が示されても試験デザイン上は参考データでしかない)が、無病生存期間が7ヶ月延長するというのは、意味のある結果と考えていいだろう。
IB期ならUFT、II-III期ならシスプラチン+ビノレルビン(非扁平上皮がんならペメトレキセドもありか?)併用術後補助化学療法と、それに引き続くアテゾリズマブ1年間投与が我が国における今後の標準治療となるのだろうか。
理由はわからないが、相変わらずアテゾリズマブ関連の臨床試験の統計学的処理はトリッキーである。
ある程度治療対象や評価項目を絞り込んででも、なんとか薬事承認のバックグラウンドになるようなpositive dataを捻出しよう、という製薬会社及び規制当局の意図の表れなのだろう。
IMpower010: Primary results of a phase III global study of atezolizumab versus best supportive care after adjuvant chemotherapy in resected stage IB-IIIA non-small cell lung cancer (NSCLC).
Heather A. Wakelee et al., 2021 ASCO Annual Meeting abst.#8500
背景:
再発リスクの高い早期非小細胞肺がん完全切除後のプラチナ併用術後補助化学療法は、そこそこの5年生存割合延長効果しかもたらさない。今回は、完全切除後の早期非小細胞肺がんに対して術後補助化学療法を行った後、引き続いてアテゾリズマブを投与するか経過観察とするかを比較するオープンラベル第III相臨床試験であるIMpower010試験について、あらかじめ規定されていた中間解析における無病生存期間の結果について報告する。
方法:
AJCC/UICC第7版基準における病理病期IB期(腫瘍長径≧4cm)-IIIA期の(臨床試験登録前4-12週間の間に)完全切除された非小細胞肺がんで、ECOG-PS 0-1の患者を登録対象とした。対象患者にはEGFR遺伝子変異陽性患者も含んでいた。1,280人の患者が登録され、1,269人が最大4コース、21日間隔のプラチナ併用術後補助化学療法(併用薬はペメトレキセド、ドセタキセル、ジェムシタビン、ビノレルビンのいずれか)を受けた。この1,269人のうち、1,005人が無作為割付の対象となった。Atezo群(アテゾリズマブ1,200mgを3週ごとに16コース)とBSC群(無治療経過観察)に1:1の割合で割り付けられた。主要評価項目である治療担当者評価による無病生存期間(DFS)、副次評価項目である全生存期間は以下の順序に従って階層的に検証された(有意差が認められなければ以後の階層の評価項目は無効とした):①SP263抗体を用いた評価による腫瘍細胞のPD-L1発現割合≧1%かつ病理病期II-IIIA期の患者サブグループにおけるDFS、②全ての病理病期II-IIIA期の患者サブグループにおけるDFS、③全対象患者のITT解析によるDFS、④全対象患者のITT解析によるOS。有効性の評価は無作為割付された患者全員を対象とし、安全性の評価は、Atezo群ではアテゾリズマブの投与を1コース以上受けた患者とし、BSC群では無作為割付後1度以上安全性評価を受けた患者とした。
結果:
2,021年1月21日のデータカットオフ時点で、ITT集団の追跡期間中央値は32.2ヶ月だった。患者背景は両治療群間で差を認めなかった。年齢中央値は62歳(26-84)、非扁平上皮癌が65.6%、IB期が12.2%、腫瘍細胞のPD-L1発現≧1%が54.6%であり、EGFR変異陽性患者が11.6%含まれていた。Atezo群では、①および②の患者集団で有意にDFSを延長していた。
①PD-L1陽性腫瘍細胞≧1%かつ病理病期II期-IIIA期の患者において、Atezo群(248人)のDFS中央値は未到達(95%信頼区間36.1ヶ月-未到達)、BSC群(228人)のDFS中央値は35.3カ月(95%信頼区間29.0ヶ月-未到達)で、ハザード比0.66(95%信頼区間0.50-0.88、p=0.004)、p=0.004だった。このサブグループにおける24ヶ月DFS割合はAtezo群が74.6%、BSC群が61.0%、36ヶ月DFS割合はAtezo群が60.0%、BSC群が48.2%だった。
②全ての病理病期II-IIIA期の患者において、Atezo群(442人)のDFS中央値は42.3ヶ月(95%信頼区間36.0ヶ月-未到達)、BSC群(440人)のDFS中央値は35.3ヶ月(95%信頼区間30.4-46.4)で、ハザード比0.79(95%信頼区間0.64-0.96、p=0.02)で有意にAtezo群で延長していた。このサブグループにおける24ヶ月DFS割合はAtezo群で70.2%、BSC群で61.6%、36ヶ月DFS割合はAtezo群で55.7%、BSC群で49.4%だった。PD-L1発現状態別にみると、PD-L1発現が50%以上のハザード比は0.43、1%以上が0.66、1%未満は0.97だった。EGFR変異陽性患者のハザード比は0.99で両群間に有意差を認めなかった。
③全対象患者のITT解析では、Atezo群(507人)のDFS中央値は未到達(95%信頼区間:36.1ヶ月-未到達)、BSC群(498人)のDFS中央値は37.2ヶ月(95%信頼区間31.6ヶ月-未到達)で、ハザード比0.81(95%信頼区間:0.67-0.99、p=0.04)で、事前に規定した有意水準を満たさなかった。24ヶ月DFS割合はAtezo群で71.4%、BSC群で63.6%、36ヶ月DFS割合はAtezo群で57.9%、BSC群で52.6%だった。
④全対象患者のITT解析では、全生存期間解析に十分なイベントはまだ発生していなかった。探索的な解析を行ったところ、腫瘍細胞のPD-L1発現≧1%で病理病期II期-IIIA期の患者では、ハザード比0.77(95%信頼区間:0.51-1.17)とAtezo群で良い傾向があった。]
Atezo群において、アテゾリズマブの投与コース中央値は16コース(1-16)だった。全グレードの有害事象は、Atezo群の92.7%、BSC群の70.7%に認められた。Atezo群でGrade3/4の有害事象を認めたのは21.8%、治療関連のグレード5は0.8%だった。BSC群でGrade3/4の有害事象を認めたのは11.5%だった。有害事象のためにアテゾリズマブ投与中止となったのは18.2%だった。
結論:
IMpower010試験は主要評価項目を満たし、病理病期II-IIIA期の完全切除後非小細胞肺がん患者のプラチナ併用術後補助化学療法後のアテゾリズマブ投与により無病生存期間が延長することが示された。
2021年06月12日
IMPACT / WJOG6410L試験・・・我が国発の術後補助ゲフィチニブ療法第III相試験
(2021/11/10 一部加筆修正)
EGFR遺伝子変異陽性、病理病期II-III期の完全切除後非小細胞肺がん患者を対象に、ゲフィチニブ術後補助療法の有効性を検証した第III相IMPACT / WJOG6410L試験。
以前も記事にしたが、中国初のADJUVANT / CTONG1104試験はあくまで参考とし、このIMPACT試験の結果を以て実地臨床における自分の考え方を決めようと思っていた。
ADJUVANT / CTONG1104試験
http://oitahaiganpractice.junglekouen.com/e974737.html
http://oitahaiganpractice.junglekouen.com/e919586.html
http://oitahaiganpractice.junglekouen.com/e900761.html
ADJUVANT / CTONG1104試験では、ゲフィチニブは無病生存期間を延長するが、全生存期間は延長しない、ただし生存期間中央値は少なくとも75ヶ月以上と有意義な結果を残していた。
しかし、昨年の話題をさらったADAURA試験から、本患者集団ではオシメルチニブの方がさらによい結果が予感され、EGFR遺伝子変異陽性の全ての患者集団におけるゲフィチニブ時代の終焉を思わせた。
ADAURA試験
http://oitahaiganpractice.junglekouen.com/e987128.html
http://oitahaiganpractice.junglekouen.com/e980042.html
http://oitahaiganpractice.junglekouen.com/e975874.html
それから1年経過しての、IMPACT / WJOG6410L試験の結果報告。
第III相臨床試験としての輝きは、既に失われてしまった。
数の暴力、時の流れというのは残酷極まりない。
とはいえ、我が国で行われた臨床試験において、この患者集団の術後生命予後がきちんとしたデータで示され、71ヶ月という長期追跡期間にもかかわらず全患者集団の生存期間中央値が未到達というのは、これから治療に臨む患者に勇気を与える結果だと思う。
Adjuvant gefitinib versus cisplatin/vinorelbine in Japanese patients with completely resected, EGFR-mutated, stage II-III non-small cell lung cancer (IMPACT, WJOG6410L): A randomized phase 3 trial.
Hirohito Tada, et al., ASCO 2021 abst.#8501
Randomized Phase III Study of Gefitinib Versus Cisplatin Plus Vinorelbine for Patients With Resected Stage II-IIIA Non–Small-Cell Lung Cancer With EGFR Mutation (IMPACT)
Hirohito Tada et al., J Clin Oncol 2021
DOI: 10.1200/JCO.21.01729 Journal of Clinical Oncology
背景:
上皮成長因子受容体(EGFR)チロシンキナーゼ阻害薬単剤療法はEGFR遺伝子変異陽性未治療進行非小細胞肺がんの標準治療のひとつである。しかし、EGFR遺伝子変異陽性の完全切除後非小細胞肺がん患者における術後補助療法としてのゲフィチニブの有効性と安全性はシスプラチンベースの術後化学療法と比べてどうなのか、本試験が開始された2,011年当時はまだわかっていなかった。
方法:
2,011年09月から2,015年12月にかけて、EGFR遺伝子変異(エクソン19欠失変異もしくはエクソン21L858R点突然変異)陽性、病理病期II-III期の完全切除後非小細胞肺がん患者234人を対象に、G群(ゲフィチニブ250mgを1日1回2年間内服)とVP群(シスプラチン80mg/㎡を1日目、ビノレルビン25mg/㎡を1日目、8日目に点滴投与、3週間ごと4コース)に無作為に割り付けた。主要評価項目は独立判定委員会評価によるintent-to-treat解析での無病生存期間(DFS)とした。副次評価項目は全生存期間(OS)、安全性、再発時の再発パターンとした。
結果:
G群のうち2人が臨床試験参加を撤回したため、intent-to-treat解析から除外した。G群(116人)とVP群(116人)の患者背景に差はなかった。両群とも女性が6割を占め、年齢中央値は64歳、喫煙歴がなかった人はG群で58.6%、VP群で63.8%、病理病期はIIA期がG群で31.0%、VP群で32.8%、IIIA期はG群で61.2%、VP群で62.9%だった。プロトコール治療を完遂したのはG群61.2%、VP群77.6%だった。G群では治療関連死がなかったが、VP群では3人の治療関連死(脳出血、自殺、肺炎)が発生した。追跡期間中央値は70ヶ月だった。数値上、DFSはG群で長く、G群35.9ヶ月(95%信頼区間30.0-47.7)、VP群25.2ヶ月(95%信頼区間17.7-41.8)だった。しかし、カプランマイヤー曲線は術後約4年後から交差し、統計学的な有意差を認めず、ハザード比0.92(95%信頼区間0.67-1.28、p=0.63)だった。2年DFS割合はG群63.7%、VP群52.3%、5年DFS割合はG群31.8%、VP群34.1%だった。OSも有意差がつかず、解析時点では両群ともに中央値に至っておらず、5年生存割合はG群で78.0%、VP群で74.6%、ハザード比1.03(95%信頼区間0.65-1.65、p=0.89)だった。70歳以上の患者を対象に探索的解析を行ったところ、G群(19人)の方がVP群(27人)よりもOSが延長していた(ハザード比0.31、95%信頼区間0.10-0.98、p=0.046)。再発パターンは、局所再発については両群で差はなかったが、遠隔転移再発については、脳がG群で26件、VP群が14件とG群で多かった。術後再発した患者のうち、G群で76人、VP群で71人が後治療を受けていた。そのうち薬物療法を受けたのはG群66人、VP群64人、EGFRチロシンキナーゼ阻害薬を投与されたのはG群43人、VP群59人、化学療法を受けたのはG群23人、VP群4人だった。プロトコール治療中、Grade 4以上の有害事象に見舞われたのはG群で4%、VP群で62%(1人を除いて、全て好中球減少症をはじめとする造血障害)だった。
結論:
EGFR遺伝子変異(エクソン19欠失変異もしくはエクソン21L858R点突然変異)陽性、病理病期II-III期の完全切除後非小細胞肺がん患者において、ゲフィチニブによる術後補助療法はDFS、OSともに統計学的有意な延長効果を示せなかった。
EGFR遺伝子変異陽性、病理病期II-III期の完全切除後非小細胞肺がん患者を対象に、ゲフィチニブ術後補助療法の有効性を検証した第III相IMPACT / WJOG6410L試験。
以前も記事にしたが、中国初のADJUVANT / CTONG1104試験はあくまで参考とし、このIMPACT試験の結果を以て実地臨床における自分の考え方を決めようと思っていた。
ADJUVANT / CTONG1104試験
http://oitahaiganpractice.junglekouen.com/e974737.html
http://oitahaiganpractice.junglekouen.com/e919586.html
http://oitahaiganpractice.junglekouen.com/e900761.html
ADJUVANT / CTONG1104試験では、ゲフィチニブは無病生存期間を延長するが、全生存期間は延長しない、ただし生存期間中央値は少なくとも75ヶ月以上と有意義な結果を残していた。
しかし、昨年の話題をさらったADAURA試験から、本患者集団ではオシメルチニブの方がさらによい結果が予感され、EGFR遺伝子変異陽性の全ての患者集団におけるゲフィチニブ時代の終焉を思わせた。
ADAURA試験
http://oitahaiganpractice.junglekouen.com/e987128.html
http://oitahaiganpractice.junglekouen.com/e980042.html
http://oitahaiganpractice.junglekouen.com/e975874.html
それから1年経過しての、IMPACT / WJOG6410L試験の結果報告。
第III相臨床試験としての輝きは、既に失われてしまった。
数の暴力、時の流れというのは残酷極まりない。
とはいえ、我が国で行われた臨床試験において、この患者集団の術後生命予後がきちんとしたデータで示され、71ヶ月という長期追跡期間にもかかわらず全患者集団の生存期間中央値が未到達というのは、これから治療に臨む患者に勇気を与える結果だと思う。
Adjuvant gefitinib versus cisplatin/vinorelbine in Japanese patients with completely resected, EGFR-mutated, stage II-III non-small cell lung cancer (IMPACT, WJOG6410L): A randomized phase 3 trial.
Hirohito Tada, et al., ASCO 2021 abst.#8501
Randomized Phase III Study of Gefitinib Versus Cisplatin Plus Vinorelbine for Patients With Resected Stage II-IIIA Non–Small-Cell Lung Cancer With EGFR Mutation (IMPACT)
Hirohito Tada et al., J Clin Oncol 2021
DOI: 10.1200/JCO.21.01729 Journal of Clinical Oncology
背景:
上皮成長因子受容体(EGFR)チロシンキナーゼ阻害薬単剤療法はEGFR遺伝子変異陽性未治療進行非小細胞肺がんの標準治療のひとつである。しかし、EGFR遺伝子変異陽性の完全切除後非小細胞肺がん患者における術後補助療法としてのゲフィチニブの有効性と安全性はシスプラチンベースの術後化学療法と比べてどうなのか、本試験が開始された2,011年当時はまだわかっていなかった。
方法:
2,011年09月から2,015年12月にかけて、EGFR遺伝子変異(エクソン19欠失変異もしくはエクソン21L858R点突然変異)陽性、病理病期II-III期の完全切除後非小細胞肺がん患者234人を対象に、G群(ゲフィチニブ250mgを1日1回2年間内服)とVP群(シスプラチン80mg/㎡を1日目、ビノレルビン25mg/㎡を1日目、8日目に点滴投与、3週間ごと4コース)に無作為に割り付けた。主要評価項目は独立判定委員会評価によるintent-to-treat解析での無病生存期間(DFS)とした。副次評価項目は全生存期間(OS)、安全性、再発時の再発パターンとした。
結果:
G群のうち2人が臨床試験参加を撤回したため、intent-to-treat解析から除外した。G群(116人)とVP群(116人)の患者背景に差はなかった。両群とも女性が6割を占め、年齢中央値は64歳、喫煙歴がなかった人はG群で58.6%、VP群で63.8%、病理病期はIIA期がG群で31.0%、VP群で32.8%、IIIA期はG群で61.2%、VP群で62.9%だった。プロトコール治療を完遂したのはG群61.2%、VP群77.6%だった。G群では治療関連死がなかったが、VP群では3人の治療関連死(脳出血、自殺、肺炎)が発生した。追跡期間中央値は70ヶ月だった。数値上、DFSはG群で長く、G群35.9ヶ月(95%信頼区間30.0-47.7)、VP群25.2ヶ月(95%信頼区間17.7-41.8)だった。しかし、カプランマイヤー曲線は術後約4年後から交差し、統計学的な有意差を認めず、ハザード比0.92(95%信頼区間0.67-1.28、p=0.63)だった。2年DFS割合はG群63.7%、VP群52.3%、5年DFS割合はG群31.8%、VP群34.1%だった。OSも有意差がつかず、解析時点では両群ともに中央値に至っておらず、5年生存割合はG群で78.0%、VP群で74.6%、ハザード比1.03(95%信頼区間0.65-1.65、p=0.89)だった。70歳以上の患者を対象に探索的解析を行ったところ、G群(19人)の方がVP群(27人)よりもOSが延長していた(ハザード比0.31、95%信頼区間0.10-0.98、p=0.046)。再発パターンは、局所再発については両群で差はなかったが、遠隔転移再発については、脳がG群で26件、VP群が14件とG群で多かった。術後再発した患者のうち、G群で76人、VP群で71人が後治療を受けていた。そのうち薬物療法を受けたのはG群66人、VP群64人、EGFRチロシンキナーゼ阻害薬を投与されたのはG群43人、VP群59人、化学療法を受けたのはG群23人、VP群4人だった。プロトコール治療中、Grade 4以上の有害事象に見舞われたのはG群で4%、VP群で62%(1人を除いて、全て好中球減少症をはじめとする造血障害)だった。
結論:
EGFR遺伝子変異(エクソン19欠失変異もしくはエクソン21L858R点突然変異)陽性、病理病期II-III期の完全切除後非小細胞肺がん患者において、ゲフィチニブによる術後補助療法はDFS、OSともに統計学的有意な延長効果を示せなかった。
2021年06月12日
規制当局FDAからの発表・・・PD-L1発現1-49%の患者における化学療法+免疫チェックポイント阻害薬
米国食品医薬品局という規制当局が発信する、という点で、とてもユニークな発表だと思う。
PD-L1発現1-49%の患者集団において、免疫チェックポイントの適正な使い方に関する臨床試験デザインの今後の在り方を問う、という立ち位置である。
しかし、タテマエとホンネというか、あくまで後方視的・探索的な統合解析というタテマエを押し出しつつも、この結果を見て実臨床に活かさない医療従事者がいるだろうか。
本報告から我々が受け止めるのは、PD-L1発現1-49%のドライバー遺伝子変異陰性進行非小細胞肺がん患者において、75歳未満であれば免疫チェックポイント阻害薬+化学療法を選ぶ、ということだろう。
75歳以上であれば免疫チェックポイント阻害薬単剤療法か、あるいは化学療法か。
Outcomes of anti-PD-(L1) therapy in combination with chemotherapy versus immunotherapy (IO) alone for first-line (1L) treatment of advanced non-small cell lung cancer (NSCLC) with PD-L1 score 1-49%: FDA pooled analysis.
Oladimeji Akinboro et al., 2021 ASCO Annual Meeting abst.#9001
背景:
免疫チェックポイント単剤療法がPD-L1発現陽性の非小細胞肺がんの治療として認可されている一方で、免疫チェックポイント阻害薬+化学療法±血管増殖因子阻害薬併用療法は、進行非小細胞肺がんの初回治療として米国食品医薬品局(FDA)に認可されている。PD-L1発現が1-49%の進行非小細胞肺がん患者では多くの治療選択肢があり、どのような患者集団でどの治療レジメンが効果があるのか、あまりよく分かっていない。
方法:
抗PD-1抗体 / 抗PD-L1抗体を単剤で、あるいは化学療法と併用で、進行非小細胞肺がん患者の初回治療として用いた8件の無作為化比較試験からデータを抽出して統合解析を行った。PD-L1スコアは腫瘍細胞のうち免疫染色で染まった細胞の割合と定義され、今回の解析はPD-L1スコアが1-49%だった患者を対象とした。腫瘍浸潤免疫細胞は検討から外した。EGFRやALKの遺伝子変異陽性患者は除外した。全生存期間(OS)および無増悪生存期間(PFS)を免疫チェックポイント阻害薬+化学療法(IO-chemo)群と免疫チェックポイント阻害薬単剤(IO alone)群で比較した。期間中央値はカプランマイヤー法で推計した。ハザード比はコックス比例ハザードモデルで推計し、臨床試験、年齢(65歳未満 vs 65-74歳 vs 75歳以上)、性別、人種、ECOG-PSECOG PS(0 vs 1以上)、組織型、喫煙歴(非喫煙者 vs 現/元喫煙者)を多変数解析の解析因子とした。
結果:
統合解析の対象となった臨床試験は、IOの単剤療法ではKEYNOTE-042試験、CheckMate-227試験、化学療法+IOではKEYNOTE-189試験、KEYNOTE-407試験、KEYNOTE-021試験(コホートG)、IMPOWER-150試験、IMPOWER-130試験、CA2099LA試験だった。PD-L1発現1-49%の非小細胞肺がん患者2,108人を対象とした。患者背景の概要は以下の通り:65-74歳の患者が37%、75%以上の患者は12%、67%が男性、79%が白人、65%がECOG-PS≧1、非扁平上皮癌は68%、85%が現/元喫煙者。IO-chemo群では、白人(88%)、現/元喫煙者(91%)、非扁平上皮癌(77%)の割合が高かった。追跡期間中央値は12.1ヶ月だった。今回の解析では、IO-chemo群(639人)の方がIO alone群(529人)よりもPFSとOSが延長する傾向にあった。PFS中央値はIO-chemo群で7.7ヶ月(95%信頼区間7.1-8.4)、IO alone群で4.2ヶ月(95%信頼区間4.0-4.9)、ハザード比0.60(95%信頼区間0.48-0.76)で、OS中央値はIO-chemo群で21.4ヶ月(95%信頼区間19.4-25.2)、IO alone群で14.5ヶ月(95%信頼区間12.2-16.9)ハザード比0.68(95%信頼区間0.52-0.90)だった。PFSについて、年齢別サブグループで解析すると、IO-chemo群とIO alone群のPFS中央値は、65歳未満のサブグループではそれぞれ7.1カ月、4.0カ月、ハザード比0.55(95%信頼区間0.40-0.76)、65-74歳のサブグループではそれぞれ9.5カ月、4.5カ月、ハザード比0.60(95%信頼区間0.40-0.88)、75歳以上のサブグループではそれぞれ6.4カ月、4.9カ月、ハザード比0.85(95%信頼区間:0.42-1.71)となり、75歳以上の患者では治療による差は見られなかった。OSについて、年齢別サブグループで解析すると、IO-chemo群とIO alone群のOS中央値は、65歳未満のサブグループではそれぞれ23.7カ月、16.1カ月、ハザード比0.63(95%信頼区間0.43-0.92)、65-74歳のサブグループではそれぞれ22.5カ月、14.8カ月、ハザード比0.61(95%信頼区間0.38-0.97)、75歳以上のサブグループではそれぞれ13.9カ月、10.3カ月、ハザード比0.95(95%信頼区間:0.42-2.14)となり、PFS同様に75歳以上の患者では治療による差は見られなかった。これらの結果はあくまで探索的なものであり、今後の臨床試験計画における仮説設定の一助とするものであり、なんらかの結論を導き出そうとするものではない。
結論:
今回の探索的統合解析において、PD-L1発現1-49%の患者では免疫チェックポイント阻害薬+化学療法併用療法の方が、免疫チェックポイント阻害薬単剤療法よりも予後を改善する傾向が示された。75歳以上の患者では、こうした差異は見られなかった。
PD-L1発現1-49%の患者集団において、免疫チェックポイントの適正な使い方に関する臨床試験デザインの今後の在り方を問う、という立ち位置である。
しかし、タテマエとホンネというか、あくまで後方視的・探索的な統合解析というタテマエを押し出しつつも、この結果を見て実臨床に活かさない医療従事者がいるだろうか。
本報告から我々が受け止めるのは、PD-L1発現1-49%のドライバー遺伝子変異陰性進行非小細胞肺がん患者において、75歳未満であれば免疫チェックポイント阻害薬+化学療法を選ぶ、ということだろう。
75歳以上であれば免疫チェックポイント阻害薬単剤療法か、あるいは化学療法か。
Outcomes of anti-PD-(L1) therapy in combination with chemotherapy versus immunotherapy (IO) alone for first-line (1L) treatment of advanced non-small cell lung cancer (NSCLC) with PD-L1 score 1-49%: FDA pooled analysis.
Oladimeji Akinboro et al., 2021 ASCO Annual Meeting abst.#9001
背景:
免疫チェックポイント単剤療法がPD-L1発現陽性の非小細胞肺がんの治療として認可されている一方で、免疫チェックポイント阻害薬+化学療法±血管増殖因子阻害薬併用療法は、進行非小細胞肺がんの初回治療として米国食品医薬品局(FDA)に認可されている。PD-L1発現が1-49%の進行非小細胞肺がん患者では多くの治療選択肢があり、どのような患者集団でどの治療レジメンが効果があるのか、あまりよく分かっていない。
方法:
抗PD-1抗体 / 抗PD-L1抗体を単剤で、あるいは化学療法と併用で、進行非小細胞肺がん患者の初回治療として用いた8件の無作為化比較試験からデータを抽出して統合解析を行った。PD-L1スコアは腫瘍細胞のうち免疫染色で染まった細胞の割合と定義され、今回の解析はPD-L1スコアが1-49%だった患者を対象とした。腫瘍浸潤免疫細胞は検討から外した。EGFRやALKの遺伝子変異陽性患者は除外した。全生存期間(OS)および無増悪生存期間(PFS)を免疫チェックポイント阻害薬+化学療法(IO-chemo)群と免疫チェックポイント阻害薬単剤(IO alone)群で比較した。期間中央値はカプランマイヤー法で推計した。ハザード比はコックス比例ハザードモデルで推計し、臨床試験、年齢(65歳未満 vs 65-74歳 vs 75歳以上)、性別、人種、ECOG-PSECOG PS(0 vs 1以上)、組織型、喫煙歴(非喫煙者 vs 現/元喫煙者)を多変数解析の解析因子とした。
結果:
統合解析の対象となった臨床試験は、IOの単剤療法ではKEYNOTE-042試験、CheckMate-227試験、化学療法+IOではKEYNOTE-189試験、KEYNOTE-407試験、KEYNOTE-021試験(コホートG)、IMPOWER-150試験、IMPOWER-130試験、CA2099LA試験だった。PD-L1発現1-49%の非小細胞肺がん患者2,108人を対象とした。患者背景の概要は以下の通り:65-74歳の患者が37%、75%以上の患者は12%、67%が男性、79%が白人、65%がECOG-PS≧1、非扁平上皮癌は68%、85%が現/元喫煙者。IO-chemo群では、白人(88%)、現/元喫煙者(91%)、非扁平上皮癌(77%)の割合が高かった。追跡期間中央値は12.1ヶ月だった。今回の解析では、IO-chemo群(639人)の方がIO alone群(529人)よりもPFSとOSが延長する傾向にあった。PFS中央値はIO-chemo群で7.7ヶ月(95%信頼区間7.1-8.4)、IO alone群で4.2ヶ月(95%信頼区間4.0-4.9)、ハザード比0.60(95%信頼区間0.48-0.76)で、OS中央値はIO-chemo群で21.4ヶ月(95%信頼区間19.4-25.2)、IO alone群で14.5ヶ月(95%信頼区間12.2-16.9)ハザード比0.68(95%信頼区間0.52-0.90)だった。PFSについて、年齢別サブグループで解析すると、IO-chemo群とIO alone群のPFS中央値は、65歳未満のサブグループではそれぞれ7.1カ月、4.0カ月、ハザード比0.55(95%信頼区間0.40-0.76)、65-74歳のサブグループではそれぞれ9.5カ月、4.5カ月、ハザード比0.60(95%信頼区間0.40-0.88)、75歳以上のサブグループではそれぞれ6.4カ月、4.9カ月、ハザード比0.85(95%信頼区間:0.42-1.71)となり、75歳以上の患者では治療による差は見られなかった。OSについて、年齢別サブグループで解析すると、IO-chemo群とIO alone群のOS中央値は、65歳未満のサブグループではそれぞれ23.7カ月、16.1カ月、ハザード比0.63(95%信頼区間0.43-0.92)、65-74歳のサブグループではそれぞれ22.5カ月、14.8カ月、ハザード比0.61(95%信頼区間0.38-0.97)、75歳以上のサブグループではそれぞれ13.9カ月、10.3カ月、ハザード比0.95(95%信頼区間:0.42-2.14)となり、PFS同様に75歳以上の患者では治療による差は見られなかった。これらの結果はあくまで探索的なものであり、今後の臨床試験計画における仮説設定の一助とするものであり、なんらかの結論を導き出そうとするものではない。
結論:
今回の探索的統合解析において、PD-L1発現1-49%の患者では免疫チェックポイント阻害薬+化学療法併用療法の方が、免疫チェックポイント阻害薬単剤療法よりも予後を改善する傾向が示された。75歳以上の患者では、こうした差異は見られなかった。
2021年06月06日
KRAS G12C変異陽性非小細胞肺がん、Sotorasibで1年長生き
まだ身の回りでは1件くらいしかKRAS G12C変異患者を見たことはないけれど。
2021/05/28付をもって、米国食品医薬品局は既治療KRAS p.G12C陽性進行非小細胞肺がんに対するsotorasibを薬事承認した。
KRAS遺伝子変異陽性の患者に対して、分子標的薬単剤で1年以上の生存期間延長が示されたのは、見事だ。
さて、我が国の実臨床にもこの恩恵がもたらされる日は来るのか?
Sotorasib for Lung Cancers with KRAS p.G12C Mutation
Ferdinandos Skoulidis, M.D., Ph.D. et al., N Engl J Med June 4, 2021
DOI: 10.1056/NEJMoa2103695
2021 ASCO Annual Meeting abst.#9003, CodeBreaK100 trial
背景:
Sotorasibは第I相試験において、KRAS p.G12C変異陽性の進行固形がんに対する有効性を示しており、その中でとりわけ非小細胞肺がんサブグループで有望な抗腫瘍活性を示していた。
方法:
今回の単アーム第II相試験において、既に標準治療を終えたKRAS p.G12C変異陽性非小細胞肺がん患者を対象にsotorasib 960mg1日1回内服投与の有効性を検証した。主要評価項目は独立評価委員会判定による奏効割合(完全奏効(CR)患者+部分奏効(PR)患者 / 全患者)とした。副次評価項目には、奏効持続期間、病勢コントロール割合(CR患者+PR患者+病勢安定(SD)患者 / 全患者)、無増悪生存期間、全生存期間、安全性を含めた。sotorasibの有効性と関わるバイオマーカーについても探索的評価を行った。
結果:
126人の患者が登録され、その大半(81.0%)はプラチナ併用化学療法とPD-1もしくはPD-L1阻害薬の前治療歴を有していた。独立評価委員会判定によると、124人はベースラインで測定可能病変を有し、腫瘍縮小効果について評価された。奏効は46人の患者で認められ(奏効割合37.1%、95%信頼区間28.6-46.2%)、そのうち4人(3.2%)は完全奏効、42人(33.9%)は部分奏効だった。奏効持続期間中央値は11.1ヶ月(95%信頼区間6.9ヶ月-未到達)だった。病勢コントロールは100人の患者で得られ、病勢コントロール割合は80.6%(95%信頼区間72.6-87.2%)だった。無増悪生存期間中央値は6.8ヶ月(95%信頼区間5.1-8.2ヶ月)、生存期間中央値は12.5ヶ月(95%信頼区間10.0ヶ月-未到達)だった。
治療関連有害事象は126人中88人(69.8%)で認められ、Grade 3の有害事象は25人(19.8%)を、Grade 4相当は1人(0.8%)だった。PD-L1発現状態、tumor mutational burden(TMB)、共存する他の遺伝子異常(STK11、KEAP1、もしくはTP53)の有無でサブグループ解析をしたが、どのサブグループでもsotorasibにより一定の腫瘍縮小効果が認められた。
結論:
今回の第II相試験において、前治療歴のあるKRAS p.G12C陽性非小細胞肺がんに対し、sotorasibは新たな有害事象を伴わず長期にわたる臨床的有用性をもたらした。
2021/05/28付をもって、米国食品医薬品局は既治療KRAS p.G12C陽性進行非小細胞肺がんに対するsotorasibを薬事承認した。
KRAS遺伝子変異陽性の患者に対して、分子標的薬単剤で1年以上の生存期間延長が示されたのは、見事だ。
さて、我が国の実臨床にもこの恩恵がもたらされる日は来るのか?
Sotorasib for Lung Cancers with KRAS p.G12C Mutation
Ferdinandos Skoulidis, M.D., Ph.D. et al., N Engl J Med June 4, 2021
DOI: 10.1056/NEJMoa2103695
2021 ASCO Annual Meeting abst.#9003, CodeBreaK100 trial
背景:
Sotorasibは第I相試験において、KRAS p.G12C変異陽性の進行固形がんに対する有効性を示しており、その中でとりわけ非小細胞肺がんサブグループで有望な抗腫瘍活性を示していた。
方法:
今回の単アーム第II相試験において、既に標準治療を終えたKRAS p.G12C変異陽性非小細胞肺がん患者を対象にsotorasib 960mg1日1回内服投与の有効性を検証した。主要評価項目は独立評価委員会判定による奏効割合(完全奏効(CR)患者+部分奏効(PR)患者 / 全患者)とした。副次評価項目には、奏効持続期間、病勢コントロール割合(CR患者+PR患者+病勢安定(SD)患者 / 全患者)、無増悪生存期間、全生存期間、安全性を含めた。sotorasibの有効性と関わるバイオマーカーについても探索的評価を行った。
結果:
126人の患者が登録され、その大半(81.0%)はプラチナ併用化学療法とPD-1もしくはPD-L1阻害薬の前治療歴を有していた。独立評価委員会判定によると、124人はベースラインで測定可能病変を有し、腫瘍縮小効果について評価された。奏効は46人の患者で認められ(奏効割合37.1%、95%信頼区間28.6-46.2%)、そのうち4人(3.2%)は完全奏効、42人(33.9%)は部分奏効だった。奏効持続期間中央値は11.1ヶ月(95%信頼区間6.9ヶ月-未到達)だった。病勢コントロールは100人の患者で得られ、病勢コントロール割合は80.6%(95%信頼区間72.6-87.2%)だった。無増悪生存期間中央値は6.8ヶ月(95%信頼区間5.1-8.2ヶ月)、生存期間中央値は12.5ヶ月(95%信頼区間10.0ヶ月-未到達)だった。
治療関連有害事象は126人中88人(69.8%)で認められ、Grade 3の有害事象は25人(19.8%)を、Grade 4相当は1人(0.8%)だった。PD-L1発現状態、tumor mutational burden(TMB)、共存する他の遺伝子異常(STK11、KEAP1、もしくはTP53)の有無でサブグループ解析をしたが、どのサブグループでもsotorasibにより一定の腫瘍縮小効果が認められた。
結論:
今回の第II相試験において、前治療歴のあるKRAS p.G12C陽性非小細胞肺がんに対し、sotorasibは新たな有害事象を伴わず長期にわたる臨床的有用性をもたらした。
2021年06月03日
会って話す
新型コロナウイルスパンデミックが我々の業界にもたらしたものは、好悪ともに夥しい。
好の面も悪の面も兼ね備えているのは、面談に関する変化ではないだろうか。
オンライン診療で、患者の利便性と安全性、医療従事者の効率性が向上したのは好の面。
一方、医療の質の低下、相互理解の低下は悪の面だろう。
どちらかというと、この点においては悪の面の方がより大きいと、私自身は感じている。
SPIKESになぞらえて言うならば、出だしの”S”の時点で既にコケている。
新型コロナウイルス感染リスクが否定できないということを理由にして、適切な病状説明や治療の透明性確保をないがしろにしていないだろうか。
これだけ医療従事者のワクチン接種が進んでくると、少なくとも医療従事者の安全確保を理由にした面談簡略化は理屈が通らない。
これからの方向性を左右する面談においては、患者・家族・医療従事者ともに意識して、努めて会って話すべきだ。
でないと、誤解や行き違いを招きかねない。
万の言葉を尽くしても伝わらない治療内容が、簡単なスケッチを介して即座に伝わることがある。
会って話して初めて、本人やご家族の切なる願いが医療従事者に届くことがあるのだ。
隔離病棟に入ってモニター越しに患者の様子を観察し、病状説明を電話口で家族にするようになって、心底からそのように思う。
新型コロナウイルス感染患者や未確定発熱患者ならやむを得ないが、がん患者を同列に扱うべきではないだろう。
好の面も悪の面も兼ね備えているのは、面談に関する変化ではないだろうか。
オンライン診療で、患者の利便性と安全性、医療従事者の効率性が向上したのは好の面。
一方、医療の質の低下、相互理解の低下は悪の面だろう。
どちらかというと、この点においては悪の面の方がより大きいと、私自身は感じている。
SPIKESになぞらえて言うならば、出だしの”S”の時点で既にコケている。
新型コロナウイルス感染リスクが否定できないということを理由にして、適切な病状説明や治療の透明性確保をないがしろにしていないだろうか。
これだけ医療従事者のワクチン接種が進んでくると、少なくとも医療従事者の安全確保を理由にした面談簡略化は理屈が通らない。
これからの方向性を左右する面談においては、患者・家族・医療従事者ともに意識して、努めて会って話すべきだ。
でないと、誤解や行き違いを招きかねない。
万の言葉を尽くしても伝わらない治療内容が、簡単なスケッチを介して即座に伝わることがある。
会って話して初めて、本人やご家族の切なる願いが医療従事者に届くことがあるのだ。
隔離病棟に入ってモニター越しに患者の様子を観察し、病状説明を電話口で家族にするようになって、心底からそのように思う。
新型コロナウイルス感染患者や未確定発熱患者ならやむを得ないが、がん患者を同列に扱うべきではないだろう。
2021年06月01日
アナモレリン、間に合わず。
このところ手元のデータの統計解析ばかりしていたので、ブログらしく久しぶりに日記を書く。
先ほど、勤め先から電話連絡があった。
数年にわたって無治療経過観察で見守ってきた胃がんの患者さんの命の灯が、間もなく消えようとしている。
齢は100を数え、大往生と言えばそれまでだが、関連症状が出始めてからの経過は本当に早かった。
食事がとれなくなって、アナモレリンを使って少しでも食べられるようになればと思ったが、市販後調査の手続きにかなり時間がかかるようで、間に合わなかった。
当直明けで体はきついけれど、これから着替えて看取りに行くことにする。
先ほど、勤め先から電話連絡があった。
数年にわたって無治療経過観察で見守ってきた胃がんの患者さんの命の灯が、間もなく消えようとしている。
齢は100を数え、大往生と言えばそれまでだが、関連症状が出始めてからの経過は本当に早かった。
食事がとれなくなって、アナモレリンを使って少しでも食べられるようになればと思ったが、市販後調査の手続きにかなり時間がかかるようで、間に合わなかった。
当直明けで体はきついけれど、これから着替えて看取りに行くことにする。




