2020年09月29日
KEYNOTE-024 data more updated...5年生存割合31.9%はおろか、81.4%って...
TPS>50%の患者に対する初回ペンブロリズマブ単剤療法の有効性を検討したKEYNOTE-024試験。
これまで何度となく取り上げてきた。
http://oitahaiganpractice.junglekouen.com/e856772.html
http://oitahaiganpractice.junglekouen.com/e874097.html
http://oitahaiganpractice.junglekouen.com/e906138.html
http://oitahaiganpractice.junglekouen.com/e914135.html
http://oitahaiganpractice.junglekouen.com/e963874.html
ESMO2020において、最新のデータが公表され、いよいよ5年生存割合が示された。
ペンブロリズマブ群での5年生存割合が31.9%というのは驚きだが、化学療法群での5年生存割合が16.3%というのに、さらに驚く。
IV期の非小細胞肺がん患者のうち、TPS≧50%なら、ペンブロリズマブで治療を開始すれば3人に1人、化学療法で治療を開始しても6人に1人は5年生存するという、我々世代からすると非現実的な現実。
ペンブロリズマブ群のうち、既定の35コースを完遂した患者に限って言えば、5年生存割合はなんと驚愕の81.4%。
今後は、この結果を基礎データとして患者・家族に話さなければならない。
TPS≧50%なら、この程度の治療成績は達成できて当たり前、というのは、治療を担当する立場から言えば、結構なプレッシャーである。
LBA51 - KEYNOTE-024 5-year OS update: First-line (1L) pembrolizumab (pembro) vs platinum-based chemotherapy (chemo) in patients (pts) with metastatic NSCLC and PD-L1 tumour proportion score (TPS) ≥50%
Julie R. Brahmer et al., ESMO 2020 Abst.#LBA51
背景:
KEYNOTE-024試験において、EGFR/ALK感受性遺伝子異常のないPD-L1-TPS≧50%の進行非小細胞肺がん患者に対する初回治療として、化学療法に対するペンブロリズマブの優越性が示された。今回は、5年の追跡期間を経てのKEYNOTE-024試験の有効性、安全性に関する最新データを公表する。
方法:
適格患者をペンブロリズマブ単剤療法群(ペンブロリズマブ200mgを3週ごとに投与、最大35コース=2年間まで)と化学療法群に無作為に割り付けた。割付調整因子はECOG-PS(0 / 1)、組織型(扁平上皮がん / 非扁平上皮がん)、地域(東アジア / それ以外)とした。化学療法群に割り付けられた患者が、プロトコール治療開始後病勢進行に至り、条件を満たした場合にはペンブロリズマブ単剤療法へクロスオーバー可能とされていた。ペンブロリズマブ群に割り付けられ、2年間のプロトコール治療を完遂した、もしくは完全奏効に至ったためプロトコール治療を途中終了した患者が病勢進行に至った場合には、ペンブロリズマブ単剤療法を再開してよいこととした。主要評価項目は無増悪生存期間で、副次評価項目は全生存期間、奏効割合、安全性、探索的評価項目は奏効持続期間とした。今回の解析においては、奏効もしくは病勢進行は、RECIST v1.1の基準に従い、担当医により評価された。
結果:
305人の患者がペンブロリズマブ群(154人)と化学療法群(151人)に無作為に割り付けられた。無作為割付からデータカットオフ時点までの期間中央値は59.9ヶ月(55.1-68.4ヶ月)だった。化学療法群に割り付けられた患者のうち83人(55%)は、クロスオーバーによりペンブロリズマブを投与された。ITT解析における有効性評価、あるいはペンブロリズマブ群において、35コースの治療を完遂した154人中39人(25.3%)の患者における有効性評価の結果を表に示した。また、154人中12人はペンブロリズマブの再投与を受けた。Grade 3-5の治療関連有害事象は、ペンブロリズマブ群の31.2%、化学療法群の53.3%で認められた。


結論:
ペンブロリズマブは、化学療法と比較して引き続きPD-L1-TPS≧50%の進行非小細胞肺がん患者における生命予後改善効果を示した。高いクロスオーバー率にもかかわらず、5年生存割合はペンブロリズマブ群で31.9%、化学療法群で16.3%と、ペンブロリズマブ群でほぼ2倍に延長していた。Grade 3-5の有害事象は、ペンブロリズマブ群の方が頻度が少なかった。ペンブロリズマブ単剤療法によって、長期にわたる生存と持続する腫瘍縮小効果が認められた。
これまで何度となく取り上げてきた。
http://oitahaiganpractice.junglekouen.com/e856772.html
http://oitahaiganpractice.junglekouen.com/e874097.html
http://oitahaiganpractice.junglekouen.com/e906138.html
http://oitahaiganpractice.junglekouen.com/e914135.html
http://oitahaiganpractice.junglekouen.com/e963874.html
ESMO2020において、最新のデータが公表され、いよいよ5年生存割合が示された。
ペンブロリズマブ群での5年生存割合が31.9%というのは驚きだが、化学療法群での5年生存割合が16.3%というのに、さらに驚く。
IV期の非小細胞肺がん患者のうち、TPS≧50%なら、ペンブロリズマブで治療を開始すれば3人に1人、化学療法で治療を開始しても6人に1人は5年生存するという、我々世代からすると非現実的な現実。
ペンブロリズマブ群のうち、既定の35コースを完遂した患者に限って言えば、5年生存割合はなんと驚愕の81.4%。
今後は、この結果を基礎データとして患者・家族に話さなければならない。
TPS≧50%なら、この程度の治療成績は達成できて当たり前、というのは、治療を担当する立場から言えば、結構なプレッシャーである。
LBA51 - KEYNOTE-024 5-year OS update: First-line (1L) pembrolizumab (pembro) vs platinum-based chemotherapy (chemo) in patients (pts) with metastatic NSCLC and PD-L1 tumour proportion score (TPS) ≥50%
Julie R. Brahmer et al., ESMO 2020 Abst.#LBA51
背景:
KEYNOTE-024試験において、EGFR/ALK感受性遺伝子異常のないPD-L1-TPS≧50%の進行非小細胞肺がん患者に対する初回治療として、化学療法に対するペンブロリズマブの優越性が示された。今回は、5年の追跡期間を経てのKEYNOTE-024試験の有効性、安全性に関する最新データを公表する。
方法:
適格患者をペンブロリズマブ単剤療法群(ペンブロリズマブ200mgを3週ごとに投与、最大35コース=2年間まで)と化学療法群に無作為に割り付けた。割付調整因子はECOG-PS(0 / 1)、組織型(扁平上皮がん / 非扁平上皮がん)、地域(東アジア / それ以外)とした。化学療法群に割り付けられた患者が、プロトコール治療開始後病勢進行に至り、条件を満たした場合にはペンブロリズマブ単剤療法へクロスオーバー可能とされていた。ペンブロリズマブ群に割り付けられ、2年間のプロトコール治療を完遂した、もしくは完全奏効に至ったためプロトコール治療を途中終了した患者が病勢進行に至った場合には、ペンブロリズマブ単剤療法を再開してよいこととした。主要評価項目は無増悪生存期間で、副次評価項目は全生存期間、奏効割合、安全性、探索的評価項目は奏効持続期間とした。今回の解析においては、奏効もしくは病勢進行は、RECIST v1.1の基準に従い、担当医により評価された。
結果:
305人の患者がペンブロリズマブ群(154人)と化学療法群(151人)に無作為に割り付けられた。無作為割付からデータカットオフ時点までの期間中央値は59.9ヶ月(55.1-68.4ヶ月)だった。化学療法群に割り付けられた患者のうち83人(55%)は、クロスオーバーによりペンブロリズマブを投与された。ITT解析における有効性評価、あるいはペンブロリズマブ群において、35コースの治療を完遂した154人中39人(25.3%)の患者における有効性評価の結果を表に示した。また、154人中12人はペンブロリズマブの再投与を受けた。Grade 3-5の治療関連有害事象は、ペンブロリズマブ群の31.2%、化学療法群の53.3%で認められた。


結論:
ペンブロリズマブは、化学療法と比較して引き続きPD-L1-TPS≧50%の進行非小細胞肺がん患者における生命予後改善効果を示した。高いクロスオーバー率にもかかわらず、5年生存割合はペンブロリズマブ群で31.9%、化学療法群で16.3%と、ペンブロリズマブ群でほぼ2倍に延長していた。Grade 3-5の有害事象は、ペンブロリズマブ群の方が頻度が少なかった。ペンブロリズマブ単剤療法によって、長期にわたる生存と持続する腫瘍縮小効果が認められた。
2020年09月29日
改めてCROWN試験
プレスリリースの時点で一度取り上げた、ロルラチニブ vs クリゾチニブのガチンコ試験、CROWN試験。
http://oitahaiganpractice.junglekouen.com/e979184.html
ESMO 2020で結果が公表されたらしい。
発表者は、ALK陽性肺がんに対するクリゾチニブ一次治療の有効性について、PROFILE1014試験で発表したSolomon先生。
https://www.nejm.org/doi/10.1056/NEJMoa1408440
2007年のALK融合遺伝子の報告、2014年のPROFILE1014の報告、そしてALEX試験、J-ALEX試験、CROWN試験と、クリゾチニブの栄枯盛衰を感じる。
Lorlatinib vs crizotinib in the first-line treatment of patients (pts) with advanced ALK-positive non-small cell lung cancer (NSCLC): Results of the phase III CROWN study
Benjamin Solomon et al., ESMO 2020 Abst.#LBA2
背景:
ロルラチニブは第3世代のALKチロシンキナーゼ阻害薬であり、ALK融合遺伝子陽性の進行非小細胞肺癌に対し、中枢神経病変を含めて全般的な有効性が証明されている。今回は、未治療のALK融合遺伝子陽性非小細胞肺がん患者の一次治療において、ロルラチニブとクリゾチニブを比較するオープンラベル、ランダム化、多施設共同の第III相比較試験の中間解析結果について報告する。
方法:
23か国、104参加施設から、ALK融合遺伝子陽性の未治療、IIIB / IV期の非小細胞肺がん患者を集積し、1:1の割合でロルラチニブ群とクリゾチニブ群に割り付けた。割り付け調整因子は中枢神経病変の有無、人種とした。主要評価項目は独立した中央判定による無増悪生存期間とした。副次評価項目は担当医評価による無増悪生存期間、奏効割合、中央判定による中枢神経病変の奏効割合、奏効持続期間、中枢神経病変の奏効持続期間、全生存期間、安全性とした。今回の中間解析は、無増悪生存イベントの72%が発生したと考えられる時点で予定されていた中間解析結果に基づくものである
結果:
296人の患者が無作為割り付けされ、291人がプロトコール治療を受けた。2020年3月20日のデータカットオフの時点で、中央判定による無増悪生存データについての追跡期間中央値はロルラチニブ群(149人)では18.3ヶ月(95%信頼区間は16.4-20.1ヶ月)、クリゾチニブ群(147人)では14.8ヶ月(95%信頼区間は12.8-18.4ヶ月)だった。中央判定による無増悪生存期間は、ロルラチニブにより有意に改善していた(ハザード比0.28、95%信頼区間は0.191-0.413、片側検定でp<0.001)。ロルラチニブの無増悪生存期間中央値は未到達(95%信頼区間も上限・下限ともに未到達)で、クリゾチニブの無増悪生存期間は9.3ヶ月(95%信頼区間は7.6-11.1ヶ月)だった。担当医評価による無増悪生存期間、奏効割合、中央判定による中枢神経病変の奏効割合もtableのごとくロルラチニブにより改善していた。Grade 3-4の有害事象はロルラチニブ群の72.5%、クリゾチニブ群の55.6%で、治療中断に至る有害事象はロルラチニブ群の6.7%で、クリゾチニブ群の9.2%で認めた。ロルラチニブ群におけるGrade 3-4の有害事象の大多数は臨床検査値の異常であり、そのほとんどは脂質異常に関するものだった。
結論:
クリゾチニブと比較して、ロルラチニブは統計学的有意に、そして臨床的に意義のある無増悪生存期間の延長を達成した。ALK融合遺伝子陽性の非小細胞肺癌に対する初回治療として、ロルラチニブは考慮すべき治療オプションである。



http://oitahaiganpractice.junglekouen.com/e979184.html
ESMO 2020で結果が公表されたらしい。
発表者は、ALK陽性肺がんに対するクリゾチニブ一次治療の有効性について、PROFILE1014試験で発表したSolomon先生。
https://www.nejm.org/doi/10.1056/NEJMoa1408440
2007年のALK融合遺伝子の報告、2014年のPROFILE1014の報告、そしてALEX試験、J-ALEX試験、CROWN試験と、クリゾチニブの栄枯盛衰を感じる。
Lorlatinib vs crizotinib in the first-line treatment of patients (pts) with advanced ALK-positive non-small cell lung cancer (NSCLC): Results of the phase III CROWN study
Benjamin Solomon et al., ESMO 2020 Abst.#LBA2
背景:
ロルラチニブは第3世代のALKチロシンキナーゼ阻害薬であり、ALK融合遺伝子陽性の進行非小細胞肺癌に対し、中枢神経病変を含めて全般的な有効性が証明されている。今回は、未治療のALK融合遺伝子陽性非小細胞肺がん患者の一次治療において、ロルラチニブとクリゾチニブを比較するオープンラベル、ランダム化、多施設共同の第III相比較試験の中間解析結果について報告する。
方法:
23か国、104参加施設から、ALK融合遺伝子陽性の未治療、IIIB / IV期の非小細胞肺がん患者を集積し、1:1の割合でロルラチニブ群とクリゾチニブ群に割り付けた。割り付け調整因子は中枢神経病変の有無、人種とした。主要評価項目は独立した中央判定による無増悪生存期間とした。副次評価項目は担当医評価による無増悪生存期間、奏効割合、中央判定による中枢神経病変の奏効割合、奏効持続期間、中枢神経病変の奏効持続期間、全生存期間、安全性とした。今回の中間解析は、無増悪生存イベントの72%が発生したと考えられる時点で予定されていた中間解析結果に基づくものである
結果:
296人の患者が無作為割り付けされ、291人がプロトコール治療を受けた。2020年3月20日のデータカットオフの時点で、中央判定による無増悪生存データについての追跡期間中央値はロルラチニブ群(149人)では18.3ヶ月(95%信頼区間は16.4-20.1ヶ月)、クリゾチニブ群(147人)では14.8ヶ月(95%信頼区間は12.8-18.4ヶ月)だった。中央判定による無増悪生存期間は、ロルラチニブにより有意に改善していた(ハザード比0.28、95%信頼区間は0.191-0.413、片側検定でp<0.001)。ロルラチニブの無増悪生存期間中央値は未到達(95%信頼区間も上限・下限ともに未到達)で、クリゾチニブの無増悪生存期間は9.3ヶ月(95%信頼区間は7.6-11.1ヶ月)だった。担当医評価による無増悪生存期間、奏効割合、中央判定による中枢神経病変の奏効割合もtableのごとくロルラチニブにより改善していた。Grade 3-4の有害事象はロルラチニブ群の72.5%、クリゾチニブ群の55.6%で、治療中断に至る有害事象はロルラチニブ群の6.7%で、クリゾチニブ群の9.2%で認めた。ロルラチニブ群におけるGrade 3-4の有害事象の大多数は臨床検査値の異常であり、そのほとんどは脂質異常に関するものだった。
結論:
クリゾチニブと比較して、ロルラチニブは統計学的有意に、そして臨床的に意義のある無増悪生存期間の延長を達成した。ALK融合遺伝子陽性の非小細胞肺癌に対する初回治療として、ロルラチニブは考慮すべき治療オプションである。



2020年09月27日
CheckMate153試験再び・・・こちらはやめられません
既治療非小細胞肺がんに対するニボルマブの継続投与と1年間期間限定投与を比較する第IIIb / IV相試験のCheckMate153試験、いまだ試験継続中のようだが、アップデートされた結果が報告された。
https://ascopubs.org/doi/full/10.1200/JCO.20.00131
無料で全文読めるので、是非通読して、できれば抄読会などで紹介してほしい。
あくまで探索的検討の位置づけだが、継続投与の方が全生存期間、無増悪生存期間共に延長しており、市販後臨床試験として参加対象が広く設定されているだけに、決して無視できない結果である。
あえて生存曲線の図表はここに掲載しないが、上記のリンクから参照していただきたい。
当初1年間のニボルマブの効果が高いほど継続投与群の優位性が高くなる、というのはもちろん、興味深いのは、beyond PDの症例まで含んだ解析でも予後が延長しており、生存曲線を見る限り、その差はランダム化から1年間はほとんど見られないが、1年経過後(すなわち、継続投与群ではニボルマブ2年間投与後)から末広がりの様相で開いていく。
ランダム化時点でCR/PRだった患者群だけで解析すると、継続投与群がずっと上を行く。
また、ランダム化の時点でbeyond PDでニボルマブを使用していた患者群だけで解析してみると、ランダム化後1年間は期間限定投与群の方が予後がよく、その後は見事に関係が逆転し、継続投与群が上を行くようになる。
まるで、PD-L1発現状態ごとの生存曲線を見ているようだ。
何はともあれ、この結果を見てしまうと、少なくとも既治療非小細胞肺がんにおけるニボルマブ単剤療法では、少なくともCR/PRの治療効果が得られた患者では、途中でやめてしまおうという気にはなれない。
とても感銘を受けたので、論文本体をほぼ全訳して掲載する。
くどいようだが、図表は上記リンクから参照のこと。
Continuous Versus 1-Year Fixed-Duration Nivolumab in Previously Treated Advanced Non–Small-Cell Lung Cancer: CheckMate 153
David M. Waterhouse et al., J Clin Oncol 2020
DOI: 10.1200/JCO.20.00131 Journal of Clinical Oncology
背景:
非小細胞肺がんの治療時を含めて、免疫チェックポイント阻害薬の最適な治療継続期間についての臨床データは限られている。今回は、市販後大規模臨床試験である第IIIb / IV相のCheckMate153試験-ニボルマブを1年間のみ投与する治療と1年を超えて継続的に投与する治療での安全性と有効性を検証する試験-における探索的検証結果について報告する。
方法:
前治療歴のある深刻非小細胞肺がん患者を対象に、ニボルマブ単剤療法(3mg/kg、2週間ごと)を行った。画像診断では病勢進行相当だが、臨床的には効果が出ていると判断されて治療継続されている患者も含め、治療開始から1年経過時点で治療を継続している患者を対象に、そのままニボルマブを継続投与する群(C群)と、病勢進行時にはニボルマブ投与を再開できるという条件付きで1年までで投与を中止する群(S群)に無作為に割り付けた。
結果:
1,428人の患者がニボルマブによる治療を受け、そのうち252人(ITT集団)がC群(127人)とS群(125人)に無作為割付された。このうち、ランダム割付時点で病勢進行に至っていなかった患者は174人(PFS集団)で、C群で89人、S群で85人だった。無作為割付後の追跡期間がもっとも短い患者でも13.5ヶ月を経過していた。無増悪生存期間中央値はC群で24.7ヶ月、S群で9.4ヶ月と、有意にC群で延長していた(ハザード比0.56、95%信頼区間は0.37-0.84)。また、無作為割付後の生存期間中央値も、ITT集団(C群で未到達、S群で28.8ヶ月、ハザード比は0.62、95%信頼区間は0.42-0.92)、PFS集団(C群で未到達、S群で32.5ヶ月、ハザード比0.61、95%信頼区間は0.37-0.99)のいずれにおいてもC群で有意に延長していた。プロトコール治療中に新たに発生した治療関連有害事象はほぼなく、安全性に関する新規の所見は認めなかった。
結論:
我々の知る限り、今回の探索的検討から得られたこれらの所見は既治療進行非小細胞肺がんにおける免疫チェックポイント阻害薬の投与期間について無作為比較した初のデータである。1年間を超えるニボルマブ維持療法は予後を改善する。
前文:
・ニボルマブはPD-1を阻害するヒトIgG4抗体であり、既治療進行非小細胞肺がんに対する標準治療薬である
・CheckMate017試験とCheckMate057試験によりこうした位置づけが確立したが、これら試験では病勢進行に至るか、あるいは忍容不能な有害事象が発生するまでニボルマブの投与が継続され、ドセタキセルに対してニボルマブが優位に生存期間を延長した
・ニボルマブの治療効果は持続性があり、長期追跡調査の結果、5年生存割合はニボルマブ群で13%、ドセタキセル群で3%だった
・第I相試験であるCheckMate003試験にも非小細胞肺がんの患者が組み入れられており、非小細胞肺がんに対して免疫チェックポイント阻害薬が使用された一連の臨床試験では最も長期の追跡調査が行われているが、6年生存割合は15%であり、この患者集団においては過去に例のない長期生存効果を示している
・免疫チェックポイント阻害薬の最適な治療期間は、これまでのところ、どの臓器別腫瘍においてもわかっていない
・イピリムマブは、CTLA4を阻害するヒトIgG1抗体だが、進行悪性黒色腫に対してわずか4コースの治療を12週間の期間内で行うことにより、長期生存効果を示している
・対照的に、いくつかの悪性腫瘍に治療適応のあるPD-1 / PD-L1抗体の投与期間は各臨床試験で異なっており、病勢進行に至るまで継続投与とされているものもあれば、一定期間で打ち切られるものもある
・CheckMate003試験に参加した既治療非小細胞肺がんの患者において、ニボルマブの投与期間は96週間と規定されており、5年以上生存した患者の75%以上はニボルマブ投与後の追加治療なく5年経過時点でも無増悪生存を維持していたが、残る25%は96週間の治療期間を満了する前に有害事象のためプロトコール治療を中止していた(=5年生存した患者の25%は、有害事象のためにニボルマブ投与を中途で中止せざるを得なかったが、それでも5年生存した=ニボルマブの継続投与は、必ずしも長期生存には必要ないのかもしれないという推測が成り立つ)
・CheckMate153試験は現在も進行中の第IIIb / IV相の臨床試験であり、一般の第III相臨床試験とは異なり、広く日常臨床に即した試験で、それだけにより実際の患者集団を反映したデータが集まると考えられている
・本試験は、既治療進行非小細胞肺がん患者に対するニボルマブ単剤療法の安全性を検証する試験として立案された
・主要評価項目は安全性とされた
・ニボルマブ投与を一定期間に限定し、その有効性と安全性を評価した探索的解析についてのデータを今回報告する
・ニボルマブ投与により奏効が得られたかどうかに関わらず、1年間ニボルマブを継続投与された患者を対象に、そのままニボルマブを継続使用する群(C群)と、病勢進行時にはプロトコール治療としてニボルマブの再投与ができることを条件にいったんニボルマブの投与を中止する群(S群)にランダムに割り付けた
・我々の知る限り、本試験はPD-1阻害薬の投与期間を限定することの意義を検証した初めての臨床試験である
・今回は、ランダム化後13ヶ月以上の追跡期間をおいた最新のデータを報告する
方法:
・本試験は第IIIb / IV相の臨床試験である
・既治療進行非小細胞肺がん患者を対象に、ニボルマブ単剤療法について検証することを目的とした
・ニボルマブ3mg/kgを2週間ごとに経静脈投与した
・C群では、病勢進行、忍容不能の有害事象発現、患者の治療同意撤回のいずれかが発生するまではニボルマブ投与を継続することとした
・S群では、病勢進行、忍容不能の有害事象発現、患者の治療同意撤回、あるいは治療開始から1年間経過するまではニボルマブ投与を継続することとした
・治療開始後に最初の病勢進行が確認された場合にも、担当医により何らかの治療効果が確認され、急速な病勢進行を来しておらず、PSが安定していて継続治療に耐えうるとみなされたときは、beyond PDとしてニボルマブの継続投与可能とした
・プロトコール治療を開始した1人目の患者が1年間の治療期間を満了する前にプロトコール改定が行われ、ニボルマブ投与により奏効が得られたかどうかに関わらず、1年間ニボルマブを継続投与された患者を対象に、そのままニボルマブを継続使用する群(C群)と、病勢進行時にはプロトコール治療としてニボルマブの再投与ができることを条件にいったんニボルマブの投与を中止する群(S群)に患者を無作為に割り付けることになった
・主要評価項目は安全性とした
・2014年のプロトコール改定ののち、1年経過時点で治療を継続していた患者を対象として、ランダム化後の探索的評価項目(安全性、忍容性、無増悪生存期間、全生存期間、奏効割合)が追加された
・治療効果判定は担当医により行われた(独立した中央判定は行われなかった9
・プロトコール治療開始時点、すなわち、ランダム化から1年前の時点でベースラインの状態評価が行われ、治療開始後初回の効果判定は9週間目に、その後は治療開始から24ヶ月経過するまでは8週間ごとに、24ヶ月経過後は12週間ごとに、病勢進行に至るまで行われた
・治療反応性はランダム化の際の割付調整因子とはされなかった
・ベースライン状態評価はランダム化の際には行われず、あくまで治療開始時点の評価がベースラインの状態と設定され、病勢進行の評価は治療開始時点から治療期間中の最良効果時点からRECIST基準ver1.1に従って行われた
・プロトコール上、PD-L1発現状態の評価は義務付けられなかったが、腫瘍サンプルが利用可能な場合には評価した
・ランダム割付をされた全ての患者集団をIntent-to-treat集団(ITT集団)と定義した
・ITT集団のうち、ランダム割付前の時点で病勢進行に至っておらず、他のがん薬物療法によ次治療を行われていなかった患者を無増悪生存集団(PFS集団)と定義した
・安全性解析はITT集団を対象に行われ、ランダム割付からプロトコール治療を最後に行ってから100日後までに発生した有害事象を対象とした
・無増悪生存期間は、PFS集団のみを対象として解析した
・全生存期間は、ITT集団、PFS集団の両方において解析した
・無増悪生存期間と全生存期間は、ランダム化された日付を起算日としてKaplan-Meier法を用いて見積もることとし、BrookMeyer & Crowley法を用いて中央値と両側検定による95%信頼区間を算定した
・無増悪生存期間については、ベースラインの患者背景を調整しつつ、多変数解析を行った
・データカットオフ、データロックは2018年9月19日時点とした
結果:
・2014年4月16日から2018年9月18日の期間内に、総数1,428人の患者がプロトコール治療を開始した
・プロトコール治療から1年経過時点で、252人の患者(=ITT集団)がプロトコール治療を継続しており、治療反応性に関係なくランダム割付された
・C群に127人、S群に125人が割り付けられた
・ITT集団252人中78人(C群127人中38人、S群125人中40人)はbeyond PDとして、病勢進行と判定された後も臨床的効果が見られるとの担当医判断でプロトコール治療を継続されていた
・beyond PDの患者を除いたC群89人、S群85人、計174人がPFS集団となった
・PFS集団のうち、C群では最良効果が完全奏効(CR)もしくは部分奏効(PR)だった患者が62人、病勢安定(SD)だった患者が27人で、S群では最良効果がCRもしくはPRだった患者が58人、SDだった患者が27人だった
・C群、S群の患者背景はおおむねバランスよく調整されていたが、S群に比べてC群では扁平上皮がんの患者割合が少なかった(ITT集団では26.8% vs 44.0%, PFS集団では31.5% vs 41.2%)
・ITT集団において、C群127人のうち65人(51.2%)、S群125人のうち61人(48.8%)でPD-L1発現状態を評価可能だった
・PFS集団において、C群89人のうち50人(56.2%)、S群85人のうち50人(58.8%)でPD-L1発現状態を評価可能だった
・データカットオフ時点で、ITT集団におけるランダム化後の最短経過観察期間は13.5ヶ月だった(=ITT集団全員で、13.5ヶ月以上の経過観察期間を確保できた)
・ITT集団において、C群127人中の29人(22.8%)、S群125人中の22人(17.6%)が生存しており、プロトコール治療を継続中だった
・ITT集団のS群で生存していた患者のうち6人は、病勢進行と判定されたのちにニボルマブ再投与を受けていた
・PFS集団において、C群89人中23人(25.8%)、S群85人中17人(20%)が生存しており、プロトコール治療を継続中だった
・PFS集団のS群で生存していた患者のうち4人は、病勢進行と判定されたのちにニボルマブ再投与を受けていた
・C群において、ランダム化時点からの治療継続期間中央値は13.6ヶ月(9.4-22.8ヶ月)だった
・PFS集団において、無増悪生存期間中央値はC群で有意に延長していた(C群24.7ヶ月、S群9.4ヶ月、ハザード比0.56、95%信頼区間は0.37-0.84)
・1年無増悪生存割合はC群64.6%、S群44.0%、2年無増悪生存割合はC群51.9%、S群30.7%だった
・ランダム割付時点で、CRもしくはPRの状態にあった患者では、C群で有意に無増悪生存期間中央値が延長していた(C群31.0ヶ月、S群10.6ヶ月、ハザード比0.46、95%信頼区間は0.27-0.77)
・ランダム割付時点で、SDの状態にあった患者では、無増悪生存期間中央値はC群とS群で同等だった(C群11.8ヶ月、S群9.4ヶ月、ハザード比1.01、95%信頼区間は0.51-2.01)
・ランダム割付後の無増悪生存期間がC群で延長する傾向は、想定していたサブグループ解析因子の大多数で認められた
・ITT集団において、ランダム割付後の生存期間中央値はC群で有意に延長していた(C群未到達、S群28.8ヶ月、ハザード比0.62、95%信頼区間は0.42-0.92)
・1年生存割合はほぼ同等だった(C群82.9%、S群81.7%)が、2年生存割合はC群で有意に延長していた(C群70.4%、S群56.8%)
・同様に、PFS集団では、ランダム割付後の生存期間中央値はC群で有意に延長していた(C群で未到達、S群で32.5ヶ月、ハザード比0.61、95%信頼区間は0.37-0.99)
・PFS集団における1年生存割合はC群で86.1%、S群で82.0%、2年生存割合はC群で73.4%、S群で60.9%だった
・PFS集団において、ランダム割付時にCR/PRの状態にあった患者でも、生存期間中央値はC群で有意に延長していた(C群で未到達、S群で33.5ヶ月、ハザード比0.50、95%信頼区間は0.26-0.97)
・PFS集団において、ランダム割付時にSDの状態にあった患者では、生存期間中央値はC群、S群で同等だった(C群32.2ヶ月、S群26.6ヶ月、ハザード比0.88、95%信頼区間は0.42-1.84)
・ランダム化前にPDと判定されていた患者では、生存期間中央値はC群で未到達、S群で23.8ヶ月、ハザード比0.70、95%信頼区間は0.37-1.33で、1年生存割合はC群で75.3%、S群で81.1%、2年生存割合はC群で63.0%、S群で47.8%だった
・ランダム割付時には無増悪状態にあったS群の患者で、ランダム化後に病死進行に至った者は47人(55.3%)いた
・この47人のうち、39人(83.0%)はニボルマブによる再治療を受けた
・データカットオフ時点で、4人(10.2%)の患者はニボルマブを継続しており、14人(35.9%)は生存していた
・PFS集団において、プロトコール治療を終えたのちに後治療に臨んだのはC群で37.1%、S群で48.2%いた
・後治療でがん薬物療法を受けた患者はC群の方が少なかった(C群24.7%、S群40.0%)
・最も高頻度に行われたがん薬物療法は、プロトコール治療終了後のニボルマブ再投与で、C群の14.6%、S群の17.6%で行われた
・ITT集団における後治療の内容はPFS集団のそれと似通っていた
・ランダム化後の有害事象発生頻度はC群の方が高く、治療期間がより長くなっていることに合致していた
・Grade 3-4の高度の有害事象は、C群で9.4%、S群で3.2%だった
・骨髄異形成症候群合併による治療関連死がC群において1人だけ認められた
https://ascopubs.org/doi/full/10.1200/JCO.20.00131
無料で全文読めるので、是非通読して、できれば抄読会などで紹介してほしい。
あくまで探索的検討の位置づけだが、継続投与の方が全生存期間、無増悪生存期間共に延長しており、市販後臨床試験として参加対象が広く設定されているだけに、決して無視できない結果である。
あえて生存曲線の図表はここに掲載しないが、上記のリンクから参照していただきたい。
当初1年間のニボルマブの効果が高いほど継続投与群の優位性が高くなる、というのはもちろん、興味深いのは、beyond PDの症例まで含んだ解析でも予後が延長しており、生存曲線を見る限り、その差はランダム化から1年間はほとんど見られないが、1年経過後(すなわち、継続投与群ではニボルマブ2年間投与後)から末広がりの様相で開いていく。
ランダム化時点でCR/PRだった患者群だけで解析すると、継続投与群がずっと上を行く。
また、ランダム化の時点でbeyond PDでニボルマブを使用していた患者群だけで解析してみると、ランダム化後1年間は期間限定投与群の方が予後がよく、その後は見事に関係が逆転し、継続投与群が上を行くようになる。
まるで、PD-L1発現状態ごとの生存曲線を見ているようだ。
何はともあれ、この結果を見てしまうと、少なくとも既治療非小細胞肺がんにおけるニボルマブ単剤療法では、少なくともCR/PRの治療効果が得られた患者では、途中でやめてしまおうという気にはなれない。
とても感銘を受けたので、論文本体をほぼ全訳して掲載する。
くどいようだが、図表は上記リンクから参照のこと。
Continuous Versus 1-Year Fixed-Duration Nivolumab in Previously Treated Advanced Non–Small-Cell Lung Cancer: CheckMate 153
David M. Waterhouse et al., J Clin Oncol 2020
DOI: 10.1200/JCO.20.00131 Journal of Clinical Oncology
背景:
非小細胞肺がんの治療時を含めて、免疫チェックポイント阻害薬の最適な治療継続期間についての臨床データは限られている。今回は、市販後大規模臨床試験である第IIIb / IV相のCheckMate153試験-ニボルマブを1年間のみ投与する治療と1年を超えて継続的に投与する治療での安全性と有効性を検証する試験-における探索的検証結果について報告する。
方法:
前治療歴のある深刻非小細胞肺がん患者を対象に、ニボルマブ単剤療法(3mg/kg、2週間ごと)を行った。画像診断では病勢進行相当だが、臨床的には効果が出ていると判断されて治療継続されている患者も含め、治療開始から1年経過時点で治療を継続している患者を対象に、そのままニボルマブを継続投与する群(C群)と、病勢進行時にはニボルマブ投与を再開できるという条件付きで1年までで投与を中止する群(S群)に無作為に割り付けた。
結果:
1,428人の患者がニボルマブによる治療を受け、そのうち252人(ITT集団)がC群(127人)とS群(125人)に無作為割付された。このうち、ランダム割付時点で病勢進行に至っていなかった患者は174人(PFS集団)で、C群で89人、S群で85人だった。無作為割付後の追跡期間がもっとも短い患者でも13.5ヶ月を経過していた。無増悪生存期間中央値はC群で24.7ヶ月、S群で9.4ヶ月と、有意にC群で延長していた(ハザード比0.56、95%信頼区間は0.37-0.84)。また、無作為割付後の生存期間中央値も、ITT集団(C群で未到達、S群で28.8ヶ月、ハザード比は0.62、95%信頼区間は0.42-0.92)、PFS集団(C群で未到達、S群で32.5ヶ月、ハザード比0.61、95%信頼区間は0.37-0.99)のいずれにおいてもC群で有意に延長していた。プロトコール治療中に新たに発生した治療関連有害事象はほぼなく、安全性に関する新規の所見は認めなかった。
結論:
我々の知る限り、今回の探索的検討から得られたこれらの所見は既治療進行非小細胞肺がんにおける免疫チェックポイント阻害薬の投与期間について無作為比較した初のデータである。1年間を超えるニボルマブ維持療法は予後を改善する。
前文:
・ニボルマブはPD-1を阻害するヒトIgG4抗体であり、既治療進行非小細胞肺がんに対する標準治療薬である
・CheckMate017試験とCheckMate057試験によりこうした位置づけが確立したが、これら試験では病勢進行に至るか、あるいは忍容不能な有害事象が発生するまでニボルマブの投与が継続され、ドセタキセルに対してニボルマブが優位に生存期間を延長した
・ニボルマブの治療効果は持続性があり、長期追跡調査の結果、5年生存割合はニボルマブ群で13%、ドセタキセル群で3%だった
・第I相試験であるCheckMate003試験にも非小細胞肺がんの患者が組み入れられており、非小細胞肺がんに対して免疫チェックポイント阻害薬が使用された一連の臨床試験では最も長期の追跡調査が行われているが、6年生存割合は15%であり、この患者集団においては過去に例のない長期生存効果を示している
・免疫チェックポイント阻害薬の最適な治療期間は、これまでのところ、どの臓器別腫瘍においてもわかっていない
・イピリムマブは、CTLA4を阻害するヒトIgG1抗体だが、進行悪性黒色腫に対してわずか4コースの治療を12週間の期間内で行うことにより、長期生存効果を示している
・対照的に、いくつかの悪性腫瘍に治療適応のあるPD-1 / PD-L1抗体の投与期間は各臨床試験で異なっており、病勢進行に至るまで継続投与とされているものもあれば、一定期間で打ち切られるものもある
・CheckMate003試験に参加した既治療非小細胞肺がんの患者において、ニボルマブの投与期間は96週間と規定されており、5年以上生存した患者の75%以上はニボルマブ投与後の追加治療なく5年経過時点でも無増悪生存を維持していたが、残る25%は96週間の治療期間を満了する前に有害事象のためプロトコール治療を中止していた(=5年生存した患者の25%は、有害事象のためにニボルマブ投与を中途で中止せざるを得なかったが、それでも5年生存した=ニボルマブの継続投与は、必ずしも長期生存には必要ないのかもしれないという推測が成り立つ)
・CheckMate153試験は現在も進行中の第IIIb / IV相の臨床試験であり、一般の第III相臨床試験とは異なり、広く日常臨床に即した試験で、それだけにより実際の患者集団を反映したデータが集まると考えられている
・本試験は、既治療進行非小細胞肺がん患者に対するニボルマブ単剤療法の安全性を検証する試験として立案された
・主要評価項目は安全性とされた
・ニボルマブ投与を一定期間に限定し、その有効性と安全性を評価した探索的解析についてのデータを今回報告する
・ニボルマブ投与により奏効が得られたかどうかに関わらず、1年間ニボルマブを継続投与された患者を対象に、そのままニボルマブを継続使用する群(C群)と、病勢進行時にはプロトコール治療としてニボルマブの再投与ができることを条件にいったんニボルマブの投与を中止する群(S群)にランダムに割り付けた
・我々の知る限り、本試験はPD-1阻害薬の投与期間を限定することの意義を検証した初めての臨床試験である
・今回は、ランダム化後13ヶ月以上の追跡期間をおいた最新のデータを報告する
方法:
・本試験は第IIIb / IV相の臨床試験である
・既治療進行非小細胞肺がん患者を対象に、ニボルマブ単剤療法について検証することを目的とした
・ニボルマブ3mg/kgを2週間ごとに経静脈投与した
・C群では、病勢進行、忍容不能の有害事象発現、患者の治療同意撤回のいずれかが発生するまではニボルマブ投与を継続することとした
・S群では、病勢進行、忍容不能の有害事象発現、患者の治療同意撤回、あるいは治療開始から1年間経過するまではニボルマブ投与を継続することとした
・治療開始後に最初の病勢進行が確認された場合にも、担当医により何らかの治療効果が確認され、急速な病勢進行を来しておらず、PSが安定していて継続治療に耐えうるとみなされたときは、beyond PDとしてニボルマブの継続投与可能とした
・プロトコール治療を開始した1人目の患者が1年間の治療期間を満了する前にプロトコール改定が行われ、ニボルマブ投与により奏効が得られたかどうかに関わらず、1年間ニボルマブを継続投与された患者を対象に、そのままニボルマブを継続使用する群(C群)と、病勢進行時にはプロトコール治療としてニボルマブの再投与ができることを条件にいったんニボルマブの投与を中止する群(S群)に患者を無作為に割り付けることになった
・主要評価項目は安全性とした
・2014年のプロトコール改定ののち、1年経過時点で治療を継続していた患者を対象として、ランダム化後の探索的評価項目(安全性、忍容性、無増悪生存期間、全生存期間、奏効割合)が追加された
・治療効果判定は担当医により行われた(独立した中央判定は行われなかった9
・プロトコール治療開始時点、すなわち、ランダム化から1年前の時点でベースラインの状態評価が行われ、治療開始後初回の効果判定は9週間目に、その後は治療開始から24ヶ月経過するまでは8週間ごとに、24ヶ月経過後は12週間ごとに、病勢進行に至るまで行われた
・治療反応性はランダム化の際の割付調整因子とはされなかった
・ベースライン状態評価はランダム化の際には行われず、あくまで治療開始時点の評価がベースラインの状態と設定され、病勢進行の評価は治療開始時点から治療期間中の最良効果時点からRECIST基準ver1.1に従って行われた
・プロトコール上、PD-L1発現状態の評価は義務付けられなかったが、腫瘍サンプルが利用可能な場合には評価した
・ランダム割付をされた全ての患者集団をIntent-to-treat集団(ITT集団)と定義した
・ITT集団のうち、ランダム割付前の時点で病勢進行に至っておらず、他のがん薬物療法によ次治療を行われていなかった患者を無増悪生存集団(PFS集団)と定義した
・安全性解析はITT集団を対象に行われ、ランダム割付からプロトコール治療を最後に行ってから100日後までに発生した有害事象を対象とした
・無増悪生存期間は、PFS集団のみを対象として解析した
・全生存期間は、ITT集団、PFS集団の両方において解析した
・無増悪生存期間と全生存期間は、ランダム化された日付を起算日としてKaplan-Meier法を用いて見積もることとし、BrookMeyer & Crowley法を用いて中央値と両側検定による95%信頼区間を算定した
・無増悪生存期間については、ベースラインの患者背景を調整しつつ、多変数解析を行った
・データカットオフ、データロックは2018年9月19日時点とした
結果:
・2014年4月16日から2018年9月18日の期間内に、総数1,428人の患者がプロトコール治療を開始した
・プロトコール治療から1年経過時点で、252人の患者(=ITT集団)がプロトコール治療を継続しており、治療反応性に関係なくランダム割付された
・C群に127人、S群に125人が割り付けられた
・ITT集団252人中78人(C群127人中38人、S群125人中40人)はbeyond PDとして、病勢進行と判定された後も臨床的効果が見られるとの担当医判断でプロトコール治療を継続されていた
・beyond PDの患者を除いたC群89人、S群85人、計174人がPFS集団となった
・PFS集団のうち、C群では最良効果が完全奏効(CR)もしくは部分奏効(PR)だった患者が62人、病勢安定(SD)だった患者が27人で、S群では最良効果がCRもしくはPRだった患者が58人、SDだった患者が27人だった
・C群、S群の患者背景はおおむねバランスよく調整されていたが、S群に比べてC群では扁平上皮がんの患者割合が少なかった(ITT集団では26.8% vs 44.0%, PFS集団では31.5% vs 41.2%)
・ITT集団において、C群127人のうち65人(51.2%)、S群125人のうち61人(48.8%)でPD-L1発現状態を評価可能だった
・PFS集団において、C群89人のうち50人(56.2%)、S群85人のうち50人(58.8%)でPD-L1発現状態を評価可能だった
・データカットオフ時点で、ITT集団におけるランダム化後の最短経過観察期間は13.5ヶ月だった(=ITT集団全員で、13.5ヶ月以上の経過観察期間を確保できた)
・ITT集団において、C群127人中の29人(22.8%)、S群125人中の22人(17.6%)が生存しており、プロトコール治療を継続中だった
・ITT集団のS群で生存していた患者のうち6人は、病勢進行と判定されたのちにニボルマブ再投与を受けていた
・PFS集団において、C群89人中23人(25.8%)、S群85人中17人(20%)が生存しており、プロトコール治療を継続中だった
・PFS集団のS群で生存していた患者のうち4人は、病勢進行と判定されたのちにニボルマブ再投与を受けていた
・C群において、ランダム化時点からの治療継続期間中央値は13.6ヶ月(9.4-22.8ヶ月)だった
・PFS集団において、無増悪生存期間中央値はC群で有意に延長していた(C群24.7ヶ月、S群9.4ヶ月、ハザード比0.56、95%信頼区間は0.37-0.84)
・1年無増悪生存割合はC群64.6%、S群44.0%、2年無増悪生存割合はC群51.9%、S群30.7%だった
・ランダム割付時点で、CRもしくはPRの状態にあった患者では、C群で有意に無増悪生存期間中央値が延長していた(C群31.0ヶ月、S群10.6ヶ月、ハザード比0.46、95%信頼区間は0.27-0.77)
・ランダム割付時点で、SDの状態にあった患者では、無増悪生存期間中央値はC群とS群で同等だった(C群11.8ヶ月、S群9.4ヶ月、ハザード比1.01、95%信頼区間は0.51-2.01)
・ランダム割付後の無増悪生存期間がC群で延長する傾向は、想定していたサブグループ解析因子の大多数で認められた
・ITT集団において、ランダム割付後の生存期間中央値はC群で有意に延長していた(C群未到達、S群28.8ヶ月、ハザード比0.62、95%信頼区間は0.42-0.92)
・1年生存割合はほぼ同等だった(C群82.9%、S群81.7%)が、2年生存割合はC群で有意に延長していた(C群70.4%、S群56.8%)
・同様に、PFS集団では、ランダム割付後の生存期間中央値はC群で有意に延長していた(C群で未到達、S群で32.5ヶ月、ハザード比0.61、95%信頼区間は0.37-0.99)
・PFS集団における1年生存割合はC群で86.1%、S群で82.0%、2年生存割合はC群で73.4%、S群で60.9%だった
・PFS集団において、ランダム割付時にCR/PRの状態にあった患者でも、生存期間中央値はC群で有意に延長していた(C群で未到達、S群で33.5ヶ月、ハザード比0.50、95%信頼区間は0.26-0.97)
・PFS集団において、ランダム割付時にSDの状態にあった患者では、生存期間中央値はC群、S群で同等だった(C群32.2ヶ月、S群26.6ヶ月、ハザード比0.88、95%信頼区間は0.42-1.84)
・ランダム化前にPDと判定されていた患者では、生存期間中央値はC群で未到達、S群で23.8ヶ月、ハザード比0.70、95%信頼区間は0.37-1.33で、1年生存割合はC群で75.3%、S群で81.1%、2年生存割合はC群で63.0%、S群で47.8%だった
・ランダム割付時には無増悪状態にあったS群の患者で、ランダム化後に病死進行に至った者は47人(55.3%)いた
・この47人のうち、39人(83.0%)はニボルマブによる再治療を受けた
・データカットオフ時点で、4人(10.2%)の患者はニボルマブを継続しており、14人(35.9%)は生存していた
・PFS集団において、プロトコール治療を終えたのちに後治療に臨んだのはC群で37.1%、S群で48.2%いた
・後治療でがん薬物療法を受けた患者はC群の方が少なかった(C群24.7%、S群40.0%)
・最も高頻度に行われたがん薬物療法は、プロトコール治療終了後のニボルマブ再投与で、C群の14.6%、S群の17.6%で行われた
・ITT集団における後治療の内容はPFS集団のそれと似通っていた
・ランダム化後の有害事象発生頻度はC群の方が高く、治療期間がより長くなっていることに合致していた
・Grade 3-4の高度の有害事象は、C群で9.4%、S群で3.2%だった
・骨髄異形成症候群合併による治療関連死がC群において1人だけ認められた
2020年09月26日
進行肺扁平上皮がんに対するカルボプラチン+S-1併用療法後のS1維持療法・・・やめておきます。
いろんな場面で維持療法をすることが当たり前になってしまった。
進行非扁平上皮非小細胞肺がんに対するカルボプラチン+パクリタキセル+ベバシズマブ併用療法後のベバシズマブ維持療法。
進行非扁平上皮非小細胞肺がんに対するプラチナ製剤+ペメトレキセド併用療法後のペメトレキセド維持療法。
免疫チェックポイント阻害薬は、単剤なら長期投与が原則だ。
プラチナ併用化学療法+免疫チェックポイント阻害薬±ベバシズマブ併用療法においても、維持療法の対象となる薬剤は使い続けるのが原則となっている。
なぜって、企業主導でそういう臨床試験デザインが組まれて、結果がpositiveだったから。
免疫チェックポイント阻害薬単剤の長期投与は、ニボルマブに関する臨床試験の結果を見る限りでは妥当性がありそうで、おそらく他の免疫チェックポイント阻害薬でも同様のことが言えるだろう。
http://oitahaiganpractice.junglekouen.com/e916533.html
しかし、その他の薬剤では、本当に維持療法が必要なのかどうか、いまだに疑わしい。
しかしながら、維持療法の意義を問う臨床試験は、少なくとも企業主導治験としては立案すら期待できない。
維持療法の意義が否定されたら、企業利益を損なうからだ。
そういった点で、今回のWJOG7512L試験は、維持療法コンセプトの是非を考えるうえでとても含蓄の深い臨床試験だと思う。
Cancer誌に掲載された論文の要約を読めば、主要評価項目である無増悪生存期間を有意に延長したため、進行肺扁平上皮がん患者に対するカルボプラチン+S-1併用導入療法4コース後に病勢進行に至らなかった患者に対するS-1維持療法は有効な初回標準治療の一つと受け止められる。
しかし、過去の学会報告の資料を紐解けば、統計学的有意ではないにしても、S-1維持療法群の生存期間中央値は緩和治療群よりも1ヶ月強短くなっている。
いかに軽微とは言え、S-1維持療法による身体毒性、経済毒性の対価が1ヶ月の生存期間短縮というのは、割に合わない。
そのため今回は、生存期間中央値のデータが明記されている学会報告の要約を敢えて掲載することにした。
また、導入療法後の病勢コントロール割合が36%しかない(裏を返せば、病勢進行割合が64%に上る)というのは、なかなか厳しい現実だ。
患者に対して、カルボプラチン+S-1併用療法をしても約65%の患者さんで3か月以内に病状が悪化します、と説明しなければならない。
これから初めての抗がん薬治療に臨もうという患者にとって、なんと辛い説明だろうか。
WJOG7512L試験は統計学的有意に主要評価項目を満たしており、臨床試験としてはpositiveだったわけだが、私はS-1維持療法は実地臨床では用いないことにした。
こういうことも起こり得るのかと、とても勉強になった。
本臨床試験の立案・実施・結果公表に尽力された先生方に賛辞を贈りたい。
A randomized phase 3 study of maintenance therapy with S‐1 plus best supportive care versus best supportive care after induction therapy with carboplatin plus S‐1 for advanced or relapsed squamous cell carcinoma of the lung (WJOG7512L)
Kaoru Tanaka et al.
Cancer, Volume126, Issue16, August 15, 2020, 3648-3656
https://doi.org/10.1002/cncr.32987
Randomized phase 3 study of maintenance therapy with S-1 plus best supportive care (BSC) versus BSC alone after induction therapy with carboplatin plus S-1 for advanced or relapsed squamous cell lung carcinoma (WJOG7512L).
Kaoru Tanaka, et al.
ASCO 2019 Abst.#e20531
背景:
以前我々が行った第III相臨床試験の結果、カルボプラチン+S-1併用療法は進行非小細胞肺がんの一次治療における標準治療のひとつと位置付けられた(J Clin Oncol 2010; 28: 5240)。しかしながら、進行扁平上皮がん患者における維持療法の重要性はまだわかっていない。
方法:
WJOG7512L試験は、進行扁平上皮がん患者を対象に、カルボプラチン+S-1併用導入療法後のS-1維持療法が臨床的アウトカムを改善するかどうかを検証するためのランダム化第III相比較試験として立案された。ランダム化前に、対象患者はカルボプラチン(5AUC, day1, 3週ごと)+S-1(40mg/㎡を1日2回分割投与, day1-day14, 3週ごと)併用療法を導入治療として施行された。4コースの導入療法後に病勢進行に至らなかった患者を、S-1+緩和医療群(S群)と緩和医療単独群(P群)に無作為に割り付けた。主要評価項目は無増悪生存期間とし、P群に対するS群の優越性を検証した。
結果:
365人の患者が登録され、347人(95%)が導入治療を受け、131人(36%)がS群(67人)とP群(64人)に無作為割付された。導入療法に対する反応性を含め、患者背景は両群間に偏りがなかった。P群と比較して、S群では有意に病勢進行のリスクが低下していた(ハザード比0.548、95%信頼区間は0.374-0.802、p=0.0019)。ランダム化以降の生存期間中央値は、S群で16.7ヶ月、P群で17.8ヶ月と、両群間に有意差を認めなかった(ハザード比0.890、95%信頼区間は0.583-1.357)。ランダム化からQoL低下までの期間もまた、両群間で有意差を認めなかった(FACT-TOI質問票ではp=0.8754、FACT-LCS質問票ではp=0.9016)。維持療法中の有害事象発生割合は低く、Grade 3-4の好中球減少、貧血、血小板減少といった骨髄抑制の頻度は4%以下だった。
結論:
カルボプラチン+S-1併用導入療法後のS-1維持療法は、進行肺扁平上皮がん患者に対する効果的で忍容性のある治療オプションである。
進行非扁平上皮非小細胞肺がんに対するカルボプラチン+パクリタキセル+ベバシズマブ併用療法後のベバシズマブ維持療法。
進行非扁平上皮非小細胞肺がんに対するプラチナ製剤+ペメトレキセド併用療法後のペメトレキセド維持療法。
免疫チェックポイント阻害薬は、単剤なら長期投与が原則だ。
プラチナ併用化学療法+免疫チェックポイント阻害薬±ベバシズマブ併用療法においても、維持療法の対象となる薬剤は使い続けるのが原則となっている。
なぜって、企業主導でそういう臨床試験デザインが組まれて、結果がpositiveだったから。
免疫チェックポイント阻害薬単剤の長期投与は、ニボルマブに関する臨床試験の結果を見る限りでは妥当性がありそうで、おそらく他の免疫チェックポイント阻害薬でも同様のことが言えるだろう。
http://oitahaiganpractice.junglekouen.com/e916533.html
しかし、その他の薬剤では、本当に維持療法が必要なのかどうか、いまだに疑わしい。
しかしながら、維持療法の意義を問う臨床試験は、少なくとも企業主導治験としては立案すら期待できない。
維持療法の意義が否定されたら、企業利益を損なうからだ。
そういった点で、今回のWJOG7512L試験は、維持療法コンセプトの是非を考えるうえでとても含蓄の深い臨床試験だと思う。
Cancer誌に掲載された論文の要約を読めば、主要評価項目である無増悪生存期間を有意に延長したため、進行肺扁平上皮がん患者に対するカルボプラチン+S-1併用導入療法4コース後に病勢進行に至らなかった患者に対するS-1維持療法は有効な初回標準治療の一つと受け止められる。
しかし、過去の学会報告の資料を紐解けば、統計学的有意ではないにしても、S-1維持療法群の生存期間中央値は緩和治療群よりも1ヶ月強短くなっている。
いかに軽微とは言え、S-1維持療法による身体毒性、経済毒性の対価が1ヶ月の生存期間短縮というのは、割に合わない。
そのため今回は、生存期間中央値のデータが明記されている学会報告の要約を敢えて掲載することにした。
また、導入療法後の病勢コントロール割合が36%しかない(裏を返せば、病勢進行割合が64%に上る)というのは、なかなか厳しい現実だ。
患者に対して、カルボプラチン+S-1併用療法をしても約65%の患者さんで3か月以内に病状が悪化します、と説明しなければならない。
これから初めての抗がん薬治療に臨もうという患者にとって、なんと辛い説明だろうか。
WJOG7512L試験は統計学的有意に主要評価項目を満たしており、臨床試験としてはpositiveだったわけだが、私はS-1維持療法は実地臨床では用いないことにした。
こういうことも起こり得るのかと、とても勉強になった。
本臨床試験の立案・実施・結果公表に尽力された先生方に賛辞を贈りたい。
A randomized phase 3 study of maintenance therapy with S‐1 plus best supportive care versus best supportive care after induction therapy with carboplatin plus S‐1 for advanced or relapsed squamous cell carcinoma of the lung (WJOG7512L)
Kaoru Tanaka et al.
Cancer, Volume126, Issue16, August 15, 2020, 3648-3656
https://doi.org/10.1002/cncr.32987
Randomized phase 3 study of maintenance therapy with S-1 plus best supportive care (BSC) versus BSC alone after induction therapy with carboplatin plus S-1 for advanced or relapsed squamous cell lung carcinoma (WJOG7512L).
Kaoru Tanaka, et al.
ASCO 2019 Abst.#e20531
背景:
以前我々が行った第III相臨床試験の結果、カルボプラチン+S-1併用療法は進行非小細胞肺がんの一次治療における標準治療のひとつと位置付けられた(J Clin Oncol 2010; 28: 5240)。しかしながら、進行扁平上皮がん患者における維持療法の重要性はまだわかっていない。
方法:
WJOG7512L試験は、進行扁平上皮がん患者を対象に、カルボプラチン+S-1併用導入療法後のS-1維持療法が臨床的アウトカムを改善するかどうかを検証するためのランダム化第III相比較試験として立案された。ランダム化前に、対象患者はカルボプラチン(5AUC, day1, 3週ごと)+S-1(40mg/㎡を1日2回分割投与, day1-day14, 3週ごと)併用療法を導入治療として施行された。4コースの導入療法後に病勢進行に至らなかった患者を、S-1+緩和医療群(S群)と緩和医療単独群(P群)に無作為に割り付けた。主要評価項目は無増悪生存期間とし、P群に対するS群の優越性を検証した。
結果:
365人の患者が登録され、347人(95%)が導入治療を受け、131人(36%)がS群(67人)とP群(64人)に無作為割付された。導入療法に対する反応性を含め、患者背景は両群間に偏りがなかった。P群と比較して、S群では有意に病勢進行のリスクが低下していた(ハザード比0.548、95%信頼区間は0.374-0.802、p=0.0019)。ランダム化以降の生存期間中央値は、S群で16.7ヶ月、P群で17.8ヶ月と、両群間に有意差を認めなかった(ハザード比0.890、95%信頼区間は0.583-1.357)。ランダム化からQoL低下までの期間もまた、両群間で有意差を認めなかった(FACT-TOI質問票ではp=0.8754、FACT-LCS質問票ではp=0.9016)。維持療法中の有害事象発生割合は低く、Grade 3-4の好中球減少、貧血、血小板減少といった骨髄抑制の頻度は4%以下だった。
結論:
カルボプラチン+S-1併用導入療法後のS-1維持療法は、進行肺扁平上皮がん患者に対する効果的で忍容性のある治療オプションである。
2020年09月24日
T.M.先生、ADAURA試験について語る
そろそろ欧州臨床腫瘍学会の話題を仕入れようとネットサーフィンをしていたら、国立がん研究センター東病院のT.M.先生が英語でプレゼンテーションをなさっている動画を見つけてしまい、びっくりたまげて椅子から滑り落ちてしまった。
https://ascopost.com/videos/esmo-virtual-congress-2020/masahiro-tsuboi-on-adjuvant-osimertinib-in-egfr-mutated-nsclc/
ときどきこのウェブサイトを覗いているのだが、日本国内で診療しておられる日本人の先生が肺がん分野で登場するのは、あまり記憶にない。
T.M.先生のプレゼンテーションから、頭に残ったことを書き残す。
Osimertinib adjuvant therapy in patients (pts) with resected EGFR mutated (EGFRm) NSCLC (ADAURA): Central nervous system (CNS) disease recurrence
ESMO 2020, Abst. #LBA1
背景:
非小細胞肺がんにおける中枢神経系への転移再発はよくあることで、予後不良因子である。外科切除後のEGFR遺伝子変異陽性非小細胞肺がんにおいて、中枢神経系を含む再発病巣への治療有効性は、治療戦略を考えるうえでのカギとなる。オシメルチニブは第三世代のEGFRチロシンキナーゼ阻害薬で、非小細胞肺がんにおける中枢神経系転移に対して有効であることが証明されている。ADAURA試験では、外科切除後の病理病期IB-IIIA期EGFR遺伝子変異陽性(Exon 19 変異もしくはExon 21変異)非小細胞肺がんに対する術後補助化学療法として、オシメルチニブがプラセボ(偽薬)と比較して有意かつ臨床的に意義のある無病生存期間延長を達成した(ハザード比0.20、99.12%信頼区間は0.14-0.30、p<0.001)。今回は、ADAURA試験における再発様式に関しての探索的検討について報告する。
方法:
術後補助化学療法施行の有無を問わず、外科切除後病理病期IB-IIIA期、EGFR遺伝子変異陽性の非小細胞肺がん患者を、オシメルチニブ80mg1日1回投与をする群(O群)とプラセボを投与する群(P群)に1:1の比率で無作為割付し、病勢進行・治療継続不能・治療開始から3年間経過のどれかを満たすまで継続治療した。再発様式と中枢神経系に特化した無病生存期間(中枢神経系への転移再発を確認されるか、患者が死亡するかをイベントと判定する)を探索的評価項目とした。術前、もしくは臨床試験参加登録前の段階での頭部MRIもしくはCTでの脳転移巣検索を臨床試験参加条件として義務付けたが、臨床症状がなければこれら検査は免除した。再発様式は、局所再発と遠隔転移再発に分類され、再発部位が記録された。2020年1月17日にデータカットオフを行った。
結果:
全体で682人の患者が無作為割付され、O群に339人、P群に343人が割り振られた。O群ではP群に比べて再発イベントが少なかった。観察期間中央値22ヶ月間の時点で全体の45人(O群6人、P群39人)が中枢神経系再発イベントを起こした。12ヶ月時点における暫定的な中枢神経系再発割合は、O群で1%未満、P群で7%だった。中枢神経系無病生存期間中央値はO群では未到達(95%信頼区間は39.0ヶ月以上)、P群では48.2ヶ月(95%信頼区間算出困難)だった。中枢神経系無病生存期間のハザード比は0.18(95%信頼区間は0.10-0.33)で、p<0.0001だった。
Table: LBA1
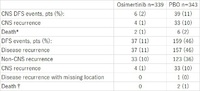
*Death in absence of CNS disease recurrence, or death within two visits of baseline where the patient has no evaluable assessments or no baseline data. †Death in the absence of disease recurrence (any site), or death within two visits of baseline where the patient has no evaluable assessments or no baseline data.
結論:
オシメルチニブによる臨床的に意義のある中枢神経系無病生存期間の改善効果が確認された。プラセボと比較して、再発もしくは死亡のリスクを82%逓減した。今回の結果により、EGFR遺伝子変異陽性の根治的切除後非小細胞肺がん患者においては、オシメルチニブが中枢神経系への転移再発を抑制する効果が明らかとなった。
Dr.T.M.のコメント
・ADAURA試験は術後病理病期IB-IIIA期、EGFR遺伝子変異陽性の患者を対象に、オシメルチニブとプラセボの効果比較を行う臨床試験である
・対象となる患者682人を、1:1の比率でオシメルチニブ群とプラセボ群に無作為に割り付けた
・主要評価項目はII-IIIA期の患者における無病生存期間
・副次評価項目はIB-IIIA期の全ての患者における無病生存期間
・主要評価項目はハザード比0.17、この時点では再発・死亡に関する83%のリスク逓減効果があった
・副次評価項目はハザード比0.20、同じく再発・死亡に関する80%のリスク逓減効果があった
・中枢神経系無病生存期間はハザード比0.18で、中枢神経系転移もしくは死亡に関する82%のリスク逓減効果があった
https://ascopost.com/videos/esmo-virtual-congress-2020/masahiro-tsuboi-on-adjuvant-osimertinib-in-egfr-mutated-nsclc/
ときどきこのウェブサイトを覗いているのだが、日本国内で診療しておられる日本人の先生が肺がん分野で登場するのは、あまり記憶にない。
T.M.先生のプレゼンテーションから、頭に残ったことを書き残す。
Osimertinib adjuvant therapy in patients (pts) with resected EGFR mutated (EGFRm) NSCLC (ADAURA): Central nervous system (CNS) disease recurrence
ESMO 2020, Abst. #LBA1
背景:
非小細胞肺がんにおける中枢神経系への転移再発はよくあることで、予後不良因子である。外科切除後のEGFR遺伝子変異陽性非小細胞肺がんにおいて、中枢神経系を含む再発病巣への治療有効性は、治療戦略を考えるうえでのカギとなる。オシメルチニブは第三世代のEGFRチロシンキナーゼ阻害薬で、非小細胞肺がんにおける中枢神経系転移に対して有効であることが証明されている。ADAURA試験では、外科切除後の病理病期IB-IIIA期EGFR遺伝子変異陽性(Exon 19 変異もしくはExon 21変異)非小細胞肺がんに対する術後補助化学療法として、オシメルチニブがプラセボ(偽薬)と比較して有意かつ臨床的に意義のある無病生存期間延長を達成した(ハザード比0.20、99.12%信頼区間は0.14-0.30、p<0.001)。今回は、ADAURA試験における再発様式に関しての探索的検討について報告する。
方法:
術後補助化学療法施行の有無を問わず、外科切除後病理病期IB-IIIA期、EGFR遺伝子変異陽性の非小細胞肺がん患者を、オシメルチニブ80mg1日1回投与をする群(O群)とプラセボを投与する群(P群)に1:1の比率で無作為割付し、病勢進行・治療継続不能・治療開始から3年間経過のどれかを満たすまで継続治療した。再発様式と中枢神経系に特化した無病生存期間(中枢神経系への転移再発を確認されるか、患者が死亡するかをイベントと判定する)を探索的評価項目とした。術前、もしくは臨床試験参加登録前の段階での頭部MRIもしくはCTでの脳転移巣検索を臨床試験参加条件として義務付けたが、臨床症状がなければこれら検査は免除した。再発様式は、局所再発と遠隔転移再発に分類され、再発部位が記録された。2020年1月17日にデータカットオフを行った。
結果:
全体で682人の患者が無作為割付され、O群に339人、P群に343人が割り振られた。O群ではP群に比べて再発イベントが少なかった。観察期間中央値22ヶ月間の時点で全体の45人(O群6人、P群39人)が中枢神経系再発イベントを起こした。12ヶ月時点における暫定的な中枢神経系再発割合は、O群で1%未満、P群で7%だった。中枢神経系無病生存期間中央値はO群では未到達(95%信頼区間は39.0ヶ月以上)、P群では48.2ヶ月(95%信頼区間算出困難)だった。中枢神経系無病生存期間のハザード比は0.18(95%信頼区間は0.10-0.33)で、p<0.0001だった。
Table: LBA1

*Death in absence of CNS disease recurrence, or death within two visits of baseline where the patient has no evaluable assessments or no baseline data. †Death in the absence of disease recurrence (any site), or death within two visits of baseline where the patient has no evaluable assessments or no baseline data.
結論:
オシメルチニブによる臨床的に意義のある中枢神経系無病生存期間の改善効果が確認された。プラセボと比較して、再発もしくは死亡のリスクを82%逓減した。今回の結果により、EGFR遺伝子変異陽性の根治的切除後非小細胞肺がん患者においては、オシメルチニブが中枢神経系への転移再発を抑制する効果が明らかとなった。
Dr.T.M.のコメント
・ADAURA試験は術後病理病期IB-IIIA期、EGFR遺伝子変異陽性の患者を対象に、オシメルチニブとプラセボの効果比較を行う臨床試験である
・対象となる患者682人を、1:1の比率でオシメルチニブ群とプラセボ群に無作為に割り付けた
・主要評価項目はII-IIIA期の患者における無病生存期間
・副次評価項目はIB-IIIA期の全ての患者における無病生存期間
・主要評価項目はハザード比0.17、この時点では再発・死亡に関する83%のリスク逓減効果があった
・副次評価項目はハザード比0.20、同じく再発・死亡に関する80%のリスク逓減効果があった
・中枢神経系無病生存期間はハザード比0.18で、中枢神経系転移もしくは死亡に関する82%のリスク逓減効果があった
2020年09月24日
肺癌画像診断と白黒反転
最近、肺がん診断のための気管支鏡検査を見ていて、少し気がかりなことがある。
胸部レントゲンの所見確認が軽視されているように思われてならない。
そもそも、気管支鏡検査前に胸部レントゲン写真が撮影されていないことすらある。
私と同世代の医師が、駆け出しのころに同じことをしていたら、きっと指導医にコテンパンにのされていたことだろう。
経気管支肺生検の現場に立ってみると。
気管支鏡ナビゲーションシステムによる事前の経路確認は抜かりない。
性能のよい気管支鏡機材が怠りなく準備されている。
超音波プローブやガイドシースの準備も万端である。
あとは仕上げを御覧じろ、ということで検査を始めてみると、しばしばずっこけてしまう。
レントゲン透視画像を見る限り、どう見ても術者が目指す病巣を把握できていないとしか思えないことがしばしばあるのだ。
気管支鏡検査に臨む若い先生方に、ぜひ試してみてほしいことがある。
気管支鏡検査前にぜひ一度、仰臥位正面でA-P撮影した胸部レントゲンを白黒反転させて、目指す病巣を確認してほしいのだ。
気管支鏡検査をするときは患者さんは仰臥位正面の状態で横たわっているため、検査前の検討段階でも同じ条件のレントゲンを撮影して病巣を確認しておくことが望ましい。
そして、白黒反転させることにより、意外なくらいに病巣が浮き上がって見えてくることがある。
加えていうならば、CTでも白黒反転をさせると、病巣が認識しやすくなることがある。
病巣のサイズ測定には、白黒反転を標準とした方がいいのでは、と思えることがあるくらいだ。
私が修行していたころ、レントゲン読影のフィルムには必ず白黒反転画像が付されていたが、この年になってそのありがたみがよく分かるようになった。
透視画像で狙うべき病巣が事前に正確に把握できているかいないかでは、雲泥の差がある。
こうした小さな事前準備が、正確な診断のために欠かせない。
胸部レントゲンの所見確認が軽視されているように思われてならない。
そもそも、気管支鏡検査前に胸部レントゲン写真が撮影されていないことすらある。
私と同世代の医師が、駆け出しのころに同じことをしていたら、きっと指導医にコテンパンにのされていたことだろう。
経気管支肺生検の現場に立ってみると。
気管支鏡ナビゲーションシステムによる事前の経路確認は抜かりない。
性能のよい気管支鏡機材が怠りなく準備されている。
超音波プローブやガイドシースの準備も万端である。
あとは仕上げを御覧じろ、ということで検査を始めてみると、しばしばずっこけてしまう。
レントゲン透視画像を見る限り、どう見ても術者が目指す病巣を把握できていないとしか思えないことがしばしばあるのだ。
気管支鏡検査に臨む若い先生方に、ぜひ試してみてほしいことがある。
気管支鏡検査前にぜひ一度、仰臥位正面でA-P撮影した胸部レントゲンを白黒反転させて、目指す病巣を確認してほしいのだ。
気管支鏡検査をするときは患者さんは仰臥位正面の状態で横たわっているため、検査前の検討段階でも同じ条件のレントゲンを撮影して病巣を確認しておくことが望ましい。
そして、白黒反転させることにより、意外なくらいに病巣が浮き上がって見えてくることがある。
加えていうならば、CTでも白黒反転をさせると、病巣が認識しやすくなることがある。
病巣のサイズ測定には、白黒反転を標準とした方がいいのでは、と思えることがあるくらいだ。
私が修行していたころ、レントゲン読影のフィルムには必ず白黒反転画像が付されていたが、この年になってそのありがたみがよく分かるようになった。
透視画像で狙うべき病巣が事前に正確に把握できているかいないかでは、雲泥の差がある。
こうした小さな事前準備が、正確な診断のために欠かせない。
2020年09月21日
予後因子を知ることに果たして意味はあるのか
治療効果予測因子(predictive marker)と生命予後因子(prognostic marker)は、似て非なるものだ。
がん治療において、治療効果予測因子はこれから行おうとする治療の効果がどの程度その患者において期待できるのかを知るためのめやすである。
ある因子Aを調べたとき、それがあればなにも治療をしなければ6ヶ月しか生きられないところ、治療Bをすると1年長生きができる、となれば、治療Bを望む患者は多いだろう。
この場合、因子Aは治療効果予測因子といってよい。
分子標的薬を用いるにあたってのドライバー遺伝子変異の有無はこの好例である。
ところが、ある因子Cを調べたとき、それがなければ6ヶ月しか生きられないところ、それがあると1年長生きができ、治療Bをしても長生き期間は変わらない、あるいは長生き期間は因子Cの有無にかかわらず等しく2ヶ月伸びる、といった場合、因子Cは治療効果を予測しているわけではなく、ただ単にそれがあると治療に関わらずより長生きできることを示している。
この場合、因子Cは生命予後因子といってよい。
分子標的薬も抗体医薬も免疫チェックポイント阻害薬もまだ世の中になかった頃から、治療効果予測因子や生命予後因子を探ろうとする研究は枚挙のいとまがないほど行われてきた。
かくいう私も、学位論文のもととなったのはある生命予後因子を臨床病理学的に証明したことだった。
しかし、生命予後因子は比較的簡単に見つかるが、治療効果予測因子を見出すのはそう簡単ではない。
そして、治療効果予測因子は実際の治療に役立つが、生命予後因子を実際の患者に当てはめても、あまりいいことはない。
長生きできない患者が、長生きできないとわかるだけで、それを正直に伝えても患者と家族を落胆させるだけである。
おそらく、進行非小細胞肺がん患者に対して免疫チェックポイント阻害薬を用いる際に、白血球の分画比を求めるのは、生命予後因子を調べていることにほかならず、治療効果予測因子を見ているわけではないだろう。
もちろん我々は、白血球の分画比を見て免疫チェックポイント阻害薬を使うかどうかを決めているわけではない。
なぜこんなことを書くかというと、以下の論文を読んでいて表題の感想を持ったからだ。
LIPIを調べて予後不良群だとわかったときに、果たしてアテゾリズマブもドセタキセルも使用しない、という選択肢があるのか。
それこそ、知らぬが仏、というものではないか。
Evaluation of the Lung Immune Prognostic Index for Prediction of Survival and Response in Patients Treated With Atezolizumab for NSCLC: Pooled Analysis of Clinical Trials
Michael J Sorich et al.,
J Thorac Oncol. 2019 Aug;14(8):1440-1446
doi: 10.1016/j.jtho.2019.04.006. Epub 2019 Apr 15
背景:
免疫チェックポイント阻害薬での治療を受けた患者の生命予後や治療反応性にはばらつきがあり、治療意思決定に役立つ治療効果予測因子が求められている。Lung Immune Prognostic Index(LIPI)は免疫チェックポイント阻害薬による治療効果を予測するために最近開発された。今回の研究では、進行非小細胞肺がんに対してアテゾリズマブを使用した患者を対象に、LIPIが生命予後と治療反応性の予測因子となり得るかどうかを検証した。
方法:
非小細胞肺がんに対してアテゾリズマブを使用する4件の臨床試験(BIRCH試験, FIR試験:いずれも、PD-L1陽性の進行非小細胞肺がん患者を対象とした単アーム試験, OAK試験,POPLAR試験:いずれも、プラチナ併用化学療法後に病勢進行した進行非小細胞肺がん患者を対象とした、アテゾリズマブとドセタキセルを比較するランダム化試験) から、各患者の個別データを集積した。治療開始前の好中球-リンパ球比率が3以上であるかどうか、同じく治療開始前のLDH値が正常上限を超えているかどうかを基準として、患者を3グループに分類した。LIPI良好群はリスク因子0ケ、LIPI中間群はリスク因子1ケ、LIPI不良群はリスク因子2ケが該当する患者とした。主要評価項目は全生存期間、副次評価項目は無増悪生存期間及び奏効割合とした。
結果:
LIPIが高値になるほど、患者年齢は若く、PSは悪く、遠隔転移巣は多く、肝転移や骨転移を伴う頻度が高く、確定診断から各臨床試験参加までの期間が短く(初回治療後増悪までの期間が短く)なる傾向にあった。LIPIとPD-L1発現の間に有意な相関は認めなかった。
少なくとも1コースのアテゾリズマブによる治療を受けた1489人の患者集団を調べたところ、LIPIは全生存期間(p<0.001)、無増悪生存期間(p<0.001)、奏効割合(p<0.001)と有意に相関していた。生存期間中央値は、LIPI良好群(n=678)で18.4ヶ月、LIPI中間群(n=180)で11.3ヶ月、LIPI不良群で4.5ヶ月だった。アテゾリズマブで治療を受けた患者集団において、LIPIと全生存期間の関係性は、喫煙歴、年齢、PS、組織型、前治療歴、PD-L1発現状態に拠らず一貫していた。一方、OAK試験とPOPLAR試験において、少なくとも1コースのドセタキセルによる治療を受けた687人の患者集団を調べたところ、同様にLIPIは全生存期間(p<0.001)や奏効割合(p=0.005)と相関していた。
結論:
治療開始前のLIPIはアテゾリズマブによる治療を受けた患者集団の全生存期間、奏効割合の予後因子として有用である。一方、LIPIは同様に化学療法を受けた患者においても予後因子である。それゆえ、LIPIは免疫チェックポイント阻害薬に特異的な予測因子ではない。
がん治療において、治療効果予測因子はこれから行おうとする治療の効果がどの程度その患者において期待できるのかを知るためのめやすである。
ある因子Aを調べたとき、それがあればなにも治療をしなければ6ヶ月しか生きられないところ、治療Bをすると1年長生きができる、となれば、治療Bを望む患者は多いだろう。
この場合、因子Aは治療効果予測因子といってよい。
分子標的薬を用いるにあたってのドライバー遺伝子変異の有無はこの好例である。
ところが、ある因子Cを調べたとき、それがなければ6ヶ月しか生きられないところ、それがあると1年長生きができ、治療Bをしても長生き期間は変わらない、あるいは長生き期間は因子Cの有無にかかわらず等しく2ヶ月伸びる、といった場合、因子Cは治療効果を予測しているわけではなく、ただ単にそれがあると治療に関わらずより長生きできることを示している。
この場合、因子Cは生命予後因子といってよい。
分子標的薬も抗体医薬も免疫チェックポイント阻害薬もまだ世の中になかった頃から、治療効果予測因子や生命予後因子を探ろうとする研究は枚挙のいとまがないほど行われてきた。
かくいう私も、学位論文のもととなったのはある生命予後因子を臨床病理学的に証明したことだった。
しかし、生命予後因子は比較的簡単に見つかるが、治療効果予測因子を見出すのはそう簡単ではない。
そして、治療効果予測因子は実際の治療に役立つが、生命予後因子を実際の患者に当てはめても、あまりいいことはない。
長生きできない患者が、長生きできないとわかるだけで、それを正直に伝えても患者と家族を落胆させるだけである。
おそらく、進行非小細胞肺がん患者に対して免疫チェックポイント阻害薬を用いる際に、白血球の分画比を求めるのは、生命予後因子を調べていることにほかならず、治療効果予測因子を見ているわけではないだろう。
もちろん我々は、白血球の分画比を見て免疫チェックポイント阻害薬を使うかどうかを決めているわけではない。
なぜこんなことを書くかというと、以下の論文を読んでいて表題の感想を持ったからだ。
LIPIを調べて予後不良群だとわかったときに、果たしてアテゾリズマブもドセタキセルも使用しない、という選択肢があるのか。
それこそ、知らぬが仏、というものではないか。
Evaluation of the Lung Immune Prognostic Index for Prediction of Survival and Response in Patients Treated With Atezolizumab for NSCLC: Pooled Analysis of Clinical Trials
Michael J Sorich et al.,
J Thorac Oncol. 2019 Aug;14(8):1440-1446
doi: 10.1016/j.jtho.2019.04.006. Epub 2019 Apr 15
背景:
免疫チェックポイント阻害薬での治療を受けた患者の生命予後や治療反応性にはばらつきがあり、治療意思決定に役立つ治療効果予測因子が求められている。Lung Immune Prognostic Index(LIPI)は免疫チェックポイント阻害薬による治療効果を予測するために最近開発された。今回の研究では、進行非小細胞肺がんに対してアテゾリズマブを使用した患者を対象に、LIPIが生命予後と治療反応性の予測因子となり得るかどうかを検証した。
方法:
非小細胞肺がんに対してアテゾリズマブを使用する4件の臨床試験(BIRCH試験, FIR試験:いずれも、PD-L1陽性の進行非小細胞肺がん患者を対象とした単アーム試験, OAK試験,POPLAR試験:いずれも、プラチナ併用化学療法後に病勢進行した進行非小細胞肺がん患者を対象とした、アテゾリズマブとドセタキセルを比較するランダム化試験) から、各患者の個別データを集積した。治療開始前の好中球-リンパ球比率が3以上であるかどうか、同じく治療開始前のLDH値が正常上限を超えているかどうかを基準として、患者を3グループに分類した。LIPI良好群はリスク因子0ケ、LIPI中間群はリスク因子1ケ、LIPI不良群はリスク因子2ケが該当する患者とした。主要評価項目は全生存期間、副次評価項目は無増悪生存期間及び奏効割合とした。
結果:
LIPIが高値になるほど、患者年齢は若く、PSは悪く、遠隔転移巣は多く、肝転移や骨転移を伴う頻度が高く、確定診断から各臨床試験参加までの期間が短く(初回治療後増悪までの期間が短く)なる傾向にあった。LIPIとPD-L1発現の間に有意な相関は認めなかった。
少なくとも1コースのアテゾリズマブによる治療を受けた1489人の患者集団を調べたところ、LIPIは全生存期間(p<0.001)、無増悪生存期間(p<0.001)、奏効割合(p<0.001)と有意に相関していた。生存期間中央値は、LIPI良好群(n=678)で18.4ヶ月、LIPI中間群(n=180)で11.3ヶ月、LIPI不良群で4.5ヶ月だった。アテゾリズマブで治療を受けた患者集団において、LIPIと全生存期間の関係性は、喫煙歴、年齢、PS、組織型、前治療歴、PD-L1発現状態に拠らず一貫していた。一方、OAK試験とPOPLAR試験において、少なくとも1コースのドセタキセルによる治療を受けた687人の患者集団を調べたところ、同様にLIPIは全生存期間(p<0.001)や奏効割合(p=0.005)と相関していた。
結論:
治療開始前のLIPIはアテゾリズマブによる治療を受けた患者集団の全生存期間、奏効割合の予後因子として有用である。一方、LIPIは同様に化学療法を受けた患者においても予後因子である。それゆえ、LIPIは免疫チェックポイント阻害薬に特異的な予測因子ではない。
2020年09月18日
sensitive relapse小細胞がんでのカルボプラチン+エトポシド併用療法再投与
この20年で、小細胞がんと非小細胞非扁平上皮がん(≒腺がん)の薬物療法には、大きな隔たりができてしまった。
非小細胞非扁平上皮がんは治療開始前の遺伝子変異検索、PD-L1発現状態評価が必須となった。
殺細胞性抗腫瘍薬、分子標的薬、(血管増殖因子阻害薬を中心とした)抗体医薬、免疫チェックポイント阻害薬およびそれらの組み合わせと治療選択肢は幅広く、かつ複雑だ。
一方の小細胞がんはあいかわらず治療効果予測因子がなく、治療選択肢となる薬は乏しい。
キードラッグはシスプラチン、カルボプラチン、エトポシド、イリノテカン、トポテカン、アムルビシン、最近になってようやく多剤併用が前提での免疫チェックポイント阻害薬が加わったといったところか。
それでも、日本はまだ恵まれている方だ。
今回の臨床試験が行われたフランスでは、小細胞がんの二次治療で使える薬は、わずかにトポテカンだけとのことで、今回のような臨床試験はクリニカル・クエスチョンへの回答に直結するようだ。
たしかにカルボプラチン+エトポシド併用療法は有意に無増悪生存期間を延長しているが、それによってトポテカンの出番はなくなった、などと早合点するのは慎みたい。今回全生存期間の改善は得られなかったわけだが、標準治療は二次治療まで、三次治療以降の標準治療は存在しない、という治療選択肢が限られた疾患に引き続き対峙するにあたり、全生存期間を延長できなかった治療を標準治療に押し上げて従来の標準治療を切り捨てるのは、非効率である。むしろ、無増悪生存期間を延長する二次治療選択肢が一つ増えたので、患者背景に応じてカルボプラチン+エトポシド併用療法を優先して使用しよう、トポテカンも選択肢として残しておこう、とするのが現実的だろう。
Carboplatin plus etoposide versus topotecan as second-line treatment for patients with sensitive relapsed small-cell lung cancer: an open-label, multicentre, randomised, phase 3 trial
Nathalie Baize, MD, et al.
Lancet Oncol VOLUME 21, ISSUE 9, P1224-1233, SEPTEMBER 01, 2020
DOI:https://doi.org/10.1016/S1470-2045(20)30461-7
背景:
トポテカンは原発性肺小細胞がんの二次治療として、現時点で欧州で唯一承認されている治療薬である。本試験は、初回治療後90日以上経過してから再燃した、いわゆる"sensitive relapse"の原発性肺小細胞がん患者に対して、カルボプラチン+エトポシド併用療法がトポテカン単剤療法よりも二次治療として優れているかどうかを検証した試験である。
方法:
今回のオープンラベル、無作為化、第III相臨床試験にはフランス国内の38施設が参加した。組織診もしくは細胞診で確認された進行、もしくは局所再発の原発性肺小細胞がん患者で、初回のプラチナ製剤+エトポシド併用療法に反応したものの、初回治療終了から90日間以上経過したのちに再燃/進行を来したものを対象とした。その他の適格条件は、18歳以上、ECOG-PS 0-2とした。患者は1:1の割合で無作為にカルボプラチン+エトポシド併用療法群(CE群、カルボプラチンは5AUCで1日目のみ、エトポシドは100mg/㎡で1日目から3日目まで、経静脈投与、最大6コースまで)とトポテカン群(T群、トポテカン2.3mg/㎡を1日目から5日目まで、経口投与、最大6コースまで)とした。無作為化には最小化法を用い、割付調整因子としてECOG-PS、初回治療の治療反応性、治療施設とした。主要評価項目はintent-to-treat解析、中央判定による無増悪生存期間とした。
結果:
2013年7月18日から2018年7月2日までの期間に、計164人(各群82人)を集積した。しかし、各群1人ずつが試験参加同意を撤回したため、計162人(各群81人)がintent-to-treat解析対象となった。経過観察期間中央値は22.7ヶ月(四分位間は20.0-37.3ヶ月)で、無増悪生存期間中央値はCE群(4.7ヶ月、90%信頼区間は3.9-5.5ヶ月)の方がT群(2.7ヶ月、90%信頼区間は2.3-3.2ヶ月)よりも有意に延長していた(ハザード比は0.57、90%信頼区間は0.41-0.73, p=0.0041)。全生存期間データを解析可能だった156人について調べたところ、CE群のうち58%、T群のうち68%がプロトコール治療終了後に三次化学療法を受けていた。生存期間中央値は、CE群で7.5ヶ月(95%信頼区間は5.4-9.5ヶ月)、T群で7.4ヶ月(95%信頼区間は6.0-8.7ヶ月)で、ハザード比は1.03、95%信頼区間は0.87-1.19、p=0.94だった。奏効割合はCE群で49%、T群で25%だった(p=0.0024)。奏効持続期間中央値はCE群で5.4ヶ月、T群で4.1ヶ月だった。プロトコール治療開始から6か月間経過時点で、CE群の31%、T群の10%が病勢進行に至っていなかった。
Grade 3-4の有害事象の頻度が高かったものは好中球減少(CE群 11人(14%)、T群18人(22%))、血小板減少(CE群 25人(31%)、T群29人(36%))、貧血(CE群20人(25%)、T群17人(21%))、発熱性好中球減少(CE群5人(6%)、T群9人(11%))、衰弱(CE群7人(9%)、T群8人(10%))だった。入院を要するような重篤な有害事象は、CE群の37%、T群の43%で認められた。治療関連有害事象によりプロトコール治療中断となったのはCE群の17%、T群の12%にのぼり、最も頻度の高かった要因は血小板減少症だった。治療関連死はT群で2人発生し、いずれも敗血症を伴う発熱性好中球減少だった。CE群では治療関連死はなかった。
結論:
Sensitive relapseの小細胞肺がん患者において、カルボプラチン+エトポシド併用療法を再投与することは理にかなった二次治療選択肢と考えられた。
非小細胞非扁平上皮がんは治療開始前の遺伝子変異検索、PD-L1発現状態評価が必須となった。
殺細胞性抗腫瘍薬、分子標的薬、(血管増殖因子阻害薬を中心とした)抗体医薬、免疫チェックポイント阻害薬およびそれらの組み合わせと治療選択肢は幅広く、かつ複雑だ。
一方の小細胞がんはあいかわらず治療効果予測因子がなく、治療選択肢となる薬は乏しい。
キードラッグはシスプラチン、カルボプラチン、エトポシド、イリノテカン、トポテカン、アムルビシン、最近になってようやく多剤併用が前提での免疫チェックポイント阻害薬が加わったといったところか。
それでも、日本はまだ恵まれている方だ。
今回の臨床試験が行われたフランスでは、小細胞がんの二次治療で使える薬は、わずかにトポテカンだけとのことで、今回のような臨床試験はクリニカル・クエスチョンへの回答に直結するようだ。
たしかにカルボプラチン+エトポシド併用療法は有意に無増悪生存期間を延長しているが、それによってトポテカンの出番はなくなった、などと早合点するのは慎みたい。今回全生存期間の改善は得られなかったわけだが、標準治療は二次治療まで、三次治療以降の標準治療は存在しない、という治療選択肢が限られた疾患に引き続き対峙するにあたり、全生存期間を延長できなかった治療を標準治療に押し上げて従来の標準治療を切り捨てるのは、非効率である。むしろ、無増悪生存期間を延長する二次治療選択肢が一つ増えたので、患者背景に応じてカルボプラチン+エトポシド併用療法を優先して使用しよう、トポテカンも選択肢として残しておこう、とするのが現実的だろう。
Carboplatin plus etoposide versus topotecan as second-line treatment for patients with sensitive relapsed small-cell lung cancer: an open-label, multicentre, randomised, phase 3 trial
Nathalie Baize, MD, et al.
Lancet Oncol VOLUME 21, ISSUE 9, P1224-1233, SEPTEMBER 01, 2020
DOI:https://doi.org/10.1016/S1470-2045(20)30461-7
背景:
トポテカンは原発性肺小細胞がんの二次治療として、現時点で欧州で唯一承認されている治療薬である。本試験は、初回治療後90日以上経過してから再燃した、いわゆる"sensitive relapse"の原発性肺小細胞がん患者に対して、カルボプラチン+エトポシド併用療法がトポテカン単剤療法よりも二次治療として優れているかどうかを検証した試験である。
方法:
今回のオープンラベル、無作為化、第III相臨床試験にはフランス国内の38施設が参加した。組織診もしくは細胞診で確認された進行、もしくは局所再発の原発性肺小細胞がん患者で、初回のプラチナ製剤+エトポシド併用療法に反応したものの、初回治療終了から90日間以上経過したのちに再燃/進行を来したものを対象とした。その他の適格条件は、18歳以上、ECOG-PS 0-2とした。患者は1:1の割合で無作為にカルボプラチン+エトポシド併用療法群(CE群、カルボプラチンは5AUCで1日目のみ、エトポシドは100mg/㎡で1日目から3日目まで、経静脈投与、最大6コースまで)とトポテカン群(T群、トポテカン2.3mg/㎡を1日目から5日目まで、経口投与、最大6コースまで)とした。無作為化には最小化法を用い、割付調整因子としてECOG-PS、初回治療の治療反応性、治療施設とした。主要評価項目はintent-to-treat解析、中央判定による無増悪生存期間とした。
結果:
2013年7月18日から2018年7月2日までの期間に、計164人(各群82人)を集積した。しかし、各群1人ずつが試験参加同意を撤回したため、計162人(各群81人)がintent-to-treat解析対象となった。経過観察期間中央値は22.7ヶ月(四分位間は20.0-37.3ヶ月)で、無増悪生存期間中央値はCE群(4.7ヶ月、90%信頼区間は3.9-5.5ヶ月)の方がT群(2.7ヶ月、90%信頼区間は2.3-3.2ヶ月)よりも有意に延長していた(ハザード比は0.57、90%信頼区間は0.41-0.73, p=0.0041)。全生存期間データを解析可能だった156人について調べたところ、CE群のうち58%、T群のうち68%がプロトコール治療終了後に三次化学療法を受けていた。生存期間中央値は、CE群で7.5ヶ月(95%信頼区間は5.4-9.5ヶ月)、T群で7.4ヶ月(95%信頼区間は6.0-8.7ヶ月)で、ハザード比は1.03、95%信頼区間は0.87-1.19、p=0.94だった。奏効割合はCE群で49%、T群で25%だった(p=0.0024)。奏効持続期間中央値はCE群で5.4ヶ月、T群で4.1ヶ月だった。プロトコール治療開始から6か月間経過時点で、CE群の31%、T群の10%が病勢進行に至っていなかった。
Grade 3-4の有害事象の頻度が高かったものは好中球減少(CE群 11人(14%)、T群18人(22%))、血小板減少(CE群 25人(31%)、T群29人(36%))、貧血(CE群20人(25%)、T群17人(21%))、発熱性好中球減少(CE群5人(6%)、T群9人(11%))、衰弱(CE群7人(9%)、T群8人(10%))だった。入院を要するような重篤な有害事象は、CE群の37%、T群の43%で認められた。治療関連有害事象によりプロトコール治療中断となったのはCE群の17%、T群の12%にのぼり、最も頻度の高かった要因は血小板減少症だった。治療関連死はT群で2人発生し、いずれも敗血症を伴う発熱性好中球減少だった。CE群では治療関連死はなかった。
結論:
Sensitive relapseの小細胞肺がん患者において、カルボプラチン+エトポシド併用療法を再投与することは理にかなった二次治療選択肢と考えられた。
2020年09月15日
お誕生日おめでとう その2
以前、「お誕生日おめでとう」という記事を書いたことがある。
私よりも若い患者さんで、喫煙経験が全くないのに肺小細胞がんと診断されたとのことで、今でも折に触れて思い出す。
http://oitahaiganpractice.junglekouen.com/e946312.html
今日ご紹介するのは、もう既に亡くなられた方だが、81歳のお誕生日のときに病室に飾られていたオーナメントの写真。

これ以外にも、ご本人とご家族が一緒に収まったたくさんのお写真や、四季折々の絵葉書がたくさん飾られていた。
髄膜癌腫症による意識障害でお話しもままならなかった患者さんだったが、診察に伺うたびにこうした飾りつけを眺めておられたのが印象深い。
新型コロナウイルス感染症、第二波もピークを越えたとはいえ、まだまだ医療機関の警戒態勢は緩まない。
そんななか、こうしたご家族心づくしの応援は、きっと患者さんの琴線に触れていることだろう。
私よりも若い患者さんで、喫煙経験が全くないのに肺小細胞がんと診断されたとのことで、今でも折に触れて思い出す。
http://oitahaiganpractice.junglekouen.com/e946312.html
今日ご紹介するのは、もう既に亡くなられた方だが、81歳のお誕生日のときに病室に飾られていたオーナメントの写真。
これ以外にも、ご本人とご家族が一緒に収まったたくさんのお写真や、四季折々の絵葉書がたくさん飾られていた。
髄膜癌腫症による意識障害でお話しもままならなかった患者さんだったが、診察に伺うたびにこうした飾りつけを眺めておられたのが印象深い。
新型コロナウイルス感染症、第二波もピークを越えたとはいえ、まだまだ医療機関の警戒態勢は緩まない。
そんななか、こうしたご家族心づくしの応援は、きっと患者さんの琴線に触れていることだろう。
2020年09月10日
ONO-4538-52/TASUKI-52試験
小野薬品工業から、以下のようなプレスリリースが発出されていたようだ。
参加患者の約70%を日本人が占めていたとのこと。
https://www.ono.co.jp/jpnw/PDF/n20_0803.pdf
<化学療法未治療の根治照射不能なIIIB / IV期又は再発の非扁平上皮非小細胞肺がんを対象とした第Ⅲ相臨床試験において、オプジーボ、ベバシズマブと化学療法の併用療法群が、有意な無増悪生存期間の延長を示す>
2020/08/03
小野薬品工業株式会社(本社:大阪市中央区、代表取締役社長:相良 暁、以下、当社)は、本日、ヒト型抗ヒト PD-1 モノクローナル抗体、オプジーボ®(一般名:ニボルマブ)点滴静注(以下、オプジーボ)について、化学療法未治療の根治照射不能なⅢB/Ⅳ期又は再発の非扁平上皮非小細胞肺がん(NSCLC)患者を対象に、オプジーボ、抗 VEGF(Vascular Endothelial Growth Factor:血管内皮増殖因子)ヒト化モノクローナル抗体であるベバシズマブと化学療法の併用療法群(オプジーボ併用療法群:275 例)をプラセボ、ベバシズマブと化学療法の併用療法群(対照併用療法群:275 例)と比較評価した第Ⅲ相臨床試験(ONO-4538-52/TASUKI-52)のトップライン結果が得られましたので、お知らせします。本試験において、予め計画していた中間解析で、オプジーボ併用療法群が、対照併用療法群と比較して、主要評価項目である無増悪生存期間(PFS)で統計学的に有意な延長を示しました。本試験におけるオプジーボ併用療法群の安全性プロファイルは、化学療法未治療の NSCLC 治療において免疫チェックポイント阻害剤、およびベバシズマブと化学療法の併用療法でこれまでに認められているものと一貫していました。
<ONO-4538-52/TASUKI-52 試験について>
本試験は、化学療法未治療の根治照射不能なⅢB/Ⅳ期又は再発の非扁平上皮 NSCLC を対象に、オプジーボ、ベバシズマブと化学療法の併用療法群(オプジーボ併用療法群:275 例)をプラセボ、ベバシズマブと化学療法の併用療法群(対照併用療法群:275 例)と比較評価した多施設共同二重盲検無作為化プラセボ対照第Ⅲ相試験(ONO-4538-52/TASUKI-52)です。オプジーボ併用療法群の患者には、オプジーボ 360 mg、カルボプラチン AUC 6、パクリタキセル 200 mg/m2およびベバシズマブ 15 mg/kg を 3 週間 1 サイクルとして投与し、対照併用療法群の患者には、プラセボ、カルボプラチン AUC 6、パクリタキセル 200 mg/m2およびベバシズマブ 15 mg/kg を 3 週間 1 サイクルとして投与しました。両群ともカルボプラチンおよびパクリタキセルは 4 サイクルまで投与し、安全に投与を継続することが可能と判断された場合は最大 6 サイクルまで投与継続可能としました。その後、オプジーボ併用療法群ではオプジーボおよびベバシズマブの投与を、対照併用療法群ではプラセボおよびベバシズマブの投与を病勢進行又は許容できない毒性が確認されるまで継続しました。本試験の主要評価項目は、独立画像判定委員会の評価に基づくPFSです。副次評価項目は、全生存期間(OS)、実施医療機関の医師判定に基づく PFS および奏効率(ORR)などです。
参加患者の約70%を日本人が占めていたとのこと。
https://www.ono.co.jp/jpnw/PDF/n20_0803.pdf
<化学療法未治療の根治照射不能なIIIB / IV期又は再発の非扁平上皮非小細胞肺がんを対象とした第Ⅲ相臨床試験において、オプジーボ、ベバシズマブと化学療法の併用療法群が、有意な無増悪生存期間の延長を示す>
2020/08/03
小野薬品工業株式会社(本社:大阪市中央区、代表取締役社長:相良 暁、以下、当社)は、本日、ヒト型抗ヒト PD-1 モノクローナル抗体、オプジーボ®(一般名:ニボルマブ)点滴静注(以下、オプジーボ)について、化学療法未治療の根治照射不能なⅢB/Ⅳ期又は再発の非扁平上皮非小細胞肺がん(NSCLC)患者を対象に、オプジーボ、抗 VEGF(Vascular Endothelial Growth Factor:血管内皮増殖因子)ヒト化モノクローナル抗体であるベバシズマブと化学療法の併用療法群(オプジーボ併用療法群:275 例)をプラセボ、ベバシズマブと化学療法の併用療法群(対照併用療法群:275 例)と比較評価した第Ⅲ相臨床試験(ONO-4538-52/TASUKI-52)のトップライン結果が得られましたので、お知らせします。本試験において、予め計画していた中間解析で、オプジーボ併用療法群が、対照併用療法群と比較して、主要評価項目である無増悪生存期間(PFS)で統計学的に有意な延長を示しました。本試験におけるオプジーボ併用療法群の安全性プロファイルは、化学療法未治療の NSCLC 治療において免疫チェックポイント阻害剤、およびベバシズマブと化学療法の併用療法でこれまでに認められているものと一貫していました。
<ONO-4538-52/TASUKI-52 試験について>
本試験は、化学療法未治療の根治照射不能なⅢB/Ⅳ期又は再発の非扁平上皮 NSCLC を対象に、オプジーボ、ベバシズマブと化学療法の併用療法群(オプジーボ併用療法群:275 例)をプラセボ、ベバシズマブと化学療法の併用療法群(対照併用療法群:275 例)と比較評価した多施設共同二重盲検無作為化プラセボ対照第Ⅲ相試験(ONO-4538-52/TASUKI-52)です。オプジーボ併用療法群の患者には、オプジーボ 360 mg、カルボプラチン AUC 6、パクリタキセル 200 mg/m2およびベバシズマブ 15 mg/kg を 3 週間 1 サイクルとして投与し、対照併用療法群の患者には、プラセボ、カルボプラチン AUC 6、パクリタキセル 200 mg/m2およびベバシズマブ 15 mg/kg を 3 週間 1 サイクルとして投与しました。両群ともカルボプラチンおよびパクリタキセルは 4 サイクルまで投与し、安全に投与を継続することが可能と判断された場合は最大 6 サイクルまで投与継続可能としました。その後、オプジーボ併用療法群ではオプジーボおよびベバシズマブの投与を、対照併用療法群ではプラセボおよびベバシズマブの投与を病勢進行又は許容できない毒性が確認されるまで継続しました。本試験の主要評価項目は、独立画像判定委員会の評価に基づくPFSです。副次評価項目は、全生存期間(OS)、実施医療機関の医師判定に基づく PFS および奏効率(ORR)などです。
2020年09月10日
ロルラチニブ、一次治療へ・・・第III相CROWN試験
ALK融合遺伝子陽性進行非小細胞肺がんにおいて、ロルラチニブも初回治療で使えることになりそうだ。
しかし、効果・安全性のバランスが非常によいアレクチニブが既に一次治療の主戦力になっている点が、EGFR遺伝子変異陽性進行非小細胞肺がんの世界とは条件が異なる。
初回治療の選択肢がクリゾチニブ、アレクチニブ、セリチニブ、ロルラチニブ、そしておそらく今後brigatinib、ensartinibと加わり、ALK陽性肺がんという少ないパイの熾烈な奪い合いになっている。
不毛極まりない。
耐性化機序の評価と治療薬選択の歯車がきちんとかみ合うようになれば、ことにALK融合遺伝子陽性肺がんにおいては、一次治療、二次治療という考え方よりも、ALK融合遺伝子の種類に応じた治療薬選択という考え方の方が、いずれ主流になるのではないだろうか。
また、本来はそのような考え方が、EGFRやほかの遺伝子変異陽性癌においても実用化されるべきだと思う。
LORBRENA® (lorlatinib) Significantly Improves Progression-Free Survival in First-Line ALK-Positive Lung Cancer
Wednesday, August 05, 2020 - 08:
第III相CROWN試験の中間解析において、主要評価項目の達成が確認された。
ファイザー社は、未治療のALK融合遺伝子陽性進行非小細胞肺がん患者に対するロルラチニブ療法が、主要評価項目である無増悪生存期間を、クリゾチニブと比較して有意に延長したと発表した。この結果は、独立データモニタリング委員会による中間解析の結果明らかになった。ロルラチニブとクリゾチニブの安全性は、これまでの各臨床試験で確認されたのと同様だった。CROWN試験の詳細は、今後の医学学会で公表される予定である。
「ほぼ10年前、我々ファイザー社は、ALK融合遺伝子陽性非小細胞肺がんに対するバイオマーカーに基づいた治療(クリゾチニブ)を開発しましたが、これにより本疾患の治療法が一変しました」
「一次治療を対象としたCROWN試験の結果は、既に二次治療以降を対象とした臨床試験で示されたロルラチニブの有用性をさらに後押しするものとなりました。我々は、医療従事者の皆様とこれらの臨床データを共有し、同様に世界中の規制当局の方々とこの治療の適応拡大について交渉できることをとても楽しみにしています」
とファイザー社の開発担当責任者は語っている。
2018年、米国食品医薬品局は、ALK融合遺伝子陽性の進行非小細胞肺がん患者で、クリゾチニブとそれ以外の少なくとも1種のALK阻害薬の治療後になお病勢が進行した患者、あるいは初回治療でアレクチニブもしくはセリチニブを使用したのちに病勢が進行した患者を対象として、ロルラチニブを適応承認した。これは、臨床試験におけるロルラチニブの奏効割合と奏効持続期間のデータをもとに、迅速承認として扱われた。CROWN試験は、以上のような条件付き承認を通常承認に転換させるための、いわば確認試験である。CROWN試験でロルラチニブの優越性が示されたことに基づき、ファイザー社は米国食品医薬品局やその他の規制当局と試験結果を共有し、条件付き承認を通常承認に切り替えるべく支援し、未治療のALK融合遺伝子陽性進行非小細胞肺がんに適応を拡大する道筋をつける予定である。
CROWN試験は第III相、ランダム化、オープンラベル、2群比較試験である。296人のALK融合遺伝子陽性未治療進行非小細胞肺がん患者を、ロルラチニブ単剤療法群とクリゾチニブ単剤療法群に、1:1の割合で無作為に割り付けた。主要評価項目は独立した中央判定による無増悪生存期間とし、副次評価項目には全生存期間、治療担当医評価による無増悪生存期間、中央判定による奏効割合、治療担当医評価による奏効割合、中枢神経系病変に関する奏効割合、安全性等とした。
しかし、効果・安全性のバランスが非常によいアレクチニブが既に一次治療の主戦力になっている点が、EGFR遺伝子変異陽性進行非小細胞肺がんの世界とは条件が異なる。
初回治療の選択肢がクリゾチニブ、アレクチニブ、セリチニブ、ロルラチニブ、そしておそらく今後brigatinib、ensartinibと加わり、ALK陽性肺がんという少ないパイの熾烈な奪い合いになっている。
不毛極まりない。
耐性化機序の評価と治療薬選択の歯車がきちんとかみ合うようになれば、ことにALK融合遺伝子陽性肺がんにおいては、一次治療、二次治療という考え方よりも、ALK融合遺伝子の種類に応じた治療薬選択という考え方の方が、いずれ主流になるのではないだろうか。
また、本来はそのような考え方が、EGFRやほかの遺伝子変異陽性癌においても実用化されるべきだと思う。
LORBRENA® (lorlatinib) Significantly Improves Progression-Free Survival in First-Line ALK-Positive Lung Cancer
Wednesday, August 05, 2020 - 08:
第III相CROWN試験の中間解析において、主要評価項目の達成が確認された。
ファイザー社は、未治療のALK融合遺伝子陽性進行非小細胞肺がん患者に対するロルラチニブ療法が、主要評価項目である無増悪生存期間を、クリゾチニブと比較して有意に延長したと発表した。この結果は、独立データモニタリング委員会による中間解析の結果明らかになった。ロルラチニブとクリゾチニブの安全性は、これまでの各臨床試験で確認されたのと同様だった。CROWN試験の詳細は、今後の医学学会で公表される予定である。
「ほぼ10年前、我々ファイザー社は、ALK融合遺伝子陽性非小細胞肺がんに対するバイオマーカーに基づいた治療(クリゾチニブ)を開発しましたが、これにより本疾患の治療法が一変しました」
「一次治療を対象としたCROWN試験の結果は、既に二次治療以降を対象とした臨床試験で示されたロルラチニブの有用性をさらに後押しするものとなりました。我々は、医療従事者の皆様とこれらの臨床データを共有し、同様に世界中の規制当局の方々とこの治療の適応拡大について交渉できることをとても楽しみにしています」
とファイザー社の開発担当責任者は語っている。
2018年、米国食品医薬品局は、ALK融合遺伝子陽性の進行非小細胞肺がん患者で、クリゾチニブとそれ以外の少なくとも1種のALK阻害薬の治療後になお病勢が進行した患者、あるいは初回治療でアレクチニブもしくはセリチニブを使用したのちに病勢が進行した患者を対象として、ロルラチニブを適応承認した。これは、臨床試験におけるロルラチニブの奏効割合と奏効持続期間のデータをもとに、迅速承認として扱われた。CROWN試験は、以上のような条件付き承認を通常承認に転換させるための、いわば確認試験である。CROWN試験でロルラチニブの優越性が示されたことに基づき、ファイザー社は米国食品医薬品局やその他の規制当局と試験結果を共有し、条件付き承認を通常承認に切り替えるべく支援し、未治療のALK融合遺伝子陽性進行非小細胞肺がんに適応を拡大する道筋をつける予定である。
CROWN試験は第III相、ランダム化、オープンラベル、2群比較試験である。296人のALK融合遺伝子陽性未治療進行非小細胞肺がん患者を、ロルラチニブ単剤療法群とクリゾチニブ単剤療法群に、1:1の割合で無作為に割り付けた。主要評価項目は独立した中央判定による無増悪生存期間とし、副次評価項目には全生存期間、治療担当医評価による無増悪生存期間、中央判定による奏効割合、治療担当医評価による奏効割合、中枢神経系病変に関する奏効割合、安全性等とした。
2020年09月08日
限局型小細胞肺がん、再燃時の治療
進展型小細胞肺がん再燃時の化学療法は、臨床試験結果に基づいて、それなりに選択肢がある。
条件が合えば、シスプラチン+イリノテカン+エトポシド併用療法もよいだろう。
条件が合わなくても、アムルビシンやトポテカンが使用できるだろう。
しかし、限局型小細胞肺がんの再燃後の治療となると、意外とエビデンスが乏しい。
今週半ばからアムルビシン単剤療法で取り掛かる予定。
本当なら、化学放射線療法後で免疫チェックポイント阻害薬が効きそうだから、使ってみたいのはやまやま。
条件が合えば、シスプラチン+イリノテカン+エトポシド併用療法もよいだろう。
条件が合わなくても、アムルビシンやトポテカンが使用できるだろう。
しかし、限局型小細胞肺がんの再燃後の治療となると、意外とエビデンスが乏しい。
今週半ばからアムルビシン単剤療法で取り掛かる予定。
本当なら、化学放射線療法後で免疫チェックポイント阻害薬が効きそうだから、使ってみたいのはやまやま。
2020年09月03日
膠原病と肺がん、嚥下障害
この病気と診断されたときは、悪性腫瘍の検索をしましょうと推奨される病態はいくつかある。
同一部位に肺炎を繰り返す患者における、その部位の根元の肺門部型肺がん。
帯状疱疹を発症した患者における悪性腫瘍合併。
そうしたものの中に、膠原病も含まれる。
私が学生の頃は、混合型結合組織病(MCTD)と診断したときは必ず悪性腫瘍を合併していないかどうか調べるようにと教わった。
膠原病の領域では、血液検査でもある程度悪性腫瘍合併の有無を判断できるようになったようだ。
皮膚筋炎という病気に関連して、TIF1γ抗体という検査があるらしい。
本検査が陽性となると、その50-70%に悪性腫瘍を合併することが知られているとのこと。
余談になるが、皮膚筋炎では嚥下障害を合併することも多い様子。
症例報告を調べてみると、いくつも引っかかってきた。
膠原病関連間質性肺炎、肺がんを含めた悪性腫瘍、嚥下障害による誤嚥性肺炎と、呼吸器内科医としても無視できない疾患である。
Paraneoplastic Dermatomyositis Syndrome Presenting as Dysphagia
Emmanuel Ofori, Gastroenterology Res. 2017 Aug;10(4):251-254.
doi: 10.14740/gr841w.
皮膚筋炎は稀な自己免疫疾患で、50-60代の女性に多く見られる。皮膚筋炎は急性、もしくは進行性の無痛性近位筋力低下、眼窩周囲のヘリオトロープ疹、手指伸側のゴットロン徴候が特徴的である。皮膚筋炎の病態生理はいまだ解明されていないが、T細胞、B細胞の免疫活性の異常が指摘されてきた。皮膚筋炎はまた、悪性腫瘍を合併することが多く、その発症タイミングも悪性腫瘍発症前、悪性腫瘍発症と同時、悪性腫瘍の診断確定後の発症と幅がある。今回我々は腎細胞がん、乳癌、子宮体部漿液性乳頭腺がんの病歴があり、進行性の筋力低下、30ポンド(約13.5kg)の体重減少、3ヶ月にわたって続く嚥下障害を呈した72歳の女性について報告する。臨床症状として歩行障害、顔の発疹(色素沈着)、手指伸展障害を伴っていた。左上腕二頭筋生検により皮膚筋炎と確定診断した。副腎皮質ステロイドの経静脈投与による免疫抑制療法を行ったが治療反応性は乏しく、経腸栄養を行うために胃瘻を増設した。
Dermatomyositis Induced by Hepatitis B Virus-related Hepatocellular Carcinoma: A Case Report and Review of the Literature
Jen-Wei Chou, Intern Med. 2017;56(14):1831-1837.
doi: 10.2169/internalmedicine.56.7595.
肝細胞癌の傍腫瘍症候群としての皮膚筋炎 / 多発性筋炎は一般的ではない。過去の文献を紐解いても、ほとんど報告がない。今回報告するのは、慢性B型肝炎とアルコール依存症の背景があり、発疹を来した55歳の男性患者である。腹部CTを撮影したところ、血管に富む肝腫瘍が多発しており、肝細胞がんとして矛盾しない所見だった。その後彼は嚥下障害と四肢筋力低下も合併した。血液検査データと筋電図の所見から、炎症性筋疾患が示唆された。これにより、本患者を肝細胞癌を誘因とする皮膚筋炎と診断した。プレドニゾロンと抗ウイルス療法を行ったが、2ヶ月後に病状の悪化により死亡した。
Oropharyngeal dysphagia as a first manifestation of dermatomyositis associated with colon cancer
J C Espinoza-Cobos, Rev Gastroenterol Mex. Oct-Dec 2010;75(4):522-7.
皮膚筋炎は特発性炎症性ミオパチーで、特徴的な皮膚症状を伴うことで知られている。その15-20%が嚥下障害を伴い、低栄養状態を来しやすく、誤嚥性肺炎の素因となり、QoLの低下を招き、予後不良である。皮膚筋炎と悪性腫瘍はしばしば合併し、卵巣がん、乳がん、肺がん、大腸がんの合併が知られている。今回は大腸がんに関連して皮膚筋炎を発症した85歳の男性について報告する。初期症状は進行性の嚥下障害で、その後に近位筋優位の筋力低下、特徴的な皮膚症状を発症した。傍腫瘍症候群として皮膚筋炎を疑い、腫瘍マーカーを測定したところCEAが高値だった。下部消化管内視鏡により大腸がんを合併していることが明らかになった。
Lung adenocarcinoma, dermatomyositis, and Lambert-Eaton myasthenic syndrome: a rare combination
Fernanda Manente Milanez, J Bras Pneumol. 2008 May;34(5):333-6.
doi: 10.1590/s1806-37132008000500014.
肺の悪性腫瘍はブラジルを含めた全正解で増加傾向にあり、おそらくは喫煙人口が増えているためと考えられる。全体の患者が増えてくると、稀な病態も経験されることがある。今回は喫煙歴、高血圧の既往のある66歳の男性について報告する。近位筋群に進行性の筋力低下を認め、2ヶ月後には嚥下障害、発声障害、胸部のV字型の皮疹が臨床症状として加わった。胸部レントゲン写真ではspiculationを伴う肺多発結節を右肺上葉に認めた。血液生化学検査では、クレアチンキナーゼが高値を示していた。補助検査と生検を行ったのち、本患者は右肺上葉切除術を受けた。病理診断は原発性肺腺がんだった。
同一部位に肺炎を繰り返す患者における、その部位の根元の肺門部型肺がん。
帯状疱疹を発症した患者における悪性腫瘍合併。
そうしたものの中に、膠原病も含まれる。
私が学生の頃は、混合型結合組織病(MCTD)と診断したときは必ず悪性腫瘍を合併していないかどうか調べるようにと教わった。
膠原病の領域では、血液検査でもある程度悪性腫瘍合併の有無を判断できるようになったようだ。
皮膚筋炎という病気に関連して、TIF1γ抗体という検査があるらしい。
本検査が陽性となると、その50-70%に悪性腫瘍を合併することが知られているとのこと。
余談になるが、皮膚筋炎では嚥下障害を合併することも多い様子。
症例報告を調べてみると、いくつも引っかかってきた。
膠原病関連間質性肺炎、肺がんを含めた悪性腫瘍、嚥下障害による誤嚥性肺炎と、呼吸器内科医としても無視できない疾患である。
Paraneoplastic Dermatomyositis Syndrome Presenting as Dysphagia
Emmanuel Ofori, Gastroenterology Res. 2017 Aug;10(4):251-254.
doi: 10.14740/gr841w.
皮膚筋炎は稀な自己免疫疾患で、50-60代の女性に多く見られる。皮膚筋炎は急性、もしくは進行性の無痛性近位筋力低下、眼窩周囲のヘリオトロープ疹、手指伸側のゴットロン徴候が特徴的である。皮膚筋炎の病態生理はいまだ解明されていないが、T細胞、B細胞の免疫活性の異常が指摘されてきた。皮膚筋炎はまた、悪性腫瘍を合併することが多く、その発症タイミングも悪性腫瘍発症前、悪性腫瘍発症と同時、悪性腫瘍の診断確定後の発症と幅がある。今回我々は腎細胞がん、乳癌、子宮体部漿液性乳頭腺がんの病歴があり、進行性の筋力低下、30ポンド(約13.5kg)の体重減少、3ヶ月にわたって続く嚥下障害を呈した72歳の女性について報告する。臨床症状として歩行障害、顔の発疹(色素沈着)、手指伸展障害を伴っていた。左上腕二頭筋生検により皮膚筋炎と確定診断した。副腎皮質ステロイドの経静脈投与による免疫抑制療法を行ったが治療反応性は乏しく、経腸栄養を行うために胃瘻を増設した。
Dermatomyositis Induced by Hepatitis B Virus-related Hepatocellular Carcinoma: A Case Report and Review of the Literature
Jen-Wei Chou, Intern Med. 2017;56(14):1831-1837.
doi: 10.2169/internalmedicine.56.7595.
肝細胞癌の傍腫瘍症候群としての皮膚筋炎 / 多発性筋炎は一般的ではない。過去の文献を紐解いても、ほとんど報告がない。今回報告するのは、慢性B型肝炎とアルコール依存症の背景があり、発疹を来した55歳の男性患者である。腹部CTを撮影したところ、血管に富む肝腫瘍が多発しており、肝細胞がんとして矛盾しない所見だった。その後彼は嚥下障害と四肢筋力低下も合併した。血液検査データと筋電図の所見から、炎症性筋疾患が示唆された。これにより、本患者を肝細胞癌を誘因とする皮膚筋炎と診断した。プレドニゾロンと抗ウイルス療法を行ったが、2ヶ月後に病状の悪化により死亡した。
Oropharyngeal dysphagia as a first manifestation of dermatomyositis associated with colon cancer
J C Espinoza-Cobos, Rev Gastroenterol Mex. Oct-Dec 2010;75(4):522-7.
皮膚筋炎は特発性炎症性ミオパチーで、特徴的な皮膚症状を伴うことで知られている。その15-20%が嚥下障害を伴い、低栄養状態を来しやすく、誤嚥性肺炎の素因となり、QoLの低下を招き、予後不良である。皮膚筋炎と悪性腫瘍はしばしば合併し、卵巣がん、乳がん、肺がん、大腸がんの合併が知られている。今回は大腸がんに関連して皮膚筋炎を発症した85歳の男性について報告する。初期症状は進行性の嚥下障害で、その後に近位筋優位の筋力低下、特徴的な皮膚症状を発症した。傍腫瘍症候群として皮膚筋炎を疑い、腫瘍マーカーを測定したところCEAが高値だった。下部消化管内視鏡により大腸がんを合併していることが明らかになった。
Lung adenocarcinoma, dermatomyositis, and Lambert-Eaton myasthenic syndrome: a rare combination
Fernanda Manente Milanez, J Bras Pneumol. 2008 May;34(5):333-6.
doi: 10.1590/s1806-37132008000500014.
肺の悪性腫瘍はブラジルを含めた全正解で増加傾向にあり、おそらくは喫煙人口が増えているためと考えられる。全体の患者が増えてくると、稀な病態も経験されることがある。今回は喫煙歴、高血圧の既往のある66歳の男性について報告する。近位筋群に進行性の筋力低下を認め、2ヶ月後には嚥下障害、発声障害、胸部のV字型の皮疹が臨床症状として加わった。胸部レントゲン写真ではspiculationを伴う肺多発結節を右肺上葉に認めた。血液生化学検査では、クレアチンキナーゼが高値を示していた。補助検査と生検を行ったのち、本患者は右肺上葉切除術を受けた。病理診断は原発性肺腺がんだった。
2020年09月01日
EGFR遺伝子変異陽性肺がんに対するペンブロリズマブ、化学療法、エルロチニブ
EGFR遺伝子変異陽性肺がんの方に免疫チェックポイント阻害薬を使っていいものか。
そんな質問を頂いた。
EGFRチロシンキナーゼ阻害薬も、化学療法も全てやりつくして、最後の挑戦としてペンブロリズマブを使用するとのこと。
データベースを検索してみたところ、EGFR遺伝子変異陽性患者でペンブロリズマブを使用した患者が4人いた。
ニボルマブやアテゾリズマブを使用した患者はいなかった。
・Exon 18点突然変異+Exon 20点突然変異複合、原発性肺腺がん完全切除後の術後補助化学療法臨床試験としてペンブロリズマブを使用、プロトコール治療完遂
・Exon 19欠失変異、多発肺転移を伴う進行原発性肺腺がん、初回治療としてオシメルチニブを使用するも約22ヶ月で病勢進行、カルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法に移行
・Exon 19挿入変異、腹部リンパ節と肝転移を伴う進行原発性肺腺がん、カルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法
・脳転移による下肢脱力を契機に発見された進行原発性肺腺がん、オンコマインDxでドライバー遺伝子変異見つからず、PD-L1発現もなく、カルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法開始、その後cobas ver.2を用いたEGFR遺伝子変異再検索でExon 21点突然変異+de novo Exon 20 T790M変異複合が発覚するも、完全奏効になったのでそのまま治療変更せずに継続
というわけで、ペンブロリズマブを使用している患者は、どちらかというとup-frontに、EGFR-TKIよりも先行して使っている患者ばかりだった。
過去の報告としては、初回治療としてペンブロリズマブ単剤療法を行ってみたもの、ペンブロリズマブ+EGFR-TKIを行ってみたものが見つかったので、参考までに記しておく。
あまりパッとしないのが寂しい。
A Phase II Study of Pembrolizumab in EGFR-Mutant, PD-L1+, Tyrosine Kinase Inhibitor Naïve Patients With Advanced NSCLC
A Lisberg et al., J Thorac Oncol 2018 Aug;13(8):1138-1145.
doi: 10.1016/j.jtho.2018.03.035.
背景:
ペンブロリズマブは、非小細胞肺癌に対して有意な抗腫瘍活性を示すにも拘らず、EGFR遺伝子変異陽性の患者においては陰性の患者に比べて効果が得られがたい。KETNOTE-001試験における我々の施設の経験では、EGFR遺伝子変異陽性の患者にあっても、EGFRチロシンキナーゼ阻害薬(EGFR-TKI)治療歴のない患者の方が、治療歴のある患者よりもペンブロリズマブが有効だった。一般に、EGFR-TKI治療歴のないEGFR遺伝子変異陽性患者はペンブロリズマブの臨床試験からは除外されており、こうした患者における治療意思決定のためのデータは不足しており、PD-L1発現≧50%の患者についてはとりわけそうである。
方法:
PD-L1発現陽性(≧1%)の進行非小細胞肺がん患者で、EGFR遺伝子変異陽性かつEGFR-TKI治療歴のない患者を対象に第II相臨床試験を立案した。対象患者にペンブロリズマブ200mg/回を3週間ごとに反復投与した。主要評価項目は奏効割合とした。副次評価項目は安全性、奏効割合以外の有効性評価項目、ペンブロリズマブ投与後のEGFR-TKI使用の効果と安全性とした。
結果:
登録予定だった25人のうち11人までは集積したが、予想したような治療効果が得られないため患者集積を中止した。82%の患者では前治療歴がなく、64%の患者で治療感受性のEGFR遺伝子変異を認め、73%の患者ではPD-L1発現≧50%だった。奏効割合は9%(1/11)だったが、患者の腫瘍組織を用いたEGFR変異再検索により、当初の変異判定が誤りだったことが判明した(実際にはEGFR遺伝子変異陰性だった)。治療関連の有害事象はペンブロリズマブの既知の有害事象と類似していたが、特筆すべきこととして患者登録から6ヶ月以内に2人が死亡しており、うち1人は肺臓炎に起因していた。
結論:
EGFR遺伝子変異陽性、PD-L1陽性、EGFR-TKI未治療の進行非小細胞肺がん患者に対するペンブロリズマブ単剤療法は効果に欠け、これはPD-L1≧50%の患者においても同様だった。この患者集団に対するペンブロリズマブ単剤療法は治療選択肢として不適切である。
本文記載より抜粋:
EGFR遺伝子変異の内訳は、Exon 21点突然変異が4人、Exon 19欠失変異が3人、Exon 20挿入変異が2人、その他のuncommon mutation(E330K)が1人、野生型が1人だった。野生型の患者のみが喫煙者で、その他の患者は非喫煙者もしくは禁煙後の患者だった。野生型の患者のペンブロリズマブ投与継続期間は8.2ヶ月で、その他の患者では1.4-4.1ヶ月だった。プロトコール治療終了後の後治療を受けたのは9人、うち2人は化学療法もしくは放射線治療を受け、うち7人(Exon 21 3人、Exon 19 3人、Exon 20 1人)はEGFR-TKIを使用し、使用されたのは全てエルロチニブだった。データカットオフの時点で、7人中5人はエルロチニブを継続しており、治療継続期間中央値は109日間で、のこる2人はエルロチニブ投与中に死亡していた。このうち1人はExon 20挿入変異の患者で、プロトコール治療後に化学療法ではなく(効果があまり期待できない)エルロチニブを使用していた。肺臓炎で亡くなった患者はExon 19欠失変異の患者で、エルロチニブ開始から6週間目の段階では腫瘍縮小を認めたものの、ペンブロリズマブの最終投与から132日目、エルロチニブ投与開始から89日目に死亡した。
Pembrolizumab in Combination With Erlotinib or Gefitinib as First-Line Therapy for Advanced NSCLC With Sensitizing EGFR Mutation
James Chih-Hsin Yang, et al., J Thorac Oncol 2019 Mar;14(3):553-559
doi: 10.1016/j.jtho.2018.11.028
背景:
抗EGFR薬はEGFR遺伝子変異陽性進行非小細胞肺がん患者に対する標準治療である。第I / II相のKEYNOTE-021試験において、抗EGFR薬のエルロチニブやゲフィチニブと抗PD-1抗体であるペンブロリズマブを併用する治療の忍容性を検証した。
方法:
成人、未治療、EGFR遺伝子変異陽性、IIIB / IV期の非小細胞肺がん患者を対象として、ペンブロリズマブ2mg/kg、3週間ごとの点滴静注に加え、コホートEではエルロチニブ150mg/日内服、コホートFではゲフィチニブ250mg/日内服を行った。コホート拡大は、いわゆるフィボナッチ法に基づき、3+3デザインで行った。RECIST基準ver.1.1に基づき、中央判定により効果判定を行った。主要評価項目は第II相試験における推奨用量の決定とした。
結果:
コホートEには12人(うち東アジア人は2人のみ)が、コホートFには7人(すべて東アジア人)が登録された。用量制限毒性やGrade 5の有害事象(=有害事象による患者死亡)は認めなかった。ペンブロリズマブ+エルロチニブ併用療法は忍容可能で、それぞれの単剤療法の際に予測される有害事象と同様だった。しかし、ペンブロリズマブ+ゲフィチニブ併用療法はGrade 3/4の肝機能障害を7人中5人(71.4%)で認め、そのうち4人で毒性による治療終了に至った。ペンブロリズマブ+エルロチニブ療法における高頻度の有害事象は発疹(50%)、ざ瘡(にきび)(33.3%)、下痢(33.3%)、甲状腺機能低下症(33.3%)、掻痒症(33.3%)だった。ペンブロリズマブ+エルロチニブ療法における奏効割合は41.7%(5/12)で、その中にはPD-L1発現が50%以上だった4人がすべて含まれていた。ペンブロリズマブ+エルロチニブ療法における無増悪生存期間中央値は19.5ヶ月(95%信頼区間は3.0-19.5ヶ月)、6ヶ月無増悪生存割合は81.8%(95%信頼区間は44.7-95.1%)、6ヶ月生存割合は91.7%(95%信頼区間は53.9-98.8%)だった。ペンブロリズマブ+ゲフィチニブ併用療法における奏効割合は14.3%(1/7)、無増悪生存期間中央値は1.4ヶ月(95%信頼区間は0.2-13.0ヶ月)、6ヶ月無増悪生存割合は47.6%(95%信頼区間は7.5-80.8%)、6ヶ月生存割合は85.7%(33.4-97.9%)だった。
そんな質問を頂いた。
EGFRチロシンキナーゼ阻害薬も、化学療法も全てやりつくして、最後の挑戦としてペンブロリズマブを使用するとのこと。
データベースを検索してみたところ、EGFR遺伝子変異陽性患者でペンブロリズマブを使用した患者が4人いた。
ニボルマブやアテゾリズマブを使用した患者はいなかった。
・Exon 18点突然変異+Exon 20点突然変異複合、原発性肺腺がん完全切除後の術後補助化学療法臨床試験としてペンブロリズマブを使用、プロトコール治療完遂
・Exon 19欠失変異、多発肺転移を伴う進行原発性肺腺がん、初回治療としてオシメルチニブを使用するも約22ヶ月で病勢進行、カルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法に移行
・Exon 19挿入変異、腹部リンパ節と肝転移を伴う進行原発性肺腺がん、カルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法
・脳転移による下肢脱力を契機に発見された進行原発性肺腺がん、オンコマインDxでドライバー遺伝子変異見つからず、PD-L1発現もなく、カルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法開始、その後cobas ver.2を用いたEGFR遺伝子変異再検索でExon 21点突然変異+de novo Exon 20 T790M変異複合が発覚するも、完全奏効になったのでそのまま治療変更せずに継続
というわけで、ペンブロリズマブを使用している患者は、どちらかというとup-frontに、EGFR-TKIよりも先行して使っている患者ばかりだった。
過去の報告としては、初回治療としてペンブロリズマブ単剤療法を行ってみたもの、ペンブロリズマブ+EGFR-TKIを行ってみたものが見つかったので、参考までに記しておく。
あまりパッとしないのが寂しい。
A Phase II Study of Pembrolizumab in EGFR-Mutant, PD-L1+, Tyrosine Kinase Inhibitor Naïve Patients With Advanced NSCLC
A Lisberg et al., J Thorac Oncol 2018 Aug;13(8):1138-1145.
doi: 10.1016/j.jtho.2018.03.035.
背景:
ペンブロリズマブは、非小細胞肺癌に対して有意な抗腫瘍活性を示すにも拘らず、EGFR遺伝子変異陽性の患者においては陰性の患者に比べて効果が得られがたい。KETNOTE-001試験における我々の施設の経験では、EGFR遺伝子変異陽性の患者にあっても、EGFRチロシンキナーゼ阻害薬(EGFR-TKI)治療歴のない患者の方が、治療歴のある患者よりもペンブロリズマブが有効だった。一般に、EGFR-TKI治療歴のないEGFR遺伝子変異陽性患者はペンブロリズマブの臨床試験からは除外されており、こうした患者における治療意思決定のためのデータは不足しており、PD-L1発現≧50%の患者についてはとりわけそうである。
方法:
PD-L1発現陽性(≧1%)の進行非小細胞肺がん患者で、EGFR遺伝子変異陽性かつEGFR-TKI治療歴のない患者を対象に第II相臨床試験を立案した。対象患者にペンブロリズマブ200mg/回を3週間ごとに反復投与した。主要評価項目は奏効割合とした。副次評価項目は安全性、奏効割合以外の有効性評価項目、ペンブロリズマブ投与後のEGFR-TKI使用の効果と安全性とした。
結果:
登録予定だった25人のうち11人までは集積したが、予想したような治療効果が得られないため患者集積を中止した。82%の患者では前治療歴がなく、64%の患者で治療感受性のEGFR遺伝子変異を認め、73%の患者ではPD-L1発現≧50%だった。奏効割合は9%(1/11)だったが、患者の腫瘍組織を用いたEGFR変異再検索により、当初の変異判定が誤りだったことが判明した(実際にはEGFR遺伝子変異陰性だった)。治療関連の有害事象はペンブロリズマブの既知の有害事象と類似していたが、特筆すべきこととして患者登録から6ヶ月以内に2人が死亡しており、うち1人は肺臓炎に起因していた。
結論:
EGFR遺伝子変異陽性、PD-L1陽性、EGFR-TKI未治療の進行非小細胞肺がん患者に対するペンブロリズマブ単剤療法は効果に欠け、これはPD-L1≧50%の患者においても同様だった。この患者集団に対するペンブロリズマブ単剤療法は治療選択肢として不適切である。
本文記載より抜粋:
EGFR遺伝子変異の内訳は、Exon 21点突然変異が4人、Exon 19欠失変異が3人、Exon 20挿入変異が2人、その他のuncommon mutation(E330K)が1人、野生型が1人だった。野生型の患者のみが喫煙者で、その他の患者は非喫煙者もしくは禁煙後の患者だった。野生型の患者のペンブロリズマブ投与継続期間は8.2ヶ月で、その他の患者では1.4-4.1ヶ月だった。プロトコール治療終了後の後治療を受けたのは9人、うち2人は化学療法もしくは放射線治療を受け、うち7人(Exon 21 3人、Exon 19 3人、Exon 20 1人)はEGFR-TKIを使用し、使用されたのは全てエルロチニブだった。データカットオフの時点で、7人中5人はエルロチニブを継続しており、治療継続期間中央値は109日間で、のこる2人はエルロチニブ投与中に死亡していた。このうち1人はExon 20挿入変異の患者で、プロトコール治療後に化学療法ではなく(効果があまり期待できない)エルロチニブを使用していた。肺臓炎で亡くなった患者はExon 19欠失変異の患者で、エルロチニブ開始から6週間目の段階では腫瘍縮小を認めたものの、ペンブロリズマブの最終投与から132日目、エルロチニブ投与開始から89日目に死亡した。
Pembrolizumab in Combination With Erlotinib or Gefitinib as First-Line Therapy for Advanced NSCLC With Sensitizing EGFR Mutation
James Chih-Hsin Yang, et al., J Thorac Oncol 2019 Mar;14(3):553-559
doi: 10.1016/j.jtho.2018.11.028
背景:
抗EGFR薬はEGFR遺伝子変異陽性進行非小細胞肺がん患者に対する標準治療である。第I / II相のKEYNOTE-021試験において、抗EGFR薬のエルロチニブやゲフィチニブと抗PD-1抗体であるペンブロリズマブを併用する治療の忍容性を検証した。
方法:
成人、未治療、EGFR遺伝子変異陽性、IIIB / IV期の非小細胞肺がん患者を対象として、ペンブロリズマブ2mg/kg、3週間ごとの点滴静注に加え、コホートEではエルロチニブ150mg/日内服、コホートFではゲフィチニブ250mg/日内服を行った。コホート拡大は、いわゆるフィボナッチ法に基づき、3+3デザインで行った。RECIST基準ver.1.1に基づき、中央判定により効果判定を行った。主要評価項目は第II相試験における推奨用量の決定とした。
結果:
コホートEには12人(うち東アジア人は2人のみ)が、コホートFには7人(すべて東アジア人)が登録された。用量制限毒性やGrade 5の有害事象(=有害事象による患者死亡)は認めなかった。ペンブロリズマブ+エルロチニブ併用療法は忍容可能で、それぞれの単剤療法の際に予測される有害事象と同様だった。しかし、ペンブロリズマブ+ゲフィチニブ併用療法はGrade 3/4の肝機能障害を7人中5人(71.4%)で認め、そのうち4人で毒性による治療終了に至った。ペンブロリズマブ+エルロチニブ療法における高頻度の有害事象は発疹(50%)、ざ瘡(にきび)(33.3%)、下痢(33.3%)、甲状腺機能低下症(33.3%)、掻痒症(33.3%)だった。ペンブロリズマブ+エルロチニブ療法における奏効割合は41.7%(5/12)で、その中にはPD-L1発現が50%以上だった4人がすべて含まれていた。ペンブロリズマブ+エルロチニブ療法における無増悪生存期間中央値は19.5ヶ月(95%信頼区間は3.0-19.5ヶ月)、6ヶ月無増悪生存割合は81.8%(95%信頼区間は44.7-95.1%)、6ヶ月生存割合は91.7%(95%信頼区間は53.9-98.8%)だった。ペンブロリズマブ+ゲフィチニブ併用療法における奏効割合は14.3%(1/7)、無増悪生存期間中央値は1.4ヶ月(95%信頼区間は0.2-13.0ヶ月)、6ヶ月無増悪生存割合は47.6%(95%信頼区間は7.5-80.8%)、6ヶ月生存割合は85.7%(33.4-97.9%)だった。



