2019年04月24日
PROCLAIM試験 シスプラチン+ペメトレキセド併用化学放射線療法は「あり」か?
前回の記事で、MS58発表後の質疑応答で取り上げられたPROCLAIM試験。
改めて見てみると、試験自体は早期無効中止となっている。
「これ以上臨床試験を続けても、患者にとっての利益にならないので、途中で切り上げましょう」
ということで早期無効中止となった臨床試験結果を以て、シスプラチン+ペメトレキセド併用化学放射線療法を患者に勧めるのは、ありなのか。
それって、根本的に間違っているのでは・・・?
・・・なんて、臨床試験原理主義者の立場で論じるつもりはない。
全生存期間に関する統計学的な優越性はもちろん証明できなかった。
早期無効中止なんて、臨床試験としては大失敗以外の何物でもない。
しかし、全生存期間成績は標準治療と同等で、毒性がより軽かったのなら、実地臨床としてはありかも知れない。
きちんとやろうと思えば、改めて全生存期間に関する非劣勢を証明して、副次評価項目として毒性が軽いことを示せばいいのだろうが、製薬会社はそんなことにお金はかけない。
だって、そんなことしなくても、実地臨床でこの治療をやって、学会発表までしている先生がいるんだもの。
そんなことしなくても、肺癌領域においてはペメトレキセドが製薬会社の稼ぎ頭であることは揺るぎない。
要は、この試験結果をどのように解釈して、患者の治療に活かすか、ということだろう。
PROCLAIM試験の結果を以て、患者にシスプラチン+併用化学放射線療法を進めるのは間違っている、と断じるのは簡単なこと。
だけど、MS58を発表した病院で、この局所進行非小細胞肺癌患者の治療後5年生存割合が40%程度あったこと、一般にIV期の患者群においてシスプラチン+ペメトレキセド併用療法が頻用されていて、医療者がそのマネジメントに習熟しており安全に治療施行可能なこと、など、現実を冷静に見つめるならば、本治療は治療選択肢と考えていいような気がする。
再燃時の治療としてペメトレキセドの選択肢を残しておきたい、という反対意見も当然あるだろう。
それはそれでもちろん一理ある。
PROCLAIM: Randomized Phase III Trial of Pemetrexed-Cisplatin or Etoposide-Cisplatin Plus Thoracic Radiation Therapy Followed by Consolidation Chemotherapy in Locally Advanced Nonsquamous Non–Small-Cell Lung Cancer
Suresh Senan, et al.
Journal of Clinical Oncology 34, no. 9 (March 20 2016) 953-962. 2016
目的:
第III相PROCLAIM試験は、A群:シスプラチン+ペメトレキセド併用化学放射線療法→ペメトレキセド維持療法とB群:シスプラチン+エトポシド併用化学放射線療法→地固め化学療法の全生存期間成績を比較する臨床試験である
対象と方法:
IIIA / IIIB期の切除不能非扁平上皮非小細胞肺癌患者を対象とし、A群とB群に1:1の割合で割り付けた。A群ではシスプラチン+ペメトレキセド併用化学療法を3週ごと3コース、根治的胸部放射線療法(総線量60-66Gy)との併行で行い、その後ペメトレキセド維持療法を3週間ごとに4コース行った。B群ではシスプラチン+エトポシド併用放射線化学療法を4週ごと2コース、根治的胸部放射線療法(総線量60-66Gy)との併行で行い、その後地固めのプラチナ併用化学療法2コースを行った。主要評価項目は全生存期間とした。第一種の過誤を5%、検出力を80%、全生存期間に関するハザード比の有意水準を0.74とし、B群に対するA群の優越性を検証する試験デザインとした。
結果:
本試験は早期無効中止となった。598人の患者を無作為割り付けし(A群301人、B群297人)、555人(A群283人、B群272人)が実際にプロトコール治療を受けた。全生存期間に関して、A群はB群に対して統計学的な優越性を示すことができなかった(ハザード比0.98、95%信頼区間は0.79-1.20、生存期間中央値はA群で26.8ヶ月、B群で25.0ヶ月、p=0.831)。A群ではGrade 3-4の有害事象が有意に少なく(64.0% vs 76.8%、p=0.001)、その中には好中球減少も含まれていた(24.4% vs 44.5%, p<0.001)。
結論:
IIIA / IIIB期の切除不能非扁平上皮非小細胞肺癌患者を対象としたシスプラチン+ペメトレキセド併用化学放射線療法は、標準治療に対する優越性を示すことができなかった。
改めて見てみると、試験自体は早期無効中止となっている。
「これ以上臨床試験を続けても、患者にとっての利益にならないので、途中で切り上げましょう」
ということで早期無効中止となった臨床試験結果を以て、シスプラチン+ペメトレキセド併用化学放射線療法を患者に勧めるのは、ありなのか。
それって、根本的に間違っているのでは・・・?
・・・なんて、臨床試験原理主義者の立場で論じるつもりはない。
全生存期間に関する統計学的な優越性はもちろん証明できなかった。
早期無効中止なんて、臨床試験としては大失敗以外の何物でもない。
しかし、全生存期間成績は標準治療と同等で、毒性がより軽かったのなら、実地臨床としてはありかも知れない。
きちんとやろうと思えば、改めて全生存期間に関する非劣勢を証明して、副次評価項目として毒性が軽いことを示せばいいのだろうが、製薬会社はそんなことにお金はかけない。
だって、そんなことしなくても、実地臨床でこの治療をやって、学会発表までしている先生がいるんだもの。
そんなことしなくても、肺癌領域においてはペメトレキセドが製薬会社の稼ぎ頭であることは揺るぎない。
要は、この試験結果をどのように解釈して、患者の治療に活かすか、ということだろう。
PROCLAIM試験の結果を以て、患者にシスプラチン+併用化学放射線療法を進めるのは間違っている、と断じるのは簡単なこと。
だけど、MS58を発表した病院で、この局所進行非小細胞肺癌患者の治療後5年生存割合が40%程度あったこと、一般にIV期の患者群においてシスプラチン+ペメトレキセド併用療法が頻用されていて、医療者がそのマネジメントに習熟しており安全に治療施行可能なこと、など、現実を冷静に見つめるならば、本治療は治療選択肢と考えていいような気がする。
再燃時の治療としてペメトレキセドの選択肢を残しておきたい、という反対意見も当然あるだろう。
それはそれでもちろん一理ある。
PROCLAIM: Randomized Phase III Trial of Pemetrexed-Cisplatin or Etoposide-Cisplatin Plus Thoracic Radiation Therapy Followed by Consolidation Chemotherapy in Locally Advanced Nonsquamous Non–Small-Cell Lung Cancer
Suresh Senan, et al.
Journal of Clinical Oncology 34, no. 9 (March 20 2016) 953-962. 2016
目的:
第III相PROCLAIM試験は、A群:シスプラチン+ペメトレキセド併用化学放射線療法→ペメトレキセド維持療法とB群:シスプラチン+エトポシド併用化学放射線療法→地固め化学療法の全生存期間成績を比較する臨床試験である
対象と方法:
IIIA / IIIB期の切除不能非扁平上皮非小細胞肺癌患者を対象とし、A群とB群に1:1の割合で割り付けた。A群ではシスプラチン+ペメトレキセド併用化学療法を3週ごと3コース、根治的胸部放射線療法(総線量60-66Gy)との併行で行い、その後ペメトレキセド維持療法を3週間ごとに4コース行った。B群ではシスプラチン+エトポシド併用放射線化学療法を4週ごと2コース、根治的胸部放射線療法(総線量60-66Gy)との併行で行い、その後地固めのプラチナ併用化学療法2コースを行った。主要評価項目は全生存期間とした。第一種の過誤を5%、検出力を80%、全生存期間に関するハザード比の有意水準を0.74とし、B群に対するA群の優越性を検証する試験デザインとした。
結果:
本試験は早期無効中止となった。598人の患者を無作為割り付けし(A群301人、B群297人)、555人(A群283人、B群272人)が実際にプロトコール治療を受けた。全生存期間に関して、A群はB群に対して統計学的な優越性を示すことができなかった(ハザード比0.98、95%信頼区間は0.79-1.20、生存期間中央値はA群で26.8ヶ月、B群で25.0ヶ月、p=0.831)。A群ではGrade 3-4の有害事象が有意に少なく(64.0% vs 76.8%、p=0.001)、その中には好中球減少も含まれていた(24.4% vs 44.5%, p<0.001)。
結論:
IIIA / IIIB期の切除不能非扁平上皮非小細胞肺癌患者を対象としたシスプラチン+ペメトレキセド併用化学放射線療法は、標準治療に対する優越性を示すことができなかった。
2019年04月23日
2019年 第59回日本呼吸器学会備忘録その4 デュルバルマブが使える患者は?
2019年 第59回日本呼吸器学会備忘録
以前、ベバシズマブが登場したときにもこんな話題があった。
薬が使えるようになったのはいいけれど、果たしてどのくらいの患者が治療対象となるのか。
今回は、局所進行非小細胞肺癌に対してプラチナ併用化学放射線療法を行った患者で、果たしてどの程度デュルバルマブの治療対象になる人がいるのか、といった検討だった。
プラチナ併用化学放射線療法を行った患者73人のうち、デュルバルマブ治療対象となるのは61人(70%)だったとのこと。
なお、本邦におけるデュルバルマブの治療適応は「切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法」と定められている。
高齢者における局所進行非小細胞肺癌に対する本邦の標準治療であるカルボプラチン単剤分割投与併用化学放射線療法の患者も対象となり得る。
今回の発表では、併用する化学療法レジメンにシスプラチン+ペメトレキセド併用療法が多かったようで、それについて会場から質問が飛んでいた。演者はPROCLAIM試験に基づいてシスプラチン+ペメトレキセド併用療法を頻用していると話していた。第III相PROCLAIM試験はシスプラチン+ペメトレキセド併用化学放射線療法がシスプラチン+エトポシド併用化学放射線療法に対する優越性を証明できなかったnegative studyである。デュルバルマブの有効性の論拠となる第III相PACIFIC試験においてもプラチナ製剤+ペメトレキセド併用化学放射線療法は全体の4%程度にしか用いられていない。
局所進行非小細胞肺癌の化学放射線療法後5年生存割合が約40%というのは、立派な治療成績だ。
〇MS58 当科における切除不能III期非小細胞肺癌に対する根治的化学放射線療法の治療成績と、デュルバルマブによる地固め療法が対象となる割合の後方視的検討
・2011年01月から2018年05月までに切除不能III期非小細胞肺癌に対して根治的化学放射線療法を行った81人の患者を対象に検討した
・どの程度の患者がデュルバルマブを使用可能な対象となるかを調べた
・患者背景は以下の通り

・プラチナ併用化学療法を含む治療を受けたのは73人(90%)
・73人中54人(74%)が経過中に放射線肺臓炎を合併し、73人中12人(16%)は化学放射線療法後3ヶ月以内にGrade 2以上の放射線肺臓炎を発症し、デュルバルマブ治療対象外と考えられた
・PS不良のためデュルバルマブ治療対象外と考えられた患者は73人中7人(10%)
・病勢進行のためデュルバルマブ治療対象外と考えられた患者は73人中3人(4%)
・結局、デュルバルマブ治療対象外の患者は73人中22人(30%)
・残る70%はデュルバルマブ治療対象になり得ると考えられた
・全体の無増悪生存期間中央値は10.9ヶ月
・5年無増悪生存割合は21.3%
・Best Supportive Careに移行し(転院して追跡不能になった)患者を打ち切り例として扱うと、生存期間中央値は57.8ヶ月、5年生存割合は45.9%
・Best Supportive Careに移行し(転院して追跡不能になった)患者を死亡例と同様に扱うと、生存期間中央値は26.8ヶ月、5年生存割合は38.3%
以前、ベバシズマブが登場したときにもこんな話題があった。
薬が使えるようになったのはいいけれど、果たしてどのくらいの患者が治療対象となるのか。
今回は、局所進行非小細胞肺癌に対してプラチナ併用化学放射線療法を行った患者で、果たしてどの程度デュルバルマブの治療対象になる人がいるのか、といった検討だった。
プラチナ併用化学放射線療法を行った患者73人のうち、デュルバルマブ治療対象となるのは61人(70%)だったとのこと。
なお、本邦におけるデュルバルマブの治療適応は「切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法」と定められている。
高齢者における局所進行非小細胞肺癌に対する本邦の標準治療であるカルボプラチン単剤分割投与併用化学放射線療法の患者も対象となり得る。
今回の発表では、併用する化学療法レジメンにシスプラチン+ペメトレキセド併用療法が多かったようで、それについて会場から質問が飛んでいた。演者はPROCLAIM試験に基づいてシスプラチン+ペメトレキセド併用療法を頻用していると話していた。第III相PROCLAIM試験はシスプラチン+ペメトレキセド併用化学放射線療法がシスプラチン+エトポシド併用化学放射線療法に対する優越性を証明できなかったnegative studyである。デュルバルマブの有効性の論拠となる第III相PACIFIC試験においてもプラチナ製剤+ペメトレキセド併用化学放射線療法は全体の4%程度にしか用いられていない。
局所進行非小細胞肺癌の化学放射線療法後5年生存割合が約40%というのは、立派な治療成績だ。
〇MS58 当科における切除不能III期非小細胞肺癌に対する根治的化学放射線療法の治療成績と、デュルバルマブによる地固め療法が対象となる割合の後方視的検討
・2011年01月から2018年05月までに切除不能III期非小細胞肺癌に対して根治的化学放射線療法を行った81人の患者を対象に検討した
・どの程度の患者がデュルバルマブを使用可能な対象となるかを調べた
・患者背景は以下の通り

・プラチナ併用化学療法を含む治療を受けたのは73人(90%)
・73人中54人(74%)が経過中に放射線肺臓炎を合併し、73人中12人(16%)は化学放射線療法後3ヶ月以内にGrade 2以上の放射線肺臓炎を発症し、デュルバルマブ治療対象外と考えられた
・PS不良のためデュルバルマブ治療対象外と考えられた患者は73人中7人(10%)
・病勢進行のためデュルバルマブ治療対象外と考えられた患者は73人中3人(4%)
・結局、デュルバルマブ治療対象外の患者は73人中22人(30%)
・残る70%はデュルバルマブ治療対象になり得ると考えられた
・全体の無増悪生存期間中央値は10.9ヶ月
・5年無増悪生存割合は21.3%
・Best Supportive Careに移行し(転院して追跡不能になった)患者を打ち切り例として扱うと、生存期間中央値は57.8ヶ月、5年生存割合は45.9%
・Best Supportive Careに移行し(転院して追跡不能になった)患者を死亡例と同様に扱うと、生存期間中央値は26.8ヶ月、5年生存割合は38.3%
2019年04月20日
2019年 第59回日本呼吸器学会備忘録その3 EGFR阻害薬再投与の是非
2019年 第59回日本呼吸器学会備忘録
日本全国津々浦々、それぞれの地方で肺がんの臨床研究グループが活動している。
中部・東海地方は、基礎研究、薬物療法、内視鏡検査・治療の臨床と研究に長けているイメージ。
今回の学会に参加して初めて知ったのだが、中部・東海地方では大規模な患者登録システムが稼動しているようで、そこから派生した研究報告がいくつか取り扱われていた。
今回の内容はそのひとつ。
EGFR阻害薬を使用して、何らかの理由で使えなくなり、再投与したらどんなだろう、という内容だった。
EGFR阻害薬の黎明期からこうした発表はいくつもあったが、これだけEGFR阻害薬の選択肢が増えると、おのずと論調も変わってくる。
間質性肺炎の毒性で使用できなくなったら再投与は難しいだろうが、例えば発疹とか、爪周囲炎とか、下痢とか、肝機能障害で継続不能になったときに、他のEGFR阻害薬に変えるのはよくある話だ。
そうした実地臨床にきちんとした裏づけを与える、という意味で、今回の発表は意義深い。
また、病勢進行後の再投与であっても、治療成功期間が3-5ヶ月程度稼げるのなら、それはそれで意義がある。
殺細胞性抗腫瘍薬の「再」投与よりは、EGFR阻害薬の再投与の方が気が利いている。
○MS49 EGFR阻害薬のrechallengeを行った541例の検討
・中部、東海地域の11拠点において、2008年から2018年にEGFR阻害薬を投与された1,400人を対象に、病勢進行後にEGFR-TKIの再投与を受けた患者をretrospectiveに検討した
・再投与を受けたのは570人で、そのうち541人を解析対象とした
・再投与を受けた患者全体の治療成功期間(Time to Treatment Failure, TTF)は6.0ヶ月だった
・初回治療時のEGFR-TKIが有害事象で中止された場合のTTFは、病勢増悪で中止された場合のTTFよりも有意に長かった


日本全国津々浦々、それぞれの地方で肺がんの臨床研究グループが活動している。
中部・東海地方は、基礎研究、薬物療法、内視鏡検査・治療の臨床と研究に長けているイメージ。
今回の学会に参加して初めて知ったのだが、中部・東海地方では大規模な患者登録システムが稼動しているようで、そこから派生した研究報告がいくつか取り扱われていた。
今回の内容はそのひとつ。
EGFR阻害薬を使用して、何らかの理由で使えなくなり、再投与したらどんなだろう、という内容だった。
EGFR阻害薬の黎明期からこうした発表はいくつもあったが、これだけEGFR阻害薬の選択肢が増えると、おのずと論調も変わってくる。
間質性肺炎の毒性で使用できなくなったら再投与は難しいだろうが、例えば発疹とか、爪周囲炎とか、下痢とか、肝機能障害で継続不能になったときに、他のEGFR阻害薬に変えるのはよくある話だ。
そうした実地臨床にきちんとした裏づけを与える、という意味で、今回の発表は意義深い。
また、病勢進行後の再投与であっても、治療成功期間が3-5ヶ月程度稼げるのなら、それはそれで意義がある。
殺細胞性抗腫瘍薬の「再」投与よりは、EGFR阻害薬の再投与の方が気が利いている。
○MS49 EGFR阻害薬のrechallengeを行った541例の検討
・中部、東海地域の11拠点において、2008年から2018年にEGFR阻害薬を投与された1,400人を対象に、病勢進行後にEGFR-TKIの再投与を受けた患者をretrospectiveに検討した
・再投与を受けたのは570人で、そのうち541人を解析対象とした
・再投与を受けた患者全体の治療成功期間(Time to Treatment Failure, TTF)は6.0ヶ月だった
・初回治療時のEGFR-TKIが有害事象で中止された場合のTTFは、病勢増悪で中止された場合のTTFよりも有意に長かった


2019年04月19日
子宮頸がんとPembrolizumab
本ブログの趣旨とは異なるが、最近GOPC-ROS1融合遺伝子陽性の子宮頸部混合型小細胞癌(この病名記載が適切かどうかはわからないけれど)の患者さんから相談を受けた。
どんな治療が可能性として挙げられるか、とのこと。
小細胞癌に対する化学療法は術後補助化学療法も含めてかなりintensiveに施行済み、ROS1に対する分子標的治療も既に試みたらしい。
畑違いで、よくわからない。
殺細胞性抗腫瘍薬、分子標的薬についてはいろいろ調べて候補が挙がったが、免疫チェックポイント阻害薬については可能性があるかどうかわからなかった。
しかし、小細胞癌に対しては、米国では免疫チェックポイント阻害薬が承認されている。
そんな中、今朝のメールにこんなのが届いていたので、書き残す。
肺がんの領域になぞらえるならば、進行肺腺癌に対するカルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法が米国食品医薬品局に承認されたときのことを思い出す。
当時も、今回の子宮頸がんと同じく、第II相臨床試験の結果を踏まえての米国食品医薬品局の決定で、私を含めて多くの人が、時期尚早ではないか、と首をひねったことだろう。
しかし、現在では我が国でも承認され、身近なところでもこの治療を受けている患者を見かけるようになった。
子宮頸がんにおいても承認の決定がなされたというのは、効果が出たら長く効く、という免疫チェックポイント特有の現象が子宮頸がんの領域でも確認されたこと、そして、ここには全く触れられていないが、もしかしたらより大規模な臨床試験においても、それなりの手ごたえが既に確認されているのかもしれない。
奏効する患者の割合は14%強と高いとは言えないが、奏効した患者の奏効持続期間のデータにはすべて”≧”の記号がついている。
全ての奏効した患者で、現在進行形で効果が続いているということだろう。
これはインパクトがある。
現在我が国でも、MSI-Highが確認されれば、子宮頸がんに対するPembrolizumab投与の道は開かれている。
以下の記事に示すように子宮頸がんにおいても3-4%程度はMSI-Highとなる可能性があるわけで、標準治療をやり切った患者さんは本検査を試みる価値があるだろう。
http://oitahaiganpractice.junglekouen.com/e949436.html
Efficacy and Safety of Pembrolizumab in Previously Treated Advanced Cervical Cancer: Results From the Phase II KEYNOTE-158 Study
Hyun Cheol Chung et al.
DOI: 10.1200/JCO.18.01265 Journal of Clinical Oncology
Published online April 03, 2019.
方法:
KEYNOTE-158試験は第II相バスケット試験で、様々な癌腫におけるペンブロリズマブの抗腫瘍効果と安全性を検証する試験である。今回は、過去に治療歴のある進行子宮頸がんの患者を対象とした中間解析の結果を報告する。
対象と方法:
参加した患者は、病勢進行・耐え難い副作用・担当医もしくは患者自身の治療中断意思のどれかに至るまで、ペンブロリズマブ200mgを3週間ごとに、最長2年にわたって使用した。効果判定は、最初の12か月間は9週間ごとに、それ以降は12週間ごとに行った。主要評価項目は奏効割合で、RECIST ver. 1.1に基づいて、独立した中央放射線診断によって行った。安全性は副次評価項目とした。
結果:
98人の患者がプロトコール治療を受けた。患者の年齢中央値は46歳(24-75歳)、全体の65.3%がPS1だった。82人(83.7%)の患者において、腫瘍組織にPD-L1の発現を認めた。77人の患者は過去に少なくとも1コース以上の化学療法を、進行・再発子宮頸がんの状態で受けていた。観察期間中央値は10.2ヶ月(0.6-22.7ヶ月)だった。奏功割合は12.2%(6.5%-20.4%)で、3人が完全奏効、9人が部分奏効に達していた。完全奏効、部分奏効に達した12人すべてでPD-L1発現は陽性だった。過去の治療歴が1レジメンの患者の奏効割合は14.6%(7.8-24.2%)、2レジメン以上の患者の奏効割合は14.3%(7.4-24.1%)だった。奏効持続期間中央値は未到達(3.7ヶ月以上-18.6ヶ月以上)だった。治療関連有害事象は全体の65.3%に認め、頻度が高かったのは甲状腺機能低下(10.2%)、食欲不振(9.2%)、疲労(9.2%)だった。Grade 3-4の治療関連有害事象は12.2%に認められた。
結論:
ペンブロリズマブ単剤治療は、進行子宮頸がんの患者に対して持続性のある抗腫瘍活性と対応可能な範囲の毒性を示した。本結果に基づき、米国食品医薬品局は化学療法既治療のPD-L1陽性進行子宮頸がん患者に対して、ペンブロリズマブ単剤治療の迅速承認の決定を下した。
どんな治療が可能性として挙げられるか、とのこと。
小細胞癌に対する化学療法は術後補助化学療法も含めてかなりintensiveに施行済み、ROS1に対する分子標的治療も既に試みたらしい。
畑違いで、よくわからない。
殺細胞性抗腫瘍薬、分子標的薬についてはいろいろ調べて候補が挙がったが、免疫チェックポイント阻害薬については可能性があるかどうかわからなかった。
しかし、小細胞癌に対しては、米国では免疫チェックポイント阻害薬が承認されている。
そんな中、今朝のメールにこんなのが届いていたので、書き残す。
肺がんの領域になぞらえるならば、進行肺腺癌に対するカルボプラチン+ペメトレキセド+ペンブロリズマブ併用療法が米国食品医薬品局に承認されたときのことを思い出す。
当時も、今回の子宮頸がんと同じく、第II相臨床試験の結果を踏まえての米国食品医薬品局の決定で、私を含めて多くの人が、時期尚早ではないか、と首をひねったことだろう。
しかし、現在では我が国でも承認され、身近なところでもこの治療を受けている患者を見かけるようになった。
子宮頸がんにおいても承認の決定がなされたというのは、効果が出たら長く効く、という免疫チェックポイント特有の現象が子宮頸がんの領域でも確認されたこと、そして、ここには全く触れられていないが、もしかしたらより大規模な臨床試験においても、それなりの手ごたえが既に確認されているのかもしれない。
奏効する患者の割合は14%強と高いとは言えないが、奏効した患者の奏効持続期間のデータにはすべて”≧”の記号がついている。
全ての奏効した患者で、現在進行形で効果が続いているということだろう。
これはインパクトがある。
現在我が国でも、MSI-Highが確認されれば、子宮頸がんに対するPembrolizumab投与の道は開かれている。
以下の記事に示すように子宮頸がんにおいても3-4%程度はMSI-Highとなる可能性があるわけで、標準治療をやり切った患者さんは本検査を試みる価値があるだろう。
http://oitahaiganpractice.junglekouen.com/e949436.html
Efficacy and Safety of Pembrolizumab in Previously Treated Advanced Cervical Cancer: Results From the Phase II KEYNOTE-158 Study
Hyun Cheol Chung et al.
DOI: 10.1200/JCO.18.01265 Journal of Clinical Oncology
Published online April 03, 2019.
方法:
KEYNOTE-158試験は第II相バスケット試験で、様々な癌腫におけるペンブロリズマブの抗腫瘍効果と安全性を検証する試験である。今回は、過去に治療歴のある進行子宮頸がんの患者を対象とした中間解析の結果を報告する。
対象と方法:
参加した患者は、病勢進行・耐え難い副作用・担当医もしくは患者自身の治療中断意思のどれかに至るまで、ペンブロリズマブ200mgを3週間ごとに、最長2年にわたって使用した。効果判定は、最初の12か月間は9週間ごとに、それ以降は12週間ごとに行った。主要評価項目は奏効割合で、RECIST ver. 1.1に基づいて、独立した中央放射線診断によって行った。安全性は副次評価項目とした。
結果:
98人の患者がプロトコール治療を受けた。患者の年齢中央値は46歳(24-75歳)、全体の65.3%がPS1だった。82人(83.7%)の患者において、腫瘍組織にPD-L1の発現を認めた。77人の患者は過去に少なくとも1コース以上の化学療法を、進行・再発子宮頸がんの状態で受けていた。観察期間中央値は10.2ヶ月(0.6-22.7ヶ月)だった。奏功割合は12.2%(6.5%-20.4%)で、3人が完全奏効、9人が部分奏効に達していた。完全奏効、部分奏効に達した12人すべてでPD-L1発現は陽性だった。過去の治療歴が1レジメンの患者の奏効割合は14.6%(7.8-24.2%)、2レジメン以上の患者の奏効割合は14.3%(7.4-24.1%)だった。奏効持続期間中央値は未到達(3.7ヶ月以上-18.6ヶ月以上)だった。治療関連有害事象は全体の65.3%に認め、頻度が高かったのは甲状腺機能低下(10.2%)、食欲不振(9.2%)、疲労(9.2%)だった。Grade 3-4の治療関連有害事象は12.2%に認められた。
結論:
ペンブロリズマブ単剤治療は、進行子宮頸がんの患者に対して持続性のある抗腫瘍活性と対応可能な範囲の毒性を示した。本結果に基づき、米国食品医薬品局は化学療法既治療のPD-L1陽性進行子宮頸がん患者に対して、ペンブロリズマブ単剤治療の迅速承認の決定を下した。
2019年04月16日
2019年 第59回日本呼吸器学会備忘録その2
2019年 第59回日本呼吸器学会備忘録
初回EGFR-TKI治療後、再生検をして、結果がどうだったかという後方視的検討・・・。
やむを得ないことだが、FLAURA試験の結果を受けて、ほとんどの臨床医がEGFR遺伝子変異陽性肺がんの初回治療としてオシメルチニブを選んでいるだろうと考えられる今、こうした発表は輝きを失っているように見える。
特に、MS47の演者との質疑応答では、ガックリ来てしまった。
〇 MS47:EGFR陽性非小細胞肺がんのEGFR-TKI耐性後EGFR-T790M変異出現に関する多施設共同後方視的検討
・2014年05月から2018年01月までに、国内5施設でEGFR-TKI使用後に耐性化し、再生検が実施された78人を対象とした
・腫瘍最大縮小率maximal tumor shrinkage(MTS)と、T790M変異出現の関連性を調べた
・T790M陽性が39人、陰性が39人、T790M出現割合は50%だった
・T790M陽性群のMTS平均値は42.7%、T790M陰性郡のMTS平均値は24.0%で、p=0.023と有意にT790M陽性群の方が初回EGFR-TKI治療時の最大腫瘍縮小率が大きかった
・裏を返せば、初回治療がよく効くほど、T790M耐性変異が出やすく、二次治療でオシメルチニブを使うチャンスが多そうだった
・この発表は、初回治療でオシメルチニブ以外のEGFR-TKIを使用することを前提としているが、演者に「先生はEGFR遺伝子変異陽性の非小細胞肺癌を診断したときに、どんな治療を勧めますか?」と質問したところ「患者の理解度にもよりますが、オシメルチニブを勧めます」との答えが返ってきて、ドン引きしてしまった
〇 MS48:当院におけるオシメルチニブ使用症例の後方視的検討
・2016年04月01日から2019年01月31日までの間にEGFR遺伝子変異陽性進行非小細胞肺癌と診断され、EGFR-TKIを使用した患者113人を対象とした
・113人のうち、再生検をしたのが61人(54.0%)
・再生検をした61人のうち、T790M陽性と判定されたのが37人(60.7%)
・患者背景は以下の通り
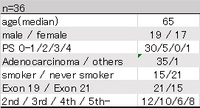
・median Time to Treatment Failure(mTTF)は417日間
・肝転移があると、TTFが有意に短くなる傾向があった
・脳転移があっても、TTFに有意差は出なかった
・胸水があっても、TTFに有意差は出なかった
・骨転移があっても、TTFに有意差は出なかった
・遺伝子変異タイプ別では、TTFに有意差は出なかった
初回EGFR-TKI治療後、再生検をして、結果がどうだったかという後方視的検討・・・。
やむを得ないことだが、FLAURA試験の結果を受けて、ほとんどの臨床医がEGFR遺伝子変異陽性肺がんの初回治療としてオシメルチニブを選んでいるだろうと考えられる今、こうした発表は輝きを失っているように見える。
特に、MS47の演者との質疑応答では、ガックリ来てしまった。
〇 MS47:EGFR陽性非小細胞肺がんのEGFR-TKI耐性後EGFR-T790M変異出現に関する多施設共同後方視的検討
・2014年05月から2018年01月までに、国内5施設でEGFR-TKI使用後に耐性化し、再生検が実施された78人を対象とした
・腫瘍最大縮小率maximal tumor shrinkage(MTS)と、T790M変異出現の関連性を調べた
・T790M陽性が39人、陰性が39人、T790M出現割合は50%だった
・T790M陽性群のMTS平均値は42.7%、T790M陰性郡のMTS平均値は24.0%で、p=0.023と有意にT790M陽性群の方が初回EGFR-TKI治療時の最大腫瘍縮小率が大きかった
・裏を返せば、初回治療がよく効くほど、T790M耐性変異が出やすく、二次治療でオシメルチニブを使うチャンスが多そうだった
・この発表は、初回治療でオシメルチニブ以外のEGFR-TKIを使用することを前提としているが、演者に「先生はEGFR遺伝子変異陽性の非小細胞肺癌を診断したときに、どんな治療を勧めますか?」と質問したところ「患者の理解度にもよりますが、オシメルチニブを勧めます」との答えが返ってきて、ドン引きしてしまった
〇 MS48:当院におけるオシメルチニブ使用症例の後方視的検討
・2016年04月01日から2019年01月31日までの間にEGFR遺伝子変異陽性進行非小細胞肺癌と診断され、EGFR-TKIを使用した患者113人を対象とした
・113人のうち、再生検をしたのが61人(54.0%)
・再生検をした61人のうち、T790M陽性と判定されたのが37人(60.7%)
・患者背景は以下の通り

・median Time to Treatment Failure(mTTF)は417日間
・肝転移があると、TTFが有意に短くなる傾向があった
・脳転移があっても、TTFに有意差は出なかった
・胸水があっても、TTFに有意差は出なかった
・骨転移があっても、TTFに有意差は出なかった
・遺伝子変異タイプ別では、TTFに有意差は出なかった
2019年04月16日
ROS1陽性非小細胞肺癌に対するEntrectinib
entrectinibとROS1について。
entrectinibが標的としているROS1, TRKsはいずれも出現頻度の低い遺伝子異常だ。
そのため、一般社会へのインパクトは弱いかもしれないが、こうした遺伝子異常をもつがんに苦しめられている方にとっては、まさに福音といってよい。
<ROS1融合遺伝子陽性非小細胞肺癌に選択的ROS1、TRKA/B/C阻害薬のentrectinibが有望【WCLC2018】>
entrectinibのフェーズ1/2試験の統合解析の結果、局所進行または転移を有するROS1融合遺伝子陽性非小細胞肺癌に、選択的ROS1、TRKA/B/C阻害薬であるentrectinibが有望であることが明らかとなった。IASLC 19th World conference on Lung Cancer(WCLC2018)で発表された。

STARTRK-2試験は、多施設フェーズ2試験のバスケット試験で、entrectinibは4週間を1サイクルとして、1日1回600mgが投与された。STARTRK-2試験からは37人のROS1変異陽性患者のデータが集められた。用量漸増フェーズ1試験のSTARTRK-1試験から7人、用量漸増フェーズ1試験のALKA-372-001試験から7人のデータが集められ、全体でROS1阻害薬未治療のROS1陽性NSCLC患者53人にentrectinibを投与した。主要評価項目は奏効割合と奏効期間。副次評価項目は無増悪生存期間(PFS)、全生存期間(OS)、頭蓋内奏効割合と奏効期間、安全性、忍容性だった。
患者背景は、年齢中央値が53歳(27-73)、女性が64.2%、アジア人が35.8%、白色人種が58.5%、喫煙歴なしが58.5%、腺癌76.1%だった。前治療歴数0が13.2%、1から2が39.7%、3以上が47.1%、ベースラインで脳病変があったのは43.4%だった。
データカットオフは2018年5月31日で、観察期間中央値は15.5カ月だった。解析の結果、全体の奏効割合は77.4%(95%信頼区間:63.8-87.7)で完全奏効(CR)が5.7%だった。ベースラインで脳病変があった患者23人においては、奏効割合は73.9%(95%信頼区間:51.6-89.8)でCRはなかった。ベースラインで脳病変がなかった患者30人においては、奏効割合は80.0%(95%信頼区間:61.4-92.3)でCRは10.0%だった。

奏効期間中央値は24.6カ月(95%信頼区間:11.4-34.8)だった。PFS中央値は19.0カ月(95%信頼区間:12.2-36.6)。生存に関する観察期間中央値15.5カ月で、OSイベントは9件しかおきておらず、OS中央値はNEだった。

ベースラインでの脳転移について、盲検下独立中央判定が可能だった20人において、頭蓋内奏効率は55%(95%信頼区間:31.53-76.94)、頭蓋内CRが4人で認められた。頭蓋内奏効期間中央値は12.9カ月(95%信頼区間:5.6-NE)だった。
3試験合わせて355人がentrectinibの投与を受けていた。ほとんどの副作用はグレード1/2で可逆的なものだった。治療関連副作用で投薬中止になったのは3.9%、減量になったのは27.3%、中断になったのは25.4%。重篤な副作用が発現したのは8.5%だった。
<entrectinibがROS1融合遺伝子陽性非小細胞肺癌を対象に申請>
中外製薬は2019年03月15日、ROS1/TRK阻害薬entrectinibについて、ROS1融合遺伝子陽性の局所進行または転移性非小細胞肺癌を対象に製造販売承認申請を厚生労働省に行ったと発表した。entrectinibは、2018年12月にNTRK融合遺伝子陽性の局所進行または転移性固形癌を対象に申請されており、2つ目の適応症になる。
今回の承認申請は、オープンラベル多施設国際フェーズ2試験STARTRK-2と海外で実施された3件のフェーズ1試験(STARTRK-NG試験、STARTRK-1試験、ALKA-372-001試験)の統合解析結果に基づいている。
entrectinibが標的としているROS1, TRKsはいずれも出現頻度の低い遺伝子異常だ。
そのため、一般社会へのインパクトは弱いかもしれないが、こうした遺伝子異常をもつがんに苦しめられている方にとっては、まさに福音といってよい。
<ROS1融合遺伝子陽性非小細胞肺癌に選択的ROS1、TRKA/B/C阻害薬のentrectinibが有望【WCLC2018】>
entrectinibのフェーズ1/2試験の統合解析の結果、局所進行または転移を有するROS1融合遺伝子陽性非小細胞肺癌に、選択的ROS1、TRKA/B/C阻害薬であるentrectinibが有望であることが明らかとなった。IASLC 19th World conference on Lung Cancer(WCLC2018)で発表された。

STARTRK-2試験は、多施設フェーズ2試験のバスケット試験で、entrectinibは4週間を1サイクルとして、1日1回600mgが投与された。STARTRK-2試験からは37人のROS1変異陽性患者のデータが集められた。用量漸増フェーズ1試験のSTARTRK-1試験から7人、用量漸増フェーズ1試験のALKA-372-001試験から7人のデータが集められ、全体でROS1阻害薬未治療のROS1陽性NSCLC患者53人にentrectinibを投与した。主要評価項目は奏効割合と奏効期間。副次評価項目は無増悪生存期間(PFS)、全生存期間(OS)、頭蓋内奏効割合と奏効期間、安全性、忍容性だった。
患者背景は、年齢中央値が53歳(27-73)、女性が64.2%、アジア人が35.8%、白色人種が58.5%、喫煙歴なしが58.5%、腺癌76.1%だった。前治療歴数0が13.2%、1から2が39.7%、3以上が47.1%、ベースラインで脳病変があったのは43.4%だった。
データカットオフは2018年5月31日で、観察期間中央値は15.5カ月だった。解析の結果、全体の奏効割合は77.4%(95%信頼区間:63.8-87.7)で完全奏効(CR)が5.7%だった。ベースラインで脳病変があった患者23人においては、奏効割合は73.9%(95%信頼区間:51.6-89.8)でCRはなかった。ベースラインで脳病変がなかった患者30人においては、奏効割合は80.0%(95%信頼区間:61.4-92.3)でCRは10.0%だった。

奏効期間中央値は24.6カ月(95%信頼区間:11.4-34.8)だった。PFS中央値は19.0カ月(95%信頼区間:12.2-36.6)。生存に関する観察期間中央値15.5カ月で、OSイベントは9件しかおきておらず、OS中央値はNEだった。

ベースラインでの脳転移について、盲検下独立中央判定が可能だった20人において、頭蓋内奏効率は55%(95%信頼区間:31.53-76.94)、頭蓋内CRが4人で認められた。頭蓋内奏効期間中央値は12.9カ月(95%信頼区間:5.6-NE)だった。
3試験合わせて355人がentrectinibの投与を受けていた。ほとんどの副作用はグレード1/2で可逆的なものだった。治療関連副作用で投薬中止になったのは3.9%、減量になったのは27.3%、中断になったのは25.4%。重篤な副作用が発現したのは8.5%だった。
<entrectinibがROS1融合遺伝子陽性非小細胞肺癌を対象に申請>
中外製薬は2019年03月15日、ROS1/TRK阻害薬entrectinibについて、ROS1融合遺伝子陽性の局所進行または転移性非小細胞肺癌を対象に製造販売承認申請を厚生労働省に行ったと発表した。entrectinibは、2018年12月にNTRK融合遺伝子陽性の局所進行または転移性固形癌を対象に申請されており、2つ目の適応症になる。
今回の承認申請は、オープンラベル多施設国際フェーズ2試験STARTRK-2と海外で実施された3件のフェーズ1試験(STARTRK-NG試験、STARTRK-1試験、ALKA-372-001試験)の統合解析結果に基づいている。
2019年04月15日
2019年 第59回日本呼吸器学会備忘録その1
2019年 第59回日本呼吸器学会備忘録
〇 MS46:実臨床においてオシメルチニブを投与された147人の検討
・2008年1月から2017年8月の期間内に、中部・東海地方の11施設で調査を実施
・二次治療でオシメルチニブの投与を受けた患者が対象
・初回治療で使用したEGFR阻害薬は、ゲフィチニブ 726人、エルロチニブ 413人、アファチニブ 235人の計1374人、そのうちT790M陽性で二次治療でオシメルチニブが使用できたのは147人(10.7%)だった
・オシメルチニブ治療継続期間(Time on Treatment)は13.8ヶ月
・全生存期間は未到達(66.2ヶ月-未到達)
・治療中止の理由として重要だったのは間質性肺炎、9人(6.1%)
・免疫チェックポイント阻害薬投与後3ヶ月以上経過してからでオシメルチニブを使用開始した患者は5人いて、解析時点では全例生存中だった

〇 MS46:実臨床においてオシメルチニブを投与された147人の検討
・2008年1月から2017年8月の期間内に、中部・東海地方の11施設で調査を実施
・二次治療でオシメルチニブの投与を受けた患者が対象
・初回治療で使用したEGFR阻害薬は、ゲフィチニブ 726人、エルロチニブ 413人、アファチニブ 235人の計1374人、そのうちT790M陽性で二次治療でオシメルチニブが使用できたのは147人(10.7%)だった
・オシメルチニブ治療継続期間(Time on Treatment)は13.8ヶ月
・全生存期間は未到達(66.2ヶ月-未到達)
・治療中止の理由として重要だったのは間質性肺炎、9人(6.1%)
・免疫チェックポイント阻害薬投与後3ヶ月以上経過してからでオシメルチニブを使用開始した患者は5人いて、解析時点では全例生存中だった

2019年04月03日
NEJ009 gefitinib±CBDCA+PEM followed by osimertinib
最近、NEJ009試験のその後について触れた。
http://oitahaiganpractice.junglekouen.com/e954088.html
ESMO2018発表時ポスターのレプリカが手に入ったので見てみたが、これは共有した方が良さそうだと考えた。
https://cslide.ctimeetingtech.com/esmo2018/attendee/confcal/show/session/260
1382PD - Phase III Study of Gefitinib (G) versus Gefitinib+Carboplatin+Pemetrexed (GCP) as 1st-line Treatment for Patients (pts) with Advanced Non-Small Cell Lung Cancer (NSCLC) with EGFR Mutations (NEJ009)
Masahiro Seike et al.
ESMO 2018 congress
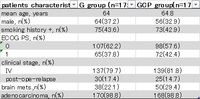
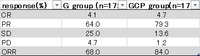

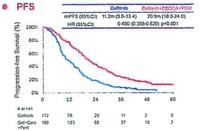




EGFR遺伝子変異陽性の進行・再発非小細胞肺がんに対して、カルボプラチン+ペメトレキセド+ゲフィチニブ併用療法が無増悪生存期間、全生存期間を有意に延長した、というのが結論で、無増悪生存期間中央値は21ヶ月、全生存期間は51ヶ月と、日本人のみを対象とした過去の臨床試験と比較しても最高の結果を残している。
これだけでも本併用療法を一押しするに足るのだが、今回の発表の白眉は何といっても次の資料だ。


ゲフィチニブ単剤療法群172人のうち、病勢進行後にT790M耐性変異が明らかとなってオシメルチニブを使用した患者が37人(22%)、オシメルチニブを使用できなかった患者が135人。
カルボプラチン+ペメトレキセド+ゲフィチニブ併用療法群の170人のうち、病勢進行後にT790M耐性変異が明らかとなってオシメルチニブを使用した患者が29人(17%)、オシメルチニブを使用できなかった患者が141人。
両群ともに、二次治療でオシメルチニブを使用できた場合には、95%以上の確率で67ヶ月以上の生存期間が期待できる、ということのようだ。
ゲフィチニブ単剤療法から開始したら、5人中4人はT790M陰性、期待される生存期間中央値は30ヶ月で、5人中1人はT790M陽性、二次治療でオシメルチニブを使用した場合に期待される生存期間は少なくとも74ヶ月。
カルボプラチン+ペメトレキセド+ゲフィチニブ併用療法から開始したら、6人中5人はT790M陰性、期待される生存期間中央値は44ヶ月、6人中1人はT790M陽性、二次治療でオシメルチニブを使用した場合に期待される生存期間は少なくとも67ヶ月。
オシメルチニブを初回治療で使用した場合の生存期間全容については今後の報告を待たねばならないが、EGFR遺伝子変異陽性の進行・再発非小細胞肺がん患者に対して、治療開始前に今回のデータを提示すべきだ。
http://oitahaiganpractice.junglekouen.com/e954088.html
ESMO2018発表時ポスターのレプリカが手に入ったので見てみたが、これは共有した方が良さそうだと考えた。
https://cslide.ctimeetingtech.com/esmo2018/attendee/confcal/show/session/260
1382PD - Phase III Study of Gefitinib (G) versus Gefitinib+Carboplatin+Pemetrexed (GCP) as 1st-line Treatment for Patients (pts) with Advanced Non-Small Cell Lung Cancer (NSCLC) with EGFR Mutations (NEJ009)
Masahiro Seike et al.
ESMO 2018 congress








EGFR遺伝子変異陽性の進行・再発非小細胞肺がんに対して、カルボプラチン+ペメトレキセド+ゲフィチニブ併用療法が無増悪生存期間、全生存期間を有意に延長した、というのが結論で、無増悪生存期間中央値は21ヶ月、全生存期間は51ヶ月と、日本人のみを対象とした過去の臨床試験と比較しても最高の結果を残している。
これだけでも本併用療法を一押しするに足るのだが、今回の発表の白眉は何といっても次の資料だ。


ゲフィチニブ単剤療法群172人のうち、病勢進行後にT790M耐性変異が明らかとなってオシメルチニブを使用した患者が37人(22%)、オシメルチニブを使用できなかった患者が135人。
カルボプラチン+ペメトレキセド+ゲフィチニブ併用療法群の170人のうち、病勢進行後にT790M耐性変異が明らかとなってオシメルチニブを使用した患者が29人(17%)、オシメルチニブを使用できなかった患者が141人。
両群ともに、二次治療でオシメルチニブを使用できた場合には、95%以上の確率で67ヶ月以上の生存期間が期待できる、ということのようだ。
ゲフィチニブ単剤療法から開始したら、5人中4人はT790M陰性、期待される生存期間中央値は30ヶ月で、5人中1人はT790M陽性、二次治療でオシメルチニブを使用した場合に期待される生存期間は少なくとも74ヶ月。
カルボプラチン+ペメトレキセド+ゲフィチニブ併用療法から開始したら、6人中5人はT790M陰性、期待される生存期間中央値は44ヶ月、6人中1人はT790M陽性、二次治療でオシメルチニブを使用した場合に期待される生存期間は少なくとも67ヶ月。
オシメルチニブを初回治療で使用した場合の生存期間全容については今後の報告を待たねばならないが、EGFR遺伝子変異陽性の進行・再発非小細胞肺がん患者に対して、治療開始前に今回のデータを提示すべきだ。



