2021年12月14日
セルペルカチニブ、上市
選択的RET阻害薬のセルペルカチニブが2021/12/13に上市された。
出現頻度は肺腺がんのわずか2%に過ぎない。
しかし、義父のようにその2%にあたった患者にとっては、福音だ。
製薬会社から提供されたパンフレットに沿って、RETそのものについて、また薬事承認の裏付けとなったLIBRETTO-001試験の概要と結果に触れる。

正常なRET遺伝子に由来する蛋白質はEGFRなどと同じく受容体型チロシンキナーゼで、リガンドが結合すると二量体を形成し、細胞内シグナル伝達系を介して細胞増殖を促すとされる。
腎臓や腸管神経系の派生や神経組織、神経内分泌組織、造血系などの組織の維持に関わる働きを持つ、とのこと。

一方、RET遺伝子の複製過程で偶然発生したRET融合遺伝子は、リガンドが結合せずとも二量体を形成して細胞質内に局在し、恒常的に細胞増殖を促し、細胞をがん化へ導く。
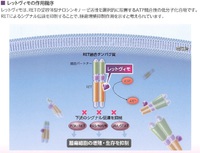
セルペルカチニブ(商品名レットヴィモ)は、RET蛋白質のアデノシン三リン酸(ATP)結合部位に、ATPと競合的に結合することで、細胞内シグナル伝達、細胞増殖刺激を抑制する。

国立がん研究センターで肺腺がん患者319人のドライバー遺伝子変異を調べたところ、その1.9%にRET融合遺伝子を認めた。

過去の論文から6899人の肺がん患者データを抽出して調査したところ、①女性、②60歳未満、③非喫煙者では統計学的有意にRET融合遺伝子陽性肺がんの患者が多かった。

RET融合遺伝子陽性肺がんは、EGFR、ALK、ROS1、BRAF各遺伝子異常と同じく、オンコマインDxTT(デラックスターゲットテスト)マルチCDx(コンパニオン診断)システムで検出できる。

LIBRETTO-001試験は、RET融合遺伝子陽性固形がんの患者を対象とした臨床試験で、推奨用量設定のための安全性確認試験である第I相部分と、主要評価項目を奏効割合とした有効性確認試験である第II相部分に分かれていた。
今回薬事承認の根拠となったのは、第I相部分および第II相部分のコホート1、コホート2における非小細胞肺がん患者のデータだ。

コホート2の未治療群では、総数49人中日本人はわずか4人しか含まれていない。
一方、コホート1の既治療群では、総数210人中日本人は44人と20%を超えるプレゼンスを示している。
既治療群において、95%は化学療法の、60%は抗PD-1 / PD-L1薬の治療歴がある。

第I相部分、第II相部分の統合解析では、主要評価項目の奏効割合は、未治療群では70.5%(95%信頼区間54.8-83.2)、既治療群では56.9%(95%信頼区間49.8-63.8)だった。
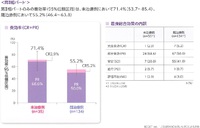
推奨用量に則った治療を受けた第II相部分の患者だけを解析すると、主要評価項目の奏効割合は、未治療群では71.4%(95%信頼区間53.7-85.4)、既治療群では55.2%(95%信頼区間46.4-63.8)だった。

最良変化率のwaterfall plotを見ると、未治療例、既治療例ともに、ほぼすべての患者で腫瘍縮小効果が得られている。
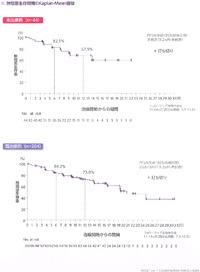
無増悪生存期間中央値は、未治療群では未到達(95%信頼区間9.2-未到達)、既治療群では20.67ヶ月(95%信頼区間19.3-未到達)だった。

全生存期間中央値は、未治療群では未到達(95%信頼区間算定不能)、既治療群でも未到達(95%信頼区間25.7-未到達)だった。

中枢神経系の測定可能病変があった患者で、治療によるその奏効割合は82%で、病勢進行は1人も認めなかった。

本試験全体(非小細胞肺がん以外の固形癌患者も含む)としての有害事象は高頻度に認め、肝障害、QT延長、高血圧が多かった。
特徴的な有害事象として過敏症関連事象が取り上げられた。
発熱、発疹、肝機能障害、血小板減少が現れたら要注意で、まずは休薬とプレドニゾロン0.5-1.0mg/kg程度の内服治療。
間質性肺炎の出現頻度は1.2%とわずかで、Grade 3以上の重篤なものはなかった。
_1-s.jpg)
発現頻度が10%を超える有害事象一覧。

発現頻度が20%を超える有害事象一覧。
-s.jpg)
日本人において、発現頻度が10%を超える有害事象一覧。

日本人において、発現頻度が20%を超える有害事象一覧。
肝機能障害がかなりの高頻度で、定期的な血液検査が欠かせない。

免疫チェックポイント阻害薬の治療歴があると、過敏症発現頻度が10%強まで高まる。
出現頻度は肺腺がんのわずか2%に過ぎない。
しかし、義父のようにその2%にあたった患者にとっては、福音だ。
製薬会社から提供されたパンフレットに沿って、RETそのものについて、また薬事承認の裏付けとなったLIBRETTO-001試験の概要と結果に触れる。

正常なRET遺伝子に由来する蛋白質はEGFRなどと同じく受容体型チロシンキナーゼで、リガンドが結合すると二量体を形成し、細胞内シグナル伝達系を介して細胞増殖を促すとされる。
腎臓や腸管神経系の派生や神経組織、神経内分泌組織、造血系などの組織の維持に関わる働きを持つ、とのこと。

一方、RET遺伝子の複製過程で偶然発生したRET融合遺伝子は、リガンドが結合せずとも二量体を形成して細胞質内に局在し、恒常的に細胞増殖を促し、細胞をがん化へ導く。

セルペルカチニブ(商品名レットヴィモ)は、RET蛋白質のアデノシン三リン酸(ATP)結合部位に、ATPと競合的に結合することで、細胞内シグナル伝達、細胞増殖刺激を抑制する。

国立がん研究センターで肺腺がん患者319人のドライバー遺伝子変異を調べたところ、その1.9%にRET融合遺伝子を認めた。

過去の論文から6899人の肺がん患者データを抽出して調査したところ、①女性、②60歳未満、③非喫煙者では統計学的有意にRET融合遺伝子陽性肺がんの患者が多かった。

RET融合遺伝子陽性肺がんは、EGFR、ALK、ROS1、BRAF各遺伝子異常と同じく、オンコマインDxTT(デラックスターゲットテスト)マルチCDx(コンパニオン診断)システムで検出できる。

LIBRETTO-001試験は、RET融合遺伝子陽性固形がんの患者を対象とした臨床試験で、推奨用量設定のための安全性確認試験である第I相部分と、主要評価項目を奏効割合とした有効性確認試験である第II相部分に分かれていた。
今回薬事承認の根拠となったのは、第I相部分および第II相部分のコホート1、コホート2における非小細胞肺がん患者のデータだ。

コホート2の未治療群では、総数49人中日本人はわずか4人しか含まれていない。
一方、コホート1の既治療群では、総数210人中日本人は44人と20%を超えるプレゼンスを示している。
既治療群において、95%は化学療法の、60%は抗PD-1 / PD-L1薬の治療歴がある。

第I相部分、第II相部分の統合解析では、主要評価項目の奏効割合は、未治療群では70.5%(95%信頼区間54.8-83.2)、既治療群では56.9%(95%信頼区間49.8-63.8)だった。

推奨用量に則った治療を受けた第II相部分の患者だけを解析すると、主要評価項目の奏効割合は、未治療群では71.4%(95%信頼区間53.7-85.4)、既治療群では55.2%(95%信頼区間46.4-63.8)だった。

最良変化率のwaterfall plotを見ると、未治療例、既治療例ともに、ほぼすべての患者で腫瘍縮小効果が得られている。

無増悪生存期間中央値は、未治療群では未到達(95%信頼区間9.2-未到達)、既治療群では20.67ヶ月(95%信頼区間19.3-未到達)だった。

全生存期間中央値は、未治療群では未到達(95%信頼区間算定不能)、既治療群でも未到達(95%信頼区間25.7-未到達)だった。

中枢神経系の測定可能病変があった患者で、治療によるその奏効割合は82%で、病勢進行は1人も認めなかった。

本試験全体(非小細胞肺がん以外の固形癌患者も含む)としての有害事象は高頻度に認め、肝障害、QT延長、高血圧が多かった。
特徴的な有害事象として過敏症関連事象が取り上げられた。
発熱、発疹、肝機能障害、血小板減少が現れたら要注意で、まずは休薬とプレドニゾロン0.5-1.0mg/kg程度の内服治療。
間質性肺炎の出現頻度は1.2%とわずかで、Grade 3以上の重篤なものはなかった。
_1-s.jpg)
発現頻度が10%を超える有害事象一覧。

発現頻度が20%を超える有害事象一覧。
-s.jpg)
日本人において、発現頻度が10%を超える有害事象一覧。

日本人において、発現頻度が20%を超える有害事象一覧。
肝機能障害がかなりの高頻度で、定期的な血液検査が欠かせない。

免疫チェックポイント阻害薬の治療歴があると、過敏症発現頻度が10%強まで高まる。
2021年12月03日
フィルムとシャウカステンの文化
しばらく前、ひょんなことから「じん肺標準X線フィルム集 増補版」を譲り受けて、職場に保管してある。
以前はとても高価なものだったのだが、CD-ROM版が流布してからというもの、すっかり見かけなくなった。
まるでNTTの電話加入権のようだ。
10年未満のキャリアの医師にとっては、フィルムとシャウカステンという文化は、おそらく過去の遺物だろう。
そもそも、シャウカステンとはなんですか、と尋ねられそうだ。
フィルムをカシャンとかけて眺めるための、あの白く光る機械である。
→https://ja.wikipedia.org/wiki/%E3%82%B7%E3%83%A3%E3%82%A6%E3%82%AB%E3%82%B9%E3%83%86%E3%83%B3
社会人になって最初の10年は、思えばフィルムとシャウカステンの文化の最後の10年だった。
思い出は様々ある。
1年目、早朝から教授の前で入院新患紹介をするにあたって、前日の夜遅くまで指導医とともに毎週のように読影練習をした。
当日は全ての教室員に見守られながら、フィルムとシャウカステンの傍らに立ち、画像の読影を含めて患者のプレゼンテーションをする。
さらに緊張するのは数ヶ月に1度、同門の医師を招集して開催されるチェストカンファレンス。
大学の大講義室で、全く事前情報のないままに提示されたレントゲン、CTを型のごとく読影し、鑑別診断を挙げていく。
レントゲンの撮影条件の是非から教科書通りに読影を進める作業を繰り返しているうちに、基礎が身についたように思う。
2年目、初期研修の一環でとある消化器病センターに勤務、毎週2回は指導医がオーダーした全ての腹部CTを読影し、レポートを作成する。
慣れない腹部造影CTの読影を、1回あたり6-10枚に及ぶフィルムを並べて、1つひとつの肝細胞癌病巣のサイズを測定比較して記録する。
薄暗い読影室にシャウカステンの白い光が煌々と輝く中、午前2時まで読影して、午前6時に出勤の繰り返しだった。
8年目から9年目は、2年目にやっていたのとほぼ同じことを肺がんについてやることになった。
ただし、こちらは胸部レントゲンと胸腹部CTがセットである。
診療と研究の合間を縫ってこなしていたが、シャウカステンの前に指導医と並んで議論をしながら読影する日々は、本当に学びが多かった。
このころは、フィルムの画像データを自動的に取り込んでjpgデータを作成する機器が登場し、フィルムからモニターへの過渡期だったように思う。
利便性の点では、現在のシステムが遥かに優れている。
カルテと同様で、複数人で、異なる場所で、同じ画像を見ることができる。
過去の画像を検索するのはいともたやすい。
かつては、重いフィルム袋を引っ張り出して、用事が済んだら遺漏なく整理して戻さなければならなかった。
異なる日付、異なる検査種のフィルム袋に収めたならまだ許せるが、他の患者と混じりあってしまったら大変なことになる。
当然場所も取る。
もっとも、いまではサーバーという形で、場所と電気代を必要とし、おそらく地球温暖化にも一役買っているだろう。
一方、フィルムとシャウカステンの文化ならでは、というものもある。
例えば、気管分岐下(#7)リンパ節腫大の有無を確認するために奇静脈食道線を追いかけるとき、フィルム下端を手に取って傾けながら、線の左右のコントラストを際立たせるなど、よく目にしたものだ。
音楽業界におけるレコード→CD→ダウンロードという流れと同様に、放射線診断でもフィルム→モニター→遠隔画像診断という流れがあるわけだが・・・・
レコード回帰のようにフィルム回帰という文化もまた、生まれるだろうか。
以前はとても高価なものだったのだが、CD-ROM版が流布してからというもの、すっかり見かけなくなった。
まるでNTTの電話加入権のようだ。
10年未満のキャリアの医師にとっては、フィルムとシャウカステンという文化は、おそらく過去の遺物だろう。
そもそも、シャウカステンとはなんですか、と尋ねられそうだ。
フィルムをカシャンとかけて眺めるための、あの白く光る機械である。
→https://ja.wikipedia.org/wiki/%E3%82%B7%E3%83%A3%E3%82%A6%E3%82%AB%E3%82%B9%E3%83%86%E3%83%B3
社会人になって最初の10年は、思えばフィルムとシャウカステンの文化の最後の10年だった。
思い出は様々ある。
1年目、早朝から教授の前で入院新患紹介をするにあたって、前日の夜遅くまで指導医とともに毎週のように読影練習をした。
当日は全ての教室員に見守られながら、フィルムとシャウカステンの傍らに立ち、画像の読影を含めて患者のプレゼンテーションをする。
さらに緊張するのは数ヶ月に1度、同門の医師を招集して開催されるチェストカンファレンス。
大学の大講義室で、全く事前情報のないままに提示されたレントゲン、CTを型のごとく読影し、鑑別診断を挙げていく。
レントゲンの撮影条件の是非から教科書通りに読影を進める作業を繰り返しているうちに、基礎が身についたように思う。
2年目、初期研修の一環でとある消化器病センターに勤務、毎週2回は指導医がオーダーした全ての腹部CTを読影し、レポートを作成する。
慣れない腹部造影CTの読影を、1回あたり6-10枚に及ぶフィルムを並べて、1つひとつの肝細胞癌病巣のサイズを測定比較して記録する。
薄暗い読影室にシャウカステンの白い光が煌々と輝く中、午前2時まで読影して、午前6時に出勤の繰り返しだった。
8年目から9年目は、2年目にやっていたのとほぼ同じことを肺がんについてやることになった。
ただし、こちらは胸部レントゲンと胸腹部CTがセットである。
診療と研究の合間を縫ってこなしていたが、シャウカステンの前に指導医と並んで議論をしながら読影する日々は、本当に学びが多かった。
このころは、フィルムの画像データを自動的に取り込んでjpgデータを作成する機器が登場し、フィルムからモニターへの過渡期だったように思う。
利便性の点では、現在のシステムが遥かに優れている。
カルテと同様で、複数人で、異なる場所で、同じ画像を見ることができる。
過去の画像を検索するのはいともたやすい。
かつては、重いフィルム袋を引っ張り出して、用事が済んだら遺漏なく整理して戻さなければならなかった。
異なる日付、異なる検査種のフィルム袋に収めたならまだ許せるが、他の患者と混じりあってしまったら大変なことになる。
当然場所も取る。
もっとも、いまではサーバーという形で、場所と電気代を必要とし、おそらく地球温暖化にも一役買っているだろう。
一方、フィルムとシャウカステンの文化ならでは、というものもある。
例えば、気管分岐下(#7)リンパ節腫大の有無を確認するために奇静脈食道線を追いかけるとき、フィルム下端を手に取って傾けながら、線の左右のコントラストを際立たせるなど、よく目にしたものだ。
音楽業界におけるレコード→CD→ダウンロードという流れと同様に、放射線診断でもフィルム→モニター→遠隔画像診断という流れがあるわけだが・・・・
レコード回帰のようにフィルム回帰という文化もまた、生まれるだろうか。
2021年12月02日
肺がん新WHO分類(第5版)とそれに準拠した病理組織分類
原則として、肺がんの確定診断は病理組織診断による。
生検(外科手術を含む)をして、顕微鏡で細かく見て、がん細胞、がん組織を確認するということである。
そのため、診断基準が変更されるのは、とても大きな出来事である。
不覚にも先週まで把握していなかったが、世界共通の診断基準であるWHO Classification of tumors: Thoracic Tumoursが2021年4月15日に刊行された。
→https://publications.iarc.fr/595
それに伴い、日本肺癌学会は「新WHO分類に準拠した病理組織分類」を2021年11月26日に公表し、以後は本分類に沿って病理組織診断を行うように通知した。
→https://www.haigan.gr.jp/modules/important/index.php?content_id=248
先日の第62回日本肺癌学会総会でセミナーが行われていたので聴講した。
大枠は変わらないとのこと。
その大枠は、概ね上記の「新WHO分類に準拠した病理組織分類」の6-8ページを読めば掴める。
重要な点を1つだけ挙げるとするならば、肺腺がんの病理組織診断において、グレード分類が適用されたことだろう。

結局、病理組織像でまず捉えるべきは低分化成分の広がりであり、概ね20%以上ならば低分化、20%以下ならばその他の部分が肺胞上皮置換型優勢なら高分化、そうでなければ中分化、ということらしい。
これなら検者によってばらつきは少なくなるだろう(実際にそうだったらしい)し、生命予後とよく相関するそうなのでそれに越したことはない。
低分化、中分化、高分化の分類は、なんだか懐古的な印象を受けるが、solid、micropapillary、cribriform, complexといった低分化=高悪性度の病理所見をきちんと定義した上での分類であり、実務上とてもよい改訂だと感じた。
生検(外科手術を含む)をして、顕微鏡で細かく見て、がん細胞、がん組織を確認するということである。
そのため、診断基準が変更されるのは、とても大きな出来事である。
不覚にも先週まで把握していなかったが、世界共通の診断基準であるWHO Classification of tumors: Thoracic Tumoursが2021年4月15日に刊行された。
→https://publications.iarc.fr/595
それに伴い、日本肺癌学会は「新WHO分類に準拠した病理組織分類」を2021年11月26日に公表し、以後は本分類に沿って病理組織診断を行うように通知した。
→https://www.haigan.gr.jp/modules/important/index.php?content_id=248
先日の第62回日本肺癌学会総会でセミナーが行われていたので聴講した。
大枠は変わらないとのこと。
その大枠は、概ね上記の「新WHO分類に準拠した病理組織分類」の6-8ページを読めば掴める。
重要な点を1つだけ挙げるとするならば、肺腺がんの病理組織診断において、グレード分類が適用されたことだろう。

結局、病理組織像でまず捉えるべきは低分化成分の広がりであり、概ね20%以上ならば低分化、20%以下ならばその他の部分が肺胞上皮置換型優勢なら高分化、そうでなければ中分化、ということらしい。
これなら検者によってばらつきは少なくなるだろう(実際にそうだったらしい)し、生命予後とよく相関するそうなのでそれに越したことはない。
低分化、中分化、高分化の分類は、なんだか懐古的な印象を受けるが、solid、micropapillary、cribriform, complexといった低分化=高悪性度の病理所見をきちんと定義した上での分類であり、実務上とてもよい改訂だと感じた。
2021年12月01日
CLIP1-LTK融合遺伝子の発見・・・LC-SCRUM Asiaから
「その他」の中にこそ、新たな発見が眠っている。
誰もが分かってはいるけれど、実際にそれを見出すのは簡単ではない。
今年の肺癌学会総会にシンクロしたもののひとつに、CLIP1-LTK融合遺伝子も挙げられる。
2021/11/25付でNature誌に発表され、国立がん研究センターのプレスリリースでも公表された。
→https://www.nature.com/articles/s41586-021-04135-5
→https://www.ncc.go.jp/jp/information/pr_release/2021/1125/index.html
出現頻度は2/542=0.37%ととてつもなく低い。
NTRKやBRAF遺伝子変異に勝るとも劣らない頻度の低さだ。
とはいえ、ロルラチニブが効くということならば、CLIP1-LTK融合遺伝子を何とか見つけなければ、という気持ちになる。
治療開始前後のPET画像は、きわめてインパクトがある。
そして、夢がある。
これを見て心を揺さぶられない研究者・臨床家は、仕事をする資格がないと私は思う。
CLIP1-LTK融合遺伝子を標的としたロルラチニブの医師主導フェーズ2試験が、登録予定患者数を16人として2022年の早期に開始される予定とのこと。
自ら見出したドライバー融合遺伝子を対象とした世界初の医師主導臨床試験であり、国立がん研究センター東病院のスタッフは勇往邁進していることだろう。
The CLIP1–LTK fusion is an oncogenic driver in non‐small‐cell lung cancer
Hiroki Izumi, Shingo Matsumoto, et al., Nature. 2021 Nov 24.
doi: 10.1038/s41586-021-04135-5. Online ahead of print.
肺がんは最も悪性度の高い腫瘍のひとつである。ドライバー遺伝子異常に基づく分子標的療法は、非小細胞肺がん患者における治療アウトカムを本質的に改善した。しかし一方で、こうしたドライバー遺伝子異常は、非小細胞肺がんの中でも最も多い原発性肺腺がん患者のうち25-40%では見つからない。
今回、多施設共同遺伝子スクリーニング基盤研究であるLC-SCRUM-Asiaにおいて行ったRNAトランスクリプトーム解析から、CLIP1とLTKの新規融合遺伝子を同定したので報告する。CLIP1-LTK融合遺伝子の非小細胞肺がん全体における発生頻度は0.4%で、他のドライバー遺伝子異常と相互排他的な関係にある。CLIP1-LTK融合遺伝子産物のリン酸化活性は恒常的で、がん化を引き起こす能力を持つ。CLIP1-LTK融合遺伝子を導入したBa/F3細胞をALK阻害薬であるロルラチニブで処理したところ、CLIP1-LTK産物のリン酸化活性が阻害され、浸潤増殖が抑制されるとともに細胞死が誘導された。CLIP1-LTk融合遺伝子陽性の非小細胞肺がん患者1人に対してロルラチニブを投与したところ、良好な臨床効果が得られた。我々の知る限り、上皮性悪性腫瘍におけるLTK異常について記載したのは本報告が初である。
誰もが分かってはいるけれど、実際にそれを見出すのは簡単ではない。
今年の肺癌学会総会にシンクロしたもののひとつに、CLIP1-LTK融合遺伝子も挙げられる。
2021/11/25付でNature誌に発表され、国立がん研究センターのプレスリリースでも公表された。
→https://www.nature.com/articles/s41586-021-04135-5
→https://www.ncc.go.jp/jp/information/pr_release/2021/1125/index.html
出現頻度は2/542=0.37%ととてつもなく低い。
NTRKやBRAF遺伝子変異に勝るとも劣らない頻度の低さだ。
とはいえ、ロルラチニブが効くということならば、CLIP1-LTK融合遺伝子を何とか見つけなければ、という気持ちになる。
治療開始前後のPET画像は、きわめてインパクトがある。
そして、夢がある。
これを見て心を揺さぶられない研究者・臨床家は、仕事をする資格がないと私は思う。
CLIP1-LTK融合遺伝子を標的としたロルラチニブの医師主導フェーズ2試験が、登録予定患者数を16人として2022年の早期に開始される予定とのこと。
自ら見出したドライバー融合遺伝子を対象とした世界初の医師主導臨床試験であり、国立がん研究センター東病院のスタッフは勇往邁進していることだろう。
The CLIP1–LTK fusion is an oncogenic driver in non‐small‐cell lung cancer
Hiroki Izumi, Shingo Matsumoto, et al., Nature. 2021 Nov 24.
doi: 10.1038/s41586-021-04135-5. Online ahead of print.
肺がんは最も悪性度の高い腫瘍のひとつである。ドライバー遺伝子異常に基づく分子標的療法は、非小細胞肺がん患者における治療アウトカムを本質的に改善した。しかし一方で、こうしたドライバー遺伝子異常は、非小細胞肺がんの中でも最も多い原発性肺腺がん患者のうち25-40%では見つからない。
今回、多施設共同遺伝子スクリーニング基盤研究であるLC-SCRUM-Asiaにおいて行ったRNAトランスクリプトーム解析から、CLIP1とLTKの新規融合遺伝子を同定したので報告する。CLIP1-LTK融合遺伝子の非小細胞肺がん全体における発生頻度は0.4%で、他のドライバー遺伝子異常と相互排他的な関係にある。CLIP1-LTK融合遺伝子産物のリン酸化活性は恒常的で、がん化を引き起こす能力を持つ。CLIP1-LTK融合遺伝子を導入したBa/F3細胞をALK阻害薬であるロルラチニブで処理したところ、CLIP1-LTK産物のリン酸化活性が阻害され、浸潤増殖が抑制されるとともに細胞死が誘導された。CLIP1-LTk融合遺伝子陽性の非小細胞肺がん患者1人に対してロルラチニブを投与したところ、良好な臨床効果が得られた。我々の知る限り、上皮性悪性腫瘍におけるLTK異常について記載したのは本報告が初である。



