2016年03月30日
Osimertinibの関連情報
EGFR二次耐性変異T790Mに対する阻害薬、Osimertinib(タグリッソ)が2016年3月28日に製造販売承認を得ました。
要は「お薬として作って、販売していいですよ」という国の許可が出たということです。
ですが、薬の値段はまだ決まっておらず、これから2-3ヶ月くらいしないと現場では通常使用できない、という見通しだそうです。
その間、1日でも早くOsimertinibを使いたい、という患者さんはたくさんいるはずです。
そのため、製造販売元のアストラゼネカ社は、以下のプレスリリースからの抜粋にあるように、薬の値段が決まるまでは一部の専門施設を窓口として、無償提供を行うことに決めたようです。
興味がある患者さんや担当医師は、相談窓口に連絡してみてはいかがでしょうか。

以下は、3月25日の講演会で私が使ったスライドからの抜粋ですが、Osimertinibの使用対象となる患者さんは、ざっと見積もって非小細胞・非扁平上皮癌患者さんの5人に1人、といったところでしょう。

アストラゼネカ社から提供された、出来立てホヤホヤのパンフレットからOsimertinibの効果を抜粋すると、
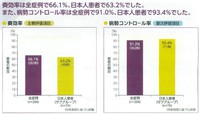


ざっと見積もって、日本人の患者さんで腫瘍が半分以上に縮小する割合は60%強、少なくとも腫瘍が一定期間大きくならない割合は90%強、腫瘍が一定以上に大きくならないでいる期間は10か月弱、というところです。
一方、副作用については、

という感じで、ちょうどgefitinibの間質性肺炎が問題になって、3000例強の追跡調査が行われたときのデータを彷彿とさせるような内容です。
実際のところ、gefitinibの当時に比べて、かなり警戒しながら使用しているはずですから、実質はgefitinibよりも間質性肺炎を生じやすいと捉えた方がいいでしょう。
要は「お薬として作って、販売していいですよ」という国の許可が出たということです。
ですが、薬の値段はまだ決まっておらず、これから2-3ヶ月くらいしないと現場では通常使用できない、という見通しだそうです。
その間、1日でも早くOsimertinibを使いたい、という患者さんはたくさんいるはずです。
そのため、製造販売元のアストラゼネカ社は、以下のプレスリリースからの抜粋にあるように、薬の値段が決まるまでは一部の専門施設を窓口として、無償提供を行うことに決めたようです。
興味がある患者さんや担当医師は、相談窓口に連絡してみてはいかがでしょうか。

以下は、3月25日の講演会で私が使ったスライドからの抜粋ですが、Osimertinibの使用対象となる患者さんは、ざっと見積もって非小細胞・非扁平上皮癌患者さんの5人に1人、といったところでしょう。

アストラゼネカ社から提供された、出来立てホヤホヤのパンフレットからOsimertinibの効果を抜粋すると、



ざっと見積もって、日本人の患者さんで腫瘍が半分以上に縮小する割合は60%強、少なくとも腫瘍が一定期間大きくならない割合は90%強、腫瘍が一定以上に大きくならないでいる期間は10か月弱、というところです。
一方、副作用については、

という感じで、ちょうどgefitinibの間質性肺炎が問題になって、3000例強の追跡調査が行われたときのデータを彷彿とさせるような内容です。
実際のところ、gefitinibの当時に比べて、かなり警戒しながら使用しているはずですから、実質はgefitinibよりも間質性肺炎を生じやすいと捉えた方がいいでしょう。
2016年03月22日
nintedanibの行方
毎年年度末から年度初めにかけて、学会地方会や各種の講演会が集中する傾向があります。
たまたまnintedanibのことをうかがう機会が重なったので、忘れないうちにちょっとまとめます。
nintedanibはPDGF-R, FGF-R, VEGF-Rの各ファミリーを阻害するマルチキナーゼ阻害薬です。
特発性肺線維症、原発性肺がんの治療薬として開発が進みました。
特発性肺線維症に対しては、第II相試験であるTOMORROW試験、第III相試験であるINPULSIS-1, 2試験の結果が報告されています。
Richeldi et al, N Engl J Med 365, 1079-1087, 2011
Richeldi et al, N Engl J Med 370, 2071-2082, 2014
どの試験においても、nintedanibを使用すると努力性肺活量の年間減少量が90-120ml/年程度少なくてすむことが明らかにされています。
どのように生命予後に寄与するかはまだわかっていません。
一方で、原発性肺がんに対しては、LUME-Lung 1試験が報告されています。
Reck et al, Lancet Oncol, 15, 143-155, 2014
既治療の非小細胞肺がんに対して、nintedanib+docetaxel併用群とdocetaxel単独群を比較したところ、主要評価項目である無増悪生存期間が有意に改善(3.4ヶ月vs2.7ヶ月、ハザード比0.79, p=0.0019)しました。
全生存期間を腺がんに限って解析するとこれも併用群で有意に改善(12.6ヶ月vs10.3ヶ月、ハザード比0.83、p=0.0359)しました。
しかし、これらの試験結果を受けてわが国ではどのように動いているかというと、特発性肺線維症に対しては既にnintedanibが使用可能となり、原発性肺がんに対しては実地臨床への導入予定はまったく立っていません。
聞くところによると、nintedanib+docetaxel併用療法を非小細胞肺がんの二次治療としてわが国で検証する予定自体がまったく立っていないようです。
理由は定かではありませんが、このところ二次治療のsettingにおいて、免疫チェックポイント阻害薬がdocetaxelを凌駕する結果が次々に報告されており、nintedanib+docetaxel療法を開発する意義が薄れているのかもしれません。
とはいえ、有害事象やコスト面での競争力があれば、治療のオプションは多いほうがいいと思うのですが。
VEGF-Rを阻害する一方でbevacizumabよりは毒性の軽いnintedanibは、EGFR-TKIと併用してみても面白いような気がしますし、脳転移や胸水・腹水貯留を伴う患者さんには向いていそうですけどね。
それでは、各講演会での備忘録です。
<特発性肺線維症に対する新たな治療戦略> 自治医科大学 杉山幸比古先生、2016年3月8日
この日は羽田空港周辺が濃霧で覆われ、欠航が相次いだそうです。
杉山先生が搭乗する予定だった便も欠航となり、杉山先生の講演は予定より1時間以上遅れて始まりました。
・特発性肺線維症と職業の関連性
金属加工業、木材加工業、塗装業、クリーニング業、理髪業の従事者に多い(岩井、1994)
・特発性肺線維症と胃食道逆流の関連性
Lee et al, Am J Respir Crit Care Med. 184(12), 1390-1394, 2011
Tcherakian et al, Thorax, 66(3), 226-231, 2011
→左右差のある特発性肺線維症では胃食道逆流を伴うことが多く、右優位であり、急性増悪も多い
・特発性肺線維症は多様な集団である(まだ細分類される余地がある)
・N-アセチルシステイン吸入療法はわが国では第一選択の治療法である。
・海外ではN-アセチルシステイン療法の有効性は否定されている(PANTHER trial)が、こちらは内服療法である。
・N-アセチルシステイン+pirfenidone併用療法の臨床試験が国内で進行中である。
・pirfenidoneの治療標的分子はいまだに不明である。
・TNF-α産生抑制作用が知られている。
・CAPACITY 1,2 study
・ASCEND study
・nintedanibのINPULSIS-1,2試験には日本から126人(全体の12%)が参加しており、米国、フランスについで第3位の参加率
・日本人は急性増悪をきたしやすい
・努力性肺活量>70%の患者を対象とすれば、nintedanibを使用すると有意に急性増悪が減少する。
・pirfenidone+nintedanib併用療法に関する報告が既に論文化されている。
→Ogura et al, Eur Respir J. 45(5):1382-92, 2015
・開発中の特発性肺線維症治療薬
→QAX-576(抗IL-13モノクローナル抗体)
→CNTO-888(抗CCL-2抗体)
→STX-100
<分子標的薬時代の肺がん治療戦略>千葉大学 吉野一郎先生、2016年3月18日
吉野先生は、間質性肺炎を伴う切除可能非小細胞肺がんの患者さんに対して周術期にpirfenidoneを使用するPEOPLE studyにおいて主導的な役割を果たされ、自施設における結果をいち早く論文化されました。
論文化の過程には個人的に思うところはありましたが、少なくともこの領域に関心を持っている外科医です。
治癒不能非小細胞肺がんに対するnintedanibの臨床開発が国内で滞っている今、間質性肺炎合併肺癌に対する周術期のnintedanib使用や、術後補助化学療法としてのnintedanib使用に関する開発余地はないのか伺ってみました。
少なくとも、pirfenidoneと同様の用途での臨床試験は思い描いていて、既に多施設共同でのプロトコールコンセプトは作成している、との回答でした。
ここ2年くらいの大分大学病院での治療内容を見てみると、15人前後の特発性肺線維症合併原発性肺がん患者さんが手術を受けており、周術期にpirfenidoneを投与されている方が少なからずいます。
その中には、術前pirfenidone投与により明らかにすりガラス陰影が軽減し、安全に手術に臨めたのではないかという方も含まれていました。
pirfenidoneにせよnintedanibにせよ、特発性肺線維症に対しては、より早期に使用を開始したほうが患者さんのメリットにつながるとされています。
間質性肺炎合併肺癌の患者さんに対して、よりストレスなくpirfenidoneやnintedanibを開始できる環境を整えたいところです。
たまたまnintedanibのことをうかがう機会が重なったので、忘れないうちにちょっとまとめます。
nintedanibはPDGF-R, FGF-R, VEGF-Rの各ファミリーを阻害するマルチキナーゼ阻害薬です。
特発性肺線維症、原発性肺がんの治療薬として開発が進みました。
特発性肺線維症に対しては、第II相試験であるTOMORROW試験、第III相試験であるINPULSIS-1, 2試験の結果が報告されています。
Richeldi et al, N Engl J Med 365, 1079-1087, 2011
Richeldi et al, N Engl J Med 370, 2071-2082, 2014
どの試験においても、nintedanibを使用すると努力性肺活量の年間減少量が90-120ml/年程度少なくてすむことが明らかにされています。
どのように生命予後に寄与するかはまだわかっていません。
一方で、原発性肺がんに対しては、LUME-Lung 1試験が報告されています。
Reck et al, Lancet Oncol, 15, 143-155, 2014
既治療の非小細胞肺がんに対して、nintedanib+docetaxel併用群とdocetaxel単独群を比較したところ、主要評価項目である無増悪生存期間が有意に改善(3.4ヶ月vs2.7ヶ月、ハザード比0.79, p=0.0019)しました。
全生存期間を腺がんに限って解析するとこれも併用群で有意に改善(12.6ヶ月vs10.3ヶ月、ハザード比0.83、p=0.0359)しました。
しかし、これらの試験結果を受けてわが国ではどのように動いているかというと、特発性肺線維症に対しては既にnintedanibが使用可能となり、原発性肺がんに対しては実地臨床への導入予定はまったく立っていません。
聞くところによると、nintedanib+docetaxel併用療法を非小細胞肺がんの二次治療としてわが国で検証する予定自体がまったく立っていないようです。
理由は定かではありませんが、このところ二次治療のsettingにおいて、免疫チェックポイント阻害薬がdocetaxelを凌駕する結果が次々に報告されており、nintedanib+docetaxel療法を開発する意義が薄れているのかもしれません。
とはいえ、有害事象やコスト面での競争力があれば、治療のオプションは多いほうがいいと思うのですが。
VEGF-Rを阻害する一方でbevacizumabよりは毒性の軽いnintedanibは、EGFR-TKIと併用してみても面白いような気がしますし、脳転移や胸水・腹水貯留を伴う患者さんには向いていそうですけどね。
それでは、各講演会での備忘録です。
<特発性肺線維症に対する新たな治療戦略> 自治医科大学 杉山幸比古先生、2016年3月8日
この日は羽田空港周辺が濃霧で覆われ、欠航が相次いだそうです。
杉山先生が搭乗する予定だった便も欠航となり、杉山先生の講演は予定より1時間以上遅れて始まりました。
・特発性肺線維症と職業の関連性
金属加工業、木材加工業、塗装業、クリーニング業、理髪業の従事者に多い(岩井、1994)
・特発性肺線維症と胃食道逆流の関連性
Lee et al, Am J Respir Crit Care Med. 184(12), 1390-1394, 2011
Tcherakian et al, Thorax, 66(3), 226-231, 2011
→左右差のある特発性肺線維症では胃食道逆流を伴うことが多く、右優位であり、急性増悪も多い
・特発性肺線維症は多様な集団である(まだ細分類される余地がある)
・N-アセチルシステイン吸入療法はわが国では第一選択の治療法である。
・海外ではN-アセチルシステイン療法の有効性は否定されている(PANTHER trial)が、こちらは内服療法である。
・N-アセチルシステイン+pirfenidone併用療法の臨床試験が国内で進行中である。
・pirfenidoneの治療標的分子はいまだに不明である。
・TNF-α産生抑制作用が知られている。
・CAPACITY 1,2 study
・ASCEND study
・nintedanibのINPULSIS-1,2試験には日本から126人(全体の12%)が参加しており、米国、フランスについで第3位の参加率
・日本人は急性増悪をきたしやすい
・努力性肺活量>70%の患者を対象とすれば、nintedanibを使用すると有意に急性増悪が減少する。
・pirfenidone+nintedanib併用療法に関する報告が既に論文化されている。
→Ogura et al, Eur Respir J. 45(5):1382-92, 2015
・開発中の特発性肺線維症治療薬
→QAX-576(抗IL-13モノクローナル抗体)
→CNTO-888(抗CCL-2抗体)
→STX-100
<分子標的薬時代の肺がん治療戦略>千葉大学 吉野一郎先生、2016年3月18日
吉野先生は、間質性肺炎を伴う切除可能非小細胞肺がんの患者さんに対して周術期にpirfenidoneを使用するPEOPLE studyにおいて主導的な役割を果たされ、自施設における結果をいち早く論文化されました。
論文化の過程には個人的に思うところはありましたが、少なくともこの領域に関心を持っている外科医です。
治癒不能非小細胞肺がんに対するnintedanibの臨床開発が国内で滞っている今、間質性肺炎合併肺癌に対する周術期のnintedanib使用や、術後補助化学療法としてのnintedanib使用に関する開発余地はないのか伺ってみました。
少なくとも、pirfenidoneと同様の用途での臨床試験は思い描いていて、既に多施設共同でのプロトコールコンセプトは作成している、との回答でした。
ここ2年くらいの大分大学病院での治療内容を見てみると、15人前後の特発性肺線維症合併原発性肺がん患者さんが手術を受けており、周術期にpirfenidoneを投与されている方が少なからずいます。
その中には、術前pirfenidone投与により明らかにすりガラス陰影が軽減し、安全に手術に臨めたのではないかという方も含まれていました。
pirfenidoneにせよnintedanibにせよ、特発性肺線維症に対しては、より早期に使用を開始したほうが患者さんのメリットにつながるとされています。
間質性肺炎合併肺癌の患者さんに対して、よりストレスなくpirfenidoneやnintedanibを開始できる環境を整えたいところです。
2016年03月20日
atezolimumab
Nivolumab, Pembrolizumabといった抗PD-1抗体が臨床現場で使えるようになりつつある中で、他の免疫チェックポイント阻害薬の報告も続いています。
今日は抗PD-L1抗体、Atezolimumabのお話です。
AtezolimumabはNivolumab, Pembrolizumabとは治療対象が異なります。
一般に、PD-1タンパクは細胞障害性T細胞の表面に、PD-L1タンパクは腫瘍細胞の表面にあり、これらが結合すると免疫反応を起こさなくなるとされています。
したがって、Nivolumab, Pembrolizumabは細胞障害性T細胞のPD-1にくっついてこれを阻害し、腫瘍免疫応答が起こるようにします。
一方で、Atezolimumabは腫瘍細胞側のPD-L1にくっついてこれを阻害し、腫瘍免疫応答が起こるようにします。
この辺の機微は、以前ちらっと触れました。
http://oitahaiganpractice.junglekouen.com/e806518.html
Atezolimumabに関する第II相試験、POPLAR studyの結果が2015年の米国臨床腫瘍学会で報告されました。
今回、Lancet誌に論文掲載されたようです。
第II相試験ではありますが、腫瘍組織のPD-L1発現状態が治療効果予測因子であることが明らかにされています。
PD-L1発現状態をかなり細かく区分していますが、実地臨床で使用する段階になったら、腫瘍組織全体のうち1%以上の領域でPD-L1が発現していればatezolimumabが有効そうで、このくらい簡単な基準なら将来は自動解析で評価できるようになりそうです。
Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial
Louis Fehrenbacher et al
Lancet 2016
背景:
既治療非小細胞肺がんの予後は不良である。抗PD-L1抗体であるAtezolimumabは、非小細胞肺がんを含む各種の癌に対して臨床的に有効で、腫瘍細胞や腫瘍内に浸潤した免疫細胞がPD-L1を発現している場合にはとりわけ効果が高い。今回、既治療非小細胞肺がんの患者を対象に、AtezolimumabとDocetaxelの有効性と安全性を評価する臨床試験を計画し、その結果に対して腫瘍細胞や免疫細胞のPD-L1発現状態がどのように関わっているかも検証した。
方法:
本試験はオープンラベル、無作為化第II相臨床試験で、欧米13カ国、61の参加施設において、プラチナ併用化学療法後に病勢進行をきたした非小細胞肺がん患者を対象にして行われた。ECOG-PS 0-1, RECIST基準で測定可能な病変を有する、血液・臓器機能が保たれていることが主要な適格基準だった。参加者は腫瘍浸潤免疫細胞のPD-L1発現状態、組織型、過去の治療内容を割付調整因子として、3週間ごとにatezorimumab 1200mg/回を点滴投与する群(A群)とdocetaxel 75mg/㎡を点滴投与する群(D群)に1:1の割合で割り付けられた。治療開始前のPD-L1発現状態は免疫染色により評価された。分類した。腫瘍細胞のPD-L1発現状態は、全腫瘍細胞のうちPD-L1を発現している細胞の割合によってTC3:全体の50%以上、TC2:全体の5%以上50%未満、TC1:全体の1%以上5%未満、TC0:全体の1%未満と分類した。腫瘍浸潤炎症細胞のPD-L1発現状態は、腫瘍組織面積のうちPD-L1を発現している炎症細胞が占める面積の割合によってIC3:10%以上、IC2:5%以上10%未満、IC1:1%以上5%未満、IC0:1%未満と分類した。主要評価項目は全生存期間とした。効果予測因子として、バイオマーカー解析も探索的に行った。少なくとも1回以上試験治療を受けた患者は、安全性評価対象とした。
結果:
2013年8月5日から2014年3月31日にかけて患者を集積した。144人がA群に、143人がD群に割り付けられた。A群のうち142人、D群のうち135人が少なくとも1回の試験治療を受けた。全生存期間はA群で12.6ヶ月(95%信頼区間は9.7-16.4ヶ月)、D群で9.7ヶ月(8.6-12.0ヶ月)で、ハザード比は0.73(95%信頼区間は0.53-0.99)だった。PD-L1の発現状態が高いほど全生存期間も向上する傾向にあった(TC3もしくはIC3の場合はハザード比0.49(95%信頼区間0.22-1.07, p=0.068)、TC2/3またはIC2/3の場合はハザード比0.54(95%信頼区間0.33-0.89、p=0.014)、TC1/2/3もしくはIC1/2/3の場合はハザード比0.59(95%信頼区間0.40-0.85、p=0.005)、TC0かつIC0の場合はハザード比1.04(95%信頼区間は0.62-1.75、p=0.871))。探索的解析では、治療開始前のエフェクターT細胞インターフェロンγ関連遺伝子の発現状態が高い患者ではA群での全生存期間が改善する傾向にあった。A群のうち11人(8%)、D群のうち30人(22%)で、有害事象により治療が中止されていた。A群のうち16人(11%)、D群のうち52人(39%)にGrade 3-4の有害事象を認め、A群のうち1人(<1%)とD群のうち3人(2%)が治療関連死した。
結論:
atezolimumabはdocetaxelと比較して、既治療非小細胞肺がんの全生存期間を有意に改善した。改善効果は腫瘍細胞と腫瘍浸潤炎症細胞のPD-L1発現状態と関連しており、PD-L1発現状態がatezolimumabの治療効果予測因子であることが示唆された。atezolimumabの忍容性も化学療法と比較して良好だった。
今日は抗PD-L1抗体、Atezolimumabのお話です。
AtezolimumabはNivolumab, Pembrolizumabとは治療対象が異なります。
一般に、PD-1タンパクは細胞障害性T細胞の表面に、PD-L1タンパクは腫瘍細胞の表面にあり、これらが結合すると免疫反応を起こさなくなるとされています。
したがって、Nivolumab, Pembrolizumabは細胞障害性T細胞のPD-1にくっついてこれを阻害し、腫瘍免疫応答が起こるようにします。
一方で、Atezolimumabは腫瘍細胞側のPD-L1にくっついてこれを阻害し、腫瘍免疫応答が起こるようにします。
この辺の機微は、以前ちらっと触れました。
http://oitahaiganpractice.junglekouen.com/e806518.html
Atezolimumabに関する第II相試験、POPLAR studyの結果が2015年の米国臨床腫瘍学会で報告されました。
今回、Lancet誌に論文掲載されたようです。
第II相試験ではありますが、腫瘍組織のPD-L1発現状態が治療効果予測因子であることが明らかにされています。
PD-L1発現状態をかなり細かく区分していますが、実地臨床で使用する段階になったら、腫瘍組織全体のうち1%以上の領域でPD-L1が発現していればatezolimumabが有効そうで、このくらい簡単な基準なら将来は自動解析で評価できるようになりそうです。
Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial
Louis Fehrenbacher et al
Lancet 2016
背景:
既治療非小細胞肺がんの予後は不良である。抗PD-L1抗体であるAtezolimumabは、非小細胞肺がんを含む各種の癌に対して臨床的に有効で、腫瘍細胞や腫瘍内に浸潤した免疫細胞がPD-L1を発現している場合にはとりわけ効果が高い。今回、既治療非小細胞肺がんの患者を対象に、AtezolimumabとDocetaxelの有効性と安全性を評価する臨床試験を計画し、その結果に対して腫瘍細胞や免疫細胞のPD-L1発現状態がどのように関わっているかも検証した。
方法:
本試験はオープンラベル、無作為化第II相臨床試験で、欧米13カ国、61の参加施設において、プラチナ併用化学療法後に病勢進行をきたした非小細胞肺がん患者を対象にして行われた。ECOG-PS 0-1, RECIST基準で測定可能な病変を有する、血液・臓器機能が保たれていることが主要な適格基準だった。参加者は腫瘍浸潤免疫細胞のPD-L1発現状態、組織型、過去の治療内容を割付調整因子として、3週間ごとにatezorimumab 1200mg/回を点滴投与する群(A群)とdocetaxel 75mg/㎡を点滴投与する群(D群)に1:1の割合で割り付けられた。治療開始前のPD-L1発現状態は免疫染色により評価された。分類した。腫瘍細胞のPD-L1発現状態は、全腫瘍細胞のうちPD-L1を発現している細胞の割合によってTC3:全体の50%以上、TC2:全体の5%以上50%未満、TC1:全体の1%以上5%未満、TC0:全体の1%未満と分類した。腫瘍浸潤炎症細胞のPD-L1発現状態は、腫瘍組織面積のうちPD-L1を発現している炎症細胞が占める面積の割合によってIC3:10%以上、IC2:5%以上10%未満、IC1:1%以上5%未満、IC0:1%未満と分類した。主要評価項目は全生存期間とした。効果予測因子として、バイオマーカー解析も探索的に行った。少なくとも1回以上試験治療を受けた患者は、安全性評価対象とした。
結果:
2013年8月5日から2014年3月31日にかけて患者を集積した。144人がA群に、143人がD群に割り付けられた。A群のうち142人、D群のうち135人が少なくとも1回の試験治療を受けた。全生存期間はA群で12.6ヶ月(95%信頼区間は9.7-16.4ヶ月)、D群で9.7ヶ月(8.6-12.0ヶ月)で、ハザード比は0.73(95%信頼区間は0.53-0.99)だった。PD-L1の発現状態が高いほど全生存期間も向上する傾向にあった(TC3もしくはIC3の場合はハザード比0.49(95%信頼区間0.22-1.07, p=0.068)、TC2/3またはIC2/3の場合はハザード比0.54(95%信頼区間0.33-0.89、p=0.014)、TC1/2/3もしくはIC1/2/3の場合はハザード比0.59(95%信頼区間0.40-0.85、p=0.005)、TC0かつIC0の場合はハザード比1.04(95%信頼区間は0.62-1.75、p=0.871))。探索的解析では、治療開始前のエフェクターT細胞インターフェロンγ関連遺伝子の発現状態が高い患者ではA群での全生存期間が改善する傾向にあった。A群のうち11人(8%)、D群のうち30人(22%)で、有害事象により治療が中止されていた。A群のうち16人(11%)、D群のうち52人(39%)にGrade 3-4の有害事象を認め、A群のうち1人(<1%)とD群のうち3人(2%)が治療関連死した。
結論:
atezolimumabはdocetaxelと比較して、既治療非小細胞肺がんの全生存期間を有意に改善した。改善効果は腫瘍細胞と腫瘍浸潤炎症細胞のPD-L1発現状態と関連しており、PD-L1発現状態がatezolimumabの治療効果予測因子であることが示唆された。atezolimumabの忍容性も化学療法と比較して良好だった。
2016年03月12日
FDAがROS1陽性肺癌にクリゾチニブを承認しました。
わが国では、クリゾチニブはALK陽性肺癌に対する分子標的薬の嚆矢として知られており、実地臨床で使われています。
一方で、クリゾチニブはさまざまな分子標的を阻害することが知られており、METやROS1に対する治療効果があるとされています。
米国食品医薬品局(FDA)は、2016年3月11日付けで、ROS1遺伝子転座を有する進行非小細胞肺癌に対して、クリゾチニブの使用を承認しました。
根拠になっているのは参加者わずか50人の下記の臨床試験で、取り扱いとしては第I相試験です。
効果を見れば納得できるのですが、第I相試験結果が承認根拠になっていること自体が驚きです。
原則的には第III相試験、特例的にも第II相試験の結果を踏まえて承認されるのが常識だったことを考えると、隔世の感があります。
わが国では、そもそもROS1陽性肺癌を診断することすら容易ではありません。
研究機関で調べるか、自費診療で調べるか、LC-SCRUM Japan参加施設を受診して試験に参加するか、です。
EGFR遺伝子変異陰性の患者さんが参加しているLC-SCRUM Japanの2016年2月末日までの解析では、RET陽性肺癌が2%、ALK陽性肺癌が4%、ROS1陽性肺癌が5%と、ALK陽性肺癌と同程度の頻度でROS1陽性肺癌が見つかっているようです。
若くて煙草を吸わない女性の非扁平上皮・非小細胞肺がん患者さんにこれらドライバー遺伝子変異が多く見出されるようで、その点はEGFR陽性肺癌と共通する部分があります。
ROS1陽性非小細胞肺がんに対するクリゾチニブの東アジア国際共同第II相試験 (OO 12-01)が行われていましたが、既に患者集積は終了し、わが国からも30人弱の患者さんが参加しました。
試験結果は今年の米国臨床腫瘍学会で後藤先生が発表されるそうですが、近日中にわが国でもROS1陽性肺がんに対するクリゾチニブの使用ができるように(コンパッショネートユース)準備が進んでいるそうなので、診断体制を整えなくてはなりません。
昨年の今頃、クリゾチニブの講演会で来日されていたイタリアのCappuzo先生が、
「とにかく、ROS1陽性肺がんに対するクリゾチニブはやたらめったら効く!」
とおっしゃっていたのを、いまさらながらに思い出します。
→http://oitahaiganpractice.junglekouen.com/e791916.html
EGFR, ALK, ROS1, RET, METと治療可能な分子標的が増えてきて、二次耐性変異例に対する治療薬も登場し、遺伝子診断の重要性は日に日に増しています。
最後に、今回の承認の根拠となった報告の要約を記します。
Crizotinib in ROS1-rearranged non-small-cell lung cancer.
Shaw AT, Ou SH, Bang YJ, Camidge DR, Solomon BJ, Salgia R, Riely GJ, Varella-Garcia M, Shapiro GI, Costa DB, Doebele RC, Le LP, Zheng Z, Tan W, Stephenson P, Shreeve SM, Tye LM, Christensen JG, Wilner KD, Clark JW, Iafrate AJ.
N Engl J Med. 2014 Nov 20;371(21):1963-71.
背景:
ROS1チロシンキナーゼをコードするROS1遺伝子の再構成が知られており、ROS1キナーゼ阻害薬の治療対象になりうると目されている。クリゾチニブはALK、ROS1、MET阻害活性を有する小分子化合物である。
方法:
クリゾチニブの第I相臨床試験における拡大試験対象として、ROS1再構成が確認された進行非小細胞肺癌患者50人を組み入れた。患者はクリゾチニブを1回250mg、1日2回内服し、安全性、薬物代謝、治療による腫瘍縮小について評価された。ROS1融合の相手となる遺伝子は次世代シーケンサーを用いて同定された。
結果:
奏効割合は72%(95%信頼区間は58%-84%)で、3人の完全奏効と33人の部分奏効を含んでいた。奏効持続期間の中央値は17.6ヶ月(95%信頼区間は14.5ヶ月以上で、上限は未確定)だった。無増悪生存期間中央値は19.2ヶ月(95%信頼区間は14.4ヶ月以上で上限は未確定)で、参加者の半数に当たる25人は解析時点でまだ増悪にいたっておらず、フォローアップ継続中だった。次世代シーケンサーで30検体を解析したところ、融合相手遺伝子座として既知の5座、新規の2座が検出された。ROS1再構成の種類とクリゾチニブの臨床効果に相関を認めなかった。クリゾチニブの安全性は、ALK陽性肺がんに対してクリゾチニブを使用する場合と同等だった。(1699人のALK陽性肺がん患者に対してクリゾチニブを使用した際の安全性評価において、頻度の高い有害事象として視覚障害、嘔気、嘔吐、下痢、浮腫、便秘、肝機能障害、疲労、食欲不振、上記どう感染、めまい、神経障害が報告されている)
結論:
今回の検討では、クリゾチニブはROS1再構成陽性肺癌に対して目覚しい抗腫瘍効果を示した。ROS1再構成は、クリゾチニブがよく効く非小細胞肺癌としてALK陽性肺がんに続く2番目のサブグループである。
一方で、クリゾチニブはさまざまな分子標的を阻害することが知られており、METやROS1に対する治療効果があるとされています。
米国食品医薬品局(FDA)は、2016年3月11日付けで、ROS1遺伝子転座を有する進行非小細胞肺癌に対して、クリゾチニブの使用を承認しました。
根拠になっているのは参加者わずか50人の下記の臨床試験で、取り扱いとしては第I相試験です。
効果を見れば納得できるのですが、第I相試験結果が承認根拠になっていること自体が驚きです。
原則的には第III相試験、特例的にも第II相試験の結果を踏まえて承認されるのが常識だったことを考えると、隔世の感があります。
わが国では、そもそもROS1陽性肺癌を診断することすら容易ではありません。
研究機関で調べるか、自費診療で調べるか、LC-SCRUM Japan参加施設を受診して試験に参加するか、です。
EGFR遺伝子変異陰性の患者さんが参加しているLC-SCRUM Japanの2016年2月末日までの解析では、RET陽性肺癌が2%、ALK陽性肺癌が4%、ROS1陽性肺癌が5%と、ALK陽性肺癌と同程度の頻度でROS1陽性肺癌が見つかっているようです。
若くて煙草を吸わない女性の非扁平上皮・非小細胞肺がん患者さんにこれらドライバー遺伝子変異が多く見出されるようで、その点はEGFR陽性肺癌と共通する部分があります。
ROS1陽性非小細胞肺がんに対するクリゾチニブの東アジア国際共同第II相試験 (OO 12-01)が行われていましたが、既に患者集積は終了し、わが国からも30人弱の患者さんが参加しました。
試験結果は今年の米国臨床腫瘍学会で後藤先生が発表されるそうですが、近日中にわが国でもROS1陽性肺がんに対するクリゾチニブの使用ができるように(コンパッショネートユース)準備が進んでいるそうなので、診断体制を整えなくてはなりません。
昨年の今頃、クリゾチニブの講演会で来日されていたイタリアのCappuzo先生が、
「とにかく、ROS1陽性肺がんに対するクリゾチニブはやたらめったら効く!」
とおっしゃっていたのを、いまさらながらに思い出します。
→http://oitahaiganpractice.junglekouen.com/e791916.html
EGFR, ALK, ROS1, RET, METと治療可能な分子標的が増えてきて、二次耐性変異例に対する治療薬も登場し、遺伝子診断の重要性は日に日に増しています。
最後に、今回の承認の根拠となった報告の要約を記します。
Crizotinib in ROS1-rearranged non-small-cell lung cancer.
Shaw AT, Ou SH, Bang YJ, Camidge DR, Solomon BJ, Salgia R, Riely GJ, Varella-Garcia M, Shapiro GI, Costa DB, Doebele RC, Le LP, Zheng Z, Tan W, Stephenson P, Shreeve SM, Tye LM, Christensen JG, Wilner KD, Clark JW, Iafrate AJ.
N Engl J Med. 2014 Nov 20;371(21):1963-71.
背景:
ROS1チロシンキナーゼをコードするROS1遺伝子の再構成が知られており、ROS1キナーゼ阻害薬の治療対象になりうると目されている。クリゾチニブはALK、ROS1、MET阻害活性を有する小分子化合物である。
方法:
クリゾチニブの第I相臨床試験における拡大試験対象として、ROS1再構成が確認された進行非小細胞肺癌患者50人を組み入れた。患者はクリゾチニブを1回250mg、1日2回内服し、安全性、薬物代謝、治療による腫瘍縮小について評価された。ROS1融合の相手となる遺伝子は次世代シーケンサーを用いて同定された。
結果:
奏効割合は72%(95%信頼区間は58%-84%)で、3人の完全奏効と33人の部分奏効を含んでいた。奏効持続期間の中央値は17.6ヶ月(95%信頼区間は14.5ヶ月以上で、上限は未確定)だった。無増悪生存期間中央値は19.2ヶ月(95%信頼区間は14.4ヶ月以上で上限は未確定)で、参加者の半数に当たる25人は解析時点でまだ増悪にいたっておらず、フォローアップ継続中だった。次世代シーケンサーで30検体を解析したところ、融合相手遺伝子座として既知の5座、新規の2座が検出された。ROS1再構成の種類とクリゾチニブの臨床効果に相関を認めなかった。クリゾチニブの安全性は、ALK陽性肺がんに対してクリゾチニブを使用する場合と同等だった。(1699人のALK陽性肺がん患者に対してクリゾチニブを使用した際の安全性評価において、頻度の高い有害事象として視覚障害、嘔気、嘔吐、下痢、浮腫、便秘、肝機能障害、疲労、食欲不振、上記どう感染、めまい、神経障害が報告されている)
結論:
今回の検討では、クリゾチニブはROS1再構成陽性肺癌に対して目覚しい抗腫瘍効果を示した。ROS1再構成は、クリゾチニブがよく効く非小細胞肺癌としてALK陽性肺がんに続く2番目のサブグループである。
2016年03月12日
経過観察のためのPET検査
リンパ腫では治療経過の観察にPETを使うのが標準とされていますが、同じことを肺がんでするのは好きではありません。
なぜって、値段が高いからです。
私自身は、
・リンパ節転移や遠隔転移の初期評価のために、どうしてもPETが必要なとき
・手術目的で外科に相談するとき
・CTでの経過観察中に、良悪性に迷う病変が出現したとき
にPETを行うようにしています。
今後はさらに、
・再生検を要する状況で、複数ある病巣から最適な生検部位を決めたいとき
という項目が加わります。
肺がんと食道がんの経過観察において、いきなりPETを使っても予後改善にはつながらないとの報告が、ミシガン大学のHealy先生からあったようで、大いに賛成します。
PETは高価な検査であるにも拘らず、こうした用途で使用されることが少なからずあり、おそらく自施設内にPETができる環境が整っている病院だと安易に利用してしまうことがあるのでしょう。
国民医療費抑制の観点からは、専門医として出来る限り自重すべきところです。
ただし、この解析では「初回病期評価時」「通常のCT検査で異常をみとめたとき、その病巣の活動性を確認する目的」でのPET検査は評価対象から除外されており、こういった用途は正当化しているようで、こちらも賛成です。
Healy先生はさらに一歩進んで、
「少なくとも治療後の経過観察期間においては、症状がなければPET検査を行う意義はない」
と断言しています。
米国のMedicare(高齢者および障害者向け公的医療保険制度)では、患者一人当たり3回までしかPET施行を許可しないことになっているようです。
十把ひとからげに回数を制限してしまうのはどうかという気もしますが、なんらかの条件で安易なPET検査施行に抑制をかけることは必要でしょうね。
PET Scan Use in Follow-up Care for Lung and Esophageal Cancer Shows Wide Variation Between Hospitals, No Impact on Survival
Mark A. Healy, Huiying Yin, Rishindra M. Reddy and Sandra L. Wong
J Natl Cancer Inst 108(7): djv429, 2016
背景:
PETはがん患者の初回病期評価、再病期評価、治療効果のモニタリングにしばしば用いられる。さらには、生存期間の延長に寄与するかどうかのエビデンスがないにも関わらず、症状のない患者の再発・再燃検索目的でもしばしば用いられる。今回われわれは、肺がんと食道がんの患者を対象に、これらの用途で利用されるPET検査が生存期間延長に寄与しているかどうかを検証した。
方法:
米国のSEERデータベースとMedicareのデータベースを用いて、2005年から2009年の間に新規発症し、2011年まで追跡可能な患者を抽出した。原発性肺がんの患者群(97152人)と食道がんの患者群(4446人)を抽出した。患者背景とがんの状態を分析し、リスク因子により調整した2年生存割合を検討した。Medicareのレセプトを利用して、PET検査歴を調べた(初回病期評価の目的、CT検査結果の確認目的の検査は評価対象から除いた)。2年生存割合を検討するに当たり、病院ごとに五分位階で層別化して解析した。全ての解析は両側検定の元に行った。
結果:
原発性肺がん患者の22%以上、食道がん患者の31%以上が、CTや他の画像診断を行うことなく、いきなりPETにより再発・再燃評価目的の検査を受けていた。病院によって、PETの利用状況には統計学的に有意な差があった。PETの検査頻度が最低の病院と最高の病院での検査頻度をあげると、原発性肺がんでは1人年あたり0.05(標準偏差0.04)vs0.70(標準偏差0.44)であり、同様に食道がんでは0.12(標準偏差0.06)vs0.97(標準偏差0.29)だった。にも関わらず、これら病院間での2年生存割合を比較すると、原発性肺がんで29.0%(標準偏差12.1%)vs28.8%(標準偏差7.2%)で(p=0.66, 有意差なし)、食道がんで28.4%(標準偏差7.2%)vs30.3%(標準偏差5.9%)(p=0.55, 有意差なし)で、生命予後には差はなかった。
結論:
がんの再発検索目的で行われるPET検査は病院によって施行頻度が異なるにも拘らず、その頻度と2年生存割合の改善には相関がなかった。再発検索目的でのPETの過剰使用が示唆される結果となった。
なぜって、値段が高いからです。
私自身は、
・リンパ節転移や遠隔転移の初期評価のために、どうしてもPETが必要なとき
・手術目的で外科に相談するとき
・CTでの経過観察中に、良悪性に迷う病変が出現したとき
にPETを行うようにしています。
今後はさらに、
・再生検を要する状況で、複数ある病巣から最適な生検部位を決めたいとき
という項目が加わります。
肺がんと食道がんの経過観察において、いきなりPETを使っても予後改善にはつながらないとの報告が、ミシガン大学のHealy先生からあったようで、大いに賛成します。
PETは高価な検査であるにも拘らず、こうした用途で使用されることが少なからずあり、おそらく自施設内にPETができる環境が整っている病院だと安易に利用してしまうことがあるのでしょう。
国民医療費抑制の観点からは、専門医として出来る限り自重すべきところです。
ただし、この解析では「初回病期評価時」「通常のCT検査で異常をみとめたとき、その病巣の活動性を確認する目的」でのPET検査は評価対象から除外されており、こういった用途は正当化しているようで、こちらも賛成です。
Healy先生はさらに一歩進んで、
「少なくとも治療後の経過観察期間においては、症状がなければPET検査を行う意義はない」
と断言しています。
米国のMedicare(高齢者および障害者向け公的医療保険制度)では、患者一人当たり3回までしかPET施行を許可しないことになっているようです。
十把ひとからげに回数を制限してしまうのはどうかという気もしますが、なんらかの条件で安易なPET検査施行に抑制をかけることは必要でしょうね。
PET Scan Use in Follow-up Care for Lung and Esophageal Cancer Shows Wide Variation Between Hospitals, No Impact on Survival
Mark A. Healy, Huiying Yin, Rishindra M. Reddy and Sandra L. Wong
J Natl Cancer Inst 108(7): djv429, 2016
背景:
PETはがん患者の初回病期評価、再病期評価、治療効果のモニタリングにしばしば用いられる。さらには、生存期間の延長に寄与するかどうかのエビデンスがないにも関わらず、症状のない患者の再発・再燃検索目的でもしばしば用いられる。今回われわれは、肺がんと食道がんの患者を対象に、これらの用途で利用されるPET検査が生存期間延長に寄与しているかどうかを検証した。
方法:
米国のSEERデータベースとMedicareのデータベースを用いて、2005年から2009年の間に新規発症し、2011年まで追跡可能な患者を抽出した。原発性肺がんの患者群(97152人)と食道がんの患者群(4446人)を抽出した。患者背景とがんの状態を分析し、リスク因子により調整した2年生存割合を検討した。Medicareのレセプトを利用して、PET検査歴を調べた(初回病期評価の目的、CT検査結果の確認目的の検査は評価対象から除いた)。2年生存割合を検討するに当たり、病院ごとに五分位階で層別化して解析した。全ての解析は両側検定の元に行った。
結果:
原発性肺がん患者の22%以上、食道がん患者の31%以上が、CTや他の画像診断を行うことなく、いきなりPETにより再発・再燃評価目的の検査を受けていた。病院によって、PETの利用状況には統計学的に有意な差があった。PETの検査頻度が最低の病院と最高の病院での検査頻度をあげると、原発性肺がんでは1人年あたり0.05(標準偏差0.04)vs0.70(標準偏差0.44)であり、同様に食道がんでは0.12(標準偏差0.06)vs0.97(標準偏差0.29)だった。にも関わらず、これら病院間での2年生存割合を比較すると、原発性肺がんで29.0%(標準偏差12.1%)vs28.8%(標準偏差7.2%)で(p=0.66, 有意差なし)、食道がんで28.4%(標準偏差7.2%)vs30.3%(標準偏差5.9%)(p=0.55, 有意差なし)で、生命予後には差はなかった。
結論:
がんの再発検索目的で行われるPET検査は病院によって施行頻度が異なるにも拘らず、その頻度と2年生存割合の改善には相関がなかった。再発検索目的でのPETの過剰使用が示唆される結果となった。



